このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
潜在的な軟骨再生のための脂肪組織由来間質血管分数の生産の臨床プロトコル
要約
ここでは、脂肪組織由来の間質血管分数と変形性関節症の軟骨様組織の再生によって膝機能の改善への応用を生成するプロトコルを提案する.
要約
変形性関節症 (OA) は、最も一般的な衰弱性疾患の一つです。最近では、間葉系幹細胞 (MSCs) の別のフォームを使用して、膝の機能を向上する多数の試みがされました。韓国・濃縮骨髄・臍帯血由来幹細胞は、軟骨再生の韓国食品や薬剤の管理 (KFDA) によって承認されています。さらに、脂肪組織由来の間質血管分数 (SVF) は、人間の患者に関節注射の KFDA によって許可されています。自己脂肪組織由来の SVF では、間葉系幹細胞に加え、細胞外マトリックス (ECM) 含まれています。ECM は、ヒアルロン酸 (HA) と多血小板血漿 (PRP) 塩化カルシウムによって活性化されると共に、MSCs は、軟骨を再生し、膝の機能を向上するさまざまなサイトカインを排泄します。この記事では OA の人間の患者の軟骨様組織の再生によって膝の機能を向上するためのプロトコルを提案します。プロトコルの結果は、いくつかの追加の出版物によって 2011 年に初めて報告されました。プロトコルには、コラゲナーゼを混ぜて自家の成人を取得する脂肪吸引が含まれます。この成人コラゲナーゼの混合物はカットし、注入時に針を詰まらせる可能性があります大規模の線維性組織を除去する均質化します。その後、混合物は、脂肪組織由来の SVF を取得する培養です。HA と組み合わせて、患者の膝に脂肪組織由来 MSCs と ECM の残党を含む結果脂肪組織由来 SVF を注入し、塩化カルシウムは、PRP を活性化します。膝の痛み, 腫れ, と硝子軟骨様組織の MRI 証拠とともに可動域が改善された私たちのプロトコルによる治療を受けた患者の 3 例には含まれます。
概要
間葉系幹細胞 (Msc) は、軟骨1,2,3,4,5,6を再生成する機能を持っている知られています。さまざまなソースから簡単に取得することができます: 骨髄、臍帯血、および多くの他の中の脂肪組織。これらのソースの中から脂肪組織は臨床設定7,8で軟骨を再生する文化拡張なし MSCs の十分な数を得ることが、唯一の情報源です。自家骨髄間質血管の分数 (SVF) は、同様に簡単に取得できます。ただし、非文化拡大骨髄に含まれる幹細胞の数は非常に低い7,8です。臍帯血は、MSCs の十分な数を含めることができます。しかし、臍帯血は、自家の SVF の容易に利用可能なソースではありません。
臨床応用には、SVF を取得する処理脂肪組織の多数の方法があります。このうち、コラゲナーゼを使用して脂肪組織から MSCs を得る方法を開発し、Zukらによって確認5,6が非常によく受け入れられます。コラゲナーゼを使用してこのメソッドは、整形外科領域における臨床応用のために変更されています。臨床現場に適用するためにシステムは、利便性を保ちながら、無菌性を維持するためにクローズド システムをする必要があります。この記事で示す 1 つの特定の変更には、成人の均質化が含まれます。小さい大きさで分類された成人は脂肪組織の不均一な破壊の結果として大きいものよりも比較的速く消化されます。また、これらのより大きい大きさで分類された成人関節注射9,10を実行しながら注射器や針を詰まらせることができます線維性の組織を生成可能性があります。成人はこれらの問題を防ぐために、切削し、コラゲナーゼの孵化前に成人をミンチが均質にする可能性があります。結果脂肪組織由来 SVF は、均質化11ではない成人と比較してより均一の細胞外のマトリックス (ECM) を含めることができます。SVF に含まれる壊れた ECM は、足場12として動作可能性があります。
2009 年に韓国食品・医薬品管理 (KFDA) 医師13によって最小限の処理と医療施設内で処理されるとき自家脂肪組織由来 SVF を許可されています。その後、自家脂肪組織由来 SVF は、潜在的再生軟骨様組織10,14,15によって変形性関節症 (OA) 患者の膝関節機能を改善するために潜在的なエージェントとして利用されています。,16,17,18.
2011 年、朴は最初に示した, 脂肪組織由来幹細胞 (Asc) 脂肪組織由来 SVF に含まれる血小板を注射されたとき人間の OA 患者の軟骨のような組織を再生可能性がある膝機能を改善できること血漿 (PRP) 14。さらに、朴らは 2013 含む 91 患者における安全性データを報告しています。この安全性データで報告された平均有効率は 6715だったその後、朴らによる追加研究はメニスカス涙と軟骨軟化症蓋10,16,17 患者の軟骨様組織の再生のために可能性がある改善膝機能を示した ,18。報告の記事に基づいて、それはこの記事で示されるプロトコルによって処理される脂肪組織の 100 g に含まれる幹細胞の数が患者の特性8,によって 1,000,000 40,000, 000 から及ぶかもしれない知られています。19,20,21,22,23。
HA と塩化カルシウムとアクティブ PRP 自家脂肪組織由来 SVF を使用して人間の膝 OA の臨床プロトコルを紹介します。201114に、無菌性を維持するために、手動閉鎖系を含む、この臨床プロトコルの最初のバージョンが報告されました。同一のプロトコル、不妊を維持することに最適化された、2013 と 201610,15で報告されました。ここでは、最適化されたプロトコルが表示されます。プロトコルの概略概観は、図 1で示されます。
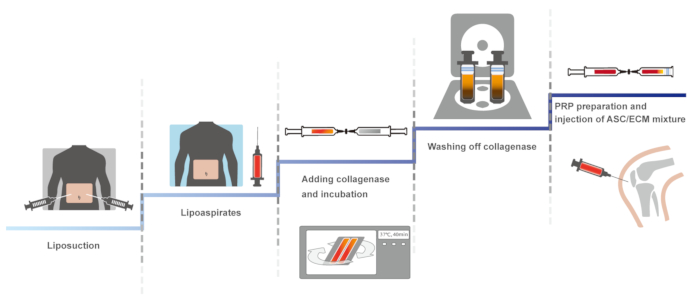
図 1: プロトコルの図式的な概観します。この図の拡大版を表示するのにはここをクリックしてください。
プロトコル
承認および次の症例報告を報告することに同意は、明知大学制度検討委員会委員 (MJUIRB) によって放棄されました。さらに、この臨床プロトコルは、KFDA のヘルシンキ宣言と規制ガイドラインに準拠していました。手順については、本人の同意は患者から得られました。
1. 脂肪吸引
注: 生殖不能の技術で実行します。
- 次の基準を使用して: ステージ 3 の (1) の MRI 証拠 OA。(2) いずれかの男性または女性である;(18 歳 3) 以上の;(4) 十分な (100-110 g) 脂肪組織脂肪吸引。(5) 外科的介入を続行する気力の無さ(保守的な管理の失敗 6)(7) の継続的な無効にする痛み。
- 以下の除外基準を使用します: (1) アクティブな炎症性または結合組織病が (すなわち、狼瘡、慢性関節リウマチ、線維筋痛) の痛みの状態に影響を与えると考えられて(痛みの状態 (すなわち甲状腺機能低下症、糖尿病) に影響を与えるかもしれない 2) アクティブの内分泌疾患(痛みの状態 (すなわち末梢神経障害、多発性硬化症) に影響を与えるかもしれない 3) アクティブの神経疾患(薬の使用を必要とする 4) アクティブな肺疾患(5) とステロイド関節注射過去 3 ヵ月の歴史無し。
- バイオハザード クラス A フードが手術室に患者をもたらすし、仰臥位で彼 (または彼女) を配置します。
- きれい betadine 5% (ポビドン ヨード) 患者の腹部と腹部脂肪吸引のための洗浄の領域を公開する生殖不能の技術を使用して、患者をドレープします。
- Infero 横方向に臍から約 5 cm 麻酔切開に-する-5 mL の注射器 (25 g、1 インチ) 針 2 mL エピネフリン無添加 2% リドカインを使用しての 2 つのサイト (左や臍の右側にある他の 1)表皮のレベルで各サイトを注入。
- 麻酔切開に-する-10 mL の注射器の針 (25 ゲージ、1 インチ) で腫れ上がった溶液 (2% リドカイン、0.5% ブピバカイン、エピネフリン 1: 1000 の 0.5 mL の 20 mL の生理食塩水、40 mL の通常の 500 mL) 5 mL を使用してのサイト。
- 皮下レベルの深さを高めるために皮膚をつまんで横に臍から下の 0.5 cm 約 5 cm の切開を 2 を作る。
- 11 番を使用すると、発生皮膚腹壁を貫通はなく皮下レベルに貫通を突きます。
- 20 cm 16 ゲージ カニューレを使用して腫れ上がったソリューションの 700 に 800 ml に-する-による誤嚥は、全体のより低い腹部区域の皮下レベルを麻酔します。
- 後に接続されている 3.0 mm のカニューレを接続することによって脂肪吸引装置を準備腫れ上がったソリューション全体の下腹部の浸潤を仕上げ 60 mL (または 30 mL) シリンジ脂肪吸引マニュアルまたは特別に設計された 3.0 mm カニューレに接続されている、遠心分離機キット、不妊を保つことを目的として閉鎖系注射器は、真空吸引を真空マシンに接続。
- 脂肪吸引脂肪腫れ上がったソリューションを除く 100 110 g を取得するを実行します。脂肪吸引の際に、脂肪を分離、削除する必要があります腫れ上がった解決策と共に取得します。
- 腫れ上がったソリューションを分離する最初に重力、遠心分離機キットで脂肪組織を 60 mL の注射器に転送し、(すなわち、注射器の部分は下部) を注射します。5-6 分を待機することによって、脂肪組織と腫れ上がった液が分離します。シリンジのプランジャーの上の部分に、注射器の下部に流体を取り外します。
- 脂肪組織 (成人) 膝あたりの 100-110 グラムの合計を蓄積されているまでは、1.9 1.11 の上記の手順を実行します。
2. 滅菌のクローズド システムを ASC/ECM 混合物の調製
- 分離後重力と各 60 mL 遠心分離機キット、滅菌のクローズド システムあたり成人の 50-55 g を蓄積して腫れ上がったソリューション配置遠心容器バケツに凝縮、5 分間 1600 x gでスピン 2 遠心分離機キット、成人と脂肪組織から液体を分離します。これのそれ以上のプロセスに凝縮、特定のケースで油脂が生じる場合、成人。
- 振る、安全キャップを取り外して、遠心分離機キットの下部にプラグ慎重にされます。
- 遠心分離機キットのピストンの上にゆっくりと押し込んで下の流体を削除します。
- 別の 60 mL の注射器に 50 ml の生理食塩水入りのコラゲナーゼ (コラゲナーゼ膠原病24特定の 5 mg) とコラゲナーゼ脂肪25特定の 5 mg の 10 mg を溶解します。
- 凝縮した lipoaspirate のおよそ 25-30 mL 1:1 (v: v) の割合で溶存コラゲナーゼ (コラゲナーゼ結合組織に固有の 5 mg) とコラゲナーゼ脂肪組織に固有の 5 mg を混ぜて使用して遠心分離機キット 60 mL 注射器を接続し特殊なコネクタです。
- 60 mL シリンジと遠心分離機キット ロッドまたはプッシャーを使用してコンテンツを押すことにより、凝縮した lipoaspirate と、コラゲナーゼを徹底的に混ぜます。
- 混合物、lipoaspirate と、コラゲナーゼを 60 mL の注射器に転送します。
- ブレードを含む組織ホモジナイザーとの混合物を含む各 60 mL 注射器を接続します。
- 空 60 mL シリンジをホモジナイザーのもう一方の端に接続します。
- 4 -6 回、ホモジナイザーで、他の 60 mL の注射器に混合物を押して切ると、lipoaspirate のミンチの結果します。
- 均質化の lipoaspirate とコラゲナーゼ混合物を特殊なコネクタを介して 60 mL 遠心分離機キットに転送します。
- 37 ° C で予熱されているインキュベーターに配置するためのコンテナーに遠心分離機キット
- 45 rpm で回転させながら 40 分の 37 ° C で均質混合物 2 つの遠心分離機キットを孵化させなさい。
- インキュベーションの 40 分後に、滅菌方法でインキュベーターからコンテナーを削除します。遠心分離機キットを削除し、遠心機でそれらを配置します。
- 脂肪組織由来 SVF を分離する 5 分間 800 x gで混合物を遠心分離機します。
- 遠心分離機後、各遠心分離機キットからプランジャーの上にシリンジ キャップを取り外し、注射器ロック経由でを開くプランジャー 30 mL シリンジを配置することによっての (これはコラゲナーゼを含む脂肪組織を消化) 上清を除去する.接続します。
- ゆっくりと 30 mL シリンジ 30 mL の注射器にいっぱいに上清のバレル部を押してください。
- 脂肪組織由来の SVF の最後の 3-4 mL のみを残して、遠心分離機キットの下の最後の 3-4 mL まで 30 mL シリンジ バレルを押してください。上清は破棄されます。
- プランジャーの上部から 30 mL シリンジを外し、リンゲル液 (D5LR) で 5% ブドウ糖で注射器を埋めます。
- 満ちている D5LR を開くプランジャーの上に 30 mL シリンジを取り付けたいで埋める D5LR と、脂肪組織由来の SVF の 3-4 mL を含む遠心分離機キット 55 mL。
- 30 mL シリンジを取り外して、プランジャーをキャップ 4 分の 300 × gで遠心分離キットを遠心分離します。
- 4 洗浄液の合計は 2.17 2.21 の手順を繰り返します。使用されるコラゲナーゼは異種です。したがって、ほとんどのコラゲナーゼが 4 洗浄液によって削除されます。しかし、FDA の承認プロトコルの微調整必要があります最終巻でコラゲナーゼ残留物を完全に除去するコラゲナーゼ残留量は、臨床を持っていない患者のため十分無視できるが副作用。
- 4回遠心分離後注入の最終的な SVF を得るために安全キャップと遠心分離機キットの下部の開口部にプラグインせず削除揺れや遠心分離機キットを回します。
- 遠心分離機キット下部の特別に設計されたコネクタを使用して開口部に 20 mL 注射器を接続します。
- 遠心分離機キットの下部に定住している細胞を揺るがす、前後数回注射器のプランジャーを引きます。
- 他のセルおよびティッシュと一緒に Asc と ECM の両方を含む SVF の目的の合計ボリュームを削除 (通常各遠心分離機用膝関節注射から約 3-4 mL)。
3. 生殖不能の技術、PRP 作製
- Asc と ECM 準備中、自家血液抗凝固薬クエン酸デキスト ロース溶液 2.5 mL と 30 mL を描画します。
- 60 mL 遠心分離機キットに描かれた血を転送します。
- 730 x gで 5 分で描かれた血液を遠心し、新しい 60 mL 遠心分離機キットに上澄みを除去します。PRP の 3-4 mL の結果、4 分間 1300 x gで上清を遠心します。
- 10:2 の比率で 3% (w/v) 塩化カルシウムを追加注入の直前 (PRP: 塩化カルシウム, v: v) アクティブに PRP を。
- 塩化カルシウムとアクティブ PRP に 0.5% (w/v)、足場としての HA を追加します。塩化カルシウム、アクティブ PRP、と共に、ECM とこれらの Asc、HA ASC/ECM 混合物の略します。
4. ASC/ECM 混合ベースの治療法
- 5 %betadine で患者の膝をきれいにし滅菌方法でドレープします。
- 脛骨と大腿骨の骨間関節腔の膝の前部を触診します。
- 関節包外だけ皮膚から希薄リドカイン (通常生理食塩水 4 mL で希釈し 1% リドカイン 1 mL) を表面的に注射部位を麻酔します。
- (1 mL 0.75% ロピバカイン通常生理食塩水 3 mL で希釈) 希釈ロピバカインによる関節包の中を麻酔します。
- SVF の注射器・注射器・ コネクタを 20 mL の注射器に含まれる 6-8 mL に HA のミックス 2 mL。
- 注射器・注射器のコネクタを使用して、自家既に準備されている PRP と 5 mL の注射器に準備ができている 3-4 mL に塩化カルシウム 0.4 mL を追加します。
- 8-10 ml の注射器に注射器コネクタ経由で20 mL の注射器で HA/SVF 混合物の 5 mL シリンジで PRP/カルシウム塩化物の 3.5 から 4.5 mL を組み合わせます。
- すぐに超音波ガイダンスの有無、38 mm 18 ゲージ針を使用して膝の前方脛骨大腿関節にゆっくり混合物 (約 12-15 mL) を注入します。
- 注入後 4 回 4 x 4 綿ガーゼを折りたたみして折り返しの 4 x 4 ガーゼ上にテープを置く圧力で注入部位を包帯します。
- 細胞接着のように 60 分間まだ残るように患者に指示します。
- ための活動を制限するように患者に指示クリニックから退院後 1 週の最小限。
- PRP の 3 週間にわたって塩化カルシウムによる活性化の 3 つの追加の注射のためにクリニックに戻ります。
5. 治療後のフォロー アップ
- 2、4、および 16 (18 または 22) の視覚アナログ スケール (VAS) の面で痛み改善と理学療法のパラメーターの点で機能改善のための週で患者を評価します。前述の26,27と機能性評価指数 (金)、VAS、・運動 (ROM) の範囲を決定します。
- 治療後治療後 MRI 3 ヶ月で患者に従ってください。
結果
3 人の患者 (87 歳女性とステージ 3 OA、1 つの 68 歳の男性で 1 ステージ 3 OA と 1 つの 60 歳女性とステージ 3 OA) 潜在的な重要な過去病歴永続的な膝の痛みでクリニックに提示、必要のないです。自己脂肪組織由来の「svf」治療。3 例はすべて整形外科医によって検討した自分の膝を持っていた人工膝関節置換術 (TKR) に提供され、手術を受けることに消極的であった。前?...
ディスカッション
2001 年、Zukら。コラゲナーゼ6コラーゲン マトリックス分解による脂肪組織から幹細胞を分離。その後、グループは示した証明これらの幹細胞が起源の間葉系軟骨と中胚葉起源の他の組織に脂肪組織由来幹細胞を変えるかもしれないことでしょう。
同様に、この資料に示す手順は、人間の患者に同じような方法を適用する変更されたプロトコルで?...
開示事項
著者が明らかに何もありません。
謝辞
著者は、ミプロ診療・ Jaepil/デヴィッド ・ リーによる図設計のスタッフからのサポートを認めています。この作品はバイオ ・ MSIT (番号 NRF 2017M3A9E4078014) によって資金を供給された NRF の医療の技術開発プログラムからの研究補助金によって支えられました。国立研究財団の韓国 (NRF) 科学 (番号 NRF 2017R1A2B4002315 と NRF 2016R1C1B2010308) ICT 省によって資金を供給します。
資料
| Name | Company | Catalog Number | Comments |
| Material | |||
| 5% Betadine (povidone-iodine) | Firson Co., Ltd. | 657400260 | |
| 2% Lidocaine | Daehan Pharmaceutical Co. | 670603480 | |
| Tumescent solution | Myungmoon Pharm. Co. Ltd. | N01BB01 | The solution was composed of 500 mL normal saline, 40 mL 2% lidocaine, 20 mL 0.5% marcaine, and 0.5 mL epinephrine 1:1000. |
| Liberase TL and TM research grade | Roche Applied Science | 5401020001 | |
| D5LR | Dahan Pharm. Co., Ltd. | 645101072 | Dextrose 5% in lactated Ringer's solution |
| Anticoagulant citrate dextrose solution | Fenwal, Inc. | NDC:0942-0641 | The solution was composed of 0.8% citric acid, 0.22% sodium citrate, and 0.223% dextrose. |
| 3% (w/v) Calcium chloride | Choongwae Pharmaceutical Co. | 644902101 | |
| 0.5% (w/v) HA (Hyaluronic acid ) | Dongkwang pharm. Co., Ltd. | 645902030 | |
| 0.25% Ropivacaine | Huons Co., Ltd. | 670600150 | |
| Equipment | |||
| 3.0 mm Cannula | WOOJU Medical Instruments Co. | ML30200 | |
| 60-mL Luer-Lock syringe | BD (Becton Dickinson) | 309653 | |
| Centrifuge Barrel Kit | CPL Co., Ltd. | 30-0827044 | |
| Tissue homogenizer that contains blades | CPL Co., Ltd. | 30-0827045 | |
| Rotating incubator mixer | Medikan Co., Ltd | MS02060092 | |
| Centrifuge | Hanil Scientific Inc. | CE1133 | |
| Magnetic Resonance Imaging | Philips Medical Systems Inc. | 18068 | |
| Ultrasound Imaging System | Samsung Medison co., Ltd | CT-LK-V10-ICM-09.05.2007 |
参考文献
- Arnoczky, S. P. Building a meniscus. Biologic considerations. Clinical Orthopaedics and Related Research. (367 Suppl), S244-S253 (1999).
- Barry, F. P. Mesenchymal stem cell therapy in joint disease. Novartis Foundation Symposium. 249, 86-241 (2003).
- Usuelli, F. G., et al. Adipose-derived stem cells in orthopaedic pathologies. British Medical Bulletin. 124 (1), 31-54 (2017).
- Zhang, H. N., Li, L., Leng, P., Wang, Y. Z., Lv, C. Y. Uninduced adipose-derived stem cells repair the defect of full-thickness hyaline cartilage. Chinese Journal of Traumatology. 12 (2), 92-97 (2009).
- Zuk, P. A., et al. Human adipose tissue is a source of multipotent stem cells. Molecular Biology of the Cell. 13 (12), 4279-4295 (2002).
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Engineering. 7 (2), 211-228 (2001).
- Baer, P. C., Geiger, H. Adipose-derived mesenchymal stromal/stem cells: tissue localization, characterization, and heterogeneity. Stem Cells International. 2012, 812693 (2012).
- Zhu, Y., et al. Adipose-derived stem cell: a better stem cell than BMSC. Cell Biochemistry and Function. 26 (6), 664-675 (2008).
- Bellei, B., Migliano, E., Tedesco, M., Caputo, S., Picardo, M. Maximizing non-enzymatic methods for harvesting adipose-derived stem from lipoaspirate: technical considerations and clinical implications for regenerative surgery. Scientific Reports. 7 (1), 10015 (2017).
- Pak, J., Lee, J. H., Park, K. S., Jeong, B. C., Lee, S. H. Regeneration of Cartilage in Human Knee Osteoarthritis with Autologous Adipose Tissue-Derived Stem Cells and Autologous Extracellular Matrix. BioResearch Open Access. 5 (1), 192-200 (2016).
- Alexander, R. W. Understanding Adipose-derived Stromal Vascular Fraction (AD-SVF) Cell Biology and Use on the Basis of Cellular, Chemical, Structural and Paracrine Components: A Concise Review. Journal of Prolotherapy. 4, e855-e869 (2012).
- Benders, K. E., et al. Extracellular matrix scaffolds for cartilage and bone regeneration. Trends in Biotechnology. 31 (3), 169-176 (2013).
- Korean Food and Drug Administration (KFDA). Cell therapy: Rules and Regulations. KFDA. , (2009).
- Pak, J. Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose-tissue-derived stem cells: a case series. Journal of Medical Case Reports. 5, 296 (2011).
- Pak, J., Chang, J. J., Lee, J. H., Lee, S. H. Safety reporting on implantation of autologous adipose tissue-derived stem cells with platelet-rich plasma into human articular joints. BMC Musculoskeletal Disorders. 14, 337 (2013).
- Pak, J., Lee, J. H., Kartolo, W. A., Lee, S. H. Cartilage Regeneration in Human with Adipose Tissue-Derived Stem Cells: Current Status in Clinical Implications. BioMed Research International. 2016, 4702674 (2016).
- Pak, J., Lee, J. H., Lee, S. H. A novel biological approach to treat chondromalacia patellae. PLoS One. 8 (5), e64569 (2013).
- Pak, J., Lee, J. H., Lee, S. H. Regenerative repair of damaged meniscus with autologous adipose tissue-derived stem cells. BioMed Research International. 2014, 436029 (2014).
- Aust, L., et al. Yield of human adipose-derived adult stem cells from liposuction aspirates. Cytotherapy. 6 (1), 7-14 (2004).
- De Ugarte, D. A., et al. Comparison of multi-lineage cells from human adipose tissue and bone marrow. Cells Tissues Organs. 174 (3), 101-109 (2003).
- Guilak, F., et al. Clonal analysis of the differentiation potential of human adipose-derived adult stem cells. Journal of Cellular Physiology. 206 (1), 229-237 (2006).
- Mitchell, J. B., et al. Immunophenotype of human adipose-derived cells: temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. 24 (2), 376-385 (2006).
- Oedayrajsingh-Varma, M. J., et al. Adipose tissue-derived mesenchymal stem cell yield and growth characteristics are affected by the tissue-harvesting procedure. Cytotherapy. 8 (2), 166-177 (2006).
- . Liberase TL information available from Sigma Millipore online Available from: https://www.sigmaaldrich.com/catalog/product/roche/05401020001?lang=en®ion=US (2018)
- . Liberase TM information available from Sigma Millipore online Available from: https://www.sigmaaldrich.com/catalog/product/roche/Libtmro?lang=en®ion=US (2018)
- Childs, J. D., Piva, S. R. Psychometric properties of the functional rating index in patients with low back pain. European Spine Journal. 14 (10), 1008-1012 (2005).
- Price, D. D., McGrath, P. A., Rafii, A., Buckingham, B. The validation of visual analogue scales as ratio scale measures for chronic and experimental pain. Pain. 17 (1), 45-56 (1983).
- Pilgaard, L., Lund, P., Rasmussen, J. G., Fink, T., Zachar, V. Comparative analysis of highly defined proteases for the isolation of adipose tissue-derived stem cells. Regenerative Medicine. 3 (5), 705-715 (2008).
- D'Ambrosi, R., Indino, C., Maccario, C., Manzi, L., Usuelli, F. G. Autologous Microfractured and Purified Adipose Tissue for Arthroscopic Management of Osteochondral Lesions of the Talus. Journal of Visualized Experiments. (131), e56395 (2018).
- Packer, J. D., Chang, W. T., Dragoo, J. L. The use of vibrational energy to isolate adipose-derived stem cells. Plastic Reconstructive Surgery-Global Open. 6 (1), e1620 (2018).
- Hanke, C. W., Bernstein, G., Bullock, S. Safety of tumescent liposuction in 15,336 patients. National survey results. Dermatologic Surgery. 21 (5), 459-462 (1995).
- Illouz, Y. G. Complications of liposuction. Clinics in Plastic Surgery. 33 (1), 129-163 (2006).
- Dixit, V. V., Wagh, M. S. Unfavourable outcomes of liposuction and their management. Indian Journal of Plastic Surgery. 46 (2), 377-392 (2013).
- Lehnhardt, M., et al. Major and lethal complications of liposuction: a review of 72 cases in Germany between 1998 and 2002. Plastic and Reconstructive Surgery. 121 (6), 396e-403e (2008).
- Iyer, S. S., Rojas, M. Anti-inflammatory effects of mesenchymal stem cells: novel concept for future therapies. Expert Opinion on Biological Therapy. 8 (5), 569-581 (2008).
- Zhang, J., Middleton, K. K., Fu, F. H., Im, H. J., Wang, J. H. HGF mediates the anti-inflammatory effects of PRP on injured tendons. PLoS One. 8 (6), e67303 (2013).
- Li, N. Y., Yuan, R. T., Chen, T., Chen, L. Q., Jin, X. M. Effect of platelet-rich plasma and latissimus dorsi muscle flap on osteogenesis and vascularization of tissue-engineered bone in dogs. Journal of Oral and Maxillofacial Surgery. 67 (9), 1850-1858 (2009).
- Parsons, P., et al. The biological effect of platelet rich-plasma on the fracture healing process. The Journal of bone and joint surgery. British volume. 91-B, 293 (2009).
- Wu, W., Chen, F., Liu, Y., Ma, Q., Mao, T. Autologous injectable tissue-engineered cartilage by using platelet-rich plasma: experimental study in a rabbit model. Journal of Oral and Maxillofacial Surgery. 65 (10), 1951-1957 (2007).
- Cooper, T. W., Eisen, A. Z., Stricklin, G. P., Welgus, H. G. Platelet-derived collagenase inhibitor: characterization and subcellular localization. Proceedings of the National Academy of Sciences of the United States of America. 82 (9), 2779-2783 (1985).
- Uzuki, M., Sawai, T. A. A comparison of the affinity of sodium hyaluronate of various molecular weights for degenerated cartilage: a histochemical study using hyaluronic acid binding protein. International Congress Series. 1223, 279-284 (2001).
- Pagano, C., et al. Molecular and morphometric description of adipose tissue during weight changes: a quantitative tool for assessment of tissue texture. International Journal of Molecular Medicine. 14 (5), 897-902 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved