需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
制备脂肪组织基质血管部分用于潜在软骨再生的临床协议
摘要
在这里, 我们提出了一个协议, 以产生脂肪组织衍生的基质血管分数和它的应用, 以改善膝关节功能的再生软骨样组织的人骨关节炎患者。
摘要
骨关节炎 (OA) 是最常见的衰弱性疾病之一。最近, 许多尝试通过使用不同形式的间充质干细胞 (MSCs) 来改善膝关节的功能。在韩国, 由韩国食品和药物管理局 (KFDA) 批准的骨髓浓缩物和脐带血源干细胞用于软骨再生。此外, KFDA 还允许人体脂肪组织衍生的基质血管分数 (SVF) 进行联合注射。自体脂肪组织衍生的 SVF 含有细胞外基质 (ECM) 除了间充质干细胞。ECM 排泄各种细胞因子, 以及由氯化钙活化的透明质酸 (HA) 和富含血小板的血浆 (PRP), 可帮助 MSCs 再生软骨, 改善膝关节功能。本文提出了一种通过在 OA 中再生软骨样组织来改善膝关节功能的方案。《议定书》的结果于2011年首次报告, 随后又出版了一些出版物。该协议涉及吸脂, 以获得与胶原酶混合的自体 lipoaspirates。这种 lipoaspirates 胶原酶的混合物, 然后切割和匀质, 以消除可能堵塞针在注射过程中的大纤维组织。然后, 将该混合物孵化以获得脂肪组织衍生的 SVF。由此产生的脂肪组织衍生的 SVF, 含有脂肪组织衍生的 MSCs 和 ECM 残留物, 被注射到患者的膝盖, 结合 HA 和氯化钙活化 PRP。包括三例患者谁接受了我们的协议, 导致改善膝关节疼痛, 肿胀和运动范围, 以及 MRI 证据的透明软骨样组织。
引言
间充质干细胞 (MSCs) 具有再生软骨1、2、3、4、5、6的能力。它们可以很容易地从各种来源获得: 骨髓, 脐带血, 脂肪组织在许多其他。在这些来源中, 脂肪组织是唯一的来源, 可以获得足够数量的 MSCs, 没有任何文化扩张, 以再生软骨在临床设置7,8。自体骨髓基质血管分数 (SVF) 也很容易得到。然而, 非培养的骨髓中的干细胞数量非常低7,8。脐带血可能含有足够数量的 MSCs。然而, 脐带血不是一个现成的自体 SVF 的来源。
许多方法来处理脂肪组织获得 SVF 可用于临床应用。其中, 采用胶原酶法从脂肪组织中获得骨髓间充质干细胞, 并由祖克等进行开发和证实。5,6、很好接受。采用胶原酶法对骨科临床应用进行了改进。为了适用于临床设置, 系统必须是一个封闭的系统, 以保持不育, 同时保持方便。本文提出的一个特殊修改涉及 lipoaspirates 的均匀化。小尺寸 lipoaspirates 的消化速度比较大的大, 导致脂肪组织的不均匀分解。此外, 这些较大尺寸的 lipoaspirates 可能产生纤维组织, 可以堵塞注射器和针头, 同时执行联合注射9,10。为了防止这些问题, lipoaspirates 可以通过在胶原酶的孵化前切割和切碎 lipoaspirates 来进行匀质。所产生的脂肪组织衍生的 SVF 可能含有更均匀的细胞外基质 (ECM) 相比, lipoaspirates 是不均匀11。SVF 中所含的分解 ECM 可以作为脚手架12使用。
在 2009年, 韩国食品和药物管理局 (KFDA) 在医疗设施内进行了13的最小处理, 从而允许自体脂肪组织衍生 SVF。此后, 自体脂肪组织衍生 SVF 作为一种潜在的药物, 以改善骨关节炎 (OA) 患者的膝关节功能可能再生软骨样组织10,14,15,16,17,18.
在 2011年, 白细胞首次显示脂肪组织衍生的干细胞 (陶瓷) 中含有的脂组织衍生 SVF 可以改善膝关节功能, 可能再生的软骨样组织的人 OA 患者注入血小板丰富血浆 (PRP) 14。此外, 巴基斯坦等人在2013年报告的安全数据涉及91名病人。该安全数据报告的平均功效率为 67%15。随后, 白等其他研究显示, 由于半月板撕裂和髌骨髌骨10、16、17 等患者的软骨样组织再生, 膝关节功能有可能改善. ,18。根据报道的文章, 据了解, 本条所述协议处理的100克脂肪组织中所含的干细胞数量可能从 100万-4000万不等, 视病人的特征8而定,19,20,21,22,23。
在这里, 我们提出了一个人体膝关节 OA 的临床协议, 使用自体脂肪组织衍生 SVF 与 HA 和 PRP 活化氯化钙。该临床议定书的第一个版本, 涉及一个封闭的, 手动系统, 以维持不孕, 报告了 2011年14。相同的协议被优化, 保持不孕, 并报告了2013年和 201610,15。在此, 提出了优化协议。该协议的示意图概述如图 1所示。
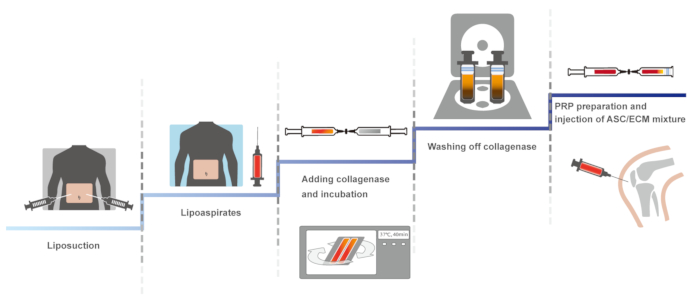
图 1: 协议的示意图概述.请单击此处查看此图的较大版本.
研究方案
明知大学机构审查委员会委员会 (MJUIRB) 放弃了批准和同意报告下列案例报告。此外, 这项临床议定书符合《赫尔辛基宣言》和 KFDA 的规章准则。对于这些程序, 知情同意是从病人那里得到的。
1. 吸脂
注意: 用无菌技术进行。
- 使用以下包含条件: (1) 3 级 OA 的 MRI 证据;(2) 男性或女性;(3) 18 岁以上;(4) 足够 (100-110 克) 脂肪组织吸脂;(5) 不愿意进行手术干预;(6) 保守管理失败;(7) 持续的致残疼痛。
- 使用以下排除标准: (1) 主动炎症或结缔组织病认为影响疼痛状况 (即狼疮、类风湿关节炎、纤维肌痛);(2) 活跃的内分泌紊乱, 可能会影响疼痛状况 (即, 甲状腺机能减退症, 糖尿病);(3) 活跃的神经系统紊乱, 可能会影响疼痛状况 (即, 周围神经病变, 多发性硬化);(4) 需要用药的主动肺部疾病;(5) 过去3月内没有类固醇联合注射的病史。
- 把病人带到一个有生物危害等级的手术室里, 把他 (或她) 置于仰卧位。
- 用 5% betadine (聚维酮碘) 清洁病人的腹部, 用无菌技术将病人披上, 露出腹部的清洁区域进行吸脂。
- 大约 5 cm infero 侧向从脐, 麻醉两个地点 (左侧和右侧的脐侧) 切口使用2毫升2% 利多卡因没有肾上腺素与 (25 口径, 1½英寸) 针在5毫升注射器通过在表皮层注射每个部位。
- 麻醉使用5毫升肿胀溶液 (500 毫升生理盐水, 40 毫升2% 利多卡因, 20 毫升0.5% 布比卡因, 0.5 毫升肾上腺素) 在1:1000 毫升注射器用针 (10 口径, 1½英寸) 进行切口的部位。
- 捏皮肤, 以提高皮下水平的深度, 使2切口0.5 厘米大约 5 cm 在脐之下侧向。
- 使用11号刀片, 戳凸起的皮肤穿透到皮下的水平, 但不穿透通过腹壁。
- 通过使用20厘米16口径套管, 麻醉整个下腹部面积的皮下水平, 这是 liposuctioned, 700 到800毫升肿胀的解决方案。
- 用肿胀溶液完成整个下腹部的浸润后, 通过连接3.0 毫米套管连接到60毫升 (或30毫升) 注射器进行人工吸脂或专门设计的3.0 毫米套管连接到一个吸脂装置, 准备一个离心机套件, 一种闭式系统注射器, 用于保持不育, 连接到真空辅助吸脂机上。
- 进行吸脂, 以获得100-110 克脂肪组织排除肿胀溶液。在进行吸脂时, 脂肪组织将与肿胀溶液一起获得, 这应该被分离和去除。
- 要分离肿胀的解决方案, 首先由重力, 转移的脂肪组织在离心机套件中的60毫升注射器和放置注射器 (即,注射器的一部分是在底部)。通过等待5-6 分钟, 脂肪组织和肿胀液将被分离。按下注射器柱塞的顶部, 取出注射器底部的液体。
- 执行上述步骤 1.9-1.11, 直到总共100-110 克脂肪组织 (lipoaspirates) 每膝已经积累。
2. 无菌密闭系统制备 ASC/ECM 混合物
- 在分离肿胀溶液的重力和积累50-55 克 lipoaspirates 每60毫升离心机套件, 一个无菌封闭系统, 将2离心机套件放入离心容器桶, 旋转 1600 x g为5分钟, 冷凝lipoaspirates 和分离脂肪组织中的液体。在这种进一步凝结的过程中, lipoaspirates 可能在某些情况下产生脂肪油。
- 小心不要摇晃, 取下安全帽和离心机套件底部的插头。
- 在离心机套件的活塞顶部慢慢按下, 卸下底液。
- 在单独的60毫升注射器, 溶解10毫克胶原酶 (5 毫克胶原酶特异的结缔组织24和5毫克胶原酶特异的脂肪组织25) 与50毫升生理盐水。
- 将60毫升注射器连接到离心机套件, 用溶解胶原酶 (5 毫克的胶原酶特异的结缔组织和5毫克胶原酶特异的脂肪组织) 的比例约为 1:1 (v: v), 用25-30 毫升 lipoaspirate专用连接器。
- 通过使用杆或推杆将60毫升注射器和离心机套件之间的内容进行彻底混合, 将浓缩 lipoaspirate 和胶原酶结合在一起。
- 将 lipoaspirate 和胶原酶的混合物转移回60毫升注射器。
- 将每60毫升注射器连接起来, 其中包含有刀片的组织均质体。
- 将空的60毫升注射器连接到匀质机的另一端。
- 把混合物推到其他60毫升注射器通过均匀机 4-6 倍, 导致切割和切碎的 lipoaspirate。
- 通过专用连接器将匀质 lipoaspirate 和胶原酶混合物转回到60毫升离心机套件中
- 将离心机套件放置在容器中, 放入预加热37摄氏度的孵化器中。
- 在 45 rpm 旋转时, 将两个离心机套件与匀质混合物在37摄氏度处孵化40分钟。
- 在孵化40分钟后, 将容器从孵化器中取出, 以一种无菌的方式。然后, 拆卸离心机套件, 并将其放置在离心设备中。
- 离心的混合物在 800 x g 5 分钟, 以分离脂肪组织衍生 SVF。
- 离心机后, 取出每个离心机套件上的上清 (包括胶原酶和消化脂肪组织), 去除柱塞顶部的注射器盖, 并将30毫升注射器放在柱塞开口上,通过注射器锁连接。
- 慢慢按下30毫升注射器的枪管部分, 以填充30毫升注射器。
- 按下30毫升注射器桶一直到最后3-4 毫升的离心机套件底部, 只留下最后3-4 毫升脂肪组织衍生的 SVF。上清液被丢弃。
- 从柱塞顶部取出30毫升注射器, 用5% 葡萄糖在乳酸的溶液中填充注射器 (D5LR)。
- 通过附加30毫升注射器填充 D5LR 在顶部的活塞开口, 填补离心套件, 包含3-4 毫升脂肪组织衍生 SVF, D5LR 高达55毫升。
- 取出30毫升注射器, 盖上柱塞, 再将离心机套件再离心 300 x克, 4 分钟。
- 重复步骤 2.17-2. 21, 总共4洗涤液。使用的胶原酶是异体。因此, 大多数胶原酶去除4洗涤。然而, 对于 FDA 的批准, 对该协议的微调可能是必要的, 以彻底消除胶原酶残留在最终的体积, 虽然目前的胶原酶残留量可能是微不足道的病人没有任何临床副作用。
- 4次离心后, 为了获得最后的 SVF 注射, 删除安全帽和插头在底部打开的离心机套件, 不动摇或转动离心套件。
- 使用特殊设计的连接器将20毫升注射器连接到离心机套件底部开口处。
- 几次来回拉动注射器的柱塞, 以震动在离心机套件底部固定的细胞。
- 删除所需的 SVF 的总体积, 包括陶瓷和 ECM 以及其他细胞和组织 (通常约3-4 毫升从每个离心机套件用于膝关节注射)。
3. 用无菌技术制备 PRP
- 在准备陶瓷和 ECM, 绘制30毫升自体血液与2.5 毫升抗凝柠檬酸葡萄糖溶液。
- 将抽取的血液转移到60毫升离心机套件。
- 离心 730 x g的抽血5分钟, 并删除上清到一个新的60毫升离心机套件。将上清液离心机在 1300 x g处4分钟, 产生3-4 毫升的 PRP。
- 注射前, 添加 3% (w/v) 氯化钙, 比例为 10:2 (PRP: 氯化钙, v: v) 到 PRP 激活。
- 添加 0.5% (w/v) HA, 作为一个脚手架, 对 PRP 活化与氯化钙。这些陶瓷与 ecm, 连同 PRP, 由氯化钙活化, HA 代表的 ASC/ECM 混合物。
4. 基于混合的治疗方法
- 用 5% betadine 清洁病人的膝盖, 用无菌的方式将其悬垂。
- 触及膝关节前部为胫骨和股骨骨之间的关节间隙。
- 麻醉注射部位表面与稀释利多卡因 (1 毫升1% 利多卡因稀释4毫升生理盐水) 从皮肤到刚刚外的联合胶囊。
- 麻醉内的联合胶囊与稀释罗哌卡因 (1 毫升0.75% 罗哌卡因稀释3毫升生理盐水)。
- 通过注射器到注射器连接器将2毫升 HA 与20毫升注射器中的6-8 毫升 SVF 混合。
- 通过使用注射器到注射器连接器, 添加0.4 毫升氯化钙到3-4 毫升自体 PRP 已经准备好, 并准备在一个5毫升的注射器。
- 3.5-4.5 毫升的 PRP/氯化钙在5毫升注射器与8-10 毫升的 HA/SVF 混合物在20毫升注射器通过注射器到注射器连接器。
- 立即将混合物 (约12-15 毫升) 缓慢注入膝前胫股骨关节, 使用38毫米18口径针, 或没有超声引导。
- 注射后, 通过折叠4x4 棉纱布4次, 并将胶带放在折叠的4x4 纱布上, 用压力包扎注射部位。
- 指示病人保持静止60分钟, 以允许细胞附着。
- 指导病人在出院后1周内限制活动。
- 在3周内, 再回到诊所再注射三份由氯化钙活化的 PRP。
5. 治疗后随访
- 评估患者在 2, 4, 16 (18 或 22) 的疼痛改善, 从视觉模拟量表 (输精管) 和功能改善方面的物理治疗参数。确定功能评分指数 (星期五), 输精管和运动范围 (ROM), 如前所述26,27。
- 治疗后3月, 随访患者的 MRI 治疗。
结果
三例患者 (87 岁女性, 3 期 oa, 68 岁男性, 3 岁 oa), 一名年龄在60年级 oa 的女性, 而没有任何重要的过去病史向临床提供持续性膝痛, 并希望潜在自体脂肪组织衍生 SVF 治疗。所有三名患者的膝盖都经过整形外科医生的检查, 并提供了全膝关节置换术 (TKR), 不愿意进行手术。在手术前, 所有三例患者都接受了多次注射类固醇和 HA, 但没有任何延长的改善。
讨论
在 2001年, 祖克。用胶原酶分解胶原基质, 从脂肪组织中分离出干细胞6。随后, 该组发现, 这些从脂肪组织中分离出来的干细胞可以转化为软骨和胚层的其他组织, 证明这些干细胞是以间充质为来源的。
同样, 本文所提出的程序也是将类似方法应用于人类患者的一种改进的协议。该协议的主要修改是将闭式系统注射器纳入 lipoaspirates 的获取和处理, 以便尽...
披露声明
作者没有什么可透露的。
致谢
作者确认了嘉强诊所员工的支持, 以及 Jaepil/李国宝的形象设计。这项工作得到了 MSIT (NRF-2017M3A9E4078014) 资助的 NRF 生物 & 医疗技术发展计划的研究补助金的支持;以及由科学和信息和通信技术部 (数字 NRF-2017R1A2B4002315 和 NRF-2016R1C1B2010308) 资助的韩国国家研究基金会 (NRF)。
材料
| Name | Company | Catalog Number | Comments |
| Material | |||
| 5% Betadine (povidone-iodine) | Firson Co., Ltd. | 657400260 | |
| 2% Lidocaine | Daehan Pharmaceutical Co. | 670603480 | |
| Tumescent solution | Myungmoon Pharm. Co. Ltd. | N01BB01 | The solution was composed of 500 mL normal saline, 40 mL 2% lidocaine, 20 mL 0.5% marcaine, and 0.5 mL epinephrine 1:1000. |
| Liberase TL and TM research grade | Roche Applied Science | 5401020001 | |
| D5LR | Dahan Pharm. Co., Ltd. | 645101072 | Dextrose 5% in lactated Ringer's solution |
| Anticoagulant citrate dextrose solution | Fenwal, Inc. | NDC:0942-0641 | The solution was composed of 0.8% citric acid, 0.22% sodium citrate, and 0.223% dextrose. |
| 3% (w/v) Calcium chloride | Choongwae Pharmaceutical Co. | 644902101 | |
| 0.5% (w/v) HA (Hyaluronic acid ) | Dongkwang pharm. Co., Ltd. | 645902030 | |
| 0.25% Ropivacaine | Huons Co., Ltd. | 670600150 | |
| Equipment | |||
| 3.0 mm Cannula | WOOJU Medical Instruments Co. | ML30200 | |
| 60-mL Luer-Lock syringe | BD (Becton Dickinson) | 309653 | |
| Centrifuge Barrel Kit | CPL Co., Ltd. | 30-0827044 | |
| Tissue homogenizer that contains blades | CPL Co., Ltd. | 30-0827045 | |
| Rotating incubator mixer | Medikan Co., Ltd | MS02060092 | |
| Centrifuge | Hanil Scientific Inc. | CE1133 | |
| Magnetic Resonance Imaging | Philips Medical Systems Inc. | 18068 | |
| Ultrasound Imaging System | Samsung Medison co., Ltd | CT-LK-V10-ICM-09.05.2007 |
参考文献
- Arnoczky, S. P. Building a meniscus. Biologic considerations. Clinical Orthopaedics and Related Research. (367 Suppl), S244-S253 (1999).
- Barry, F. P. Mesenchymal stem cell therapy in joint disease. Novartis Foundation Symposium. 249, 86-241 (2003).
- Usuelli, F. G., et al. Adipose-derived stem cells in orthopaedic pathologies. British Medical Bulletin. 124 (1), 31-54 (2017).
- Zhang, H. N., Li, L., Leng, P., Wang, Y. Z., Lv, C. Y. Uninduced adipose-derived stem cells repair the defect of full-thickness hyaline cartilage. Chinese Journal of Traumatology. 12 (2), 92-97 (2009).
- Zuk, P. A., et al. Human adipose tissue is a source of multipotent stem cells. Molecular Biology of the Cell. 13 (12), 4279-4295 (2002).
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Engineering. 7 (2), 211-228 (2001).
- Baer, P. C., Geiger, H. Adipose-derived mesenchymal stromal/stem cells: tissue localization, characterization, and heterogeneity. Stem Cells International. 2012, 812693 (2012).
- Zhu, Y., et al. Adipose-derived stem cell: a better stem cell than BMSC. Cell Biochemistry and Function. 26 (6), 664-675 (2008).
- Bellei, B., Migliano, E., Tedesco, M., Caputo, S., Picardo, M. Maximizing non-enzymatic methods for harvesting adipose-derived stem from lipoaspirate: technical considerations and clinical implications for regenerative surgery. Scientific Reports. 7 (1), 10015 (2017).
- Pak, J., Lee, J. H., Park, K. S., Jeong, B. C., Lee, S. H. Regeneration of Cartilage in Human Knee Osteoarthritis with Autologous Adipose Tissue-Derived Stem Cells and Autologous Extracellular Matrix. BioResearch Open Access. 5 (1), 192-200 (2016).
- Alexander, R. W. Understanding Adipose-derived Stromal Vascular Fraction (AD-SVF) Cell Biology and Use on the Basis of Cellular, Chemical, Structural and Paracrine Components: A Concise Review. Journal of Prolotherapy. 4, e855-e869 (2012).
- Benders, K. E., et al. Extracellular matrix scaffolds for cartilage and bone regeneration. Trends in Biotechnology. 31 (3), 169-176 (2013).
- Korean Food and Drug Administration (KFDA). Cell therapy: Rules and Regulations. KFDA. , (2009).
- Pak, J. Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose-tissue-derived stem cells: a case series. Journal of Medical Case Reports. 5, 296 (2011).
- Pak, J., Chang, J. J., Lee, J. H., Lee, S. H. Safety reporting on implantation of autologous adipose tissue-derived stem cells with platelet-rich plasma into human articular joints. BMC Musculoskeletal Disorders. 14, 337 (2013).
- Pak, J., Lee, J. H., Kartolo, W. A., Lee, S. H. Cartilage Regeneration in Human with Adipose Tissue-Derived Stem Cells: Current Status in Clinical Implications. BioMed Research International. 2016, 4702674 (2016).
- Pak, J., Lee, J. H., Lee, S. H. A novel biological approach to treat chondromalacia patellae. PLoS One. 8 (5), e64569 (2013).
- Pak, J., Lee, J. H., Lee, S. H. Regenerative repair of damaged meniscus with autologous adipose tissue-derived stem cells. BioMed Research International. 2014, 436029 (2014).
- Aust, L., et al. Yield of human adipose-derived adult stem cells from liposuction aspirates. Cytotherapy. 6 (1), 7-14 (2004).
- De Ugarte, D. A., et al. Comparison of multi-lineage cells from human adipose tissue and bone marrow. Cells Tissues Organs. 174 (3), 101-109 (2003).
- Guilak, F., et al. Clonal analysis of the differentiation potential of human adipose-derived adult stem cells. Journal of Cellular Physiology. 206 (1), 229-237 (2006).
- Mitchell, J. B., et al. Immunophenotype of human adipose-derived cells: temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. 24 (2), 376-385 (2006).
- Oedayrajsingh-Varma, M. J., et al. Adipose tissue-derived mesenchymal stem cell yield and growth characteristics are affected by the tissue-harvesting procedure. Cytotherapy. 8 (2), 166-177 (2006).
- . Liberase TL information available from Sigma Millipore online Available from: https://www.sigmaaldrich.com/catalog/product/roche/05401020001?lang=en®ion=US (2018)
- . Liberase TM information available from Sigma Millipore online Available from: https://www.sigmaaldrich.com/catalog/product/roche/Libtmro?lang=en®ion=US (2018)
- Childs, J. D., Piva, S. R. Psychometric properties of the functional rating index in patients with low back pain. European Spine Journal. 14 (10), 1008-1012 (2005).
- Price, D. D., McGrath, P. A., Rafii, A., Buckingham, B. The validation of visual analogue scales as ratio scale measures for chronic and experimental pain. Pain. 17 (1), 45-56 (1983).
- Pilgaard, L., Lund, P., Rasmussen, J. G., Fink, T., Zachar, V. Comparative analysis of highly defined proteases for the isolation of adipose tissue-derived stem cells. Regenerative Medicine. 3 (5), 705-715 (2008).
- D'Ambrosi, R., Indino, C., Maccario, C., Manzi, L., Usuelli, F. G. Autologous Microfractured and Purified Adipose Tissue for Arthroscopic Management of Osteochondral Lesions of the Talus. Journal of Visualized Experiments. (131), e56395 (2018).
- Packer, J. D., Chang, W. T., Dragoo, J. L. The use of vibrational energy to isolate adipose-derived stem cells. Plastic Reconstructive Surgery-Global Open. 6 (1), e1620 (2018).
- Hanke, C. W., Bernstein, G., Bullock, S. Safety of tumescent liposuction in 15,336 patients. National survey results. Dermatologic Surgery. 21 (5), 459-462 (1995).
- Illouz, Y. G. Complications of liposuction. Clinics in Plastic Surgery. 33 (1), 129-163 (2006).
- Dixit, V. V., Wagh, M. S. Unfavourable outcomes of liposuction and their management. Indian Journal of Plastic Surgery. 46 (2), 377-392 (2013).
- Lehnhardt, M., et al. Major and lethal complications of liposuction: a review of 72 cases in Germany between 1998 and 2002. Plastic and Reconstructive Surgery. 121 (6), 396e-403e (2008).
- Iyer, S. S., Rojas, M. Anti-inflammatory effects of mesenchymal stem cells: novel concept for future therapies. Expert Opinion on Biological Therapy. 8 (5), 569-581 (2008).
- Zhang, J., Middleton, K. K., Fu, F. H., Im, H. J., Wang, J. H. HGF mediates the anti-inflammatory effects of PRP on injured tendons. PLoS One. 8 (6), e67303 (2013).
- Li, N. Y., Yuan, R. T., Chen, T., Chen, L. Q., Jin, X. M. Effect of platelet-rich plasma and latissimus dorsi muscle flap on osteogenesis and vascularization of tissue-engineered bone in dogs. Journal of Oral and Maxillofacial Surgery. 67 (9), 1850-1858 (2009).
- Parsons, P., et al. The biological effect of platelet rich-plasma on the fracture healing process. The Journal of bone and joint surgery. British volume. 91-B, 293 (2009).
- Wu, W., Chen, F., Liu, Y., Ma, Q., Mao, T. Autologous injectable tissue-engineered cartilage by using platelet-rich plasma: experimental study in a rabbit model. Journal of Oral and Maxillofacial Surgery. 65 (10), 1951-1957 (2007).
- Cooper, T. W., Eisen, A. Z., Stricklin, G. P., Welgus, H. G. Platelet-derived collagenase inhibitor: characterization and subcellular localization. Proceedings of the National Academy of Sciences of the United States of America. 82 (9), 2779-2783 (1985).
- Uzuki, M., Sawai, T. A. A comparison of the affinity of sodium hyaluronate of various molecular weights for degenerated cartilage: a histochemical study using hyaluronic acid binding protein. International Congress Series. 1223, 279-284 (2001).
- Pagano, C., et al. Molecular and morphometric description of adipose tissue during weight changes: a quantitative tool for assessment of tissue texture. International Journal of Molecular Medicine. 14 (5), 897-902 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。