Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yağ dokusundan elde edilen Stromal vasküler kesir için potansiyel kıkırdak rejenerasyon üreten klinik protokol
Bu Makalede
Özet
Burada, bir Yağ dokusundan elde edilen stromal vasküler fraksiyonu ve osteoartrit olan insan hastalarda kıkırdak benzeri doku Yenileyici tarafından diz işlevlerini geliştirmek için uygulama üretmek için bir protokol mevcut.
Özet
Osteoartrit (OA) en yaygın zayıflatıcı bozuklukları biridir. Son zamanlarda, sayısız girişimde mezenkimal kök hücrelerin (MSCs) farklı formları kullanarak diz fonksiyonlarını geliştirmek için yapılmıştır. Kore, kemik iliği konsantreleri ve kordon kan kaynaklı kök hücre Kore Gıda ve ilaç yönetimi (KFDA) tarafından kıkırdak rejenerasyon için onaylanmıştır. Buna ek olarak, bir Yağ dokusundan elde edilen stromal vasküler fraksiyonu (SVF) tarafından KFDA insan hastalarda eklem enjeksiyonları için izin. Otolog yağ dokusundan elde edilen SVF yanı sıra mezenkimal kök hücre hücre dışı matriks (ECM) içerir. ECM, hyaluronik asit (HA) ve trombosit açısından zengin plazma kalsiyum klorür karışımından aktif (PRP) ile birlikte MSCs kıkırdak yeniden ve diz işlevlerini geliştirmek için yardımcı olabilecek çeşitli sitokinlerin excretes. Bu makalede, biz OA insan hastalarda kıkırdak benzeri doku Yenileyici tarafından diz işlevlerini geliştirmek için bir protokol sundu. Protokol sonucu ilk birkaç ek yayınları tarafından takip 2011 yılında bildirildi. Protokol collagenase ile karışık otolog lipoaspirates elde etmek için liposuction içerir. Bu lipoaspirates-collagenase karışımı daha sonra kesme ve iğne kadar enjeksiyon sırasında yapışmasına neden büyük fibröz doku kaldırmak için homojenize. Daha sonra karışımı Yağ dokusundan elde edilen SVF elde etmek için inkübe. Hem Yağ dokusundan elde edilen MSCs ve ECM, kalıntıları içeren elde edilen Yağ dokusundan elde edilen SVF diz HA ile birlikte hastaların içine enjekte edilir ve kalsiyum klorür PRP harekete geçirmek. Diz ağrısı, şişkinlik ve MRI kanıt hiyalin kıkırdak benzeri doku birlikte hareket aralığını iyileştirme sonuçlanan bizim protokolü ile tedavi edilen hastaların üç kasa bulunmaktadır.
Giriş
Mezenkimal kök hücre (MSCs) kıkırdak1,2,3,4,5,6yeniden yeteneğine sahip olduğu bilinmektedir. Onlar kolayca çeşitli kaynaklardan elde edilebilir: kemik iliği, kordon kanı ve yağ dokusu diğerleri arasında. Bu kaynaklar arasında yağ dokusu nerede MSCs yeterli sayıda klinik ayarları7,8kıkırdak yeniden oluşturmak için herhangi bir kültür genişleme olmadan elde edilebilir tek kaynağıdır. Otolog Kemik iliği stromal vasküler kesir (SVF) kolayca de elde edilebilir. Ancak, kök hücre kültürü olmayan genişletilmiş iliğinde bulunan çok düşük7,8sayısıdır. Kordon kanı MSCs yeterli sayıda içerebilir. Ancak, kordon kanı otolog SVF hazır bir kaynak değildir.
İşleme yağ dokusu SVF elde etmek için birçok yöntem klinik uygulamaları için uygundur. Bunlar MSCs collagenase, kullanarak Yağ dokusundan elde etme yöntemi arasında geliştirilen ve Zuk vd tarafından onaylandı 5 , 6, çok iyi kabul edilir. Collagenase kullanarak bu yöntem ortopedi klinik uygulamalar için değiştirildi. Klinik ayarları için uygulanması için sistemi kolaylık tutarken kısırlık korumak için kapalı bir sistem olması gerekir. Bu makalede sunulan bir belirli değişiklik lipoaspirates homojenizasyon içerir. Küçük ölçekli lipoaspirates nispeten yağ dokusu düzensiz dağılımı sonuçlanan büyük olanlar daha hızlı sindirilir. Ayrıca, bu daha büyük ölçekli lipoaspirates eklem enjeksiyonları9,10gerçekleştirirken yapışmasına neden olabilir şırınga ve iğne kadar fibröz doku üretebilir. Bu sorunları önlemek için lipoaspirates tarafından kesim ve lipoaspirates collagenase ile kuluçka önce kıyma homojenize. Elde edilen Yağ dokusundan elde edilen SVF homojenize11olmayan lipoaspirates göre daha düzgün hücre dışı matriks (ECM) içerebilir. SVF içinde bulunan kırık dökük ECM iskele12olarak çalışabilir.
2009 yılında, Otolog yağ dokusundan elde edilen SVF Kore Gıda ve ilaç yönetimi (KFDA) en az işlemi olan bir tıbbi tesis içinde bir hekim13tarafından işlendiğinen tarafından izin verilmiş. Daha sonra Otolog yağ dokusundan elde edilen SVF potansiyel olarak kıkırdak benzeri doku10,14,15 Yenileyici tarafından Osteoartrit (OA) hastalarda diz işlevlerini geliştirmek için potansiyel bir aracı olarak kullanılmaktadır , 16 , 17 , 18 .
2011 yılında Pak ilk kez Yağ dokusundan elde edilen kök hücreler (ASCs) Yağ dokusundan elde edilen SVF bulunan potansiyel olarak trombosit açısından zengin ile enjekte edildiğinde insan OA hastalarda kıkırdak benzeri doku Yenileyici diz işlevlerini artırabilir gösterdi plazma (PRP) 14. Buna ek olarak, Pak et al. 2013 maddelerle ilgili 91 hastalarda güvenlik veri bildirdin. Bu Emanet verilerde bildirilen kaba etkinliği oranı % 67'si15oldu. Daha sonra bir menisküs gözyaşı chondromalacia patellae10,ve16,17 olan hastalarda kıkırdak benzeri doku yenilenmesi nedeniyle potansiyel olarak geliştirilmiş diz işlevleri Pak et al. tarafından ek çalışmalar gösterdi ,18. Rapor makaleler göre bu kök hücreleri 100 gr yağ dokusu Bu makalede sunulan protokolü tarafından işlenen yer alan 1.000.000-40.000.000 bağlı olarak hastaların özellikleri8, arasında değişen bilinmektedir 19 , 20 , 21 , 22 , 23.
Burada, bir klinik protokol insan diz OA HA ve kalsiyum klorür ile aktive PRP ile Otolog yağ dokusundan elde edilen SVF kullanarak mevcut. Kısırlık, korumak için kapalı, el ile bir sistem içeren bu klinik protokolünün ilk sürümünü 201114' te bildirildi. Aynı protokol optimize edildi, kısırlık, bakımı ve 2013 ve 201610,15' olduğu bildirildi. Burada, en iyi duruma getirilmiş Protokolü sundu. Protokol şematik bakış Şekil 1' de sunulmuştur.
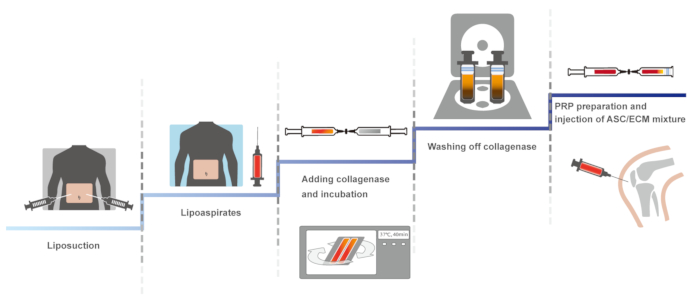
Şekil 1: protokol şematik bakış. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Protokol
Onay ve olgu sunumları takiben rapor için kullanıcıdan Myongji Üniversitesi Kurumsal değerlendirme komitesi Komitesi (MJUIRB) tarafından feragat. Daha fazla, bu klinik protokol KFDA Helsinki Bildirgesi ve düzenleme yönergeleri ile uyumlu oldu. Yordamlar için Hastalardan bilgilendirilmiş izinlerin elde edilmiştir.
1. liposuction
Not: steril tekniği ile gerçekleştirin.
- Aşağıdaki dahil ölçütleri kullanın: evre 3 (1) MRG kanıtı OA; (2) ya erkek veya kadın; (3) 18 yaşını doldurmuş; (4) yeterli (100-110 g) yağ dokusu liposuction için; (5) isteksizlik cerrahi müdahale ile devam etmek için; (6) muhafazakar yönetimi yetersizliği; ve (7) devam eden devre dışı bırakma ağrı.
- Aşağıdaki dışlama ölçütleri kullanın: (1) etkin enflamatuar veya bağ dokusu hastalığı düşündüm etkisi ağrı durumu (Yani,lupus romatoid artrit, fibromiyalji); (2) ağrı durumu (Yani, hipotiroidi, diyabet); etkisi olabilir aktif endokrin bozukluğu (3) ağrı durumu (Yani, periferik nöropati, multipl skleroz); etkileyebilir etkin nörolojik bozukluk (4) aktif akciğer hastalığı ilaç kullanımı gerektiren; ve (5) steroid eklem enjeksiyonları son 3 ay öyküsü.
- Ameliyathane biohazard sınıf A kukuleta ile hasta getirmek ve onu (ya da onu) sırtüstü pozisyonda yerleştirin.
- %5 betadin (povidone-iyot) ile hastanın karın bölgesi temiz ve karın liposuction için temizlenmiş alanı açığa steril tekniği kullanılarak hastanın asmak.
- Yaklaşık 5 cm infero yanal abdomenden anestezi kesi to-be-%2 lidokain adrenalin olmadan 2 mL 5 mL şırınga (25 ölçer, 1½ inç) iğne ile kullanılarak yapılan iki site (sol ve diğer abdomenden sağ tarafında bir) her site epidermal düzeyde enjekte edilerek.
- Kesi to-be-5 mL şişen çözeltisi (%2 lidokain, % 0.5 bupivacaine, 1: 1000 adrenalin 0,5 mL 20 mL normal salin, 40 mL, 500 mL) bir 10 mL şırınga bir iğneyle (25 ölçer, 1½ inç) kullanılarak yapılan sitenin anestezi.
- 0.5 cm yaklaşık 5 cm abdomenden aşağıda 2 insizyon yanal subkutan düzey derinliği yükseltmek için cilt pinching tarafından olun.
- No 11 bıçak kullanarak, yükseltilmiş deri yoluyla subkutan seviyeye nüfuz ama karın duvarı nüfuz değil poke.
- 20 cm 16 lik kanül kullanarak, e-be-liposuctioned, bütün alt karın alanı subkutan düzeyi 700-800 mL şişen çözeltisi ile anestezi.
- Sonra bütün alt karin şişen çözümle infiltrasyonu bitirme bağlı bir 3,0 mm kanül bağlanarak hazırlamak liposuction cihazları 60 mL (ya da bir 30 mL) şırınga el ile liposuction veya bağlı bir özel olarak tasarlanmış 3.0 mm kanül için bir Santrifüj kiti, kısırlık, tutmak amacıyla kapalı sistem şırınga için Vakum Yardımlı liposuction vakum makinesine bağlı.
- 100-110 g yağ doku şişen çözüm hariç olmak üzere elde etmek için liposuction gerçekleştirin. Liposuction işlemi sırasında Yağ dokusundan ayrılmış ve kaldırılması şişen çözüm ile birlikte elde edilir.
- Şişen çözüm ayırmak için ilk yerçekimi tarafından 60 mL şırınga yağ dokusu santrifüj seti transfer ve şırınga (şırınga altındaki alandıryani ) aşağı yerleştirin. 5-6 dk bekleyerek, yağ dokusu ve şişen sıvı ayrılacaktır. Sıvı şırınga dibinde şırınga pistonu üst kısmı basarak kaldırın.
- Birikmiş yağ dokusu diz (lipoaspirates) 100-110 g toplam kadar 1.9-1,11 yukarıdaki adımları uygulayın.
2. steril kapalı sistem ile ASC/ECM karışımı hazırlanması
- Ayıran sonra yerçekimi ve lipoaspirates her 60 mL santrifüj kit, steril kapalı bir sistem, başına 50-55 g biriken şişen çözüm yer bir santrifüj konteyner kova ve 1600 x g 5 min, yoğuşmalı için spin içine 2 santrifüj kitleri lipoaspirates ve sıvı yağ dokusundan ayırmak. Bu süreci daha da yoğunlaşır, lipoaspirates bazı durumlarda yağ yağ üretebilir.
- Salla, güvenlik kapağı ve alt santrifüj kitinin fiş kaldırmak için dikkatli olmak.
- Alt sıvı yavaş yavaş aşağı santrifüj kiti pistonu üstüne bastırarak çıkarın.
- Ayrı 60 mL şırınga üzerinde collagenase (5 mg collagenase bağ dokusu24 için belirli) ve collagenase yağ dokusu25için belirli 5 mg 10 mg 50 mL normal salin ile geçiyoruz.
- Yoğun lipoaspirate yaklaşık 25-30 mL çözünmüş collagenase (5 mg collagenase bağ dokusu için belirli) ve 5 mg collagenase yağ dokusu için belirli bir oranında 1:1 (v: v) kullanarak bir santrifüj teçhizat-e doğru 60 mL şırınga bağlanarak karıştırın özel bir bağlayıcı.
- İyice yoğun lipoaspirate ve collagenase içeriği 60 mL şırınga ve santrifüj setleri arasında bir çubuk veya bir itici kullanarak iterek karıştırın.
- Lipoaspirate ve collagenase karışımı 60 mL şırınga geri aktarın.
- Bıçaklar içeren bir doku homogenizer ile karışımı içeren her 60 mL şırınga bağlayın.
- Bir boş 60 mL şırınga homogenizer diğer ucunu bağlayın.
- 4 -6 kez için diğer 60 mL şırınga ile homogenizer karışımı itmeye kesme ve lipoaspirate kıyma ile sonuçlanan.
- Homojenize lipoaspirate ve collagenase karışımı geri 60 mL santrifüj kitleri özel bir bağlayıcıyla transfer
- Santrifüj kitleri 37 ° C'de önceden ısıtılmış olmuştur bir kuluçka yerleştirilmesi için bir kapsayıcı yerleştirin
- İki santrifüj kitleri 40 dk 37 ° C'de homojen karışımı ile 45 rpm'de dönen kuluçkaya.
- Kuluçka 40 dk sonra da kuluçka makinesine steril bir moda konteyner kaldırın. O zaman, santrifüj kitleri kaldırın ve yer onları içinde bir santrifüj makinesi.
- Karışımlar vasıl 800 x g Yağ dokusundan elde edilen SVF ayırmak 5 dk santrifüj kapasitesi.
- Santrifüj sonra (hangi collagenase içerir ve yağ dokusu sindirmek) süpernatant her santrifüj kitleri şırınga başlığını pistonu üstünde kaldırma ve üzerinden şırınga kilit açma dalgıç bir 30 mL şırınga yerleştirerek kaldırmak bağlantı.
- Yavaş yavaş 30 mL şırınga 30 mL şırınga doldurmak süpernatant için varil parçası aşağı tuşuna basın.
- 30 mL şırınga namludan sadece son 3-4 mL Yağ dokusundan elde edilen SVF bırakarak santrifüj kit alt son 3-4 mL kadar basın. Süpernatant atılır.
- 30 mL şırınga pistonu en baştan çıkarmak ve %5 Dekstroz lactated zil'ın çözüm (D5LR) ile şırıngaya doldur.
- Açılış pistonu üst kısmında D5LR ile dolu 30 mL şırınga ekleyerek, D5LR ile Yağ dokusundan elde edilen SVF 3-4 mL içeren santrifüj kitleri doldurmak kadar 55 mL.
- 30 mL şırınga kaldırmak, pistonu kap ve 300 x g 4 dk santrifüj kitleri tekrar santrifüj kapasitesi.
- 2.17-2.21 toplam 4 yıkama makinaları için yineleyin. Kullanılan collagenase xenogenic. Bu nedenle, çoğu collagenase 4 yıkama tarafından kaldırılır. Her ne kadar collagenase artıkları geçerli miktarı herhangi bir klinik var mı hastalar için önemsiz olabilir ancak, FDA onayı için protokolü ile ince ayar collagenase artıkları son hacim içinde tamamen kaldırmak gerekli olabilir yan etkileri.
- 4th Santrifüjü sonra enjeksiyon için son SVF elde etmek için güvenlik kapağı ve alt açıklıklı santrifüj kitinin fişini sallayarak veya santrifüj kiti dönerek kaldırın.
- Özel olarak tasarlanmış bir bağlayıcı kullanarak açılış santrifüj kit alt 20 mL şırınga iliştirin.
- Santrifüj seti altta yerleşmiş hücreleri sarsmak için birkaç kez ileri geri şırınga pompayı çek.
- Kaldırmak istediğiniz diğer hücre ve doku ile birlikte ASCs ve ECM içeren SVF hacmi (genellikle diz eklem enjeksiyonları için her santrifüj Takımı'ndan yaklaşık 3-4 mL).
3. PRP hazırlık steril tekniği ile
- ASCs ve ECM hazırlarken, otolog kan 30 mL 2.5 mL antikoagülan sitrat dekstroz çözeltisi ile çizin.
- Çizilmiş kan 60 mL santrifüj kitleri için transfer.
- 730 x g 5 min için çizilmiş kana santrifüj kapasitesi ve süpernatant yeni bir 60 mL santrifüj kiti kaldırın. 1300 x g 4 dk, 3-4 mL PRP sonuçlanan için de süpernatant santrifüj kapasitesi.
- Şu enjeksiyon önce 10:2 oranında % 3 (w/v) Kalsiyum klorür ekleyin (PRP: Kalsiyum klorür, v: v) etkinleştirmek için PRP için.
- %0,5 (w/v) HA, bir iskele olarak kalsiyum klorür ile aktive PRP ekleyin. Bu ASCs ile birlikte PRP, ECM ile kalsiyum klorür tarafından aktive ve HA stand için ASC/ECM karışımı.
4. ASC/ECM karışımı dayalı tedavi
- Hasta % 5 betadin ile diz temiz ve steril bir şekilde asmak.
- Anterior tibial ve femur kemikleri arasında ortak alanı için dizde muayene et.
- Deri dışında ek kapsül sadece yüzeysel olarak seyreltilmiş lidokain (4 mL normal salin ile seyreltilmiş %1 lidokain 1 mL) ile enjeksiyon izi anestezi.
- Seyreltilmiş ropivacaine (normal salin ile 3 mL sulandırılmış 1 mL % 0.75 ropivacaine) ile ek kapsül içine anestezi.
- Mix 2 mL şırınga şırınga bağlayıcı üzerinden 20 mL şırınga bulunan SVF 6-8 ml ha.
- Bir şırınga şırınga bağlayıcı kullanarak, 0.4 mL kalsiyum klorür otolog zaten hazırlanan PRP ve bir 5 mL şırınga hazır 3-4 mL ekleyin.
- 8-10 mL şırınga şırınga bağlayıcı üzerinden 20 mL şırınga HA/SVF karışımı ile 3.5-4.5 mL 5 mL şırınga PRP/kalsiyum klorür birleştirir.
- Hemen (yaklaşık 12-15 mL) karışımı yavaş yavaş 38 mm 18'lik iğne ile veya ultrason rehberliği olmadan kullanarak diz ön tibio-femoral eklem içine enjekte.
- Sonra enjeksiyon, enjeksiyon yeri basınç ile 4 x 4 pamuk gazlı bez 4 kez katlanır ve kasetleri katlanmış 4 x 4 gazlı bez yerleştirerek bandaj.
- Hasta hücre eki için izin vermek 60 dk için hala kalır için talimat.
- Hastanın aktiviteleri için sınırlamak için talimat minimum 1 hafta sonra klinik deşarj.
- Kalsiyum klorür tarafından 3 hafta içinde aktif PRP üç ek enjeksiyonu için klinik dönün.
5. tedavi sonrası takip
- 2, 4 ve 16 (18 ve 22) hafta ağrı iyileşme açısından görsel analog ölçek (VAS) ve fizik tedavi parametreleri açısından işlevi geliştirme için hasta değerlendirmek. İşlev değerlendirmesi dizin (Cuma), VAS ve sıra-in devinim (ROM) yukarıda açıklanan26,27belirleyin.
- Hasta tedavi sonrası MRI 3 ay tedaviden sonra izleyin.
Sonuçlar
3 hasta (87 yaşında kadın ile sahne 3 OA, bir 68 yaşındaki erkek ile birinci aşama 3 OA ve bir 60-year-old kadınla sahne 3 OA) tıbbi geçmiş kalıcı diz ağrısı klinik için sunulan ve istenen herhangi bir önemli geçmiş potansiyel için olmadan Otolog yağ dokusundan elde edilen SVF tedavi. Tüm üç hasta ortopedik cerrah tarafından muayene onların diz vardı ve total diz değiştirme (TKR) için teklif edildi ve ameliyat olmak istekli değildi. Önce yordamı, steroidle...
Tartışmalar
2001 yılında Zuk ve ark. kollajen matris collagenase6ile aşağı kırarak Yağ dokusundan izole kök hücre. Daha sonra Grup, bu kök hücre kaynaklı mezenkimal kanıtlayan bu kök hücrelerin Yağ dokusundan izole kıkırdak ve mesoderm kökenli, diğer dokuların içine dönüştürebilir gösterdi.
Aynı şekilde, yordamın bu makalede sunulan benzer yöntem insan hastalara uygulamak için değiştirilmiş bir protokoldür. Protokol ana değişiklik elde...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Yazar, Mipro tıbbi klinik ve Jaepil/David Lee tarafından şekil tasarım personelinden destek kabul eder. Bu eser araştırma hibe biyo & Tıbbi teknoloji geliştirme programı (sayı NMG-2017M3A9E4078014); MSIT tarafından finanse edilen NMG tarafından desteklenmiştir ve Ulusal Araştırma Vakfı, Kore (ICT (numaraları NMG-2017R1A2B4002315 ve NATO Mukabele Gücü-2016R1C1B2010308) ve Bilim Bakanlığı tarafından finanse edilen NMG).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Material | |||
| 5% Betadine (povidone-iodine) | Firson Co., Ltd. | 657400260 | |
| 2% Lidocaine | Daehan Pharmaceutical Co. | 670603480 | |
| Tumescent solution | Myungmoon Pharm. Co. Ltd. | N01BB01 | The solution was composed of 500 mL normal saline, 40 mL 2% lidocaine, 20 mL 0.5% marcaine, and 0.5 mL epinephrine 1:1000. |
| Liberase TL and TM research grade | Roche Applied Science | 5401020001 | |
| D5LR | Dahan Pharm. Co., Ltd. | 645101072 | Dextrose 5% in lactated Ringer's solution |
| Anticoagulant citrate dextrose solution | Fenwal, Inc. | NDC:0942-0641 | The solution was composed of 0.8% citric acid, 0.22% sodium citrate, and 0.223% dextrose. |
| 3% (w/v) Calcium chloride | Choongwae Pharmaceutical Co. | 644902101 | |
| 0.5% (w/v) HA (Hyaluronic acid ) | Dongkwang pharm. Co., Ltd. | 645902030 | |
| 0.25% Ropivacaine | Huons Co., Ltd. | 670600150 | |
| Equipment | |||
| 3.0 mm Cannula | WOOJU Medical Instruments Co. | ML30200 | |
| 60-mL Luer-Lock syringe | BD (Becton Dickinson) | 309653 | |
| Centrifuge Barrel Kit | CPL Co., Ltd. | 30-0827044 | |
| Tissue homogenizer that contains blades | CPL Co., Ltd. | 30-0827045 | |
| Rotating incubator mixer | Medikan Co., Ltd | MS02060092 | |
| Centrifuge | Hanil Scientific Inc. | CE1133 | |
| Magnetic Resonance Imaging | Philips Medical Systems Inc. | 18068 | |
| Ultrasound Imaging System | Samsung Medison co., Ltd | CT-LK-V10-ICM-09.05.2007 |
Referanslar
- Arnoczky, S. P. Building a meniscus. Biologic considerations. Clinical Orthopaedics and Related Research. (367 Suppl), S244-S253 (1999).
- Barry, F. P. Mesenchymal stem cell therapy in joint disease. Novartis Foundation Symposium. 249, 86-241 (2003).
- Usuelli, F. G., et al. Adipose-derived stem cells in orthopaedic pathologies. British Medical Bulletin. 124 (1), 31-54 (2017).
- Zhang, H. N., Li, L., Leng, P., Wang, Y. Z., Lv, C. Y. Uninduced adipose-derived stem cells repair the defect of full-thickness hyaline cartilage. Chinese Journal of Traumatology. 12 (2), 92-97 (2009).
- Zuk, P. A., et al. Human adipose tissue is a source of multipotent stem cells. Molecular Biology of the Cell. 13 (12), 4279-4295 (2002).
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Engineering. 7 (2), 211-228 (2001).
- Baer, P. C., Geiger, H. Adipose-derived mesenchymal stromal/stem cells: tissue localization, characterization, and heterogeneity. Stem Cells International. 2012, 812693 (2012).
- Zhu, Y., et al. Adipose-derived stem cell: a better stem cell than BMSC. Cell Biochemistry and Function. 26 (6), 664-675 (2008).
- Bellei, B., Migliano, E., Tedesco, M., Caputo, S., Picardo, M. Maximizing non-enzymatic methods for harvesting adipose-derived stem from lipoaspirate: technical considerations and clinical implications for regenerative surgery. Scientific Reports. 7 (1), 10015 (2017).
- Pak, J., Lee, J. H., Park, K. S., Jeong, B. C., Lee, S. H. Regeneration of Cartilage in Human Knee Osteoarthritis with Autologous Adipose Tissue-Derived Stem Cells and Autologous Extracellular Matrix. BioResearch Open Access. 5 (1), 192-200 (2016).
- Alexander, R. W. Understanding Adipose-derived Stromal Vascular Fraction (AD-SVF) Cell Biology and Use on the Basis of Cellular, Chemical, Structural and Paracrine Components: A Concise Review. Journal of Prolotherapy. 4, e855-e869 (2012).
- Benders, K. E., et al. Extracellular matrix scaffolds for cartilage and bone regeneration. Trends in Biotechnology. 31 (3), 169-176 (2013).
- Korean Food and Drug Administration (KFDA). Cell therapy: Rules and Regulations. KFDA. , (2009).
- Pak, J. Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose-tissue-derived stem cells: a case series. Journal of Medical Case Reports. 5, 296 (2011).
- Pak, J., Chang, J. J., Lee, J. H., Lee, S. H. Safety reporting on implantation of autologous adipose tissue-derived stem cells with platelet-rich plasma into human articular joints. BMC Musculoskeletal Disorders. 14, 337 (2013).
- Pak, J., Lee, J. H., Kartolo, W. A., Lee, S. H. Cartilage Regeneration in Human with Adipose Tissue-Derived Stem Cells: Current Status in Clinical Implications. BioMed Research International. 2016, 4702674 (2016).
- Pak, J., Lee, J. H., Lee, S. H. A novel biological approach to treat chondromalacia patellae. PLoS One. 8 (5), e64569 (2013).
- Pak, J., Lee, J. H., Lee, S. H. Regenerative repair of damaged meniscus with autologous adipose tissue-derived stem cells. BioMed Research International. 2014, 436029 (2014).
- Aust, L., et al. Yield of human adipose-derived adult stem cells from liposuction aspirates. Cytotherapy. 6 (1), 7-14 (2004).
- De Ugarte, D. A., et al. Comparison of multi-lineage cells from human adipose tissue and bone marrow. Cells Tissues Organs. 174 (3), 101-109 (2003).
- Guilak, F., et al. Clonal analysis of the differentiation potential of human adipose-derived adult stem cells. Journal of Cellular Physiology. 206 (1), 229-237 (2006).
- Mitchell, J. B., et al. Immunophenotype of human adipose-derived cells: temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. 24 (2), 376-385 (2006).
- Oedayrajsingh-Varma, M. J., et al. Adipose tissue-derived mesenchymal stem cell yield and growth characteristics are affected by the tissue-harvesting procedure. Cytotherapy. 8 (2), 166-177 (2006).
- . Liberase TL information available from Sigma Millipore online Available from: https://www.sigmaaldrich.com/catalog/product/roche/05401020001?lang=en®ion=US (2018)
- . Liberase TM information available from Sigma Millipore online Available from: https://www.sigmaaldrich.com/catalog/product/roche/Libtmro?lang=en®ion=US (2018)
- Childs, J. D., Piva, S. R. Psychometric properties of the functional rating index in patients with low back pain. European Spine Journal. 14 (10), 1008-1012 (2005).
- Price, D. D., McGrath, P. A., Rafii, A., Buckingham, B. The validation of visual analogue scales as ratio scale measures for chronic and experimental pain. Pain. 17 (1), 45-56 (1983).
- Pilgaard, L., Lund, P., Rasmussen, J. G., Fink, T., Zachar, V. Comparative analysis of highly defined proteases for the isolation of adipose tissue-derived stem cells. Regenerative Medicine. 3 (5), 705-715 (2008).
- D'Ambrosi, R., Indino, C., Maccario, C., Manzi, L., Usuelli, F. G. Autologous Microfractured and Purified Adipose Tissue for Arthroscopic Management of Osteochondral Lesions of the Talus. Journal of Visualized Experiments. (131), e56395 (2018).
- Packer, J. D., Chang, W. T., Dragoo, J. L. The use of vibrational energy to isolate adipose-derived stem cells. Plastic Reconstructive Surgery-Global Open. 6 (1), e1620 (2018).
- Hanke, C. W., Bernstein, G., Bullock, S. Safety of tumescent liposuction in 15,336 patients. National survey results. Dermatologic Surgery. 21 (5), 459-462 (1995).
- Illouz, Y. G. Complications of liposuction. Clinics in Plastic Surgery. 33 (1), 129-163 (2006).
- Dixit, V. V., Wagh, M. S. Unfavourable outcomes of liposuction and their management. Indian Journal of Plastic Surgery. 46 (2), 377-392 (2013).
- Lehnhardt, M., et al. Major and lethal complications of liposuction: a review of 72 cases in Germany between 1998 and 2002. Plastic and Reconstructive Surgery. 121 (6), 396e-403e (2008).
- Iyer, S. S., Rojas, M. Anti-inflammatory effects of mesenchymal stem cells: novel concept for future therapies. Expert Opinion on Biological Therapy. 8 (5), 569-581 (2008).
- Zhang, J., Middleton, K. K., Fu, F. H., Im, H. J., Wang, J. H. HGF mediates the anti-inflammatory effects of PRP on injured tendons. PLoS One. 8 (6), e67303 (2013).
- Li, N. Y., Yuan, R. T., Chen, T., Chen, L. Q., Jin, X. M. Effect of platelet-rich plasma and latissimus dorsi muscle flap on osteogenesis and vascularization of tissue-engineered bone in dogs. Journal of Oral and Maxillofacial Surgery. 67 (9), 1850-1858 (2009).
- Parsons, P., et al. The biological effect of platelet rich-plasma on the fracture healing process. The Journal of bone and joint surgery. British volume. 91-B, 293 (2009).
- Wu, W., Chen, F., Liu, Y., Ma, Q., Mao, T. Autologous injectable tissue-engineered cartilage by using platelet-rich plasma: experimental study in a rabbit model. Journal of Oral and Maxillofacial Surgery. 65 (10), 1951-1957 (2007).
- Cooper, T. W., Eisen, A. Z., Stricklin, G. P., Welgus, H. G. Platelet-derived collagenase inhibitor: characterization and subcellular localization. Proceedings of the National Academy of Sciences of the United States of America. 82 (9), 2779-2783 (1985).
- Uzuki, M., Sawai, T. A. A comparison of the affinity of sodium hyaluronate of various molecular weights for degenerated cartilage: a histochemical study using hyaluronic acid binding protein. International Congress Series. 1223, 279-284 (2001).
- Pagano, C., et al. Molecular and morphometric description of adipose tissue during weight changes: a quantitative tool for assessment of tissue texture. International Journal of Molecular Medicine. 14 (5), 897-902 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır