A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس مستويات الإجهاد البيوفيزيائي والنفسي بعد الزيارة إلى ثلاثة مواقع ذات مستويات مختلفة من الطبيعة
In This Article
Summary
الغرض من هذه الورقة هو تحديد التغيرات في مستويات الإجهاد بعد الزيارة إلى ثلاثة إعدادات مختلفة ووصف الأساليب المستخدمة في تحديد مستويات الإجهاد على أساس مقاييس الكورتيزول اللعابي، α-amylase، وتقرير ذاتي النفسي الصك.
Abstract
وقد تم ربط زيارة البيئات الطبيعية بالحد من الإجهاد النفسي. على الرغم من أن معظم البحوث المتعلقة بالإجهاد اعتمدت على أشكال التقرير الذاتي، فإن عددا متزايدا من الدراسات يتضمن الآن الهرمونات والمحفزات البيولوجية المتصلة بالإجهاد، مثل الكورتيزول وα-amylase، لقياس مستويات الإجهاد. يعرض هنا بروتوكول لدراسة الآثار على مستويات الإجهاد البيوفيزيائي والنفسي بعد زيارة إلى ثلاثة مواقع مختلفة مع مستويات مختلفة من الطبيعة. وتقاس مستويات الإجهاد النفسي البيوفيزيائية والمبلغ عنها ذاتيا فور دخول المواقع المختارة وقبل مغادرة الزوار للموقع مباشرة. باستخدام طريقة "سال لعابه"، يتكون المقياس البيوفيزيائي من عينات 1-2 مل من اللعاب التي تقدمها مواضيع الدراسة عند الدخول إلى واحد من ثلاثة مواقع الدراسة. كما هو منصوص عليه في الأدب الموجود، يتم جمع اللعاب في غضون 45 دقيقة من الإطار الزمني بعد نهاية مشاركة الزائر في الموقع. بعد جمع اللعاب، يتم تسمية العينات ونقلها إلى مختبر بيولوجي. الكورتيزول هو المتغير البيوفيزيائي للاهتمام في هذه الدراسة وتقاس باستخدام عملية ELISA مع قارئ لوحة TECAN. لقياس الإجهاد المبلغ عنه ذاتياً، فإن استبيان الإجهاد المتصور (PSQ)، الذي يبلغ عن مستويات القلق والتوتر والفرح والمطالب المتصورة. ويتم جمع البيانات في جميع المواقع الثلاثة في وقت متأخر من بعد الظهر وحتى وقت مبكر من المساء. وعند مقارنتها في جميع البيئات الثلاثة، فإن مستويات الإجهاد، التي تقاس بالعلامات البيولوجية والتقارير الذاتية على حد سواء، أقل بكثير بعد الزيارة إلى البيئة الأكثر طبيعية.
Introduction
وقد تم ربط مستويات الإجهاد المرتفعة منذ فترة طويلة إلى العديد منالظروف الصحية الخطيرة مثل أمراض القلب والسمنة والاضطرابات النفسية 1،2،3. وتشير مجموعة متزايدة من البحوث إلى أن القرب من البيئات الطبيعية أو زيارتها إلى البيئات الطبيعية مثل الحديقة والمناظر الطبيعية غير المتقدمة يمكن أن يكون لها تأثير ملحوظ على الرفاه النفسي وانخفاض مستويات الإجهاد1،4، 5،6،7،8،9،10. وقد شملت تفسيرات لآثار البيئات الطبيعية ومستويات الإجهاد ما يلي: (1) البيئات الطبيعية توفر أماكن للنشاط البدني8و11 و (2) زوار البيئات الطبيعية لديهم القدرة على التركيز على المزيد من العمليات الفكر غير المهمة، مما يؤدي إلى انخفاض في التعب الانتباه12. لتحديد آثار الطبيعة على الحد من الإجهاد، وتستخدم هذه الدراسة تقرير ذاتي من الإجهاد النفسي (PSQ) واثنين من المؤشرات الحيوية القائمة على اللعاب، الكورتيزول وα-amylase، بعد زيارة إلى ثلاثة مواقع ترفيهية مختلفة. وتختلف هذه المواقع بين مستويات "الطبيعة" وتشمل بيئة من نوع البرية، وحديقة البلدية، ومرافق اللياقة البدنية والترفيه المحلية.
تهدف هذه الدراسة إلى معالجة الأسئلةالبحثية التالية: (RQ 1) هل هناك اختلافات في مستويات الإجهاد البيوفيزيائي تقاس بالكورتيزول اللعابي وα-amylase عند مقارنتها عبر جميع المواقع الثلاثة (أي الطبيعية، شبه الطبيعية، بنيت)؟ (RQ2) هل هناك اختلافات في مستويات الإجهاد النفسي تقاس بـ PSQ (تتجلى في أربعة منشآت: المطالب، والمخاوف، والتوتر، والفرح) عند مقارنتها عبر جميع المواقع الثلاثة (أي الطبيعية، شبه الطبيعية، التي بنيت)؟
Protocol
وتتبع هذه الدراسة السياسات والمبادئ التوجيهية لبرنامج حماية البحوث البشرية التابع لمجلس الاستعراض المؤسسي لجامعة إنديانا.
1. اختيار الموقع
- حدد عدد المواقع (n) استنادًا إلى مستويات مختلفة من الطبيعة.
ملاحظة: اخترنا ثلاثة مواقع لعملنا. وباستخدام سلسلة متصلة تستند إلى مستويات "الطبيعة"، اعتُبر الموقع ألف الأكثر طبيعية ويتألف من حوالي 200 1 فدان من التلال المشجرة المتاخمة لبحيرة ويقع داخل غابة نفضية. وتشمل الأنشطة الأكثر شيوعا المشي ومشاهدة الحياة البرية. كان الموقع B حديقة بلدية بمساحة 33 فدانًا تضم مسارات للمشي وأماكن للتجمعات وملاعب ومساحة ميدانية مفتوحة للأنشطة الترفيهية السببية. وكان الموقع جيم مرفقاً حضرياً داخلياً لممارسة التمارين الرياضية مع أدنى مستوى من الطبيعة. والمواقع الثلاثة جميعها قريبة نسبيا من مدينة متوسطة الحجم (يقدر عدد سكانها بـ 000 46 نسمة) في وسط غرب الولايات المتحدة.
2- فرز المشاركين وإعدادهم
- استكمال توظيف المشاركين قبل مشاركة الأشخاص في التجارب الترفيهية.
ملاحظة: بالنسبة للمواقع A و B، اقترب الباحث من المواضيع في موقف السيارات من مدخل الحديقة. وبالنسبة للموقع جيم، تم الاتصال بالمواضيع في مكتب الاستقبال في مرفق التمارين الداخلية. وللتحكم في الاختلافات في نوع النشاط، كانت المواضيع التي تم تعيينها لكل من الموقعين ألف وباء تتنزه في الغالب، في حين أن النشاط الأساسي بالنسبة للموقع جيم كان يعمل أو يسير على المسار الداخلي. - أثناء التوظيف، تذكير المواضيع للامتثال للمبادئ التوجيهية المتعلقة بجمع عينات الكورتيزول اللعابي. يجب أن لا تأكل أو تشرب 10 دقائق قبل تقديم عينات اللعاب.
ملاحظة: تجدر الإشارة إلى أنه في هذه الحالة، لم يتم تطبيع عينات اللعاب لحجم أو تخفيف (تركيز) - أي ما إذا كان المشاركون رطبين بشكل كاف و/أو لم تغير الترطيب بين مجموعات العينات. - إعطاء أربطة الذراع الحمراء (أو ما يعادلها من الملابس الملحوظة) لكل مشارك للسماح بتحديد الهوية بسهولة عند الظهور في نهاية ارتباطاتهم.
- تعيين تخصيص وقت 30-40 دقيقة بحيث تنفق جميع المواضيع عبر المواقع الثلاثة قدرا مماثلا من الوقت في كل موقع. استبعاد الأشخاص الذين يقضون وقتًا أطول أو أقل بكثير من باقي العينة.
- الحفاظ على نوع النشاط المتناسق.
ملاحظة: في هذه الحالة، كان النشاط "المتوسط" المشي أو المشي لمسافات طويلة. واستُبعدت من العينة الأشخاص الذين شاركوا في أنشطة تختلف اختلافاً كبيراً عن المشي أو المشي لمسافات طويلة. على سبيل المثال، لم يتم تضمين الأشخاص الذين كانوا يصطادون، أو تنزهم، أو رفع الأثقال في العينات المعنية.
3. الظروف والتصميم التجريبي
- استخدام تصميم شبه تجريبي قبل الاختبار/ما بعد الاختبار.
- بعد تحديد المواضيع وعند موافقتها على المشاركة، اطلب من كل موضوع قراءة وتوقيع استمارة IRB تشرح الطبيعة الطوعية للدراسة والغرض منها وإجراءاتها.
- بعد هذه العملية، إعطاء المواضيع قطعة من الملابس (على سبيل المثال، حزام الذراع الأحمر) لتحديد في المستقبل والحصول على التدابير الفسيولوجية والنفسية لمستويات الإجهاد (أي PSQ، 1-2 مل من اللعاب الذي يبصق أو سالل بالله في أنبوب اختبار). جمع عينات من وقت متأخر من بعد الظهر إلى وقت مبكر من المساء.
ملاحظة: تم جمع هذه البيانات من قبل الباحثين على حد سواء 1) قبل دخول المواضيع إلى الموقع و 2) مباشرة عند إنهاء زيارة الموقع.
4. عينات اللعاب
- لتجنب تخفيف العينة، اطلب من الأشخاص عدم تناول الطعام أو الشراب أو شطف الأفواه 10 دقائق قبل تقديم عينات اللعاب.
- اطلب من الأشخاص توفير عينات لعاب 1-2 مل (باستثناء الرغوة) قبل التجربة الترفيهية مباشرة وبعد الانتهاء من التجربة مباشرة.
- جمع عينات اللعاب باستخدام طريقة سال لعابه السلبي:
- توفير المواضيع مع 2 في البلاستيك شرب القش لشال لعابه في 2 مل cryovial (انظر جدولالمواد).
- إرشاد المواضيع للسماح للعاب لتجميع في أفواههم، ثم سال لعابه أسفل القش وإلى التبريد. وفقا لجمع اللعاب والمشورة مناولة (2011)، 1 مل (باستثناء رغوة) كافية لمعظم الاختبارات.
- عينات من الملصقات مع رقم معرّف مكون من 3 أرقام (أي 001) وحرف يشير إلى توقيت جمع البيانات (أي يمثل A الاختبار المسبق، يمثل B ما بعد الاختبار؛ حيث يمثل 001A عينة اللعاب التي يقدمها المشارك 001 قبل إجراء الاختبار تجربة ترفيهية).
- بعد جمع العينة ووصفت, ثم ينبغي تخزينها المجمدة مؤقتاً في مربع رغوة الستيرويد الكامل من الجليد الجاف لمدة لا تزيد عن 2 ح.
- نقل العينات التي تحمل علامة إلى مختبر وتخزينها في -80 درجة مئوية حتى تحليلها.
5. القياس الكمي α-amylase
ملاحظة: في هذا التبّع، فإن α-amylase hydrolyzes 2-chloro-p-nitrophenyl-α-D-maltotrioside to 2-chloro-nitrophenol وأشكال الجلوكوز، 2-كلورو-ف-نيتروفينل-α-D-مالتوزيد، مالتوتريو، الجلوكوز. يتم رصد رد الفعل عند امتصاص 405 نانومتر، والذي يتوافق مع نشاط α-amylase في العينة. يوضح هذا التبّاق الخطيّة بين 0 و2000 U/L.
-
المواد
- استخدام مجموعة كاشف الأييليز السائل (انظر جدولالمواد) لتحديد كمية α-amylase في عينات اللعاب. يتم توفير جميع الكواشف كسوائل جاهزة للاستخدام وتخزينها عند درجة حرارة تمنأى عند درجة حرارة تمنة.
- استخدام قارئ متعدد الوضع (انظر جدولالمواد) قادرة على قراءة كثافة بصرية في 405 نانومتر مع درجة حرارة تسيطر عليها إلى 37 درجة مئوية أثناء الفحص.
-
تحليل
- إذابة العينات على الجليد قبل التحليل.
- تمييع العينات 1:10 مع 1X PBS (10 ميكرولتر من اللعاب + 90 ميكرولتر من PBS).
- تحليل كل عينة في مكررة.
- معادلة كاشف المعمي إلى 20-25 درجة مئوية لمدة 30 دقيقة على الأقل.
- إضافة 0.1 مل من كاشف أميليز إلى لوحة صغيرة 96 جيدا لكل عينة.
- قبل احتضان ميكروبليت في 37 درجة مئوية لمدة لا تقل عن 5 دقائق.
- إضافة 2.5 ميكرولتر من العينة إلى كاشف الأناليس.
- خذ قراءة أولية بعد 60 s.
- مواصلة القراءات كل 60 ق لمدة 2 دقيقة إضافية.
- حساب متوسط الفرق امتصاص في الدقيقة الواحدة(ΔAbs /دقيقة).
-
حساب
- لحساب نشاط الأناليز، استخدم الصيغة التالية:

حيث ΔAbs/min = التغيرات في الفرق الامتصاص في الدقيقة الواحدة؛ TV = إجمالي حجم التقييم (0.1025 مل)؛ * 1000 = تحويل U / مل إلى U / L؛ MMA = امتصاص المليمول من 2-الكلورو-ف-نيتروفينول = 12.9؛ SV = حجم العينة (0.0025 مل)؛ وLP = مسار الضوء (1 سم). استبدال يعطي:
لذلك، اضرب ΔAbs/min بمقدار 3178x عامل التخفيف (10) للحصول على amylase في U/L. - بالنسبة للعينات التي تزيد عن 2000 U/L (خطية الفحص) تضعف أكثر (على الأقل 2x باستخدام PBS) وإعادة التبيّن، ثم اضرب نتيجة α-amylase بعامل التخفيف الإضافي.
- لحساب نشاط الأناليز، استخدم الصيغة التالية:
6. القياس الكمي للكورتيزون
ملاحظة: في هذا الاختبار، يتم قياس الكورتيزول المجاني في اللعاب باستخدام منحنى قياسي الكورتيزول. يتم إضافة المعايير والعينات المخففة إلى لوحة ميكروتيدر التي هي مغلفة مسبقا مع الأجسام المضادة. يتم إضافة متقارن الكورتيزول بيروكسيداز إلى الآبار، تليها إضافة جسم مضاد أحادي النسيلة إلى الكورتيزول. كمية الكورتيزول / بيروكسيداز ربط المتقارن يقلل مع زيادة تركيز الكورتيزول في العينة.
-
المواد
- استخدم مجموعة مناعية إنزيم الكورتيزول (انظر جدولالمواد) لتحديد كمية الكورتيزول في عينات اللعاب. يتم تضمين جميع الكواشف اللازمة لإجراء هذا التوكيلات. يتم تخزين كافة مكونات المجموعة عند درجة حرارة 0-4 درجة مئوية قبل الوصول إلى تاريخ انتهاء الصلاحية.
- استخدام مقياس الطيف الضوئي قادرة على قراءة كثافة بصرية (OD) في 450 نانومتر (انظر جدولالمواد)، فضلا عن البرمجيات القادرة على استخدام تسجيلات OD من قارئ لوحة لأداء أربعة معلمة منحنى اللوجستية (4 PLC) المناسب.
-
إعداد الكاشف
- السماح لجميع الكواشف لequilibrate إلى 20-25 درجة مئوية لمدة لا تقل عن 30 دقيقة.
- تخفيف العازلة تسرب الكورتيزول 1:5 باستخدام الماء منزوع الأيونات.
- تمييع العازلة غسل 1:20 باستخدام الماء منزوع الأيونات.
ملاحظة: المخازن المؤقتة للتخزين والتخزين المؤقت للغسيل مستقرة لمدة 3 أشهر عند تخزينها عند 0-4 درجة مئوية.
-
إعداد العينات
- إذابة العينات على الجليد قبل التحليل.
- تمييع العينات 1:10 مع عازل اختبار الكورتيزول (20 ميكرولتر من اللعاب + 180 ميكرولتر من المخزن المؤقت) واستخدامها في غضون 2 ساعة من التحضير.
-
إعداد المعايير
- تسمية أنابيب اختبار الزجاج #1 #7.
- Pipet 225 μL من مخزن العازلة في أنبوب #1 و 125 ميكرولتر من العازلة في أنابيب #2 #7.
- إضافة 25 درجة مئوية من محلول مخزون الكورتيزول إلى أنبوب #1 ودوامة.
- إزالة 125 درجة مئوية من العازلة من أنبوب #1 وإضافته إلى أنبوب #2، ثم دوامة.
- كرر التخفيفات التسلسلية للأنابيب #3 #7.
ملاحظة: ترد تركيزات الكورتيزول النهائية لكل معيار في الجدول 1. - يجب استخدام المعايير في غضون 2 ساعة من الإعداد.
| القياسيه | #1 | #2 | #3 | #4 | #5 | #6 | #7 |
| حجم المخزن المؤقت للتخزين (ميكرولتر) | 225 | 125 | 125 | 125 | 125 | 125 | 125 |
| الاضافه الي ذلك | مؤشر ستوك ستد | #1 | #2 | #3 | #4 | #5 | #6 |
| حجم الإضافة (μL) | 25 | 125 | 125 | 125 | 125 | 125 | 125 |
| التركيز النهائي (pg/mL) | 3200 | 1600 | 800 | 400 | 200 | 100 | 50 |
الجدول 1: جدول إعداد المنحنى القياسي.
-
تحليل
- استخدم تخطيط اللوحة أدناه في الشكل 1 كدليل لإعداد اللوحة الدقيقة.
- من المستحسن استخدام ماصة متعددة القنوات لإضافة الكواشف.
- إضافة 50 درجة مئوية من العينات أو المعايير في العدد المناسب من الآبار في لوحة. يجب تشغيل العينات والمعايير في تكرار.
- إضافة مخزن مؤقت للتخزين (75 درجة مئوية) إلى آبار الربط غير المحددة (NSB).
- إضافة مخزن العازلة للتدقيق (50 درجة مئوية) في آبار الربط القصوى (B0) والآبار القياسية الصفرية (الفارغة).
- إضافة 25 درجة مئوية من متقارن الكورتيزول إلى كل بئر.
- إضافة 25 درجة مئوية من الأجسام المضادة الكورتيزول إلى كل بئر، باستثناء الآبار NSB.
- اضغط برفق على جانب اللوحة لخلط الكواشف.
- يُغطّى بالسدادة المطليّة ويُرجّ في درجة حرارة الغرفة (RT) عند درجة حرارة 20-25 درجة مئوية لمدّة ساعة واحدة.
- إزالة محتويات البئر وشطف كل بئر 4X مع العازلة غسل (300 ميكرولتر). اضغط على لوحة لتجف على المناشف ماصة بين الشهي.
- إضافة الركيزة TMB إلى كل بئر (100 درجة مئوية).
- احتضان لوحة في 20-25 درجة مئوية لمدة 30 دقيقة دون هز.
- إضافة وقف الحل لكل بئر (50 درجة مئوية).
- قراءة الكثافة البصرية في كل بئر من ميكروبليت في 450 نانومتر.
- متوسط الكثافات البصرية لكل معيار، ثم عينة وطرح متوسط الكثافة البصرية لآبار NSB.
- حساب النسبة المئوية المنضمة (B/B0) لكافة العينات باستخدام عناصر تحكم الربط القصوى (B0).
- إنشاء منحنى قياسي باستخدام برنامج قادر على تركيب منحنى الانحدار اللوجستي بأربع معلمات، محسوبمن منحنى %B/B0.
- مضاعفة النتيجة بعامل التخفيف (10) للحصول على قيم الكورتيزول في pg/mL.
- وينبغي زيادة تخفيف العينات ذات الكثافات البصرية التي تقع فوق أعلى مستوى مع مخزن الفحص المؤقت وإعادة الفحص، ثم ينبغي أن تتضاعف النتيجة بعامل التخفيف الإضافي.
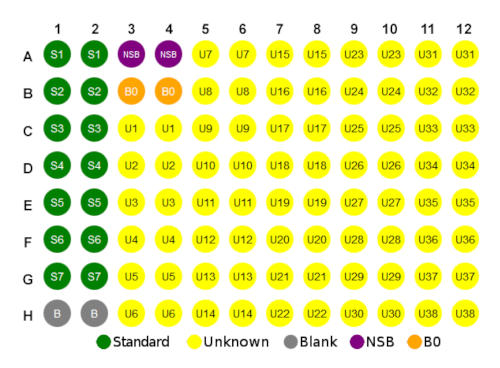
الشكل 1 مثال تخطيط اللوحة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
7. القياس النفسي (استبيان الإجهاد المتصور)
- قياس المستويات النفسية للمواضيع باستخدام PSQ التي نشرتها Fliege وآخرون13، والتي تشمل أربعة عوامل (القلق، والتوتر، والتوتر، والفرح) ويستخدم 20 البنود.
- اطلب من الموضوع ملء PSQ قبل تجربتهم الترفيهية مباشرة وبعد الانتهاء من التجربة مباشرة.
- استبيانات الوسم مع رقم معرف مكون من 3 أرقام مطابق لمستوى الإجهاد الفسيولوجي الحيوي لكل موضوع.
النتائج
وصف العينة
وباستخدام تقنية أخذ عينات من الحصص، وظفت هذه الدراسة 35 زائرا من كل موقع من المواقع الثلاثة. وإجمالا، تم تعيين 105 مواضيع في هذه الدراسة، من بينهم 63 من الذكور و 42 من الإناث. وبلغ متوسط أعمار الزوار المعينين من ثلاثة مواقع مختلفة 25.9 سنة (الموقع ألف)، و 37.2 سنة (الموقع باء)، و ...
Discussion
والهدف من هذه الدراسة هو تحديد التغيرات المحتملة في الإجهاد باستخدام الأدوات البيوفيزيائية والنفسية بعد الزيارة الترفيهية إلى ثلاثة أماكن مختلفة مع مستويات مختلفة من الطبيعة. وقد ثبت كل من الكورتيزول وα-amylase لتكون مؤشرات موثوق بها لمستويات الإجهاد النفسي. وقد تم تكييف إجراء دراسة الأنال...
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم تمويل هذه الدراسة جزئيا من خلال برنامج منحة أبحاث الكلية (FRGP) برعاية من خلال كلية الصحة العامة في جامعة إنديانا، بلومينغتون، IN. ويود صاحبا البلاغ أن يشكرا الدكتورة أليسون فويت وميليسا بيج على مساعدتهما التحريرية وتعليقاتهما البناءة.
Materials
| Name | Company | Catalog Number | Comments |
| Cortisol Enzyme Immunoassay Kit | DetectX | K003-H1 | The Cortisol Enzyme Immunoassay kit is designed to quantitatively measure cortisol present in dried fecal extracts, saliva, urine, serum, plasma and culture media samples. |
| Cryogenic Labels for Cryogenic Storage | Fisherbrand | 5-910-A | Unique adhesive withstands extreme temperature |
| Liquid Amylase (CNPG3) Reagent Set | Pointe Scientific | A7564 | For the quantitative kinetic determination of α-amylase activity in human serum. |
| Round Bottom 2mL Polypropylene Tubes with External Thread Cap | Greiner Bio-One | 07-000-257 | 2.0 ml U-BTM Cryo.s self standing polypropylene sterilized |
| Synergy Multi-Mode Microplate Reader | BioTek | It is a single-channel absorbance, fluorescence, and luminescence microplate reader that uses a dual-optics design to perform measurements of samples in a microplate format. |
References
- Hansmann, R., Hug, S., Seeland, K. Restoration and stress relief through physical activities in forests and parks. Urban Forestry and Urban Greening. 6, 213-225 (2007).
- Krantz, D. S., McCeney, M. K. Effects of psychological and social factors on organic disease: A critical assessment of research on coronary heart disease. Annual Review of Psychology. 53, 341-369 (2002).
- Ward Thompson, C., et al. More green space is linked to less stress in deprived communities: Evidence from salivary cortisol patterns. Landscape and Urban Planning. 105, 221-229 (2012).
- Haluza, D., Schonbauer, R., Cervinka, R. Green perspectives for public health: A narrative on the physiological effects of experiencing outdoor nature. International Journal of Environmental Research and Public Health. 11, 5445-5461 (2014).
- Korpela, K. M., Ylen, M., Tyrväinen, L., Silvennomen, H. Determinants of restorative experiences in everyday favorite places. Health and Place. 14, 636-652 (2008).
- Mantler, A., Logan, A. C. Natural environments and mental health. Advances in Integrative Medicine. 2, 5-12 (2015).
- Mayer, F. S., McPherson-Frantz, C., Bruehlman-Senecal, E., Dolliver, K. Why is nature beneficial? the role of connectedness to nature. Environment and Behavior. 41, 307-643 (2009).
- Pretty, J., Peacock, J., Sellens, M., Griffin, M. The mental and physical health outcomes of green exercise. International Journal of Environal Health Research. 15, 319-337 (2005).
- Ulrich, R., et al. Stress recovery during exposure to natural and urban environments. Journal of Environmental Psychology. 11, 201-230 (1991).
- Kaplan, S., Talbot, J. F., Altman, I., Wohlwill, J. F. Psychological Benefits of a Wilderness Experience. Behavior and the Natural Environment. , 163-203 (1983).
- Salmon, P. Effects of physical exercise on anxiety, depression, and sensitivity to stress: A unifying theory. Clinical Psychology Review. 21, 33-61 (2001).
- Focht, B. C. Brief walks in outdoor and laboratory environments: Effects on affective responses, enjoyment, and intentions to walk for exercise. Research Quarterly for Exercise and Sport. 80, 611-620 (2009).
- Fliege, H., et al. The Perceived Stress Questionnaire (PSQ) reconsidered: Validation and reference values from different clinical and healthy adult samples. Psychosomatic Medicine. 67, 78-88 (2005).
- Kirschbaum, C., Hellhammer, D. H. Salivary cortisol in psychoneuronendocrine research: Recent developments and applications. Psychoneuroendocrinology. 19, 313-333 (1994).
- Gallacher, D. V., Petersen, O. H. Stimulus-secretion coupling in mammalian salivary glands. International Reviews in Physiology. 28, 1-52 (1983).
- Slosnik, R. T., Chatterton, R. T., Swisher, T., Par, S. Modulation of attentional inhibition by norepinephrine and cortisol after psychological stress. International Journal of Psychophysiology. 36, 59-68 (2000).
- Nater, U. M., et al. Stress-induced changes in human salivary alpha-amylase activity-associations with adrenergic activity. Psychoneuroendocrinology. 31 (1), 49-58 (2006).
- Takai, N., et al. Effect of psychological stress on the salivary cortisol and amylase levels in healthy young adults. Archives of Oral Biology. 49 (12), 963-968 (2004).
- Shirtcliff, E. A., Granger, D. A., Schwatz, E., Curran, M. J. Use of salivary biomarkers in biobehavioral research: Cotton based sample collection methods can interfere with salivary immunoassay results. Psychoneuroendocrinology. 26, 165-173 (2001).
- Nater, U. M., et al. Human salivary alpha-amylase reactivity in a psychosocial stress paradigm. Journal of Psychophysiology. 55 (3), 333-342 (2005).
- Granger, D. A., et al. Integration of salivary biomarkers into developmental and behaviorally-oriented research: Problems and solutions for collecting specimens. Physiology and Behavior. 92, 583-590 (2007).
- Frumkin, H. Beyond toxicity: Human health and the natural environment. American Journal of Preventive Medicine. 20, 234-240 (2001).
- Hartig, T., Mitchell, R., de Vries, S., Frumkin, H. Nature and health. Annual Review of Public Health. 35, 207-228 (2014).
- Gidlow, C. J., et al. Where to put your best foot forward: Psycho-physiological responses to walking in natural and urban environments. Journal of Environmental Psychology. 45, 22-29 (2016).
- Ewert, A., Chang, Y. Levels of nature and stress response. Behavioral Sciences. 8 (5), 49 (2018).
- Wyles, K. J., et al. Are some natural environments more psychologically beneficial than others? The importance of type and quality on connectedness to nature and psychological restoration. Environment and Behavior. 51 (2), 111-143 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved