このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
自然の異なる3箇所への訪問後の生物物理学的および心理的ストレスレベルの測定
要約
本論文の目的は、3つの異なる設定に訪問した後のストレスレベルの変化を特定し、唾液コルチゾール、α-アミラーゼ、および心理的自己報告の尺度に基づいてストレスレベルを識別するために使用される方法を説明することです。楽器。
要約
自然環境への訪問は、心理的ストレスの軽減にリンクされています。ほとんどのストレス関連研究は自己報告形式に依存していますが、現在では、コルチゾールやα-アミラーゼなどの生物学的ストレス関連ホルモンや触媒を組み込んでストレスのレベルを測定する研究が増えています。ここでは、自然の異なるレベルを持つ3つの異なる場所への訪問後の生物物理学的および心理的ストレスのレベルに及ぼす影響を調べるプロトコルです。生物物理学的および自己申告された心理的ストレスレベルは、選択した場所に入るとすぐに、訪問者がサイトを離れる直前に測定されます。「ドール」法を用いて、生物物理学的尺度は、3つの研究場所のいずれかに入る際に被験者が提供する唾液の1〜2mLサンプルから成る。外来文献によって規定されているように、唾液は場所での訪問者の婚約の終了後45分の時間枠内に収集されます。唾液採取に続いて、サンプルは標識され、生物学的研究室に運ばれる。コルチゾールは、この研究で関心のある生物物理学的変数であり、TECANプレートリーダーを用いてELISAプロセスを用いて測定される。自己申告されたストレスを測定するために、不安、緊張、喜び、知覚された要求のレベルを報告する知覚ストレスアンケート(PSQ)。データは、午後遅くから夕方にかけて、3つのサイトすべてで収集されます。3つの設定すべてで比較すると、生物学的マーカーと自己報告の両方で測定される応力レベルは、最も自然な設定に訪問した後に有意に低くなります。
概要
高いストレスレベルは、長い心臓病、肥満、および心理的障害1、2、3などの多くの深刻な健康状態にリンクされています。研究の成長のボディは、公園や未発達の風景などの自然の設定への近接または訪問は、心理的な幸福とストレスのレベルの低下に顕著な影響を持つことができることを示唆しています 1,4, 5,6,7,8,9,10.自然環境とストレスレベルの影響についての説明は、以下を含んでいます:(1)自然の設定は、身体活動のための会場を提供します 8,11と (2) 自然環境への訪問者は、焦点を当てる能力を持っていますより多くの非タスク思考プロセス上で、それによって注意疲労の減少につながる12.ストレス軽減に対する自然の影響を決定するために、本研究では、3つの異なるレクリエーション施設を訪問した後、心理的ストレス(PSQ)と2つの唾液ベースのバイオマーカー、コルチゾールおよびα-アミラーゼの自己報告を利用する。これらの場所は「自然」のレベルによって異なり、荒野型の設定、市立公園、地元のフィットネスやレクリエーション施設が含まれます。
本研究は、(RQ1)唾液コルチゾールとαアミラーゼによって測定された生物物理学的ストレスのレベルに違いはありますか(すなわち、自然、半自然、構築された)。(RQ2)3つのサイト(自然、半自然、構築)で比較すると、PSQ(需要、心配、緊張、喜びの4つの構成要素によって明らかにされる)によって測定される心理的ストレスのレベルに違いがありますか?
プロトコル
本研究は、インディアナ大学機関審査委員会の人間研究保護プログラムの方針とガイドラインに従う。
1. 場所の選択
- 異なるレベルの自然に基づいてサイト数 (n) を選択します。
注:私たちは、私たちの仕事のために3つのサイトを選択しました。「自然」のレベルに基づいて連続体を使用して、サイトAは最も自然と考えられ、湖に隣接し、落葉樹林内に設定された森林の約1,200エーカーの森林尾根で構成されています。最も一般的な活動には、ウォーキングや野生動物の見守りが含まれます。サイトBは、ウォーキングパス、集まりのための場所、遊び場、因果レクリエーション活動のためのオープンフィールドスペースを備えた33エーカーの市立公園でした。サイトCは、自然度が最も低い都市型の屋内運動施設でした。3 つのサイトはすべて、米国中西部の中規模都市 (推定人口 46,000 人) に比較的近接しています。
2. 参加者の選考と準備
- 被験者がレクリエーション体験を行う前に、参加者の募集を完了します。
注:サイトAとBの場合、被験者は公園入り口の駐車場で研究者からアプローチを受けました。サイトCでは、屋内運動施設のフロントで被験者に接近しました。活動タイプの違いを制御するために、サイトAとBの両方で募集された被験者は主にハイキングでしたが、サイトCでは主な活動が屋内トラックを走ったり歩いたりしていました。 - 募集の間、唾液コルチゾールサンプルの収集に関するガイドラインに従うことを被験者に思い出させる。唾液サンプルを提供する前に10分を食べたり飲んだりしてはいけません。
注:この場合、唾液サンプルは体積または希釈(濃度)のために正規化されなかった、すなわち、参加者が適切に水和されたか、またはサンプルコレクション間の水分補給変化を行ったかどうかに留意すべきである。 - 各参加者に赤い腕章(または同等の目立つ衣服)を与え、婚約の最後に出現したときに簡単に識別できるようにします。
- 3 つのサイトにまたがるすべてのサブジェクトが各サイトで同様の時間を費やすように、30 ~ 40 分の時間の割り当てを割り当てます。サンプルの残りの部分よりも実質的に多くのまたは少ない時間を費やす被験者を除外します。
- 活動の種類を一貫性を保ちます。
注:この場合、「中」の活動はウォーキングまたはハイキングでした。ウォーキングやハイキングとは大きく異なる活動に従事した被験者は、サンプルから除外された。例えば、釣り、ピクニック、または重量挙げを行った被験者は、それぞれのサンプルに含まれていませんでした。
3. 条件と実験設計
- 準実験的な事前テスト/テスト後の設計を使用します。
- 被験者を特定し、参加することに同意した後、各被験者に、研究の自発的な性質、目的、手続きを説明するIRBフォームを読み、署名してもらいます。
- このプロセスに続いて、被験者に衣類(例えば、赤い腕章)を与え、ストレスレベルの生理学的および心理的尺度(すなわち、PSQ、試験管に唾液を吐き出すか、または垂れ下がった唾液の1-2 mL)を得る。午後遅くから夕方にかけてサンプルを収集します。
注:これらのデータは、被験者がサイトに入る直前の1)と2)サイトへの訪問を終了した直後に、両方の研究者によって収集されました。
4. 唾液サンプル
- サンプル希釈を避けるため、唾液サンプルを提供する前に、被験者に食べたり、飲んだり、口をすすいでいたりしないように頼みます。
- レクリエーション体験の直前と経験の終了直後に1-2 mL唾液サンプル(泡を除く)を提供するように被験者に依頼してください。
- パッシブドール法を用いて唾液サンプルを収集します。
- 被験者に2 mLの凍結物に垂れ下がるためにプラスチック製の飲みわらで2を与える(材料の表を参照)。
- 唾液を口の中に溜め込み、わらを下ろして凍結に入れるように被験者に指示する。唾液の収集および取り扱いのアドバイス(2011)によると、1 mL(泡を除く)はほとんどのテストのために十分です。
- データ収集のタイミングを示す3桁のID番号(すなわち、001)と文字を持つラベルサンプル(すなわち、Aは事前検定を表し、Bはポストテストを表し、001Aは参加者001が提供する唾液サンプルを表す。レクリエーション体験)。
- サンプルが収集され、ラベル付けされた後、それは2時間以下のドライアイスの完全なステロイド発泡ボックスに一時的に凍結保存する必要があります。
- マークされたサンプルを実験室に輸送し、分析されるまで-80 °Cで保存します。
5. αアミラーゼの定量
注:このアッセイでは、α-アミラーゼは2-クロロ-p-ニトロフェニル-α-D-マルトトリオシドを2-クロロニトロフェノールに加水分解し、グルコース、2-クロロ-p-ニトロフェニル-α-D-マルトサイド、マルトトリオス、およびグルコースを形成する。反応は405nmの吸光度で監視され、これは試料中のα-アミラーゼ活性に相当する。このアッセイは、0~ 2000 U/L の直線性を示します。
-
材料
- 液体アミラーゼ試薬セット(材料表参照)を使用して、唾液サンプル中のα-アミラーゼを定量化した。すべての試薬はすぐに使用される液体として提供され、0-4 °Cで貯えられる。
- アッセイ中に37°Cに制御された温度で405nmの光学密度を読み取ることができるマルチモードリーダー(材料の表を参照)を使用してください。
-
分析
- 分析の前に氷の上でサンプルを解凍します。
- 希釈サンプル 1:10 1x PBS (唾液の 10 μL + 90 μL の PBS)
- 各サンプルを重複して分析します。
- アミラーゼ試薬を少なくとも30分間20~25°Cに平衡化します。
- 各サンプルの96ウェルマイクロプレートにアミラーゼ試薬の0.1 mLを追加します。
- マイクロプレートを37°Cで5分以上事前インキュベートします。
- アミラーゼ試薬に2.5 μLのサンプルを追加します。
- 60以降の最初の読み取りを取ります。
- さらに2分間、60度ごとに読み続けます。
- 1 分あたりの平均吸光度差(ΔAbs/min) を計算します。
-
計算
- アミラーゼ活性を計算するには、次の式を使用します。

ΔAbs/min = 1 分あたりの吸光度差の変化。テレビ= 総アッセイ容積 (0.1025 mL);*1000 = U/mL から U/L への変換;MMA = 2-クロロ-p-ニトロフェノールのミリモル吸収性 = 12.9;SV = サンプル容積 (0.0025 mL);LP = ライトパス (1 cm) を使用します。置換は次のとおりです。
したがって、ΔAbs/minに希釈係数(10)を3178倍で乗算し、U/Lでアミラーゼを得る。 - 2000 U/L(アッセイ線形性)を超えるサンプルの場合、さらに(PBSを使用して少なくとも2倍)希釈し、再アッセイを行い、その結果に追加の希釈係数を乗算します。
- アミラーゼ活性を計算するには、次の式を使用します。
6. コルチゾールの定量
注:このアッセイでは、フリーコルチゾールは、コルチゾール標準曲線を用いて唾液中で定量される。標準および希釈されたサンプルは抗体と前もってコーティングされるマイクロチター版に加される。コルチゾール-ペルオキシダーゼコンジュゲートをウェルに添加し、続いてコルチゾールにモノクローナル抗体を添加する。サンプル中のコルチゾールの濃度が増加するにつれて、コルチゾール/ペルオキシダーゼコンジュゲート結合の量が減少します。
-
材料
- コルチゾール酵素免疫アッセイキット(材料の表を参照)を使用して、唾液サンプル中のコルチゾールを定量します。このアッセイを実行するために必要なすべての試薬は、キットに含まれています。キットのすべてのコンポーネントは、有効期限に達する前に0〜4 °Cで保存されます。
- 450 nmの光学密度(OD)を読み取ることができる分光光光度計(材料の表を参照)、プレートリーダーからのOD記録を使用して4パラメータロジスティックカーブ(4 PLC)継手を実行できるソフトウェアを使用します。
-
試薬の調製
- すべての試薬を20~25°Cまで30分以上平衡化します。
- 脱イオン水を用いてコルチゾールアッセイバッファー1:5を希釈する。
- 脱イオン水を使用して洗浄バッファー1:20を希釈します。
注:アッセイと洗浄バッファーは、0~4°Cで保存した場合、3ヶ月間安定しています。
-
サンプル調製
- 分析の前に氷の上でサンプルを解凍します。
- 希釈試料1:10をコルチゾールアッセイバッファー(唾液20μL+180μLバッファー)で希釈し、調製の2時間以内に使用する。
-
標準の準備
- ラベルガラス試験管#1#7。
- チューブ#1にアッセイバッファーのピペ225 μLとチューブに125 μLのバッファー#2#7。
- コルチゾールストック溶液の25 μLをチューブ#1および渦に加えます。
- チューブ#1から125μLのバッファーを取り出し、チューブ#2に加え、渦を加えます。
- チューブ#3#7のシリアル希釈を繰り返します。
注:各規格の最終的なコルチゾール濃度を表1に示す。 - 規格は、準備の2時間以内に使用する必要があります。
| 標準 | #1 | #2 | #3 | #4 | #5 | #6 | #7 |
| アッセイバッファボリューム(μL) | 225名 | 125名 | 125名 | 125名 | 125名 | 125名 | 125名 |
| また | ストックストッド | #1 | #2 | #3 | #4 | #5 | #6 |
| 加算量(μL) | 25名 | 125名 | 125名 | 125名 | 125名 | 125名 | 125名 |
| 最終濃度 (pg/mL) | 3200の | 1600年 | 800の | 400人 | 200年 | 100人 | 50歳 |
表 1: 標準曲線準備表。
-
分析
- マイクロプレートを設定するためのガイドとして、図1の下のプレートレイアウトを使用します。
- 試薬の添加にはマルチチャンネルピペットを使用することをお勧めします。
- プレート内の適切な数のウェルに50 μLのサンプルまたは規格を追加します。サンプルと標準は重複して実行する必要があります。
- 非特異的結合(NSB)ウェルにアッセイバッファ(75 μL)を追加します。
- 最大結合(B0)ウェルとゼロ標準(ブランク)ウェルにアッセイバッファ(50 μL)を追加します。
- 各ウェルにコルチゾールコンジュゲートの25 μLを追加します。
- NSBウェルを除き、各ウェルに25 μLのコルチゾール抗体を添加します。
- プレートの側面を軽くタップして試薬を混ぜます。
- プレートシーラーで覆い、室温(RT)で20~25°Cで1時間振ります。
- ウェルの内容物を取り外し、洗浄バッファー(300 Μl)で各ウェル4xをすすいでください。プレートをタップして、洗いタオルの間で乾燥させます。
- 各ウェル(100 μL)にTMB基板を追加します。
- 20~25°Cでプレートを30分間振らずにインキュベートします。
- 各ウェル(50 μL)にストップ溶液を追加します。
- 450 nmのマイクロプレートの各ウェルの光学密度を読み取ります。
- 各規格の光学密度を平均し、NSBウェルの平均光密度をサンプリングして減算します。
- 最大バインディング (B0) コントロールを使用して、すべてのサンプルのパーセントバインド (B/B0) を計算します。
- %B/B0 カーブから計算された 4 パラメータロジスティック回帰曲線継手が可能なソフトウェアを使用して標準カーブを作成します。
- その結果に希釈係数(10)を掛け、pg/mLでコルチゾール値を得ます。
- 最高水準を超える光学密度を持つサンプルは、アッセイバッファーでさらに希釈し、再アッセイし、その結果に追加の希釈係数を乗算する必要があります。
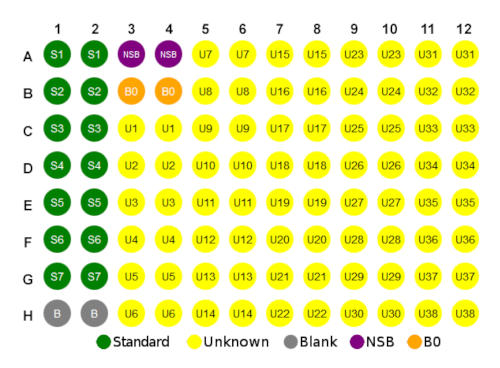
図 1: プレートレイアウトの例。この図のより大きなバージョンを表示するには、ここをクリックしてください。
7. 心理測定(知覚ストレスアンケート)
- Fliege et al.13が発表したPSQを用いて被験者の心理レベルを測定し、4つの要因(心配、緊張、緊張、喜び)を含み、20項目を利用する。
- レクリエーション体験の直前と経験の終了直後にPSQに記入してもらいます。
- 各被験者の生体生理学的ストレスレベルと同じ3桁のID番号を持つアンケートにタグを付けます。
結果
サンプルの説明
クォータサンプリング手法を用いて、本研究では3つのサイトから35名の来場者を募集した。この研究では、男性63名、女性42名を含む105名の被験者を募集しました。3つの異なるサイトから募集された平均訪問者数は、25.9年(サイトA)、37.2年(サイトB)、28.8年(サイトC)であった。選択した3つのサイトへの被験者の訪問の頻度も記録された。サイトAとサイトCでは、?...
ディスカッション
本研究の目的は、自然の異なるレベルを持つ3つの異なる設定へのレクリエーション訪問後の生物物理学的および心理的な器具を使用して、ストレスの潜在的な変化を特定することです。コルチゾールとα-アミラーゼの両方が心理的ストレスのレベルの信頼性の高い指標であることが示されています。.本研究で説明するアミラーゼアッセイ手順は、96ウェルフォーマットに適合している。唾液...
開示事項
著者は利益相反を宣言しない。
謝辞
この研究は、インディアナ大学ブルーミントン校公衆衛生学部を通じて後援された教員研究助成プログラム(FRGP)を通じて一部資金提供を受けました。著者たちは、アリソン・ヴォイト博士とメリッサ・ペイジ博士の編集支援と建設的なコメントに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Cortisol Enzyme Immunoassay Kit | DetectX | K003-H1 | The Cortisol Enzyme Immunoassay kit is designed to quantitatively measure cortisol present in dried fecal extracts, saliva, urine, serum, plasma and culture media samples. |
| Cryogenic Labels for Cryogenic Storage | Fisherbrand | 5-910-A | Unique adhesive withstands extreme temperature |
| Liquid Amylase (CNPG3) Reagent Set | Pointe Scientific | A7564 | For the quantitative kinetic determination of α-amylase activity in human serum. |
| Round Bottom 2mL Polypropylene Tubes with External Thread Cap | Greiner Bio-One | 07-000-257 | 2.0 ml U-BTM Cryo.s self standing polypropylene sterilized |
| Synergy Multi-Mode Microplate Reader | BioTek | It is a single-channel absorbance, fluorescence, and luminescence microplate reader that uses a dual-optics design to perform measurements of samples in a microplate format. |
参考文献
- Hansmann, R., Hug, S., Seeland, K. Restoration and stress relief through physical activities in forests and parks. Urban Forestry and Urban Greening. 6, 213-225 (2007).
- Krantz, D. S., McCeney, M. K. Effects of psychological and social factors on organic disease: A critical assessment of research on coronary heart disease. Annual Review of Psychology. 53, 341-369 (2002).
- Ward Thompson, C., et al. More green space is linked to less stress in deprived communities: Evidence from salivary cortisol patterns. Landscape and Urban Planning. 105, 221-229 (2012).
- Haluza, D., Schonbauer, R., Cervinka, R. Green perspectives for public health: A narrative on the physiological effects of experiencing outdoor nature. International Journal of Environmental Research and Public Health. 11, 5445-5461 (2014).
- Korpela, K. M., Ylen, M., Tyrväinen, L., Silvennomen, H. Determinants of restorative experiences in everyday favorite places. Health and Place. 14, 636-652 (2008).
- Mantler, A., Logan, A. C. Natural environments and mental health. Advances in Integrative Medicine. 2, 5-12 (2015).
- Mayer, F. S., McPherson-Frantz, C., Bruehlman-Senecal, E., Dolliver, K. Why is nature beneficial? the role of connectedness to nature. Environment and Behavior. 41, 307-643 (2009).
- Pretty, J., Peacock, J., Sellens, M., Griffin, M. The mental and physical health outcomes of green exercise. International Journal of Environal Health Research. 15, 319-337 (2005).
- Ulrich, R., et al. Stress recovery during exposure to natural and urban environments. Journal of Environmental Psychology. 11, 201-230 (1991).
- Kaplan, S., Talbot, J. F., Altman, I., Wohlwill, J. F. Psychological Benefits of a Wilderness Experience. Behavior and the Natural Environment. , 163-203 (1983).
- Salmon, P. Effects of physical exercise on anxiety, depression, and sensitivity to stress: A unifying theory. Clinical Psychology Review. 21, 33-61 (2001).
- Focht, B. C. Brief walks in outdoor and laboratory environments: Effects on affective responses, enjoyment, and intentions to walk for exercise. Research Quarterly for Exercise and Sport. 80, 611-620 (2009).
- Fliege, H., et al. The Perceived Stress Questionnaire (PSQ) reconsidered: Validation and reference values from different clinical and healthy adult samples. Psychosomatic Medicine. 67, 78-88 (2005).
- Kirschbaum, C., Hellhammer, D. H. Salivary cortisol in psychoneuronendocrine research: Recent developments and applications. Psychoneuroendocrinology. 19, 313-333 (1994).
- Gallacher, D. V., Petersen, O. H. Stimulus-secretion coupling in mammalian salivary glands. International Reviews in Physiology. 28, 1-52 (1983).
- Slosnik, R. T., Chatterton, R. T., Swisher, T., Par, S. Modulation of attentional inhibition by norepinephrine and cortisol after psychological stress. International Journal of Psychophysiology. 36, 59-68 (2000).
- Nater, U. M., et al. Stress-induced changes in human salivary alpha-amylase activity-associations with adrenergic activity. Psychoneuroendocrinology. 31 (1), 49-58 (2006).
- Takai, N., et al. Effect of psychological stress on the salivary cortisol and amylase levels in healthy young adults. Archives of Oral Biology. 49 (12), 963-968 (2004).
- Shirtcliff, E. A., Granger, D. A., Schwatz, E., Curran, M. J. Use of salivary biomarkers in biobehavioral research: Cotton based sample collection methods can interfere with salivary immunoassay results. Psychoneuroendocrinology. 26, 165-173 (2001).
- Nater, U. M., et al. Human salivary alpha-amylase reactivity in a psychosocial stress paradigm. Journal of Psychophysiology. 55 (3), 333-342 (2005).
- Granger, D. A., et al. Integration of salivary biomarkers into developmental and behaviorally-oriented research: Problems and solutions for collecting specimens. Physiology and Behavior. 92, 583-590 (2007).
- Frumkin, H. Beyond toxicity: Human health and the natural environment. American Journal of Preventive Medicine. 20, 234-240 (2001).
- Hartig, T., Mitchell, R., de Vries, S., Frumkin, H. Nature and health. Annual Review of Public Health. 35, 207-228 (2014).
- Gidlow, C. J., et al. Where to put your best foot forward: Psycho-physiological responses to walking in natural and urban environments. Journal of Environmental Psychology. 45, 22-29 (2016).
- Ewert, A., Chang, Y. Levels of nature and stress response. Behavioral Sciences. 8 (5), 49 (2018).
- Wyles, K. J., et al. Are some natural environments more psychologically beneficial than others? The importance of type and quality on connectedness to nature and psychological restoration. Environment and Behavior. 51 (2), 111-143 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved