Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición de los niveles de estrés biofísico y psicológico después de la visita a tres lugares con diferentes niveles de naturaleza
En este artículo
Resumen
El propósito de este artículo es identificar los cambios en los niveles de estrés después de la visita a tres entornos diferentes y describir los métodos utilizados para identificar los niveles de estrés basados en medidas de cortisol salival, amilasa y un autoinforme psicológico Instrumento.
Resumen
La visita a entornos naturales se ha relacionado con la reducción del estrés psicológico. Aunque la mayoría de las investigaciones relacionadas con el estrés se han basado en formatos de autoinforme, un número creciente de estudios ahora incorporan hormonas y catalizadores biológicos relacionados con el estrés, como el cortisol y la amilasa, para medir los niveles de estrés. Aquí se presenta un protocolo para examinar los efectos sobre los niveles de estrés biofísico y psicológico después de la visita a tres lugares diferentes con diferentes niveles de naturaleza. Los niveles de estrés psicológico biofísico y autoinformado se miden inmediatamente al entrar en los lugares seleccionados y justo antes de que los visitantes abandonen el sitio. Utilizando un método "drool", la medida biofísica consiste en 1-2 ml de muestras de saliva proporcionadas por sujetos de estudio al entrar en uno de los tres lugares de estudio. Según lo prescrito por la literatura existente, la saliva se recoge dentro de un plazo de 45 minutos después del final de la participación del visitante en el lugar. Después de la recolección de saliva, las muestras se etiquetan y se transportan a un laboratorio biológico. El cortisol es la variable biofísica de interés en este estudio y se mide mediante un proceso ELISA con un lector de placas TECAN. Para medir el estrés autoinformado, el Cuestionario de Estrés Percibido (PSQ, por sus que se informa de los niveles de preocupación, tensión, alegría y demandas percibidas). Los datos se recopilan en los tres sitios a última hora de la tarde hasta primera hora de la noche. En comparación con los tres entornos, los niveles de tensión, medidos tanto por los marcadores biológicos como por los autoinformes, son significativamente más bajos después de la visita al entorno más natural.
Introducción
Los niveles elevados de estrés se han relacionado durante mucho tiempo con muchas enfermedades graves como enfermedades del corazón, obesidad, y trastornos psicológicos1,2,3. Un creciente cuerpo de investigación sugiere que la proximidad o las visitas a entornos naturales como el parque y los paisajes no desarrollados pueden tener un efecto notable en el bienestar psicológico y la disminución de los niveles de estrés1,4, 5,6,7,8,9,10. Las explicaciones sobre los efectos de los entornos naturales y los niveles de estrés han incluido lo siguiente: (1) los entornos naturales proporcionan lugares para la actividad física8,11 y (2) los visitantes a entornos naturales tienen la capacidad de enfocarse en más procesos de pensamiento no tareas, lo que conduce a una reducción de la fatiga de atención12. Para determinar los efectos de la naturaleza en la reducción del estrés, este estudio utiliza un autoinforme de estrés psicológico (PSQ) y dos biomarcadores basados en saliva, cortisol y amilasa, después de visitar a tres sitios de recreación diferentes. Estos lugares varían entre sus niveles de "naturalidad" e incluyen un entorno de tipo desierto, parque municipal, y gimnasio local y instalaciones recreativas.
Este estudio tiene como objetivo abordar las siguientes preguntas de investigación: (RQ1) ¿Existen diferencias en los niveles de estrés biofísico medidos por cortisol salival y amilasa en comparación con los tres sitios (es decir, natural, semi-natural, construido)? (RQ2) ¿Hay diferencias en los niveles de estrés psicológico medidos por el PSQ (manifestado por cuatro construcciones: demandas, preocupaciones, tensión y alegría) en comparación con los tres sitios (es decir, natural, seminatural, construido)?
Protocolo
Este estudio sigue las políticas y directrices del Programa de Protección de Investigación Humana de la Junta de Revisión Institucional de la Universidad de Indiana.
1. Selección de ubicación
- Seleccione el número de sitios (n) en función de los diferentes niveles de la naturaleza.
NOTA: Elegimos tres sitios para nuestro trabajo. Utilizando un continuo basado en los niveles de "naturalidad", el Sitio A fue considerado el más natural y se compone de aproximadamente 1,200 acres de crestas boscosas que bordean un lago y se encuentra dentro de un bosque caducifolio. Las actividades más comunes incluyen caminar y observar la vida silvestre. El sitio B era un parque municipal de 33 acres que ofrece senderos para caminar, lugares para reuniones, áreas de juegos infantiles y espacio de campo abierto para actividades recreativas causales. El Sitio C era un gimnasio urbano, en interiores con el nivel más bajo de naturalidad. Los tres sitios están relativamente cerca de una ciudad de tamaño mediano (población estimada de 46.000 personas) en el medio oeste de los Estados Unidos.
2. Examen y preparación de los participantes
- Completar el reclutamiento de participantes antes de que las asignaturas participen en experiencias recreativas.
NOTA: Para los sitios A y B, los sujetos fueron abordados por el investigador en el estacionamiento de la entrada del parque. Para el Sitio C, los sujetos fueron abordados en la recepción del gimnasio interior. Para controlar las diferencias en el tipo de actividad, los sujetos reclutados para los sitios A y B eran predominantemente de senderismo, mientras que para el Sitio C la actividad principal corría o caminaba por la pista cubierta. - Durante el reclutamiento, recuerde a los sujetos que cumplan con las pautas relacionadas con la recolección de muestras de cortisol salival. No deben comer ni beber 10 minutos antes de proporcionar muestras de saliva.
NOTA: Cabe señalar que en este caso, las muestras de saliva no se normalizaron para el volumen o dilución (concentración) - es decir, si los participantes estaban adecuadamente hidratados y/o cambiaron la hidratación entre las colecciones de muestras. - Dar brazaletes rojos (o ropa notablemente perceptible) a cada participante para permitir una identificación fácil cuando salide al final de sus compromisos.
- Asigne una asignación de tiempo de 30-40 minutos para que todos los sujetos de los tres sitios pasen una cantidad similar de tiempo en cada sitio. Excluya los sujetos que pasen sustancialmente más o menos tiempo que el resto de la muestra.
- Mantenga el tipo de actividad comprometida de forma constante.
NOTA: En este caso, la actividad "media" era caminar o hacer senderismo. Los sujetos que participaban en actividades sustancialmente diferentes de caminar o hacer senderismo fueron excluidos de la muestra. Por ejemplo, los sujetos que pescaban, hacían picnic o levantaban pesas no estaban incluidos en las muestras respectivas.
3. Condiciones y diseño experimental
- Utilice un diseño cuasi-experimental pre-prueba/post-prueba.
- Después de identificar a los sujetos y al aceptar participar, pida a cada sujeto que lea y firme un formulario IRB que explique la naturaleza voluntaria, el propósito y los procedimientos del estudio.
- Después de este proceso, entregar a los sujetos una pieza de ropa (por ejemplo, brazalete rojo) para la identificación futura y obtener medidas fisiológicas y psicológicas de los niveles de estrés (es decir, PSQ, 1-2 mL de saliva que escupe o se babea en un tubo de ensayo). Recoger muestras desde la tarde hasta la noche.
NOTA: Estos datos fueron recogidos por los investigadores tanto 1) justo antes de que los sujetos entraran en el sitio y 2) inmediatamente después de finalizar la visita al sitio.
4. Muestras de saliva
- Para evitar la dilución de la muestra, pida a los sujetos que no coman, beban o enjuaguen bocas 10 minutos antes de proporcionar muestras de saliva.
- Pida a los sujetos que proporcionen muestras de saliva de 1-2 ml (excluyendo espuma) justo antes de la experiencia recreativa e inmediatamente después de la conclusión de la experiencia.
- Recoger muestras de saliva utilizando un método de baba pasiva:
- Proporcione a los sujetos un 2 en plástico de paja para beber gotea en un criovial de 2 ml (ver Tabla de Materiales).
- Instruya a los sujetos para que permitan que la saliva se ameta en la boca, luego babee por la paja y en el criovial. Según el Consejo de Recogida y Manipulación de Saliva (2011), 1 mL (excluyendo espuma) es adecuado para la mayoría de las pruebas.
- Etiquetar muestras con un número de identificación asignado de 3 dígitos (es decir, 001) y una letra para indicar el momento de la recopilación de datos (es decir, A representa la prueba previa, B representa la prueba posterior; donde 001A representa la muestra de saliva proporcionada por el participante 001 antes de realizar la experiencia recreativa).
- Después de que la muestra se recoge y etiquetado, entonces debe ser almacenado congelado temporalmente en una caja de espuma de esteroides llena de hielo seco durante no más de 2 h.
- Transportar las muestras marcadas a un laboratorio y almacenar a -80 oC hasta que se analicen.
5. Cuantificación de la amilasa
NOTA: En este ensayo, hidroliza 2-cloro-p-nitrofenil--D-maltotrioside a 2-cloro-nitrofenol y forma glucosa, 2-cloro-p-nitrofenilo--D-maltoside, maltotriosa y glucosa. La reacción se controla a una absorbancia de 405 nm, que corresponde a la actividad de la amilasa en la muestra. Este ensayo demuestra la linealidad entre 0 y 2000 U/L.
-
Materiales
- Se utilizó un conjunto de reactivos de amilasa líquida (ver Tabla de materiales)para cuantificar la amilasa en muestras de saliva. Todos los reactivos se proporcionan como líquidos listos para usar y se almacenan a 0-4 oC.
- Utilice un lector multimodo (ver Tabla de Materiales)capaz de leer una densidad óptica a 405 nm con una temperatura controlada a 37 oC durante el ensayo.
-
Análisis
- Descongelar las muestras en hielo antes del análisis.
- Las muestras diluir 1:10 con 1x PBS (10 l de saliva + 90 l de PBS).
- Analice cada muestra por duplicado.
- Equilibre el reactivo de amilasa a 20-25 oC durante al menos 30 min.
- Añadir 0,1 ml de reactivo de amilasa a una microplaca de 96 pocillos para cada muestra.
- Pre-incubar la microplaca a 37oC durante un mínimo de 5 min.
- Añadir 2,5 ml de la muestra al reactivo de amilasa.
- Tome una lectura inicial después de los 60 s.
- Continúe las lecturas cada 60 s durante 2 minutos adicionales.
- Calcular la diferencia media de absorbancia por minuto (.Abs/min).
-
Cálculo
- Para calcular la actividad de la amilasa, utilice la siguiente fórmula:

Donde ElAbs/min cambia en la diferencia de absorbancia por minuto; TV : volumen total de ensayo (0,1025 ml); *1000 - conversión de U/mL a U/L; MMA - absorción milimolar de 2-cloro-p-nitrofenol á 12.9; SV - volumen de la muestra (0.0025 mL); y LP - camino de luz (1 cm). La sustitución da:
Por lo tanto, multiplique los Abs/min por 3178x el factor de dilución (10) para obtener amilasa en U/L. - Para muestras superiores a 2000 U/L (linealidad del ensayo) diluir aún más (al menos 2 veces usando PBS) y volver a analizar, luego multiplicar el resultado de la amilasa por el factor de dilución adicional.
- Para calcular la actividad de la amilasa, utilice la siguiente fórmula:
6. Cuantificación del cortisol
NOTA: En este ensayo, el cortisol libre se cuantifica en la saliva utilizando una curva estándar de cortisol. Las normas y las muestras diluidas se añaden a una placa de microtíter pre-recubierta con un anticuerpo. Se añade un conjugado de cortisol-peroxidasa a los pozos, seguido de la adición de un anticuerpo monoclonal al cortisol. La cantidad de unión conjugada cortisol/peroxidasa disminuye a medida que aumenta la concentración de cortisol en la muestra.
-
Materiales
- Utilice un kit de inmunoensayo de enzimas cortisol (ver Tabla de materiales)para cuantificar el cortisol en muestras de saliva. Todos los reactivos necesarios para realizar este ensayo están incluidos en el kit. Todos los componentes del kit se almacenan a 0-4 oC antes de alcanzar la fecha de caducidad.
- Utilice un espectrofotómetro capaz de leer una densidad óptica (OD) a 450 nm (consulte Tabla de materiales),así como un software capaz de utilizar grabaciones OD del lector de placas para realizar un ajuste de curva logística de cuatro parámetros (4 PLC).
-
Preparación de reactivos
- Permita que todos los reactivos se equilibren a 20-25 oC durante un mínimo de 30 min.
- Diluir el tamón de ensayo de cortisol 1:5 utilizando agua desionizada.
- Diluir el tampón de lavado 1:20 con agua desionizada.
NOTA: Los tampones de ensayo y lavado son estables durante 3 meses cuando se almacenan a 0-4 oC.
-
Preparación de muestras
- Descongelar las muestras en hielo antes del análisis.
- Diluir las muestras 1:10 con tampón de ensayo de cortisol (20 l de saliva + 180 l de tampón) y utilizar dentro de 2 h de preparación.
-
Preparación de normas
- Etiquetar tubos de ensayo de vidrio #1-#7.
- Pipet 225 l de tampón de ensayo en #1 de tubo y 125 ml de tampón en tubos #2-#7.
- Añadir 25 l de la solución de material de cortisol al tubo #1 y vórtice.
- Retire 125 ml de tampón del tubo #1 y agréguelo al tubo #2, luego vórtice.
- Repita las diluciones en serie para tubos #7 #3.
NOTA: Las concentraciones finales de cortisol de cada norma se muestran en la Tabla1. - Las normas deben utilizarse dentro de las 2 h de la preparación.
| Estándar | #1 | #2 | #3 | #4 | #5 | #6 | #7 |
| Volumen de búfer de ensayo (L) | 225 | 125 | 125 | 125 | 125 | 125 | 125 |
| Adición | Stock Std | #1 | #2 | #3 | #4 | #5 | #6 |
| Volumen de Adición (L) | 25 | 125 | 125 | 125 | 125 | 125 | 125 |
| Concentración final (pg/mL) | 3200 | 1600 | 800 | 400 | 200 | 100 | 50 |
Tabla 1: Tabla de preparación de curvas estándar.
-
Análisis
- Utilice el diseño de placa que figura a continuación en la Figura 1 como guía para configurar la microplaca.
- Se recomienda utilizar una pipeta multicanal para la adición de reactivos.
- Añadir 50 l de muestras o normas en el número adecuado de pozos en la placa. Las muestras y los estándares deben ejecutarse por duplicado.
- Agregue el búfer de ensayo (75 l) en los pozos de enlace no específicos (NSB).
- Agregue el búfer de ensayo (50 l) en los pozos de unión máxima (B0) y los pozos estándar cero (en blanco).
- Añadir 25 s de la conjugación de cortisol a cada poca.
- Añadir 25 éL del anticuerpo cortisol a cada pocal, a excepción de los pozos NSB.
- Toque suavemente el lado de la placa para mezclar los reactivos.
- Cubra con el sellador de placas y agite a temperatura ambiente (RT) a 20-25 oC durante 1 h.
- Retire el contenido del pozo y enjuague cada poca con tampón de lavado (300 l). Toque el plato para secar las toallas absorbentes entre lavados.
- Añadir el sustrato de TMB a cada pocal (100 l).
- Incubar la placa a 20-25 oC durante 30 min sin agitar.
- Añadir solución de parada a cada pocal (50 l).
- Lea la densidad óptica en cada pocal de la microplaca a 450 nm.
- Promedio de las densidades ópticas para cada estándar, luego muestrear y restar la densidad óptica media para los pozos NSB.
- Calcule el % consolidado (B/B0) para todas las muestras utilizando controles de enlace máximo (B0).
- Cree una curva estándar utilizando un software capaz de ajustar la curva de regresión logística de cuatro parámetros, calculada a partir de la curva %B/B0.
- Multiplique el resultado por el factor de dilución (10) para obtener valores de cortisol en pg/mL.
- Las muestras con densidades ópticas que estén por encima del estándar más alto deben diluirse con el búfer de ensayo y volver a ensayo, entonces el resultado debe multiplicarse por el factor de dilución adicional.
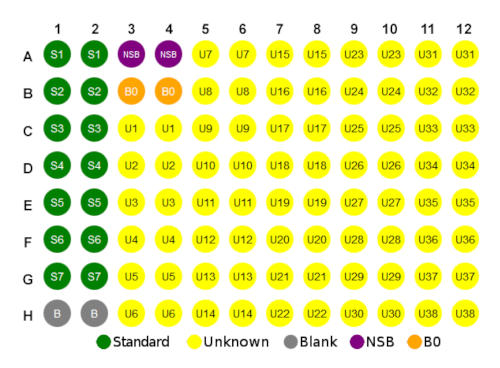
Figura 1 : Diseño de placa de ejemplo. Haga clic aquí para ver una versión más grande de esta figura.
7. Medición psicológica (Cuestionario de Estrés Percibido)
- Mida los niveles psicológicos de sujetos utilizando el PSQ publicado por Fliege et al.13, que incluye cuatro factores (preocupación, tensión, tensión, alegría) y utiliza 20 artículos.
- Pídale al sujeto que llene el PSQ justo antes de su experiencia recreativa e inmediatamente después de la conclusión de la experiencia.
- Etiquete cuestionarios con un número de identificación de 3 dígitos idéntico al nivel biofisiológico de estrés de cada sujeto.
Resultados
Descripción de la muestra
Utilizando una técnica de muestreo de cuotas, este estudio reclutó a 35 visitantes de cada uno de los tres sitios. En total, se reclutaron 105 sujetos en este estudio, incluidos 63 hombres y 42 mujeres. Las edades promedio de los visitantes reclutados en tres sitios diferentes fueron de 25,9 años (Sitio A), 37,2 años (Sitio B) y 28,8 años (Sitio C). También se registraron las frecuencias de las visitas de los sujetos a los tres sitios seleccionados. Para el Sitio A y e...
Discusión
El objetivo de este estudio es identificar posibles cambios en el estrés utilizando instrumentos biofísicos y psicológicos después de visitas recreativas a tres entornos diferentes con diferentes niveles de naturaleza. Tanto el cortisol como la amilasa han demostrado ser indicadores fiables de los niveles de estrés psicológico. El procedimiento de ensayo de amilasa descrito en este estudio se ha adaptado a un formato de 96 pozos. Cuando los niveles de amilasa en la saliva son altos, los cambios de absorbancia ocurr...
Divulgaciones
Los autores no declaran conflictos de intereses.
Agradecimientos
Este estudio fue financiado en parte a través del Programa de Becas de Investigación de la Facultad (FRGP) patrocinado a través de la Escuela de Salud Pública de la Universidad de Indiana, Bloomington, IN. Los autores quieren agradecer a la Dra. Alison Voight y Melissa Page por su asistencia editorial y comentarios constructivos.
Materiales
| Name | Company | Catalog Number | Comments |
| Cortisol Enzyme Immunoassay Kit | DetectX | K003-H1 | The Cortisol Enzyme Immunoassay kit is designed to quantitatively measure cortisol present in dried fecal extracts, saliva, urine, serum, plasma and culture media samples. |
| Cryogenic Labels for Cryogenic Storage | Fisherbrand | 5-910-A | Unique adhesive withstands extreme temperature |
| Liquid Amylase (CNPG3) Reagent Set | Pointe Scientific | A7564 | For the quantitative kinetic determination of α-amylase activity in human serum. |
| Round Bottom 2mL Polypropylene Tubes with External Thread Cap | Greiner Bio-One | 07-000-257 | 2.0 ml U-BTM Cryo.s self standing polypropylene sterilized |
| Synergy Multi-Mode Microplate Reader | BioTek | It is a single-channel absorbance, fluorescence, and luminescence microplate reader that uses a dual-optics design to perform measurements of samples in a microplate format. |
Referencias
- Hansmann, R., Hug, S., Seeland, K. Restoration and stress relief through physical activities in forests and parks. Urban Forestry and Urban Greening. 6, 213-225 (2007).
- Krantz, D. S., McCeney, M. K. Effects of psychological and social factors on organic disease: A critical assessment of research on coronary heart disease. Annual Review of Psychology. 53, 341-369 (2002).
- Ward Thompson, C., et al. More green space is linked to less stress in deprived communities: Evidence from salivary cortisol patterns. Landscape and Urban Planning. 105, 221-229 (2012).
- Haluza, D., Schonbauer, R., Cervinka, R. Green perspectives for public health: A narrative on the physiological effects of experiencing outdoor nature. International Journal of Environmental Research and Public Health. 11, 5445-5461 (2014).
- Korpela, K. M., Ylen, M., Tyrväinen, L., Silvennomen, H. Determinants of restorative experiences in everyday favorite places. Health and Place. 14, 636-652 (2008).
- Mantler, A., Logan, A. C. Natural environments and mental health. Advances in Integrative Medicine. 2, 5-12 (2015).
- Mayer, F. S., McPherson-Frantz, C., Bruehlman-Senecal, E., Dolliver, K. Why is nature beneficial? the role of connectedness to nature. Environment and Behavior. 41, 307-643 (2009).
- Pretty, J., Peacock, J., Sellens, M., Griffin, M. The mental and physical health outcomes of green exercise. International Journal of Environal Health Research. 15, 319-337 (2005).
- Ulrich, R., et al. Stress recovery during exposure to natural and urban environments. Journal of Environmental Psychology. 11, 201-230 (1991).
- Kaplan, S., Talbot, J. F., Altman, I., Wohlwill, J. F. Psychological Benefits of a Wilderness Experience. Behavior and the Natural Environment. , 163-203 (1983).
- Salmon, P. Effects of physical exercise on anxiety, depression, and sensitivity to stress: A unifying theory. Clinical Psychology Review. 21, 33-61 (2001).
- Focht, B. C. Brief walks in outdoor and laboratory environments: Effects on affective responses, enjoyment, and intentions to walk for exercise. Research Quarterly for Exercise and Sport. 80, 611-620 (2009).
- Fliege, H., et al. The Perceived Stress Questionnaire (PSQ) reconsidered: Validation and reference values from different clinical and healthy adult samples. Psychosomatic Medicine. 67, 78-88 (2005).
- Kirschbaum, C., Hellhammer, D. H. Salivary cortisol in psychoneuronendocrine research: Recent developments and applications. Psychoneuroendocrinology. 19, 313-333 (1994).
- Gallacher, D. V., Petersen, O. H. Stimulus-secretion coupling in mammalian salivary glands. International Reviews in Physiology. 28, 1-52 (1983).
- Slosnik, R. T., Chatterton, R. T., Swisher, T., Par, S. Modulation of attentional inhibition by norepinephrine and cortisol after psychological stress. International Journal of Psychophysiology. 36, 59-68 (2000).
- Nater, U. M., et al. Stress-induced changes in human salivary alpha-amylase activity-associations with adrenergic activity. Psychoneuroendocrinology. 31 (1), 49-58 (2006).
- Takai, N., et al. Effect of psychological stress on the salivary cortisol and amylase levels in healthy young adults. Archives of Oral Biology. 49 (12), 963-968 (2004).
- Shirtcliff, E. A., Granger, D. A., Schwatz, E., Curran, M. J. Use of salivary biomarkers in biobehavioral research: Cotton based sample collection methods can interfere with salivary immunoassay results. Psychoneuroendocrinology. 26, 165-173 (2001).
- Nater, U. M., et al. Human salivary alpha-amylase reactivity in a psychosocial stress paradigm. Journal of Psychophysiology. 55 (3), 333-342 (2005).
- Granger, D. A., et al. Integration of salivary biomarkers into developmental and behaviorally-oriented research: Problems and solutions for collecting specimens. Physiology and Behavior. 92, 583-590 (2007).
- Frumkin, H. Beyond toxicity: Human health and the natural environment. American Journal of Preventive Medicine. 20, 234-240 (2001).
- Hartig, T., Mitchell, R., de Vries, S., Frumkin, H. Nature and health. Annual Review of Public Health. 35, 207-228 (2014).
- Gidlow, C. J., et al. Where to put your best foot forward: Psycho-physiological responses to walking in natural and urban environments. Journal of Environmental Psychology. 45, 22-29 (2016).
- Ewert, A., Chang, Y. Levels of nature and stress response. Behavioral Sciences. 8 (5), 49 (2018).
- Wyles, K. J., et al. Are some natural environments more psychologically beneficial than others? The importance of type and quality on connectedness to nature and psychological restoration. Environment and Behavior. 51 (2), 111-143 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados