需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
测量对三个自然水平不同的地点进行访问后的生物物理和心理压力水平
摘要
本文的目的是确定访问三种不同环境后压力水平的变化,并描述根据唾液皮质醇、β-淀粉酶和心理自我报告测量来确定压力水平的方法仪器。
摘要
对自然环境的访问与心理压力的减轻有关。虽然大多数与压力相关的研究都依赖于自我报告格式,但越来越多的研究现在纳入了与生物压力相关的激素和催化剂,如皮质醇和β-淀粉酶,以测量压力水平。这里介绍的是一个协议,用于检查在访问三个不同地点后对生物物理和心理压力水平的影响,这些地点的性质水平不同。生物物理和自我报告的心理压力水平在进入选定地点后立即测量,并在访客离开现场之前进行测量。生物物理测量方法包括研究对象在进入三个研究地点之一时提供的1-2 mL唾液样本。根据现有文献的规定,唾液在访客在地点订婚后45分钟内收集。在收集唾液后,这些样本被标记并运送到生物实验室。皮质醇是本研究中感兴趣的生物物理变量,使用 ELISA 过程与 TECAN 板读取器进行测量。为了测量自我报告的压力,感知压力问卷 (PSQ) 报告担心、紧张、喜悦和感知需求的程度。数据在傍晚至傍晚在三个地点收集。当对所有三个设置进行比较时,通过生物标记和自我报告测量的应力水平在访问到最自然的设置后明显较低。
引言
压力水平升高长期以来与许多严重的健康问题有关,如心脏病、肥胖和心理障碍1、2、3。越来越多的研究表明,靠近或参观自然环境,如公园和未开发景观,可以产生显著的影响心理健康和减少压力水平1,4 5,6,7,8,9,10.对自然环境和压力水平影响的解释包括:(1) 自然环境为自然环境提供场所8、11 和 (2) 自然环境的访问者能够集中注意力对更多的非任务思维过程,从而减少注意力疲劳12。为了确定自然对减压的影响,本研究利用自我报告的心理压力(PSQ)和两个基于唾液的生物标志物,皮质醇和β-淀粉酶,在访问三个不同的娱乐场所后。这些地点因"自然"程度而异,包括荒野式环境、市政公园以及当地的健身和娱乐设施。
本研究旨在解决以下研究问题:(RQ 1)与所有三个部位(即自然、半自然、构建)进行比较时,唾液皮质醇和β-淀粉酶测量的生物物理应力水平是否有差异?(RQ2)与所有三个地点(即自然、半自然、建筑)相比,PSQ衡量的心理压力水平是否有差异(表现为四种结构:需求、忧虑、紧张和喜悦)?
研究方案
本研究遵循印第安纳大学机构审查委员会人类研究保护计划的政策和指导方针。
1. 位置选择
- 根据不同的自然级别选择站点数 (n)。
注:我们选择了三个网站为我们的工作。A地块采用基于"自然性"水平的连续体,被认为是最自然的,由大约1,200英亩的林地山脊组成,毗邻湖泊,位于落叶林中。最常见的活动包括散步和观赏野生动物。站点 B 是一个占地 33 英亩的市政公园,设有步行道、聚会场所、游乐场和用于因果娱乐活动的开阔场地。C站点是一个城市室内运动设施,自然程度最低。这三个地点都比较接近美国中西部的一个中等规模城市(人口估计为46,000人)。
2. 参与者筛选和准备
- 在受试者从事娱乐体验之前完成参与者招募。
注:对于A和B地点,研究人员在公园入口的停车场接触了受试者。对于C站点,在室内运动设施的前台接触受试者。为了控制活动类型的差异,为A和B地点招募的受试者主要是徒步旅行,而对于网站C,主要活动是在室内跑道上跑步或行走。 - 在招聘期间,提醒受试者遵守有关收集唾液皮质醇样本的指引。在提供唾液样本之前,他们不得进食或饮用10分钟。
注:应当指出,在这种情况下,唾液样本未归化为体积或稀释(浓度) - 即参与者是否充分水合和/或样本收集之间的水化变化。 - 给每位参与者红色臂章(或同等明显的服装),以便在他们订婚结束时轻松识别。
- 分配 30-40 分钟时间分配,以便三个站点中的所有主体在每个站点上花费相同的时间。排除花费比样本其余部分多得多或更少的时间的主体。
- 保持参与活动类型保持一致。
注:在这种情况下,"中等"活动是步行或徒步旅行。从事与步行或徒步旅行有很大不同活动的受试者被排除在样本之外。例如,钓鱼、野餐或举重的受试者不包括在各自的样本中。
3. 条件和实验设计
- 使用准实验预测试/测试后设计。
- 确定受试者并同意参与后,请每个受试者阅读并签署一份IRB表格,解释学习的自愿性质、目的和程序。
- 按照这个过程,给受试者一件衣服(如红色臂章),以便将来识别,并获得压力水平的生理和心理测量(即PSQ,1-2 mL的唾液,吐痰或流口水到试管中)。从下午晚些时候到傍晚收集样品。
注:这些数据由研究人员收集,两者都在受试者进入网站之前收集,2)在结束对站点的访问后立即收集。
4. 唾液样品
- 为避免样品稀释,在提供唾液样本前10分钟,要求受试者不要进食、饮用或漱口。
- 要求受试者在娱乐体验之前和体验结束后立即提供1-2 mL唾液样本(不包括泡沫)。
- 使用被动流口水法收集唾液样本:
- 向受试者提供2个塑料吸管,使人流口水进入2 mL冷冻液(见材料表)。
- 指导受试者让唾液在嘴里聚集,然后从吸管中流口水,进入冷冻液中。根据唾液收集和处理建议 (2011),1 mL(不包括泡沫)是足够的大多数测试。
- 标签样本,带有分配的 3 位 ID 号(即 001)和字母,以指示数据收集的时间(即 A 表示预测试,B 表示测试后;其中 001A 表示参与者 001 在进行娱乐体验)。
- 样品被收集和标记后,应暂时冷冻在充满干冰的类固醇泡沫箱不超过2小时。
- 将标记的样品运送到实验室,并在-80°C下储存,直到分析。
5. β-淀粉酶的定量
注:在此测定中,β-淀粉酶水解2-氯-p-硝基-β-D-麦芽糖,形成葡萄糖、2-氯-p-硝基苯-β-D-麦芽糖、麦芽糖和葡萄糖。反应在405nm的吸收度下被监测,这相当于样品中的β-淀粉酶活性。此测定显示 0 和 2000 U/L 之间的线性度。
-
材料
- 使用液体淀粉酶试剂组(见材料表)对唾液样品中的β-淀粉酶进行量化。所有试剂均作为即用液体提供,储存在0-4°C。
- 使用多模读卡器(见材料表),能够在测定过程中读取405nm的光学密度,温度控制在37°C。
-
分析
- 在分析之前,先解冻冰上的样品。
- 用 1x PBS 稀释样品 1:10(10 μL 的唾液 + 90 μL 的 PBS)。
- 以重复的方式分析每个示例。
- 将淀粉酶试剂平衡至20-25°C至少30分钟。
- 在每个样品的96孔微孔板中加入0.1 mL的淀粉酶试剂。
- 在37°C下预孵育微孔板至少5分钟。
- 将2.5 μL的样品加入淀粉酶试剂。
- 在 60 岁以后进行初始阅读。
- 继续每 60 秒读取 2 分钟。
- 计算每分钟的平均吸光差 (μAbs/min)。
-
计算
- 要计算淀粉酶活性,请使用以下公式:

其中=Abs/min = 每分钟吸收差的变化;电视= 总测定量(0.1025 mL);*1000 = 将 U/mL 转换为 U/L;MMA = 2-氯-p-硝基苯酚的毫摩尔吸收率= 12.9;SV = 样品体积 (0.0025 mL);LP = 光路(1 厘米)。替换提供:
因此,将μAbs/min乘以稀释系数(10)的3178倍,以在U/L中获得淀粉酶。 - 对于超过2000 U/L(测定线性)的样品进一步稀释(使用PBS至少2倍),再测定,然后将β-淀粉酶结果乘以额外的稀释系数。
- 要计算淀粉酶活性,请使用以下公式:
6. 皮质醇的定量
注:在此测定中,使用皮质醇标准曲线在唾液中量化游出皮质醇。标准和稀释样品被添加到预涂有抗体的微小板中。皮质醇过氧化物酶结合添加到井中,然后向皮质醇中添加单克隆抗体。皮质醇/过氧化物酶结合量随着样品中皮质醇浓度的增加而减少。
-
材料
- 使用皮质醇酶免疫测定试剂盒(见材料表)对唾液样本中的皮质醇进行量化。执行此测定所需的所有试剂都包含在试剂盒中。在到达到期日期之前,套件的所有组件都存储在 0-4 °C。
- 使用能够读取 450 nm 光密度 (OD) 的分光光度计(参见材料表),以及能够使用板读取器的 OD 录像执行四参数物流曲线 (4 PLC) 拟合的软件。
-
试剂制备
- 允许所有试剂平衡至20-25°C至少30分钟。
- 使用去离子水稀释皮质醇测定缓冲液1:5。
- 使用去离子水稀释洗涤缓冲液 1:20。
注:在0-4°C下储存时,测定和洗涤缓冲液稳定3个月。
-
样品制备
- 在分析之前,先解冻冰上的样品。
- 用皮质醇检测缓冲液稀释样品1:10(唾液20μL= 180μL的缓冲液),并在2小时内使用。
-
制定标准
- 标记玻璃试管#1#7。
- 将225μL的测定缓冲液插入管#1,将125μL的缓冲液送入管#2#7。
- 将25μL的皮质醇库存溶液加入管#1和涡旋。
- 从管#1中取出125 μL的缓冲液,并将其#2加入管中,然后涡旋。
- 重复管#3#7的连续稀释。
注:每个标准的最终皮质醇浓度如表1所示。 - 标准必须在准备后 2 小时内使用。
| 标准 | #1 | #2 | #3 | #4 | #5 | #6 | #7 |
| 测定缓冲液体积 (μL) | 225 | 125 | 125 | 125 | 125 | 125 | 125 |
| 除了 | 股票股票 | #1 | #2 | #3 | #4 | #5 | #6 |
| 添加量 (μL) | 25 | 125 | 125 | 125 | 125 | 125 | 125 |
| 最终浓度(pg/mL) | 3200 | 1600 | 800 | 400 | 200 | 100 | 50 |
表1:标准曲线准备表。
-
分析
- 使用图 1中的板布局作为设置微板的指南。
- 建议使用多通道移液器添加试剂。
- 将 50 μL 的样品或标准添加到板中适当数量的孔中。示例和标准应重复运行。
- 将测定缓冲液(75 μL)加入非特异性结合(NSB)井中。
- 将测定缓冲液(50 μL)加入最大结合(B0)井和零标准(空白)井。
- 在每个孔中加入25μL的皮质醇结合。
- 将25μL的皮质醇抗体添加到每口井中,NSB井除外。
- 轻轻敲击板的侧面以混合试剂。
- 用板封盖机盖上,在室温 (RT) 下在 20-25 °C 下摇动 1 小时。
- 取出井内内容物,用洗涤缓冲液(300 μl)冲洗每口井 4x。在洗洗之间,用吸水毛巾敲打盘子晾干。
- 将 TMB 基板添加到每个井 (100 μL)。
- 在 20-25°C 下孵育板 30 分钟,不摇晃。
- 向每口井(50 μL)添加止步溶液。
- 读取 450 nm 微孔中每个孔中的光学密度。
- 为每个标准提供光学密度平均值,然后采样和减去 NSB 油井的平均光学密度。
- 使用最大绑定 (B0) 控件计算所有样本的 % 绑定 (B/B0)。
- 使用基于 %B/B0 曲线计算的四参数逻辑回归曲线拟合软件创建标准曲线。
- 将结果乘以稀释系数 (10) 以获得 pg/mL 中的皮质醇值。
- 光学密度超过最高标准的样品应进一步稀释与测定缓冲液和重新测定,然后结果应乘以额外的稀释系数。
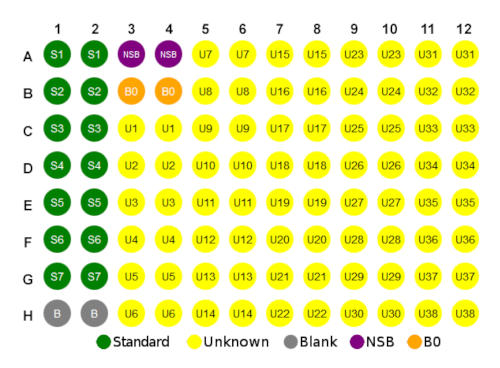
图 1:示例板布局。请点击此处查看此图的较大版本。
7. 心理测量(感知压力问卷)
- 使用Fliege等人13号出版的PSQ测量受试者的心理水平,其中包括四个因素(焦虑、紧张、紧张、快乐),并利用20个项目。
- 要求受试者在娱乐体验之前和体验结束后立即填写PSQ。
- 标记问卷,其 ID 号与每个受试者的生物生理压力水平相同。
结果
示例说明
利用配额抽样技术,这项研究从三个地点分别招募了35名访问者。在这项研究中共招募了105名受试者,包括63名男性和42名女性。从三个不同地点招募的访问者的平均年龄分别为25.9岁(网站A)、37.2岁(网站B)和28.8岁(网站C)。还记录了受试者访问选定三个地点的频率。对于站点 A 和站点 C,大多数受试者每周访问此站点一到三次。对于B站点的受试者,他们的访问频率平均为每周一至三...
讨论
本研究的目的是利用生物物理和心理工具,在娱乐访问后,确定压力的潜在变化,这些环境具有不同的自然水平。皮质醇和β-淀粉酶已被证明是心理压力水平的可靠指标。本研究中描述的淀粉酶测定程序已适应96井格式。当唾液中的淀粉酶水平高时,吸收性变化迅速发生。因此,限制一次分析的样本数量至关重要,因为一次可以分析的样本数量受每个井中 2.5 μL 的可添加速度的限制。在这项研究中,淀粉酶?...
披露声明
提交人声明没有利益冲突。
致谢
这项研究部分资金来自印第安纳州布卢明顿印第安纳大学公共卫生学院赞助的教师研究资助计划(FRGP)。作者要感谢艾莉森·沃伊特博士和梅丽莎·佩奇博士的编辑协助和建设性意见。
材料
| Name | Company | Catalog Number | Comments |
| Cortisol Enzyme Immunoassay Kit | DetectX | K003-H1 | The Cortisol Enzyme Immunoassay kit is designed to quantitatively measure cortisol present in dried fecal extracts, saliva, urine, serum, plasma and culture media samples. |
| Cryogenic Labels for Cryogenic Storage | Fisherbrand | 5-910-A | Unique adhesive withstands extreme temperature |
| Liquid Amylase (CNPG3) Reagent Set | Pointe Scientific | A7564 | For the quantitative kinetic determination of α-amylase activity in human serum. |
| Round Bottom 2mL Polypropylene Tubes with External Thread Cap | Greiner Bio-One | 07-000-257 | 2.0 ml U-BTM Cryo.s self standing polypropylene sterilized |
| Synergy Multi-Mode Microplate Reader | BioTek | It is a single-channel absorbance, fluorescence, and luminescence microplate reader that uses a dual-optics design to perform measurements of samples in a microplate format. |
参考文献
- Hansmann, R., Hug, S., Seeland, K. Restoration and stress relief through physical activities in forests and parks. Urban Forestry and Urban Greening. 6, 213-225 (2007).
- Krantz, D. S., McCeney, M. K. Effects of psychological and social factors on organic disease: A critical assessment of research on coronary heart disease. Annual Review of Psychology. 53, 341-369 (2002).
- Ward Thompson, C., et al. More green space is linked to less stress in deprived communities: Evidence from salivary cortisol patterns. Landscape and Urban Planning. 105, 221-229 (2012).
- Haluza, D., Schonbauer, R., Cervinka, R. Green perspectives for public health: A narrative on the physiological effects of experiencing outdoor nature. International Journal of Environmental Research and Public Health. 11, 5445-5461 (2014).
- Korpela, K. M., Ylen, M., Tyrväinen, L., Silvennomen, H. Determinants of restorative experiences in everyday favorite places. Health and Place. 14, 636-652 (2008).
- Mantler, A., Logan, A. C. Natural environments and mental health. Advances in Integrative Medicine. 2, 5-12 (2015).
- Mayer, F. S., McPherson-Frantz, C., Bruehlman-Senecal, E., Dolliver, K. Why is nature beneficial? the role of connectedness to nature. Environment and Behavior. 41, 307-643 (2009).
- Pretty, J., Peacock, J., Sellens, M., Griffin, M. The mental and physical health outcomes of green exercise. International Journal of Environal Health Research. 15, 319-337 (2005).
- Ulrich, R., et al. Stress recovery during exposure to natural and urban environments. Journal of Environmental Psychology. 11, 201-230 (1991).
- Kaplan, S., Talbot, J. F., Altman, I., Wohlwill, J. F. Psychological Benefits of a Wilderness Experience. Behavior and the Natural Environment. , 163-203 (1983).
- Salmon, P. Effects of physical exercise on anxiety, depression, and sensitivity to stress: A unifying theory. Clinical Psychology Review. 21, 33-61 (2001).
- Focht, B. C. Brief walks in outdoor and laboratory environments: Effects on affective responses, enjoyment, and intentions to walk for exercise. Research Quarterly for Exercise and Sport. 80, 611-620 (2009).
- Fliege, H., et al. The Perceived Stress Questionnaire (PSQ) reconsidered: Validation and reference values from different clinical and healthy adult samples. Psychosomatic Medicine. 67, 78-88 (2005).
- Kirschbaum, C., Hellhammer, D. H. Salivary cortisol in psychoneuronendocrine research: Recent developments and applications. Psychoneuroendocrinology. 19, 313-333 (1994).
- Gallacher, D. V., Petersen, O. H. Stimulus-secretion coupling in mammalian salivary glands. International Reviews in Physiology. 28, 1-52 (1983).
- Slosnik, R. T., Chatterton, R. T., Swisher, T., Par, S. Modulation of attentional inhibition by norepinephrine and cortisol after psychological stress. International Journal of Psychophysiology. 36, 59-68 (2000).
- Nater, U. M., et al. Stress-induced changes in human salivary alpha-amylase activity-associations with adrenergic activity. Psychoneuroendocrinology. 31 (1), 49-58 (2006).
- Takai, N., et al. Effect of psychological stress on the salivary cortisol and amylase levels in healthy young adults. Archives of Oral Biology. 49 (12), 963-968 (2004).
- Shirtcliff, E. A., Granger, D. A., Schwatz, E., Curran, M. J. Use of salivary biomarkers in biobehavioral research: Cotton based sample collection methods can interfere with salivary immunoassay results. Psychoneuroendocrinology. 26, 165-173 (2001).
- Nater, U. M., et al. Human salivary alpha-amylase reactivity in a psychosocial stress paradigm. Journal of Psychophysiology. 55 (3), 333-342 (2005).
- Granger, D. A., et al. Integration of salivary biomarkers into developmental and behaviorally-oriented research: Problems and solutions for collecting specimens. Physiology and Behavior. 92, 583-590 (2007).
- Frumkin, H. Beyond toxicity: Human health and the natural environment. American Journal of Preventive Medicine. 20, 234-240 (2001).
- Hartig, T., Mitchell, R., de Vries, S., Frumkin, H. Nature and health. Annual Review of Public Health. 35, 207-228 (2014).
- Gidlow, C. J., et al. Where to put your best foot forward: Psycho-physiological responses to walking in natural and urban environments. Journal of Environmental Psychology. 45, 22-29 (2016).
- Ewert, A., Chang, Y. Levels of nature and stress response. Behavioral Sciences. 8 (5), 49 (2018).
- Wyles, K. J., et al. Are some natural environments more psychologically beneficial than others? The importance of type and quality on connectedness to nature and psychological restoration. Environment and Behavior. 51 (2), 111-143 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。