A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحقيق من التفاعلات بين النباتية عبر شبكات مسام الشائعة باستخدام استدارة النوى
In This Article
Summary
معظم النباتات داخل المجتمعات المحتمل مترابطة بالفطريات (ص) مسام أربوسكولار، ولكن تم التحقيق الوساطة للتفاعلات بين النباتية بها أساسا عن طريق زراعة النباتات بمقابل دون ميكورهيزاس. نحن نقدم طريقة للتعامل مع شبكات مسام المشتركة بين النباتات مسام للتحقيق من نتائجها للتفاعلات بين النباتية.
Abstract
الفطريات أربوسكولار مسام (ص) التأثير على امتصاص المغذيات المعدنية النباتية والنمو، ومن ثم فإن لديهم القدرة للتأثير على التفاعلات بين النباتية. قوة نفوذها في mycelia اكستراراديكال التي تنتشر خارج مناطق استنفاد المغذيات وجدت قرب الجذور لربط الأفراد داخل شبكة مسام مشتركة (CMN) في نهاية المطاف. ومع ذلك، حققت معظم التجارب، دور الفطريات صباحا في معمل التفاعلات بزراعة النباتات بمقابل دون مسام الفطريات، أسلوب الذي يفشل في معالجة دور كمنس صراحة. هنا، فإننا نقترح أسلوب الذي تعالج كمنس للتحقيق في دورها في التفاعلات بين النباتية. يستخدم الأسلوب لدينا حاويات تم التعديل مع قيعان المخروطية مع شبكة النايلون و/أو مواد مسعور تغطي فتحات فترة زمنية محددة والأسمدة 15ن رمل خلالي الفقيرة بالمغذيات. يتم ترك كمنس أما سليمة بين الأفراد المتفاعلة، قطعت بالتناوب للحاويات، أو يحول دون تشكيل بحاجز متين. النتائج التي توصلنا إليها تشير إلى أن تدوير حاويات كافية لتعطيل كمنس ومنع آثارها على التفاعلات بين النباتية عبر كمنس. نهجنا مفيد لأنه يحاكي جوانب الطبيعة، مثل شتلات مستغلا كمنس المنشأة بالفعل، واستخدام مجموعة من الفطريات صباحا قد توفر مزايا متنوعة. على الرغم من أن لدينا تجربة محدودة للتحقيق النباتات في مرحلة الشتلة، التفاعلات بين النباتية عبر كمنس يمكن الكشف عن استخدام النهج الذي نتبعه لذلك يمكن تطبيقها للتحقيق البيولوجي تساؤلات بشأن أداء كمنس في النظم الإيكولوجية.
Introduction
الفطريات أربوسكولار مسام (ص) ساعدت النباتات في استعمار الأراضي قبل 460 مليون سنة1 واليوم، وهم سيمبيونتس في كل مكان من معظم النباتات2، تزويدها بالمغذيات المعدنية الحيوية للنمو. خيوط فطرية رقيقة، مثل مؤشر ترابط للفطريات صباحا الأعلاف للمغذيات المعدنية بعد استنفاد المغذيات في المناطق القريبة من الجذور، وكثيراً ما تواجه واستعمار نظم الجذور المجاورة النباتات في "شبكة مسام مشتركة" (CMN). شبكات مسام المشتركة قد تشكل أيضا عندما أنشئ الفطرية جيرملينجس الانضمام إلى شبكات3، أو عندما أشعر بخيوط فطرية الصمامات (أناستوموسي) مع خيوط فطرية كونسبيسيفيك4،5،،من67. مدى هذه خيوط فطرية اكستراراديكال في التربة هائلة، ومع خيوط فطرية اكستراراديكال التي تشكل 20% إلى 30% من التربة مجموع الكتلة الحيوية الميكروبية في البراري والمراعي التربة8 وتمتد ل m·cm 111-3 في المراعي دون عائق9 .
تقسيم شبكات مسام المشتركة المغذيات المعدنية بين المترابطة المجاورة النباتات10،11،،من1213. قد تتلقى النباتات يصل إلى 80% على الفوسفور ونسبة 25 في المائة من احتياجاتها من النتروجين من الفطريات صباحا، مع توفير يصل إلى 20 في المائة إجمالي الثابتة الكربون للفطريات في العودة14. وقد وجدت الجهاز الجذر في المختبر الأخيرة ثقافة العمل أن كمنس تفضيلي تبادل المغذيات المعدنية ذات جذور المضيفة التي توفر معظم الكربون إلى11،الفطريات12. وعلاوة على ذلك، الأنواع المختلفة من الفطريات صباحا قد تختلف في نوعيتها كشركاء التكافلية، مع بعض الفطريات تبادل الفوسفور أكثر للكربون أقل من غيرها15. على الرغم من أن الثقافات الجهاز الجذر نماذج مفيدة لدراسة التكافل صباحا نظراً لأنها تعرض البيئات التي تسيطر عليها بعناية، والقدرة على مراقبة الترابط أصله مباشرة، وهي لا تشمل يطلق النار على photosynthesizing التي تؤثر على العمليات الفسيولوجية الهامة مثل النتح، التمثيل الضوئي، والتغييرات الدافيء، المغذيات الكربون والمعادن، فضلا عن أنها تشكل المصارف.
في الطبيعة، الاستفادة الشتلات على الأرجح كمنس المنشأة بالفعل. حتى وقت قريب، إلا أن العلماء قد فقط بحث أثر الفطريات صباحا في تغذية النباتات بزراعة النباتات مع أو بدون الفطريات صباحا، غالباً مع نوع واحد من الفطريات صباحا. هذا الأسلوب على الرغم من أن هذا العمل كان هائلا مفيدة لفهم ميكورهيزاس أربوسكولار، قد أغفل الدور الحاسم المحتمل الذي قد كمنس في التفاعلات بين النباتات المضيفة مترابطة. على وجه الخصوص، النباتات التي تعتمد اعتماداً كبيرا على الفطريات صباحا لنمو التفاعل الحد الأدنى دون صباحا الفطريات16،17، ربما الخلط وتفسيرنا للتفاعلات الفطريات بوساطة صباحا عند استخدامها ك 'الضوابط' لخط الأساس مرجع.
أننا نقترح نهجاً استدارة النواة للتحقيق في دور كمنس في التفاعلات بين النباتية وهيكله السكان. يحاكي نهجنا مكونات للتكافل صباحا في الطبيعة لأنه أنشأ كله نباتات انضمام كمنس وجميع النباتات تزرع مع الفطريات صباحا. عن طريق إزالة التفاعلات الجذرية، منهجيتنا يركز تحديداً على التفاعلات التي تتوسط فيها الفطريات صباحا حين تتبع حركة المغذيات المعدنية داخل كمنس أيضا. نهجنا يستند إلى الأعمال السابقة التي استخدمت النوى استدارة سواء في الميدان أو في الدفيئة لفهم صباحا أداء واقعية.
الأسلوب الأساسي الذي تمت استدارته قد أنشئت في الأدب كوسيلة للتلاعب بخيوط فطرية اكستراراديكال18،19،،من2021، وكان التناسخات عدة تبعاً للغرض منها على مدى خلال العقدين الماضيين. في البداية، مش أكياس أو الحواجز مما يسمح بنمو خيوط فطرية استخدمت لتوفير حجرات خالية من الجذر تحديد مقدار خيوط فطرية مسام أربوسكولار في التربة22،23. ثم وضعت النوى أسطوانية من التربة محاطة بأنابيب المياه الجامدة أو البلاستيك الأنابيب مع فتحات تغطيها خيوط فطرية، ولكن لا جذور، في شبكة نايلون حدودية. هذه يمكن أن تكون استدارة بسهولة تعطيل mycelia اكستراراديكال18،،من2425. وضعت النوى استدارة بين النباتات والتربة أطوال أصله كل غرام من التربة18، 13ج الدفقات mycelia اكستراراديكال24، أو امتصاص الفوسفور من النوى خالية من النبات كمياً18. وكان آخر استخدام هذه النوى زراعة النباتات داخل كل منها في مجال تخفيض استعمار جذور بالفطريات صباحا من خلال تكرار انقطاع أصله كبديل للتعقيم أو تطبيق مبيدات الفطريات، التي لها آثار غير مباشرة على التربة العضوية هذه المسألة وغيرها الميكروبات18.
وقد استخدمت نهج الحاجز مش أصله التحقيق تقسيم المغذيات والنبات التفاعلات عبر كمنس، لكن في ميكروكوسمس مستطيلة وليس مع استدارة النوى. الدر et al.26 باقتفاء أثر المغذيات المعدنية لتبادل الكربون باستخدام النظائر المشعة عبر كمنس أما الفطور الساعة رهيزوفاجوس التحقيق في التفاعلات بين Linum usitatissimum (الكتان) و ذو لونين السرغوم (الذرة البيضاء) إيريجولاريس أو فونيليفورميس موسى26. مش ميكروكوسمس في المقصورات النبات دراسة شملت بهم مفصولة بحواجز والمقصورات أصله فقط للوصول إلى خيوط فطرية مسام المقصورات أصله المسماة التي تحتوي على نظائر مشعة ومستقرة. واستخدمت الدراسة كعناصر تحكم، علاجات دون مسام الفطريات. أغنية et al.27 تستخدم نهجاً مماثلاً للعثور على هذا النبات إشارات يمكن أن يتم فقط بين كمنس الراسخة موسى ف. عند مصنع واحد مصاب بمسببات الأمراض فطرية. أيضا، وبالمثل إلى26من الدر et al., ميريلد et al.28 نمو النباتات في المقصورات الفردية مفصولة مش للتحقيق في أداء مصنع شتلة بندورة مغد (الطماطم) مرتبطة كبيرة قثد كمنس الزعفران النباتية (خيار) التي تمثل مصدر الكربون وفيرة. كما استخدموا العلاجات دون الفطريات مسام بدلاً من قطع كمنس28. في تجربة ثانية، ذات الصلة، تم فحص الكربون لتبادل الفوسفور استخدام أكياس شبكية المسمى مع 32"ص ميكروكوسمس" مع الحواجز مش أصله و CMN قطع كعلاج تستخدمها جانوس et al.29، الذي حقق التنافسية التفاعلات بين شتلات الأنواع السافانا شجرة اوكالبتوس تيترودونتا وزرع شجرة الغابات المطيرة، دبق ليتسيا. وفي هذا الدراسة، جانوس et al.29 رفع الأجزاء الأخرى التي تحتوي على بذور بضعة سنتيمترات، انزلاق طبقات مش ضد بعضها البعض لكسر الترابط أصله29.
وقد تتمثل الخطوة الأخيرة في تطور الأسلوب الأساسي الذي تمت استدارته زراعة النباتات داخل النوى الموجودة داخل الأواني أو ميكروكوسمس20،30. ويس30 يستخدم النوى استدارة للتأكد مما إذا كان اكستراراديكال صباحا الميسليوم يمكن أن استعمار شتلة صنوبر إليوتي عندما ينتشر من المانحين أو النبات المضيف 'ممرضة' صباحا، تاماريندوس انديكا، وكيف اكستراراديكال الميسليوم من اكتوميكورهيزال الفطريات يؤثر الأداء الشتلات. حاويات كبيرة الشتلات أنبوبي التجارية (جدول المواد) داخل ميكروكوسمس أما البلاستيكية الصلبة (لا كمنس) أو فترة زمنية محددة ومغطاة بغشاء مسعور. حاويات الشتلة فترة زمنية محددة كانت أما عدم استدارة (كمنس سليمة) أو استدارة إلى قطع النوى كمنس. روتاتيد المنشأة مع الحاجز مش مختلفة الأحجام استخدمت من قبل بابيكوفا et al.20 للتحقيق بيلووجروند إشارات عن طريق كمنس بين بيقية فول النباتات (فول). كان مترابطة مصنع الوسطى المانح في ميسوكوسمس قطرها 30 سم في دراستهم، بالجذور وخيوط فطرية (لا الجدار) أو فقط بواسطة كمنس المنشأة من خلال شبكة 40 ميكرومتر. قطعت محطات مركزية من التفاعلات مع النباتات المجاورة من خلال تناوب النوى المغلقة على شبكة، أو منعوا كمنس بشبكة 0.5 ميكرومتر غرامة أرفق الأساسية.
نقدم هنا، أسلوب الذي يجمع بين جوانب النهج استدارة النواة السابقة لدراسة تأثير كمنس على التفاعلات بين النباتية مباشرة جنبا إلى جنب مع تتبع النظائر المستقرة. لدينا أسلوب يستخدم نهج 'النباتات مستهدفة'، الذي محاط بالمحطة المركزية لمصلحة النباتات المجاورة. نباتات تزرع داخل الحاويات الشتلات للتدوير التي هي فترة زمنية محددة ومغطاة بنايلون مش الشاشة الحريرية، غشاء مسعور، أو البلاستيكية الصلبة غير معدلة. شبكات مسام مشتركة يتم فصل مرة واحدة في أسبوع أو الاحتفاظ بها سليمة، والنظائر المستقرة 15N تتبع حركة النيتروجين من استدارة النوى الجيران إلى المحطة المركزية المستهدفة. وبمقارنة حجم النبات بامتصاص النظائر مستقرة والمغذيات المعدنية، علينا أن نقيم النباتات التي قد تستفيد أو تعاني من كمنس في التفاعلات بين النباتات المضيفة.
Protocol
1-بناء وتجميع النوى للتدوير
- تعديل الحاويات التجارية الشتلات أنبوبي (فيما بعد باسم 'الحاويات'؛ جدول المواد) أن يكون 19 مم × 48 سم طول الفتحات.
- استخدام صحفي حفر حفرة 19 ملم مع رأي دون حفر تويست المركزية، تجريبي، قطع اثنين من الثقوب، واحدة فوق الأخرى، في الجانبين من حاوية (قطره 2.5 سم × الطول 12.1 سم) حيث تكون الثقوب حوالي 1 سم عن بعضها البعض. عقد الحاوية ضد سياج على الصحافة الحفر وقد توقف مع وتد قصيرة التي تناسب داخل الحاوية للمساعدة على الاحتفاظ بها في مكان أثناء الحفر. استخدام حاوية بلاستيكية مرنة لمنع تكسير.
- قص قطعة رقيقة المتبقية من البلاستيك بين الثقوب مقص، وقطع الأسلاك أو القصاصات القصدير (لاستخدام البلاستيك الجامد سيبر-منشار) تجعل المرء ممدود فتح حوالي 2 سم وطولها 5 سم.
- كرر الخطوات 1.1.1-1-1-2 على الجانب المعاكس من الحاوية.
- تغطية الفتحات مع شبكة النايلون و/أو الغشاء مسعور (الشكل 1A).
- قطع شبكة النايلون مع 40 ميكرومتر المسام إلى قطع 9.5 سم × 8.5 سم. قطع العديد من القطع كما توجد حاويات.
- الصق شبكة النايلون خارجياً على الحاويات تغطي كل الفتحات مع بعض تداخل طفيف في النسيج باستخدام الغراء الساخنة عالية القوة، والصناعية.
- إذا كانت هناك حاجة إلى منع حركة المياه، مثل عند استخدام المغذيات للذوبان في الماء أو النظائر، تغطي طبقة شبكة النايلون مع غشاء مسعور31،32 (جدول المواد) التي تسمح وأنا خيوط فطرية فطر إلى تمرير، ولكن فقط حركة بخار الماء والماء السائل لا.
- ضع الغراء الساخنة حول الفتحات في الحاوية وعلى طول حواف مش نايلون طويلة. لفة الحاوية على نسيج لتجنب حرق الأصابع. إضافة طبقة من الغراء على طول الحافة النسيج حيث حواف الشبكة التداخل. اضغط على حافتها على بعض الورق المقوى ختم ذلك بشدة. دائماً لفة دائماً في اتجاه واحد سوف يكون نفس اتجاه دوران الحاويات الانتهاء داخل الأواني أو ميكروكوسمس حيث أنه سيتم دفع حافة شبكة متراكبة لا يحتمل أن حفر في الركيزة.
- مرة واحدة وقد بردت الغراء، الشريط نهايات النسيج إلى الحاوية للحيلولة دون حواف فضفاضة والنسخ من القرص المضغوط باستخدام شريط مرنة، مثل شريط كهربائي لأعلى وأسفل.
- باستخدام الشريط نفسه كما هو الحال في الخطوة 1.2.5، تغطية الثقوب الصغيرة على جانبي نهاية المخروطية (لا الثقب في غيض من الجزء السفلي) لكل حاوية لمنع نمو الجذر خارج الحاوية إلى باقي الوعاء/مصغرة.
- لمنع فقدان التربة مع توفير الصرف الصحي، وضع رخام زجاج في الجزء السفلي من كل حاوية.
- معاملة السيطرة التي لا تنطوي على أي احتمال CMN إلى النموذج بين النباتات، استخدام الحاويات الصلبة، غير معدلة (الشكل 1A).
2-الجمعية من الأواني أو ميكروكوسمس لتناسب نهايات مخروطية الشكل للحاويات
- لضمان حاويات يقف منتصبا في وضع ثابت والتصريف السليم، اقلب وعاء حيث أن الجزء السفلي هو مواجهة. قص حول الجزء السفلي من الوعاء، وترك شفة صغيرة للدعم، باستخدام منشار-سيبر.
- إعداد رغوة البوليسترين
- قطع البوليسترين الرغوي، حوالي 36 مم، بنفس القطر كالجزء السفلي من وعاء استخدام المنشار الشريطي مع رقصة قطع الدائرة.
- شهد حفر ثقوب في الرغاوي في استخدام ثقب الحفر الصحافة و 19 مم (بدون حفر تويست مركزية) في النمط الذي سيتم وضع الحاويات.
- لتجربة نبات المستهدف، حفر حفرة مركزية مع ثقوب متباعدة بالتساوي للمجاورة للأفراد المحيطة به. لوعاء يبلغ قطرها 15.5 سم، ثقوب الفضاء ستة 12 مم وبصرف النظر حول محيط دائرة قطرها 11 سم (الشكل 1B).
- تخطيط الثقوب هاكسغنلي أو في مصفوفة مربعة (الشكل 1، د) لتجربة مصغرة.
3-ملء الحاويات والأواني مع مخاليط التربة والرمال
- تحديد خليط تربة المطلوبة وإضافة أنا الفطريات حقل تجميع أو العدوى مثقف وعاء للتربة بشكل موحد خلط مقطعة قطع الجذر (طولها 1-2 سم) جيدا بالتربة. مزيج التربة المطلوب مع السليكا العقم حبات الرمل أو الزجاج لتقليل تركيز المغذيات المعدنية المتاحة للنباتات.
- ضع الحاويات المملوءة في حفر أسفل رغوة أو مصغرة وملء المساحة المتداخلة مع الركيزة العقم.
- ملء المساحة المتداخلة بين الحاويات مع خليط السليكا الفقيرة بالمغذيات الرمال باستخدام قمع للمساعدة في ملء الفراغات الصغيرة. لضمان تصريف المياه الكافية وتقليد نسيج التربة، ومزيج المتوسط الرمل حجم الجسيمات، مثل الصف 6-20، مع الرمل حجم الجسيمات الصغيرة، مثل الصف 30-65، في خلاط الأسمنت.
4-إنشاء كمنس طوال الأواني/ميكروكوسمس
- مصنع مصانع المعالجة المسبقة 'ممرضة' الأنواع المرغوبة في كل حاوية للحفاظ على الفطريات صباحا حيث أنه يمكن أن ينتشر بين الحاويات وإنشاء كمنس.
- عندما وضعت كافة الحاويات الشتلات، إزالة يطلق النار بالقطع حتى يظل هذا فرد واحد فقط في كل حاوية.
- تسمح 2-3 أشهر لنمو النبات وإنشاء CMN.
5-إنشاء محطات تجريبية والعلاجات
- زرع محطات تجريبية ببذر أو زرع في حاويات. إذا كان البذر، الانتظار حتى يصبح جميع الحاويات شتلات نبتت قبل إزالة النباتات ممرضة قبل العلاج بالقطع ما يطلق النار على. إذا كان زرع، مقطع محطات المعالجة قبل كل شيء قبل زراعة الشتلات تجريبية لمنع الآثار التنافسية غير مقصودة.
- وضع علاجات CMN أما ترك الحاويات لا تحرك خلال مدة التجربة (كمنس سليمة) أو استدارتها التنزيلات فعلياً قطع خيوط فطرية تمتد بين الحاويات المعدلة (كمنس مقطوعة؛ الشكل 1A). عند قطع كمنس، قم بتدوير كل حاوية من خلال تناوب كامل واحد لتجنب تغيير سطحي التفاعلات، خاصة بالنسبة للنباتات انتهج عن غير قصد.
- المياه بشدة جميع الأواني أو ميكروكوسمس فورا بعد التدوير لإعادة تأسيس الاتصال بين الجانبين للحاويات والركيزة المتداخلة.
6-تتبع حركة المغذيات المعدنية عبر كمنس
- تسميد النباتات المجاورة مع 0.5% 15ن أثري كنو3 و NH4Cl.
- تسميد الفرد المستهدف مع أسمدة 14N تساوي التركيز.
7-رصد وصيانة للتجربة
- بانتظام (على الأقل شهريا) إعادة بطريقة عشوائية ومواقف الأواني أو ميكروكوسمس على مدى التجربة.
- الأسبوعية قياس النمو، مثل الارتفاع أو أطول ورقة الطول (للأعشاب) لرصد عندما يبدأ النمو بطء، لأن من المهم أن الحصاد قبل أن تصبح النباتات الجذرية زمنياً.
8-حصاد التجربة
- مقطع جميع الأنسجة سطحي ووضع النباتات الفردية في مغلفات المسمى بتحديد العلاج ووعاء أو مصغرة، والموقف.
- الأنسجة فوق الأرض الجافة عند 60 درجة مئوية للوزن المستمر. قياس الوزن الجاف لكل الأنسجة النباتية.
- السماح للتربة الجافة قبل استخراج الحاويات وحصاد الجذور.
- دقة وزر التربة كثير ممكن من نظم الجذور وغسلها في وعاء للمياه أو تحت تيار لطيف من المياه في غربال حجم المسام 250 ميكرون.
- السماح لجذور أيردري وتزن جذر النظام برمته.
- مقطع نظام الجذر جزافا، وتخزين أجزاء الجذر في الإيثانول 50%. بعد أنها ملطخة33، استخدام هذه الشظايا للتحديد الكمي لاستعمار الجذر باستخدام أسلوب تقاطع خطوط الشبكة34.
- إعادة وزن جذر النظام المتبقية وتخزينها في مظروف ورق مسمى الجافة عند 60 درجة مئوية لتقييم الوزن الجاف. تستخدم المعادلة التالية لحساب وزن النظام الجذر بأكمله:
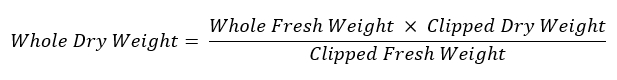
9-تحليل النظائر المغذيات ومستقرة المعدنية
- مجموعة الشتلات بالكتلة الأحيائية في "عشيرات" أو المجموعات 10، "أوكتيليس" أو 8 مجموعات، "quartiles" أو أربع مجموعات، إلخ بعد رتبة-يأمر لهم بالوزن إذا كانت كمية الأنسجة منخفضة جداً للحد الأدنى من المتطلبات الهضم لتحديد المغذيات المعدنية تركيزات.
- إرسال عينات ورقي إلى مختبر المتعاقد عليها لتحليل النظائر مستقرة والمغذيات المعدنية (جدول المواد).
- وصف وفرة النظائر المشعة باستخدام التعبير العرفي التالي:
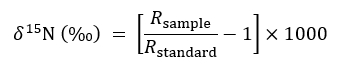
حيث تمثل R 15N/14ن نسبة من عينة أو المعيار الذي هو الغلاف الجوي أ. - استخدام غير المعدلة، معالجة الحاويات الصلبة ليكون بمثابة عنصر تحكم للخلفية 15ن نسب في معادلة توازن الكتلة التالية عند التحديد الكمي لمقدار 15ن تناول نبات المستهدف في فصل أو علاجات CMN سليمة:
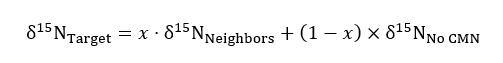
δ15N يمثل وفرة النظائر المشعة للأهداف، والجيران، والنباتات المستهدفة في لا معاملة CMN، حيث يمثل x (ككسر عشري) النيتروجين النسبة المئوية التي حصلت عليها المصنع المستهدف من الحاويات الجار الذي تمت إضافة التسمية. Δ15نالجيران هي الحصول على قيم للجيران تتكون كل محطة الهدف.
- وصف وفرة النظائر المشعة باستخدام التعبير العرفي التالي:
النتائج
لتحديد كيف كمنس قد تؤثر في أداء المصنع من خلال تقسيم المغذيات، ونحن نمت بيتمان لحية الرجل ، وعشب البراري مهيمنة، في تجربة نبات المستهدف مع الجيران متباعدة بنفس الدرجة 6 وسليمة، وقطعت، أو لا كمنس. وجدنا أن قطع أو منع كمنس تضاءل الأوزان أهداف الجافة سطحي (ال?...
Discussion
النتائج التي توصلنا إليها تؤكد أن أسلوبنا الأساسية استدارة حادة يمكن التركيز على دور كمنس في التفاعلات بين النباتية بيلووجروند. وهناك العديد من الخطوات الهامة في البروتوكول، ومع ذلك، إذا غيرت، لديها إمكانية للتأثير على القدرة على الكشف عن آثار CMN. من الضروري ملء الحاويات المحيطة بها منطق...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
نود أن أشكر المراجعين المجهول لاقتراحاتهم. ونشكر أيضا الجامعيين العديد الذين ساعد مع تشييد الأواني، ميكروكوسمس، وفترة زمنية محددة الحاويات وقد ساعدت منظمة الصحة العالمية مع الحفاظ على وحصاد التجارب. ونشكر أيضا كلية الوسطى الشمالية لأموال بدء التشغيل (إلى جي دبليو) والمرافق الحالية، فضلا عن فويسشوفسكي أشلي للحصول على "شمال وسط كلية ريختر منحة" دعم تجربة استخدام هذه الأساليب. جزء من هذا العمل مولت على "الوطنية العلم الدكتوراه أطروحة تحسين منحة من مؤسسة" (ديب-1401677).
Materials
| Name | Company | Catalog Number | Comments |
| Commercial tubular seedlings container (called 'containers' in the manuscript) | Stuewe and Sons, Inc | Ray Leach Cone-tainer ™ | RLC3U |
| Course glass beads | Industrial Supply, Inc. | 12/20 sieve | Size #1 |
| Course silica sand | Florida Silica Sand | 6/20 50lb bags | None |
| Fine glass beads | Black Beauty | Black Beauty FINE Crushed Glass Abrasive (50 lbs) | BB-Glass-Fine |
| Hydrophobic membrane | Gore-tex | None | None |
| Large commercial tubular seedling containers | Stuewe and Sons, Inc. | Deepot ™ | D16L |
| Medium silica sand | Florida Silica Sand | 30/65 50 lb bags | None |
| Nylon mesh | Tube Lite Company, Inc. | Silk screen | LE7-380-34d PW YEL 60/62 SEFAR LE PECAP POLYESTER |
| Soil and foliar nutrient analysis facility | Kansas State University Soil Testing Lab | None | None |
| Stable isotope core facility | University of Miami | None | None |
References
- Remy, W., Taylor, T. N., Hass, H., Kerp, H. Four hundred-million-year-old vesicular arbuscular mycorrhizae. Proceedings of the National Academy of Sciences of the United States of America. 91 (25), 11841-11843 (1994).
- Smith, S. E., Read, D. J. . Mycorrhizal Symbiosis. , (2008).
- Giovannetti, M., Avio, L., Sbrana, C. . Mycorrhizal Networks. , 41-67 (2015).
- Giovannetti, M., Sbrana, C., Cresti, A., Heath, M., Geitmann, I. B. . Cell Biology of Plant and Fungal Tip Growth. Vol. 328. Nato Science Series, Sub-Series I: Life and Behavioural Sciences. , 221-231 (2001).
- Giovannetti, M., Sbrana, C., Avio, L., Strani, P. Patterns of below-ground plant interconnections established by means of arbuscular mycorrhizal networks. New Phytologist. 164 (1), 175-181 (2004).
- Avio, L., Pellegrino, E., Bonari, E., Giovannetti, M. Functional diversity of arbuscular mycorrhizal fungal isolates in relation to extraradical mycelial networks. New Phytologist. 172 (2), 347-357 (2006).
- Giovannetti, M., et al. At the root of the wood wide web: self recognition and nonself incompatibility in mycorrhizal networks. Plant Signaling & Behavior. 1 (1), 1-5 (2006).
- Miller, R., Kling, M. J. The importance of integration and scale in the arbuscular mycorrhizal symbiosis. Plant and Soil. 226 (2), 295-309 (2000).
- Miller, R., Jastrow, J., Reinhardt, D. R. External hyphal production of vesicular-arbuscular mycorrhizal fungi in pasture and tallgrass prairie communities. Oecologia. 103 (1), 17-23 (1995).
- Weremijewicz, J., Sternberg, L. d. S. L. O., Janos, D. P. Common mycorrhizal networks amplify competition by preferential mineral nutrient allocation to large host plants. New Phytologist. , (2016).
- Fellbaum, C. R., et al. Fungal nutrient allocation in common mycorrhizal networks is regulated by the carbon source strength of individual host plants. New Phytologist. 203 (2), 646-656 (2014).
- Lekberg, Y., Hammer, E. C., Olsson, P. A. Plants as resource islands and storage units--adopting the mycocentric view of arbuscular mycorrhizal networks. FEMS Microbiol Ecol. 74 (2), 336-345 (2010).
- Jakobsen, I., Hammer, E. C. . Mycorrhizal Networks. , 91-131 (2015).
- Jakobsen, I., Rosendahl, L. Carbon flow into soil and external hyphae from roots of mycorrhizal cucumber plants. New Phytologist. 115 (1), 77-83 (1990).
- Kiers, E. T., et al. Reciprocal rewards stabilize cooperation in the mycorrhizal symbiosis. Science. 333 (6044), 880-882 (2011).
- Hartnett, D. C., Hetrick, B. A. D., Wilson, G. W. T. Mycorrhizal influence on intra- and interspecific neighbour interactions among co-occuring prairie grasses. Journal of Ecology. 81 (4), 787-795 (1993).
- Hetrick, B. A. D., Wilson, G. W. T., Todd, T. C. Differential responses of C3 and C4 grasses to mycorrhizal symbiosis, phosphorus fertilization, and soil microorganisms. Canadian Journal of Botany. 68 (3), 461-467 (1990).
- Johnson, D., Leake, J. R., Read, D. J. Novel in-growth core system enables functional studies of grassland mycorrhizal mycelial networks. New Phytologist. 152 (3), 555-562 (2001).
- Leake, J. R., et al. Networks of power and influence: the role of mycorrhizal mycelium in controlling plant communities and agroecosystem functioning. Canadian Journal of Botany-Revue Canadienne De Botanique. 82 (8), 1016-1045 (2004).
- Babikova, Z., et al. Underground signals carried through common mycelial networks warn neighbouring plants of aphid attack. Ecology Letters. 16 (7), 835-843 (2013).
- Schüepp, H., Miller, D. D., Bodmer, M. A new technique for monitoring hyphal growth of vesicular-arbuscular mycorrhizal fungi through soil. Transactions of the British Mycological Society. 89 (4), 429-435 (1987).
- Miller, D. D., Bodmer, M., Schüepp, H. Spread of endomycorrhizal colonization and effects on growth of apple seedlings. New Phytologist. 111 (1), 51-59 (1989).
- Jakobsen, I., Gazey, C., Abbott, L. K. Phosphate transport by communities of arbuscular mycorrhizal fungi in intact soil cores. New Phytologist. 149 (1), 95-103 (2001).
- Johnson, D., Leake, J., Ostle, N., Ineson, P., Read, D. J. In situ 13CO2 pulse‐labelling of upland grassland demonstrates a rapid pathway of carbon flux from arbuscular mycorrhizal mycelia to the soil. New Phytologist. 153 (2), 327-334 (2002).
- Johnson, D., Leake, J., Read, D. J. Transfer of recent photosynthate into mycorrhizal mycelium of an upland grassland: short-term respiratory losses and accumulation. of 14C. Soil Biology and Biochemistry. 34 (10), 1521-1524 (2002).
- Walder, F., et al. Mycorrhizal networks: Common goods of plants shared under unequal terms of trade. Plant Physiology. 159 (June 2012), 789-797 (2012).
- Song, Y. Y., et al. Interplant communication of tomato tlants through underground common mycorrhizal networks. Plos One. 5 (10), e13324 (2010).
- Merrild, M. P., Ambus, P., Rosendahl, S., Jakobsen, I. Common arbuscular mycorrhizal networks amplify competition for phosphorus between seedlings and established plants. New Phytologist. 200 (1), 229-240 (2013).
- Janos, D. P., Scott, J., Aristizábal, C., Bowman, D. M. J. S. Arbuscular-mycorrhizal networks inhibit Eucalyptus tetrodonta seedlings in rain forest soil microcosms. Plos One. 8 (2), e57716 (2013).
- Wyss Lozano Hoyos, T. . Pinus elliottii var. densa Seedling Performance Reflects Ectomycorrhizas, Soil Nutrient Availability and Root Competition. , (2010).
- Mäder, P., Vierheilig, H., Alt, M., Wiemken, A. Boundries between soil compartments formed by microporous hydrophobic membranes (GORE-TEX) can be crossed by vesicular-arbuscular mycorrhizal fungi but not by ions in the soil solution. Plant and Soil. 152, 201-206 (1993).
- Mäder, P., et al. Transport of 15N from a soil compartment separated by a polytetrafluoroethylene membrane to plant roots via the hyphae of arbuscular mycorrhizal fungi. New Phytologist. 146 (1), 155-161 (2000).
- Brundrett, M., Bougher, N., Dell, B., Grove, T. . Working with Mycorrhizas in Forestry and Agriculture. , (1996).
- McGonigle, T. P., Miller, M. H., Evans, D. G., Fairchild, G. L., Swan, J. A. A new method which gives an objective-measure of colonization of roots by vesicular arbuscular mycorrhizal fungi. New Phytologist. 115 (3), 495-501 (1990).
- Weremijewicz, J., Janos, D. P. Common mycorrhizal networks amplify size inequality in Andropogon gerardii monocultures. New Phytologist. 198 (1), 203-213 (2013).
- Weremijewicz, J., O’Reilly, L. d. S. L., Janos, D. P. Arbuscular common mycorrhizal networks mediate intra-and interspecific interactions of two prairie grasses. Mycorrhiza. , 1-13 (2017).
- Weiner, J. Asymmetric competition in plant populations. Tree. 5 (11), 360-364 (1990).
- Damgaard, C., Weiner, J. Describing inequality in plant size or fecundity. Ecology. 81 (4), 1139-1142 (2000).
- Johnson, C. R., Joiner, J. N., Crews, C. E. Effects of N, K, and Mg on growth and leaf nutrient composition of 3 container grown woody ornamentals inoculated with mycorrhizae. Journal of the American Society for Horticultural Science. 105 (2), 286-288 (1980).
- Estrada-Luna, A. A., Davies, F. T., Egilla, J. N. Mycorrhizal fungi enhancement of growth and gas exchange of micropropagated guava plantlets (Psidium guajava L.) during ex vitro acclimatization and plant establishment. Mycorrhiza. 10 (1), 1-8 (2000).
- Hurlbert, S. H. Pseudoreplication and the design of ecological field experiments. Ecological Monographs. 54 (2), 187-211 (1984).
- Argüello, A., et al. Options of partners improve carbon for phosphorus trade in the arbuscular mycorrhizal mutualism. Ecology Letters. 19 (6), 648-656 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved