È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Studio delle interazioni pianta tutte le comuni reti Mycorrhizal utilizzando core ruotati
In questo articolo
Riepilogo
Maggior parte delle piante all'interno delle comunità probabilmente sono collegati tra loro da funghi (AM) micorrizici arbuscolari, ma mediazione delle interazioni pianta da loro è stato studiato principalmente da coltivazione di piante con rispetto senza micorrize. Presentiamo un metodo per modificare reti mycorrhizal comuni tra piante micorrizate per indagare le conseguenze per le interazioni pianta.
Abstract
(AM) micorrizici arbuscolari influenzano la crescita e l'assorbimento dei nutrienti minerali della pianta, quindi, hanno il potenziale per influenzare le interazioni pianta. Il potere della loro influenza è in extraradical Miceli che si diffondono di là di zone di svuotamento nutriente nei pressi di radici di interconnettere, in definitiva, gli individui all'interno di una rete comune micorrizici (CMN). Maggior parte degli esperimenti, tuttavia, hanno studiato il ruolo dei funghi AM nelle interazioni pianta da coltivazione di piante con rispetto senza funghi micorrizici, un metodo che non riesce ad affrontare in modo esplicito il ruolo di CMNs. Qui, vi proponiamo un metodo che manipola CMNs per studiare il loro ruolo nelle interazioni pianta. Il nostro metodo utilizza modificate contenitori con fondo conico con una maglia di nylon e/o materiale idrofobico che coprono con intaglio aperture, il fertilizzante 15N e una sabbia interstiziale dei sostanza-poveri. CMNs sono lasciato sia intatto tra individui interagenti, interrotta mediante rotazione dei contenitori, o impedito formando una barriera solida. I nostri risultati suggeriscono che contenitori di rotazione è sufficiente per interrompere CMNs e impedire che i loro effetti sulle interazioni pianta su CMNs. Il nostro approccio è vantaggioso perché imita gli aspetti della natura, come piantine toccando in CMNs già stabilita e l'uso di una suite di funghi AM che può fornire diversi benefici. Anche se il nostro esperimento è limitato a indagare le piante nella fase del semenzale, interazioni pianta attraverso CMNs possono essere rilevati tramite il nostro approccio che quindi può essere applicato su questioni biologiche sul funzionamento di CMNs negli ecosistemi.
Introduzione
(AM) micorrizici arbuscolari assistita piante nella colonizzazione della terra 460 milioni anni fa1 e oggi, sono simbionti onnipresente della maggior parte delle piante2, fornendo loro le sostanze nutrienti minerali vitali per la crescita. Le ife sottili, filiformi di funghi AM foraggio per nutrienti minerali di là di zone di svuotamento nutriente vicino radici, spesso incontrando e colonizzando i sistemi della radice delle vicine piante in una "rete micorrizici comune" (CMN). Reti mycorrhizal comuni possono formare anche quando germlings fungine join stabilito reti3, o quando sto IFE fusibile (anastomotizzare) con ife conspecifici4,5,6,7. La portata di queste ife extraradical nel terreno è enorme, con extraradical IFE che costituiscono il 20% al 30% della biomassa microbica del suolo totale nella prateria e terreni di pascolo8 e si estende per m·cm 111-3 in pascolo indisturbato9 .
Reti mycorrhizal comuni partizione nutrienti minerali tra interconnessi vicine piante10,11,12,13. Piante possono ricevere fino a 80% di loro fosforo e 25% del loro fabbisogno di azoto da funghi AM, fornendo al contempo fino al 20% del loro totale carbonio ai funghi in fisso ritorno14. Recente lavoro di cultura in vitro radice dell'organo ha trovato che CMNs preferenzialmente scambio di nutrienti minerali con radici di host che forniscono la maggior parte del carbonio ai funghi11,12. Inoltre, diverse specie di funghi AM possono differire nella loro qualità come partner simbiotico, con alcuni funghi lo scambio più fosforo per meno carbonio rispetto ad altri15. Anche se colture d'organo radice sono utili modelli per lo studio la simbiosi AM perché presentano ambienti accuratamente controllati e la possibilità di osservare direttamente le interconnessioni ifale, essi non includono fotosintesi germogli che interessano importanti processi fisiologici come la fotosintesi, traspirazione e variazioni diurne, anche come costituenti carbonio e minerali nutrienti affonda.
In natura, piantine più probabile attingere CMNs già stabilita. Fino a poco tempo, tuttavia, gli scienziati hanno solo esaminato l'impatto dei funghi AM sulla nutrizione delle piante da coltivazione di piante con e senza funghi AM, spesso con una singola specie di fungo AM. Anche se questo lavoro è stato tremendamente informativo alla nostra comprensione di micorrize arbuscolari, questo metodo ha trascurato il ruolo potenzialmente cruciale che CMNs possono avere nelle interazioni tra piante ospiti interconnessi. In particolare, piante che dipendono fortemente dai funghi AM per crescita interagiscono minimamente senza AM funghi16,17, possibilmente confondendo la nostra interpretazione delle interazioni di fungo-mediata AM quando utilizzato come 'controlli' per baseline riferimento.
Noi proponiamo un approccio ruotato-core per indagine sul ruolo di CMNs nelle interazioni pianta e strutturazione della popolazione. Il nostro approccio imita componenti della simbiosi AM in natura perché intere piante join stabilita che CMNs e tutte le piante sono coltivate con funghi AM. Rimuovendo le interazioni di radice, la nostra metodologia si concentra in particolare sulle interazioni mediate da funghi AM mentre si tracciano anche nutriente minerale movimento all'interno di CMNs. Il nostro approccio si basa sul precedente lavoro che ha utilizzato Core ruotati sia nel campo e in serra per capire AM funzionamento realisticamente.
Il metodo di base ruotato è stato stabilito nella letteratura come un metodo per manipolare le ife extraradical18,19,20,21, e ha avuto diverse reincarnazioni a seconda del suo scopo sopra negli ultimi due decenni. Inizialmente, i sacchetti della maglia o barriere permettendo in crescita di ife sono state utilizzate per fornire privo di radice scomparti per quantificare l'importo di ife micorrizici arbuscolari nel suolo22,23. Quindi, nuclei cilindrici di terreno racchiuso in tubi rigidi di acqua o di plastica della tubazione con slot coperto in una rete di nylon penetrabile da ife, ma non le radici, sono stati sviluppati. Questi potrebbe facilmente essere ruotati per interrompere Miceli extraradical18,24,25. I nuclei ruotati sono stati collocati tra piante e suolo ifale lunghezze per grammo di terreno18, 13C flussi di Miceli extraradical24, o l'assorbimento di fosforo dai nuclei di stabilimento-libera sono stati quantificati18. Un altro uso di tali nuclei era far crescere le piante all'interno di essi nel campo per ridurre la colonizzazione delle radici dai funghi AM attraverso frequenti interruzioni ifale come alternativa alla sterilizzazione o l'applicazione dei fungicidi, entrambi i quali hanno effetti indiretti sul suolo organico questione e altri microbi18.
L'approccio di barriera ifale maglia è stato utilizzato per indagare il partizionamento dei nutrienti e interazioni della pianta attraverso CMNs, ma in microcosmi rettangolari anziché con core ruotati. Walder et al.26 studiato le interazioni tra usitatissimum di Linum (lino) e sorgo bicolore (sorgo) tracciando nutrienti minerali per lo scambio di carbonio utilizzando isotopi attraverso CMNs di uno dei funghi AM Rhizophagus irregularis o Funneliformis mosseae26. I microcosmi nei propri scomparti di pianta studio comprendeva separati da mesh barriere, ifale scomparti accessibili solo ai hyphae micorrizici e con etichettate scompartimenti hyphal che conteneva gli isotopi radioattivi e stabili. Come controlli, lo studio utilizzato trattamenti senza funghi micorrizici. Canzone et al.27 usato un approccio simile per trovare quella pianta segnali potrebbero essere trasportati solo tra CMNs stabilito di F. mosseae quando una pianta è stata infettata da un agente patogeno fungoso. Inoltre, analogamente a Walder et al.26, Merrild et al.28 è cresciuto piante in singoli compartimenti separati da maglia per indagare le prestazioni dell'impianto delle piantine di Solanum lycopersicum (pomodoro) collegati da CMNs a un grande Cucumis sativus pianta (cetriolo) che hanno rappresentato una fonte di carbonio abbondante. Utilizzavano anche trattamenti senza funghi micorrizici invece di troncare CMNs28. In un esperimento in secondo luogo, correlato, carbonio per lo scambio di fosforo è stato esaminato usando sacchetti della maglia etichettati con 32P. microcosmi con maglia ifale barriere e CMN severing come trattamento sono state usate da Janos et al29, che ha studiato competitivo interazioni tra piantine delle specie arboree savana Eucalyptus tetrodonta e trapianti dell'albero della foresta pluviale, Litsea glutinosa. In quanto Studio, Janos et al.29 sollevato scomparti contenenti piantine di pochi centimetri, scorrevole strati di maglia uno contro l'altro per rompere le interconnessioni ifale29.
Il passaggio finale nell'evoluzione del metodo ruotato core è stato far crescere le piante all'interno di nuclei che sono all'interno di vasi o microcosmi20,30. Wyss30 utilizzato Core ruotati per accertare se il micelio AM extraradical potrebbe colonizzare semenzali di Pinus elliottii quando si diffondono da un donatore o pianta ospite 'infermiere' AM, Tamarindus indicae come extraradical micelio di ectomicorrizici funghi influenza le prestazioni del semenzale. Contenitori di grande commerciale semenzale tubolare (Tabella materiali) all'interno di microcosmi erano entrambi plastica solida (nessun CMNs) o fessurati e coperti con una membrana idrofobica. Con intaglio semenzale contenitori erano entrambi non ruotato (CMNs intatto) o ruotato per sever stabilito CMNs. ruotata nuclei con barriera di maglie di diverse dimensioni sono stati utilizzati da barretta et al.20 per indagare necromassa segnalazione attraverso CMNs tra Vicia FABA piante (fagiolo). Nel loro studio, una pianta centrale donatore in 30 cm diametro mesocosmi fu collegata da radici e IFE (nessuna barriera) o solo da CMNs stabilito attraverso una maglia di 40 μm. Impianti centrali furono recisi da interazioni con le piante vicine attraverso la rotazione dei nuclei racchiuso in maglia o CMNs sono stati impediti da una maglia fine 0,5 μm che racchiude il nucleo.
Qui, presentiamo un metodo che combina aspetti dei precedenti approcci ruotato-core per esaminare l'influenza di CMNs sulle interazioni pianta diretto combinato con l'analisi degli isotopi stabili. Il nostro metodo utilizza un approccio «impianto di destinazione», in cui la pianta centrale di interesse è circondata da piante vicine. Le piante sono coltivate all'interno di contenitori di semenzale ruotabile che sono fessurati e coperti con maglia di nylon del silk-screen, membrana idrofobica, o sono di plastica solida non modificato. Reti mycorrhizal comuni sono reciso una volta a settimana o mantenute intatte, e isotopi stabili 15N traccia il movimento di azoto da nuclei ruotato dei vicini all'impianto di destinazione centrale. Confrontando le dimensioni dell'impianto con assorbimento dell'isotopo stabile e nutrienti minerali, valutiamo quali piante possono beneficiare o soffrono di CMNs nelle interazioni tra piante ospiti.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. costruzione e montaggio di nuclei ruotabile
- Modificare contenitori commerciali semenzale tubolare (successivamente chiamato 'contenitori'; Tabella materiali) per avere 19 mm di larghezza x aperture lunghezza 48cm.
- Utilizzando un trapano con un foro di 19 mm visto senza una punta centrale, pilota, taglia due fori, uno sopra l'altro, ai lati di un contenitore (diametro 2,5 cm x 12,1 cm di lunghezza) in modo che i fori sono circa 1 cm di distanza. Tenere il contenitore contro una recinzione sulla pressa di trivello e hanno una fermata con un breve tassello che si inserisce all'interno del contenitore per aiutare a tenerlo in posizione durante la perforazione. Utilizzare un contenitore di plastica flessibile per evitare fessurazioni.
- Tagliare il pezzo restante sottile di plastica tra i fori con forbici, un filo di lama o forbici (per plastica rigida utilizzare una sega a sciabola) per fare uno allungata apertura circa 2 cm di larghezza e 5 cm di lunghezza.
- Ripetere i passaggi da 1.1.1-1.1.2 sul lato opposto del contenitore.
- Non coprire le aperture con rete di nylon e/o membrana idrofobica (Figura 1A).
- Maglia di nylon con 40 μm pori tagliate a pezzi di 9,5 x 8,5 cm. Tagliare a pezzi come molti come ci sono contenitori.
- Incollare la rete di nylon esternamente su contenitori per coprire entrambe le aperture con qualche leggera sovrapposizione nel tessuto con colla a caldo ad alta resistenza, industriale.
- Se è necessaria la prevenzione del movimento dell'acqua, tali come quando si utilizza sostanze nutrienti solubili in acqua o isotopi stabili, coprire lo strato di maglia di nylon con una membrana idrofobica31,32 (Tabella materiali) che permette sono ife del fungo a Pass, ma solo il movimento del vapore acqueo e acqua non liquida.
- Posto la colla a caldo intorno alle aperture sul contenitore e lungo i bordi lunghi di maglia di nylon. Rotolare il contenitore sul tessuto per evitare di bruciare le dita. Aggiungere uno strato di colla lungo il bordo del tessuto dove la maglia bordi si sovrappongono. Premere il bordo su qualche cartone per sigillarlo con fermezza. Avvolgere sempre costantemente in una direzione che sarà la stessa direzione della rotazione dei contenitori finiti all'interno di vasi o microcosmi in modo che il bordo della mesh sovrapposte non sarà spinto a potenzialmente scavare nel substrato.
- Una volta che la colla si è raffreddata, nastro l'estremità superiore e inferiore del tessuto al contenitore per evitare bordi sciolti e ripping utilizzando un nastro flessibile, ad esempio un nastro da elettricista.
- Usando lo stesso nastro come al punto 1.2.5, coprire i piccoli fori sui lati dell'estremità conica (non il foro all'estremità della parte inferiore) di ciascun contenitore per prevenire la crescita di radice dal contenitore nel resto del vaso/microcosmo.
- Per evitare la perdita di terreno fornendo al drenaggio, pongono una biglia di vetro nella parte inferiore di ogni contenitore.
- Per un trattamento di controllo che non comporta alcun potenziale per un CMN a forma tra le piante, utilizzare contenitori solidi, non modificati (Figura 1A).
2. montaggio del POT o microcosmi per inserire le estremità coniche dei contenitori
- Affinché i contenitori in posizione verticale in posizione fissa e hanno corretto drenaggio, capovolgere una pentola in modo che il fondo è rivolto verso l'alto. Tagliare intorno alla parte inferiore della pentola, lasciando un piccolo labbro per il supporto, utilizzando una sega a sciabola.
- Preparazione di polistirene espanso
- Taglio polistirolo espanso, circa 36 mm di spessore, per lo stesso diametro del fondo della pentola utilizzando una sega a nastro con un jig circle-taglio.
- Eseguire i fori nella schiuma utilizzando una pressa di trivello e 19 mm foro visto (senza un trivello di torsione centrale) nel modello in cui saranno posizionati i contenitori.
- Per un esperimento di impianto di destinazione, un foro centrale con fori equidistanti per i vicini gli individui che lo circondano. Per una pentola con un diametro di cm 15,5, spazio sei fori 12 mm intorno alla circonferenza di un cerchio del diametro di 11 cm (Figura 1B).
- Stendere i fori hexagonally o in una matrice quadrata (Figura 1, D) per un esperimento di microcosmo.
3. riempimento dei contenitori e vasi con miscele di terra e sabbia
- Selezionare una miscela di terreno desiderato e aggiungere sto fungo campo-raccolte o coltivate in vaso inoculo al suolo mescolando uniformemente tritato pezzi di radice (1 – 2 cm di lunghezza) accuratamente con il terreno. Mischiare il terriccio desiderato con una infertile silice sabbia o perline di vetro per diminuire la concentrazione di nutrienti minerali disponibili alle piante.
- Posizionare i contenitori riempiti in schiuma o microcosmo fondo forato e riempire lo spazio interstiziale con un substrato infertile.
- Riempire lo spazio interstiziale tra contenitori con miscela di sabbia silicea di sostanza-poveri utilizzando un imbuto per assistere in piccoli spazi di riempimento. Per garantire un adeguato drenaggio e imitare la texture del terreno, mescolare sabbia di granulometria media, come grado 6-20, con sabbia di granulometria piccola, come grado 30-65, in una betoniera.
4. istituzione di CMNs tutto pentole/microcosmi
- Impianto di pretrattamento 'infermiere' piante delle specie desiderate in ogni contenitore a sostenere funghi AM affinché possano diffondersi tra i contenitori e stabilire CMNs.
- Quando tutti i contenitori hanno stabilito i semenzali, rimuovere germogli di ritaglio in modo che solo un individuo rimane in ogni contenitore.
- Consentire 2-3 mesi per la crescita delle piante e istituzione di CMN.
5. istituzione di impianti sperimentali e trattamenti
- Seminare piante sperimentali di semina o di trapianto in contenitori. Se la semina, attendere che tutti i contenitori hanno un semenzale germinato prima di rimuovere impianti di pretrattamento infermiera fissando il loro germogli. Se un trapianto, clip tutto pre-trattamento piante prima del trapianto sperimentale piantine per evitare effetti indesiderati competitivi.
- Stabilire trattamenti CMN o lasciando i contenitori non spostati per tutta la durata dell'esperimento (intatto CMNs) o ruotandole settimanale di recidere fisicamente IFE che si estende tra i contenitori modificati (CMNs mozzata; Figura 1A). Quando severing CMNs, ruotare ogni contenitore attraverso una rotazione completa per non alterare involontariamente interazioni aboveground, particolarmente per le piante ruderali.
- Acqua fortemente tutte le pentole o microcosmi immediatamente dopo la rotazione per ristabilire il contatto tra il substrato interstiziale e i lati dei contenitori.
6. il tracciamento del movimento dei nutrienti minerale attraverso CMNs
- Fertilizzare le piante vicine con 0,5% 15N arricchita KNO3 e NH4Cl.
- Fertilizzare l'individuo di destinazione con un fertilizzante 14N di pari concentrazione.
7. monitoraggio e manutenzione dell'esperimento
- Regolarmente (a almeno mensile) ri-randomizzare le posizioni dei vasi o microcosmi nel corso dell'esperimento.
- Settimanale misurare la crescita, come l'altezza o lunghezza (per erbe) più lunga foglia per monitorare quando crescita inizia a rallentare, perché è importante raccogliere prima le piante diventano radice-limite.
8. raccolta dell'esperimento
- Tutto il tessuto aboveground di clip e inserire singole piante in buste con etichettate che identificano il loro trattamento, pot o microcosmo e posizione.
- A secco aboveground tessuti a 60 ° C fino a peso costante. Misurare il peso a secco di ogni tessuto vegetale.
- Permetta che il terreno si asciughi prima di estrarre i contenitori e le radici di raccolta.
- Spazzolare delicatamente come molto del terreno come possibile da sistemi della radice e lavarli in una vaschetta d'acqua o sotto un leggero getto d'acqua su un setaccio di formato del poro di 250 micron.
- Consentire le radici asciugare e pesare l'intero sistema della radice.
- Il sistema della radice di clip a casaccio e memorizzare i frammenti di radice in etanolo al 50%. Dopo che si sono macchiati33, è possibile utilizzare questi frammenti per la quantificazione della colonizzazione di radice utilizzando il metodo di intersezione della griglia34.
- Ripesare il restante sistema di radice e riporlo in una busta di carta con etichetta asciugare a 60 ° C per la valutazione del peso secco. Utilizzare la seguente equazione per calcolare il peso dell'intero sistema di radice:
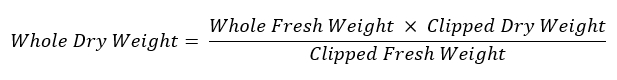
9. analisi isotopiche minerali nutrienti e stabile
- Raggruppare i semenzali di biomassa in "decili" o 10 gruppi, "octiles" o 8 gruppi, "quartili" o quattro gruppi, ecc dopo rango-ordinando loro di peso se la quantità di tessuto è troppo bassa per i requisiti minimi per la digestione determinare minerali nutrienti concentrazioni.
- Invia fogliari campioni ad un laboratorio contratto per analisi dell'isotopo stabile e nutrienti minerali (Tabella materiali).
- Descrivere abbondanza isotopica utilizzando la seguente espressione abituale:
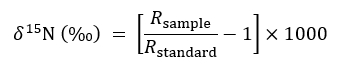
dove R rappresenta il 15N /14N rapporto di un campione o dello standard che è n atmosferico. - Uso non modificato, trattamento solido contenitore per servire come un controllo per rapporti di 15N sfondo nella seguente equazione di bilancio di massa quando quantificare l'importo di 15N ripreso da un impianto di destinazione in reciso o intatto CMN trattamenti:
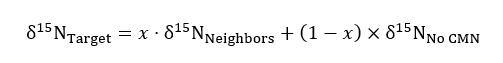
dove δ15N rappresenta l'abbondanza isotopica di obiettivi, i vicini e piante bersaglio in nessun trattamento CMN e x rappresenta (come frazione decimale) l'azoto delle percentuali ottenute dall'impianto di destinazione da contenitori vicino a cui è stato aggiunto l'etichetta. Valori di δ15Nvicini sono ottenuti per i vicini composte di ogni impianto di destinazione.
- Descrivere abbondanza isotopica utilizzando la seguente espressione abituale:
Access restricted. Please log in or start a trial to view this content.
Risultati
Per determinare come CMNs possono influenzare le prestazioni dell'impianto tramite il partizionamento dei nutrienti, siamo cresciuti Andropogon gerardii Vitman, un'erba di prateria dominante, in un esperimento di pianta di destinazione con 6 vicini equidistanti e intatto, mozzata o nessun CMNs. Abbiamo trovato che severing o prevenire CMNs diminuita pesi a secco fuori terra di obiettivi (Figura 2), suggerendo che intatto CMNs promosso la crescita del...
Access restricted. Please log in or start a trial to view this content.
Discussione
I nostri risultati confermano che il nostro metodo di nucleo ruotato acutamente può concentrarsi sul ruolo di CMNs nelle interazioni pianta necromassa. Ci sono diversi passaggi critici nel protocollo, tuttavia, che se alterati, hanno il potenziale di influenzare la capacità di rilevare gli effetti CMN. È fondamentale per riempire i contenitori circostante zona interstiziale con un mezzo di sostanza-poveri. Nel nostro esperimento infruttuoso, ruotato-core target di pianta con piantine di albero di guaiava, anche se c'e...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Vorremmo ringraziare i due revisori anonimi per i loro suggerimenti. Ringraziamo anche i numerosi laureandi che hanno contribuito con la costruzione di vasi, microcosmi e fessurati contenitori e che hanno assistito con il mantenimento e la raccolta di esperimenti. Ringraziamo anche North Central College per avvio fondi (JW) e strutture attuali, come pure Ashley Wojciechowski per l'ottenimento di un esperimento utilizzando questi metodi di supporto una sovvenzione North Central College Richter. Parte di questo lavoro è stato finanziato da un National Science Foundation tesi miglioramento borsa di dottorato (DEB-1401677).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Commercial tubular seedlings container (called 'containers' in the manuscript) | Stuewe and Sons, Inc | Ray Leach Cone-tainer ™ | RLC3U |
| Course glass beads | Industrial Supply, Inc. | 12/20 sieve | Size #1 |
| Course silica sand | Florida Silica Sand | 6/20 50lb bags | None |
| Fine glass beads | Black Beauty | Black Beauty FINE Crushed Glass Abrasive (50 lbs) | BB-Glass-Fine |
| Hydrophobic membrane | Gore-tex | None | None |
| Large commercial tubular seedling containers | Stuewe and Sons, Inc. | Deepot ™ | D16L |
| Medium silica sand | Florida Silica Sand | 30/65 50 lb bags | None |
| Nylon mesh | Tube Lite Company, Inc. | Silk screen | LE7-380-34d PW YEL 60/62 SEFAR LE PECAP POLYESTER |
| Soil and foliar nutrient analysis facility | Kansas State University Soil Testing Lab | None | None |
| Stable isotope core facility | University of Miami | None | None |
Riferimenti
- Remy, W., Taylor, T. N., Hass, H., Kerp, H. Four hundred-million-year-old vesicular arbuscular mycorrhizae. Proceedings of the National Academy of Sciences of the United States of America. 91 (25), 11841-11843 (1994).
- Smith, S. E., Read, D. J. Mycorrhizal Symbiosis. , 3 edn, Academic Press. (2008).
- Giovannetti, M., Avio, L., Sbrana, C. Mycorrhizal Networks. , Springer. 41-67 (2015).
- Giovannetti, M., Sbrana, C. Cell Biology of Plant and Fungal Tip Growth. Vol. 328. Nato Science Series, Sub-Series I: Life and Behavioural Sciences. Cresti, A., Heath, M., Geitmann, I. B. , 221-231 (2001).
- Giovannetti, M., Sbrana, C., Avio, L., Strani, P. Patterns of below-ground plant interconnections established by means of arbuscular mycorrhizal networks. New Phytologist. 164 (1), 175-181 (2004).
- Avio, L., Pellegrino, E., Bonari, E., Giovannetti, M. Functional diversity of arbuscular mycorrhizal fungal isolates in relation to extraradical mycelial networks. New Phytologist. 172 (2), 347-357 (2006).
- Giovannetti, M., et al. At the root of the wood wide web: self recognition and nonself incompatibility in mycorrhizal networks. Plant Signaling & Behavior. 1 (1), 1-5 (2006).
- Miller, R., Kling, M. J. The importance of integration and scale in the arbuscular mycorrhizal symbiosis. Plant and Soil. 226 (2), 295-309 (2000).
- Miller, R., Jastrow, J., Reinhardt, D. R. External hyphal production of vesicular-arbuscular mycorrhizal fungi in pasture and tallgrass prairie communities. Oecologia. 103 (1), 17-23 (1995).
- Weremijewicz, J., Sternberg, L. dS. L. O., Janos, D. P. Common mycorrhizal networks amplify competition by preferential mineral nutrient allocation to large host plants. New Phytologist. , (2016).
- Fellbaum, C. R., et al. Fungal nutrient allocation in common mycorrhizal networks is regulated by the carbon source strength of individual host plants. New Phytologist. 203 (2), 646-656 (2014).
- Lekberg, Y., Hammer, E. C., Olsson, P. A. Plants as resource islands and storage units--adopting the mycocentric view of arbuscular mycorrhizal networks. FEMS Microbiol Ecol. 74 (2), 336-345 (2010).
- Jakobsen, I., Hammer, E. C. Mycorrhizal Networks. , Springer. 91-131 (2015).
- Jakobsen, I., Rosendahl, L. Carbon flow into soil and external hyphae from roots of mycorrhizal cucumber plants. New Phytologist. 115 (1), 77-83 (1990).
- Kiers, E. T., et al. Reciprocal rewards stabilize cooperation in the mycorrhizal symbiosis. Science. 333 (6044), 880-882 (2011).
- Hartnett, D. C., Hetrick, B. A. D., Wilson, G. W. T. Mycorrhizal influence on intra- and interspecific neighbour interactions among co-occuring prairie grasses. Journal of Ecology. 81 (4), 787-795 (1993).
- Hetrick, B. A. D., Wilson, G. W. T., Todd, T. C. Differential responses of C3 and C4 grasses to mycorrhizal symbiosis, phosphorus fertilization, and soil microorganisms. Canadian Journal of Botany. 68 (3), 461-467 (1990).
- Johnson, D., Leake, J. R., Read, D. J. Novel in-growth core system enables functional studies of grassland mycorrhizal mycelial networks. New Phytologist. 152 (3), 555-562 (2001).
- Leake, J. R., et al. Networks of power and influence: the role of mycorrhizal mycelium in controlling plant communities and agroecosystem functioning. Canadian Journal of Botany-Revue Canadienne De Botanique. 82 (8), 1016-1045 (2004).
- Babikova, Z., et al. Underground signals carried through common mycelial networks warn neighbouring plants of aphid attack. Ecology Letters. 16 (7), 835-843 (2013).
- Schüepp, H., Miller, D. D., Bodmer, M. A new technique for monitoring hyphal growth of vesicular-arbuscular mycorrhizal fungi through soil. Transactions of the British Mycological Society. 89 (4), 429-435 (1987).
- Miller, D. D., Bodmer, M., Schüepp, H. Spread of endomycorrhizal colonization and effects on growth of apple seedlings. New Phytologist. 111 (1), 51-59 (1989).
- Jakobsen, I., Gazey, C., Abbott, L. K. Phosphate transport by communities of arbuscular mycorrhizal fungi in intact soil cores. New Phytologist. 149 (1), 95-103 (2001).
- Johnson, D., Leake, J., Ostle, N., Ineson, P., Read, D. J. In situ 13CO2 pulse‐labelling of upland grassland demonstrates a rapid pathway of carbon flux from arbuscular mycorrhizal mycelia to the soil. New Phytologist. 153 (2), 327-334 (2002).
- Johnson, D., Leake, J., Read, D. J. Transfer of recent photosynthate into mycorrhizal mycelium of an upland grassland: short-term respiratory losses and accumulation. of 14C. Soil Biology and Biochemistry. 34 (10), 1521-1524 (2002).
- Walder, F., et al. Mycorrhizal networks: Common goods of plants shared under unequal terms of trade. Plant Physiology. 159 (June 2012), 789-797 (2012).
- Song, Y. Y., et al. Interplant communication of tomato tlants through underground common mycorrhizal networks. Plos One. 5 (10), e13324(2010).
- Merrild, M. P., Ambus, P., Rosendahl, S., Jakobsen, I. Common arbuscular mycorrhizal networks amplify competition for phosphorus between seedlings and established plants. New Phytologist. 200 (1), 229-240 (2013).
- Janos, D. P., Scott, J., Aristizábal, C., Bowman, D. M. J. S. Arbuscular-mycorrhizal networks inhibit Eucalyptus tetrodonta seedlings in rain forest soil microcosms. Plos One. 8 (2), e57716(2013).
- Wyss Lozano Hoyos, T. Pinus elliottii var. densa Seedling Performance Reflects Ectomycorrhizas, Soil Nutrient Availability and Root Competition. , (2010).
- Mäder, P., Vierheilig, H., Alt, M., Wiemken, A. Boundries between soil compartments formed by microporous hydrophobic membranes (GORE-TEX) can be crossed by vesicular-arbuscular mycorrhizal fungi but not by ions in the soil solution. Plant and Soil. 152, 201-206 (1993).
- Mäder, P., et al. Transport of 15N from a soil compartment separated by a polytetrafluoroethylene membrane to plant roots via the hyphae of arbuscular mycorrhizal fungi. New Phytologist. 146 (1), 155-161 (2000).
- Brundrett, M., Bougher, N., Dell, B., Grove, T. Working with Mycorrhizas in Forestry and Agriculture. , (1996).
- McGonigle, T. P., Miller, M. H., Evans, D. G., Fairchild, G. L., Swan, J. A. A new method which gives an objective-measure of colonization of roots by vesicular arbuscular mycorrhizal fungi. New Phytologist. 115 (3), 495-501 (1990).
- Weremijewicz, J., Janos, D. P. Common mycorrhizal networks amplify size inequality in Andropogon gerardii monocultures. New Phytologist. 198 (1), 203-213 (2013).
- Weremijewicz, J., O’Reilly, L. dS. L., Janos, D. P. Arbuscular common mycorrhizal networks mediate intra-and interspecific interactions of two prairie grasses. Mycorrhiza. , 1-13 (2017).
- Weiner, J. Asymmetric competition in plant populations. Tree. 5 (11), 360-364 (1990).
- Damgaard, C., Weiner, J. Describing inequality in plant size or fecundity. Ecology. 81 (4), 1139-1142 (2000).
- Johnson, C. R., Joiner, J. N., Crews, C. E. Effects of N, K, and Mg on growth and leaf nutrient composition of 3 container grown woody ornamentals inoculated with mycorrhizae. Journal of the American Society for Horticultural Science. 105 (2), 286-288 (1980).
- Estrada-Luna, A. A., Davies, F. T., Egilla, J. N. Mycorrhizal fungi enhancement of growth and gas exchange of micropropagated guava plantlets (Psidium guajava L.) during ex vitro acclimatization and plant establishment. Mycorrhiza. 10 (1), 1-8 (2000).
- Hurlbert, S. H. Pseudoreplication and the design of ecological field experiments. Ecological Monographs. 54 (2), 187-211 (1984).
- Argüello, A., et al. Options of partners improve carbon for phosphorus trade in the arbuscular mycorrhizal mutualism. Ecology Letters. 19 (6), 648-656 (2016).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon