このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
回転コアを使用して一般的な菌根菌ネットワークを介した植物相互作用の研究
要約
可能性のコミュニティ内でのほとんどの植物は、アーバスキュラー菌根菌 (AM) によって相互接続されてが、それらによって植物の相互作用の仲介は、主に成長する植物を対菌根なしが検討されています。植物の相互作用に与える影響を調査する菌根植物の間で共通の菌根菌ネットワークを操作する手法を提案します。
要約
植物ミネラル養分吸収と成長に影響を与えるアーバスキュラー菌根菌 (AM)、それ故に、彼らは植物の相互作用に影響を与える可能性があります。その影響力の栄養枯渇ゾーンを越えて広がる extraradical の菌糸体である最終的に一般的な菌根菌ネットワーク (CMN) 内の個人を相互接続するための根の近く。ただし、ほとんどの実験は、成長する植物を対菌根菌、CMNs の役割を明示的にアドレスに失敗したメソッドなしで植物相互作用における AM 菌の役割を検討しました。ここでは、植物相互作用におけるそれらの役割を調査するため CMNs を操作する手法を提案します。ナイロン メッシュや栄養素貧しい質砂・ 15N 肥料スロットの開口部をカバーする疎水性材料の円錐形底で変更されたコンテナーを用いる。CMNs はどちらか残っている容器の回転により切断や固体のバリアを形成できなく、相互作用の個人間そのまま。容器を回転 CMNs を混乱させるし、CMNs 全体植物相互作用への影響を防ぐために十分であることが示唆されました。我々 のアプローチは、自然、多様なメリットを提供する AM 菌のスイートの既に確立された CMNs 使いにタップの苗などの側面を模倣するために便利です。実験は幼苗期の植物を調査、植物相互作用 CMNs は CMNs の生態系における機能について生物学的質問を調査するために適用できる私たちのアプローチを使用してに検出できます。
概要
アーバスキュラー菌根菌 (AM) は、土地の植民地化で植物を支援 4 億 6000 万年前1と今日、彼らがほとんど植物2成長のための鉱物の重要な栄養素を提供することのユビキタスの共生。AM 菌の薄い、糸のような菌糸が根、頻繁に発生して、隣接する「一般的な菌根菌ネットワーク」の植物の根システムを植民地化に近い栄養枯渇ゾーンを超えてミネラル栄養素の飼料 (CMN)。一般的な菌根菌ネットワークも形成があります真菌胞子結合ネットワーク3、または融合時は菌糸と同種の菌糸4,5,6,7(吻合する)。土壌中のこれらの extraradical 菌糸の範囲は巨大、草原と牧草地土壌8とストレッチは妨げられていない草地9 111 m·cm-3合計土壌微生物バイオマスの 20 ~ 30% を構成する extraradical の菌糸で、.
一般的な菌根菌ネットワークは、相互接続された隣接植物10、11,12,13のミネラル栄養素をパーティション分割します。植物までを受け取ることがあります、リンの 80% と 25% で菌類に炭素を固定、合計の 20% までを提供しながら AM 菌から窒素条件の14を返します。最近体外ルート オルガン文化仕事 CMNs が菌類11,12ほとんどの炭素を供給するホストの根で養分を優先的に交換することを発見しました。さらに、AM 菌の種異なる場合があります彼らの品質の他のものより少ない炭素のより多くのリンを交換いくつかの菌類との共生パートナーとして15。アーチング撮影に影響を与えるに含まれないルート器官培養が注意深く管理された環境と菌糸の配線を直接観察する能力を出すために午前共生を研究するための有益なモデル、光合成、蒸散、日周変化など重要な生理学的なプロセス、同様に構成する炭素とミネラル栄養素は沈みます。
自然の中で最も可能性の高い苗を既に確立された CMNs にタップします。最近まで、ただし、科学者がのみ影響を検討した AM 菌の植物栄養成長する植物とアーバスキュラー菌根菌接種の単一種の頻繁になしで。この作品は、途方もなくアーブスキュラーの私達の理解に有益されている、このメソッドは CMNs が相互接続されたホスト植物間の相互作用であるかもしれない可能性のある重要な役割を見落とさが。特に、AM 菌の成長のために非常に依存している植物最小 AM 菌16,17、おそらく AM 菌を介する相互作用ベースラインの 'コントロール' として使うときの我々 の解釈を混同せずにやり取り参照。
植物相互作用および人口構造で CMNs の役割の調査のため回転コアのアプローチを提案する.我々 のアプローチは、全体の植物結合確立 CMNs とすべての植物は、菌根菌栽培されてため午前共生自然の中のコンポーネントを模倣します。ルート相互作用を削除すると、我々 の方法論は特に CMNs 内鉱物の栄養運動をトラッキングしながら AM 菌を介した相互作用について説明します。我々 のアプローチは、現実的に機能して午前を理解するフィールドや温室の回転コアを使用しています前の作業に基づいています。
回転コア メソッドは extraradical 菌糸18,19,20,21を操作するためのメソッドとして文献で確立している、それは上の目的に応じていくつかの生まれ変わりを持って過去 20 年間。最初に、メッシュ バッグや菌糸の成長を許可する障壁は土22,23に菌根菌菌糸の量を定量化するためのコンパートメントの無料のルートを提供するために使用されました。その後、硬質の水パイプやプラスチック スロット不可解ナイロン メッシュで覆われて菌糸がない根管で囲まれた土の円筒コアが開発されました。これらは、extraradical 菌糸体18,24,25を混乱させる簡単に回転でした。回転コアは植物の間に置かれた、土土18日工場無料コアから extraradical 菌糸体24、またはリン吸収13C フラックスのグラム当たり菌糸長さ定量化された18。そのような中心の別の使用された滅菌または殺菌剤、有機土壌への間接効果があるどちらのアプリケーションの代替として頻繁に菌糸の混乱を通じて AM 菌根の植民地化を減らすためにフィールド内で植物を育てる物質とその他の微生物の18。
菌糸メッシュ防策は、栄養パーティショニングを調査し、CMNs でが、長方形ではなく回転コアの相互作用を植物に使用されています。ワルダーら26 CMNs AM 菌Rhizophagus のいずれかの間での同位体比を用いた炭素交換のため養分をトレースしてアマ(亜麻) とソルガム(モロコシ) 間の相互作用を検討しました。irregularisまたはFunneliformis mosseae26。区切ってから構成される研究所コンパートメントの小宇宙メッシュ障壁、菌根菌の菌糸からだけアクセスできる菌糸コンパートメントおよび放射性・安定同位体比に含まれるラベルの菌糸コンパートメント。コントロールと菌根菌のない治療法を用いた。歌ら27では、同様のアプローチを使用して設立 CMNs F. mosseaeの間でのみ 1 つの植物が病原菌に感染していたときに、信号を運ぶことができるその植物を検索します。また、同様にワルダーら26、28で区切られた個々 のコンパートメントで植物を育てた Merrild らメッシュ大キュウリに CMNs によってリンクされているトマ(トマト) 苗のプラントのパフォーマンスを調査するにはダイコン(キュウリ) 植物豊富な炭素源を表す。彼らはまた CMNs28を切断ではなく菌根菌なしのトリートメントを使用しました。第二に、関連実験でリン交換用炭素を32p. 小宇宙菌糸メッシュ障壁とラベルの付いたメッシュの袋を使用して調べたし、治療薬として切断 CMN はヤーノシュら29、競争力を調査したによって使用されました。サバンナ ツリー種ユーカリ tetrodontaの苗と熱帯雨林の木、リツェアクベバ glutinosaの移植との間の相互作用。その研究・ ヤーノシュら29苗数センチ、お互い菌糸配線29を破るにメッシュのレイヤーをスライドを含む区画を持ち上げた。
回転コア法の進化の最終段階は、鍋か小宇宙20,30内にあるコアの中の植物を成長してきました。ウィース30は extraradical 午前菌糸がマツ elliottii苗ドナーまたは '看護' 午前ホスト植物、タマリンド インディカ、外生菌根の方法 extraradical 菌糸体から広がっているときを植民地化かどうかを確認するために回転コアを使用菌苗のパフォーマンスに影響を与えます。マイクロコズム内の大きい商業鋼管苗コンテナー (材料表) いずれかの固体プラスチック (CMNs なし) だったスロットや疎水性の膜で覆われています。スロット苗コンテナーのいずれかのない回転 (そのまま CMNs) されたりサイズは Babikova ら20坑内ソラマメ間 CMNs 介したシグナル伝達機構を調査するため使用されていた別のメッシュ障壁確立された CMNs。 回転コアをサーバーに回転させるソラマメ(bean) の植物。彼らの研究で根と菌糸 (バリア) や CMNs を通じ、40 μ m メッシュだけで 30 cm 直径メソコスム中央ドナー工場だった相互接続されています。中央プラントがメッシュで囲まれたコアの回転を介して近隣の植物との相互作用から切断または CMNs は 0.5 μ m の細かいメッシュ中心部を囲むによって防がれました。
CMNs の安定同位体比のトレースと組み合わせて直接植物相互作用に及ぼす影響を検討する事前回転コアのアプローチの面を結合する方法を紹介します。私たちのメソッドは、関心の中央工場が近隣の植物によって囲まれています 'ターゲット植物' アプローチを使用します。植物スロットし、ナイロン シルク スクリーン メッシュ、疎水性の膜で覆われている回転式苗コンテナー内に育つか非変更された固体プラスチックもあります。一般的な菌根菌ネットワークの週に一度の切断や、そのまま、 15N 安定同位体は、中央にある対象工場に隣人の回転コアから窒素の動きをトレースします。ミネラル栄養および安定同位体の摂取量と植物体の大きさを比較すると、植物が利益または苦しむ CMNs 宿主植物間の相互作用で評価する.
プロトコル
1、建設および回転コアのアセンブリ
- (その後呼ばれる 'コンテナー'; 商業鋼管苗コンテナーを変更します。材料の表)19 mm 幅 × 48 cm 長さ開口部を持っています。
- 使用しては、穴が約 1 cm 離れてコンテナー (12.1 cm × 直径 2.5 cm) の側面で、その他上記のいずれか 2 つの穴を切り中央、パイロット ドリルなし 19 mm の穴をドリル出版物を見た。ドリル出版物の塀に対してコンテナーを保持して、掘削中の場所でそれを保持するために、コンテナー内に収まる短い釘に停止を持ってください。割れを防ぐために、柔軟なプラスチック製のコンテナーを使用します。
- 1 つを作る (用硬質プラスチック セイバー見た)、はさみ、ワイヤー カッターやはさみで穴の間プラスチックの残りの薄い部分をカットは幅約 2 cm と 5 cm の長さを開く細長い。
- 1.1.1-1.1.2 コンテナーの反対側の手順を繰り返します。
- ナイロン メッシュや疎水性膜 (図 1 a) スロットをカバーします。
- 9.5 × 8.5 cm に 40 μ m の孔を持つナイロン メッシュを切る。コンテナーがあるので、多くの部分をカットします。
- 外部から高強度、工業用ホット接着剤を使用して、ファブリックにわずかな重複がいくつかの両方の開口部をカバーするコンテナーにナイロン メッシュを接着します。
- 水の動きの防止が必要な場合このような水溶性栄養素または安定同位体を使用する場合カバー ナイロン メッシュ層疎水性膜31,32 (材料表) ができると、午前に菌菌糸ない液体の水と水蒸気の動きのみを渡します。
- コンテナーで、ナイロン メッシュの長い辺に沿って開口部周囲にホット接着剤を配置します。指の書き込みを避けるために生地の上にコンテナーをロールバックします。メッシュが重複を端布エッジに沿って接着剤の層を追加します。しっかりとそれを密封するためのいくつかの段ボールにエッジを押します。常にオーバー ラップ メッシュ エッジは可能性のある基板に掘るにはプッシュされませんので、鍋またはマイクロコズム内に完成したコンテナーの回転の同じ方向になります 1 つの方向に一貫してロールバックします。
- 接着剤が冷却、一度緩い端および電気技師のテープなどの柔軟なテープを使用してリッピングを防ぐために、コンテナーに生地の上下両端をテープします。
- 1.2.5 のステップのように同じテープを使用すると、ポット/小宇宙の残りの部分に容器から根の成長を防ぐために各コンテナーの円錐端部 (下の先端の穴ではない) の両側に小さな穴をカバーします。
- 土壌の損失を防ぐため、排水を提供しながら、各容器の底にガラスのビー玉を配置します。
- 植物の間に形成の CMN のあらゆる潜在的なを含まないコントロール治療、固体、変更されていないコンテナー (図 1 a) を使用します。
2. 鍋または容器の円錐形の端を合わせて小宇宙のアセンブリ
- コンテナーの固定位置に直立して適切な排水を確保するため、下を向いているので、鍋を適切なを裏返します。サーベル鋸を使用してサポートの小さな唇を残して、鍋の底の周りカットします。
- ポリスチレン フォームの作製
- 発泡ポリスチレン, 約 36 mm、厚さをバンドソー サークル カット治具を鍋の底と同じ直径にカットします。
- コンテナーが配置されるパターンで (中央のツイスト ドリル) なしドリル出版物、19 mm の穴を使用して泡にドリル穴を見た。
- ターゲット植物実験では、近隣の個人のそれを囲むため等間隔の穴と中央の穴をドリルします。15.5 cm 直径の鍋のためのスペース 6 穴 12 mm (図 1 b) 11 cm の直径の円のまわりを離れて。
- 六角または正方配列 (図 1、D) マイクロコズム実験の穴をレイアウトします。
3. 容器と鉢土と砂の混合物の充填
- 希望の土壌混合物を選択し、午前菌フィールド-収集または均一に混合することにより土にポット培養菌根の部分 (長さ 1-2 cm) のみじん切りを追加土を徹底的に。植物が利用できるミネラル栄養素の濃度を減少する砂やガラス ビーズ不妊石英希望の土壌をミックスします。
- ドリル泡または縮図底に充填容器を置き、不妊の基板と間質性スペースを埋めます。
- 支援小さなスペースを充填するために、目標到達プロセスを使用して栄養素貧しい珪砂混合物と容器の間の間質性スペースを埋めます。十分な排水を確保し、土壌のテクスチャを模倣、30-65 年生、セメント ミキサーなどの小さな粒砂 6 20 グレードなどに、中粒砂をミックスします。
4 ポット/小宇宙を通して CMNs の確立
- 彼らは、コンテナー間で普及して CMNs を確立できるように AM 菌を維持するためにそれぞれの容器に目的の種前処理 '看護' 植物を植えます。
- すべてのコンテナーには、苗が確立されている、その 1 つだけの個人が各コンテナーに残りますので、クリッピングによる撮影を削除します。
- 植物の成長と CMN 確立のため 2-3 か月を許可します。
5. 実験植物や治療法の確立
- 播種またはコンテナーに移植実験植物の種をまきます。播種している場合、すべてのコンテナーは、その芽をクリッピングによる前処理看護師植物を削除する前に発芽苗をあるまで待ちます。移植、意図しない競争を防ぐために実験の実生植物を移植する前にすべての前処理工場をクリップします。
- いずれかを残すことによって容器のない実験 (そのまま CMNs) の間を移動または回転させること物理的に変更されたコンテナー (切断 CMNs; 間で拡張する菌糸を断つため毎週 CMN の治療法を確立します。図 1 a)。CMNs を切断、誤って向日性植物の特に地上の相互作用の変更を避けるために完全な 1 回転を介して各コンテナーを回転します。
- 間質性の基板とコンテナーの側面間の接触を確立する回転の直後に重く水すべての鍋または小宇宙。
6. CMNs 間ミネラル養分動態のトレース
- 近隣の植物を肥やす自演3および NH4Cl 0.5 15N が濃縮されています。
- 等しい濃度の14N 肥料を持つターゲット個人を肥やしなさい。
7. 監視の実験やメンテナンス
- 定期的に (毎月)、少なくとも再実験の経過鍋または小宇宙の位置をランダムに。
- 毎週最長葉 (草) の長さの成長は植物根バインドになる前に収穫することが重要だから減速し始めたときに監視するまたは成長の高さなどを測定します。
8. 実験の収穫
- クリップのすべての地上組織し彼らの治療、鍋または縮図と位置を識別するラベルの付いた封筒に個々 の植物を配置します。
- 一定の重量を 60 ° C で乾燥の地上組織。各植物組織の乾燥重量を測定します。
- コンテナーを抽出し、根を収穫する前に乾燥する土壌を許可します。
- 繊細な根系からできるだけ多く土壌し、水、250 ミクロンの細孔径のふるいの上に水の穏やかな流れの下で鍋に洗ってをはねのけます。
- 空気乾燥し、全体のルート システムの重量を量る根を許可します。
- 偶然根系をクリップし、50% エタノールでルート フラグメントを格納します。彼らは33染色後、枠線交差法34を使用してルートの植民地化の定量化のためこれらのフラグメントを使用します。
- 再残存根系の重さし、乾燥重量の評価のための 60 ° C で乾燥するラベルの付いた紙の封筒に格納します。全体のルート システムの重量を計算する次の数式を使用します。
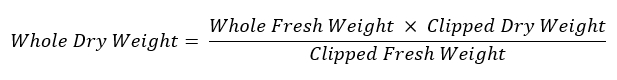
9. ミネラル栄養素・安定同位体比分析
- ランク-ご注文後それら重量組織量が小さすぎる消化養分を決定するための最小要件の場合「無形」または 10 のグループ、"octiles"または 8 グループ、「四分位数」または 4 つのグループ、等に実生植物バイオマス グループ濃度。
- ミネラル栄養と安定同位体比分析 (材料表) の契約ラボに葉面散布のサンプルを送信します。
- 次の慣習的表現を使用して同位体の豊富なをについて説明します。
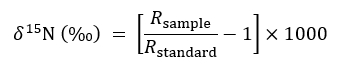
Rが15N を表します/14N 比のサンプルまたは標準の大気 (名) - 使用は非-変更、背景15N 比15ターゲット工場とら N 量の定量化で切断された場合次の物質収支式のコントロールとして機能する固体コンテナー治療やそのまま CMN 治療:
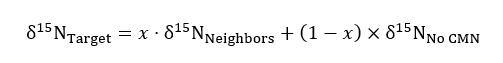
どこ δ15N ターゲット、近所の人やないの CMN 処理対象植物の同位体豊富を表し x (小数) としてパーセントの窒素は、ラベルが追加されている隣人コンテナーからターゲット植物によって得られます。値 δ15N隣人は、各対象工場の合成隣人のため取得されます。
- 次の慣習的表現を使用して同位体の豊富なをについて説明します。
結果
CMNs が可能性があります栄養パーティショニングを通じてプラントのパフォーマンスにどのように影響を与えるかを確認するのには、アンドロポゴン gerardiiゾロトエ、支配的な草原の草、ターゲット植物実験 6 均等に間隔をあけられた隣人とそのまま、切断、またはない CMNs 成長しました。そのまま CMNs が植物の成長を促進されることを示唆している切断した?...
ディスカッション
回転コア手法が地下植物相互作用における CMNs の役割に集中できる大幅我々 の結果を確認します。プロトコル、ただしで変更された場合、CMN 効果を検出する能力に影響を与える可能性があるいくつかの重要な手順があります。栄養素貧しい中で間質部周囲の容器を埋めるために重要です。グアバの木の苗で失敗した、回転コアのターゲット植物実験で任意の数、隣人の存在下で成長を目指?...
開示事項
著者が明らかに何もありません。
謝辞
我々 は彼らの提案の 2 つの匿名のレビューを感謝したいです。また、人を維持する実験を収穫と支援人鍋的小宇宙の構築を手伝っていて、コンテナーをスロットと数多くの大学生を感謝いたします。スタートアップ資金 (JW) を現在の設備とアシュリー ヴォイツェホフスキー ノースセントラル ・ カレッジをありがとうございますまた北中央大学リヒター許可これらのメソッドを使用して実験のサポートを得るため。この作品の一部は国立科学財団博士論文改善の助成金 (デブ 1401677) によって賄われていた。
資料
| Name | Company | Catalog Number | Comments |
| Commercial tubular seedlings container (called 'containers' in the manuscript) | Stuewe and Sons, Inc | Ray Leach Cone-tainer ™ | RLC3U |
| Course glass beads | Industrial Supply, Inc. | 12/20 sieve | Size #1 |
| Course silica sand | Florida Silica Sand | 6/20 50lb bags | None |
| Fine glass beads | Black Beauty | Black Beauty FINE Crushed Glass Abrasive (50 lbs) | BB-Glass-Fine |
| Hydrophobic membrane | Gore-tex | None | None |
| Large commercial tubular seedling containers | Stuewe and Sons, Inc. | Deepot ™ | D16L |
| Medium silica sand | Florida Silica Sand | 30/65 50 lb bags | None |
| Nylon mesh | Tube Lite Company, Inc. | Silk screen | LE7-380-34d PW YEL 60/62 SEFAR LE PECAP POLYESTER |
| Soil and foliar nutrient analysis facility | Kansas State University Soil Testing Lab | None | None |
| Stable isotope core facility | University of Miami | None | None |
参考文献
- Remy, W., Taylor, T. N., Hass, H., Kerp, H. Four hundred-million-year-old vesicular arbuscular mycorrhizae. Proceedings of the National Academy of Sciences of the United States of America. 91 (25), 11841-11843 (1994).
- Smith, S. E., Read, D. J. . Mycorrhizal Symbiosis. , (2008).
- Giovannetti, M., Avio, L., Sbrana, C. . Mycorrhizal Networks. , 41-67 (2015).
- Giovannetti, M., Sbrana, C., Cresti, A., Heath, M., Geitmann, I. B. . Cell Biology of Plant and Fungal Tip Growth. Vol. 328. Nato Science Series, Sub-Series I: Life and Behavioural Sciences. , 221-231 (2001).
- Giovannetti, M., Sbrana, C., Avio, L., Strani, P. Patterns of below-ground plant interconnections established by means of arbuscular mycorrhizal networks. New Phytologist. 164 (1), 175-181 (2004).
- Avio, L., Pellegrino, E., Bonari, E., Giovannetti, M. Functional diversity of arbuscular mycorrhizal fungal isolates in relation to extraradical mycelial networks. New Phytologist. 172 (2), 347-357 (2006).
- Giovannetti, M., et al. At the root of the wood wide web: self recognition and nonself incompatibility in mycorrhizal networks. Plant Signaling & Behavior. 1 (1), 1-5 (2006).
- Miller, R., Kling, M. J. The importance of integration and scale in the arbuscular mycorrhizal symbiosis. Plant and Soil. 226 (2), 295-309 (2000).
- Miller, R., Jastrow, J., Reinhardt, D. R. External hyphal production of vesicular-arbuscular mycorrhizal fungi in pasture and tallgrass prairie communities. Oecologia. 103 (1), 17-23 (1995).
- Weremijewicz, J., Sternberg, L. d. S. L. O., Janos, D. P. Common mycorrhizal networks amplify competition by preferential mineral nutrient allocation to large host plants. New Phytologist. , (2016).
- Fellbaum, C. R., et al. Fungal nutrient allocation in common mycorrhizal networks is regulated by the carbon source strength of individual host plants. New Phytologist. 203 (2), 646-656 (2014).
- Lekberg, Y., Hammer, E. C., Olsson, P. A. Plants as resource islands and storage units--adopting the mycocentric view of arbuscular mycorrhizal networks. FEMS Microbiol Ecol. 74 (2), 336-345 (2010).
- Jakobsen, I., Hammer, E. C. . Mycorrhizal Networks. , 91-131 (2015).
- Jakobsen, I., Rosendahl, L. Carbon flow into soil and external hyphae from roots of mycorrhizal cucumber plants. New Phytologist. 115 (1), 77-83 (1990).
- Kiers, E. T., et al. Reciprocal rewards stabilize cooperation in the mycorrhizal symbiosis. Science. 333 (6044), 880-882 (2011).
- Hartnett, D. C., Hetrick, B. A. D., Wilson, G. W. T. Mycorrhizal influence on intra- and interspecific neighbour interactions among co-occuring prairie grasses. Journal of Ecology. 81 (4), 787-795 (1993).
- Hetrick, B. A. D., Wilson, G. W. T., Todd, T. C. Differential responses of C3 and C4 grasses to mycorrhizal symbiosis, phosphorus fertilization, and soil microorganisms. Canadian Journal of Botany. 68 (3), 461-467 (1990).
- Johnson, D., Leake, J. R., Read, D. J. Novel in-growth core system enables functional studies of grassland mycorrhizal mycelial networks. New Phytologist. 152 (3), 555-562 (2001).
- Leake, J. R., et al. Networks of power and influence: the role of mycorrhizal mycelium in controlling plant communities and agroecosystem functioning. Canadian Journal of Botany-Revue Canadienne De Botanique. 82 (8), 1016-1045 (2004).
- Babikova, Z., et al. Underground signals carried through common mycelial networks warn neighbouring plants of aphid attack. Ecology Letters. 16 (7), 835-843 (2013).
- Schüepp, H., Miller, D. D., Bodmer, M. A new technique for monitoring hyphal growth of vesicular-arbuscular mycorrhizal fungi through soil. Transactions of the British Mycological Society. 89 (4), 429-435 (1987).
- Miller, D. D., Bodmer, M., Schüepp, H. Spread of endomycorrhizal colonization and effects on growth of apple seedlings. New Phytologist. 111 (1), 51-59 (1989).
- Jakobsen, I., Gazey, C., Abbott, L. K. Phosphate transport by communities of arbuscular mycorrhizal fungi in intact soil cores. New Phytologist. 149 (1), 95-103 (2001).
- Johnson, D., Leake, J., Ostle, N., Ineson, P., Read, D. J. In situ 13CO2 pulse‐labelling of upland grassland demonstrates a rapid pathway of carbon flux from arbuscular mycorrhizal mycelia to the soil. New Phytologist. 153 (2), 327-334 (2002).
- Johnson, D., Leake, J., Read, D. J. Transfer of recent photosynthate into mycorrhizal mycelium of an upland grassland: short-term respiratory losses and accumulation. of 14C. Soil Biology and Biochemistry. 34 (10), 1521-1524 (2002).
- Walder, F., et al. Mycorrhizal networks: Common goods of plants shared under unequal terms of trade. Plant Physiology. 159 (June 2012), 789-797 (2012).
- Song, Y. Y., et al. Interplant communication of tomato tlants through underground common mycorrhizal networks. Plos One. 5 (10), e13324 (2010).
- Merrild, M. P., Ambus, P., Rosendahl, S., Jakobsen, I. Common arbuscular mycorrhizal networks amplify competition for phosphorus between seedlings and established plants. New Phytologist. 200 (1), 229-240 (2013).
- Janos, D. P., Scott, J., Aristizábal, C., Bowman, D. M. J. S. Arbuscular-mycorrhizal networks inhibit Eucalyptus tetrodonta seedlings in rain forest soil microcosms. Plos One. 8 (2), e57716 (2013).
- Wyss Lozano Hoyos, T. . Pinus elliottii var. densa Seedling Performance Reflects Ectomycorrhizas, Soil Nutrient Availability and Root Competition. , (2010).
- Mäder, P., Vierheilig, H., Alt, M., Wiemken, A. Boundries between soil compartments formed by microporous hydrophobic membranes (GORE-TEX) can be crossed by vesicular-arbuscular mycorrhizal fungi but not by ions in the soil solution. Plant and Soil. 152, 201-206 (1993).
- Mäder, P., et al. Transport of 15N from a soil compartment separated by a polytetrafluoroethylene membrane to plant roots via the hyphae of arbuscular mycorrhizal fungi. New Phytologist. 146 (1), 155-161 (2000).
- Brundrett, M., Bougher, N., Dell, B., Grove, T. . Working with Mycorrhizas in Forestry and Agriculture. , (1996).
- McGonigle, T. P., Miller, M. H., Evans, D. G., Fairchild, G. L., Swan, J. A. A new method which gives an objective-measure of colonization of roots by vesicular arbuscular mycorrhizal fungi. New Phytologist. 115 (3), 495-501 (1990).
- Weremijewicz, J., Janos, D. P. Common mycorrhizal networks amplify size inequality in Andropogon gerardii monocultures. New Phytologist. 198 (1), 203-213 (2013).
- Weremijewicz, J., O’Reilly, L. d. S. L., Janos, D. P. Arbuscular common mycorrhizal networks mediate intra-and interspecific interactions of two prairie grasses. Mycorrhiza. , 1-13 (2017).
- Weiner, J. Asymmetric competition in plant populations. Tree. 5 (11), 360-364 (1990).
- Damgaard, C., Weiner, J. Describing inequality in plant size or fecundity. Ecology. 81 (4), 1139-1142 (2000).
- Johnson, C. R., Joiner, J. N., Crews, C. E. Effects of N, K, and Mg on growth and leaf nutrient composition of 3 container grown woody ornamentals inoculated with mycorrhizae. Journal of the American Society for Horticultural Science. 105 (2), 286-288 (1980).
- Estrada-Luna, A. A., Davies, F. T., Egilla, J. N. Mycorrhizal fungi enhancement of growth and gas exchange of micropropagated guava plantlets (Psidium guajava L.) during ex vitro acclimatization and plant establishment. Mycorrhiza. 10 (1), 1-8 (2000).
- Hurlbert, S. H. Pseudoreplication and the design of ecological field experiments. Ecological Monographs. 54 (2), 187-211 (1984).
- Argüello, A., et al. Options of partners improve carbon for phosphorus trade in the arbuscular mycorrhizal mutualism. Ecology Letters. 19 (6), 648-656 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved