Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Untersuchung der Pflanze Interaktionen netzübergreifend gemeinsame Mykorrhiza mit gedrehten Kerne
In diesem Artikel
Zusammenfassung
Die meisten Pflanzen innerhalb der Gemeinschaften, die wahrscheinlich durch arbuskulären Mykorrhizapilze (AM) miteinander verbunden sind, sondern Vermittlung von Pflanze-Interaktionen von ihnen wurde vor allem durch wachsende Pflanzen mit vs. ohne Mykorrhizen untersucht. Wir präsentieren Ihnen eine Methode zur gemeinsamen Mykorrhiza Netze unter Mykorrhiza Pflanzen zu untersuchen, deren Folgen für die Pflanze-Interaktionen zu manipulieren.
Zusammenfassung
Arbuskulären Mykorrhiza (AM) Pilze zu beeinflussen, mineralische Nährstoffaufnahme der Pflanze und das Wachstum, daher, sie haben das Potenzial, Pflanze-Interaktionen zu beeinflussen. Die Macht ihres Einflusses findet in extraradical Myzelien, die darüber hinaus Nährstoffverarmung Zonen verteilt in der Nähe von Wurzeln, Personen innerhalb eines gemeinsamen Mykorrhiza-Netzwerks (CMN) letztlich miteinander zu verbinden. Die meisten Experimente haben allerdings die Rolle des AM-Pilze in Pflanze-Interaktionen durch den Anbau von Pflanzen mit vs. ohne Mykorrhiza-Pilze, eine Methode, die nicht explizit die Rolle der CMNs untersucht. Hier schlagen wir eine Methode, die CMNs um ihre Rolle in der Pflanze-Interaktionen zu untersuchen manipuliert. Unsere Methode nutzt modifizierte Container mit konischen Böden mit einem Nylon-Mesh und/oder hydrophoben Material über geschlitzte Öffnungen, 15N-Dünger und nährstoffarme interstitielle Sand. CMNs sind entweder Links intakt zwischen interagierenden Individuen, abgetrennt durch Rotation von Containern oder daran gehindert, durch eine feste Barriere bilden. Unsere Ergebnisse deuten darauf hin, dass rotierende Behälter ausreichend ist, um CMNs zu stören und zu verhindern, dass ihre Auswirkungen auf Pflanze-Interaktionen über CMNs. Unser Ansatz ist vorteilhaft, weil es imitiert Aspekte der Natur, wie Sämlinge Erschließung bereits etablierten CMNs und die Verwendung einer Reihe von AM-Pilze, die vielfältigen Vorteile bieten kann. Obwohl unser Experiment zur Untersuchung von Pflanzen an den Keimlings begrenzt ist, können Pflanzen Interaktionen über CMNs mit unserem Ansatz die biologische Fragen über das Funktionieren der CMNs in Ökosystemen zu untersuchen daher angewendet werden können erkannt werden.
Einleitung
Arbuskulären Mykorrhiza (AM) Pilze Pflanzen in der Besiedlung des Landes 460 Millionen Jahren unterstützt1 und heute sind sie allgegenwärtig Symbionten von den meisten Pflanzen2, Wachstum mit lebenswichtigen Mineralstoffen vorsieht. Die dünnen, fadenförmigen Hyphen von Pilzen AM Futter für mineralische Nährstoffe über Nährstoffverarmung Zonen in der Nähe von Wurzeln, oft zu begegnen und besiedeln die Wurzelsysteme der Pflanzen in einem "gemeinsamen Mykorrhiza Netzwerk" benachbarten (CMN). Gemeinsamen Mykorrhiza Netze können auch bilden, wenn Pilz Germlings Join Netzwerke3 etablierte, oder wenn Hyphen bin verschmelzen (anastomosieren) mit Sicht Hyphen4,5,6,7. Das Ausmaß dieser extraradical Hyphen im Boden ist enorm, mit extraradical Hyphen bilden 20 % bis 30 % der gesamten Boden mikrobielle Biomasse in Prärie und Weide Böden8 und stretching für 111 M·cm-3 in ungestörten Grünland9 .
Gemeinsamen Mykorrhiza Netze partitionieren mineralische Nährstoffen zwischen miteinander verbundenen benachbarten Pflanzen10,11,12,13. Pflanzen erhalten bis zu 80 % ihrer Phosphor und 25 % von ihren Stickstoffbedarf von AM-Pilze, gleichzeitig bis zu 20 % ihrer gesamten festen Kohlenstoff zu den Pilzen in14zurück. Aktuelle in-vitro-Wurzel Orgel Kultur arbeiten hat festgestellt, dass CMNs bevorzugt mineralische Nährstoffe mit Host Wurzeln auszutauschen, die die meisten Carbon zu den Pilzen11,12bieten. Darüber hinaus können verschiedene Arten von AM-Pilze in ihrer Qualität als Symbiosepartner, mit einigen Pilzen den Austausch mehr Phosphor für weniger Kohlenstoff als andere15abweichen. Zwar Wurzel Orgel Kulturen vorteilhaft Modelle für die Uhr Symbiose zu studieren, weil sie sorgfältig kontrollierten Umgebungen und die Fähigkeit, direkt beobachten Bodenaggregaten Zusammenhänge darstellen, enthalten sie photosynthetischen Triebe nicht die Auswirkungen auf wichtige physiologische Prozesse wie Photosynthese, Transpiration und tagaktiv Änderungen, Waschbecken sowie konstituierenden Kohlenstoff und Mineral-Nährstoff.
In der Natur erschließen Sämlinge höchstwahrscheinlich bereits etablierten CMNs. Bis vor kurzem, haben jedoch Wissenschaftler nur die Auswirkungen von AM-Pilze auf Pflanzenernährung untersucht durch den Anbau von Pflanzen mit und ohne AM-Pilze, oft mit einer einzigen Art von AM Pilz. Obwohl diese Arbeit enorm informativ zu unserem Verständnis der arbuskulären Mykorrhiza wurde, hat diese Methode die möglicherweise entscheidende Rolle übersehen, die CMNs in Interaktionen zwischen miteinander verbundenen Wirtspflanzen haben können. Vor allem interagieren Pflanzen, die stark abhängig von AM-Pilze für Wachstum sind minimal, ohne AM Pilze16,17, möglicherweise verwirrende unsere Interpretation AM Pilz-vermittelten Wechselwirkungen bei als "Bedienelemente" baseline Referenz.
Wir schlagen einen gedreht-Core-Ansatz zur Untersuchung der Rolle der CMNs in Pflanze-Interaktionen und Strukturierung der Bevölkerung. Unser Ansatz ahmt Komponenten AM Symbiose in der Natur, weil ganze Pflanzen Join etablierte CMNs und alle Pflanzen mit AM-Pilze angebaut werden. Durch das Entfernen der Wurzel Interaktionen, konzentriert sich unsere Methodik speziell auf Interaktionen von AM-Pilze gleichzeitig auch mineralische Nährstoffe Bewegung innerhalb CMNs vermittelt. Unser Ansatz baut auf früheren Arbeiten, die gedrehte Adern sowohl im Gewächshaus als auch im Bereich verwendet hat, um AM realistisch Funktionsweise zu verstehen.
Die gedrehte Kern-Methode wurde in der Literatur als eine Methode zu manipulieren, extraradical Hyphen18,19,20,21, und es hatte mehrere Reinkarnationen je nach Zielsetzung über den letzten zwei Jahrzehnten. Zunächst Netzbeutel oder Barrieren, so dass im Wachstum der Hyphen wurden zur Bereitstellung von Wurzel-freie Fächer um die Höhe der arbuskulären Mykorrhiza Hyphen in den Boden22,23zu quantifizieren. Dann entwickelten sich zylindrische Kerne des Bodens eingeschlossen in starre Wasserleitungen oder Kunststoff-Schläuche mit Schlitzen von Hyphen, aber keine Wurzeln in einem Nylon-Mesh durchlässig abgedeckt. Diese könnte leicht gedreht werden, um extraradical Myzelien18,24,25stören. Die gedrehten Adern wurden zwischen Pflanzen und Boden Bodenaggregaten Längen pro Gramm Boden18, 13C Fluten extraradical Myzelien24oder Phosphoraufnahme von Pflanze-freie Kerne waren quantifizierte18. Eine andere Verwendung von solcher Kerne wollte wachsen Pflanzen in ihnen im Feld zur Besiedlung der Wurzeln zu reduzieren, indem Sie AM-Pilze durch häufige Bodenaggregaten Unterbrechung als Alternative zur Sterilisation oder die Anwendung von Fungiziden, die indirekte Auswirkungen auf die organischen Böden haben Materie und andere Mikroben-18.
Bodenaggregaten Netz Barriere Ansatz wurde zur Untersuchung Nährstoff Partitionierung und Pflanzen Interaktionen über CMNs, aber in rechteckigen Mikrokosmen statt mit gedrehten Kerne. Walder Et Al.26 untersucht Wechselwirkungen zwischen Linum Usitatissimum (Lein) und Sorghum bicolor (Hirse) durch Verfolgung der mineralischen Nährstoff für Austausch von Kohlenstoff über CMNs entweder AM-Pilze Rhizophagus Isotope Irregularis oder Funneliformis Mosseae26. Die Mikrokosmen in ihrer Studie umfasste Pflanze Fächer getrennt durch mesh Barrieren, Bodenaggregaten Fächer nur zugänglich für Mykorrhiza Hyphen und beschrifteten Bodenaggregaten Fächer, die stabile und radioaktive Isotope enthalten. Als Steuerelemente die Studie Behandlungen ohne Mykorrhiza-Pilzen eingesetzt. Song Et Al.27 verwendet einen ähnlichen Ansatz, um die Pflanze zu finden, die Signale nur bei etablierten CMNs F. Mosseae durchgeführt werden können, wenn eine Pflanze durch pilzliche Erreger infiziert war. Auch Netz ähnlich Walder Et Al.26, Merrild Et Al.28 Pflanzen in einzelnen Fächern getrennt durch wuchs, Anlagenleistung von Solanum Lycopersicum (Tomate) Sämlinge durch CMNs verbunden, um eine große Cucumis zu untersuchen Sativus (Gurke) Pflanze, die eine reiche Kohlenstoffquelle vertreten. Sie benutzten auch Behandlungen ohne Mykorrhiza-Pilze statt Abbruch CMNs28. In einem zweiten, Verwandte Experiment wurden Carbon für Phosphor Austausch wurde geprüft mit Mesh-Taschen mit 32s. Mikrokosmen mit Bodenaggregaten Netz Barrieren beschriftet und CMN severing als Behandlung von Janos Et Al.29, der wettbewerbsfähig untersucht Wechselwirkungen zwischen Sämlinge der Savanne Baumarten Eucalyptus Tetrodonta und Transplantationen von Regenwald Baum, Litsea Glutinosa. In diesem Studie, Janos Et Al.29 Fächer mit Sämlinge wenige Zentimeter, Schiebe-Schichten von Masche Bodenaggregaten Verbindungen29brechen gegeneinander aufgehoben.
Der letzte Schritt in der Evolution der gedrehten Kern Methode bestand darin, wachsen Pflanzen im Inneren Kerne, die in Töpfen oder Mikrokosmen20,30. Wyss30 verwendet gedrehte Kerne, um festzustellen, ob extraradical AM Myzel Pinus Elliottii Sämlinge besiedeln könnte bei der Verbreitung von einem Spender oder "Krankenschwester" AM Wirtspflanze, Tamarindus Indicaund wie extraradical Myzel von Ektomykorrhiza Pilze Einflüsse Sämling Leistung. Große kommerzielle röhrenförmigen Sämling-Container (Table of Materials) in Mikrokosmen waren entweder Vollkunststoff (keine CMNs) oder geschlitzt und mit einer hydrophoben Membran abgedeckt. Geschlitzte Sämling-Container wurden entweder nicht gedreht (intakt CMNs) oder so gedreht, dass um etablierte CMNs. gedreht Kerne mit verschiedenen Netz-Barriere zu trennen, die Größen von Babikova Et Al.20 verwendet wurden, um zu untersuchen, unterirdischer Signalisierung durch CMNs unter Vicia Faba (Bohne) Pflanzen. In ihrer Studie wurde eine zentrale Spender-Werk in 30 cm Durchmesser Mesokosmen Wurzeln und Hyphen (kein Hindernis) oder nur durch CMNs gegründet durch ein 40 μm-Netz miteinander verbunden. Zentralanlagen wurden getrennt von Interaktionen mit benachbarten Pflanzen durch Rotation der Netz-geschlossenen Kerne oder CMNs von einem feinmaschigen 0,5 μm umschließt den Kern gehindert wurden.
Hier präsentieren wir Ihnen eine Methode, die vorherige gedreht-Core Ansätze zu prüfen, den Einfluss der CMNs auf direkte Pflanze Interaktionen kombiniert mit stabilen Isotopen Tracing miteinander verbindet. Unsere Methode verwendet einen "Ziel-Anlage"-Ansatz, in dem das zentrale Werk des Interesses von benachbarten Pflanzen umgeben ist. Pflanzen sind nicht veränderten Vollkunststoff oder innen drehbaren Sämling-Container, die sind geschlitzt und mit Nylon-Siebdruck-Mesh, hydrophoben Membran bedeckt gewachsen sind. Gemeinsamen Mykorrhiza Netze sind einmal in der Woche getrennt intakt gehalten oder stabile Isotope 15N Spur der Bewegung von Stickstoff von Nachbarn gedrehte Adern zum Leitziel Werk. Vergleicht man die Größe des Werks mit mineralischen Nährstoffen und stabilen Isotop Aufnahme, bewerten wir welche Pflanzen können profitieren oder leiden an CMNs in Interaktionen zwischen Wirtspflanzen.
Protokoll
1. Aufbau und Montage der drehbaren Kerne
- Ändern von kommerziellen röhrenförmigen Sämling-Container (später genannt "Container"; Tabelle der Materialien) 19 mm breit x 48 cm Länge Öffnungen haben.
- Mit eine Bohrmaschine mit einem 19 mm Loch sah ohne zentrale, pilot Spiralbohrer, zwei Löcher, eins über dem anderen, in den Seiten eines Containers (2,5 cm Durchmesser x 12,1 cm Länge) geschnitten, damit die Löcher ca. 1 cm auseinander sind. Halten Sie den Behälter gegen einen Zaun auf der Bohrmaschine und haben Sie eine Haltestelle mit kurzen Zapfen, die im Inneren des Behälters passen zu helfen, während des Bohrens in Position zu halten. Verwenden Sie einen Behälter mit flexiblem Kunststoff, um Rissbildung zu verhindern.
- Schneiden die verbleibenden dünnere Stück Plastik zwischen den Löchern mit Schere, Seitenschneider oder Blechschere (für starre Kunststoff verwenden eine Säbel-Säge) länglich zu einem Öffnung ca. 2 cm breit und 5 cm lang.
- Wiederholen Sie die Schritte 1.1.1, 1.1.2 auf der gegenüberliegenden Seite des Behälters.
- Decken Sie die Schlitze mit Nylon-Mesh und/oder hydrophoben Membran (Abbildung 1A).
- Schneiden Sie Nylon-Mesh mit 40 μm Poren in 9,5 x 8,5 cm Stücke. Schneiden Sie so viele Stücke wie Container.
- Kleben Sie die Nylon-Netzgewebe extern auf den Containern um beide Öffnungen mit etwas Überstand in das Gewebe mit hoher Festigkeit, industrielle Heißkleber zu decken.
- Wenn die Verhinderung der Bewegung des Wassers benötigt wird, bin so wie bei der Verwendung von wasserlöslichen Nährstoffe oder stabile Isotope, die Nylon Mesh Schicht mit einem hydrophoben Membran31,32 (Table of Materials) abdecken, die ermöglicht Pilz Hyphen übergeben Sie, sondern nur die Bewegung von Wasserdampf und nicht flüssiges Wasser.
- Ort der Heißkleber um die Öffnungen für den Container und entlang den langen Kanten von Nylon-Netzgewebe. Rollen Sie den Behälter auf den Stoff zu vermeiden, Finger verbrennen. Fügen Sie eine Schicht Kleber entlang der Stoffkante, wo das Netz überlappen Kanten. Drücken Sie den Rand auf einige Kartons zu fest versiegeln. Rollen Sie immer konstant in eine Richtung, die die gleiche Drehrichtung der fertigen Container in Töpfe oder Mikrokosmen werden, so dass die überlappenden Netzkante nicht potentiell in das Substrat Graben geschoben werden.
- Sobald der Klebstoff abgekühlt ist, kleben Sie die oberen und unteren Enden des Gewebes auf den Container, lose Kanten und Rippen mit einem flexiblen Band, wie z. B. Elektriker Band zu verhindern.
- Mit dem gleichen Band wie in Schritt 1.2.5, decken Sie die kleinen Löcher an den Seiten des konischen Ende (nicht das Loch an der Spitze des unteren) jedes Behälters Wurzelwachstum aus dem Behälter in den Rest des Pot/Mikrokosmos zu verhindern.
- Um Bodenverlust zu verhindern und gleichzeitig Entwässerung, setzen Sie einen Glas Marmor am unteren Rand jedes Containers.
- Verwenden Sie für eine Kontrolle der Behandlung, die nicht mögliche für eine CMN zwischen Pflanzen solide, unveränderten Behälter (Abbildung 1A).
2. Montage der Töpfe oder Mikrokosmen, die konischen Enden der Container passen
- Container in einer festen Position aufrecht stehen und haben richtige Drainage, einen Topf umdrehen, so dass die Unterseite nach oben zu gewährleisten. Um den Boden des Topfes, verlassen eine kleine Lippe für Unterstützung, mit einem Säbel-Säge geschnitten.
- Vorbereitung von Polystyrol-Hartschaum
- Geschnitten Sie Polystyrol-Hartschaum, ca. 36 mm dick, auf den gleichen Durchmesser wie der Boden des Topfes mit einer Bandsäge mit einem Kreis-Schnittvorrichtung.
- Bohrungen in den Schaum mit einer Bohrmaschine und 19 mm Loch sah (ohne zentrale Spiralbohrer) in das Muster, in dem die Container positioniert werden.
- Für ein Ziel-Pflanze-Experiment eine zentrale Bohrung mit gleichmäßig angeordneten Löchern für benachbarte Personen um ihn herum. Platz sechs Löcher für einen Topf mit einem Durchmesser von 15,5 cm 12 mm auseinander, um den Umfang der ein 11 cm Durchmesser-Kreis (Abbildung 1 b).
- Legen Sie die Löcher, Hexagonal oder in quadratischer Anordnung (Abbildung 1, D) für ein Mikrokosmos-Experiment.
(3) Befüllung der Container und Töpfe mit Erde und Sand-Gemische
- Wählen Sie eine gewünschte Erdmischung und fügen bin Pilz Feld-gesammelt oder Topf kultiviert Inokulum auf den Boden durch gleichmäßig mischen gehackte Wurzel-Stücke (1 – 2 cm lang) gründlich mit dem Boden. Mischen Sie den gewünschten Boden mit einem unfruchtbaren Kieselsäure Sand oder Glas Perlen um die Konzentration von mineralischen Nährstoffe pflanzenverfügbar zu verringern.
- Positionieren Sie die gefüllten Behälter in gebohrten Schaum oder Mikrokosmos unten und füllen Sie den Zwischenraum mit einem unfruchtbaren Substrat.
- Füllen Sie den Zwischenraum zwischen Containern mit nährstoffarmen Quarzsand-Mischung mit einem Trichter, bei der kleine Räume zu füllen. Auf ausreichende Drainage zu gewährleisten und die Textur des Bodens zu imitieren, mittlere Partikelgröße Sand, z. B. 6-20 Grad, mit kleiner Partikelgröße Sand, z. B. 30-65 Grad, in einen Betonmischer mischen.
4. Einrichtung der CMNs in Töpfen/Mikrokosmen
- Pflanzen Sie Vorbehandlung "Krankenschwester" die gewünschten Arten in jedem Behälter, AM-Pilze zu erhalten, so dass sie können die Container verteilt und CMNs zu etablieren.
- Wenn alle Container Sämlinge hergestellt haben, entfernen Sie Triebe durch clipping, so, dass nur eine Person in jedem Container bleibt.
- 2-3 Monate für Pflanzenwachstum und CMN Einrichtung zu ermöglichen.
5. Einrichtung von Versuchseinrichtungen und Behandlungen
- Säen Sie experimentelle Pflanzen durch Aussaat oder Pflanzung in Containern. Aussaat, warten Sie bis alle Container gekeimten Sämling haben bevor Sie Vorbehandlung Krankenschwester Pflanzen durch Zuschneiden ihrer Triebe entfernen. Wenn Umpflanzen, clip alle Vorbehandlung Pflanzen vor der Verpflanzung experimentelle Sämlinge um unerwünschte Wirkungen zu verhindern.
- CMN Behandlungen zu etablieren, indem entweder verlassen die Container nicht für die Dauer des Experiments (intakt CMNs) verschoben oder drehen sie wöchentliche Hyphen Erweiterung unter der modifizierten Container (abgetrennte CMNs; physisch zu durchtrennen Abbildung 1A). Bei der CMNs trennte, drehen Sie jeden Container durch eine volle Umdrehung zur Vermeidung unbeabsichtigt verändern oberirdische Interaktionen, besonders nach Südskandinavien Pflanzen.
- Stark Wasser alle Töpfe oder Mikrokosmen sofort nach der Drehung zum Kontakt zwischen dem interstitiellen Substrat und die Seiten der Container wiederherzustellen.
6. Verfolgung von mineralischen Nährstoffen Bewegung über CMNs
- Benachbarten Pflanzen düngen mit 0,5 % angereichert 15N KNO3 und NH4Cl.
- Düngen Sie das Ziel-Individuum mit einem 14N-Dünger von gleicher Konzentration.
7. Überwachung und Wartung des Experiments
- Regelmäßig (bei mindestens einmal pro Monat) zufällig wieder die Positionen der Töpfe oder Mikrokosmen im Laufe des Experiments.
- Wöchentlich wie Höhe zu messen oder längste Blatt Länge (für Gräser) um zu überwachen, wenn Wachstum beginnt zu verlangsamen, weil es wichtig ist zu ernten, bevor die Pflanzen Wurzeln gebunden werden.
8. Ernte des Experiments
- Clip-alle oberirdisches Gewebe und Einzelpflanzen in beschriftete Umschläge, die ihre Behandlung, Topf oder Mikrokosmos und Position zu identifizieren.
- Trocknen Sie oberirdische Gewebe bei 60 ° C zur Gewichtskonstanz. Das Trockengewicht von jedes Pflanzengewebe zu messen.
- Lassen Sie die Erde zu trocknen, bevor die Container zu extrahieren und Ernte der Wurzeln.
- Vorsichtig Bürsten Sie ab, so viel wie möglich von der Wurzelsysteme beschmutzen und Sie sie in einer Pfanne Wasser oder unter einem sanften Strahl des Wassers auf ein Sieb von 250 µm Porengröße waschen.
- Lassen Sie die Wurzeln an der Luft trocknen und wiegen das ganze Wurzelsystem.
- Schneiden Sie das Wurzelsystem planlos und speichern Sie die Wurzel-Fragmente in 50 % igem Ethanol. Nachdem sie33gefärbt sind, verwenden Sie diese Fragmente für die Quantifizierung der Wurzel Kolonisation mit Gitternetzlinie Schnittpunkt-Methode34.
- Erneut wiegen Sie die restlichen Wurzelsystem und bewahren Sie es an eine beschriftete Papierumschlag bei 60 ° C zur Beurteilung der Trockengewicht trocknen. Verwenden Sie die folgende Gleichung, um das Gewicht des gesamten Wurzelsystems zu berechnen:
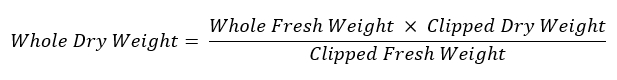
9. mineralischen Nährstoffen und stabilen Isotop Analysen
- Gruppieren Sie die Sämlinge von Biomasse in "Dezile" oder 10 Gruppen, "Octiles" oder 8 Gruppen, "Quartile" oder vier Gruppen, etc. nach Rang-bestellen sie nach Gewicht wenn die Gewebe-Menge zu niedrig für die Mindestanforderungen für die Verdauung ist, mineralische Nährstoffe bestimmen Konzentrationen.
- Senden Sie Blatt-Proben zu einem vertraglich vereinbarten Labor für mineralischen Nährstoffen und stabilen Isotopen-Analysen (Table of Materials).
- Beschreiben Sie isotopischen Überfluß mit dem folgenden üblichen Ausdruck:
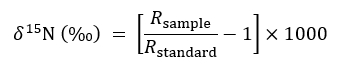
wo R repräsentiert 15N /14N Verhältnis einer Probe oder von der Norm, die atmosphärische N. - Benutzen die nicht veränderten, solide Container Behandlung dienen als Kontrolle für Hintergrund- 15N-Verhältnisse in der folgenden Gleichung der Massenbilanz bei der Quantifizierung des Betrags von 15N von einem Ziel-Werk in aufgegriffen durchtrennt oder intakt CMN Behandlungen:
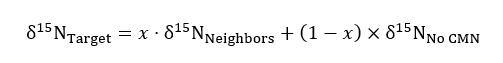
wo δ15N stellt die isotopische Fülle Ziele, Nachbarn und Ziel-Pflanzen in der keine CMN-Behandlung und x dar (als Dezimalbruch) Prozent Stickstoff erhalten von der Ziel-Pflanze vom Nachbar Container Label hinzugefügt wurde. Werte für δ15NNachbarn werden für jedes Ziel Werk Compositing Nachbarn erhalten.
- Beschreiben Sie isotopischen Überfluß mit dem folgenden üblichen Ausdruck:
Ergebnisse
Um festzustellen, wie CMNs Anlagenleistung durch Nährstoff Partitionierung beeinflussen können, sind wir gewachsen Andropogon Gerardii Vitman, eine dominante Präriegras in einem Ziel-Pflanze-Experiment mit 6 gleichmäßig verteilte Nachbarn und intakt, abgetrennten, oder keine CMNs. Wir fanden, dass Durchtrennung oder Verhinderung CMNs vermindert Ziele oberirdische trockene Gewichte (Abbildung 2), was darauf hindeutet, dass intakte CMNs Pflanzenwa...
Diskussion
Unsere Ergebnisse bestätigen, dass unsere gedrehte Kern-Methode stark auf die Rolle der CMNs in unterirdischer Pflanze Interaktionen konzentrieren kann. Es gibt mehrere wichtige Schritte im Protokoll, jedoch, die verändert, Potenzial, die Fähigkeit zu CMN Auswirkungen erkennen zu beeinflussen. Es ist entscheidend für die interstitielle Bereich umgebenden Behälter mit einem nährstoffarmen Medium zu füllen. In unserem erfolglosen, gedreht-Kern Ziel Pflanze Experiment mit Guave Baumsetzlingen, zwar gab es eine deutli...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir möchten die zwei anonymen Gutachtern für ihre Vorschläge bedanken. Wir danken auch die zahlreichen Studenten, die mit dem konstruieren Töpfe, Mikrokosmen, geholfen haben und Behälter gesteckt und haben, die mit Pflege und Ernte von Experimenten unterstützt. Wir danken auch North Central College für Start-up Mittel (JW) sowie aktuelle Einrichtungen und Ashley Wojciechowski für Erhalt einer North Central College Richter Finanzhilfe ein Experiment mit diesen Methoden zu unterstützen. Teil dieser Arbeit wurde durch ein National Science Foundation Doctoral Dissertation Verbesserung Grant (DEB-1401677) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Commercial tubular seedlings container (called 'containers' in the manuscript) | Stuewe and Sons, Inc | Ray Leach Cone-tainer ™ | RLC3U |
| Course glass beads | Industrial Supply, Inc. | 12/20 sieve | Size #1 |
| Course silica sand | Florida Silica Sand | 6/20 50lb bags | None |
| Fine glass beads | Black Beauty | Black Beauty FINE Crushed Glass Abrasive (50 lbs) | BB-Glass-Fine |
| Hydrophobic membrane | Gore-tex | None | None |
| Large commercial tubular seedling containers | Stuewe and Sons, Inc. | Deepot ™ | D16L |
| Medium silica sand | Florida Silica Sand | 30/65 50 lb bags | None |
| Nylon mesh | Tube Lite Company, Inc. | Silk screen | LE7-380-34d PW YEL 60/62 SEFAR LE PECAP POLYESTER |
| Soil and foliar nutrient analysis facility | Kansas State University Soil Testing Lab | None | None |
| Stable isotope core facility | University of Miami | None | None |
Referenzen
- Remy, W., Taylor, T. N., Hass, H., Kerp, H. Four hundred-million-year-old vesicular arbuscular mycorrhizae. Proceedings of the National Academy of Sciences of the United States of America. 91 (25), 11841-11843 (1994).
- Smith, S. E., Read, D. J. . Mycorrhizal Symbiosis. , (2008).
- Giovannetti, M., Avio, L., Sbrana, C. . Mycorrhizal Networks. , 41-67 (2015).
- Giovannetti, M., Sbrana, C., Cresti, A., Heath, M., Geitmann, I. B. . Cell Biology of Plant and Fungal Tip Growth. Vol. 328. Nato Science Series, Sub-Series I: Life and Behavioural Sciences. , 221-231 (2001).
- Giovannetti, M., Sbrana, C., Avio, L., Strani, P. Patterns of below-ground plant interconnections established by means of arbuscular mycorrhizal networks. New Phytologist. 164 (1), 175-181 (2004).
- Avio, L., Pellegrino, E., Bonari, E., Giovannetti, M. Functional diversity of arbuscular mycorrhizal fungal isolates in relation to extraradical mycelial networks. New Phytologist. 172 (2), 347-357 (2006).
- Giovannetti, M., et al. At the root of the wood wide web: self recognition and nonself incompatibility in mycorrhizal networks. Plant Signaling & Behavior. 1 (1), 1-5 (2006).
- Miller, R., Kling, M. J. The importance of integration and scale in the arbuscular mycorrhizal symbiosis. Plant and Soil. 226 (2), 295-309 (2000).
- Miller, R., Jastrow, J., Reinhardt, D. R. External hyphal production of vesicular-arbuscular mycorrhizal fungi in pasture and tallgrass prairie communities. Oecologia. 103 (1), 17-23 (1995).
- Weremijewicz, J., Sternberg, L. d. S. L. O., Janos, D. P. Common mycorrhizal networks amplify competition by preferential mineral nutrient allocation to large host plants. New Phytologist. , (2016).
- Fellbaum, C. R., et al. Fungal nutrient allocation in common mycorrhizal networks is regulated by the carbon source strength of individual host plants. New Phytologist. 203 (2), 646-656 (2014).
- Lekberg, Y., Hammer, E. C., Olsson, P. A. Plants as resource islands and storage units--adopting the mycocentric view of arbuscular mycorrhizal networks. FEMS Microbiol Ecol. 74 (2), 336-345 (2010).
- Jakobsen, I., Hammer, E. C. . Mycorrhizal Networks. , 91-131 (2015).
- Jakobsen, I., Rosendahl, L. Carbon flow into soil and external hyphae from roots of mycorrhizal cucumber plants. New Phytologist. 115 (1), 77-83 (1990).
- Kiers, E. T., et al. Reciprocal rewards stabilize cooperation in the mycorrhizal symbiosis. Science. 333 (6044), 880-882 (2011).
- Hartnett, D. C., Hetrick, B. A. D., Wilson, G. W. T. Mycorrhizal influence on intra- and interspecific neighbour interactions among co-occuring prairie grasses. Journal of Ecology. 81 (4), 787-795 (1993).
- Hetrick, B. A. D., Wilson, G. W. T., Todd, T. C. Differential responses of C3 and C4 grasses to mycorrhizal symbiosis, phosphorus fertilization, and soil microorganisms. Canadian Journal of Botany. 68 (3), 461-467 (1990).
- Johnson, D., Leake, J. R., Read, D. J. Novel in-growth core system enables functional studies of grassland mycorrhizal mycelial networks. New Phytologist. 152 (3), 555-562 (2001).
- Leake, J. R., et al. Networks of power and influence: the role of mycorrhizal mycelium in controlling plant communities and agroecosystem functioning. Canadian Journal of Botany-Revue Canadienne De Botanique. 82 (8), 1016-1045 (2004).
- Babikova, Z., et al. Underground signals carried through common mycelial networks warn neighbouring plants of aphid attack. Ecology Letters. 16 (7), 835-843 (2013).
- Schüepp, H., Miller, D. D., Bodmer, M. A new technique for monitoring hyphal growth of vesicular-arbuscular mycorrhizal fungi through soil. Transactions of the British Mycological Society. 89 (4), 429-435 (1987).
- Miller, D. D., Bodmer, M., Schüepp, H. Spread of endomycorrhizal colonization and effects on growth of apple seedlings. New Phytologist. 111 (1), 51-59 (1989).
- Jakobsen, I., Gazey, C., Abbott, L. K. Phosphate transport by communities of arbuscular mycorrhizal fungi in intact soil cores. New Phytologist. 149 (1), 95-103 (2001).
- Johnson, D., Leake, J., Ostle, N., Ineson, P., Read, D. J. In situ 13CO2 pulse‐labelling of upland grassland demonstrates a rapid pathway of carbon flux from arbuscular mycorrhizal mycelia to the soil. New Phytologist. 153 (2), 327-334 (2002).
- Johnson, D., Leake, J., Read, D. J. Transfer of recent photosynthate into mycorrhizal mycelium of an upland grassland: short-term respiratory losses and accumulation. of 14C. Soil Biology and Biochemistry. 34 (10), 1521-1524 (2002).
- Walder, F., et al. Mycorrhizal networks: Common goods of plants shared under unequal terms of trade. Plant Physiology. 159 (June 2012), 789-797 (2012).
- Song, Y. Y., et al. Interplant communication of tomato tlants through underground common mycorrhizal networks. Plos One. 5 (10), e13324 (2010).
- Merrild, M. P., Ambus, P., Rosendahl, S., Jakobsen, I. Common arbuscular mycorrhizal networks amplify competition for phosphorus between seedlings and established plants. New Phytologist. 200 (1), 229-240 (2013).
- Janos, D. P., Scott, J., Aristizábal, C., Bowman, D. M. J. S. Arbuscular-mycorrhizal networks inhibit Eucalyptus tetrodonta seedlings in rain forest soil microcosms. Plos One. 8 (2), e57716 (2013).
- Wyss Lozano Hoyos, T. . Pinus elliottii var. densa Seedling Performance Reflects Ectomycorrhizas, Soil Nutrient Availability and Root Competition. , (2010).
- Mäder, P., Vierheilig, H., Alt, M., Wiemken, A. Boundries between soil compartments formed by microporous hydrophobic membranes (GORE-TEX) can be crossed by vesicular-arbuscular mycorrhizal fungi but not by ions in the soil solution. Plant and Soil. 152, 201-206 (1993).
- Mäder, P., et al. Transport of 15N from a soil compartment separated by a polytetrafluoroethylene membrane to plant roots via the hyphae of arbuscular mycorrhizal fungi. New Phytologist. 146 (1), 155-161 (2000).
- Brundrett, M., Bougher, N., Dell, B., Grove, T. . Working with Mycorrhizas in Forestry and Agriculture. , (1996).
- McGonigle, T. P., Miller, M. H., Evans, D. G., Fairchild, G. L., Swan, J. A. A new method which gives an objective-measure of colonization of roots by vesicular arbuscular mycorrhizal fungi. New Phytologist. 115 (3), 495-501 (1990).
- Weremijewicz, J., Janos, D. P. Common mycorrhizal networks amplify size inequality in Andropogon gerardii monocultures. New Phytologist. 198 (1), 203-213 (2013).
- Weremijewicz, J., O’Reilly, L. d. S. L., Janos, D. P. Arbuscular common mycorrhizal networks mediate intra-and interspecific interactions of two prairie grasses. Mycorrhiza. , 1-13 (2017).
- Weiner, J. Asymmetric competition in plant populations. Tree. 5 (11), 360-364 (1990).
- Damgaard, C., Weiner, J. Describing inequality in plant size or fecundity. Ecology. 81 (4), 1139-1142 (2000).
- Johnson, C. R., Joiner, J. N., Crews, C. E. Effects of N, K, and Mg on growth and leaf nutrient composition of 3 container grown woody ornamentals inoculated with mycorrhizae. Journal of the American Society for Horticultural Science. 105 (2), 286-288 (1980).
- Estrada-Luna, A. A., Davies, F. T., Egilla, J. N. Mycorrhizal fungi enhancement of growth and gas exchange of micropropagated guava plantlets (Psidium guajava L.) during ex vitro acclimatization and plant establishment. Mycorrhiza. 10 (1), 1-8 (2000).
- Hurlbert, S. H. Pseudoreplication and the design of ecological field experiments. Ecological Monographs. 54 (2), 187-211 (1984).
- Argüello, A., et al. Options of partners improve carbon for phosphorus trade in the arbuscular mycorrhizal mutualism. Ecology Letters. 19 (6), 648-656 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten