Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Исследование взаимодействия растений через общие микоризных сетей с использованием повернутый ядер
В этой статье
Резюме
Большинство растений в общинах вероятно соединены арбускулы микоризы (AM), но главным образом путем выращивания растений с или без mycorrhizas исследовано посреднических взаимодействий завод им. Мы представляем способ манипулировать общих микоризных сетей среди микоризных растений для изучения их последствий для взаимодействия растений.
Аннотация
Арбускулы микоризных (AM) грибов влияют завод минеральных питательных и роста, следовательно, они имеют возможность влиять на завод взаимодействий. Сила их влияния в extraradical мицелия, которые распространяются за пределы зоны питательных поблизости корни, чтобы в конечном итоге объединению людей в рамках общей сети микоризных (CMN). Однако, большинство экспериментов, исследовали роль AM грибов в завод взаимодействия путем выращивания растений с против без микоризных грибов, метод, который не явно рассмотреть роль CMNs. Здесь мы предлагаем метод, который управляет CMNs расследовать их роль в завод взаимодействий. Наш метод использует изменение контейнеры с коническими днищами с нейлоновой сетки или гидрофобных материалов, охватывающих щелевые отверстия, 15N удобрения и бедных питательными веществами интерстициальных песка. CMNs либо остаются нетронутыми взаимодействующих индивидуумами, разрушенных в результате вращения контейнеров, или предотвратить от формирования твердых барьер. Наши результаты показывают, что вращение контейнеры достаточно, чтобы нарушить CMNs и предотвращения их воздействие на растения взаимодействия через CMNs. Наш подход выгодно, потому что он имитирует аспекты природы, такие как саженцев, выстукивать в уже созданной CMNs и использование набора AM грибов, которые могут предоставлять различные преимущества. Хотя наш эксперимент ограничивается расследованием растений на этапе сеянца, завод взаимодействие между CMNs могут быть обнаружены с помощью нашего подхода, которые поэтому могут быть применены для изучения биологических вопросы о функционировании CMNs в экосистемах.
Введение
Арбускулы микоризных (AM) грибов помощь растений в колонизации земель 460 миллионов лет назад1 и сегодня, они являются вездесущими симбионтами большинства растений2, предоставления им жизненно важных минеральных питательных веществ для роста. Тонкий, нитевидные гифы AM грибов комбикорма для минеральных питательных веществ за пределами зон питательных возле корней, часто сталкиваются и колонизировать корневых систем соседних растений в «общих микоризных сеть» (CMN). Общие микоризных сетей также могут образовывать при грибковых germlings присоединиться созданы сети3, или когда я гифы предохранитель (анастомозируют) с conspecific гифы4,5,6,7. Масштабы этих extraradical ГИФы в почве огромен, с extraradical гифы, составляющие 20% до 30% общей почвы микробной биомассы в прерии и пастбищных почвах8 и растяжения для 111 m·cm-3 в ненарушенных луга9 .
Общие микоризных сети раздел минеральных питательных веществ среди взаимосвязанных соседних растений10,11,12,13. Растения могут получить до 80% их фосфора и 25% их требований азота от AM грибов, обеспечивая до 20% от их общей фиксированной углерода для грибов в возвращение14. Недавние работы культуры в пробирке корневого органа обнаружила, что CMNs преференциально обмен минеральных питательных веществ с принимающей корнями, которые обеспечивают наиболее углерода до11,грибов12. Кроме того различные виды грибов AM могут отличаться в их качества как симбиотические партнеров, причем некоторые грибки, обмена больше фосфора для меньше углерода, чем другие15. Хотя корень орган культуры являются полезной модели для изучения AM симбиоз, потому что они представляют тщательно контролируемых средах и возможность непосредственно наблюдать гиф межсоединений, они не включают фотосинтезирующим побеги, которые влияют на важные физиологические процессы фотосинтеза, транспирации и суточные изменения, а также составляющих углерода и минеральных питательных раковины.
В природе саженцы скорее задействовать уже созданных CMNs. До недавнего времени, однако, ученые только изучили влияние AM грибов на питание растений, растения с и без утра грибов, часто с одного вида гриба AM. Хотя эта работа была чрезвычайно информативным для нашего понимания арбускулы mycorrhizas, этот метод упустила потенциально решающую роль, которую могут иметь CMNs в взаимодействия среди растений взаимосвязанных узлов. В частности растения, которые сильно зависят от AM грибов для роста минимально взаимодействовать без утра грибов16,17, возможно смешение наша интерпретация AM гриб опосредованного взаимодействия при использовании в качестве «контроль» для базового ссылка.
Мы предлагаем подход вращается ядро для расследования роли CMNs в завод взаимодействий и структурирование населения. Наш подход имитирует компоненты AM симбиоз в природе, потому что весь растений соединения учредила CMNs и все растения выращиваются с утра грибов. Путем удаления корня взаимодействий, наша методология специально фокусируется на взаимодействий, посредничестве AM грибов также отслеживая минеральных питательных движения в пределах CMNs. Наш подход основывается на предыдущей работе, которая использована повернутый ядер как на местах, так и в Теплице для понимания функционирования реально AM.
Повернутое основной метод был создан в литературе как метод для манипулирования extraradical гифы18,19,20,21, и он имел несколько перевоплощений в зависимости от своей цели над в последние два десятилетия. Первоначально, Сетчатые мешки или барьеры, позволяя в рост гифы были использованы для обеспечения свободной от корня отсеков для количественной оценки суммы арбускулы микоризных ГИФы в почве22,23. Затем цилиндрические ядер почвы, заключенный в жесткой воды трубы или пластиковые трубки с слотов в нейлоновая сетка проницаемые, охватываемых гифы, но не корни, были разработаны. Это легко может быть повернут сорвать extraradical мицелия18,24,25. Повернутое ядер были помещены между растениями, и гиф длины почвы на грамм почвы18, флюсы 13C extraradical мицелия24, или усвоение фосфора из растений свободный ядер были количественных18. Другой способ использования таких ядер был для выращивания растений в них в поле сократить колонизации корней AM грибов через частые гиф нарушения в качестве альтернативы к стерилизации или применение фунгицидов, оба из которых имеют косвенное воздействие на почву органических вопрос и другие микробы18.
Гиф сетки барьер подход использовался для расследования питательных секционирование и растений взаимодействия через CMNs, но в прямоугольные микромира, а не с повернутым ядер. Уолдер et al.26 исследованы взаимодействия между Linum usitatissimum (лен) и сорго биколор (сорго) путем отслеживания минеральных питательных веществ для обмена углерода с использованием изотопов через CMNs любой из грибов AM Rhizophagus irregularis или Funneliformis mosseae26. Микромира в их исследование включает в себя завод отсеков, разделенных сетка барьеры, гиф отсеки, доступные только для микоризных гифы и помечены гиф отсеков, которые содержали стабильных и радиоактивных изотопов. Как элементы управления исследования используют методы лечения без арбускулярными. 27 песня et al. используется аналогичный подход для поиска это растение, которое сигналы могут перевозиться только среди установленных CMNs ф mosseae , когда один завод был заражен грибкового патогена. Кроме того аналогично Уолдер et al.26, Merrild et al.28 выросли растения в отдельных отсеков, разделенных сетка расследовать производительность завода Solanum lycopersicum (помидор) саженцев, связанных CMNs в большой Cucumis sativus завод (огурец), который представлял собой обильные углерода источник. Они также использовали процедуры без микоризных грибов вместо отсечения CMNs28. В эксперимент, во-вторых, связанные углерода для обмена фосфора было рассмотрено с использованием сетчатых мешков с 32P. микромира с гиф сетки барьеров и CMN, разорвав лечения были использованы Янош et al.29, который исследовал конкуренции взаимодействие между саженцев саванны пород деревьев эвкалипта tetrodonta и пересадке дерева тропических лесов, Litsea железистый. В этом исследовании, Янош et al.29 поднял отсеков, содержащие сеянцы несколько сантиметров, раздвижные слои сетки против друг друга, чтобы сломать гиф межсоединений29.
Последним шагом в эволюции повернутый основной метод был выращивать растения внутри ядер, которые находятся в горшки или микромира20,30. ВИСС30 используется повернутый ядер для выяснения, если extraradical AM мицелия может колонизировать Сосна Эллиота саженцев при распространении от доноров или «медсестра» AM растения-хозяина, Tamarindus indicaи как extraradical мицелий ectomycorrhizal грибов влияет на производительность рассада. Большие коммерческие трубчатых Рассада контейнеры (Таблица материалов) в пределах микромира были либо твердого пластика (не CMNs) или прорези и покрыты гидрофобные мембраны. Щелевые Рассада контейнеры были либо не поворачивается (нетронутыми CMNs) или вращать разорвать установленных CMNs. повернутый ядер с различными сетки барьер, размеры были использованы Бабикова et al.20 расследовать Билогические сигнализации через CMNs среди горошек Фаба растения (бин). В их исследовании Центральный доноров завод в 30 см диаметр мезокосмы было взаимосвязано корни и гифы (не барьер) или только CMNs через сетку 40 мкм. Центральный растения были разорваны из взаимодействия с соседних растений путем поворота сетки прилагается ядер, или CMNs помешала тонкой сетки 0,5 мкм, включающего ядро.
Здесь мы представляем метод, который сочетает в себе аспекты предварительного повернут основных подходов к изучить влияние CMNs на прямой завод взаимодействий, в сочетании с стабильного изотопа трассировки. Наш метод использует «целевой завод» подход, в котором Центральный завод интереса окружен соседних растений. Растения выращиваются внутри вращающийся Рассада контейнеры, которые прорези и покрыты нейлоновая сетка шелкографии, гидрофобные мембраны, или немодифицированных твердого пластика. Общие микоризных сетей разорваны один раз в неделю или сохранены, и 15N стабильных изотопов отслеживать движение азота от соседей повернутый ядер на главной мишенью завод. Сравнивая размер растений с поглощение минеральных питательных веществ и стабильных изотопов, мы определяем, какие растения могут воспользоваться или страдают от CMNs во взаимодействиях среди растений-хозяев.
протокол
1. Строительство и Ассамблеи поворотный ядер
- Изменить коммерческие трубчатых Рассада контейнеры (впоследствии под названием «контейнеры»; Таблица материалов) чтобы иметь 19 мм в ширину x 48 см Длина отверстия.
- С помощью сверлильный с 19 мм отверстие увидел без центрального, экспериментального сверло, вырезать два отверстия, один над другим, в стороны контейнера (диаметр 2,5 см x 12,1 см длиной), так, чтобы отверстия около 1 см друг от друга. Держите контейнер против забор на буровых печати и остановка с короткой дюбель, который приспособит внутри контейнера, чтобы помочь удерживать его на месте во время бурения. Используйте контейнер с гибкой пластиковой для предотвращения растрескивания.
- Вырезать оставшиеся тонкий кусок пластика между отверстиями с ножницы, кусачки или по металлу (для жесткого пластика сабля пила) чтобы сделать один удлиненные открытия шириной около 2 см и 5 см длиной.
- Повторите шаги 1.1.1-1.1.2 на противоположной стороне контейнера.
- Обложка слотов с нейлоновой сетки или гидрофобные мембраны (рис. 1A).
- Нарежьте нейлоновая сетка с 40 мкм поры 9,5 х 8,5 см. Вырежьте столько частей как контейнеры.
- Нейлоновая сетка внешне на контейнеры для покрытия оба отверстия с некоторым легким перекрытием в ткани с использованием высокопрочных, промышленных горячего клея клей.
- При необходимости предотвращения движения воды, такие как при использовании водорастворимого питательных веществ или стабильных изотопов, покрывают сетка слой нейлона с гидрофобные мембраны31,32 (Таблица материалов), позволяющий ам гифы гриба до перевал, но движение только водяного пара и не жидкой воды.
- Место горячего клея вокруг отверстия в контейнере и длинные по краям сетки нейлона. Ролл контейнера на ткань, чтобы избежать горения пальцев. Добавьте слой клея вдоль края ткани, где сетка ребер перекрытия. Нажмите на край на некоторые картон плотно запечатать его. Всегда ролл последовательно в одном направлении, которое будет же направление вращения готовых контейнеров в горшки или микромира, так что не перекрытые сетки края будет толкнул потенциально копаться в субстрат.
- После остывания клея, лента верхние и нижние концы ткани в контейнер, чтобы предотвратить свободные края и копирования с помощью гибкой ленты, такие как электрика ленты.
- Используя ту же ленту как шаг 1.2.5, покрывают маленькие отверстия по бокам конический конец (не отверстие на кончике нижней) каждого контейнера для предотвращения роста корней из контейнера в остальной части микрокосм горшок.
- Чтобы предотвратить потери почвы обеспечивая дренаж, место стекла мрамора в нижней части каждого контейнера.
- Для управления лечения, которые не связаны с любой потенциал для CMN форме между растениями используйте твердые, неизмененное контейнеры (рис. 1A).
2. Ассамблея горшки или микромира подогнать конические концы контейнеров
- Чтобы гарантировать контейнеры стоять в неподвижном положении и имеют надлежащего дренажа, переверните горшок так что снизу вверх. Вырежьте вокруг нижней части горшка, оставляя небольшой lip для поддержки, используя сабля пила.
- Подготовка пенополистирола
- Вырежьте пенополистирола, около 36 мм толщиной, чтобы тот же диаметр, как в нижней части горшка с помощью ленточной пилы с jig круг резки.
- Просверлить отверстия в пену с использованием буровых печати и 19 мм отверстие увидел (без центрального сверло) в шаблон, в котором будет располагаться контейнеры.
- Для целевой завод эксперимента сверлить центральное отверстие с равноудаленных отверстиями для соседних окружающих его лиц. Для горшок диаметром 15,5 см пространства шесть отверстия 12 мм друг от друга по окружности круга Диаметр 11 см (рис. 1B).
- Выложить отверстия, гексагонально или в массиве квадратный (рис. 1 c, D) для эксперимента микромира.
3. Заполнение контейнеров и горшки с почвы и песчаных смесей
- Выберите желаемый грунтосмесь и добавить AM гриб поле собранные или пот культивированный посевным материалом в почву равномерно смешивая нарезанные кусочки корня (1 — 2 см длиной) тщательно с почвой. Смешайте желаемого почвы с бесплодных кварцевый песок или стеклянные бусы для уменьшения концентрации минеральных питательных веществ для растений.
- Позиция заполненных контейнеров в просверленные пены или микрокосм нижней и заполнить интерстициального пространства с бесплодными субстрата.
- Заполните интерстициального пространства между контейнеры со смесью бедных питательными веществами кварцевого песка, используя воронку для оказания помощи в заполнении небольших пространствах. Чтобы обеспечить адекватный дренаж и имитировать текстуру почвы, смесь средний размер частиц песка, например класс 6-20, с небольшой размер частиц песка, например класс 30-65, в бетономешалку.
4. Создание CMNs по всему горшки/микромира
- Растений предварительной «медсестра» желаемого вида в каждый контейнер для поддержания AM грибов, так что они могут распространяться среди контейнеров и установить CMNs.
- Когда все контейнеры создали саженцев, удалите побеги путем отсечения, так что только один человек остается в каждом контейнере.
- Разрешить 2-3 месяца для роста растений и CMN учреждение.
5. Создание экспериментальной растений и лечения
- Сеять экспериментальной растений, посев или пересадка в контейнеры. Если инициализация, подождите, пока все контейнеры имеют проросшие рассаду перед удалением медсестра предварительной обработки растений путем отсечения их побеги. Если пересадка, клип все до очистных сооружений до пересадки экспериментальных саженцев для предотвращения непреднамеренных последствий конкуренции.
- Создание CMN лечения, либо оставив контейнеры не переехал в течение всего эксперимента (нетронутыми CMNs) или поворачивая их каждую неделю, чтобы физически разорвать гифы, распространение среди модифицированных контейнеры (разорвала CMNs; Рисунок 1A). При разрыве CMNs, вращайте каждый контейнер через один полный оборот, чтобы избежать непреднамеренного изменения надземной взаимодействия, особенно для гелиотропный растений.
- Сильно воды все горшки или микромира сразу после поворота восстановить контакт между сторонами контейнеров и интерстициальный субстрата.
6. Отслеживание движения минеральных питательных веществ через CMNs
- Удобрять растения соседних с 0,5% 15N обогащенный KNO3 и NH4Cl.
- Цель человека с 14N удобрения равной концентрации Удобряйте.
7. Мониторинг и техническое обслуживание эксперимента
- Регулярно (по крайней мере ежемесячно) повторно рандомизировать позиции горшки или микромира в течение эксперимента.
- Еженедельно измерения роста, такие как высота или длинный лист длиной (для трав) для отслеживания роста начинает медленно, потому что это важно для урожая до растения становятся корень прыгните.
8. урожай эксперимента
- Клип все наземные ткани и уложите помечены конвертов, которые определяют их лечения, горшок или микрокосм и положение отдельных растений.
- Сухая трава тканей при 60 ° C до постоянного веса. Мера сухого веса каждой растительной ткани.
- Разрешить почвы высохнуть до извлечения контейнеров и уборки корни.
- Деликатно отмахнуться от как много почвы как можно дальше от корневых систем и мыть их в кастрюлю воды или под нежный поток воды на сито размера пор 250 микрон.
- Разрешить корни просушите и весят всей корневой системы.
- Клип корневой системы бессистемно и хранить корневых фрагментов в 50% этанола. После того, как они запятнаны33, используйте эти фрагменты для количественного определения корневого колонизации с помощью метода пересечения сетки34.
- Повторно взвесить оставшиеся корневой системы и хранить его в обозначенные Бумажный конверт для просушки при 60 ° C для оценки сухого веса. Чтобы вычислить вес всей корневой системы используйте следующее уравнение:
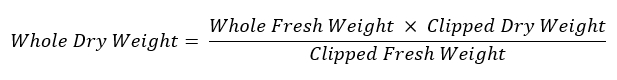
9. минеральных питательных веществ и стабильного изотопа анализы
- Группировка биомассы в «децилей» или 10 групп, «octiles» или 8 групп, «квартили» или четыре группы и т.д. саженцы после ранга упорядочение их по весу если количество ткани является слишком низким для минимальных требований для переваривания для определения минеральных питательных веществ концентрации.
- Отправьте лиственного покрова контракт лабораторию для анализа минеральных питательных веществ и стабильных изотопов (Таблица материалов).
- Опишите изотопный изобилия, используя следующее выражение обычного:
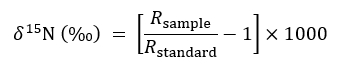
где R представляет 15N /14N коэффициент выборки или стандарта, который является атмосферный N. - Использования немодифицированных, лечения твердый контейнер в качестве элемента управления для фона 15N соотношения в следующее уравнение баланса массы при количественной количество 15N, принятые Целевой завод в разорваны или нетронутыми CMN лечения:
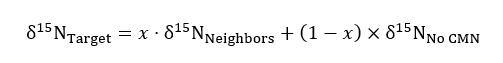
где δ15N представляет изотопный обилие целей, соседи и целевой растений не CMN лечения, а x (в виде десятичной дроби) процент азота полученные Целевой завода от соседа контейнеров, к которым был добавлен ярлык. Для каждого целевого растения собраны соседей получены значения δ15Nсоседей .
- Опишите изотопный изобилия, используя следующее выражение обычного:
Результаты
Чтобы определить, как CMNs может влиять на производительность завода через питательных перегородки, мы выросли, Бородач Жерара Витман, травы прерии доминирующим, в эксперименте целевой завод с 6 равноудаленных соседей и нетронутыми, разорвала или не CMNs. Мы обнаружи?...
Обсуждение
Наши результаты подтверждают, что наш метод повернутый ядро может резко сосредоточиться на роль CMNs в Билогические завод взаимодействий. Есть несколько важных шагов в протоколе, однако, если изменены, имеющих возможность влиять на способность обнаруживать CMN эффекты. Важно заполнить ин...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы хотели бы поблагодарить два анонимных рецензентов для их предложений. Мы также благодарим многочисленных магистрантов, которые помогли с построения горшки, микромира и прорези контейнеров и ВОЗ оказывали помощь с поддержания и промысловые эксперименты. Мы также благодарим Северный Центральный колледж для запуска средства (для JW) и учреждений, а также Эшли Войцеховский для получения Северный Центральный Колледж Рихтер Грант поддержки эксперимент с использованием этих методов. Часть этой работы была финансируется национальной науки докторской диссертации улучшение Грант фонда (DEB-1401677).
Материалы
| Name | Company | Catalog Number | Comments |
| Commercial tubular seedlings container (called 'containers' in the manuscript) | Stuewe and Sons, Inc | Ray Leach Cone-tainer ™ | RLC3U |
| Course glass beads | Industrial Supply, Inc. | 12/20 sieve | Size #1 |
| Course silica sand | Florida Silica Sand | 6/20 50lb bags | None |
| Fine glass beads | Black Beauty | Black Beauty FINE Crushed Glass Abrasive (50 lbs) | BB-Glass-Fine |
| Hydrophobic membrane | Gore-tex | None | None |
| Large commercial tubular seedling containers | Stuewe and Sons, Inc. | Deepot ™ | D16L |
| Medium silica sand | Florida Silica Sand | 30/65 50 lb bags | None |
| Nylon mesh | Tube Lite Company, Inc. | Silk screen | LE7-380-34d PW YEL 60/62 SEFAR LE PECAP POLYESTER |
| Soil and foliar nutrient analysis facility | Kansas State University Soil Testing Lab | None | None |
| Stable isotope core facility | University of Miami | None | None |
Ссылки
- Remy, W., Taylor, T. N., Hass, H., Kerp, H. Four hundred-million-year-old vesicular arbuscular mycorrhizae. Proceedings of the National Academy of Sciences of the United States of America. 91 (25), 11841-11843 (1994).
- Smith, S. E., Read, D. J. . Mycorrhizal Symbiosis. , (2008).
- Giovannetti, M., Avio, L., Sbrana, C. . Mycorrhizal Networks. , 41-67 (2015).
- Giovannetti, M., Sbrana, C., Cresti, A., Heath, M., Geitmann, I. B. . Cell Biology of Plant and Fungal Tip Growth. Vol. 328. Nato Science Series, Sub-Series I: Life and Behavioural Sciences. , 221-231 (2001).
- Giovannetti, M., Sbrana, C., Avio, L., Strani, P. Patterns of below-ground plant interconnections established by means of arbuscular mycorrhizal networks. New Phytologist. 164 (1), 175-181 (2004).
- Avio, L., Pellegrino, E., Bonari, E., Giovannetti, M. Functional diversity of arbuscular mycorrhizal fungal isolates in relation to extraradical mycelial networks. New Phytologist. 172 (2), 347-357 (2006).
- Giovannetti, M., et al. At the root of the wood wide web: self recognition and nonself incompatibility in mycorrhizal networks. Plant Signaling & Behavior. 1 (1), 1-5 (2006).
- Miller, R., Kling, M. J. The importance of integration and scale in the arbuscular mycorrhizal symbiosis. Plant and Soil. 226 (2), 295-309 (2000).
- Miller, R., Jastrow, J., Reinhardt, D. R. External hyphal production of vesicular-arbuscular mycorrhizal fungi in pasture and tallgrass prairie communities. Oecologia. 103 (1), 17-23 (1995).
- Weremijewicz, J., Sternberg, L. d. S. L. O., Janos, D. P. Common mycorrhizal networks amplify competition by preferential mineral nutrient allocation to large host plants. New Phytologist. , (2016).
- Fellbaum, C. R., et al. Fungal nutrient allocation in common mycorrhizal networks is regulated by the carbon source strength of individual host plants. New Phytologist. 203 (2), 646-656 (2014).
- Lekberg, Y., Hammer, E. C., Olsson, P. A. Plants as resource islands and storage units--adopting the mycocentric view of arbuscular mycorrhizal networks. FEMS Microbiol Ecol. 74 (2), 336-345 (2010).
- Jakobsen, I., Hammer, E. C. . Mycorrhizal Networks. , 91-131 (2015).
- Jakobsen, I., Rosendahl, L. Carbon flow into soil and external hyphae from roots of mycorrhizal cucumber plants. New Phytologist. 115 (1), 77-83 (1990).
- Kiers, E. T., et al. Reciprocal rewards stabilize cooperation in the mycorrhizal symbiosis. Science. 333 (6044), 880-882 (2011).
- Hartnett, D. C., Hetrick, B. A. D., Wilson, G. W. T. Mycorrhizal influence on intra- and interspecific neighbour interactions among co-occuring prairie grasses. Journal of Ecology. 81 (4), 787-795 (1993).
- Hetrick, B. A. D., Wilson, G. W. T., Todd, T. C. Differential responses of C3 and C4 grasses to mycorrhizal symbiosis, phosphorus fertilization, and soil microorganisms. Canadian Journal of Botany. 68 (3), 461-467 (1990).
- Johnson, D., Leake, J. R., Read, D. J. Novel in-growth core system enables functional studies of grassland mycorrhizal mycelial networks. New Phytologist. 152 (3), 555-562 (2001).
- Leake, J. R., et al. Networks of power and influence: the role of mycorrhizal mycelium in controlling plant communities and agroecosystem functioning. Canadian Journal of Botany-Revue Canadienne De Botanique. 82 (8), 1016-1045 (2004).
- Babikova, Z., et al. Underground signals carried through common mycelial networks warn neighbouring plants of aphid attack. Ecology Letters. 16 (7), 835-843 (2013).
- Schüepp, H., Miller, D. D., Bodmer, M. A new technique for monitoring hyphal growth of vesicular-arbuscular mycorrhizal fungi through soil. Transactions of the British Mycological Society. 89 (4), 429-435 (1987).
- Miller, D. D., Bodmer, M., Schüepp, H. Spread of endomycorrhizal colonization and effects on growth of apple seedlings. New Phytologist. 111 (1), 51-59 (1989).
- Jakobsen, I., Gazey, C., Abbott, L. K. Phosphate transport by communities of arbuscular mycorrhizal fungi in intact soil cores. New Phytologist. 149 (1), 95-103 (2001).
- Johnson, D., Leake, J., Ostle, N., Ineson, P., Read, D. J. In situ 13CO2 pulse‐labelling of upland grassland demonstrates a rapid pathway of carbon flux from arbuscular mycorrhizal mycelia to the soil. New Phytologist. 153 (2), 327-334 (2002).
- Johnson, D., Leake, J., Read, D. J. Transfer of recent photosynthate into mycorrhizal mycelium of an upland grassland: short-term respiratory losses and accumulation. of 14C. Soil Biology and Biochemistry. 34 (10), 1521-1524 (2002).
- Walder, F., et al. Mycorrhizal networks: Common goods of plants shared under unequal terms of trade. Plant Physiology. 159 (June 2012), 789-797 (2012).
- Song, Y. Y., et al. Interplant communication of tomato tlants through underground common mycorrhizal networks. Plos One. 5 (10), e13324 (2010).
- Merrild, M. P., Ambus, P., Rosendahl, S., Jakobsen, I. Common arbuscular mycorrhizal networks amplify competition for phosphorus between seedlings and established plants. New Phytologist. 200 (1), 229-240 (2013).
- Janos, D. P., Scott, J., Aristizábal, C., Bowman, D. M. J. S. Arbuscular-mycorrhizal networks inhibit Eucalyptus tetrodonta seedlings in rain forest soil microcosms. Plos One. 8 (2), e57716 (2013).
- Wyss Lozano Hoyos, T. . Pinus elliottii var. densa Seedling Performance Reflects Ectomycorrhizas, Soil Nutrient Availability and Root Competition. , (2010).
- Mäder, P., Vierheilig, H., Alt, M., Wiemken, A. Boundries between soil compartments formed by microporous hydrophobic membranes (GORE-TEX) can be crossed by vesicular-arbuscular mycorrhizal fungi but not by ions in the soil solution. Plant and Soil. 152, 201-206 (1993).
- Mäder, P., et al. Transport of 15N from a soil compartment separated by a polytetrafluoroethylene membrane to plant roots via the hyphae of arbuscular mycorrhizal fungi. New Phytologist. 146 (1), 155-161 (2000).
- Brundrett, M., Bougher, N., Dell, B., Grove, T. . Working with Mycorrhizas in Forestry and Agriculture. , (1996).
- McGonigle, T. P., Miller, M. H., Evans, D. G., Fairchild, G. L., Swan, J. A. A new method which gives an objective-measure of colonization of roots by vesicular arbuscular mycorrhizal fungi. New Phytologist. 115 (3), 495-501 (1990).
- Weremijewicz, J., Janos, D. P. Common mycorrhizal networks amplify size inequality in Andropogon gerardii monocultures. New Phytologist. 198 (1), 203-213 (2013).
- Weremijewicz, J., O’Reilly, L. d. S. L., Janos, D. P. Arbuscular common mycorrhizal networks mediate intra-and interspecific interactions of two prairie grasses. Mycorrhiza. , 1-13 (2017).
- Weiner, J. Asymmetric competition in plant populations. Tree. 5 (11), 360-364 (1990).
- Damgaard, C., Weiner, J. Describing inequality in plant size or fecundity. Ecology. 81 (4), 1139-1142 (2000).
- Johnson, C. R., Joiner, J. N., Crews, C. E. Effects of N, K, and Mg on growth and leaf nutrient composition of 3 container grown woody ornamentals inoculated with mycorrhizae. Journal of the American Society for Horticultural Science. 105 (2), 286-288 (1980).
- Estrada-Luna, A. A., Davies, F. T., Egilla, J. N. Mycorrhizal fungi enhancement of growth and gas exchange of micropropagated guava plantlets (Psidium guajava L.) during ex vitro acclimatization and plant establishment. Mycorrhiza. 10 (1), 1-8 (2000).
- Hurlbert, S. H. Pseudoreplication and the design of ecological field experiments. Ecological Monographs. 54 (2), 187-211 (1984).
- Argüello, A., et al. Options of partners improve carbon for phosphorus trade in the arbuscular mycorrhizal mutualism. Ecology Letters. 19 (6), 648-656 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены