需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
旋转芯在常见菌根网络中植物相互作用的研究
摘要
社区内的大多数植物可能是由丛枝菌根 (AM) 真菌相互关联的, 但它们对植物相互作用的介导主要是通过种植与不生长菌根的植物进行的。我们提出了一种方法来操纵常见的菌根网络之间的菌根植物, 以研究它们对植物相互作用的后果。
摘要
丛枝菌根真菌 (AM) 影响植物矿物养分的吸收和生长, 因此, 它们有可能影响植物的相互作用。它们的影响力量在于在根附近发现的营养枯竭区之外的硬质菌丝体, 最终将个体连接在一个共同的菌根网络 (CMN) 中。然而, 大多数实验都研究了 AM 真菌在植物相互作用中的作用, 通过种植植物与不种植菌根真菌, 这种方法未能明确解决 Cmn 的作用。在这里, 我们提出了一种方法来操纵 Cmn, 以研究它们在植物相互作用中的作用。我们的方法使用改进的容器与锥形底部与尼龙网和/或疏水材料覆盖开槽开口, 15n 肥料, 和营养差的间质砂。Cmn 要么在相互作用的个体之间保持完整, 要么因容器的旋转而被切断, 要么被固体屏障阻止形成。我们的研究结果表明, 旋转容器足以破坏 Cmn, 并防止它们对植物在 Cmn 之间的相互作用的影响。我们的方法是有利的, 因为它模仿自然的各个方面, 如幼苗挖掘已经建立的 Cmn 和使用一套 AM 真菌, 可能会提供不同的好处。尽管我们的实验仅限于研究处于苗期的植物, 但使用我们的方法可以检测到 Cmn 之间的植物相互作用, 因此可以应用于研究有关 Cmn 在生态系统中的功能的生物学问题。
引言
丛枝菌根真菌 (AM) 辅助植物在4.6亿年前的土地殖民, 今天, 他们是无处不在的共生关系的大多数植物 2, 为他们提供了重要的矿物营养物质的生长。AM 真菌的薄的、线状的菌丝在根系附近营养物质枯竭区以外寻找矿物质, 经常在 "常见的菌根网" (CMN) 中遇到和殖民邻近植物的根系。常见的菌根网也可能形成真菌芽业加入建立的网络3, 或当 am 菌丝融合 (吻合) 与康特异性菌丝4,5,6, 7.这些体外菌丝在土壤中的作用范围是巨大的, 在草原和牧场土壤中, 体外菌种占土壤微生物总生物量的20% 至 30%, 在未受干扰的草地上拉伸 111 m-3 .
常见的菌根网络在相互连接的相邻植物之间划分矿物养分 10,11,12,13。植物可从 AM 真菌中获得高达80% 的磷和25% 的氮需求, 同时向真菌提供高达20% 的固定碳, 作为回报14。最近的体外根系培养研究发现, cmn 优先交换矿物营养素与宿主根, 为真菌提供最多的碳11,12.此外, 不同种类的 AM 真菌作为共生伙伴的质量可能不同, 一些真菌交换更多的磷与更少的碳比其他15.虽然根器官培养是研究 AM 共生的有益模型, 因为它们提供了精心控制的环境和直接观察菌丝相互联系的能力, 但它们不包括影响的光合作用芽重要的生理过程, 如光合作用, 蒸腾作用, 日变化, 以及构成碳和矿物质营养汇。
在自然界中, 幼苗很可能会进入已经建立的 Cmn。然而, 直到最近, 科学家们还只研究了 AM 真菌对植物营养的影响, 因为种植的植物有 am 真菌, 而且通常是用单一种类的 AM 真菌生长。尽管这项工作为我们理解丛枝菌根提供了大量信息, 但这种方法忽略了 Cmn 在互联宿主植物之间的相互作用中可能具有的潜在关键作用。特别是, 高度依赖 am 真菌生长的植物在没有 am真菌 16,17 的情况下相互作用最小, 这可能混淆了我们对 am 真菌介导的相互作用的解释, 当用作基线的 "控制" 时参考。
我们提出了一个旋转核心的方法来调查 Cmn 在植物相互作用和人口结构中的作用。我们的方法模仿了 am 共生的组成部分, 因为整个植物加入了既定的 Cmn, 所有的植物都是用 AM 真菌生长的。通过去除根系相互作用, 我们的方法特别关注 am 真菌介导的相互作用, 同时跟踪 Cmn 内的矿物养分运动。我们的方法建立在以前的工作基础上, 这些工作在现场和温室中都使用了旋转的核心来理解 AM 的实际运作。
旋转核心方法已在文献中确立为一种方法来操纵过度的菌丝18,19, 20,21, 它已经有几个轮回取决于它的目的在过去的二十年里最初, 网袋或允许菌丝生长的屏障被用来提供无根隔间, 以量化土壤中的丛枝菌根菌丝的数量 22,23。然后, 开发了封闭在刚性水管或塑料管中的土体圆柱形岩心, 其槽被尼龙网覆盖, 但不能被菌丝穿透, 但不能被根部穿透。这些可以很容易地旋转, 以扰乱外菌丝体18,24,25。旋转岩心在植物之间放置, 土壤每克土壤的包骨长度 18, 13c 通量为硬外菌丝体24, 或对无植物岩心的磷吸收进行了定量的 18。这种核心的另一个用途是在田间种植植物, 通过频繁的菌丝破坏作为灭菌或使用杀菌剂的替代方法, 减少 AM 真菌对根系的定植, 这两者都对土壤有机物质产生间接影响物质和其他微生物18。
在 cmn 之间, 采用了菌丝网格屏障法研究营养分配和植物相互作用, 但采用矩形微宇宙而不是旋转的核心。Walder 等人26 通过利用 am 真菌根瘤菌中的同位素追踪矿物养分进行碳交换, 研究了亚麻(亚麻) 和高粱(高粱) 之间的相互作用不规则的或毛沙毛花26。他们研究中的微观成分包括由网状屏障隔开的植物隔间、只有菌根菌丝袋才能进入的菌丝隔间, 以及含有放射性和稳定同位素的标记的菌丝隔间。作为对照, 该研究使用了不含菌根真菌的治疗方法。Song 等人 (song等人) 也采用了类似的方法, 发现只有当一种植物被真菌病原体感染时, 植物信号才能在一种植物的既定 cmn 中携带。另外, 与 Walder 等人26 相似, Merrild 等人. 28人在用网状方式分开的各个隔间中种植植物, 以研究由 cmn 连接到一个大黄瓜的番茄幼苗的植物性能黄瓜(黄瓜) 植物, 代表着丰富的碳源。他们还使用了不含菌根真菌的治疗方法, 而不是切断 Cmn28。在第二个相关实验中, 用带有32p. 微生物标记的微生物袋进行了磷交换检测, 该网袋带有连字符屏障, Junos 等人在29岁时使用了 cmn 切断作为治疗方法稀树树种桉树幼苗与雨林树--------- --------------------------------------------------------------- -----------------在这项研究中, Janos等人 29岁举起了一个几厘米长的幼苗, 滑动的网层相互对抗,以打破菌丝连接29。
旋转核心方法演变的最后一步是在锅或微观世界20、30内的岩心内生长植物。Wyss30使用旋转岩心来确定从供体或 "护士" 寄主植物--罗望子植物中繁殖时, 亚木耳外是否能对小松幼苗进行菌落幼苗的菌落繁殖, 以及外外的外菌根真菌会影响幼苗的性能。微宇宙内的大型商用管状幼苗容器 (材料表) 要么是固体塑料 (无 cmn), 要么是开槽并覆盖着疏水膜。开槽苗容器要么没有旋转 (完整的 Cmn), 要么旋转, 以分离建立的 Cmn, Babikova 等人使用不同网层屏障尺寸的旋转核心研究 Vicia之间通过 Cmn 的地下信号蚕豆(豆) 植物。在他们的研究中, 一个直径30厘米的中央供体植物通过根部和菌丝 (无屏障) 或仅通过通过40微米网建立的 Cmn 相互连接。中心植物通过网状封闭岩心的旋转与相邻植物的相互作用而被切断, 或者 Cmn 被包围核心的0.5μm 细网网阻止。
在这里, 我们提出了一个方法, 结合以前的旋转核心方法的各个方面来检查 Cmn 对植物直接相互作用的影响, 结合稳定的同位素追踪。我们的方法采用了 "目标植物" 的方法, 其中感兴趣的中心植物被邻近的植物包围。植物生长在可旋转的幼苗容器内, 这些容器的开槽和覆盖上有尼龙丝网、疏水膜, 或者是非改性固体塑料。常见的菌根网每周被切断一次或保持完整, 15个n 个稳定同位素追踪氮从邻居的旋转核心向中心目标植物的运动。通过比较植物大小与矿物质和稳定的同位素吸收, 我们评估哪些植物可能受益于或遭受 Cmn 在宿主植物之间的相互作用。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 可旋转芯的建造和组装
- 修改商用管状幼苗容器 (后来称为 "容器");材料表)有19毫米宽 x 48 厘米长的开口。
- 使用带19毫米孔锯的钻压机, 没有中央, 飞行员扭转钻, 削减两个孔, 一个高于另一个, 在一个容器的两侧 (2.5 厘米直径 x 12.1 厘米长), 使孔之间约1厘米的距离。将容器固定在钻床上的围栏上, 并在钻孔时使用一个短的销钉, 将其安装在容器内, 以帮助将其固定在适当的位置。使用带有柔性塑料的容器, 以防止开裂。
- 用剪刀、线切割机或锡片 (用于刚性塑料使用佩锯) 在孔之间切割剩余的薄薄的塑料片, 使一个拉长的开口约2厘米宽, 5 厘米长。
- 重复步骤1.1.1 –1.1.2 在容器的另一侧。
- 用尼龙网和/或疏水膜覆盖插槽 (图 1 a)。
- 将带有40μm 毛孔的尼龙网切割成 9.5 cm x 8.5 厘米的碎片。切割的碎片和容器一样多。
- 将尼龙网外部粘附在容器上, 使织物中的两个开口都有一些轻微的重叠, 使用高强度的工业热胶。
- 如果需要防止水的流动, 例如在使用水溶性营养物质或稳定的同位素时, 用疏水膜 31, 32 (材料表) 覆盖尼龙网层31,32 (材料表), 使 am 真菌菌丝通过, 但只有水蒸气的运动, 而不是液态水。
- 将热胶放在容器上的开口周围, 并沿着尼龙网的长边放置。将容器滚动到织物上, 以避免手指燃烧。在网格边缘重叠的织物边缘添加一层胶水。按下一些纸板的边缘, 将其牢固地密封。始终一致地在一个方向滚动, 这将是相同的方向, 完成容器的旋转在锅或微宇宙, 这样重叠的网格边缘不会被推入潜在的挖掘到基板。
- 一旦胶水冷却, 将织物的顶部和底部贴在容器上, 以防止松散的边缘和撕裂使用灵活的胶带, 如电工的胶带。
- 使用与步骤1.2.5 相同的胶带, 覆盖每个容器的锥形端两侧 (而不是底部尖端的孔) 上的小孔, 以防止根部从容器中生长到锅的其他部分。
- 为了防止土壤流失, 同时提供排水, 在每个容器的底部放置一个玻璃大理石。
- 对于不涉及 CMN 在植物之间形成任何可能的控制处理, 请使用固体、未经修改的容器 (图 1a)。
2. 将锅或微型航天器组装在一起, 以适应容器的锥形末端
- 为了确保容器在固定的位置垂直站立, 并有适当的排水, 翻转锅, 使底部朝上。在锅底周围剪下, 用佩锯留下一个小嘴唇作为支撑。
- 聚苯乙烯泡沫的制备
- 切割聚苯乙烯泡沫, 约36毫米厚, 到相同的直径锅底部使用带锯与圆环切割夹具。
- 在容器的位置模式中, 使用钻床和19毫米孔锯 (不带中央麻花钻) 钻孔到泡沫中。
- 对于目标植物实验, 为周围的相邻个体钻一个具有相同间距孔的中心孔。对于直径15.5 厘米的锅, 在直径11厘米的圆的周长周围间隔6个孔12毫米 (图 1 b)。
- 将孔六边形或方形数组 (图 1c, d) 放置在一个微宇宙实验中。
3. 将容器和锅装满土壤和沙子混合物
- 选择所需的土壤混合物, 并通过与土壤均匀混合切碎的根片 (1-2 厘米长), 将 am 真菌现场采集或盆栽接种到土壤中。将所需的土壤与不孕硅砂或玻璃珠混合, 以降低植物可用的矿物质养分的浓度。
- 将填充的容器放置在钻孔泡沫或微孔底部, 并用不孕的基板填充间隙空间。
- 用营养差的硅砂混合物填充容器之间的间隙空间, 使用漏斗来帮助填充小空间。为确保充分排水和模仿土壤的质地, 混合中颗粒大小的沙子, 如 6-20级, 与小颗粒大小的沙子, 如 30-65级, 在水泥搅拌机。
4. 在整个坑/微宇宙中建立 Cmn
- 植物预处理 "护士" 植物的所需物种到每个容器, 以维持 AM 真菌, 使他们可以传播在容器之间, 并建立 Cmn。
- 当所有容器都建立了幼苗, 通过剪裁去除芽, 使每个容器中只剩下一个单独的。
- 工厂生长和 CMN 建立允许2-3个月。
5. 建立实验植物和处理方法
- 通过播种或移植到容器中播种实验植物。如果播种, 等待, 直到所有容器有一个发芽的幼苗, 然后通过修剪他们的芽删除预处理护士植物。如果移植, 在移植实验苗之前, 应夹住所有预处理设备, 以防止意外的竞争影响。
- 建立 CMN 处理方法, 要么在实验期间不移动容器 (完整的 Cmn), 要么每周轮换容器, 使其在修改后的容器 (被切断的 Cmn) 中延伸;图 1a)。在切断 Cmn 时, 通过一次完全旋转旋转每个容器, 以避免无意中改变地面上的相互作用, 特别是对于各向同性植物。
- 重水所有的锅或微宇宙旋转后立即重建之间的间隙基板和容器的两侧接触。
6. 追踪 Cmn 上的矿物养分运动
- 用 0.5% 15n 富色 kno 3 和 nh 4 cl对邻近植物进行施肥。
- 用浓度相等的14n肥料给目标个体施肥。
7. 监测和维持实验
- 在实验过程中, 定期 (至少每月) 重新随机化锅或微宇宙的位置。
- 每周测量生长, 如高度或最长的叶子长度 (草), 以监测生长何时开始放缓, 因为在植物开始根系之前收获是很重要的。
8. 收获的实验
- 将所有地上组织夹在一起, 并将单个植物放入标记的信封中, 以识别它们的处理、锅或缩影和位置。
- 在60°c 下干燥地面组织, 使其重量恒定。测量每个植物组织的干重。
- 在提取容器和收获根部之前, 让土壤干燥。
- 从根系上精心擦掉尽可能多的土壤, 用平底锅或在250微米孔径的筛子上的温和水流下清洗。
- 让根部风干, 称量整个根系。
- 随意夹紧根系, 并将根系片段储存在50% 乙醇中。在它们被染色33 后, 使用这些片段使用网格线交集方法 34对根定植进行量化。
- 重新称重剩余的根系, 并将其存放在贴有标签的纸包中, 在60°c 下干燥, 以评估干重。使用以下公式计算整个根系的重量:
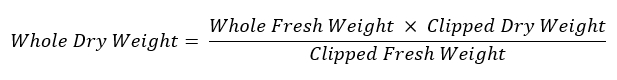
9. 矿物养分和稳定同位素分析
- 如果组织数量太低, 消化对测定矿物质养分的最低要求, 则按生物量将幼苗分为 "十分位数" 或10组、"八角" 或8组、"四分位" 或4组等, 按重量排序浓度。
- 将叶面样本送往承包实验室进行矿物营养和稳定同位素分析 (材料表)。
- 使用以下习惯表达式描述同位素丰度:
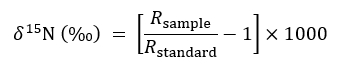
其中r表示样品或标准 n 的 15 n/14 氮比. - 使用未经修改的固体容器处理作为控制背景 15 n 比率在以下质量平衡方程时, 量化 15 n 的数量占目标植物在断线或完整的 cmn 处理:
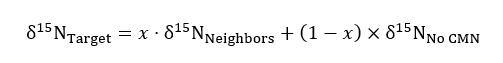
其中15 n 表示无 cmn 处理中目标、邻居和目标植物的同位素丰度, x 表示目标植物从添加标签的邻居容器中获得的氮百分比 (作为十进制分数)。为每个目标工厂的组合邻居获取 15 n邻居的值。
- 使用以下习惯表达式描述同位素丰度:
Access restricted. Please log in or start a trial to view this content.
结果
为了确定 Cmn 如何通过养分分配影响植物性能, 我们在一个目标植物实验中种植了占主导地位的草原草--安德罗戈恩·杰拉迪·维特曼, 该实验有6个间隔相等的邻居, 并被切断, 或者没有 cmn。我们发现, 切断或防止 Cmn 减少目标的地上干重 (图 2), 这表明完整的 cmn 促进了植物的生长。Cmn 被切断并防止 Cmn 的植物对其处理的反应与它们的处理相似, 这?...
Access restricted. Please log in or start a trial to view this content.
讨论
我们的研究结果证实, 我们的旋转核心方法可以突出 Cmn 在地下植物相互作用中的作用。但是, 协议中有几个关键步骤, 如果进行更改, 有可能影响检测 CMN 影响的能力。用营养差的培养基填充容器周围的间隙区域是至关重要的。在我们不成功的、旋转的、核心的番石榴树幼苗目标植物实验中, 虽然在任何数量的邻居在场的情况下, 目标生长明显减少, 但没有发现 Cmn 对地下竞争的影响, 可能是因为整个...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
我们要感谢两位匿名评论家的建议。我们还感谢众多本科生帮助建造了锅、微宇宙和开槽容器, 并协助进行了维护和收获实验。我们还感谢中北部学院的启动资金 (给 JW) 和现有设施, 并感谢 Ashley Wojciechowski 获得了北中央学院里克斯特赠款, 支持使用这些方法进行的实验。这项工作的一部分由国家科学基金会博士论文改进补助金 (deb-1401677) 资助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Commercial tubular seedlings container (called 'containers' in the manuscript) | Stuewe and Sons, Inc | Ray Leach Cone-tainer ™ | RLC3U |
| Course glass beads | Industrial Supply, Inc. | 12/20 sieve | Size #1 |
| Course silica sand | Florida Silica Sand | 6/20 50lb bags | None |
| Fine glass beads | Black Beauty | Black Beauty FINE Crushed Glass Abrasive (50 lbs) | BB-Glass-Fine |
| Hydrophobic membrane | Gore-tex | None | None |
| Large commercial tubular seedling containers | Stuewe and Sons, Inc. | Deepot ™ | D16L |
| Medium silica sand | Florida Silica Sand | 30/65 50 lb bags | None |
| Nylon mesh | Tube Lite Company, Inc. | Silk screen | LE7-380-34d PW YEL 60/62 SEFAR LE PECAP POLYESTER |
| Soil and foliar nutrient analysis facility | Kansas State University Soil Testing Lab | None | None |
| Stable isotope core facility | University of Miami | None | None |
参考文献
- Remy, W., Taylor, T. N., Hass, H., Kerp, H. Four hundred-million-year-old vesicular arbuscular mycorrhizae. Proceedings of the National Academy of Sciences of the United States of America. 91 (25), 11841-11843 (1994).
- Smith, S. E., Read, D. J. Mycorrhizal Symbiosis. , 3 edn, Academic Press. (2008).
- Giovannetti, M., Avio, L., Sbrana, C. Mycorrhizal Networks. , Springer. 41-67 (2015).
- Giovannetti, M., Sbrana, C. Cell Biology of Plant and Fungal Tip Growth. Vol. 328. Nato Science Series, Sub-Series I: Life and Behavioural Sciences. Cresti, A., Heath, M., Geitmann, I. B. , 221-231 (2001).
- Giovannetti, M., Sbrana, C., Avio, L., Strani, P. Patterns of below-ground plant interconnections established by means of arbuscular mycorrhizal networks. New Phytologist. 164 (1), 175-181 (2004).
- Avio, L., Pellegrino, E., Bonari, E., Giovannetti, M. Functional diversity of arbuscular mycorrhizal fungal isolates in relation to extraradical mycelial networks. New Phytologist. 172 (2), 347-357 (2006).
- Giovannetti, M., et al. At the root of the wood wide web: self recognition and nonself incompatibility in mycorrhizal networks. Plant Signaling & Behavior. 1 (1), 1-5 (2006).
- Miller, R., Kling, M. J. The importance of integration and scale in the arbuscular mycorrhizal symbiosis. Plant and Soil. 226 (2), 295-309 (2000).
- Miller, R., Jastrow, J., Reinhardt, D. R. External hyphal production of vesicular-arbuscular mycorrhizal fungi in pasture and tallgrass prairie communities. Oecologia. 103 (1), 17-23 (1995).
- Weremijewicz, J., Sternberg, L. dS. L. O., Janos, D. P. Common mycorrhizal networks amplify competition by preferential mineral nutrient allocation to large host plants. New Phytologist. , (2016).
- Fellbaum, C. R., et al. Fungal nutrient allocation in common mycorrhizal networks is regulated by the carbon source strength of individual host plants. New Phytologist. 203 (2), 646-656 (2014).
- Lekberg, Y., Hammer, E. C., Olsson, P. A. Plants as resource islands and storage units--adopting the mycocentric view of arbuscular mycorrhizal networks. FEMS Microbiol Ecol. 74 (2), 336-345 (2010).
- Jakobsen, I., Hammer, E. C. Mycorrhizal Networks. , Springer. 91-131 (2015).
- Jakobsen, I., Rosendahl, L. Carbon flow into soil and external hyphae from roots of mycorrhizal cucumber plants. New Phytologist. 115 (1), 77-83 (1990).
- Kiers, E. T., et al. Reciprocal rewards stabilize cooperation in the mycorrhizal symbiosis. Science. 333 (6044), 880-882 (2011).
- Hartnett, D. C., Hetrick, B. A. D., Wilson, G. W. T. Mycorrhizal influence on intra- and interspecific neighbour interactions among co-occuring prairie grasses. Journal of Ecology. 81 (4), 787-795 (1993).
- Hetrick, B. A. D., Wilson, G. W. T., Todd, T. C. Differential responses of C3 and C4 grasses to mycorrhizal symbiosis, phosphorus fertilization, and soil microorganisms. Canadian Journal of Botany. 68 (3), 461-467 (1990).
- Johnson, D., Leake, J. R., Read, D. J. Novel in-growth core system enables functional studies of grassland mycorrhizal mycelial networks. New Phytologist. 152 (3), 555-562 (2001).
- Leake, J. R., et al. Networks of power and influence: the role of mycorrhizal mycelium in controlling plant communities and agroecosystem functioning. Canadian Journal of Botany-Revue Canadienne De Botanique. 82 (8), 1016-1045 (2004).
- Babikova, Z., et al. Underground signals carried through common mycelial networks warn neighbouring plants of aphid attack. Ecology Letters. 16 (7), 835-843 (2013).
- Schüepp, H., Miller, D. D., Bodmer, M. A new technique for monitoring hyphal growth of vesicular-arbuscular mycorrhizal fungi through soil. Transactions of the British Mycological Society. 89 (4), 429-435 (1987).
- Miller, D. D., Bodmer, M., Schüepp, H. Spread of endomycorrhizal colonization and effects on growth of apple seedlings. New Phytologist. 111 (1), 51-59 (1989).
- Jakobsen, I., Gazey, C., Abbott, L. K. Phosphate transport by communities of arbuscular mycorrhizal fungi in intact soil cores. New Phytologist. 149 (1), 95-103 (2001).
- Johnson, D., Leake, J., Ostle, N., Ineson, P., Read, D. J. In situ 13CO2 pulse‐labelling of upland grassland demonstrates a rapid pathway of carbon flux from arbuscular mycorrhizal mycelia to the soil. New Phytologist. 153 (2), 327-334 (2002).
- Johnson, D., Leake, J., Read, D. J. Transfer of recent photosynthate into mycorrhizal mycelium of an upland grassland: short-term respiratory losses and accumulation. of 14C. Soil Biology and Biochemistry. 34 (10), 1521-1524 (2002).
- Walder, F., et al. Mycorrhizal networks: Common goods of plants shared under unequal terms of trade. Plant Physiology. 159 (June 2012), 789-797 (2012).
- Song, Y. Y., et al. Interplant communication of tomato tlants through underground common mycorrhizal networks. Plos One. 5 (10), e13324(2010).
- Merrild, M. P., Ambus, P., Rosendahl, S., Jakobsen, I. Common arbuscular mycorrhizal networks amplify competition for phosphorus between seedlings and established plants. New Phytologist. 200 (1), 229-240 (2013).
- Janos, D. P., Scott, J., Aristizábal, C., Bowman, D. M. J. S. Arbuscular-mycorrhizal networks inhibit Eucalyptus tetrodonta seedlings in rain forest soil microcosms. Plos One. 8 (2), e57716(2013).
- Wyss Lozano Hoyos, T. Pinus elliottii var. densa Seedling Performance Reflects Ectomycorrhizas, Soil Nutrient Availability and Root Competition. , (2010).
- Mäder, P., Vierheilig, H., Alt, M., Wiemken, A. Boundries between soil compartments formed by microporous hydrophobic membranes (GORE-TEX) can be crossed by vesicular-arbuscular mycorrhizal fungi but not by ions in the soil solution. Plant and Soil. 152, 201-206 (1993).
- Mäder, P., et al. Transport of 15N from a soil compartment separated by a polytetrafluoroethylene membrane to plant roots via the hyphae of arbuscular mycorrhizal fungi. New Phytologist. 146 (1), 155-161 (2000).
- Brundrett, M., Bougher, N., Dell, B., Grove, T. Working with Mycorrhizas in Forestry and Agriculture. , (1996).
- McGonigle, T. P., Miller, M. H., Evans, D. G., Fairchild, G. L., Swan, J. A. A new method which gives an objective-measure of colonization of roots by vesicular arbuscular mycorrhizal fungi. New Phytologist. 115 (3), 495-501 (1990).
- Weremijewicz, J., Janos, D. P. Common mycorrhizal networks amplify size inequality in Andropogon gerardii monocultures. New Phytologist. 198 (1), 203-213 (2013).
- Weremijewicz, J., O’Reilly, L. dS. L., Janos, D. P. Arbuscular common mycorrhizal networks mediate intra-and interspecific interactions of two prairie grasses. Mycorrhiza. , 1-13 (2017).
- Weiner, J. Asymmetric competition in plant populations. Tree. 5 (11), 360-364 (1990).
- Damgaard, C., Weiner, J. Describing inequality in plant size or fecundity. Ecology. 81 (4), 1139-1142 (2000).
- Johnson, C. R., Joiner, J. N., Crews, C. E. Effects of N, K, and Mg on growth and leaf nutrient composition of 3 container grown woody ornamentals inoculated with mycorrhizae. Journal of the American Society for Horticultural Science. 105 (2), 286-288 (1980).
- Estrada-Luna, A. A., Davies, F. T., Egilla, J. N. Mycorrhizal fungi enhancement of growth and gas exchange of micropropagated guava plantlets (Psidium guajava L.) during ex vitro acclimatization and plant establishment. Mycorrhiza. 10 (1), 1-8 (2000).
- Hurlbert, S. H. Pseudoreplication and the design of ecological field experiments. Ecological Monographs. 54 (2), 187-211 (1984).
- Argüello, A., et al. Options of partners improve carbon for phosphorus trade in the arbuscular mycorrhizal mutualism. Ecology Letters. 19 (6), 648-656 (2016).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。