A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
وظيفية من القوة الذرية مجهر Cantilevers مع خلايا واحدة تي أو الجسيمات واحدة لالمناعية أحادية الخلية قوة مطيافية
In This Article
Summary
نقدم بروتوكولا ً لتجسيد مجهر القوة الذرية (AFM) مع خلية T واحدة وجسيمات الخرزة للدراسات المناعية. وتظهر إجراءات التحقيق في خلية T خلية واحدة ملزمة من قبل AFM ورصد الاستجابة الخلوية في الوقت الحقيقي من الضامة إلى الجسيمات الصلبة واحدة من قبل AFM مع التصوير الفلوري.
Abstract
التحليل المجهري للقوة الذرية القائم على قوة الخلية الواحدة (AFM-SCFS) هو أداة قوية لدراسة الخصائص البيوفيزيائية للخلايا الحية. تسمح هذه التقنية للتحقق من نقاط القوة والديناميات التفاعل على غشاء الخلية الحية, بما في ذلك تلك التي بين الخلايا, مستقبلات وligands, وجنبا إلى جنب مع العديد من الاختلافات الأخرى. كما أنها تعمل كآلية لتقديم التحفيز الفيزيائي أو البيوكيميائي على الخلايا المفردة بطريقة محكومة زمنياً، مما يسمح بمراقبة تنشيط الخلايا المحددة والأحداث الخلوية اللاحقة في الوقت الحقيقي عندما يتم دمجها مع الخلية الحية التصوير الفلوري. الخطوة الرئيسية في تلك القياسات AFM-SCFS هي AFM-cantilever functionalization، أو بعبارة أخرى، إرفاق موضوع من الفائدة على cantilever. هنا، نقدم أساليب لتعديل cantilevers AFM مع خلية T واحدة وحبة البوليسترين واحدة على التوالي للدراسات المناعية. الأول ينطوي على الغراء متوافق بيولوجيا أن الأزواج خلايا T واحدة إلى غيض من cantilever شقة في حل، في حين أن هذا الأخير يعتمد على الغراء الايبوكسي لالتصاق حبة واحدة في بيئة الهواء. كما يتم توفير تطبيقين مناعيين مرتبطين بكل تعديل في الكانتيلفين. الطرق الموصوفة هنا يمكن تكييفها بسهولة لأنواع الخلايا المختلفة والجسيمات الصلبة.
Introduction
وقد وجدت مجهرية القوة الذرية (AFM)، أداةمتعددة الاستخدامات، العديد من التطبيقات في أبحاث بيولوجيا الخلايا 1،2،3،4،5. وبصرف النظر عن قدرتها على التصوير عالية الدقة، تسمح ميزة سبر القوة الأصلية بالخصائص البيوفيزيائية للخلايا الحية للتحقيق مباشرة في الموقع على مستوى الخلية الواحدة6و7. وتشمل هذه صلابة الهياكل دون الخلوية أو حتى الخلايا الكاملة8،9،10،11،12، محددة ligand / مستقبلات نقاط القوة ملزمة في مستوى جزيء واحد على سطح الخلية13، وقوات التصاق بين أزواج واحدة من الجسيمات الصلبة والخلايا أو بين خليتين1،2،14،15. وغالبا ما تصنف هذه الأخيرة على أنها مطياف قوة خلية واحدة (SCFS)16. نظرا ً للوجود اتّصاليّة متاحة بسهولة مع ثابت ة ربيعية مختلفة، فإن نطاق القوة الذي يمكن الوصول إليه من قبل AFM واسع نوعاً ما من عدد قليل من البيكونيوتن (pN) إلى ميكرونيوتن (μN)، الذي يغطي بشكل كافًا المجموعة الكاملة من الأحداث الخلوية التي تشمل قوى من بضع عشرات من pN، مثل مستقبلات القائم على واحد جزيء ملزمة، إلى nN، مثل الأحداث الخلوية phagocytic15. هذا النطاق قوة ديناميكية كبيرة يجعل AFM مفيدة على غيرها من تقنيات القوة التحقيق مثل ملاقط البصرية / المغناطيسية ومسبار قوة الغشاء الحيوي، كما أنها أكثر ملاءمة لقياسات قوة ضعيفة، مع قوة عادة أقل من 200 pN17 , 18.وبالإضافة إلى ذلك، يمكن أن تعمل AFM كمتلاعب عالية الدقة لتقديم مختلف المحفزات على خلايا واحدة بطريقة محددة زمنيا4،19. هذا أمر مرغوب فيه لدراسات تنشيط خلية واحدة في الوقت الحقيقي. جنبا إلى جنب مع التصوير الفلورة الخلية الحية، يمكن رصد الاستجابة الخلوية اللاحقة للتحفيز محددة في وقت واحد، مما يجعل SCFS المستندة إلى AFM قوية للغاية كما التصوير البصري توفير أداة عملية للتحقيق الإشارات الخلوية. على سبيل المثال، تم استخدام AFM لتحديد السلالات اللازمة للحصول على عابرات الكالسيوم في osteoblasts20. في هذا العمل، تم تعقب عابري الكالسيوم بشكل فلوري من خلال التصوير الكالسيوم نسبة متري بعد تطبيق القوى المترجمة على osteoblasts المستزرعة مع طرف AFM. في الآونة الأخيرة، تم استخدام AFM لتمتد fibrils الكولاجين التي نمت خلايا الستيلات الكبد (HSC) وهذا التنشيط HSC التي يسببها المشانو تم رصدها في الوقت الحقيقي من قبل جهاز استشعار حيوي SRC الفلورسنت، الذي الفسفورية كما يمثلها ويرتبط كثافة الفلورة من جهاز الاستشعارالحيوي مع تفعيل HSC 3.
في تجارب SCFS المستندة إلى AFM، يعتبر إضفاء الطابع الوظيفي السليم على cantilevers AFM خطوة رئيسية نحو القياسات الناجحة. منذ اهتمامنا البحثي يركز على تنشيط الخلايا المناعية، ونحن تعمل بشكل روتيني cantilevers مع المسائل الجسيمات مثل الجسيمات الصلبة واحدة التي يمكن أن تؤدي إلى phagocytosis و / أو استجابات المناعة القوية4،14 , 15 وخلايا T واحدة التي يمكن أن تشكل متشابك المناعة مع مستضد تقديم الخلايا، مثل الخلايا الجذعية المنشطة (DC)2. وعادة ما تقترن الجسيمات الصلبة واحدة إلى cantilever عن طريق الغراء الايبوكسي في بيئة الهواء، في حين أن خلايا T واحدة، بسبب طبيعتها غير لاصقة، هي functionalized إلى cantilever عن طريق الغراء متوافق بيولوجيا في الحل. هنا، ونحن نوصف أساليب لتنفيذ هذين النوعين من تعديل cantilever وإعطاء اثنين من التطبيقات المرتبطة بها كذلك. التطبيق الأول هو التحقيق T خلية / DC التفاعلات مع AFM-SCFS لفهم الآلية القمعية للخلايا T التنظيمية من وجهة نظر ميكانيكا الخلية. والثاني ينطوي على الجمع بين AFM مع التصوير الفلوري الخلايا الحية لرصد الاستجابة الخلوية للماكروفاج إلى الجسيمات الصلبة في الوقت الحقيقي للكشف عن الآلية الجزيئية للفوسفاتيديلينسيتول مستقل مستقبلات 4,5-بيسفوسفات (PIP2)- [موسين] يتوسط [فغوستسس]. والهدف من هذا البروتوكول هو توفير إطار مرجعي للباحثين المهتمين لتصميم وتنفيذ الإعدادات التجريبية الخاصة بهم مع تحليل الخلايا الواحدة القائم على AFM للبحوث المناعية.
Protocol
بروتوكول تجربة الماوس يتبع المبادئ التوجيهية لرعاية الحيوانات من جامعة تسينغهوا
1. Cantilever functionalization مع خلايا T واحدة
- إعداد خلايا الطحال الماوس
- التضحية الماوس (8-16 أسابيع من العمر (أي من الجنسين)؛ على سبيل المثال، C57BL/6 سلالة) باستخدام ثاني أكسيد الكربون، تليها خلع عنق الرحم.
- تنظيف الماوس مع الإيثانول 75٪ وجعل شق الجلد خط الوسط تليها استئصال الطحال.
- تجانس الطحال في 4 مل من PBS التي تحتوي على 2٪ مصل البقر الجنيني (FBS) باستخدام الشرائح الزجاجية وإزالة المجاميع والحطام عن طريق تمرير تعليق الخلية من خلال مصفاة النايلون شبكة 70 ميكرومتر.
- طرد مركزي تعليق الخلية في 500 × ز لمدة 5 دقائق، وتجاهل supernatant وإعادة تعليق الخلايا في 2 مل من الدم الأحمر حالة الدم العازلة (متوازنة في درجة حرارة الغرفة) لمدة 5 دقائق.
- طرد الخلايا تعليق في 500 × ز لمدة 5 دقائق وإعادة تعليق الخلايا في كثافة 1 × 108 خلايا / مل في PBS تحتوي على 2٪ FBS و 1 MM EDTA (وصفت بأنها الحل A)، وعادة 0.25-2 مل اعتمادا على كثافة الخلية. نقل الخلايا المعلقة إلى 5 مل (12 × 75 ملم) البوليسترين أنبوب أسفل جولة مستديرة.
- إعداد الخلايا الماوس CD4 + T
- إضافة 50 ميكروغرام /مل مصل الفئران (انظر جدولالمواد) و 50 ميكرولتر / مل CD4 + T خلية العزل كوكتيل (انظر جدولالمواد) إلى عينة الخلية التي تم الحصول عليها من الخطوة 1.1.5. يُخلط المزيج ويُحضن لمدة 10 دقائق في درجة حرارة الغرفة.
- دوامة الأوراق المالية streptavidin المغلفة حل الجسيمات المغناطيسية (انظر جدولالمواد) لمدة 30 ق أو حتى تظهر الجسيمات مشتتة بالتساوي.
- إضافة 75 ميكرولتر / مل streptavidin المغلفة الجسيمات المغناطيسية إلى عينة الخلية. يُخلط المزيج ويُحضن لمدة 2.5 دقيقة في درجة حرارة الغرفة.
- إضافة الحل A إلى أعلى عينة الخلية إلى 2.5 مل ومزيج عن طريق الأنابيب بلطف صعودا وهبوطا لمدة 2-3 مرات.
- وضع أنبوب عينة (دون غطاء) في المغناطيس (انظر جدولالمواد) وحضانة لمدة 5 دقائق في درجة حرارة الغرفة. صب بعناية تعليق الخلية المخصب في أنبوب جديد 5 مل البوليسترين جولة القاع.
- طرد مركزي تعليق الخلية في 500 × ز لمدة 5 دقائق.
ملاحظة: تحتوي خلايا CD4+ T الغنية على خلايا T التقليدية والتنظيمية.
- فصل الخلايا T التنظيمية من الخلايا T التقليدية
- إضافة 25 μL من مانع FcR (راجع جدولالمواد) إلى عينة الخلية T المخصب التي تم الحصول عليها من الخطوة 1.2.6. يُمزج المزيج ويُحضن لمدة 5 دقائق في درجة حرارة الغرفة.
- إضافة 25 درجة مئوية من الكوكتيل اختيار الخلية T التنظيمية الإيجابية (انظر جدولالمواد) إلى عينة الخلية T. يُخلط المزيج ويُحضن لمدة 10 دقائق في درجة حرارة الغرفة.
- إضافة 10 درجة مئوية من كوكتيل اختيار PE (انظر جدولالمواد) إلى عينة الخلية T. يُمزج المزيج ويُحضن لمدة 5 دقائق في درجة حرارة الغرفة.
- دوامة الأسهم dextran المغلفة حل الجسيمات المغناطيسية (انظر جدولالمواد) لمدة 30 ق أو حتى تظهر الجسيمات مشتتة بالتساوي.
- أضف 10 ميكرولتر من الجسيمات المغناطيسية المغلفة بـ dextran إلى عينة الخلية T. يُمزج المزيج ويُحضن لمدة 5 دقائق في درجة حرارة الغرفة.
- إضافة الحل A إلى أعلى عينة الخلية T إلى 2.5 مل ومزيج عن طريق الأنابيب بلطف صعودا وهبوطا لمدة 2-3 مرات.
- وضع أنبوب عينة الخلية T (دون غطاء) في المغناطيس وحضانة لمدة 5 دقائق في درجة حرارة الغرفة. صب بعناية supernatant إلى أنبوب جديد.
ملاحظة: يحتوي supernatant على خلايا CD4+T التقليدية المخصب. - طرد مركزي خلايا CD4+T التقليدية المخصب في 500 × ز لمدة 5 دقائق.
- إزالة الأنبوب الذي يتم إثراء الخلايا T التنظيمية من المغناطيس. إضافة 2.5 مل من الحل A إلى الأنبوب ومزيج عن طريق الأنابيب بلطف صعودا وهبوطا لمدة 2-3 مرات. وضع أنبوب مرة أخرى في المغناطيس، وحضانة لمدة 5 دقائق، ومن ثم صب بعناية قبالة وتجاهل supernatant. كرر هذه الخطوة ثلاث مرات أخرى.
- إعادة تعليق الخلايا T التنظيمية المخصب في 2 مل من متوسط B.
- احتضان كل من الخلايا T التقليدية النقية والخلايا T التنظيمية مع 100 U / mL hIL-2 بين عشية وضحاها أو لمدة 4 ساعة على الأقل في 37 درجة مئوية في حاضنة رطبة مع 5٪ CO2 قبل استخدامها لcantilever functionalization.
- إعداد الخلايا الجذعية
- إعداد محلول البيرانا، خليط من 30٪ H2O2 (30٪) و70% H2SO4 (conc) (v/v). صب ببطء 3 مل من H2O2 إلى 7 مل من H2SO4 تحت التحريك المستمر والتبريد.
تحذير: محلول البيرانا هو تآكل للغاية، ويمكن أن يحرق ويدمر أنسجة الجسم. ولذلك، فمن الأكثر أمانا لاستخدام محلول البيرانا تحت غطاء محرك السيارة وارتداء معدات السلامة المناسبة، كما أن الخليط سوف دفقة حول الكأس. تحييد الحل مع هيدروكسيد الصوديوم إلى pH 7 بعد الاستخدام. - تزج غطاء الزجاج من قطر 24 ملم في محلول البيرانا لمدة 30 دقيقة وشطف جيدا بعد ذلك مع الماء المعقمة فائقة النقية.
- تراجع زوج من ملاقط مدببة في الإيثانول 75٪ لمدة 30 دقيقة للتطهير البارد.
- أدخل الأغطية الزجاجية النظيفة في لوحة ثقافة 6-well من قبل ملاقط.
- إمالة طبق ثقافة البلاستيك 6 سم التي كانت خلايا DC2.4 قبل المستزرعة مع 4 مل من B المتوسطة واستنشاق كل وسيلة. إضافة 2 مل من PBS في طبق الثقافة لشطف خلايا DC2.4 وتجاهل PBS. كرر هذه الخطوة الإعادة مرتين أكثر.
- أضف 1 مل من 0.25٪ تريبسين EDTA إلى طبق الثقافة لمدة 2 دقيقة إضافة 1 مل من متوسط B إلى هذا الطبق لإنهاء رد فعل هضم الإنزيم. نقل تعليق الخلية المهضومة إلى أنبوب 15 مل.
- طرد الخلايا بتعليق هاف ة في 500 × ز لمدة 5 دقائق وإعادة تعليق خلايا DC2.4 بكثافة 2 × 105 خلايا /مل في متوسطة B.
- بذور DC2.4 الخلايا على الأغطية الزجاجية أعدت في الخطوة 1.4.4 وحضانة الخلايا بين عشية وضحاها في غرفة رطبة في 37 درجة مئوية مع 5٪ CO2.
ملاحظة: من أجل قياس القوى المتفاعلة بين خليتين مفردتين، يكون التركيز المنخفض نسبياً لخلايا DC2.4 (أي ،lt;10% الملاءمة) ضروريًا للحصول على تباعد مناسب بين الخلايا.
- إعداد محلول البيرانا، خليط من 30٪ H2O2 (30٪) و70% H2SO4 (conc) (v/v). صب ببطء 3 مل من H2O2 إلى 7 مل من H2SO4 تحت التحريك المستمر والتبريد.
- إعداد الكانتيلفيل AFM
ملاحظة: الكانتيفيرس التي هي مناسبة لتجارب مطياف قوة الخلية واحدة هي تلك التي تحتوي على ثوابت الربيع منخفضة، عادة في نطاق 0.01-0.06 N/m. هنا، يفضل لينة تلميح أقل cantilevers للخلايا واحدة وجزيئات صلبة واحدة وظيفية.- تنظيف cantilevers عن طريق العلاج بيرانا أو البلازما أو الأشعة فوق البنفسجية الأوزون التنظيف.
- قم بتركيب الكانتيلفير الذي تم تنظيفه على رأس المسح الضوئي AFM.
- إعداد غرفة عينة نظيفة مليئة بالماء النقي ومعايرة cantilever في محلول المياه عن طريق تشغيل أولا منحنى قوة على الركيزة الزجاجية للحصول على حساسية (المنحدر من تناسب خطي على الجزء البغيض من منحنى تقترب) ومن ثم تسجيل طيف الضوضاء الحرارية لاستخراج ثابت الربيع وفقا لدليل التعليمات من AFM.
- إزالة رئيس المسح AFM من الحل، وغسل العلب شنت مع بضع قطرات من الإيثانول النقي، والحفاظ على cantilever الجافة على رأس المسح الضوئي.
- إرفاق خلايا T واحدة إلى cantilever
- سخني حاوية بيئة الخلية الحية مع 5% من ثاني أكسيد الكربون2 عند 37 درجة مئوية.
- جبل غطاء الزجاج مع الخلايا DC2.4 نمت على ذلك من الخطوة 1.4.8 إلى عينة تجميع الغرفة، إضافة 600 درجة مئوية من متوسط B إلى الغرفة على الفور، ومن ثم وضع التجميع على مرحلة عينة AFM.
- إضافة خلايا CD4+T الحاضنة hIL-2 (إما الخلايا T التقليدية أو التنظيمية) في غرفة العينة.
ملاحظة: يجب أن لا يتجاوز إجمالي وحدة تخزين العينة 1 مل. - انتظر حتى يتم تسوية خلايا CD4+T المضافة بشكل كامل أسفل أسفل غطاء الغلاف.
ملاحظة: فقاعات الهواء سوف يسبب اضطراب كبير في التجربة، ولذلك، فمن المستحسن تجنب أي فقاعات الهواء في step1.6.2 و 1.6.3. - إضافة قطرة من 2 ميكرولتر من الغراء متوافق بيولوجيا على نهاية cantilever شنت مع ماصة كما هو مبين في الشكل 1 ومن ثم وضع رئيس المسح الضوئي على مرحلة العينة بسرعة، وبالتالي السماح للcantilever المغلفة مع الغراء متوافق بيولوجيا تزج في حل.
تحذير: لا تلمس الكتلة الزجاجية أو العلبة مع طرف الماصات. منذ الغراء متوافق بيولوجيا المستخدمة هنا عرضة للأكسدة في الهواء، وينبغي أن يتم هذه الخطوة في أسرع وقت ممكن. - حدد موقع خلية T صحية تحت طرف الكانتيلفير الخشنة تحت المجهر عن طريق تحريك مرحلة العينة ومن ثم ضبط بدقة تحديد المواقع عن طريق تحريك رأس المسح الضوئي.
ملاحظة: خلية CD4 +T صحية عادة ً حجم كبير نسبياً حواف ناعمة وtransmissive بصريًا في التصوير بالمجال الساطع. - خفض cantilever يدويا مع أحجام خطوة بدءا من 50 درجة مئوية ثم إلى 10، 5، 2 و 0.5 ميكرومتر تدريجيا عن طريق السيطرة على محركات السائر. عقد موقف المحركات السائر وضبط تحديد المواقع من رئيس المسح الضوئي لتحسين المحاذاة بين طرف cantilever والخلية، مرة واحدة في cantilever يجعل اتصال ثابت مع الخلية T الهدف كما هو مبين من قبل الإزاحة الصغيرة من شعاع الليزر موقف في كاشف ضوئي المقابلة لمجموعة قوة نموذجية من 0.5-1.5 nN.
ملاحظة: يمكن أيضاً القيام بهذه الخطوة عن طريق تشغيل قياس قوة واحدة حيث يمكن تعريف نقطة مجموعة (القوة المطبقة على الخلية) ووقت الاتصال بشكل جيد في البرنامج. ومع ذلك، نظرا ً لطبيعة الخلايا T غير لاصقة، يوفر النهج اليدوي المزيد من المرونة في التحكم في التصويب وتحديد المواقع، ووقت الاتصال أكثر من الاقتراب التلقائي ويعمل بشكل موثوق للتصاق الخلايا T. يجب على التجريبية في المستقبل محاولة كل من دليل والتلقائي تقترب لمعرفة ما يعمل بشكل أفضل لنظمهم ذات الأهمية. - سحب cantilever بعد 30 s من الاتصال.
ملاحظة: إذا كانت الخلية تتحرك مع cantilever المرفق بنجاح. إذا لم يكن كذلك، كرر الخطوة 1.6.6 ولكن على خلية T مختلفة. الغراء متوافق بيولوجيا هو أكسدة بسهولة. وينبغي أن تكتمل الخطوة 1-6-5-1-6-7 في غضون 5 دقائق. بالإضافة إلى ذلك، إذا فشل نفس cantilever ثلاث مرات لملحق الخلية T، يجب استخدام cantilever جديد، ويجب أن يبدأ إجراء المرفق من الخطوة 1.5.2 مرة أخرى.
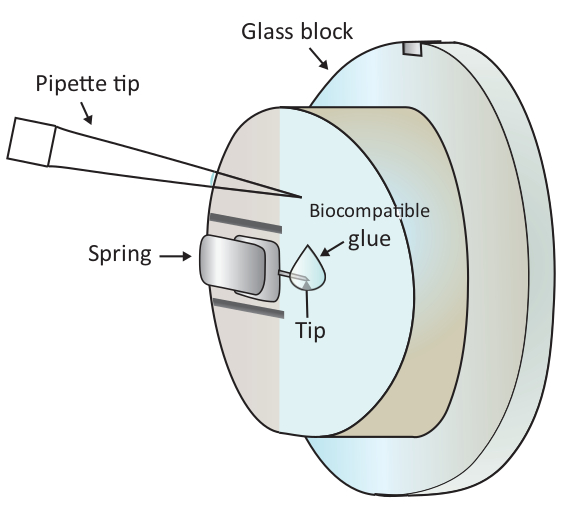
الشكل 1: التمثيل التخطيطي لإضافة قطرة صغيرة من الغراء المتوافق ة بيولوجيا على cantilever شنت. يتم تركيب الكانتيلفير عبر ربيع لقط على حامل كتلة الزجاج التي يتم تثبيتها على رأس المسح الضوئي AFM (لم يتم رسمها هنا). عندما يقف رأس المسح الضوئي على سطح مستوي، يتم توجيه الكانتيلفير عمودياً كما هو موضح في الرسم. يمكن إضافة حوالي 2 ميكرولتر الغراء متوافق بيولوجيا إلى غيض من cantilever مع ماصة صغيرة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- مطياف القوة من خلية T أحادية الزوج/ تفاعل الخلايا الجذعية
ملاحظة: للتحقيق في تفاعلات الخلايا/الخلايا، مطلوب AFM مع نطاق Z أكبر من 10-15 درجة مئوية التقليدية من أجل فصل الخلايا اثنين بشكل كامل. يتلقّى ال [أفف] يستعمل هنا [ز-رنج] من 100 [م], أيّ يكون كاف أن يفصل [ت] خلية من الخلية [دندريتيك] بعد خلية/خلية اتّصال.- ضع الخلية T المرفقة فوق خلية DC2.4 منفصلة عن طريق تحريك مرحلة العينة و/أو رأس المسح الضوئي (انظر الشكل2).
- تعيين المعلمات المناسبة وتشغيل مطياف القوة.
ملاحظة: عادة ما تستخدم إعدادات المفاتيح التالية: Setpoint 0.5 nN، سحب طول 50 ميكرومتر، Z حركة السرعة الثابتة، تمديد السرعة 5 ميكرومتر / ثانية، وقت الاتصال 10 ثانية، تأخير وضع القوة الثابتة. لكل أزواج T-DC، يتم جمع 20 تكرارات من منحنيات القوة ويتم استخدام ما لا يقل عن 14 منحنيات القوة لمزيد من التحليل. - قم بتركيب معلبة جديدة تم تنظيفها، ومعايرة في الماء النقي كما هو الحال في الخطوة 1.5.3، والعودة إلى نفس عينة الخلايا T-DC لتكرار الخطوة 1.6 و 1.7 لزوج T-DC مختلفة. التحقيق على الأقل 5 أزواج لكل شرط.
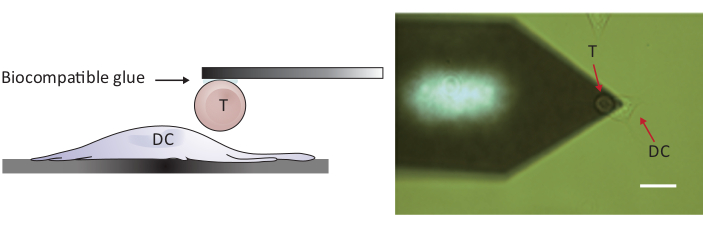
الشكل 2: التكوين التجريبي للتحقق من القوة بين خلية T واحدة وDC. (أ) رسم تخطيطي للتكوين التجريبي الذي يتم فيه إحضار خلية T المتصلة بالشمعة إلى DC نمت على الركيزة لسبر القوة. (B) صورة مشرق ة في الحقل لكانتيليفر T خلية وظيفية وDC. شريط مقياس، 20 درجة مئوية.
2. cantilever functionalization مع حبات البوليسترين واحدة
- إعداد الخرز واحد
- تخفيف تعليق الأسهم من 6 ميكرومتر حبات البوليسترين في الإيثانول 100٪.
ملاحظة: يجب أن يكون تركيز محلول الخرز المخفف منخفضًا بما فيه الكفاية بحيث عندما يتم إضافته إلى سطح غطاء زجاجي، يتم فصل الخرز الفردي بشكل جيد دون تجميع كبير بعد تبخر المذيبات. - تنظيف غطاء الزجاج قطرها 24 ملم مع الإيثانول وإزالة أي غبار من قبل N2 تدفق الهواء.
- جبل غطاء الزجاج تنظيفها إلى الجمعية غرفة عينة ووضع الجمعية على المجهر.
- وضع قطرة من الخرز المخفف الحل إلى الجانب الأيسر ولكن على مقربة من مركز غطاء (انظر الشكل3) والتحقق من التباعد بين الخرز بعد تبخر المذيبات في حقل مشرق تحت المجهر مع هدف 20X. انتقل إلى الخطوة التالية إذا تم فصل الخرز الفردية بشكل جيد.
- تراجع طرف micropipette أو مسواك في الغراء الايبوكسي مختلطة جيدا ومن ثم نقل كمية صغيرة من هذا الغراء إلى ثلاثة بقع منفصلة مع اللمسات لطيف المتعاقبة على الجانب الأيمن ولكن على مقربة من وسط غطاء.
ملاحظة: يجب محاذاة بقع الغراء الثلاثة عمودياً (انظر الشكل3). سيتم استخدام آخر بقعة مع أقل قدر من الغراء في وقت لاحق.
- تخفيف تعليق الأسهم من 6 ميكرومتر حبات البوليسترين في الإيثانول 100٪.
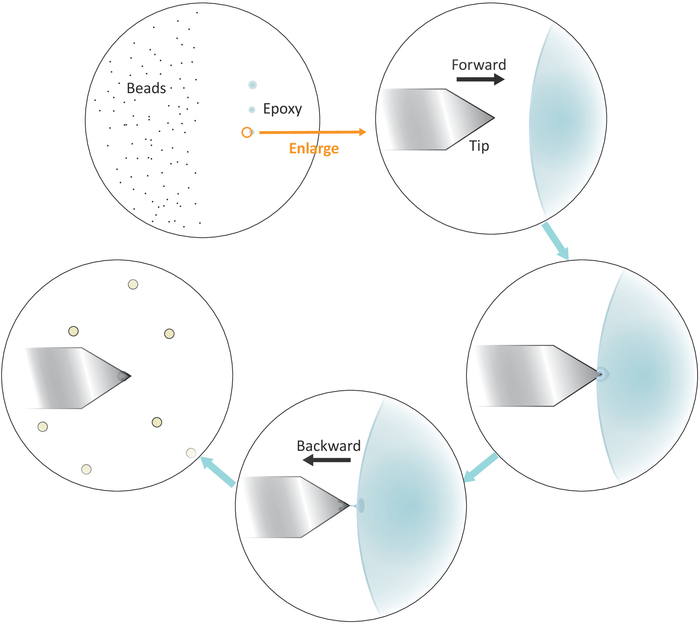
الشكل 3: التمثيل التخطيطي لتدفق العمل لـ "عملية الخرز الواحد" على الكانتيلفيل. يتم إعداد حبات صغيرة الحجم منفصلة بشكل جيد على الجانب الأيسر من الركيزة ويتم نقل كمية صغيرة من الغراء الايبوكسي على الجانب الأيمن من الركيزة من خلال 3 لمسات لطيفة متتالية، مما أدى إلى 3 بقع الغراء. يتم استخدام فقط بقعة الماضي مع أقل قدر من الغراء (المشار إليها من قبل دائرة) لمعطف نهاية جدا من cantilever. الاقتراب من cantilever في الغراء من اليسار ومن ثم نقل cantilever إلى الوراء مرة واحدة يتم مغمورة في الغراء لحصر الغراء في نهاية جدا من cantilever. جلب حبة الهدف تحت cantilever ومحاذاة لهم بشكل صحيح قبل إجراء اتصال شركة (عادة 2-5 nN) لاستصاق حبة. عندما يتم تشغيل حبة بنجاح على cantilever، يمكن تركيب cantilever جديدة لبدء دورة وظيفية جديدة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- إعداد الكانتيلفيل AFM
- قم بتركيب معلبة نظيفة بدون أطراف إلى رأس المسح الضوئي AFM.
- معايرة هذا cantilever في الهواء مع سطح نظيف للحصول على ثابت الربيع.
- إرفاق حبات واحدة إلى cantilever
- ضع طرف الكانتيلفير فوق الحدود اليسرى لآخر بقعة الغراء الايبوكسي كما هو موضح في الشكل 3.
- جلب cantilever قريبة من الغراء ببطء عن طريق خفض المحركات السائر مع أحجام خطوة صغيرة.
- سحب cantilever بعيدا بسرعة من الغراء أفقيا عن طريق تحريك رئيس المسح الضوئي AFM إلى الوراء (إلى اليسار) يدويا مرة واحدة يتم مغمورة غيض في الغراء.
ملاحظة: تأكد من أن كمية صغيرة فقط من الغراء تلتزم بنهاية تلميح جداً. إذا كان هناك الغراء المفرط على طرف، فمن الممكن للحد من كمية الغراء عن طريق لمس تليها انزلاق غيض على سطح فارغ. - حرك طرف الكانتيلفير فوق حبة واحدة معزولة بشكل جيد.
- الاقتراب من cantilever إلى حبة واحدة ببطء وإجراء اتصال ثابت مع حبة (كما هو مبين من خلال إزاحة موقف شعاع الليزر في جهاز الكشف الضوئي المقابلة لمجموعة قوة نموذجية من 2-5 nN) لحوالي 10 ق خلالها تعديل غرامة من ر سوف الملكية الفكرية تحديد المواقع أفقيا تساعد على تحديد موقع أفضل حبة في نهاية جدا من غيض. سحب تلميح في نهاية جهة الاتصال.
ملاحظة: اختفاء حبة جدا من المستوى البؤري الأصلي يشير إلى حدث الالتزام ناجحة. - قم بفك العلبة المعدلة بعناية وتخزينها في صندوق كانتيلفر بين عشية وضحاها من أجل التصلب الكامل للغراء.
- التصوير الفلوري للاستجابة الخلوية من الضامة إلى حبة واحدة تسليمها من قبل AFM.
ملاحظة: تم إجراء التصوير الفلوري على مجهر الفلورة الانعكاس الداخلي الكلي من النوع الموضوعي على أساس موقف المجهر التجاري. وقد تم تجهيز هذا النظام التصوير مع 4 مصادر الليزر (405 نانومتر، 488 نانومتر، 561 نانومتر، 647 نانومتر)، والمشاهد الخائن للكشف عن لونين، وجهاز شحنة ضرب الإلكترون المقترنة (EMCCD) للتصوير واسعة المجال.- تنمو خلايا RAW264.7 على غطاء زجاجي عند 37 درجة مئوية في غرفة مرطبة بنسبة 5٪ CO 2.
- Transfect Moesin-EGFP وPLCδ-PH-mCherry إلى خلايا RAW264.7 باستخدام مجموعة التغوط (انظر جدولالمواد) وفقا لبروتوكول الشركة المصنعة لتصور الفلورسنت موسين وفوسفاتيديلينوسيتول 4,5-بيسفوسفات (PIP2) جزيئات التوالي.
ملاحظة: Moesin لديه عزر ITAM التي يمكن تنشيط سيك، لاعب رئيسي في phagocytosis. ومن المعروف PIP2 لتجنيد Moesin إلى غشاء الخلية. - وضع غطاء الزجاج مع الخلايا على عينة مجلس تجميع وجبل التجميع على مرحلة عينة AFM.
- قم بتركيب العلبة المعدلة على الخرزة على رأس المسح الضوئي AFM.
- تشغيل منحنى قوة في منطقة فارغة ومعايرة القوة مع حساسية من هذا المنحنى وثابت الربيع تقاس في الخطوة 2.2.2.
- العثور على خلية معزولة جيدا مع كثافة الفلورة المناسبة في كل من الأخضر (Moesin-EGFP) والأحمر (PLCδ-PH-mCherry) مع 488/561 نانومتر الإثارة.
- تسليم عارية 6 م حبة البوليسترين مع AFM إلى سطح الخلية مع قوة ثابتة 1 nN و 500 ثانية وقت الاتصال.
- سجل سلسلة صور الفلورة من الخلية في اتصال مع حبة لتحليل (عادة 10 إطارات / ق).
ملاحظة: للحد من ابيضاض الصور من الفلوروفور، ينبغي استخدام قوة إثارة منخفضة نسبيا ً للبحث في الخلايا ذات الأهمية. وبالإضافة إلى ذلك، يمكن استخدام مخطط إثارة متقطعة لإطالة آثار وقت الفلورة إذا كانت ديناميات استجابات الخلايا على نطاق زمني بطيء.
النتائج
ويبين الشكل 4A منحنيات المسافة الفردية من التفاعل الملزم بين الخلية أحادية T ووحدة البيانات أحادية في دورة واحدة للسحب من النهج. منحنى أحمر فاتح هو منحنى التمديد والأحمر الداكن هو منحنى التراجع. منذ يتم استخدام منحنى التمديد عادة للمسافة البادئة أو صلابة ?...
Discussion
وقد تطور التحليل الطيفي لقوة الخلية الواحدة القائم على AFM ليكون أداة قوية لمعالجة الخصائص الفيزيائية الحيوية للخلايا الحية. وبالنسبة لتلك التطبيقات، تحتاج العلبة إلى أن تعمل بشكل صحيح من أجل سبر تفاعلات أو خصائص محددة على خلايا الاهتمام. هنا، يتم وصف أساليب لاقتران خلية T واحدة وحبة واحدة...
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
ويدعم هذا العمل المؤسسة الوطنية للعلوم الطبيعية في الصين (31370878)، وبرنامج مفتاح الدولة (31630023)، وبرنامج مجموعة البحوث المبتكرة (81621002).
Materials
| Name | Company | Catalog Number | Comments |
| Material | |||
| 10 μl pipette tip | Thermo Fisher | 104-Q | |
| 15 ml tube | Corning | 430791 | |
| 6 cm diameter culture dish | NALGENE nunc | 150462 | |
| 6-well culture plate | JET | TCP011006 | |
| AFM Cantilever | NanoWorld | Arrow-TL1-50 | tipless cantilever |
| β-Mercaptoethanol | Sigma | 7604 | |
| Biocompatible glue | BD Cell-Tak | 354240 | |
| CD4+ T cell isolation Cocktail | STEMCELL | 19852C.1 | |
| DC2.4 cell line | A gift from K. Rock (University of Massachusetts Medical School, Worcester, MA) | ||
| Dextran-coated magnetic particles | STEMCELL | SV30010 | |
| EDTA | GENEray | Generay-E1101-500 ml | |
| Epoxy | ERGO | 7100 | |
| Ethanol | twbio | 00019 | |
| FBS | Ex Cell Bio | FSP500 | |
| FcR blocker | STEMCELL | 18731 | |
| Glass coverslip | local vender (Hai Men Lian Sheng) | HX-E37 | 24mm diameter, 0.17mm thinckness |
| Glass slides | JinTong department of laboratory and equipment management, Haimen | N/A | customized |
| H2O2 (30%) | Sino pharm | 10011218 | |
| H2SO4 | Sino pharm | 80120892 | |
| HEPES | Sigma | 51558 | |
| Magnet | STEMCELL | 18000 | |
| Mesh nylon strainer | BD Falcon | REF 352350 | |
| Moesin-EGFP | N/A | cloned in laboratory | |
| Mouse CD25 Treg cell positive isolation kit | STEMCELL | 18782 | Component: FcR Blocker,Regulatory T cell Positive Selection Cocktail, PE Selection Cocktail, Dextran RapidSpheres, |
| Mouse CD4+ Tcell isolation kit | STEMCELL | 19852 | Component:CD4+T cell isolation Cocktail, Streptavidin RapidSpheres, Rat Serum |
| NaOH | Lanyi chemical products co., LTD? Beijing | 1310-73-2 | |
| PBS | Solarbio | P1022-500 | |
| PE selection cocktail | STEMCELL | 18151 | |
| Penicillin-Streptomycin | Hyclone | SV30010 | |
| PLCδ-PH-mCherry | Addgene | 36075 | |
| Polystyrene microspheres 6.0μm | Polysciences | 07312-5 | |
| polystyrene round bottom tube | BD Falcon | 352054 | |
| Rat serum | STEMCELL | 13551 | |
| RAW264.7 | ATCC | ||
| Recombinant Human Interleukin-2 | Peprotech | Peprotech, 200-02-1000 | |
| Red blood cell lysis buffer | Beyotime | C3702 | |
| Regulatory T cell positive selection cocktail | STEMCELL | 18782C | |
| RPMI 1640 | Life | C11875500BT | |
| Sample chamber | Home made | ||
| Streptavidin-coated magnetic particles | STEMCELL | 50001 | |
| Transfection kit | Clontech | 631318 | |
| Trypsin 0.25% EDTA | Life | 25200114 | |
| Tweezers | JD | N/A | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 20x objective NA 0.8 | Zeiss | 420650-9901 | Plan-Apochromat |
| Atomic force microscope | JPK | cellHesion200 | |
| Centrifuge | Beckman coulter | Allegra X-12R | |
| Fluorescence imaging | home-made objective-type total internal reflection fluorescence microscop based on a Zeiss microscope stand | ||
| Humidified CO2 incubator | Thermo Fisher | HERACELL 150i | |
| Inverted light microscope | Zeiss | Observer A1 manual |
References
- Benoit, M., Gabriel, D., Gerisch, G., Gaub, H. E. Discrete interactions in cell adhesion measured by single-molecule force spectroscopy. Nature Cell Biology. 2 (6), 313-317 (2000).
- Chen, J., et al. Strong adhesion by regulatory T cells induces dendritic cell cytoskeletal polarization and contact-dependent lethargy. Journal of Experimental Medicine. 214 (2), 327-338 (2017).
- Liu, L., et al. Mechanotransduction-modulated fibrotic microniches reveal the contribution of angiogenesis in liver fibrosis. Nature Materials. 16 (12), 1252-1261 (2017).
- Mu, L. B., et al. A phosphatidylinositol 4,5-bisphosphate redistribution-based sensing mechanism initiates a phagocytosis programing. Nature Communications. 9, (2018).
- Qi, C., et al. Pathology-targeted cell delivery via injectable micro-scaffold capsule mediated by endogenous TGase. Biomaterials. 126, 1-9 (2017).
- Muller, D. J., Helenius, J., Alsteens, D., Dufrene, Y. F. Force probing surfaces of living cells to molecular resolution. Nature Chemical Biology. 5 (6), 383-390 (2009).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy: a nanoscopic window on the cell surface. Trends in Cell Biology. 21 (8), 461-469 (2011).
- Radotic, K., et al. Atomic force microscopy stiffness tomography on living Arabidopsis thaliana cells reveals the mechanical properties of surface and deep cell-wall layers during growth. Biophysics Journal. 103 (3), 386-394 (2012).
- Kuznetsova, T. G., Starodubtseva, M. N., Yegorenkov, N. I., Chizhik, S. A., Zhdanov, R. I. Atomic force microscopy probing of cell elasticity. Micron. 38 (8), 824-833 (2007).
- Scheuring, S., Dufrene, Y. F. Atomic force microscopy: probing the spatial organization, interactions and elasticity of microbial cell envelopes at molecular resolution. Molecular Microbiology. 75 (6), 1327-1336 (2010).
- Berdyyeva, T. K., Woodworth, C. D., Sokolov, I. Human epithelial cells increase their rigidity with ageing in vitro: direct measurements. Physics in Medicine and Biology. 50 (1), 81-92 (2005).
- Sokolov, I., Dokukin, M. E., Guz, N. V. Method for quantitative measurements of the elastic modulus of biological cells in AFM indentation experiments. Methods. 60 (2), 202-213 (2013).
- Bozna, B. L., et al. Binding strength and dynamics of invariant natural killer cell T cell receptor/CD1d-glycosphingolipid interaction on living cells by single molecule force spectroscopy. Journal of Biological Chemistry. 286 (18), 15973-15979 (2011).
- Flach, T. L., et al. Alum interaction with dendritic cell membrane lipids is essential for its adjuvanticity. Nature Medicine. 17 (4), 479-487 (2011).
- Ng, G., et al. Receptor-independent, direct membrane binding leads to cell-surface lipid sorting and Syk kinase activation in dendritic cells. Immunity. 29 (5), 807-818 (2008).
- Helenius, J., Heisenberg, C. P., Gaub, H. E., Muller, D. J. Single-cell force spectroscopy. Journal of Cell Science. 121 (11), 1785-1791 (2008).
- Litvinov, R. I., Shuman, H., Bennett, J. S., Weisel, J. W. Binding strength and activation state of single fibrinogen-integrin pairs on living cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (11), 7426-7431 (2002).
- Evans, E., Ritchie, K., Merkel, R. Sensitive Force Technique to Probe Molecular Adhesion and Structural Linkages at Biological Interfaces. Biophysics Journal. 68 (6), 2580-2587 (1995).
- Lamprecht, C., Hinterdorfer, P., Ebner, A. Applications of biosensing atomic force microscopy in monitoring drug and nanoparticle delivery. Expert Opinion on Drug Delivery. 11 (8), 1237-1253 (2014).
- Charras, G. T., Horton, M. A. Single cell mechanotransduction and its modulation analyzed by atomic force microscope indentation. Biophysics Journal. 82 (6), 2970-2981 (2002).
- Sun, M. Z., et al. Multiple membrane tethers probed by atomic force microscopy. Biophysics Journal. 89 (6), 4320-4329 (2005).
- Yan, J. C., Liu, B., Shi, Y., Qi, H. Class II MHC-independent suppressive adhesion of dendritic cells by regulatory T cells in vivo. Journal of Experimental Medicine. 214 (2), 319-326 (2017).
- Hao, J. J., et al. Phospholipase C-mediated hydrolysis of PIP2 releases ERM proteins from lymphocyte membrane. Journal of Cell Biology. 184 (3), 451-462 (2009).
- Rodriguez, R. M., et al. Lymphocyte-T Adhesion to Fibronectin (Fn) - a Possible Mechanism for T-Cell Accumulation in the Rheumatoid Joint. Clinical and Experimental Immunology. 89 (3), 439-445 (1992).
- Kimura, A., Ersson, B. Activation of Lymphocytes-T by Lectins and Carbohydrate-Oxidizing Reagents Viewed as an Immunological Recognition of Cell-Surface Modifications Seen in the Context of Self Major Histocompatibility Complex Antigens. European Journal of Immunology. 11 (6), 475-483 (1981).
- Miller, K. The Stimulation of Human Lymphocyte-B and Lymphocyte-T by Various Lectins. Immunobiology. 165 (2), 132-146 (1983).
- Vitte, J., Pierres, A., Benoliel, A. M., Bongrand, P. Direct quantification of the modulation of interaction between cell- or surface-bound LFA-1 and ICAM-1. Journal of Leukocyte Biology. 76 (3), 594-602 (2004).
- Beaussart, A., et al. Quantifying the forces guiding microbial cell adhesion using single-cell force spectroscopy. Nature Protocols. 9 (5), 1049-1055 (2014).
- Shu, F., et al. Cholesterol Crystal-Mediated Inflammation Is Driven by Plasma Membrane Destabilization. Frontiers in Immunology. 9, (2018).
- Hosseini, B. H., et al. Immune synapse formation determines interaction forces between T cells and antigen-presenting cells measured by atomic force microscopy. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17852-17857 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved