Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tek-T hücreleri veya tek parçacık Immünolojik tek hücreli kuvvet spektroskopisi ile Atomic Force mikroskop Cantilevers functionalization
Bu Makalede
Özet
Biz immunolojik çalışmalar için tek bir T hücresi ve boncuk parçacık ile Atomic Force mikroskop (AFM) konsol functionalize bir protokol sunuyoruz. AFM tarafından tek çifti T hücreli dendritik hücre bağlayıcılığı araştırması ve makrofajların gerçek zamanlı hücresel tepkisi ile AFM tarafından floresans görüntüleme ile tek bir katı parçacığın izlenmesi için prosedürler gösterilmektedir.
Özet
Atomik kuvvet mikroskopisi bazlı tek hücreli kuvvet spektroskopisi (AFM-SCFS), yaşam hücrelerinin Biyofizik özelliklerini incelemek için güçlü bir araçtır. Bu teknik, hücreler, reseptör ve ligler arasında ve diğer birçok varyasyonların yanı sıra, canlı bir hücre membranında etkileşim kuvvetlerini ve dinamiklerini araştırarak sağlar. Ayrıca, belirli hücre aktivasyonu ve sonraki hücresel olayların canlı hücre ile kombine edildiğinde gerçek zamanlı olarak izlenmesi için izin, böylece bir spatiotemporally kontrollü bir şekilde tek hücrelerde fiziksel veya biyokimyasal uyarıcı teslim etmek için bir mekanizma olarak çalışır floresans görüntüleme. Bu AFM-SCFS ölçümlerinde anahtar adım AFM-Cantilever functionalization, ya da başka bir deyişle, konsol için ilgi bir konu iliştirmek. Burada, immünolojik çalışmalar için sırasıyla tek bir T hücresi ve tek bir polistiren boncuk ile AFM atölyeler değiştirmek için yöntemler sunuyoruz. Eski bir çözelti içinde düz bir konsol ucunu çiftler tek T hücreleri bir biyouyumlu tutkal içerir, ikincisi hava ortamında tek boncuk yapışma için bir epoksi tutkal dayanır iken. Her bir konsol modifikasyonu ile ilişkili iki immünolojik uygulama da sağlanır. Burada açıklanan yöntemler, farklı hücre türlerine ve katı parçacıklara kolayca adapte edilebilir.
Giriş
Atomic Force microkopi (AFM), çok yönlü bir araç, hücre Biyoloji araştırma1,2,3,4,5birçok uygulama buldu. Yüksek çözünürlüklü görüntüleme özelliğinden farklı olarak, doğal kuvvet yoklama özelliği, yaşam hücrelerinin Biyofizik özelliklerinin, tek hücreli6,7' de doğrudan situ 'da araştırılmasını sağlar. Bunlar, alt hücreli yapıların sertlik ve hatta tüm hücreler8,9,10,11,12, spesifik ligand/reseptör bağlama güçlü içerir tek molekül seviyesi hücre yüzeyi13, ve tek çiftleri arasında katı parçacıklar ve hücreler veya iki hücre arasında yapışma güçleri1,2,14,15. İkinci iki genellikle tek hücreli kuvvet spektroskopisi (SCFS)16olarak sınıflandırılır. Çeşitli bahar sabiti ile kolayca kullanılabilir atölyeler sayesinde, AFM erişilebilir kuvvet aralığı oldukça birkaç piconewtons (PN) mikronewtons (μn), hangi yeterli hücresel olayların tüm aralığı kapsar birkaç onlarca güçler içeren geniş pN, reseptör tabanlı tek molekül bağlama gibi, nN için, gibi phagositik hücresel olaylar15. Bu büyük dinamik kuvvet aralığı, AFM 'ye, optik/manyetik cımbız ve Biomembran kuvvet sondası gibi diğer kuvvet prob teknikleri üzerinde avantajlı hale getirir, çünkü zayıf kuvvet ölçümleri için daha uygundur, genellikle 200 pN17 ' den az kuvvet ile , 18. Buna ek olarak, AFM, tek hücrelere çeşitli uyaranlara teslim etmek için yüksek hassasiyetli manipülatör olarak işlev verebilir bir spatiotemporally tanımlanan şekilde4,19. Bu gerçek zamanlı tek hücreli aktivasyon çalışmaları için arzu edilir. Canlı hücreli floresan görüntüleme ile birlikte, spesifik uyarıcı için sonraki hücresel yanıt aynı anda izlenebilir, böylece AFM tabanlı scfs son derece sağlam optik görüntüleme olarak hücresel sinyal prob için pratik bir araç sağlayan güçlü hale. Örneğin, osteoblastlar20' de kalsiyum geçişler için gerekli suşları belirlemek için AFM kullanılmıştır. Bu çalışmamızda, lokalize kuvvetlerin bir AFM ucu ile kültürlü osteoblastlar üzerinde uygulanması sonrasında kalsiyum onay görüntülemesi ile floresan kalsiyum geçitleri izlenen. Son zamanlarda, AFM hangi hepatik stellat hücreler (HSC) büyüdü ve bu mechano-dönüştürücü HSC aktivasyon gerçek zamanlı bir floresan src biosensor tarafından izlenen olan fosforilasyon tarafından temsil edilen kollajen fibriller germe için istihdam edildi biosensörün floresan yoğunluğu HSC aktivasyonu ile ilişkilidir3.
AFM tabanlı scfs deneylerinde, AFM atölyeler uygun functionalization başarılı ölçümler doğru önemli bir adımdır. Araştırmalarımız bağışıklık hücrelerinin aktivasyonuna odaklandığı için, biz rutin olarak fagositoz ve/veya güçlü immün tepkiler tetikleyebilir tek katı parçacıklar gibi partikül konuları ile konsol functionalize4,14 , 15 ve tek T hücreleri bu aktif dendritik hücreler (DC)2gibi antijen sunan hücreler, bir bağışıklık sinaps oluşturabilir. Tek katı parçacıklar normal olarak bir konsol ile hava ortamında bir epoksi tutkal ile birleştiğinde, tek T hücreleri, onların yapışkan olmayan doğası nedeniyle, çözüm bir biyouyumlu tutkal aracılığıyla bir konsol functionalized. Burada, bu iki tür konsol değişikliğini gerçekleştirmek ve aynı zamanda iki ilişkili uygulama vermek için yöntemleri tarif ediyoruz. İlk uygulama, T Cell/DC etkileşimlerini AFM-SCFS ile araştırmanın hücre mekaniği açısından düzenleyici T hücrelerinin bastırıcı mekanizmasını anlamak içindir. İkincisi, reseptör bağımsız fosfatidilositol 4, 5-bisfosfat (PIP2) molekül mekanizmasını ortaya çıkarmak için gerçek zamanlı olarak makro Phage sağlam bir parçacık için hücresel tepkisi izlemek için canlı hücreli floresan görüntüleme ile AFM birleştirerek içerir- Moesin aracılı fagositoz. Bu protokolün amacı, ilgili araştırmacıların immünolojik araştırmalar için AFM tabanlı tek hücreli analizlerle kendi deneysel ayarlarını tasarlayıp uygulamalarına yönelik bir referans çerçevesi sağlamaktır.
Protokol
Fare deney Protokolü Tsinghua Üniversitesi hayvan bakım kurallarını takip
1. tek T hücreleri ile konsol functionalization
- Fare dalak hücreleri hazırlama
- Karbon dioksit kullanarak fare (8-16 yaş (ya seks); Örneğin, C57BL/6 strain) feda, servikal dislocation izledi.
- 75% etanol ile fareyi temizleyin ve splenektomi takiben orta çizgi cilt kesi yapın.
- Cam kaydırakları kullanarak% 2 fetal sığır serumu (FBS) içeren 4 mL PBS 'de dalağı homojenize ederek, hücre süspansiyonunu 70 μm kafes naylon süzgecinden geçirerek toplar ve kalıntıları çıkarın.
- 5 dakika boyunca 500 x g 'de hücre süspansiyonunu santrifüjle çıkarın, 2 ml kırmızı kan hücresi liziz tamponunun (Oda sıcaklığında dengeli) 5 dk. PBS çözeltisi 8 ml ekleyerek liziz reaksiyonu sonlandırmak için süpernatant ve pelletini hücreleri atın.
- % 2 FBS ve 1 mm EDTA (çözüm a olarak etiketlenmiş) içeren PBS 'de 1 x 108 hücre/ml yoğunluğunda 5 dakika ve pelletini hücreler için 500 x g 'de hücre süspansiyonunu santrifüjle yapın, hücre yoğunluğuna bağlı olarak genellikle 0.25-2 ml. Resuspended hücreleri 5 mL (12 x 75 mm) polistiren yuvarlak alt tüpüne aktarın.
- Fare CD4 + T hücreleri hazırlama
- Eklemek 50 μL/mL sıçan serumu (bkz. malzeme tablosu) ve 50 μL/ml CD4 + T hücre yalıtım kokteyli (bkz. malzeme tablosu) hücre örneği için adım 1.1.5 elde. Oda sıcaklığında 10 dakika boyunca karıştırın ve inküye yapın.
- Stok streptavidin kaplı Manyetik parçacık çözeltisi Vortex (bkz. malzeme tablosu) 30 s veya parçacıklar eşit dağınık görünür kadar.
- 75 μL/mL streptavidin kaplı manyetik parçacıkları hücre örneğine ekleyin. Oda sıcaklığında 2,5 dakika boyunca karıştırın ve inküye yapın.
- 2,5 mL 'ye kadar hücre örneğini üst üste ve 2-3 kez hafifçe yukarı ve aşağı pipetleme yaparak Mix A çözüm ekleyin.
- Numune tüpünü (kapak olmadan) mıknatıs içine yerleştirin ( malzeme tablosunabakın) ve oda sıcaklığında 5 dakika boyunca inküye yapın. Özenle yeni bir 5 mL polistiren yuvarlak alt tüp içine zenginleştirilmiş hücre süspansiyon dökün.
- Hücre süspansiyonunu 5 dakika boyunca 500 x g 'de santrifüjle çıkarın ve 500 μL çözüm A 'da zenginleştirilmiş T hücrelerini yeniden pelletini.
Not: zenginleştirilmiş CD4 + T hücreleri hem geleneksel hem de düzenleyici T hücrelerini içerir.
- Geleneksel T hücrelerinden düzenleyici T hücreleri ayrımı
- Adım 1.2.6 ' den elde edilen zenginleştirilmiş T hücresi örneğinden 25 μL FcR engelleyici ( malzeme tablosunabakın) ekleyin. Oda sıcaklığında 5 dakika boyunca karıştırın ve inküye yapın.
- T hücresi örneğine 25 μL düzenleyici T hücresi pozitif seçim kokteyli (bkz. malzeme tablosu) ekleyin. Oda sıcaklığında 10 dakika boyunca karıştırın ve inküye yapın.
- T hücresi örneğine 10 μL PE seçim kokteyli (bkz. malzeme tablosu) ekleyin. Oda sıcaklığında 5 dakika boyunca karıştırın ve inküye yapın.
- 30 s için veya parçacıklar eşit dağınık görünene kadar stok dextran kaplı Manyetik parçacık solüsyonu (bkz. malzeme tablosu) Vortex.
- T hücresi örneğine 10 μL dextran kaplı manyetik parçacıklar ekleyin. Oda sıcaklığında 5 dakika boyunca karıştırın ve inküye yapın.
- T hücre örneğini 2,5 mL 'ye kadar yukarı ve 2-3 kez hafifçe yukarı ve aşağı pipetleme ile karıştırın A çözümü ekleyin.
- T hücresi numune tüpünü (kapak olmadan) mıknatıs içine yerleştirin ve oda sıcaklığında 5 dakika boyunca inküye yapın. Dikkatle yeni bir tüp için süpernatant dökün.
Not: süpernatant zenginleştirilmiş konvansiyonel CD4 + T hücreleri içerir. - Zenginleştirilmiş konvansiyonel CD4 + T hücrelerini 5 dakika boyunca 500 x g 'de santrifüjün ve% 10 FBS, 0,05 mm β-mercaptoetanol, 0,01 M Hepler ve% 1 penisilin/streptomisin (orta B olarak etiketlenmiş) içeren 4 ml 'lik hücrelerde süpernatant 'ı atın ve hücreleri pelletini.
- Düzenleyici T hücrelerinin mıknatıs tarafından zenginleştirilen tüpünü çıkarın. 2,5 mL çözelti Ekle tüp ve mix, 2-3 kez hafifçe yukarı ve aşağı pipetleme ile. Tüp geri mıknatıs içine koyun, 5 dakika boyunca inküye, ve sonra dikkatle dökün ve supernatant atın. Bu adımı üç kez daha tekrarlayın.
- Zenginleştirilmiş düzenleyici T hücrelerini 2 mL orta B 'de resuspend.
- Her iki saflaştırılmış geleneksel T hücrelerini ve düzenleyici T hücrelerini 100 U/mL hIL-2 ' y e ya da 37 °C ' de en az 4 saat ile% 5 CO2 ' lik bir nemlendirici inküyörün içinde takerever functionalization için kullanmadan önce kuluçla.
- Dendritik hücreler hazırlanması
- Hazırlamak Piranha çözüm, bir karışımı 30% H2O2 (30%) ve 70% H2bu yüzden4 (CONC) (v/v). Yavaşça 3 mL H 2 o2 içine 7 ml h2so4 sabit karıştırma ve soğutma altında dökün.
DIKKAT: Piranha çözeltisi son derece korozif, ve yakmak ve vücut dokularında yok olabilir. Bu nedenle, bir başlık altında Piranha solüsyonu kullanmak ve uygun güvenlik ekipmanları giymek daha güvenlidir, karışımı Beaker etrafında sıçrama gibi. Kullanımından sonra pH 7 ' ye NaOH ile çözüm nötralize. - 24 mm çapında cam lamel magazini 30 dakika boyunca Piranha çözeltisi içine daldırın ve steril ultra saf su ile daha sonra iyice durulayın.
- Soğuk dezenfeksiyon için 30 dakika boyunca% 75 etanol içinde sivri cımbız bir çift dip.
- Temizlenmiş cam coverlar cımbız tarafından 6-well kültür plaka içine tanıtmak.
- DC 2.4 hücrelerinin 4 ml Orta B ile önceden kültürlü olduğu ve tüm ortamı Aspire eden 6 cm 'lik plastik kültür çanak eğim. DC 2,4 hücreleri durulamak ve PBS atmak için kültür çanak içine PBS 2 mL ekleyin. Bu durulama adımını iki kez daha tekrarlayın.
- Ekle 1 ml 0,25% tripsin EDTA için kültür çanak 2 dakika. enzimin sindirim reaksiyonu sona erdirmek için bu çanak için orta B 1 ml ekleyin. Sindirilmiş hücre süspansiyonunu 15 mL 'Lik bir tüpe aktarın.
- Hücre süspansiyonunu 5 dakika için 500 x g 'de santrifüjler ve orta B 'de 2 x 105 hücre/ml yoğunlukta DC 2.4 hücreleri pelletini.
- Adım 1.4.4 ' de hazırlanan cam coverları üzerinde çekirdek DC 2.4 hücreler ve% 5 CO2Ile 37 °c ' de nemlendirilmiş bir odada bir gecede hücreleri kulkayla.
Not: iki tek hücre arasında etkileşim güçleri ölçmek için, nispeten düşük bir DC 2.4 hücreleri konsantrasyonu (yani, <% 10 konfluency) hücreler arasında uygun bir Aralık olması gerekir.
- Hazırlamak Piranha çözüm, bir karışımı 30% H2O2 (30%) ve 70% H2bu yüzden4 (CONC) (v/v). Yavaşça 3 mL H 2 o2 içine 7 ml h2so4 sabit karıştırma ve soğutma altında dökün.
- AFM konsol hazırlama
Not: tek hücreli kuvvet spektroskopisi deneyleri için uygun olan konsol, genellikle 0.01-0.06 N/m aralığında düşük yay sabitleri olan olanlardır. Burada, yumuşak uç-Less atölyeler tek hücreler ve tek katı parçacıklar functionalization için tercih edilir.- Piranha tedavi veya plazma veya UV-ozon temizliği ile atölyeler temizleyin.
- Temizlenmiş konsol AFM tarama kafasına monte edin.
- Saf su ile dolu temiz bir örnek odası hazırlayın ve ilk önce cam substrat üzerinde bir kuvvet eğrisi kullanarak hassasiyetini elde etmek için (yaklaşan eğrinin itici parçası üzerinde doğrusal sığmanın eğimi) su çözeltisi üzerinde konsol kalibre edin ve sonra AFM 'nin yönerge kılavuzuna göre Yay sabiti ayıklamak için bir termal gürültü spektrum kayıt.
- Çözümden AFM tarama kafasını çıkarın, saf etanol birkaç damla ile monte konsol yıkayın ve tarama kafası üzerinde konsol kuru tutmak.
- Tek T hücrelerini konsol içine ekleme
- 37 °C ' de% 5 CO2 ile yaşayan hücre ortamını ön ısıtın.
- DC 2.4 hücreleri ile cam lamel magazini Mount örnek bir oda montajı için adım 1.4.8 üzerinde yetiştirilen, hemen odasına 600 μL orta B ekleyin ve ardından montaj AFM örnek aşamaya yerleştirin.
- HIL-2 Ekle CD4 + T hücreleri (ya geleneksel veya düzenleyici T hücreleri) örnek odasına ekleyin.
Not: Toplam örnek birim 1 mL 'yi geçmemelidir. - Katma CD4 + T hücreleri tamamen coverslip alt aşağı yerleşmiş kadar bekleyin.
Not: hava kabarcıkları deney için büyük rahatsızlık neden olacak, bu nedenle, adım 1.6.2 ve 1.6.3 herhangi bir hava kabarcıkları önlemek için tavsiye edilir. - Şekil 1 ' de gösterildiği gibi bir pipet ile monte edilen konsol ucunu üzerine 2 μL biyouyumlu tutkal bir damla ekleyin ve daha sonra hızlı bir şekilde örnek aşamasına tarama kafasını yerleştirin, böylece konsol biyouyumlu tutkal batırmak ile kaplanmış izin Çözüm.
DIKKAT: pipet ucu ile cam bloğa veya konsol dokunuşuna dokunmayın. Burada kullanılan biyouyumlu tutkal havada oksidasyona eğilimli olduğundan, bu adım mümkün olduğunca çabuk yapılmalıdır. - Örnek aşamasını hareket ettirerek ve ardından tarama kafasını hareket ettirerek pozisyonlamayı ince olarak ayarlayarak, mikroskop altında, konsol ucunu altında sağlıklı bir T hücresi bulun.
Not: sağlıklı bir CD4 + T hücresi genellikle nispeten büyük bir boyuta sahiptir, Pürüzsüz kenarlar ve parlak alan görüntülemede optik olarak aktarıcıdır. - Step motorları kontrol ederek kademeli olarak 50 μm ' den başlayarak 10, 5, 2 ve 0,5 μm ' ye kadar adım boyutları ile manuel olarak indirin. Step motorları konumunu tutun ve konsol ucu ve hücre arasında daha iyi uyum için tarama kafası konumlandırma ayarlamak, bir kez konsol lazer ışını küçük bir deplasman tarafından belirtildiği gibi hedef T hücresi ile sağlam bir temas yapar 0.5-1.5 nN tipik bir kuvvet aralığına karşılık gelen Fotodedektör pozisyon.
Not: Bu adım, hangi set-Point (hücreye uygulanan kuvvet) ve temas süresi iyi yazılım içinde tanımlanabilir tek bir kuvvet ölçümü çalıştırarak da yapılabilir. Ancak, T hücrelerinin yapışkanlı olmayan doğası nedeniyle, Manuel yaklaşım, hedeflemeyi kontrol etmek daha fazla esneklik sağlar, konumlandırma, ve iletişim süresi otomatik yaklaşan yapar ve T hücre yapışma için güvenilir bir şekilde çalışır. Gelecekteki deneyler hem manuel ve otomatik olarak ilgi onların sistemleri için daha iyi çalışır bulmak için yaklaşıyor denemelisiniz. - 30 s temas ettikten sonra konsol geri çekin.
Not: hücre konsol ile hareket ederse, ek başarılı olur. Değilse, adım 1.6.6 ancak farklı bir T hücresinde yineleyin. Biyouyumlu tutkal kolayca okside edilir. Adım 1.6.5-1.6.7 5 dk içinde tamamlanmalıdır. Buna ek olarak, aynı konsol T hücresi eki için üç kez başarısız olursa, yeni bir konsol kullanılmalıdır ve ek prosedür, adım 1.5.2 ' den tekrar başlamalıdır.
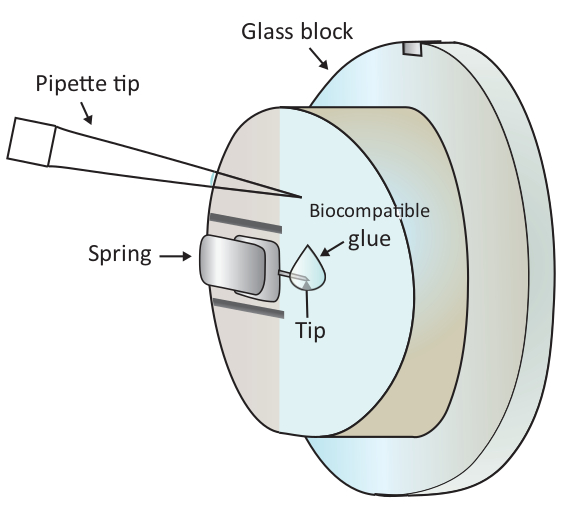
Şekil 1: monte edilen konsol üzerine küçük bir damla biyouyumlu tutkal ekleme şematik temsili. Konsol, AFM tarama kafası (burada çizilmiş değil) yüklü cam blok tutucu üzerinde bir bağlama yay üzerinden monte edilir. Tarama kafası seviyelendirilmiş bir yüzeyde durduğunda, konsol resimde gösterildiği gibi dikey olarak yönlendirilir. Yaklaşık 2 μL biyouyumlu tutkal bir mikro-pipet ile konsol ucunu eklenebilir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
- Tek çifti T hücre/dendritik hücre etkileşimi Force spektroskopisi
Not: hücre/hücre etkileşimlerini araştırabilmek Için, iki hücreyi tam olarak ayırmak için geleneksel 10-15 μm ' den daha büyük bir Z aralığına sahip bir AFM gereklidir. Burada kullanılan AFM, hücre/hücre temas ettikten sonra dendritik hücreden T hücresini ayırmak için yeterli olan 100 μm Z aralığına sahiptir.- Ekli T hücresini, örnek aşaması ve/veya tarama kafasını taşıyarak ayrı bir DC 2.4 hücresinin üzerine getirin (bkz. Şekil 2).
- Uygun parametreler ayarlayın ve kuvvet spektroskopisi çalıştırın.
Not: aşağıdaki anahtar ayarları genellikle kullanılır: SetPoint 0,5 nN, çekme uzunluğu 50 μm, Z hareketi sabit hız, uzatma hızı 5 μm/s, kontak süresi 10 s, Delay modu Constant Force. Her T-DC çiftleri için 20 kuvvet eğrilerinin tekrarı toplanır ve daha fazla analiz için en az 14 kuvvet eğrisi kullanılır. - Yeni bir temizlenmiş konsol monte, adım 1.5.3 gibi saf suda kalibre ve farklı bir T-DC çifti için adım 1,6 ve 1,7 tekrar aynı T-DC hücreleri örnek geri dönün. Her koşul için en az 5 çift prob.
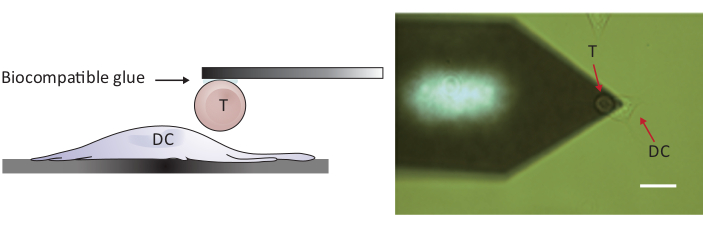
Şekil 2: tek bir T hücresi Ile DC arasında kuvvet yoklama deneysel yapılandırma. (A) şematik çizim, bir T hücresi bağlı olan bir DC için güç probing için substrat yetiştirilen getirilen deneysel yapılandırma. (B) T hücresi işlevselleştirilmiş bir konsol ve bir DC 'nin parlak alan görüntüsü. Ölçek çubuğu, 20 μm. Bu rakam daha büyük bir sürümünü görüntülemek Için lütfen buraya tıklayın .
2. tek polistiren boncuklar ile konsol functionalization
- Tek boncuk hazırlama
- 100% etanol içinde 6 μm polistiren boncuk stok süspansiyon seyreltme.
Not: seyreltilmiş boncuk çözeltisi konsantrasyonu yeterince düşük olmalıdır, böylece bir cam lamel magazini yüzeyine eklendiğinde, bireysel boncuklar solvent buharlaşma sonrasında önemli bir kümeleme olmaksızın iyi ayrılır. - 24 mm çapında cam kaplama kayma etanol ile temizleyin ve N2 hava akımı ile herhangi bir toz çıkarın.
- Temizlenmiş cam lamel magazini örnek bir oda montajına monte edin ve montajı mikroskop üzerine koyun.
- Sol tarafına seyreltilmiş boncuk solüsyonu bir damla koyun ama lamel magazini merkezine yakın ( Şekil 3' e bakın) ve 20X objektif ile mikroskop altında parlak alanda solvent evaporasyon sonra boncuklar arasındaki aralığı kontrol edin. Bireysel boncuklar iyi ayrılırsa bir sonraki adıma geçin.
- Bir mikropipet ucu veya bir kürdan iyi karışık epoksi tutkal içine daldırma ve daha sonra sağ tarafta ardışık nazik dokunuşlar ile üç ayrı noktalara bu tür tutkal küçük bir miktar transfer ama coverslip merkezine yakın.
Not: üç yapıştırıcı spot dikey olarak hizalanmalıdır (bkz. Şekil 3). En az tutkal miktarı ile son nokta daha sonra kullanılacaktır.
- 100% etanol içinde 6 μm polistiren boncuk stok süspansiyon seyreltme.
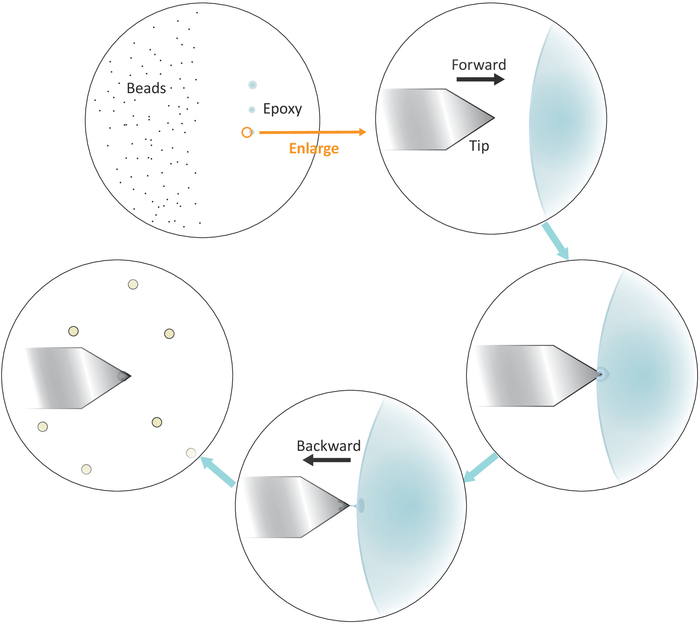
Şekil 3: tek boncuk functionalization için çalışma akışının şematik gösterimi. İyi ayrılmış mikron ölçekli boncuk substrat sol tarafında hazırlanır ve epoksi tutkal küçük bir miktar 3 ardışık nazik dokunuşlar ile substrat sağ tarafına aktarılır, 3 tutkal lekeler sonuçlanan. Sadece son nokta tutkal en az miktarda (bir daire ile gösterilir), kabın çok sonuna kat için kullanılır. Soldan tutkal içine konsol yaklaşım ve sonra konsol geriye doğru bir kez o yapıştırıcının içine yapıştırıcının içine yapışmış olan en sonunda tutkal sıkışmak için hareket. Hedef boncuk konsol altında getirmek ve düzgün bir temas yapmadan önce doğru şekilde hizalayın (genellikle 2-5 nN) boncuk yapışma için. Boncuk başarıyla konsol üzerinde işlevselleştirilmiş olduğunda, yeni bir konsol yeni bir functionalization döngüsü başlatmak için monte edilebilir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
- AFM konsol hazırlama
- AFM tarama kafası için temizlenmiş bir uç-Less konsol bağlayın.
- Yay sabiti elde etmek için temiz bir yüzeye sahip bu konsol havada kalibre.
- Tek boncuk eklemek için konsol
- Şekil 3 ' te gösterildiği gibi son epoksi tutkal noktasının sol sınırında konsol ucunu konumlandırın.
- Küçük adım boyutları ile step motorları düşürerek yavaşça tutkal yakın yapıştırma getirin.
- Ucu yapıştırıcının içine Daldırıldıktan sonra AFM tarama kafasını geriye doğru (sola) hareket ettirerek hızlı bir şekilde tutkal üzerinden hızlıca yapıştırıcıyı çekin.
Not: sadece küçük bir miktar tutkal ucu çok sonuna kadar yapışır emin olun. Uç üzerinde aşırı tutkal varsa, ucu boş bir yüzeye kaydırarak ardından dokunarak tutkal miktarını azaltmak mümkündür. - İyi yalıtılmış tek bir boncuk üzerine konsol ucu taşıyın.
- Yavaş tek boncuk için konsol yaklaşımı ve boncuk ile sağlam bir temas yapmak (gibi fotoğraf dedektörü tipik bir kuvvet aralığına karşılık gelen lazer ışını konumunun deplasmanında belirtilen 2-5 nN) yaklaşık 10 s sırasında t ince ayarı ip konumlandırma yanal daha iyi ucu en sonunda boncuk bulmak yardımcı olacaktır. Kişinin sonundaki ucu geri çekin.
Not: orijinal odak düzleminden çok boncuk ortadan kaybolması başarılı bir yapışıcı olay gösterir. - Boncuk-modifiye konsol dikkatle demount ve tutkal tam katılaşma için bir gece kutusunda bir konsol saklamak.
- AFM tarafından teslim edilen tek bir boncuk için makrophaj hücresel yanıt floresan görüntüleme.
Not: floresan görüntüleme, ticari mikroskop standına dayanan ev yapımı objektif tipi Toplam dahili yansıma Floresan Mikroskobu üzerinde yapılmıştır. Bu görüntüleme sistemi 4 lazer kaynakları (405 Nm, 488 Nm, 561 Nm, 647 Nm), iki renk algılama için bir Splitter Görüntüleyici ve geniş alan görüntüleme için bir elektron çarpık şarj bağlantılı cihaz (EMCCD) ile donatılmıştır.- % 5 Co2 nemlendirici odada 37 °c ' de cam lamel magazini üzerinde RAW 264.7 hücreler büyütün.
- Transfect moesin-EGFP ve plcδ-pH-MCherry RAW 264.7 hücreler için bir transfeksiyon Kit kullanarak (bkz . malzeme tablosu) floresan ve fosfatidilositol 4, 5-bisfosfat (PIP2) molekül görselleştirme için üreticinin protokolüne göre Sıra -sıyla.
Not: Moesin, phagositozda anahtar bir oyuncu olan SYK 'ı etkinleştirecek bir ITAM motif vardır. PIP2 Moesin 'in Hücre zarına işe almaktadır. - Cam coverslını hücrelerle örnek bir oda montajına yerleştirin ve montajı AFM örnek aşamasına takın.
- Boncuk-modifiye konsol AFM tarama kafası monte edin.
- Boş bir alanda bir kuvvet eğrisi çalıştırın ve bu eğrinin hassasiyetiyle kuvveti kalibre edin ve adım 2.2.2 'de ölçülen Yay sabiti.
- 488/561 nm uyarımları ile hem yeşil (Moesin-EGFP) hem de kırmızı (PLCδ-PH-mCherry) kanallarında uygun floresan yoğunlukları olan iyi yalıtılmış bir hücre bulun.
- 1 nN sabit kuvvet ve 500 s temas süresi ile hücre yüzeyine AFM ile çıplak 6 μm polistiren boncuk teslim.
- Analiz için boncuk ile temas hücresinin floresan görüntü serisi kayıt (genellikle 10 kare/s).
Not: fluoropoerlerin photobleaching azaltmak Için, nispeten düşük uyarma gücü ilgi hücreleri arama için kullanılmalıdır. Ayrıca, hücre yanıtlarının dinamikleri yavaş zaman ölçeğinde ise floresan zaman izlerini uzatmak için aralıklı bir uyarma şeması kullanılabilir.
Sonuçlar
Şekil 4A , tek T hücresi Ile tek DC arasındaki bağlama etkileşiminden tipik kuvvet uzaklığı eğrilerini bir yaklaşım geri çekilme döngüsünde gösterir. Açık kırmızı eğrisi uzatma eğrisidir ve koyu kırmızı olan geri çekme eğrisidir. Uzantı eğrisi genellikle girintileme veya rijitlik analizi için kullanılındığı için, burada yalnızca geri çekme eğrisi hücre yapışma için ilgilidir. Eğrinin minimum değeri (yeşil daire) ...
Tartışmalar
AFM tabanlı tek hücreli kuvvet spektroskopisi, yaşayan hücrelerin Biyofizik özelliklerini ele almak için güçlü bir araç olarak gelişti. Bu uygulamalar için, konsol ilgi hücrelerinde belirli etkileşimleri veya özellikleri araştırma için düzgün işlevselleştirilmiş olması gerekir. Burada, tek T hücresi ve tek mikron büyüklüğünde boncuk için ucu-Less konsol bağlama yöntemleri sırasıyla açıklanmıştır. Tek bir T hücresi eklemek için, hücre yapıştırıcı olarak biyouyumlu bir tutkal...
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Bu çalışma Ulusal Doğal Bilim Vakfı Çin genel programı (31370878), devlet anahtar programı (31630023) ve yenilikçi araştırma grubu programı (81621002) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Material | |||
| 10 μl pipette tip | Thermo Fisher | 104-Q | |
| 15 ml tube | Corning | 430791 | |
| 6 cm diameter culture dish | NALGENE nunc | 150462 | |
| 6-well culture plate | JET | TCP011006 | |
| AFM Cantilever | NanoWorld | Arrow-TL1-50 | tipless cantilever |
| β-Mercaptoethanol | Sigma | 7604 | |
| Biocompatible glue | BD Cell-Tak | 354240 | |
| CD4+ T cell isolation Cocktail | STEMCELL | 19852C.1 | |
| DC2.4 cell line | A gift from K. Rock (University of Massachusetts Medical School, Worcester, MA) | ||
| Dextran-coated magnetic particles | STEMCELL | SV30010 | |
| EDTA | GENEray | Generay-E1101-500 ml | |
| Epoxy | ERGO | 7100 | |
| Ethanol | twbio | 00019 | |
| FBS | Ex Cell Bio | FSP500 | |
| FcR blocker | STEMCELL | 18731 | |
| Glass coverslip | local vender (Hai Men Lian Sheng) | HX-E37 | 24mm diameter, 0.17mm thinckness |
| Glass slides | JinTong department of laboratory and equipment management, Haimen | N/A | customized |
| H2O2 (30%) | Sino pharm | 10011218 | |
| H2SO4 | Sino pharm | 80120892 | |
| HEPES | Sigma | 51558 | |
| Magnet | STEMCELL | 18000 | |
| Mesh nylon strainer | BD Falcon | REF 352350 | |
| Moesin-EGFP | N/A | cloned in laboratory | |
| Mouse CD25 Treg cell positive isolation kit | STEMCELL | 18782 | Component: FcR Blocker,Regulatory T cell Positive Selection Cocktail, PE Selection Cocktail, Dextran RapidSpheres, |
| Mouse CD4+ Tcell isolation kit | STEMCELL | 19852 | Component:CD4+T cell isolation Cocktail, Streptavidin RapidSpheres, Rat Serum |
| NaOH | Lanyi chemical products co., LTD? Beijing | 1310-73-2 | |
| PBS | Solarbio | P1022-500 | |
| PE selection cocktail | STEMCELL | 18151 | |
| Penicillin-Streptomycin | Hyclone | SV30010 | |
| PLCδ-PH-mCherry | Addgene | 36075 | |
| Polystyrene microspheres 6.0μm | Polysciences | 07312-5 | |
| polystyrene round bottom tube | BD Falcon | 352054 | |
| Rat serum | STEMCELL | 13551 | |
| RAW264.7 | ATCC | ||
| Recombinant Human Interleukin-2 | Peprotech | Peprotech, 200-02-1000 | |
| Red blood cell lysis buffer | Beyotime | C3702 | |
| Regulatory T cell positive selection cocktail | STEMCELL | 18782C | |
| RPMI 1640 | Life | C11875500BT | |
| Sample chamber | Home made | ||
| Streptavidin-coated magnetic particles | STEMCELL | 50001 | |
| Transfection kit | Clontech | 631318 | |
| Trypsin 0.25% EDTA | Life | 25200114 | |
| Tweezers | JD | N/A | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 20x objective NA 0.8 | Zeiss | 420650-9901 | Plan-Apochromat |
| Atomic force microscope | JPK | cellHesion200 | |
| Centrifuge | Beckman coulter | Allegra X-12R | |
| Fluorescence imaging | home-made objective-type total internal reflection fluorescence microscop based on a Zeiss microscope stand | ||
| Humidified CO2 incubator | Thermo Fisher | HERACELL 150i | |
| Inverted light microscope | Zeiss | Observer A1 manual |
Referanslar
- Benoit, M., Gabriel, D., Gerisch, G., Gaub, H. E. Discrete interactions in cell adhesion measured by single-molecule force spectroscopy. Nature Cell Biology. 2 (6), 313-317 (2000).
- Chen, J., et al. Strong adhesion by regulatory T cells induces dendritic cell cytoskeletal polarization and contact-dependent lethargy. Journal of Experimental Medicine. 214 (2), 327-338 (2017).
- Liu, L., et al. Mechanotransduction-modulated fibrotic microniches reveal the contribution of angiogenesis in liver fibrosis. Nature Materials. 16 (12), 1252-1261 (2017).
- Mu, L. B., et al. A phosphatidylinositol 4,5-bisphosphate redistribution-based sensing mechanism initiates a phagocytosis programing. Nature Communications. 9, (2018).
- Qi, C., et al. Pathology-targeted cell delivery via injectable micro-scaffold capsule mediated by endogenous TGase. Biomaterials. 126, 1-9 (2017).
- Muller, D. J., Helenius, J., Alsteens, D., Dufrene, Y. F. Force probing surfaces of living cells to molecular resolution. Nature Chemical Biology. 5 (6), 383-390 (2009).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy: a nanoscopic window on the cell surface. Trends in Cell Biology. 21 (8), 461-469 (2011).
- Radotic, K., et al. Atomic force microscopy stiffness tomography on living Arabidopsis thaliana cells reveals the mechanical properties of surface and deep cell-wall layers during growth. Biophysics Journal. 103 (3), 386-394 (2012).
- Kuznetsova, T. G., Starodubtseva, M. N., Yegorenkov, N. I., Chizhik, S. A., Zhdanov, R. I. Atomic force microscopy probing of cell elasticity. Micron. 38 (8), 824-833 (2007).
- Scheuring, S., Dufrene, Y. F. Atomic force microscopy: probing the spatial organization, interactions and elasticity of microbial cell envelopes at molecular resolution. Molecular Microbiology. 75 (6), 1327-1336 (2010).
- Berdyyeva, T. K., Woodworth, C. D., Sokolov, I. Human epithelial cells increase their rigidity with ageing in vitro: direct measurements. Physics in Medicine and Biology. 50 (1), 81-92 (2005).
- Sokolov, I., Dokukin, M. E., Guz, N. V. Method for quantitative measurements of the elastic modulus of biological cells in AFM indentation experiments. Methods. 60 (2), 202-213 (2013).
- Bozna, B. L., et al. Binding strength and dynamics of invariant natural killer cell T cell receptor/CD1d-glycosphingolipid interaction on living cells by single molecule force spectroscopy. Journal of Biological Chemistry. 286 (18), 15973-15979 (2011).
- Flach, T. L., et al. Alum interaction with dendritic cell membrane lipids is essential for its adjuvanticity. Nature Medicine. 17 (4), 479-487 (2011).
- Ng, G., et al. Receptor-independent, direct membrane binding leads to cell-surface lipid sorting and Syk kinase activation in dendritic cells. Immunity. 29 (5), 807-818 (2008).
- Helenius, J., Heisenberg, C. P., Gaub, H. E., Muller, D. J. Single-cell force spectroscopy. Journal of Cell Science. 121 (11), 1785-1791 (2008).
- Litvinov, R. I., Shuman, H., Bennett, J. S., Weisel, J. W. Binding strength and activation state of single fibrinogen-integrin pairs on living cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (11), 7426-7431 (2002).
- Evans, E., Ritchie, K., Merkel, R. Sensitive Force Technique to Probe Molecular Adhesion and Structural Linkages at Biological Interfaces. Biophysics Journal. 68 (6), 2580-2587 (1995).
- Lamprecht, C., Hinterdorfer, P., Ebner, A. Applications of biosensing atomic force microscopy in monitoring drug and nanoparticle delivery. Expert Opinion on Drug Delivery. 11 (8), 1237-1253 (2014).
- Charras, G. T., Horton, M. A. Single cell mechanotransduction and its modulation analyzed by atomic force microscope indentation. Biophysics Journal. 82 (6), 2970-2981 (2002).
- Sun, M. Z., et al. Multiple membrane tethers probed by atomic force microscopy. Biophysics Journal. 89 (6), 4320-4329 (2005).
- Yan, J. C., Liu, B., Shi, Y., Qi, H. Class II MHC-independent suppressive adhesion of dendritic cells by regulatory T cells in vivo. Journal of Experimental Medicine. 214 (2), 319-326 (2017).
- Hao, J. J., et al. Phospholipase C-mediated hydrolysis of PIP2 releases ERM proteins from lymphocyte membrane. Journal of Cell Biology. 184 (3), 451-462 (2009).
- Rodriguez, R. M., et al. Lymphocyte-T Adhesion to Fibronectin (Fn) - a Possible Mechanism for T-Cell Accumulation in the Rheumatoid Joint. Clinical and Experimental Immunology. 89 (3), 439-445 (1992).
- Kimura, A., Ersson, B. Activation of Lymphocytes-T by Lectins and Carbohydrate-Oxidizing Reagents Viewed as an Immunological Recognition of Cell-Surface Modifications Seen in the Context of Self Major Histocompatibility Complex Antigens. European Journal of Immunology. 11 (6), 475-483 (1981).
- Miller, K. The Stimulation of Human Lymphocyte-B and Lymphocyte-T by Various Lectins. Immunobiology. 165 (2), 132-146 (1983).
- Vitte, J., Pierres, A., Benoliel, A. M., Bongrand, P. Direct quantification of the modulation of interaction between cell- or surface-bound LFA-1 and ICAM-1. Journal of Leukocyte Biology. 76 (3), 594-602 (2004).
- Beaussart, A., et al. Quantifying the forces guiding microbial cell adhesion using single-cell force spectroscopy. Nature Protocols. 9 (5), 1049-1055 (2014).
- Shu, F., et al. Cholesterol Crystal-Mediated Inflammation Is Driven by Plasma Membrane Destabilization. Frontiers in Immunology. 9, (2018).
- Hosseini, B. H., et al. Immune synapse formation determines interaction forces between T cells and antigen-presenting cells measured by atomic force microscopy. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17852-17857 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır