需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
原子力显微镜罐体功能化,具有单T细胞或单粒子免疫单细胞力光谱
摘要
我们提出了一种协议,用单个T细胞和珠子粒子使原子力显微镜(AFM)的吊带功能化,用于免疫学研究。显示了通过AFM探测单对T细胞树突状细胞结合的过程,并监测宏噬细胞对单个固体颗粒的实时细胞响应,并采用荧光成像。
摘要
基于原子力显微镜的单细胞力光谱(AFM-SCFS)是研究活细胞生物物理特性的有力工具。这种技术允许在活细胞膜上探测相互作用强度和动力学,包括细胞、受体和配体之间的相互作用强度和动力学,以及许多其他变异。它还作为一种机制,以时空控制的方式在单个细胞上提供物理或生化刺激,从而在与活细胞结合时实时监控特定的细胞激活和随后的细胞事件荧光成像。这些 AFM-SCFS 测量的关键步骤是 AFM 悬臂功能化,换句话说,将感兴趣的主题附加到悬臂上。在这里,我们提出用单个T细胞和单个聚苯乙烯珠分别修改AFM吊杆的方法,用于免疫学研究。前者涉及一种生物相容性胶水,将单T细胞耦合到溶液中的扁平悬臂尖端,而后者则依靠环氧胶在空气环境中的单珠粘附。还提供了与每个悬臂修饰相关的两个免疫学应用。此处描述的方法可以很容易地适应不同的细胞类型和固体颗粒。
引言
原子力显微镜(AFM),一个多功能的工具,在细胞生物学研究1,2,3,4,5中已经发现许多应用。除了高分辨率成像能力外,原生力探测功能还允许活细胞的生物物理特性在单细胞6、7级直接就地研究。这些包括亚细胞结构,甚至整个细胞的刚性 8,9,10,11,12,特定的配体/受体结合强度细胞表面的单分子水平13,固体粒子和细胞的单对之间的附着力或两个细胞1、2、14、15之间的附着力。后两种通常被归类为单细胞力光谱(SCFS)16。由于各种弹簧常数的易得的悬臂,AFM 可访问的力范围相当广泛,从几皮克纽顿 (pN) 到微牛顿 (μN),这足以覆盖涉及几十个力的整个细胞事件范围pN,如基于受体的单分子结合,到nN,如噬菌体细胞事件15。这种较大的动态力范围使 AFM 优于其他力探测技术,如光学/磁性钳子和生物膜力探头,因为它们更适合弱力测量,其力通常小于 200 pN17,18.此外,AFM可以作为高精度操纵器,以临时定义的方式4,19向单个细胞提供各种刺激。这是理想的实时单细胞活化研究。结合活细胞荧光成像,可以同时监测随后细胞对特定刺激的反应,从而使基于AFM的SCFS作为光学成像极其强大,为探测细胞信号提供了实用的工具。例如,AFM用于确定在成骨菌20中引起钙瞬变所需的菌株。在这项工作中,在用AFM尖端在培养的成骨器上应用局部力后,通过钙比例成像对钙瞬变进行荧光跟踪。最近,AFM被用于拉伸胶原纤维,在胶原纤维上生长肝硬质细胞(HSC),这种经研究用的HSC活化由荧光Src生物传感器实时监测,其磷酸化代表生物传感器的荧光强度与HSC活化3相关。
在基于 AFM 的 SCFS 实验中,AFM 悬臂的正确功能化是成功测量的关键步骤。由于我们的研究兴趣集中在免疫细胞激活,我们经常功能与颗粒物质,如单个固体颗粒,可以触发噬菌体和/或强烈的免疫反应4,14,15和单个T细胞,可以形成免疫突触与抗原呈现细胞,如活化树突细胞(DC)2。单固体颗粒通常通过空气环境中的环氧胶与悬臂耦合,而单 T 细胞由于其非粘合性质,通过溶液中的生物相容性胶水功能化为悬臂。在这里,我们将描述执行这两种类型的悬臂修改的方法,并给出两个关联的应用程序。第一个应用是探测T细胞/直流与AFM-SCFS的相互作用,以便从细胞力学的角度理解调节T细胞的抑制机制。第二个涉及将AFM与活细胞荧光成像相结合,实时监测巨噬细胞对固体颗粒的细胞反应,揭示受体独立磷脂醇4,5-双磷酸(PIP2)的分子机制-莫辛调解了方位体。该协议的目的是为感兴趣的研究人员提供一个参考框架,以设计和实现自己的实验设置与基于AFM的单细胞分析的免疫学研究。
研究方案
小鼠实验方案遵循清华大学动物护理指南
1. 单T细胞的悬臂功能化
- 小鼠脾细胞制剂
- 牺牲小鼠(8-16周的年龄(两性);例如,C57BL/6菌株)使用二氧化碳,其次是宫颈脱位。
- 用75%乙醇清洁小鼠,进行中线皮肤切口,然后进行切除。
- 使用玻璃滑梯将含有 2% 胎儿牛血清 (FBS) 的 PBS 4 mL 中的脾脏均匀化,并通过 70 μm 网状尼龙滤网将细胞悬浮液排出骨质和碎屑。
- 将细胞悬浮在500 x g下悬浮5分钟,在2 mL红细胞解压缓冲液(在室温下平衡)中丢弃上清液并重新悬浮细胞5分钟。通过加入8 mL的PBS溶液终止赖舍反应。
- 将细胞悬浮在500 x g下5分钟,在含有2%FBS和1 mM EDTA(标记为溶液A)的PBS中,以1 x108细胞/mL的密度重新悬浮细胞,通常为0.25-2 mL,具体取决于细胞密度。将重新悬浮的电池转移到 5 mL(12 x 75 mm)聚苯乙烯圆形底管中。
- 小鼠CD4+T细胞制备
- 将50μL/mL大鼠血清(见材料表)和50μL/mL CD4+T细胞分离鸡尾酒(见材料表)添加到步骤1.1.5获得的细胞样本中。在室温下混合和孵育10分钟。
- 涡旋股票链球菌素涂层的磁性颗粒溶液(见材料表)30s或直到颗粒出现均匀分散。
- 在细胞样品中加入75 μL/mL链球菌素涂层磁性颗粒。在室温下混合和孵育2.5分钟。
- 添加解决方案 A,将细胞样品加到 2.5 mL,然后轻轻上下移液 2-3 次进行混合。
- 将样品管(无盖)放入磁铁(见材料表),在室温下孵育5分钟。小心地将浓缩细胞悬浮液倒入新的5 mL聚苯乙烯圆底管中。
- 将细胞悬浮液在500 x g下离心5分钟,丢弃上清液,在溶液A的500μL中重新悬浮富集的T细胞。
注:浓缩的CD4+T细胞同时包含常规和调节性T细胞。
- 调节性T细胞从传统T细胞分离
- 将25μL的FcR阻滞剂(见材料表)添加到从步骤1.2.6中获得的浓缩T细胞样本中。在室温下混合和孵育5分钟。
- 在T细胞样品中加入25μL的调节性T细胞阳性选择鸡尾酒(见材料表)。在室温下混合和孵育10分钟。
- 在 T 细胞样品中加入 10 μL 的 PE 选择鸡尾酒(参见材料表)。在室温下混合和孵育5分钟。
- 涡旋库存dextran涂层的磁粒子溶液(见材料表)30s或直到颗粒出现均匀分散。
- 在 T 细胞样品中加入 10 μL 的 dextran 涂层磁性颗粒。在室温下混合和孵育5分钟。
- 添加溶液 A 将 T 细胞样品加到 2.5 mL,然后轻轻上下移液 2-3 次混合。
- 将 T 细胞样品管(无盖)放入磁铁中,在室温下孵育 5 分钟。小心地将上清液倒入新管中。
注:上清液含有丰富的常规CD4+T细胞。 - 在500 x g下将浓缩的常规CD4+T细胞离心5分钟。丢弃上清液,在含有10%FBS、0.05 mM β-Mercaptoto乙醇、0.01 M HEPES和1%青霉素/链霉素(标记为中B)的4mL中重新悬浮细胞。
- 从磁铁中取出调节性T细胞的管子。将 2.5 mL 溶液 A 添加到管中,然后轻轻上下移液 2-3 次进行混合。将管子放回磁铁中,孵育5分钟,然后小心地倒出并丢弃上清液。重复此步骤三次。
- 在2mL的中B中重新悬浮富集的调节T细胞。
- 在加湿培养箱中,在加湿孵化器中,用100 U/mL hIL-2在37°C下孵化100U/mL hIL-2,在5%CO2的加湿培养箱中孵化100U/mL hIL-2,然后用于悬臂功能化。
- 丹德霉素细胞制剂
- 准备食人鱼溶液,30% H2O2 (30%)和 70% H2SO4 (conc) (v/v)。在不断搅拌和冷却的情况下,缓慢地将 3 mL 的 H2O2倒入 7 mL 的 H2SO4。
注意:Piranha溶液具有很强的腐蚀性,它可以燃烧和破坏身体组织。因此,在引擎盖下使用食人鱼溶液并佩戴适当的安全设备更安全,因为混合物会溅到烧杯周围。使用后,使用 NaOH 将溶液中和至 pH 7。 - 将直径为 24 mm 的玻璃盖玻片浸入食人鱼溶液中 30 分钟,然后用无菌超纯水彻底冲洗。
- 将一对尖钳浸入 75% 乙醇中 30 分钟,进行冷消毒。
- 将清洁的玻璃盖板引入 6 孔培养板中。
- 倾斜6厘米的塑料培养皿,其中DC2.4细胞预培养4mL的中B和吸出所有介质。将 2 mL 的 PBS 加入培养皿中,以冲洗 DC2.4 细胞并丢弃 PBS。重复此击球步骤两次。
- 在培养盘中加入1 mL 0.25%胰蛋白酶EDTA2分钟,向该菜中加入1 mL的中B,以结束酶消化反应。将消化的细胞悬浮液转移到15 mL管中。
- 将细胞悬浮液在500 x g下离心5分钟,在B中,以2 x 105细胞/mL的密度重新悬浮DC2.4细胞。
- 在步骤1.4.4中制备的玻璃盖玻片上的种子DC2.4细胞,在37°C的加湿室中孵育细胞过夜,CO2为5%。
注:为了测量两个单细胞之间的相互作用力,需要相对较低的DC2.4细胞浓度(即<10%汇合)才能在细胞之间产生适当的间距。
- 准备食人鱼溶液,30% H2O2 (30%)和 70% H2SO4 (conc) (v/v)。在不断搅拌和冷却的情况下,缓慢地将 3 mL 的 H2O2倒入 7 mL 的 H2SO4。
- AFM 悬臂准备
注: 适合单细胞力光谱实验的罐体是具有低弹簧常数的罐体,通常在 0.01-0.06 N/m 的范围内。在这里,软无尖端的吊杆是单细胞和单固体粒子功能化的首选。- 通过皮兰哈处理或等离子或紫外线臭氧清洁清洁吊臂。
- 将清洁的悬臂安装到 AFM 扫描头。
- 准备一个干净的样品室,填充纯水,并校准水溶液中的悬臂,首先在玻璃基板上运行力曲线,以获得灵敏度(线性配合在接近曲线的排斥部分的斜率),然后根据 AFM 的指令手册记录热噪声频谱以提取弹簧常数。
- 从溶液中取出 AFM 扫描头,用几滴纯乙醇清洗安装的悬臂,并保持悬臂在扫描头上干燥。
- 将单个 T 单元连接到悬臂
- 在 37°C 下用 5% CO2预热活细胞环境外壳。
- 将玻璃盖玻片与从步骤 1.4.8 到样品室组件的 DC2.4 细胞一起安装,立即向造型室中加入 600 μL 的中 B,然后将组件置于 AFM 样品级。
- 将hIL-2孵育的CD4+T细胞(常规或调节性T细胞)加入样品室。
注:总样本量不应超过 1 mL。 - 等待,直到添加的CD4+T单元完全稳定在盖玻片的底部。
注:气泡会对实验造成极大的干扰,因此,建议避免步骤1.6.2和1.6.3中的任何气泡。 - 将 2 μL 的生物相容性胶水滴在安装的悬臂末端,如图1所示,然后快速将扫描头放在样品台上,从而使涂有生物相容性胶的悬臂浸入解决 方案。
注意:请勿用移液器尖端触摸玻璃块或悬臂。由于此处使用的生物相容性胶水容易在空气中氧化,因此应尽快执行此步骤。 - 通过移动样品阶段,在显微镜下粗糙地找到悬臂尖端下方的健康 T 细胞,然后通过移动扫描头来微调定位。
注:健康的CD4+T电池在明场成像中通常具有相对较大的尺寸、平滑的边缘和光学透射性。 - 通过控制步进电机,将悬臂尺寸从 50 μm 开始,然后逐渐降至 10、5、2 和 0.5 μm。保持步进电机的位置,并调整扫描头的位置,以便悬臂尖端和电池更好地对齐,一旦悬臂与目标 T 单元牢固接触,如激光束的小位移所示在光电探测器中的位置,对应于 0.5-1.5 nN 的典型力范围。
注: 此步骤还可以通过运行单个力测量来完成,其中设定点(施加在单元上的力)和接触时间可以在软件中定义。然而,由于T细胞的非粘合特性,手动方法在控制瞄准、定位和接触时间方面比自动接近更灵活,并且对T细胞粘附可靠。未来的实验者应该尝试手动和自动接近,找出哪种更好的工作,他们感兴趣的系统。 - 接触 30 小时后,收回悬臂。
注: 如果单元格随悬臂一起移动,则附件成功。如果没有,请重复步骤 1.6.6,但重复不同的 T 单元格。生物相容性胶水易于氧化。步骤 1.6.5-1.6.7 应在 5 分钟内完成。此外,如果 T 细胞附件的同一悬臂失败三次,则应使用新的悬臂,并且附件过程应再次从步骤 1.5.2 开始。
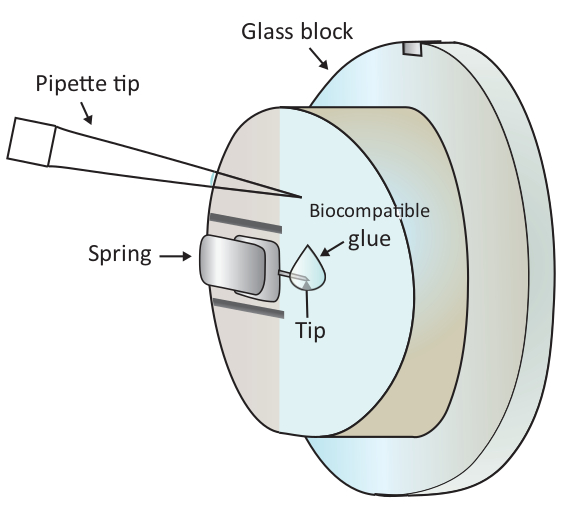
图1:在安装的悬臂上添加一小滴生物相容性胶水的原理表示。悬臂通过安装在 AFM 扫描头上的玻璃块支架上的夹紧弹簧安装(此处未绘制)。当扫描头站在平平表面上时,悬臂垂直方向,如图形所示。约2 μL生物相容性胶水可加入悬臂尖端与微移液器。请点击此处查看此图的较大版本。
- 单对T细胞/树突状细胞相互作用的力谱
注:要探测细胞/细胞相互作用,需要Z范围大于常规10-15μm的AFM才能完全分离两个细胞。此处使用的 AFM 的 Z 范围为 100 μm,足以在细胞/细胞接触后将 T 细胞与树突状细胞分离。- 通过移动样品级和/或扫描头,将附加的T单元置于单独的DC2.4单元上方(见图2)。
- 设置正确的参数并运行力谱。
注: 通常使用以下键设置:设定点 0.5 nN、拉距 50 μm、Z 移动恒定速度、延长速度 5 μm/s、接触时间 10 s、延迟模式恒定力。对于每个 T-DC 对,收集 20 次力曲线重复,并至少使用 14 个力曲线进行进一步分析。 - 如步骤 1.5.3 所示,安装新的清洁悬臂,在纯净水中校准,然后返回相同的 T-DC 电池样本,以重复步骤 1.6 和 1.7,用于不同的 T-DC 对。针对每个条件,至少探测 5 对。
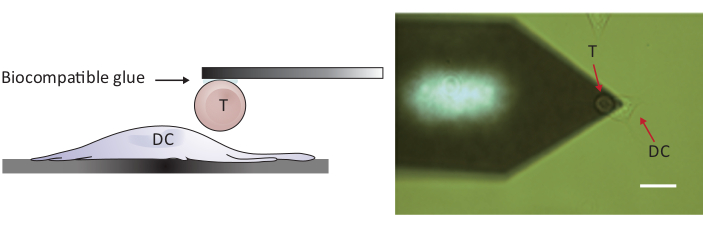
图2:单个T单元和直流之间力探测的实验配置。(A) 实验结构的原理图,其中附着在悬臂上的T细胞被带到基板上生长的直流,以进行力探测。(B) T细胞功能化悬臂和直流的明亮场图像。比例尺,20 μm。请点击此处查看此图的较大版本。
2. 单聚苯乙烯珠的悬臂功能化
- 单珠制备
- 在100%乙醇中稀释6μm聚苯乙烯珠子的库存悬浮量。
注:稀释珠溶液的浓度应足够低,因此当添加到玻璃盖玻片表面时,单个珠子在溶剂蒸发后不会显著聚类。 - 用乙醇清洁直径为 24 mm 的玻璃盖玻片,并通过 N2气流清除灰尘。
- 将清洁的玻璃盖玻片安装到样品室组件上,并将组件放在显微镜上。
- 将一滴稀释的珠溶液放在左侧,但靠近盖玻片的中心(见图3),并在显微镜下以20倍的物镜在明亮的磁场中检查溶剂蒸发后珠子之间的间距。如果单个珠子分离良好,请继续执行下一步。
- 将微移液器尖端或牙签浸入混合良好的环氧胶中,然后将少量此类胶水转移到三个单独的点,在右侧连续轻轻触摸,但靠近盖玻片的中心。
注:三个胶点应垂直对齐(见图3 )。最后一个胶水量最少的点将在稍后使用。
- 在100%乙醇中稀释6μm聚苯乙烯珠子的库存悬浮量。
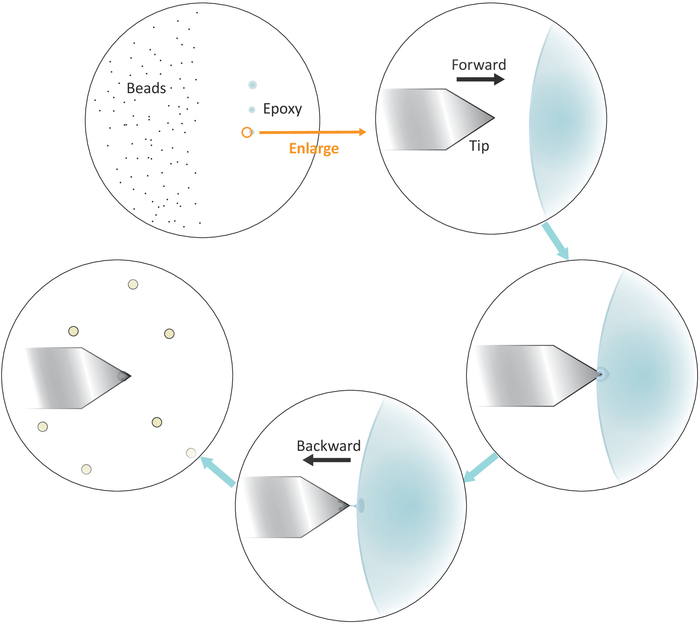
图 3:悬臂上单珠功能化的工作流程的原理表。基材左侧制备了分离良好的微米大小的珠子,通过3次连续的温和接触将少量环氧胶转移到基材的右侧,从而产生3个胶斑。只有胶水含量最少的最后一点(用圆圈表示)才用来涂覆悬臂的末端。从左侧接近悬臂进入胶水,一旦悬臂浸入胶水中,将悬臂向后移动,将胶水限制在悬臂的末端。将目标珠子放在悬臂下方,并在与粘附的牢固接触(通常为 2-5 nN)进行牢固接触之前将其正确对齐。当挂靠子成功功能化时,可以安装新的悬臂以启动新的功能化周期。请点击此处查看此图的较大版本。
- AFM 悬臂准备
- 将清洁的无尖端悬臂安装到 AFM 扫描头。
- 用干净的表面校准空气中的悬臂,以获得弹簧常数。
- 将单珠子连接到悬臂
- 将悬臂尖端置于最后一个环氧胶点左边界上,如图 3所示。
- 通过降低步进电机,使悬臂慢慢靠近胶水。
- 一旦尖端浸入胶水中,手动向后移动 AFM 扫描头,横向快速将悬臂从胶水中拉出。
注:确保只有少量的胶水粘附在尖端的末端。如果尖端上胶水过多,可以通过触摸后在空表面上滑动吸头来减少胶水量。 - 将悬臂尖端移到隔离良好的单珠子顶部。
- 缓慢地接近悬臂到单珠,并与珠子进行牢固接触(如照相中照相照的激光束位置与典型力范围为 2-5 nN 相对应)约 10 s,在此期间,t 的微调ip 横向定位将有助于更好地定位尖端末端的珠子。缩回触点末端的尖端。
注: 珠子从原始焦点平面消失表示一个成功的附着事件。 - 小心地拆卸珠子修改的悬臂,并将其存放在悬臂盒中过夜,以便完全凝固胶水。
- 宏噬细胞对AFM提供的单个珠子的细胞反应的荧光成像。
注:荧光成像是在基于商业显微镜支架的自制物位型全内反射荧光显微镜上进行的。该成像系统配有 4 个激光源(405 nm、488 nm、561 nm、647 nm),一个用于双色检测的分体查看器和用于广域成像的电子倍增电荷耦合器件 (EMCCD)。- 在 5% CO2加湿室中,在 37°C 的玻璃盖玻片上生长 RAW264.7 细胞。
- 根据制造商的方案,根据制造商的方案,将Moesin-EGFP和PLC+-PH-mCherry转染至RAW264.7细胞(见材料表),以荧光方式可视化莫辛和磷脂基诺西醇4,5-双磷酸(PIP2)分子分别。
注:Moesin有一个ITAM图案,可以激活Syk,一个关键的细胞化球员。众所周知,PIP2会招募莫辛到细胞膜。 - 将带电池的玻璃盖玻片放在样品室组件上,并将组件安装到 AFM 样品级上。
- 将珠子修改的悬臂安装到 AFM 扫描头。
- 在空区域中运行力曲线,并使用此曲线的灵敏度和步骤 2.2.2 中测量的弹簧常数校准力。
- 在具有 488/561 nm 激发的绿色 (Moesin-EGFP) 和红色 (PLC+-PH-mCherry) 通道中查找具有适当荧光强度的隔离型电池。
- 以 1 nN 恒定力和 500 s 接触时间将带 AFM 的裸 6 μm 聚苯乙烯珠送到细胞表面。
- 记录与珠子接触的细胞的荧光图像系列进行分析(通常为 10 帧/秒)。
注:为了减少荧光团的光漂白,应使用相对较低的激发能力来搜索感兴趣的细胞。此外,如果细胞反应的动态在缓慢的时间尺度上,可以使用间歇性激励方案来延长荧光时间轨迹。
结果
图 4A显示了单 T 单元和单 DC 之间在一个接近缩回周期中结合交互的典型力距离曲线。浅红色曲线是延伸曲线,深红色曲线为回缩曲线。由于延伸曲线通常用于缩进或刚度分析,因此这里只涉及缩进曲线, 与细胞粘附有关。曲线中的最小值(绿色圆圈)表示最大附着力的度量。曲线下的区域(带沙区)表示将 T 单元与 DC 分离所需的工作(能量)。在完全分离之前,...
讨论
基于AFM的单细胞力光谱已经演变为解决活细胞生物物理特性的有力工具。对于这些应用,悬臂需要正确工作,以便探测感兴趣的单元上的特定交互或属性。分别介绍了单T单元和单微米尺寸珠与无尖悬臂耦合的方法。为了将单个T细胞附着在悬臂上,选择生物相容性胶水作为细胞粘合剂。它是一种从海洋贝类中提取的特制蛋白质溶液。其粘附性源于多酚残留物,其羟基基组可与以非特异性方式在细胞表面?...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国家自然科学基金总体计划(31370878)、国家重点计划(31630023)和创新研究组计划(81621002)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Material | |||
| 10 μl pipette tip | Thermo Fisher | 104-Q | |
| 15 ml tube | Corning | 430791 | |
| 6 cm diameter culture dish | NALGENE nunc | 150462 | |
| 6-well culture plate | JET | TCP011006 | |
| AFM Cantilever | NanoWorld | Arrow-TL1-50 | tipless cantilever |
| β-Mercaptoethanol | Sigma | 7604 | |
| Biocompatible glue | BD Cell-Tak | 354240 | |
| CD4+ T cell isolation Cocktail | STEMCELL | 19852C.1 | |
| DC2.4 cell line | A gift from K. Rock (University of Massachusetts Medical School, Worcester, MA) | ||
| Dextran-coated magnetic particles | STEMCELL | SV30010 | |
| EDTA | GENEray | Generay-E1101-500 ml | |
| Epoxy | ERGO | 7100 | |
| Ethanol | twbio | 00019 | |
| FBS | Ex Cell Bio | FSP500 | |
| FcR blocker | STEMCELL | 18731 | |
| Glass coverslip | local vender (Hai Men Lian Sheng) | HX-E37 | 24mm diameter, 0.17mm thinckness |
| Glass slides | JinTong department of laboratory and equipment management, Haimen | N/A | customized |
| H2O2 (30%) | Sino pharm | 10011218 | |
| H2SO4 | Sino pharm | 80120892 | |
| HEPES | Sigma | 51558 | |
| Magnet | STEMCELL | 18000 | |
| Mesh nylon strainer | BD Falcon | REF 352350 | |
| Moesin-EGFP | N/A | cloned in laboratory | |
| Mouse CD25 Treg cell positive isolation kit | STEMCELL | 18782 | Component: FcR Blocker,Regulatory T cell Positive Selection Cocktail, PE Selection Cocktail, Dextran RapidSpheres, |
| Mouse CD4+ Tcell isolation kit | STEMCELL | 19852 | Component:CD4+T cell isolation Cocktail, Streptavidin RapidSpheres, Rat Serum |
| NaOH | Lanyi chemical products co., LTD? Beijing | 1310-73-2 | |
| PBS | Solarbio | P1022-500 | |
| PE selection cocktail | STEMCELL | 18151 | |
| Penicillin-Streptomycin | Hyclone | SV30010 | |
| PLCδ-PH-mCherry | Addgene | 36075 | |
| Polystyrene microspheres 6.0μm | Polysciences | 07312-5 | |
| polystyrene round bottom tube | BD Falcon | 352054 | |
| Rat serum | STEMCELL | 13551 | |
| RAW264.7 | ATCC | ||
| Recombinant Human Interleukin-2 | Peprotech | Peprotech, 200-02-1000 | |
| Red blood cell lysis buffer | Beyotime | C3702 | |
| Regulatory T cell positive selection cocktail | STEMCELL | 18782C | |
| RPMI 1640 | Life | C11875500BT | |
| Sample chamber | Home made | ||
| Streptavidin-coated magnetic particles | STEMCELL | 50001 | |
| Transfection kit | Clontech | 631318 | |
| Trypsin 0.25% EDTA | Life | 25200114 | |
| Tweezers | JD | N/A | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 20x objective NA 0.8 | Zeiss | 420650-9901 | Plan-Apochromat |
| Atomic force microscope | JPK | cellHesion200 | |
| Centrifuge | Beckman coulter | Allegra X-12R | |
| Fluorescence imaging | home-made objective-type total internal reflection fluorescence microscop based on a Zeiss microscope stand | ||
| Humidified CO2 incubator | Thermo Fisher | HERACELL 150i | |
| Inverted light microscope | Zeiss | Observer A1 manual |
参考文献
- Benoit, M., Gabriel, D., Gerisch, G., Gaub, H. E. Discrete interactions in cell adhesion measured by single-molecule force spectroscopy. Nature Cell Biology. 2 (6), 313-317 (2000).
- Chen, J., et al. Strong adhesion by regulatory T cells induces dendritic cell cytoskeletal polarization and contact-dependent lethargy. Journal of Experimental Medicine. 214 (2), 327-338 (2017).
- Liu, L., et al. Mechanotransduction-modulated fibrotic microniches reveal the contribution of angiogenesis in liver fibrosis. Nature Materials. 16 (12), 1252-1261 (2017).
- Mu, L. B., et al. A phosphatidylinositol 4,5-bisphosphate redistribution-based sensing mechanism initiates a phagocytosis programing. Nature Communications. 9, (2018).
- Qi, C., et al. Pathology-targeted cell delivery via injectable micro-scaffold capsule mediated by endogenous TGase. Biomaterials. 126, 1-9 (2017).
- Muller, D. J., Helenius, J., Alsteens, D., Dufrene, Y. F. Force probing surfaces of living cells to molecular resolution. Nature Chemical Biology. 5 (6), 383-390 (2009).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy: a nanoscopic window on the cell surface. Trends in Cell Biology. 21 (8), 461-469 (2011).
- Radotic, K., et al. Atomic force microscopy stiffness tomography on living Arabidopsis thaliana cells reveals the mechanical properties of surface and deep cell-wall layers during growth. Biophysics Journal. 103 (3), 386-394 (2012).
- Kuznetsova, T. G., Starodubtseva, M. N., Yegorenkov, N. I., Chizhik, S. A., Zhdanov, R. I. Atomic force microscopy probing of cell elasticity. Micron. 38 (8), 824-833 (2007).
- Scheuring, S., Dufrene, Y. F. Atomic force microscopy: probing the spatial organization, interactions and elasticity of microbial cell envelopes at molecular resolution. Molecular Microbiology. 75 (6), 1327-1336 (2010).
- Berdyyeva, T. K., Woodworth, C. D., Sokolov, I. Human epithelial cells increase their rigidity with ageing in vitro: direct measurements. Physics in Medicine and Biology. 50 (1), 81-92 (2005).
- Sokolov, I., Dokukin, M. E., Guz, N. V. Method for quantitative measurements of the elastic modulus of biological cells in AFM indentation experiments. Methods. 60 (2), 202-213 (2013).
- Bozna, B. L., et al. Binding strength and dynamics of invariant natural killer cell T cell receptor/CD1d-glycosphingolipid interaction on living cells by single molecule force spectroscopy. Journal of Biological Chemistry. 286 (18), 15973-15979 (2011).
- Flach, T. L., et al. Alum interaction with dendritic cell membrane lipids is essential for its adjuvanticity. Nature Medicine. 17 (4), 479-487 (2011).
- Ng, G., et al. Receptor-independent, direct membrane binding leads to cell-surface lipid sorting and Syk kinase activation in dendritic cells. Immunity. 29 (5), 807-818 (2008).
- Helenius, J., Heisenberg, C. P., Gaub, H. E., Muller, D. J. Single-cell force spectroscopy. Journal of Cell Science. 121 (11), 1785-1791 (2008).
- Litvinov, R. I., Shuman, H., Bennett, J. S., Weisel, J. W. Binding strength and activation state of single fibrinogen-integrin pairs on living cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (11), 7426-7431 (2002).
- Evans, E., Ritchie, K., Merkel, R. Sensitive Force Technique to Probe Molecular Adhesion and Structural Linkages at Biological Interfaces. Biophysics Journal. 68 (6), 2580-2587 (1995).
- Lamprecht, C., Hinterdorfer, P., Ebner, A. Applications of biosensing atomic force microscopy in monitoring drug and nanoparticle delivery. Expert Opinion on Drug Delivery. 11 (8), 1237-1253 (2014).
- Charras, G. T., Horton, M. A. Single cell mechanotransduction and its modulation analyzed by atomic force microscope indentation. Biophysics Journal. 82 (6), 2970-2981 (2002).
- Sun, M. Z., et al. Multiple membrane tethers probed by atomic force microscopy. Biophysics Journal. 89 (6), 4320-4329 (2005).
- Yan, J. C., Liu, B., Shi, Y., Qi, H. Class II MHC-independent suppressive adhesion of dendritic cells by regulatory T cells in vivo. Journal of Experimental Medicine. 214 (2), 319-326 (2017).
- Hao, J. J., et al. Phospholipase C-mediated hydrolysis of PIP2 releases ERM proteins from lymphocyte membrane. Journal of Cell Biology. 184 (3), 451-462 (2009).
- Rodriguez, R. M., et al. Lymphocyte-T Adhesion to Fibronectin (Fn) - a Possible Mechanism for T-Cell Accumulation in the Rheumatoid Joint. Clinical and Experimental Immunology. 89 (3), 439-445 (1992).
- Kimura, A., Ersson, B. Activation of Lymphocytes-T by Lectins and Carbohydrate-Oxidizing Reagents Viewed as an Immunological Recognition of Cell-Surface Modifications Seen in the Context of Self Major Histocompatibility Complex Antigens. European Journal of Immunology. 11 (6), 475-483 (1981).
- Miller, K. The Stimulation of Human Lymphocyte-B and Lymphocyte-T by Various Lectins. Immunobiology. 165 (2), 132-146 (1983).
- Vitte, J., Pierres, A., Benoliel, A. M., Bongrand, P. Direct quantification of the modulation of interaction between cell- or surface-bound LFA-1 and ICAM-1. Journal of Leukocyte Biology. 76 (3), 594-602 (2004).
- Beaussart, A., et al. Quantifying the forces guiding microbial cell adhesion using single-cell force spectroscopy. Nature Protocols. 9 (5), 1049-1055 (2014).
- Shu, F., et al. Cholesterol Crystal-Mediated Inflammation Is Driven by Plasma Membrane Destabilization. Frontiers in Immunology. 9, (2018).
- Hosseini, B. H., et al. Immune synapse formation determines interaction forces between T cells and antigen-presenting cells measured by atomic force microscopy. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17852-17857 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。