JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
단일 T 세포또는 면역 학적 단세포 힘 분광학을 위한 단입자를 가진 원자력 현미경 캔틸레버의 기능화
요약
우리는 면역학적 연구를 위한 단 하나 T 세포 및 비드 입자를 가진 원자력 현미경 (AFM) 캔틸레버를 기능화하는 프로토콜을 제시합니다. AFM에 의해 단일 쌍 T 세포 수지상 세포 결합을 조사하고 형광 이미징을 통해 AFM에 의해 단일 고체 입자에 대한 대식세포의 실시간 세포 반응을 모니터링하는 절차가 도시된다.
초록
원자력 현미경 검사법 기반 단일 세포 힘 분광법 (AFM-SCFS)은 살아있는 세포의 생물 물리학적 특성을 연구하기위한 강력한 도구입니다. 이 기술은 세포, 수용체 및 리간드 사이, 그리고 많은 그밖 변이와 더불어 그(것)들을 포함하여 살아있는 세포막에 상호 작용 힘 그리고 역학을 탐구하는 것을 허용합니다. 그것은 또한 spatiotemporally 통제된 방식으로 단 하나 세포에 물리적 또는 생화확적인 자극을 전달하는 기계장치로 작동합니다, 따라서 살아있는 세포와 결합될 때 특정 세포 활성화 및 후속 세포 사건을 실시간으로 감시될 수 있게 합니다 형광 이미징. 이러한 AFM-SCFS 측정의 핵심 단계는 AFM-캔틸레버 기능화 또는 즉, 관심 있는 주제를 캔틸레버에 부착하는 것입니다. 여기에서, 우리는 면역학 연구를 위한 단 하나 T 세포 및 단 하나 폴리스티렌 비드를 각각 가진 AFM 캔틸레버를 수정하는 방법을 제시합니다. 전자는 단일 T 세포를 용액의 평평한 캔틸레버 끝에 결합하는 생체 적합성 접착제를 포함하고, 후자는 공기 환경에서 단일 비드 접착을 위해 에폭시 접착제에 의존합니다. 각 캔틸레버 수정과 관련된 두 가지 면역 학적 응용 분야도 제공됩니다. 여기서 설명한 방법은 다양한 세포 유형 및 고체 입자에 쉽게 적응할 수 있습니다.
서문
원자력 현미경 검사법 (AFM), 다재 다능한 도구는세포 생물학 연구 1, 2,3,4,5에서많은 응용 프로그램을 발견했습니다. 고해상도 이미징 기능 외에도, 네이티브 포스 프로빙 기능은 살아있는 세포의 생물 물리학적 특성을 단일 세포 수준6,7에서현장에서 직접 조사 할 수 있게합니다. 이들은 세포내 세포 구조 또는 전체 세포 8,9,10,11,12,특정 리간드/수용체 결합 강도의 강성을 포함합니다. 세포 표면(13)에대한 단일 분자 수준, 고체 입자와 세포의 단일 쌍 또는 두 세포 사이 또는 1,2,14,15사이의 접착력. 후자의 두 가지는 종종 단세포 힘 분광법 (SCFS)16으로분류됩니다. 다양한 스프링 상수와 쉽게 사용할 수있는 캔틸레버로 인해 AFM에 액세스 할 수있는 힘 범위는 몇 피코 뉴턴 (pN)에서 마이크로 뉴턴 (μN)까지 다소 광범위하며, 이는 수십 개의 힘을 포함하는 세포 이벤트의 전체 범위를 적절하게 커버합니다. pN의, 예컨대 수용체 계 단일 분자 결합, nN, 예컨대 식세포이벤트(15). 이 큰 동적 힘 범위는 AFM을 광학/자기 핀셋 및 생체 막 힘 프로브와 같은 다른 힘 프로빙 기술에 비해 유리하게 만들며, 일반적으로 200 pN17 미만의 힘으로 약한 힘 측정에 더 적합합니다. , 18. 또한, AFM은 spatiotempoy 정의 된 방식으로 단일 세포에 다양한 자극을 전달하는 고정밀 조작기로서 기능 할 수있다4,19. 이는 실시간 단세포 활성화 연구에 바람직하다. 살아있는 세포 형광 화상 진찰과 결합된, 특정 자극에 대한 후속 세포 반응은 동시에 감시될 수 있습니다, 따라서 AFM 기지를 둔 SCFS는 세포 신호를 탐사하는 실용적인 공구를 제공하는 광학 화상 진찰로 대단히 견고하게 만듭니다. 예를 들면, AFM은 조골 세포20에있는 칼슘 과도를 이끌어 내는 것을 요구되는 긴장을 결정하기 위하여 이용되었습니다. 이 작품에서, 칼슘 과도는 AFM 팁으로 배양 된 조골 세포에 국한 된 힘을 적용 한 후 칼슘 비율 측정 이미징을 통해 형광으로 추적되었습니다. 최근, AFM은 간 성세포(HSC)가 성장한 콜라겐 섬유를 스트레칭하는 데 사용되었으며, 이러한 메카노-트랜스듀싱 HSC 활성화는 형광 Src 바이오센서에 의해 실시간 모니터링되었으며, 그 인산화는 바이오 센서의 형광 강도는 HSC 활성화3과상관관계가 있습니다.
AFM 기반 SCFS 실험에서 AFM 캔틸레버의 적절한 기능화는 성공적인 측정을 향한 핵심 단계입니다. 우리의 연구 관심은 면역 세포 활성화에 초점을 맞추고 있기 때문에, 우리는 일상적으로 식세포증 및 / 또는 강한 면역 반응을 유발할 수있는단일 고체 입자와 같은 미립자 물질로 캔틸레버를 기능화4,14 , 15 및 활성 수지상 세포(DC)와 같은 항원 제시 세포로 면역 시냅스를형성할 수 있는 단일 T 세포 2. 단일 고체 입자는 일반적으로 공기 환경에서 에폭시 접착제를 통해 캔틸레버에 결합되는 반면, 단일 T 세포는 비 접착 성질로 인해 용액의 생체 적합성 접착제를 통해 캔틸레버로 기능화됩니다. 여기서는 이러한 두 가지 유형의 캔틸레버 수정을 수행하고 두 개의 관련 응용 프로그램을 제공하는 방법에 대해 설명합니다. 첫번째 응용은 세포 역학 관점에서 규정하는 T 세포의 억제 기계장치를 이해하기 위하여 AFM-SCFS를 가진 T 세포/DC 상호 작용을 탐구하는 것입니다. 두 번째는 수용체 독립적 인 포스 파티딜리노시톨 4,5-비스포스페이트 (PIP2)의 분자 메커니즘을 밝히기 위해 실시간으로 고체 입자에 대한 대식세포의 세포 반응을 모니터링하기 위해 살아있는 세포 형광 이미징과 AFM을 결합하는 것을 포함합니다. 모에신은 식세포증을 매개했다. 이 프로토콜의 목적은 면역 학적 연구를위한 AFM 기반 단일 세포 분석을 통해 자신의 실험 설정을 설계하고 구현하기 위해 관심있는 연구자들이 참조 프레임 워크를 제공하는 것입니다.
프로토콜
마우스 실험 프로토콜은 칭화대학의 동물 관리 지침을 따릅니다.
1. 단일 T 셀로 캔틸레버 기능화
- 마우스 비장 세포 준비
- 마우스를 희생 (나이의 8-16 주 (어느 섹스); 예를 들어, C57BL/6 변형) 이산화탄소를 사용 하 여, 자궁 경 부 탈구 다음.
- 75% 에탄올로 마우스를 청소하고 비장 절제술 에 이어 중간 선 피부 절개를합니다.
- 유리 슬라이드를 사용하여 2% 태아 소 혈청(FBS)을 함유하는 PBS의 4 mL에서 비장을 균질화하고 70 μm 메쉬 나일론 스트레이너를 통해 세포 현탁액을 통과시킴으로써 응집체 및 이물질을 제거한다.
- 세포 현탁액을 5분 동안 500 x g에서 원심분리하고, 상복부 세포를 폐기하고, 적혈구 용해 완충액 2 mL(실온에서 균형)에서 5분 동안 재중단한다.
- 세포 현탁액을 5분 동안 500 x g에서 원심분리하고 2% FBS 및 1 mM EDTA(솔루션 A로 표시됨)를 포함하는 PBS에서 1 x 108 셀/mL의 밀도로 세포를 재중단시키고, 전형적으로 세포 밀도에 따라 0.25-2 mL. 재부유 된 세포를 5 mL (12 x 75 mm) 폴리스티렌 라운드 바닥 튜브로 옮니다.
- 마우스 CD4+ T 세포 제제
- 50 μL/mL 래트 세럼(재료 표참조) 및 50 μL/mL CD4+ T 세포 분리 칵테일(재료 표참조)을 1.1.5단계에서 얻은 세포 샘플에 추가합니다. 실온에서 10분 동안 혼합하고 배양합니다.
- 30s 또는 입자가 고르게 분산 나타날 때까지 스톡 스트렙타비딘 코팅 된 자기 입자 용액 (재료 표참조)을 소용돌이.
- 셀 샘플에 75 μL/mL 스트렙타비딘 코팅 된 자기 입자를 추가합니다. 실온에서 2.5분 동안 혼합하고 배양합니다.
- 용액 A를 추가하여 셀 샘플을 2.5 mL로 위로 올려 놓고 2-3 회 위아래로 부드럽게 파이펫팅하여 섞습니다.
- 샘플 튜브(뚜껑 없이)를 자석에 넣고(재료 표참조) 실온에서 5분 동안 배양합니다. 농축 된 셀 서스펜션을 새로운 5 mL 폴리스티렌 라운드 바닥 튜브에 조심스럽게 붓습니다.
- 500 x g에서 5분 동안 세포 현탁액을 원심분리. 상급체를 버리고 용액 A의 500 μL에서 농축된 T 세포를 다시 중단한다.
참고: 농축된 CD4+ T 세포는 기존의 T 세포와 조절T 세포를 모두 함유하고 있다.
- 기존 T 세포로부터 의 규제 T 세포 분리
- 1.2.6단계에서 얻은 농축 된 T 세포 샘플에 FcR 차단제 25 μL (재료 표참조)을 추가하십시오. 실온에서 5분 동안 혼합하고 배양합니다.
- T 세포 샘플에 25 μL의 조절 T 세포 양성 선택 칵테일(재료 표참조)을 추가합니다. 실온에서 10분 동안 혼합하고 배양합니다.
- T 세포 샘플에 PE 선택 칵테일 10 μL(재료 표참조)을 추가합니다. 실온에서 5분 동안 혼합하고 배양합니다.
- 30초 동안 또는 입자가 고르게 분산될 때까지 스톡 덱스란 코팅 된 자기 입자 용액 (재료 표참조)을 소용돌이.
- T 세포 샘플에 덱스트렌 코팅 된 자기 입자 10 μL을 추가합니다. 실온에서 5분 동안 혼합하고 배양합니다.
- 용액 A를 추가하여 T 세포 샘플을 2.5 mL까지 위로 올려 놓고 2-3회 위아래로 부드럽게 파이펫팅하여 섞습니다.
- T 세포 샘플 튜브 (뚜껑없이)를 자석에 넣고 실온에서 5 분 동안 배양하십시오. 조심스럽게 새 튜브에 상급을 붓습니다.
참고: 상급제는 농축된 기존의 CD4+T 세포를 함유하고 있다. - 원심분리기는 500 x g에서 5분간 농축된 CD4+T 세포를 폐기하고 10% FBS, 0.05 mM β-메르카포에탄올, 0.01 MM HEPES 및 1% 페니실린/스트렙토마이신(B로 표지됨)을 함유하는 RPMI1640의 4 mL에서 세포를 재중단시켰다.
- 조절 T 세포가 자석에서 농축되는 튜브를 제거합니다. 2.5 mL의 용액 A를 튜브에 넣고 위아래로 부드럽게 파이펫팅하여 2-3회 섞습니다. 튜브를 자석에 다시 넣고 5 분 동안 배양 한 다음 조심스럽게 부어 상류물을 버립니다. 이 단계를 세 번 더 반복합니다.
- 중간 B의 2 mL에서 농축 된 조절 T 세포를 다시 중단하십시오.
- 캔틸레버 기능화에 사용되기 전에 100 U/mL hIL-2로 정제된 기존의 T 세포와 조절 T 세포를 밤새 또는 가습된 인큐베이터에서 37°C에서 적어도 4시간 동안 배양합니다.
- 수지상 세포 준비
- 30% H2O2 (30%)의 혼합물인 피라냐 용액을 준비합니다. 및 70 % H2SO4 (conc) (v / v). H2 O2 의 3 mL을 H2SO4의 7 mL에 일정한 교반 및 냉각 하에 천천히 붓습니다.
주의 : 피라냐 용액은 매우 부식성이 있으며 신체 조직을 태우고 파괴 할 수 있습니다. 따라서, 혼합물이 비커 주위에 튀기 때문에 후드 아래에 피라냐 용액을 사용하고 적절한 안전 장비를 착용하는 것이 더 안전합니다. 사용 후 NaOH로 용액을 pH 7로 중화시. - 직경 24mm의 유리 커버슬립을 피라냐 용액에 30분 동안 담그고 멸균 된 초순수로 완전히 헹구십시오.
- 차가운 소독을 위해 30 분 동안 75 % 에탄올에 뾰족한 핀셋 한 쌍을 담급강.
- 핀셋으로 6웰 배양 플레이트에 클리클 된 유리 커버립을 소개합니다.
- DC2.4 세포가 배지 B의 4 mL로 미리 배양시킨 6 cm 플라스틱 배양 접시를 기울이고 모든 배지를 흡인한다. 배양 접시에 2 mL의 PBS를 추가하여 DC2.4 세포를 헹구고 PBS를 폐기하십시오. 이 헹위 단계를 두 번 더 반복합니다.
- 배양 요리에 0.25% 트립신 EDTA 1 mL을 2분 간 첨가합니다. 소화된 세포 현탁액을 15 mL 튜브로 옮김을 옮김.
- 500 x g에서 5분 동안 세포 현탁액을 원심분리하고 중간 B에서 2 x 105 셀/mL의 밀도로 DC2.4 셀을 다시 일시 중단합니다.
- 1.4.4단계에서 제조된 유리 커버립상의 종자 DC2.4 세포는 5% CO2로 37°C에서가습된 챔버에서 밤새 세포를 배양한다.
참고: 두 개의 단일 세포 간의 상호 작용 력을 측정하기 위해서는 상대적으로 낮은 DC2.4 세포 농도(즉, lt;10% confluency)가 세포 간에 적절한 간격을 가질 필요가 있습니다.
- 30% H2O2 (30%)의 혼합물인 피라냐 용액을 준비합니다. 및 70 % H2SO4 (conc) (v / v). H2 O2 의 3 mL을 H2SO4의 7 mL에 일정한 교반 및 냉각 하에 천천히 붓습니다.
- AFM 캔틸레버 준비
참고: 단일 세포 힘 분광법 실험에 적합한 캔틸레버는 일반적으로 0.01-0.06 N/m 범위의 낮은 스프링 상수를 가진 분광술입니다. 여기서, 부드러운 팁없는 캔틸레버는 단일 세포 및 단일 고체 입자 기능화에 바람직하다.- 피라냐 처리 또는 플라즈마 또는 UV-오존 세척으로 캔틸레버를 청소하십시오.
- 세척된 캔틸레버를 AFM 스캐닝 헤드에 장착합니다.
- 순수한 물로 채워진 깨끗한 샘플 챔버를 준비하고 먼저 감도 (접근 곡선의 반발 부분에 선형 맞춤의 기울기)를 얻기 위해 유리 기판에 힘 곡선을 실행하여 물 용액에 캔틸레버를 보정한 다음 AFM의 사용 설명서에 따라 스프링 상수를 추출하기 위해 열 노이즈 스펙트럼을 기록합니다.
- 용액에서 AFM 스캐닝 헤드를 제거하고, 장착된 캔틸레버를 몇 방울의 순수 에탄올로 세척하고, 캔틸레버를 스캐닝 헤드에 건조하게 유지합니다.
- 캔틸레버에 단일 T 셀 부착
- 37 °C에서 5 % CO2로 살아있는 셀 환경 인클로저를 예열하십시오.
- 1.4.8 단계에서 샘플 챔버 어셈블리에 성장한 DC2.4 셀로 유리 커버슬립을 장착하고 즉시 챔버에 중간 B 의 600 μL을 추가한 다음 어셈블리를 AFM 샘플 단계에 놓습니다.
- hIL-2 인큐베이팅된 CD4+T 세포(기존 또는 조절 T 세포 중 하나)를 샘플 챔버에 추가합니다.
참고: 총 샘플 볼륨이 1mL를 초과해서는 안 됩니다. - 추가된 CD4+T 셀이 커버슬립 하단에 완전히 가라앉을 때까지 기다립니다.
참고: 기포는 실험에 큰 교란을 일으키므로 1.6.2 단계와 1.6.3단계의 기포를 피하는 것이 좋습니다. - 그림 1과 같이 파이펫을 장착한 캔틸레버 끝에 2 μL의 생체 적합성 접착제를 한 방울 떨어뜨린 다음 스캔 헤드를 샘플 스테이지에 빠르게 배치하여 생체 적합성 접착제로 코팅된 캔틸레버를 솔루션.
주의: 파이펫 팁으로 유리 블록이나 캔틸레버를 만지지 마십시오. 여기에 사용되는 생체 적합성 접착제는 공기 중의 산화가 발생하기 쉽기 때문에 이 단계는 가능한 한 빨리 수행해야 합니다. - 샘플 단계를 이동하여 캔틸레버 의 끝 아래에 있는 건강한 T 세포를 현미경 아래에 거칠게 찾은 다음 스캐닝 헤드를 이동하여 위치를 미세하게 조정합니다.
참고: 건강한 CD4+T 셀은 일반적으로 밝은 필드 이미징에서 비교적 큰 크기, 매끄러운 가장자리 및 광학 투과성입니다. - 스테퍼 모터를 제어하여 50 μm에서 10, 5, 2 및 0.5 μm로 점진적으로 단계 크기로 수동으로 캔틸레버를 낮춥춥습니다. 스테퍼 모터의 위치를 잡고 캔틸레버 팁과 셀 사이의 더 나은 정렬을 위해 스캐닝 헤드의 위치를 조정하고, 캔틸레버가 레이저 빔의 작은 변위에 의해 지시된 바와 같이 대상 T 셀과 단단히 접촉하게 되면 0.5-1.5 nN의 일반적인 힘 범위에 해당하는 광검출기의 위치입니다.
참고: 이 단계는 설정점(셀에 가해지는 힘)과 접촉 시간을 소프트웨어에서 잘 정의할 수 있는 단일 힘 측정을 실행하여 수행할 수도 있습니다. 그러나 T 셀의 접착성이 아닌 특성으로 인해 수동 접근 방식은 자동 접근보다 조준, 위치 지정 및 접촉 시간을 제어하는 데 더 많은 유연성을 제공하며 T 세포 접착에 안정적으로 작동합니다. 미래의 실험가들은 수동 및 자동 접근 을 모두 시도하여 관심있는 시스템에 더 잘 맞는 것을 찾아야합니다. - 접촉 30회 후에 캔틸레버를 철회하십시오.
참고: 셀이 캔틸레버와 함께 이동하면 첨부 파일이 성공합니다. 그렇지 않은 경우 1.6.6 단계를 반복하지만 다른 T 셀에서 반복합니다. 생체 적합성 접착제는 쉽게 산화됩니다. 1.6.5-1.6.7 단계는 5 분 이내에 완료해야합니다. 또한 동일한 캔틸레버가 T 셀 부착에 대해 세 번 실패하면 새 캔틸레버를 사용해야 하며 부착 절차는 1.5.2 단계부터 다시 시작해야 합니다.
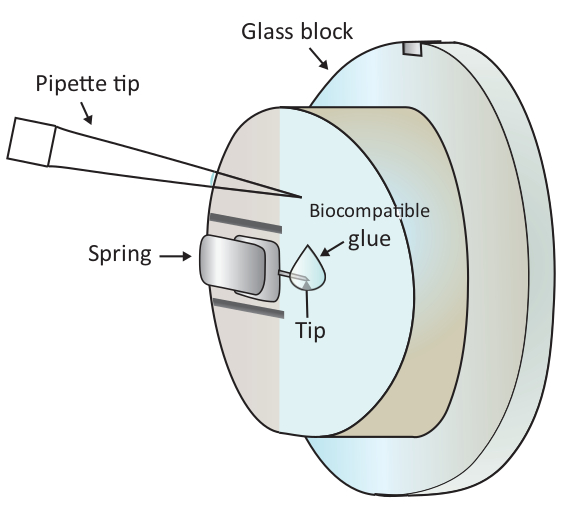
그림 1: 장착된 캔틸레버에 생체 적합성 접착제를 작은 방울을 추가하는 회로도 표현. 캔틸레버는 AFM 스캐닝 헤드에 설치된 유리 블록 홀더의 클램핑 스프링을 통해 장착됩니다(여기에 그려지지 않음). 스캐닝 헤드가 평평한 표면에 서 있으면 캔틸레버가 도면에 표시된 대로 수직 방향으로 향하게 됩니다. 약 2 μL 생체 적합성 접착제는 마이크로 파이펫으로 캔틸레버의 팁에 첨가될 수 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 단일 쌍 T 세포 / 수지상 세포 상호 작용의 힘 분광법
참고: 세포/세포 상호 작용을 프로브하기 위해, 두 세포를 완전히 분리하기 위해서는 기존의 10-15 μm보다 큰 Z 범위를 가진 AFM이 필요합니다. 여기에서 사용된 AFM에는 세포/세포 접촉 후에 수지상 세포에서 T 세포를 분리하기 위하여 적당한 100 μm의 Z 범위를 가있습니다.- 샘플 단계 및/또는 스캐닝 헤드를 이동하여 연결된 T 셀을 별도의 DC2.4 셀 위에 놓습니다(그림 2참조).
- 적절한 매개 변수를 설정하고 힘 분광법을 실행합니다.
참고: 설정점 0.5 nN, 당기 길이 50 μm, Z 이동 상수 속도, 속도 5 μm/s 연장, 접촉 시간 10s, 지연 모드 상수 힘 등 일반적으로 사용됩니다. 각 T-DC 쌍에 대해 20회 반복의 힘 곡선이 수집되고 추가 해석을 위해 최소 14개의 힘 곡선이 사용됩니다. - 새로운 세척 캔틸레버를 장착하고 1.5.3단계에서와 같이 순수한 물에 교정하고 동일한 T-DC 셀 샘플로 돌아가 다른 T-DC 쌍에 대해 1.6 단계 와 1.7을 반복합니다. 각 조건에 대해 적어도 5 쌍을 조사합니다.
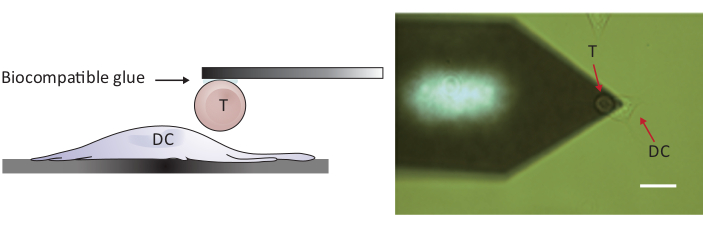
그림 2: 단일 T 셀과 DC 간의 강제 프로빙의 실험 적 구성. (a) 캔틸레버에 부착된 T 셀이 힘 프로빙을 위해 기판 상에서 성장된 DC로 이송되는 실험 구성의 개략도. (B) T 세포 기능화 캔틸레버 및 DC의 밝은 필드 이미지. 배율 표시줄, 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 단일 폴리스티렌 구슬캔틸레버 기능화
- 단일 구슬 준비
- 100 % 에탄올에 6 μm 폴리스티렌 구슬의 재고 현탁액을 희석.
참고 : 희석 된 비드 용액의 농도는 유리 커버 슬립 표면에 추가 될 때, 개별 구슬이 용매 증발 후 상당한 클러스터링없이 잘 분리되도록 충분히 낮아야합니다. - 직경 24mm의 유리 커버슬립을 에탄올로 청소하고N2 공기 흐름에 의한 먼지를 제거합니다.
- 세척된 유리 커버슬립을 샘플 챔버 어셈블리에 장착하고 어셈블리를 현미경에 놓습니다.
- 희석된 비드 용액을 왼쪽에 떨어뜨리되 커버슬립의 중심에 가깝게 떨어뜨리고(도 3참조) 20배 의 목적으로 현미경 아래 의 밝은 필드에서 용매 증발 후 비드 사이의 간격을 확인한다. 개별 구슬이 잘 분리된 경우 다음 단계로 진행합니다.
- 마이크로파이펫 팁이나 이쑤시개를 잘 혼합된 에폭시 접착제에 담근 다음, 소량의 접착제를 오른쪽에 연이어 부드럽게 닿은 채 커버슬립중앙에 가깝게 세 개의 분리된 반점으로 옮깁니다.
참고: 세 개의 접착제 반점은 수직으로 정렬되어야 합니다(그림 3참조). 접착제의 양이 적은 마지막 지점은 나중에 사용됩니다.
- 100 % 에탄올에 6 μm 폴리스티렌 구슬의 재고 현탁액을 희석.
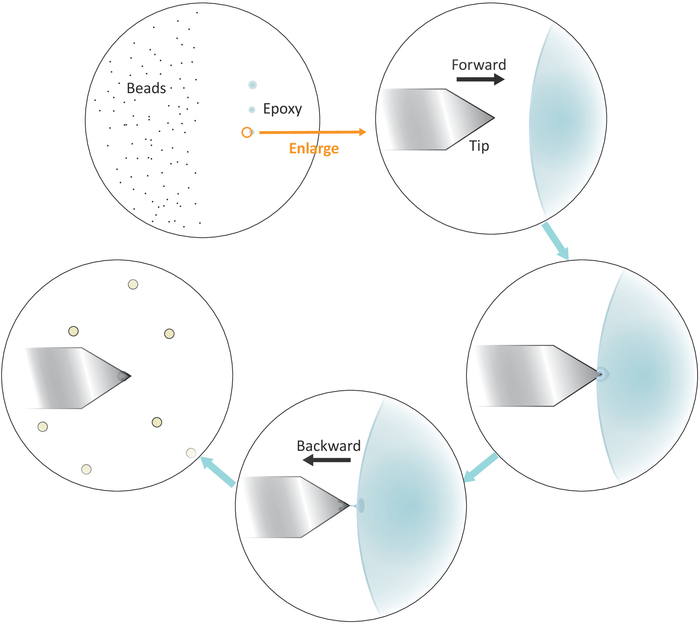
그림 3: 캔틸레버에서 단일 비드 기능화를 위한 작업 흐름의 회로도 표현. 잘 분리 된 미크림 크기의 구슬은 기판의 왼쪽에 제조되고 소량의 에폭시 접착제는 3 개의 연속적인 부드러운 터치를 통해 기판의 오른쪽으로 옮겨져 3 개의 접착제 스팟을 초래합니다. 접착제의 양이 가장 적은 마지막 지점 (원으로 표시)만 캔틸레버의 맨 끝을 코팅하는 데 사용됩니다. 캔틸레버를 왼쪽에서 접착제로 접근한 다음 캔틸레버가 접착제에 담근 후 캔틸레버를 뒤로 이동하여 캔틸레버 의 맨 끝에 있는 접착제를 제한합니다. 비드 접착에 대해 단단한 접촉(일반적으로 2-5n)을 하기 전에 캔틸레버 아래에 대상 비드를 가져와서 올바르게 정렬합니다. 비드를 캔틸레버에서 성공적으로 기능화하면 새로운 캔틸레버를 장착하여 새로운 기능화 주기를 시작할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- AFM 캔틸레버 준비
- 세척된 팁이 없는 캔틸레버를 AFM 스캐닝 헤드에 장착합니다.
- 이 캔틸레버를 깨끗한 표면으로 공기 중에서 보정하여 스프링 상수를 얻습니다.
- 캔틸레버에 단일 비드 부착
- 그림 3과 같이 마지막 에폭시 접착제 스팟의 왼쪽 경계 위에 캔틸레버 팁을 배치합니다.
- 작은 스텝 크기의 스테퍼 모터를 낮추어 캔틸레버를 접착제 가까이에 천천히 가져옵니다.
- 팁이 접착제에 담김되면 AFM 스캐닝 헤드를 왼쪽으로(왼쪽) 뒤로 이동하여 캔틸레버를 접착제에서 빠르게 당겨 빼냅니다.
참고: 소량의 접착제만 팁 끝에 부착되어 있는지 확인하십시오. 팁에 과도한 접착제가 있는 경우, 빈 표면에 팁을 슬라이딩한 다음 터치하여 접착제의 양을 줄일 수 있습니다. - 잘 분리된 단일 비드 위에 캔틸레버 팁을 이동합니다.
- 캔틸레버를 단일 비드에 천천히 접근하고 비드(2-5 nN의 일반적인 힘 범위에 해당하는 광검출기에서 레이저 빔 위치의 변위에 의해 지시된 바와 같이)를 약 10초 동안 t의 미세 조정을 위해 비드와 단단히 접촉하게 한다. IP 포지셔닝은 팁의 맨 끝에 있는 비드를 더 잘 찾는 데 도움이 됩니다. 접지 끝에 있는 팁을 철회합니다.
참고: 원래 초점 평면에서 매우 비드의 실종은 성공적인 부착 이벤트를 나타냅니다. - 비드 수정 캔틸레버를 조심스럽게 분리하고 접착제의 완전한 응고를 위해 밤새 캔틸레버 상자에 보관하십시오.
- AFM에 의해 전달된 단일 비드에 대한 대식세포의 세포 반응의 형광 이미징.
참고: 형광 이미징은 상업적 현미경 스탠드에 기초하여 집에서 만든 객관적인 유형의 총 내부 반사 형광 현미경에서 수행되었다. 이 이미징 시스템에는 4개의 레이저 소스(405nm, 488nm, 561nm, 647nm), 2색 검출을 위한 스플리터 뷰어, 광시야 각진 이미징을 위한 전자 증식 전하 결합 장치(EMCCD)가 장착되어 있습니다.- 5% CO2 가습 챔버에서 37°C에서 유리 커버슬립상RAW264.7 세포를 성장시다.
- Transfect 모에신-EGFP 및 PLCδ-PH-mCherry를 RAW264.7 세포로 변환 키트를 사용하여 (재료 표참조) 제조업체의 프로토콜에 따라 모에신및 포스파티딜리노시톨 4,5-비스포스페이트(PIP2) 분자를 형광적으로 시각화 각각.
참고: 모에신은 식세포증의 핵심 플레이어인 Syk를 활성화할 수 있는 ITAM 모티프를 가지고 있습니다. PIP2는 세포막에 모에신을 모집하는 것으로 알려져 있다. - 셀이 있는 유리 커버슬립을 샘플 챔버 어셈블리에 놓고 어셈블리를 AFM 샘플 스테이지에 장착합니다.
- 비드 수정 캔틸레버를 AFM 스캐닝 헤드에 장착합니다.
- 빈 영역에서 힘 곡선을 실행하고 이 곡선의 민감도와 2.2.2단계에서 측정된 스프링 상수로 힘을 보정합니다.
- 488/561 nm 여기와 녹색 (모에신-EGFP) 및 빨간색 (PLCδ-PH-mCherry) 채널 모두에서 적절한 형광 강도를 가진 잘 단리된 세포를 찾습니다.
- AFM이 있는 6 μm 폴리스티렌 비드를 1 nN 일정한 힘과 500s 의 접촉 시간으로 셀 표면에 전달합니다.
- 분석을 위해 비드와 접촉하는 셀의 형광 이미지 계열을 기록합니다(일반적으로 10프레임/s).
참고 : 형광의 광 표백을 줄이기 위해 관심있는 세포를 검색하는 데 상대적으로 낮은 여기 전력을 사용해야합니다. 또한, 세포 반응의 역학이 느린 시간 척도에 있는 경우에 형광 시간 추적을 연장하기 위하여 간헐적인 여기 체계를 채택될 수 있습니다.
결과
그림 4A는 단일 T 셀과 단일 DC 간의 결합 상호 작용으로부터의 일반적인 힘 거리 곡선을 하나의 접근-리트랙트 사이클에서 보여줍니다. 연한 빨간색 곡선은 확장 곡선이고 진한 빨간색 곡선은 후퇴 곡선입니다. 확장 곡선은 일반적으로 들여쓰기 또는 강성 분석에 사용되므로 여기서는 후퇴 곡선만 셀 접착에 대해 우려됩니다. 곡선의 최소값(녹색 원)?...
토론
AFM 기반 단세포 힘 분광법은 살아있는 세포의 생물물리학적 특성을 해결하는 강력한 도구로 발전했습니다. 이러한 응용 프로그램의 경우, 캔틸레버는 관심 있는 세포에 대한 특정 상호 작용 또는 특성을 조사하기 위해 제대로 기능화되어야 합니다. 여기서, 단일 T 세포와 단일 미크로넨 크기의 비드를 팁리스 캔틸레버에 결합하는 방법이 각각 기재되어 있다. 단일 T 세포를 캔틸레버에 부착하기 ?...
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 중국 일반 프로그램의 국립 자연 과학 재단 (31370878), 국가 키 프로그램 (31630023) 및 혁신적인 연구 그룹 프로그램 (81621002)에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| Material | |||
| 10 μl pipette tip | Thermo Fisher | 104-Q | |
| 15 ml tube | Corning | 430791 | |
| 6 cm diameter culture dish | NALGENE nunc | 150462 | |
| 6-well culture plate | JET | TCP011006 | |
| AFM Cantilever | NanoWorld | Arrow-TL1-50 | tipless cantilever |
| β-Mercaptoethanol | Sigma | 7604 | |
| Biocompatible glue | BD Cell-Tak | 354240 | |
| CD4+ T cell isolation Cocktail | STEMCELL | 19852C.1 | |
| DC2.4 cell line | A gift from K. Rock (University of Massachusetts Medical School, Worcester, MA) | ||
| Dextran-coated magnetic particles | STEMCELL | SV30010 | |
| EDTA | GENEray | Generay-E1101-500 ml | |
| Epoxy | ERGO | 7100 | |
| Ethanol | twbio | 00019 | |
| FBS | Ex Cell Bio | FSP500 | |
| FcR blocker | STEMCELL | 18731 | |
| Glass coverslip | local vender (Hai Men Lian Sheng) | HX-E37 | 24mm diameter, 0.17mm thinckness |
| Glass slides | JinTong department of laboratory and equipment management, Haimen | N/A | customized |
| H2O2 (30%) | Sino pharm | 10011218 | |
| H2SO4 | Sino pharm | 80120892 | |
| HEPES | Sigma | 51558 | |
| Magnet | STEMCELL | 18000 | |
| Mesh nylon strainer | BD Falcon | REF 352350 | |
| Moesin-EGFP | N/A | cloned in laboratory | |
| Mouse CD25 Treg cell positive isolation kit | STEMCELL | 18782 | Component: FcR Blocker,Regulatory T cell Positive Selection Cocktail, PE Selection Cocktail, Dextran RapidSpheres, |
| Mouse CD4+ Tcell isolation kit | STEMCELL | 19852 | Component:CD4+T cell isolation Cocktail, Streptavidin RapidSpheres, Rat Serum |
| NaOH | Lanyi chemical products co., LTD? Beijing | 1310-73-2 | |
| PBS | Solarbio | P1022-500 | |
| PE selection cocktail | STEMCELL | 18151 | |
| Penicillin-Streptomycin | Hyclone | SV30010 | |
| PLCδ-PH-mCherry | Addgene | 36075 | |
| Polystyrene microspheres 6.0μm | Polysciences | 07312-5 | |
| polystyrene round bottom tube | BD Falcon | 352054 | |
| Rat serum | STEMCELL | 13551 | |
| RAW264.7 | ATCC | ||
| Recombinant Human Interleukin-2 | Peprotech | Peprotech, 200-02-1000 | |
| Red blood cell lysis buffer | Beyotime | C3702 | |
| Regulatory T cell positive selection cocktail | STEMCELL | 18782C | |
| RPMI 1640 | Life | C11875500BT | |
| Sample chamber | Home made | ||
| Streptavidin-coated magnetic particles | STEMCELL | 50001 | |
| Transfection kit | Clontech | 631318 | |
| Trypsin 0.25% EDTA | Life | 25200114 | |
| Tweezers | JD | N/A | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 20x objective NA 0.8 | Zeiss | 420650-9901 | Plan-Apochromat |
| Atomic force microscope | JPK | cellHesion200 | |
| Centrifuge | Beckman coulter | Allegra X-12R | |
| Fluorescence imaging | home-made objective-type total internal reflection fluorescence microscop based on a Zeiss microscope stand | ||
| Humidified CO2 incubator | Thermo Fisher | HERACELL 150i | |
| Inverted light microscope | Zeiss | Observer A1 manual |
참고문헌
- Benoit, M., Gabriel, D., Gerisch, G., Gaub, H. E. Discrete interactions in cell adhesion measured by single-molecule force spectroscopy. Nature Cell Biology. 2 (6), 313-317 (2000).
- Chen, J., et al. Strong adhesion by regulatory T cells induces dendritic cell cytoskeletal polarization and contact-dependent lethargy. Journal of Experimental Medicine. 214 (2), 327-338 (2017).
- Liu, L., et al. Mechanotransduction-modulated fibrotic microniches reveal the contribution of angiogenesis in liver fibrosis. Nature Materials. 16 (12), 1252-1261 (2017).
- Mu, L. B., et al. A phosphatidylinositol 4,5-bisphosphate redistribution-based sensing mechanism initiates a phagocytosis programing. Nature Communications. 9, (2018).
- Qi, C., et al. Pathology-targeted cell delivery via injectable micro-scaffold capsule mediated by endogenous TGase. Biomaterials. 126, 1-9 (2017).
- Muller, D. J., Helenius, J., Alsteens, D., Dufrene, Y. F. Force probing surfaces of living cells to molecular resolution. Nature Chemical Biology. 5 (6), 383-390 (2009).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy: a nanoscopic window on the cell surface. Trends in Cell Biology. 21 (8), 461-469 (2011).
- Radotic, K., et al. Atomic force microscopy stiffness tomography on living Arabidopsis thaliana cells reveals the mechanical properties of surface and deep cell-wall layers during growth. Biophysics Journal. 103 (3), 386-394 (2012).
- Kuznetsova, T. G., Starodubtseva, M. N., Yegorenkov, N. I., Chizhik, S. A., Zhdanov, R. I. Atomic force microscopy probing of cell elasticity. Micron. 38 (8), 824-833 (2007).
- Scheuring, S., Dufrene, Y. F. Atomic force microscopy: probing the spatial organization, interactions and elasticity of microbial cell envelopes at molecular resolution. Molecular Microbiology. 75 (6), 1327-1336 (2010).
- Berdyyeva, T. K., Woodworth, C. D., Sokolov, I. Human epithelial cells increase their rigidity with ageing in vitro: direct measurements. Physics in Medicine and Biology. 50 (1), 81-92 (2005).
- Sokolov, I., Dokukin, M. E., Guz, N. V. Method for quantitative measurements of the elastic modulus of biological cells in AFM indentation experiments. Methods. 60 (2), 202-213 (2013).
- Bozna, B. L., et al. Binding strength and dynamics of invariant natural killer cell T cell receptor/CD1d-glycosphingolipid interaction on living cells by single molecule force spectroscopy. Journal of Biological Chemistry. 286 (18), 15973-15979 (2011).
- Flach, T. L., et al. Alum interaction with dendritic cell membrane lipids is essential for its adjuvanticity. Nature Medicine. 17 (4), 479-487 (2011).
- Ng, G., et al. Receptor-independent, direct membrane binding leads to cell-surface lipid sorting and Syk kinase activation in dendritic cells. Immunity. 29 (5), 807-818 (2008).
- Helenius, J., Heisenberg, C. P., Gaub, H. E., Muller, D. J. Single-cell force spectroscopy. Journal of Cell Science. 121 (11), 1785-1791 (2008).
- Litvinov, R. I., Shuman, H., Bennett, J. S., Weisel, J. W. Binding strength and activation state of single fibrinogen-integrin pairs on living cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (11), 7426-7431 (2002).
- Evans, E., Ritchie, K., Merkel, R. Sensitive Force Technique to Probe Molecular Adhesion and Structural Linkages at Biological Interfaces. Biophysics Journal. 68 (6), 2580-2587 (1995).
- Lamprecht, C., Hinterdorfer, P., Ebner, A. Applications of biosensing atomic force microscopy in monitoring drug and nanoparticle delivery. Expert Opinion on Drug Delivery. 11 (8), 1237-1253 (2014).
- Charras, G. T., Horton, M. A. Single cell mechanotransduction and its modulation analyzed by atomic force microscope indentation. Biophysics Journal. 82 (6), 2970-2981 (2002).
- Sun, M. Z., et al. Multiple membrane tethers probed by atomic force microscopy. Biophysics Journal. 89 (6), 4320-4329 (2005).
- Yan, J. C., Liu, B., Shi, Y., Qi, H. Class II MHC-independent suppressive adhesion of dendritic cells by regulatory T cells in vivo. Journal of Experimental Medicine. 214 (2), 319-326 (2017).
- Hao, J. J., et al. Phospholipase C-mediated hydrolysis of PIP2 releases ERM proteins from lymphocyte membrane. Journal of Cell Biology. 184 (3), 451-462 (2009).
- Rodriguez, R. M., et al. Lymphocyte-T Adhesion to Fibronectin (Fn) - a Possible Mechanism for T-Cell Accumulation in the Rheumatoid Joint. Clinical and Experimental Immunology. 89 (3), 439-445 (1992).
- Kimura, A., Ersson, B. Activation of Lymphocytes-T by Lectins and Carbohydrate-Oxidizing Reagents Viewed as an Immunological Recognition of Cell-Surface Modifications Seen in the Context of Self Major Histocompatibility Complex Antigens. European Journal of Immunology. 11 (6), 475-483 (1981).
- Miller, K. The Stimulation of Human Lymphocyte-B and Lymphocyte-T by Various Lectins. Immunobiology. 165 (2), 132-146 (1983).
- Vitte, J., Pierres, A., Benoliel, A. M., Bongrand, P. Direct quantification of the modulation of interaction between cell- or surface-bound LFA-1 and ICAM-1. Journal of Leukocyte Biology. 76 (3), 594-602 (2004).
- Beaussart, A., et al. Quantifying the forces guiding microbial cell adhesion using single-cell force spectroscopy. Nature Protocols. 9 (5), 1049-1055 (2014).
- Shu, F., et al. Cholesterol Crystal-Mediated Inflammation Is Driven by Plasma Membrane Destabilization. Frontiers in Immunology. 9, (2018).
- Hosseini, B. H., et al. Immune synapse formation determines interaction forces between T cells and antigen-presenting cells measured by atomic force microscopy. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17852-17857 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유