È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Funzionalizzazione dei cantilever a microscopio a forza atomica con cellule A T singole o a particella singola per la spettroscopia immunologica a forza a cella singola
In questo articolo
Riepilogo
Presentiamo un protocollo per funzionalizzare i cantilever a forza atomica (AFM) con una singola cellula T e particelle di perline per studi immunologici. Vengono mostrate le procedure per sondare il legame di cellula-cellula T a una singola coppia da parte di AFM e per monitorare la risposta cellulare in tempo reale dei macrofagi a una singola particella solida da AFM con imaging a fluorescenza.
Abstract
La spettroscopia a forza cellulare atomica (AFM-SCFS) è un potente strumento per studiare le proprietà biofisiche delle cellule viventi. Questa tecnica consente di sondare i punti di forza e la dinamica di interazione su una membrana cellulare viva, compresi quelli tra le cellule, il recettore e i ligandi, e insieme a molte altre variazioni. Funziona anche come meccanismo per fornire uno stimolo fisico o biochimico su singole cellule in modo spatiotemporalmente controllato, consentendo così l'attivazione di cellule specifiche e i successivi eventi cellulari da monitorare in tempo reale quando combinati con le cellule vive l'imaging a fluorescenza. Il passo chiave in queste misurazioni AFM-SCFS è la funzionalizzazione a sbalzo AFM, o in altre parole, allegando un argomento di interesse al cantilever. Qui, presentiamo metodi per modificare i cantilever AFM con una singola cellula T e una singola perla di polistirolo rispettivamente per gli studi immunologici. Il primo prevede una colla biocompatibile che associa singole cellule T alla punta di uno sbalzo piatto in una soluzione, mentre la seconda si basa su una colla epossidica per l'adesione a perline singola nell'ambiente atmosferico. Vengono fornite anche due applicazioni immunologiche associate a ogni modifica a sbalzo. I metodi qui descritti possono essere facilmente adattati a diversi tipi di cellule e particelle solide.
Introduzione
La microscopia a forza atomica (AFM), uno strumento versatile, ha trovato molte applicazioni nella ricerca sulla biologia cellulare1,2,3,4,5. Oltre alla sua capacità di imaging ad alta risoluzione, la funzione nativa di sonda di forza consente di studiare direttamente le proprietà biofisiche delle cellule viventi in situ al livello a cella singola6,7. Questi includono le rigidità delle strutture subcellulari o anche le cellule intere8,9,10,11,12, specifici punti di forza di legamento / recettore livello di singola molecola sulla superficie cellulare13, e le forze di adesione tra singole coppie di particelle solide e cellule o tra due cellule1,2,14,15. Questi ultimi due sono spesso classificati come spettroscopia a forza singola (SCFS)16. A causa dei cantilever prontamente disponibili con varie costanti primaverili, la gamma di forza accessibile all'AFM è piuttosto ampia da pochi piconewtons (pN) a micronewton (N), che copre adeguatamente l'intera gamma di eventi cellulari che coinvolgono forze di poche decine di pN, come il legame a singola molecola basato sul recettore, a nN, come gli eventi cellulari fagocitici15. Questa vasta gamma di forza dinamica rende l'AFM vantaggioso rispetto ad altre tecniche di sonda di forza come le pinzette ottiche/magnetiche e una sonda di forza biomembrana, in quanto sono più adatte per misurazioni a forza debole, con forza tipicamente inferiore a 200 pN17 , 18.Inoltre, l'AFM può funzionare come manipolatore ad alta precisione per fornire vari stimoli su singole celle in modo spatiotemporale4,19. Questo è auspicabile per gli studi di attivazione di una singola cellula in tempo reale. In combinazione con l'imaging a fluorescenza delle cellule vive, la successiva risposta cellulare allo stimolo specifico può essere monitorata contemporaneamente, rendendo così SCFS basato su AFM estremamente robusto come imaging ottico che fornisce uno strumento pratico per sondare la segnalazione cellulare. Per esempio, AFM è stato utilizzato per determinare i ceppi necessari per suscitare transitori di calcio negli osteoblasti20. In questo lavoro, i transitori di calcio sono stati tracciati fluorescente attraverso l'imaging ratiometrico del calcio dopo l'applicazione di forze localizzate su osteoblasti coltivati con una punta AFM. Recentemente, AFM è stato impiegato per allungare fibrille di collagene su cui sono state coltivate cellule epatiche stellate (HSC) e questa attivazione di HSC trassedanti mechano è stata monitorata in tempo reale da un biosensore Src fluorescente, la cui fosforolazione come l'intensità di fluorescenza del biosensore è correlata all'attivazione HSC3.
Negli esperimenti SCFS basati su AFM, una corretta funzionalizzazione dei cantilever AFM è un passo fondamentale verso misurazioni di successo. Dal momento che il nostro interesse di ricerca si concentra sull'attivazione delle cellule immunitarie, abbiamo regolarmente funzionalizzante i sbalzioni con particolato come singole particelle solide che possono innescare la fagocitosi e/o forti risposte immunitarie4,14 , 15 e singole cellule T che possono formare una sinapsi immunitaria con antigene che presenta cellule, come le cellule dendritiche attivate (DC)2. Le singole particelle solide sono normalmente accoppiate a un cantilever tramite una colla epossidica nell'ambiente atmosferico, mentre le singole cellule T, a causa della loro natura non adesiva, sono funzionalizzate a un sbalzo tramite una colla biocompatibile in soluzione. Qui, descriviamo i metodi per eseguire questi due tipi di modifica a sbalzo e diamo anche due applicazioni associate. La prima applicazione è quella di sondare le interazioni tra cellule T e DC con AFM-SCFS per comprendere il meccanismo soppressivo delle cellule T regolatorie dal punto di vista della meccanica cellulare. Il secondo consiste nel combinare AFM con l'imaging a fluorescenza a cellule vive per monitorare la risposta cellulare del macrofago a una particella solida in tempo reale per rivelare il meccanismo molecolare del fosfatoindipendentene 4,5-bisphofosfatolo 4,5-bisphosphatel (PIP2)- Moesin mediava la fagocitosi. L'obiettivo di questo protocollo è quello di fornire un quadro di riferimento per i ricercatori interessati per progettare e implementare le proprie impostazioni sperimentali con l'analisi unicellulare basata su AFM per la ricerca immunologica.
Protocollo
Il protocollo di sperimentazione dei topi segue le linee guida per la cura degli animali dell'Università di Tsinghua
1. Funzionalizzazione a sbalzo con singole cellule T
- Preparazione delle cellule di milza del topo
- Sacrificare il topo (8-16 settimane di età (entrambi i sessi); ceppo C57BL/6) utilizzando anidride carbonica, seguita da lussazione cervicale.
- Pulire il mouse con il 75% di etanolo e fare un'incisione della pelle midline seguita da splenectomia.
- Omogeneizzare la milza in 4 mL di PBS contenente 2% siero bovino fetale (FBS) utilizzando vetrini di vetro e rimuovere gli aggregati e detriti passando la sospensione cellulare attraverso un colino di nylon a rete di 70 m.
- Centrifugare la sospensione cellulare a 500 x g per 5 min, scartare il supernatante e rimettere in sospensione le cellule in 2 mL di lisi di lisi dei globuli rossi (bilanciato a temperatura ambiente) per 5 min. Termina la reazione di lisismo aggiungendo 8 mL di soluzione PBS.
- Centrifugare la sospensione cellulare a 500 x g per 5 min e risospendere le cellule ad una densità di 1 x 108 celle/mL in PBS contenenti 2% FBS e 1 mM EDTA (etichettato come soluzione A), in genere 0,25-2 mL a seconda della densità della cella. Trasferire le celle risospese in un tubo inferiore rotondo in polistirolo da 5 mL (12 x 75 mm).
- Preparazione delle cellule T del CD4 per mouse
- Aggiungere il siero di 50 -L/mL (vedere Tabella deimateriali) e il cocktail di isolamento delle cellule T luna/mL 50 l/mL (vedere Tabella dei materiali) al campione di cellule ottenuto dal punto 1.1.5. Mescolare e incubare per 10 min a temperatura ambiente.
- Vortice il magazzino streptavidin particelle magnetiche rivestite (vedi Tabella dei materiali) per 30 s o fino a quando le particelle appaiono uniformemente disperse.
- Aggiungere 75 particelle magnetiche rivestite di streptavidina l/mL al campione di cellule. Mescolare e incubare per 2,5 min a temperatura ambiente.
- Aggiungere la soluzione A per ricaricare il campione di cellule a 2,5 mL e mescolare pipettando delicatamente su e giù per 2-3 volte.
- Collocare il tubo campione (senza coperchio) nel magnete (vedere Tabella deimateriali) e incubare per 5 min a temperatura ambiente. Versare con attenzione la sospensione cellulare arricchita in un nuovo tubo rotondo in polistirolo da 5 mL.
- Centrifugare la sospensione cellulare a 500 x g per 5 min. Scartare il supernatante e rimettere in sospensione le cellule T arricchite in 500 .L della Soluzione A.
NOTA: Le cellule T cd4 e t arricchite contengono cellule T sia convenzionali che regolatorie.
- Separazione delle cellule T regolatorie dalle celle T convenzionali
- Aggiungere 25 l di blocco FcR (vedere Tabella dei materiali) al campione di cellule T arricchito ottenuto dal punto 1.2.6. Mescolare e incubare per 5 min a temperatura ambiente.
- Aggiungete 25 -L di t cell regolatore positivo selection cocktail (vedi Tabella dei materiali) al campione di cellule T. Mescolare e incubare per 10 min a temperatura ambiente.
- Aggiungete 10 cocktail di selezione PE (vedere Tabella deimateriali) al campione di cellule T. Mescolare e incubare per 5 min a temperatura ambiente.
- Vorticare la soluzione di particelle magnetiche rivestite in dextran (vedi Tabella deimateriali) per 30 s o fino a quando le particelle non appaiono disperse in modo uniforme.
- Aggiungete 10 litri di particelle magnetiche rivestite di dextran al campione di cellule T. Mescolare e incubare per 5 min a temperatura ambiente.
- Aggiungere la soluzione A per ricaricare il campione di celle T a 2,5 mL e mescolare pipettando delicatamente su e giù per 2-3 volte.
- Posizionare il tubo campione della cella T (senza coperchio) nel magnete e incubare per 5 min a temperatura ambiente. Versare con attenzione il supernatante in un nuovo tubo.
NOTA: Il supernatante contiene le cellule convenzionali CD4 e T arricchite. - Centrifugare le cellule convenzionali CD4-T arricchite a 500 x g per 5 min. Scartare il supernatante e risospendere nuovamente le cellule in 4 mL di RPMI1640 contenenti 10% FBS, 0,05 mM-Mercaptoethanol, 0,01 M HEPES e 1% penicillina/streptomicina (etichettato come Medium B).
- Rimuovere il tubo in cui le cellule T regolatorie vengono arricchite dal magnete. Aggiungere 2,5 mL della soluzione A al tubo e mescolare con la pipistratura delicatamente su e giù per 2-3 volte. Rimettere il tubo nel magnete, incubare per 5 min, e poi versare con attenzione e scartare il supernatante. Ripetere questo passaggio altre tre volte.
- Risospendere le cellule T regolatorie arricchite in 2 mL di Media B.
- Incubare sia le cellule T convenzionali purificate che le cellule T regolatorie con 100 U/mL hIL-2 durante la notte o per almeno 4 h a 37 gradi centigradi in un'incubatrice umidificata con 5% DI CO2 prima di essere utilizzata per la funzionalizzazione a sbalzo.
- Preparazione delle cellule dendritiche
- Preparare la soluzione piranha, una miscela del 30% H2O2 (30%) e 70% H2SO4 (conc) (v/v). Versare lentamente 3 mL di H2O2 in 7 mL di H2SO4 sotto agitazione e raffreddamento costanti.
AVVISO: la soluzione Piranha è altamente corrosiva e può bruciare e distruggere i tessuti del corpo. Pertanto, è più sicuro utilizzare la soluzione piranha sotto un cofano e indossare attrezzature di sicurezza appropriate, in quanto la miscela sguazzerà intorno al becher. Neutralizzare la soluzione con NaOH a pH 7 dopo l'uso. - Immergere la vetrina di vetro di 24 mm di diametro nella soluzione piranha per 30 min e risciacquare accuratamente in seguito con l'acqua ultrapura sterile.
- Immergere un paio di pinzette appuntite nel 75% di etanolo per 30 min per la disinfezione da freddo.
- Introdurre i coperchi in vetro pulitoin fila in una piastra di coltura a 6-ben dalle pinzette.
- Inclinare un piatto di coltura plastica di 6 cm in cui le cellule DC2.4 sono state pre-coltivate con 4 mL di Medium B e aspirare tutto il mezzo. Aggiungere 2 mL di PBS nel piatto di coltura per sciacquare le cellule DC2.4 e scartare PBS. Ripetere questo passaggio di risciacquo altre due volte.
- Aggiungere 1 mL di 0,25% di trypsin EDTA al piatto di coltura per 2 min. Aggiungere 1 mL di Mezzo B a questo piatto per terminare la reazione di digestione enzimatica. Trasferire la sospensione cellulare digerita in un tubo da 15 mL.
- Centrifugare la sospensione cellulare a 500 x g per 5 min e riattendere le cellule DC2.4 ad una densità di 2 x 105 5 cellule/mL nel mezzo B.
- Seme DC2.4 cellule sul vetro coverlips preparate al passo 1.4.4 e incubare le cellule durante la notte in una camera umidizzata a 37 gradi centigradi con 5% di CO2.
NOTA: per misurare le forze interagenti tra due celle singole, è necessaria una concentrazione relativamente bassa di celle DC2.4 (cioè la confluenza <10%).
- Preparare la soluzione piranha, una miscela del 30% H2O2 (30%) e 70% H2SO4 (conc) (v/v). Versare lentamente 3 mL di H2O2 in 7 mL di H2SO4 sotto agitazione e raffreddamento costanti.
- Preparazione a sbalzo AFM
NOTA: I cantilever adatti per esperimenti di spettroscopia a forza cellulare singola sono quelli con costanti a molla bassa, in genere nell'intervallo di 0,01-0,06 N/m. Qui, i cantilever senza punta morbidi sono preferiti per la funzionalizzazione di singole cellule e particelle solide.- Pulire i cantilever con il trattamento Piranha o plasma o pulizia UV-ozona.
- Montare lo sbalzo pulito sulla testa di scansione AFM.
- Preparare una camera campione pulita riempita con acqua pura e calibrare il cantilever in soluzione d'acqua eseguendo prima una curva di forza sul substrato di vetro per ottenere la sensibilità (la pendenza della vestibilità lineare sulla parte repulsiva della curva in avvicinamento) e poi registrazione di uno spettro di rumore termico per estrarre la costante della molla secondo il manuale di istruzioni dell'AFM.
- Rimuovere la testina di scansione AFM dalla soluzione, lavare il cantilever montato con qualche goccia di etanolo puro e mantenere il cantilever asciutto sulla testa di scansione.
- Attacco di singole cellule T allo sbalzo
- Preriscaldare l'involucro dell'ambiente cellulare vivente con il 5% di CO2 a 37 gradi centigradi.
- Montare il coperchio di vetro con celle DC2.4 coltivate da un gruppo di camere campione 1.4.8 a un assemblaggio a camera campione, aggiungere immediatamente 600 L di Medio B alla camera, quindi posizionare l'assemblaggio sullo stadio del campione AFM.
- Aggiungere cellule T incubate da hIL-2 (cellule T convenzionali o regolatorie) nella camera campione.
NOTA: il volume totale del campione non deve superare 1 mL. - Attendere che le celle CD4 e T aggiunte siano completamente sistemate nella parte inferiore della coverslip.
NOTA: Le bolle d'aria causeranno grande disturbo all'esperimento, quindi è consigliabile evitare eventuali bolle d'aria nel passaggio1.6.2 e 1.6.3. - Aggiungere una goccia di 2 -L di colla biocompatibile all'estremità dello sbalzo montato con una pipetta come mostrato nella Figura 1 e quindi posizionare rapidamente la testa di scansione sullo stadio campione, lasciando così lo sbalzo rivestito con la colla biocompatibile soluzione.
AVVISO: Non toccare il blocco di vetro o il cantilever con la punta della pipetta. Poiché la colla biocompatibile utilizzata qui è soggetta all'ossidazione nell'aria, questo passaggio dovrebbe essere fatto il più rapidamente possibile. - Individuare una cella T sana sotto la punta del cantilever grossolanamente sotto il microscopio spostando lo stadio del campione e quindi regolare finemente il posizionamento spostando la testa di scansione.
NOTA: una cella c'è un CD4 e Una cella T sani che in genere hanno dimensioni relativamente grandi, bordi lisci e otticamente trasmissive nell'imaging del campo luminoso. - Abbassare lo sbalzo manualmente con dimensioni di gradino a partire da 50 m, quindi a 10, 5, 2 e 0,5 m gradualmente controllando i motori stepper. Mantenere la posizione dei motori stepper e regolare il posizionamento della testa di scansione per un migliore allineamento tra la punta a sbalzo e la cella, una volta che lo sbalzo fa un contatto fermo con la cella T di destinazione come indicato da un piccolo spostamento del raggio laser posizione nel fotodetector corrispondente a un intervallo di forza tipico di 0,5-1,5 nN.
NOTA: Questo passaggio può essere fatto anche eseguendo una singola misurazione della forza in cui set-point (la forza applicata alla cella) e il tempo di contatto può essere ben definito nel software. Tuttavia, a causa della natura non adesiva delle cellule T, l'approccio manuale offre una maggiore flessibilità nel controllo dell'obiettivo, del posizionamento e del tempo di contatto rispetto all'avvicinamento automatico e funziona in modo affidabile per l'adesione alle cellule T. I futuri sperimentalisti dovrebbero provare sia l'avvicinamento manuale che automatico per scoprire quale funziona meglio per i loro sistemi di interesse. - Ritirare lo sbalzo dopo 30 s di contatto.
NOTA: Se la cella si sposta con lo sbalzo, l'allegato ha esito positivo. In caso contrario, ripetere il passaggio 1.6.6 ma su una cella T diversa. La colla biocompatibile è facilmente ossidabile. Passo 1.6.5-1.6.7 deve essere completato entro 5 min. Inoltre, se lo stesso cantilever non riesce tre volte per l'attacco della cella T, deve essere utilizzato un nuovo sbalzo e la procedura di attacco dovrebbe iniziare nuovamente dal passaggio 1.5.2.
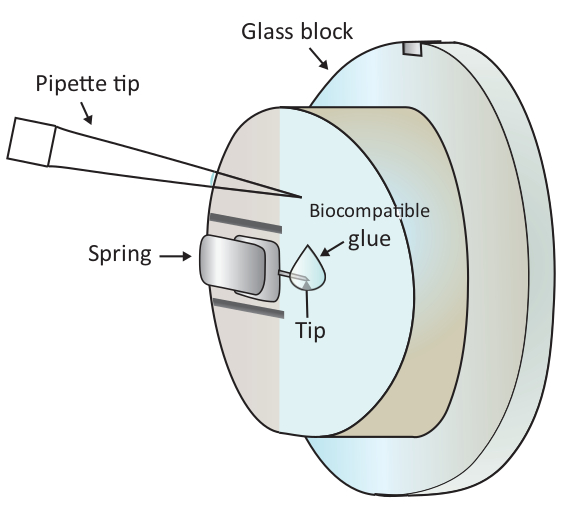
Figura 1: Rappresentazione schematica dell'aggiunta di una piccola goccia di colla biocompatibile sul sbalzo montato. Il cantilever è montato tramite una molla di bloccaggio sul supporto del blocco di vetro che viene installato sulla testa di scansione AFM (non disegnato qui). Quando la testina di scansione si trova su una superficie livellata, il cantilever è orientato verticalmente come mostrato nel disegno. Circa 2 colla biocompatibile ll può essere aggiunto alla punta del cantilever con una micro-pipetta. Fare clic qui per visualizzare una versione più grande di questa figura.
- Forza spettroscopia dell'interazione cellulare T a coppia singola/dendritica
NOTA: Per sondare le interazioni tra celle e celle, è necessario un AFM con un intervallo z maggiore del convenzionale 10-15 m per separare completamente le due celle. L'AFM utilizzato qui ha un intervallo di 100 m, che è adeguato per separare la cella T dalla cella dendritica dopo il contatto cella/cellula.- Posizionare la cella T collegata sopra una cella DC2.4 separata spostando lo stage campione e/o la testina di scansione (vedere la Figura 2).
- Impostare i parametri appropriati e eseguire la spettroscopia della forza.
NOTA: in genere vengono utilizzate le seguenti impostazioni chiave: Setpoint 0,5 nN, Pulling Length 50 m, velocità costante di movimento, Estendi velocità 5 m/s, Tempo di contatto 10 s, Forza costante modalità di ritardo. Per ogni coppia T-DC vengono raccolte 20 ripetizioni di curve di forza e per un'ulteriore analisi vengono utilizzate almeno 14 curve di forza. - Montare un nuovo sbalzo pulito, calibrarlo in acqua pura come nel passo 1.5.3, e tornare allo stesso campione di cellule T-DC per ripetere i passaggi 1.6 e 1.7 per una coppia T-DC diversa. Sondare almeno 5 paia per ogni condizione.
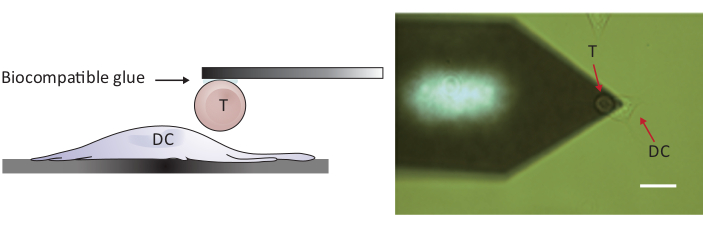
Figura 2: Configurazione sperimentale del probe forzato tra una singola cella T e DC. (A) Disegno schematico della configurazione sperimentale in cui una cellula T attaccata al cantilever viene portata a un DC coltivato sul substrato per il sondaggio forzato. (B) Immagine a campo luminoso di uno sbalzo a sbalzo a celle T e di un DC. Barra della scala, 20 m. Fare clic qui per visualizzare una versione più grande di questa figura.
2. funzionalizzazione a sbalzo con perline singole in polistirolo
- Preparazione di perline singole
- Diluire la sospensione di scorte di 6 m di perline di polistirolo in 100% etanolo.
NOTA: La concentrazione di soluzione di perline diluite dovrebbe essere sufficientemente bassa da essere aggiunta a una superficie in vetro, le singole perle sono ben separate senza un significativo clustering dopo l'evaporazione del solvente. - Pulire la copertura di vetro di 24 mm con etanolo e rimuovere qualsiasi polvere da N2 flusso d'aria.
- Montare il coperchio di vetro pulito su un gruppo di camere campione e mettere l'assemblaggio al microscopio.
- Mettere una goccia di perline diluite soluzione sul lato sinistro, ma vicino al centro della coverslip (vedi Figura 3) e controllare la spaziatura tra le perline dopo l'evaporazione del solvente in campo luminoso sotto il microscopio con un obiettivo 20x. Procedere al passo successivo se le singole perline sono ben separate.
- Immergere una punta di micropipette o uno stuzzicadenti in una colla epossidica ben miscelata e quindi trasferire una piccola quantità di tale colla in tre punti separati con successivi tocchi delicati sul lato destro ma vicino al centro del coperchio.
NOTA: le tre macchie di colla devono essere allineate verticalmente (vedere la figura3). L'ultimo punto con il minor numero di collante verrà utilizzato in seguito.
- Diluire la sospensione di scorte di 6 m di perline di polistirolo in 100% etanolo.
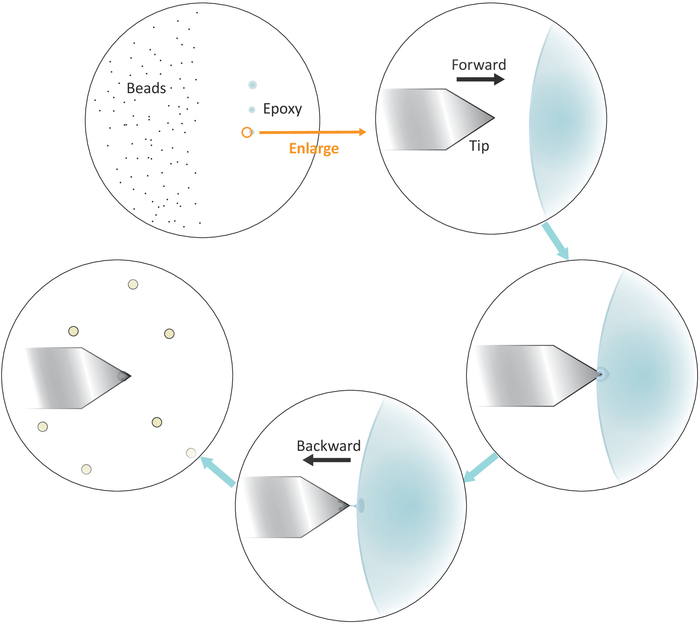
Figura 3: Rappresentazione schematica del flusso di lavoro per la funzionalizzazione delle perline singole sul sbalzo. Ben separati micron-dimensioni sono preparati sul lato sinistro del substrato e una piccola quantità di colla epossidica viene trasferita sul lato destro del substrato attraverso 3 tocchi delicati successivi, con conseguente 3 macchie di colla. Solo l'ultimo punto con la minima quantità di colla (indicato da un cerchio) viene utilizzato per rivestire l'estremità dello sbalzo. Avvicinati allo sbalzo nella colla da sinistra e poi sposta il cantilever all'indietro una volta immerso nella colla per confinare la colla all'estremità del cantilever. Portare il tallone bersaglio sotto il sbalzo e allinearli correttamente prima di effettuare un contatto fermo (in genere 2-5 nN) per l'adesivo del tallone. Quando il tallone è funzionalizzato con successo sul cantilever, un nuovo cantilever può essere montato per iniziare un nuovo ciclo di funzionalizzazione. Fare clic qui per visualizzare una versione più grande di questa figura.
- Preparazione a sbalzo AFM
- Montare uno sbalzo senza punta pulito alla testa di scansione AFM.
- Calibrare questo cantilever nell'aria con una superficie pulita per ottenere la costante a molla.
- Attaccando singole perline al cantilever
- Posizionare la punta a sbalzo sul bordo sinistro dell'ultimo punto di colla epossidica, come illustrato nella Figura 3.
- Portare lo sbalzo vicino alla colla lentamente abbassando i motori stepper con piccole dimensioni passo.
- Tirare il sbalzo via rapidamente dalla colla lateralmente spostando la testa di scansione AFM all'indietro (a sinistra) manualmente una volta che la punta è immersa nella colla.
NOTA: Assicurarsi che solo una piccola quantità di colla aderisca alla fine della punta. Se c'è una colla eccessiva sulla punta, è possibile ridurre la quantità di colla toccandoseguita seguita facendo scorrere la punta su una superficie vuota. - Spostare la punta a sbalzo sopra un singolo tallone ben isolato.
- Avvicinarsi al cantilever al singolo tallone lentamente e fare un contatto fermo con il tallone (come indicato dallo spostamento della posizione del raggio laser nel fotodetector corrispondente ad un tipico intervallo di forza di 2-5 nN) per circa 10 s durante il quale una regolazione fine del t posizionamento ip lateralmente aiuterà a individuare meglio il tallone alla fine della punta. Ritirare la punta alla fine del contatto.
NOTA: La scomparsa del tallone dal piano focale originale indica un evento aderente di successo. - Smontare il sbalzo modificato perline con attenzione e conservarlo in una scatola a sbalzo durante la notte per la completa solidificazione della colla.
- L'imaging a fluorescenza della risposta cellulare del macrofago a una singola perla consegnata dall'AFM.
NOTA: L'imaging di fluorescenza è stato eseguito su un microscopio a fluorescenza totale di tipo obiettivo fatto in casa sulla base di un supporto commerciale al microscopio. Questo sistema di imaging è dotato di 4 sorgenti laser (405 nm, 488 nm, 561 nm, 647 nm), un visualizzatore di splitter per il rilevamento a due colori e un dispositivo accoppiato a carica (EMCCD) che moltiplica gli elettroni per l'imaging a campo largo.- Coltivare le cellule RAW264.7 su una vetrina di vetro a 37 gradi centigradi in una camera umidificata di COdel 5%.
- Transfect Moesin-EGFP e PLC-PH-mCherry a celle RAW264.7 utilizzando un kit di trasfezione (vedi Tabella dei materiali) secondo il protocollo del produttore per visualizzare fluorescente Moesin e fosfatilinositol 4,5-bisphosphates (PIP2) molecole rispettivamente.
NOTA: Moesin ha un motivo ITAM che può attivare Syk, un giocatore chiave in fagocitosi. PIP2 è noto per reclutare Moesin nella membrana cellulare. - Posizionare il coperchio di vetro con le celle su un assieme camera campione e montare l'assieme sullo stadio campione AFM.
- Montare lo sbalzo modificato per tallone sulla testa di scansione AFM.
- Eseguire una curva di forza in un'area vuota e calibrare la forza con la sensibilità di questa curva e la costante di molla misurata nel passaggio 2.2.2.
- Trova una cella ben isolata con intensità di fluorescenza adeguate sia nei canali verdi (Moesin-EGFP) che in rosso (PLC-PH-mCherry) con eccitazioni 488/561 nm.
- Consegnare il tallone nudo in polistirolo da 6 m con AFM sulla superficie cellulare con 1 nN forza costante e 500 s tempo di contatto.
- Registrare serie di immagini a fluorescenza della cella a contatto con il tallone per l'analisi (in genere 10 fotogrammi/s).
NOTA: Per ridurre il fotosbiancamento dei fluorofori, è necessario utilizzare un potere di eccitazione relativamente basso per la ricerca delle cellule di interesse. Inoltre, può essere impiegato uno schema di eccitazione intermittente per prolungare le tracce del tempo di fluorescenza se la dinamica delle risposte cellulari è su una scala temporale lenta.
Risultati
La figura 4A mostra le tipiche curve di distanza della forza dall'interazione di legame tra cella a T singola e single-DC in un ciclo di avvicinamento-retratto. La curva rosso chiaro è la curva di estensione e quella rossa scura è la curva di retrazione. Poiché la curva di estensione viene in genere utilizzata per l'indentazione o l'analisi della rigidità, qui si tratta solo della curva di retrazione per l'adesione cellulare. Il valore minimo (il cerchio ...
Discussione
La spettroscopia a forza singola basata su AFM si è evoluta per essere un potente strumento per affrontare le proprietà biofisiche delle cellule viventi. Per tali applicazioni, il cantilever deve essere funzionalizzato correttamente al fine di sondare interazioni o proprietà specifiche sulle cellule di interesse. Qui, i metodi per l'accoppiamento di una singola cellula T e di un singolo tallone di dimensioni micron al cantilever senza punta sono descritti rispettivamente. Per attaccare una singola cellula T al cantile...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è supportato dal National Natural Science Foundation of China General Program (31370878), dal State Key Program (31630023) e dal Innovative Research Group Program (81621002).
Materiali
| Name | Company | Catalog Number | Comments |
| Material | |||
| 10 μl pipette tip | Thermo Fisher | 104-Q | |
| 15 ml tube | Corning | 430791 | |
| 6 cm diameter culture dish | NALGENE nunc | 150462 | |
| 6-well culture plate | JET | TCP011006 | |
| AFM Cantilever | NanoWorld | Arrow-TL1-50 | tipless cantilever |
| β-Mercaptoethanol | Sigma | 7604 | |
| Biocompatible glue | BD Cell-Tak | 354240 | |
| CD4+ T cell isolation Cocktail | STEMCELL | 19852C.1 | |
| DC2.4 cell line | A gift from K. Rock (University of Massachusetts Medical School, Worcester, MA) | ||
| Dextran-coated magnetic particles | STEMCELL | SV30010 | |
| EDTA | GENEray | Generay-E1101-500 ml | |
| Epoxy | ERGO | 7100 | |
| Ethanol | twbio | 00019 | |
| FBS | Ex Cell Bio | FSP500 | |
| FcR blocker | STEMCELL | 18731 | |
| Glass coverslip | local vender (Hai Men Lian Sheng) | HX-E37 | 24mm diameter, 0.17mm thinckness |
| Glass slides | JinTong department of laboratory and equipment management, Haimen | N/A | customized |
| H2O2 (30%) | Sino pharm | 10011218 | |
| H2SO4 | Sino pharm | 80120892 | |
| HEPES | Sigma | 51558 | |
| Magnet | STEMCELL | 18000 | |
| Mesh nylon strainer | BD Falcon | REF 352350 | |
| Moesin-EGFP | N/A | cloned in laboratory | |
| Mouse CD25 Treg cell positive isolation kit | STEMCELL | 18782 | Component: FcR Blocker,Regulatory T cell Positive Selection Cocktail, PE Selection Cocktail, Dextran RapidSpheres, |
| Mouse CD4+ Tcell isolation kit | STEMCELL | 19852 | Component:CD4+T cell isolation Cocktail, Streptavidin RapidSpheres, Rat Serum |
| NaOH | Lanyi chemical products co., LTD? Beijing | 1310-73-2 | |
| PBS | Solarbio | P1022-500 | |
| PE selection cocktail | STEMCELL | 18151 | |
| Penicillin-Streptomycin | Hyclone | SV30010 | |
| PLCδ-PH-mCherry | Addgene | 36075 | |
| Polystyrene microspheres 6.0μm | Polysciences | 07312-5 | |
| polystyrene round bottom tube | BD Falcon | 352054 | |
| Rat serum | STEMCELL | 13551 | |
| RAW264.7 | ATCC | ||
| Recombinant Human Interleukin-2 | Peprotech | Peprotech, 200-02-1000 | |
| Red blood cell lysis buffer | Beyotime | C3702 | |
| Regulatory T cell positive selection cocktail | STEMCELL | 18782C | |
| RPMI 1640 | Life | C11875500BT | |
| Sample chamber | Home made | ||
| Streptavidin-coated magnetic particles | STEMCELL | 50001 | |
| Transfection kit | Clontech | 631318 | |
| Trypsin 0.25% EDTA | Life | 25200114 | |
| Tweezers | JD | N/A | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 20x objective NA 0.8 | Zeiss | 420650-9901 | Plan-Apochromat |
| Atomic force microscope | JPK | cellHesion200 | |
| Centrifuge | Beckman coulter | Allegra X-12R | |
| Fluorescence imaging | home-made objective-type total internal reflection fluorescence microscop based on a Zeiss microscope stand | ||
| Humidified CO2 incubator | Thermo Fisher | HERACELL 150i | |
| Inverted light microscope | Zeiss | Observer A1 manual |
Riferimenti
- Benoit, M., Gabriel, D., Gerisch, G., Gaub, H. E. Discrete interactions in cell adhesion measured by single-molecule force spectroscopy. Nature Cell Biology. 2 (6), 313-317 (2000).
- Chen, J., et al. Strong adhesion by regulatory T cells induces dendritic cell cytoskeletal polarization and contact-dependent lethargy. Journal of Experimental Medicine. 214 (2), 327-338 (2017).
- Liu, L., et al. Mechanotransduction-modulated fibrotic microniches reveal the contribution of angiogenesis in liver fibrosis. Nature Materials. 16 (12), 1252-1261 (2017).
- Mu, L. B., et al. A phosphatidylinositol 4,5-bisphosphate redistribution-based sensing mechanism initiates a phagocytosis programing. Nature Communications. 9, (2018).
- Qi, C., et al. Pathology-targeted cell delivery via injectable micro-scaffold capsule mediated by endogenous TGase. Biomaterials. 126, 1-9 (2017).
- Muller, D. J., Helenius, J., Alsteens, D., Dufrene, Y. F. Force probing surfaces of living cells to molecular resolution. Nature Chemical Biology. 5 (6), 383-390 (2009).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy: a nanoscopic window on the cell surface. Trends in Cell Biology. 21 (8), 461-469 (2011).
- Radotic, K., et al. Atomic force microscopy stiffness tomography on living Arabidopsis thaliana cells reveals the mechanical properties of surface and deep cell-wall layers during growth. Biophysics Journal. 103 (3), 386-394 (2012).
- Kuznetsova, T. G., Starodubtseva, M. N., Yegorenkov, N. I., Chizhik, S. A., Zhdanov, R. I. Atomic force microscopy probing of cell elasticity. Micron. 38 (8), 824-833 (2007).
- Scheuring, S., Dufrene, Y. F. Atomic force microscopy: probing the spatial organization, interactions and elasticity of microbial cell envelopes at molecular resolution. Molecular Microbiology. 75 (6), 1327-1336 (2010).
- Berdyyeva, T. K., Woodworth, C. D., Sokolov, I. Human epithelial cells increase their rigidity with ageing in vitro: direct measurements. Physics in Medicine and Biology. 50 (1), 81-92 (2005).
- Sokolov, I., Dokukin, M. E., Guz, N. V. Method for quantitative measurements of the elastic modulus of biological cells in AFM indentation experiments. Methods. 60 (2), 202-213 (2013).
- Bozna, B. L., et al. Binding strength and dynamics of invariant natural killer cell T cell receptor/CD1d-glycosphingolipid interaction on living cells by single molecule force spectroscopy. Journal of Biological Chemistry. 286 (18), 15973-15979 (2011).
- Flach, T. L., et al. Alum interaction with dendritic cell membrane lipids is essential for its adjuvanticity. Nature Medicine. 17 (4), 479-487 (2011).
- Ng, G., et al. Receptor-independent, direct membrane binding leads to cell-surface lipid sorting and Syk kinase activation in dendritic cells. Immunity. 29 (5), 807-818 (2008).
- Helenius, J., Heisenberg, C. P., Gaub, H. E., Muller, D. J. Single-cell force spectroscopy. Journal of Cell Science. 121 (11), 1785-1791 (2008).
- Litvinov, R. I., Shuman, H., Bennett, J. S., Weisel, J. W. Binding strength and activation state of single fibrinogen-integrin pairs on living cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (11), 7426-7431 (2002).
- Evans, E., Ritchie, K., Merkel, R. Sensitive Force Technique to Probe Molecular Adhesion and Structural Linkages at Biological Interfaces. Biophysics Journal. 68 (6), 2580-2587 (1995).
- Lamprecht, C., Hinterdorfer, P., Ebner, A. Applications of biosensing atomic force microscopy in monitoring drug and nanoparticle delivery. Expert Opinion on Drug Delivery. 11 (8), 1237-1253 (2014).
- Charras, G. T., Horton, M. A. Single cell mechanotransduction and its modulation analyzed by atomic force microscope indentation. Biophysics Journal. 82 (6), 2970-2981 (2002).
- Sun, M. Z., et al. Multiple membrane tethers probed by atomic force microscopy. Biophysics Journal. 89 (6), 4320-4329 (2005).
- Yan, J. C., Liu, B., Shi, Y., Qi, H. Class II MHC-independent suppressive adhesion of dendritic cells by regulatory T cells in vivo. Journal of Experimental Medicine. 214 (2), 319-326 (2017).
- Hao, J. J., et al. Phospholipase C-mediated hydrolysis of PIP2 releases ERM proteins from lymphocyte membrane. Journal of Cell Biology. 184 (3), 451-462 (2009).
- Rodriguez, R. M., et al. Lymphocyte-T Adhesion to Fibronectin (Fn) - a Possible Mechanism for T-Cell Accumulation in the Rheumatoid Joint. Clinical and Experimental Immunology. 89 (3), 439-445 (1992).
- Kimura, A., Ersson, B. Activation of Lymphocytes-T by Lectins and Carbohydrate-Oxidizing Reagents Viewed as an Immunological Recognition of Cell-Surface Modifications Seen in the Context of Self Major Histocompatibility Complex Antigens. European Journal of Immunology. 11 (6), 475-483 (1981).
- Miller, K. The Stimulation of Human Lymphocyte-B and Lymphocyte-T by Various Lectins. Immunobiology. 165 (2), 132-146 (1983).
- Vitte, J., Pierres, A., Benoliel, A. M., Bongrand, P. Direct quantification of the modulation of interaction between cell- or surface-bound LFA-1 and ICAM-1. Journal of Leukocyte Biology. 76 (3), 594-602 (2004).
- Beaussart, A., et al. Quantifying the forces guiding microbial cell adhesion using single-cell force spectroscopy. Nature Protocols. 9 (5), 1049-1055 (2014).
- Shu, F., et al. Cholesterol Crystal-Mediated Inflammation Is Driven by Plasma Membrane Destabilization. Frontiers in Immunology. 9, (2018).
- Hosseini, B. H., et al. Immune synapse formation determines interaction forces between T cells and antigen-presenting cells measured by atomic force microscopy. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17852-17857 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon