Method Article
التعبير، تنقية، تبلور، واختبارات إنزيم من البروتينات التي تحتوي على مجال الهيدرولاز اتاتس
In This Article
Summary
التعبير وتنقية البروتينات التي تحتوي على مجال هيدرولاز fumarylacetoacetatee مع أمثلة (التعبير في E. القولونية، FPLC). وتستخدم البروتينات النقية لإنتاج التبلور والأجسام المضادة وتستخدم في اختبارات الإنزيم. يتم تقديم اختبارات ضوئية مختارة لعرض وظائف متعددة من FAHD1 كما ديكاربوكسيلاز أوكسالوأسيتات وأسيلففات هيدرولاز.
Abstract
البروتينات التي تحتوي على حقول هيدرولاز (فهد) هي من أفراد الأسرة الفائقة التابعة لـ FAH في الإيكريوتيات. تعرض إنزيمات هذه العائلة الفائقة بشكل عام وظائف متعددة، تتضمن بشكل رئيسي آليات هيدرولاز وديكاربوكسيلاس. يعرض هذا المقال سلسلة من الطرق المتتالية للتعبير عن بروتينات فهد وتنقيتها، وأساساً ببروتين فهد 1 (فهد 1) تقويم العظام بين الأنواع (الإنسان، الفأر، الديدان الخيطية، النباتات، إلخ). والأساليب المغطاة هي تعبير البروتين في E. coli، والكروماتوغرافيا التقارب ، والكروماتوغرافيا التبادل الأيون ، والترشيح جل إعدادي والتحليلي ، تبلور ، وانعراج الأشعة السينية ، واختبارات قياس ضوئي. بروتين مركز عالي النقاء (98٪ قد تستخدم لبلورة أو إنتاج الأجسام المضادة. البروتينات ذات الجودة المماثلة أو الأقل قد تستخدم في اختبارات الإنزيم أو تستخدم كمستضدات في أنظمة الكشف (غرب-Blot، ELISA). في مناقشة هذا العمل، تم تحديد آليات الأنزيمية من FAHD1 لوصف هيدرولاز وdecarboxylase ثنائية الأداء في مزيد من التفاصيل.
Introduction
وfumarylacetoacetate hydrolase (FAH)1,2 عائلة فائقة من الإنزيمات يصف مجموعة من الإنزيمات التي تشترك في الحفاظ على نطاق حفية الحفازة 3,4,5,6 , 7 , 8 , 9 , 10. على الرغم من مركزها الحفاز المشترك، هذه الإنزيمات متعددة الوظائف، وتوجد معظمها في prokaryotes، حيث يتم استخدامها لكسر المركبات المستخرجة من مصادر الكربون المعقدة3. تم التعرف على ثلاثة أفراد فقط من هذه العائلة في eukaryotes حتى الآن: الاسم الذي يعطي FAH2،وكذلك البروتين الذي يحتوي على نطاق FAH 1 (FAHD1)11,12,13,14 15 والبروتين المحتوي على النطاق 2 من فاه (فهد 2). وقد ارتبط استنفاد FAHD1 مع ضعف التنفس الميتوكوندريا13،16 والمرتبطة بنوع قابل للعكس من النمط الظاهري الشيخوخة الخلوية14 التي ترتبط المحتملة المتوسطة أوجه القصور في نظام نقل الإلكترون. وقد أصبحت المتغيرات القابلة للدواء التي يمكن أن تكون ذات أهمية كبيرة هي HUMAN FAHD1 وتقويمها في الأنظمة النموذجية (الماوس، الخيطية، خطوط الخلايا السرطانية، النباتات، إلخ)، فضلاً عن متغيرات الطفرة التي تم اختيارها. لهذا البحث، البروتين المؤتلف في مستويات عالية من النقاء، فضلا عن معلومات عن الآليات الحفازة الموجهة من قبل هياكل الكريستال والأجسام المضادة الانتقائية أمر حيوي.
تصف هذه المخطوطة طرق التعبير عن بروتين فهد في القولونية،والكروماتوغرافيا التقاربية، والكروماتوغرافيا التبادلية للأيونات، وهطول الأمطار كبريتات الأمونيوم، والترشيح الجل إعدادي والتحليلي، والتبلور، وانعف الأشعة السينية، و الاختبارات الضوئية. الغرض من الأساليب والبروتوكولات المذكورة هنا هو توفير التوجيه للعلماء العاملين في مجالات متنوعة مثل علم الجراثيم والبيولوجيا النباتية، فضلا عن الدراسات الحيوانية والبشرية، لتمييز أعضاء الأسرة الكبرى من أجل الصحة، بما في ذلك يجب أن تصبح ذات الصلة في مجال معين. البروتوكولات المذكورة هنا قد توفر دعما قيما للمشاريع التي تهدف إلى توصيف أفراد الأسرة الفائقة الأخرى prokaryotic أو eukaryotic FAH.
الأساس المنطقي وراء الأساليب الموصوفة هنا هو حقيقة أنه لوصف البروتينات سيئة الوصف (على وجه الخصوص، الإنزيمات الأيضية غير معروفة الأهمية الفسيولوجية)، والنهج للبدء مع البروتينات المؤتلفة النقية يسمح لل تطوير أدوات بحثية لا تقدر بثمن وعالية الجودة مثل مستحضرات الإنزيم النشطة في المختبر، والأجسام المضادة عالية الجودة، ومثبطات دوائية قوية ومحددة للإنزيمات المختارة. الطرق الموصوفة تتطلب بروتين سريع السائل الكروماتوغرافيا (FPLC) وأشعة إكس البلورات. ويمكن العثور على طرق بديلة (مثل التعبير عن البروتين دون الاستقراء الكيميائي، أو لعرض تنقية البروتين عن طريق التنقية بعد المعالجة الحرارية تليها إزالة الملحة والكروماتوغرافيا استبعاد حجم)، في مكان آخر17. في حين أن مجموعة أوسع من الأساليب المتاحة للتعبير وتنقية من الإنزيمات الأسرة الفائقة فاه2,7,9,17,18, هذا العمل يركز على التعبير و تنقية بروتينات فهد على وجه الخصوص.
في قسم المناقشة من هذه المخطوطة، تم وصف الآليات الحفازة المحددة لبروتين FAHD1 (هيدرولاز، ديكاربوكسيلاس)15 بمزيد من التفصيل، من أجل إظهار الطابع الكيميائي للتفاعلات المحفزة. البيانات التي تم الحصول عليها استنادا إلى العمل السابق7،15،18 (PDB: 6FOG، PDB: 6FOH) يعني نشاط ثالث من الإنزيم كما الكيتو ايزول إيزوماراز.
Protocol
1. التعبير عن بروتينات فهد في الإشريكية القولونية المختصة
- تحويل القولونية مع ناقلات للتعبير عن بروتين فهد
ملاحظة: يتم تلخيص الخطوات التي تمت مناقشتها في القسم التالي في الرسم التخطيطي في الشكل 1A، B. وينطبق نفس البروتوكول على أي بروتين من نوع فهد، بما في ذلك المتغيرات المتحولة. ويمكن الحصول على هذه المتغيرات عن طريق تقنيات التمويجين الموجه من الموقع وPCR19 (مثل ثنائي الوجهين SOE PCR20)من cDNA البرية من النوع.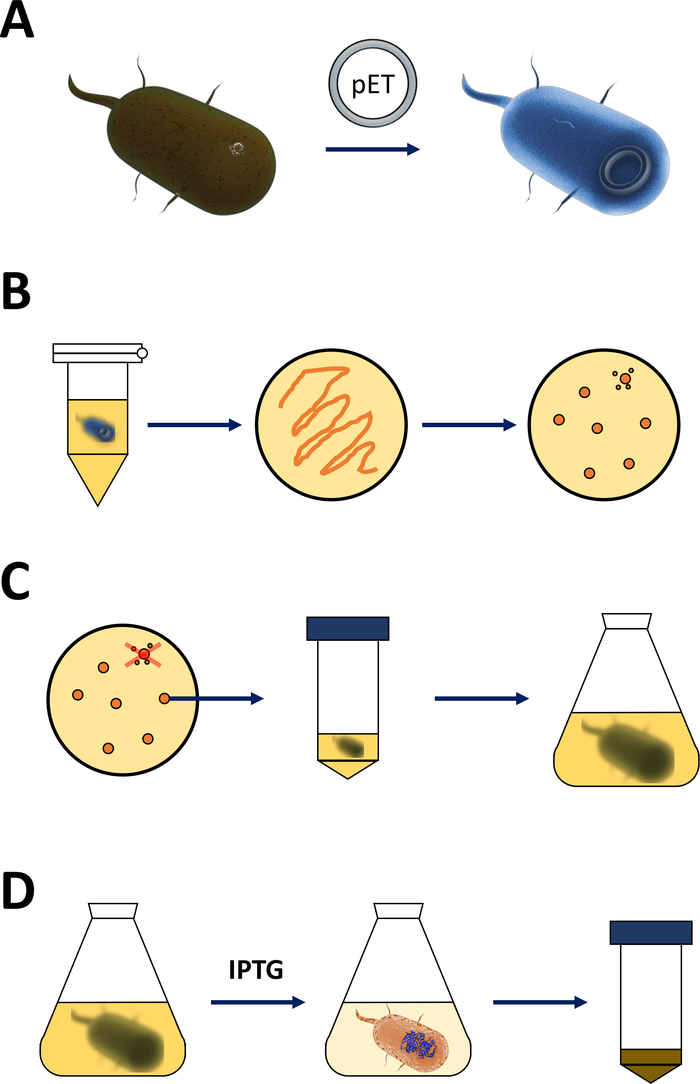
الشكل 1 تضخيم الإشريكية القولونية وتحريض التعبير البروتيني:
(أ) إدخال متجه PET إلى بكتيريا BL21(DE3) PLysS E. coli المختصة، الموصوفة في القسم 1. (ب) بروتوكول الصدمة الحرارية والطلاء من PET تحولت E. القولونية البكتيريا، ووصف في الخطوة 1 من البروتوكول. يتم طلاء البكتيريا المحولة على لوحات أجار LB مع المضادات الحيوية للاختيار. (ج) تضخيم PET تحويل البكتيريا القولونية E. ، والموصوفة في القسم 1. يتم انتقاؤها المستعمرات من لوحة أجار LB وتضخيمها في المتوسط مغذية (LB أو NZCYM) حتى وصلت الكثافة البكتيرية عتبة تجريبية من 0.4. (د) تحريض التعبير البروتيني عن طريق نظام DE3-IPTG-pET، الموصوف في القسم 1 والمبين في الشكل 2. يبدأ إنتاج البروتين من خلال تطبيق IPTG الكيميائية. في نهاية القسم 1، يتم حصاد بيليه البكتيرية التي تحتوي على البروتين. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.- الحصول على كفاءة BL21(DE3) plysS E. القولونية البكتيريا وناقلات التعبير PET (انظر جدول المواد). يفضل اختيار متجه PET الذي يقوم أيضاً بترميز علامة له -محطة Nأو علامة التقاط ذات صلة لتسهيل خطوات التنقية التالية.
- الحصول على cDNA من البروتين فهد من اختيار وإدراجه في موقع الاستنساخ النشط من ناقلات التعبير PET، في ما بين المروج T7 وT7 مواقع المنهي، على التوالي.
- بعد نجاح تضخيم البلازميد والتحقق [عن طريق التسلسل من قبل مورد تجاري (يمكن استخدام التمهيديات T7 مع نظام pET للراحة: T7 المروج، التمهيدي إلى الأمام: TAATACGACTCACTATAGGG؛ T7 المنهي، التمهيدي العكسي: GCTAGTTATTCTCAGCGG)]،] إدراج 5-10 نانوغرام من البلازميد في 100 ميكرولتر من BL21 (DE3) plysS E. القولونية البكتيريا على الجليد. لا يستنشق صعودا وهبوطا، ولكن اضغط قليلا على أنبوب مع من أجل خلط المحتوى.
- الحفاظ على البكتيريا على الجليد لمدة 30 دقيقة، والتنصت بلطف على أنبوب كل بضع دقائق.
- تسخين جهاز التدفئة أو حمام مائي إلى 42 درجة مئوية (بالضبط). وضع الأنبوب الذي يحتوي على البكتيريا في الجهاز والاحتفاظ بها لمدة 90 ق (بالضبط). وضعها على الجليد على الفور (الشكل 1A).
- بعد 5-10 دقيقة على الجليد، أضف 600 ميكرولتر من الوسط NCZYM (انظر جدولالمواد) ووضع الأنبوب في حاضنة البكتيريا. هز الأنبوب بسرعة متوسطة على طول اتجاه الهز في 37 درجة مئوية لمدة ساعة واحدة.
- لوحة 200 μL من الثقافة البكتيرية على لوحة 10 سم LB-أجار (انظر جدولالمواد), تحتوي على اختيار المضادات الحيوية من اختيار [على سبيل المثال, واحد محدد لBL21(DE3) plysS المقاومة (chloramphenicol), واحد للمقاومة مشفرة على متجه PET (كانامايسين أو أمبيسلين، الشكل 1B)].
- زراعة البكتيريا على لوحة LB-أجار في حاضنة بكتيرية في 37 درجة مئوية بين عشية وضحاها.
- التعبير عن بروتينات فهد عن طريق الحث IPTG
ملاحظة: يتم تلخيص الخطوات الأولى التي تمت مناقشتها في القسم التالي كرسم تخطيطي في الشكل 1C، D. ويلخص الشكل 2نظام التعبير T7 عن طريق الجمع بين الكاسيت البكتيري DE3 ونظام ناقلات PET .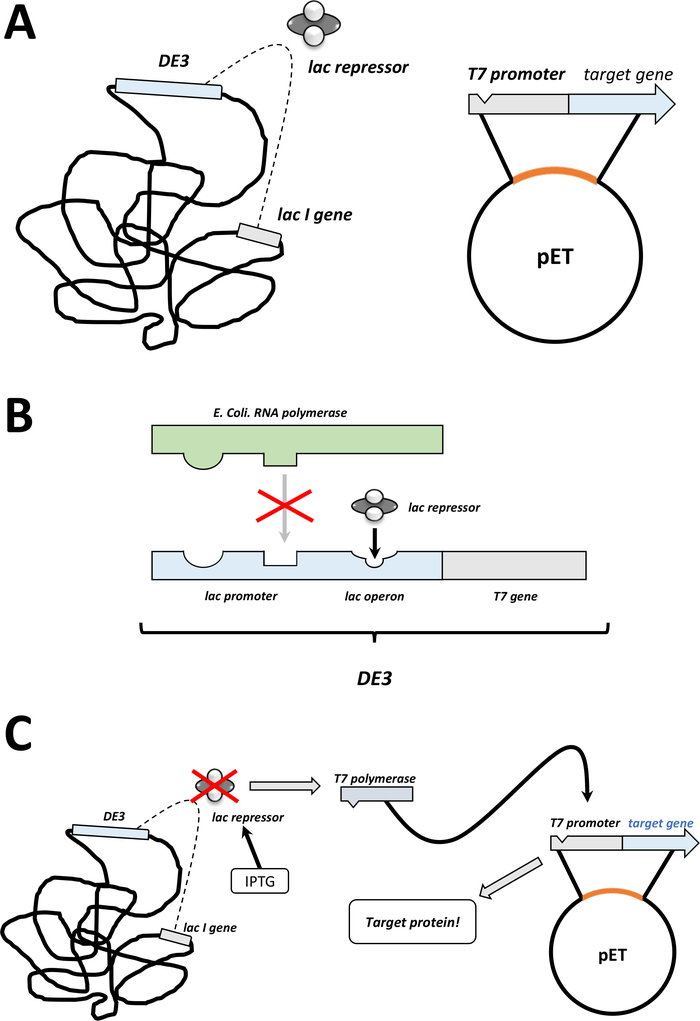
الشكل 2 وأوضح دي 3 كاسيت / pET ناقلات نظام مزدوج.
(أ) الجينوم رسمها من ناقلات PET تحويل BL21 (DE3) plysS E. القولونية البكتيريا. يحمل الجينوم البكتيري الأصلي كاسيت DE3 (انظر اللوحة B)، فضلا عن جين لاك الذي يعبر باستمرار عن وحدات قمع اللاك. ناقلات pET غير الأم يحمل الجينات البروتين إدراجها بين المروج البوليميراز T7 وتسلسل المنهي. مزيد من التفاصيل في لوحة B. (B) وDE3 كاسيت من الجينوم البكتيريالأصلي ترميز المعلومات عن البوليميراز T7 من حيث E. القولونية RNA البولميراز أوبيرون. هذا البروتين، ومع ذلك، لا يتم التعبير عن لأن وحدة قمع لاك يمنع البروتين البوليميراز RNA من ملزمة. وبالتالي لا يتم التعبير عن البوليميراز T7 ولا يتم التعبير عن أي بروتينخارجي. (ج) تطبيق IPTG الكيميائية(جدول المواد) يشوه هيكل وحدات كبت اللاك ويمنعها من الربط إلى شريط DE3. ونتيجة لذلك، يمكن الآن ربط البوليميراز الحمض النووي الريبي إلى الكاسيت، الذي يتم التعبير عن البوليميراز T7، كما هو البروتين الخارجي في نهاية المطاف. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.- بعد تشكيل مستعمرة ناجحة، واختيار مستعمرة واحدة واحدة (بدون أي مستعمرات الأقمار الصناعية) وتفريقه في 5 مل من NZCYM أو LB المتوسطة مع المضادات الحيوية، التي تم اختيارها كما كان من قبل (الخطوة 1.1.7). الثقافة في الحاضنة البكتيرية في 37 درجة مئوية بين عشية وضحاها (الشكل 1C).
- بعد نمو البكتيريا بنجاح، تضخيم البكتيريا في 250 مل، 500 مل، أو 1 ل دفعات متوسطة، اعتمادا على الطلب من كمية البروتين.
- مناسبة لحجم، وتطبيق المضادات الحيوية المختارة كما فعلت في الخطوة 1.1.7 وإضافة حوالي 1٪ - 2 ٪ من البكتيريا الكثيفة ما قبل الثقافة (أي 2.5-5.0 مل إلى 250 مل حجم المتوسطة، الخ). خذ عينة لاستخدامها في الخطوة 1.2.5 (1 مل أو أكثر) وتحقق من الكثافة البصرية (OD) في 600 نانومتر. البكتيريا في الحاضنة البكتيرية عند 37 درجة مئوية لمدة 2-3 ساعة (الشكل1C).
- بعد 2-3 ح، ارسم عينة لتحليل القياس الضوئي. إذا كان OD في 600 نانومتر قد وصلت إلى 0.4، وتطبيق 200 ميكرومتر تصل إلى 1 م أيزوبروبيل-β-D-ثيوغالاكتوبيرونسيد (IPTG، انظر جدول المواد).
ملاحظة: القيمة الفعلية تجريبية لكل متغير من بروتين أو نقطة الطفرة، حيث يكون 1 mM IPTG هو الحد الأقصى الذي ينبغي تطبيقه. وهذا يحفز التعبير البروتين (الشكل 1D, الشكل 2C). - بعد 3-5 ساعات أخرى في الحاضنة البكتيرية في 37 درجة مئوية، يتم استنفاد التعبير البروتين.
ملاحظة: راجع قسم المناقشة للحصول على تعليقات على التحكم في درجة الحرارة. لا ينصح أطول من 5 ح من الهز بعد الحث. خذ عينة للاستخدام في الخطوة 1.2.5 (1 مل أو أكثر) وتحقق من الكثافة البصرية (OD) في 600 نانومتر.- حصاد بيليه البكتيرية عن طريق الطرد المركزي في 5000 x ز لمدة 5 دقائق.
- تحقق من الحث عن طريق العيّنات الضوئية المسترجعة، التي تحمل اسم "-I" (قبل الحث) و"+I" (بعد الحث). بعد التمركز وإعادة تعليق بيليه البكتيرية، وتحليل العيّنات اثنين من SDS-PAGE عن طريق تحميل نفس الكمية من البروتين الكلي.
ملاحظة: يجب أن تعرض العينة "+I" نطاقًا قويًا مرتبطًا بالوزن الجزيئي للبروتين المختار، في حين أن عينة "-I" يجب ألا تحتوي على هذه الفرقة. انخفاض مستوى الاستقراء هو مشكلة شائعة لإنتاج البروتينات، ولكن مستوى البروتين التعبير عنه غالبا ما تكون كافية للخطوات التالية. مستوى التعريفي العالي هو ميزة ولكن ليست إلزامية.
2. Lysis من الكريات البكتيرية والترشيح للحطام
- تعتمد على ما إذا كان البروتين المختار هو له- الموسومة أو غير الموسومة، حدد Ni-NTA تشغيل العازلة (له -الموسومة، انظر جدولالمواد) أو HIC الجليد الباردة تشغيل العازلة (غير الموسومة).
- لكل 250 مل من تعليق البكتيرية الأصلي، وتطبيق 5 مل من العازلة المحددة على بيليه البكتيرية (5 مل ل250 مل، 10 مل ل500 مل، الخ). إضافة 10 μL β-mercaptoethanol (β-ME) لكل 5 مل من العازلة التطبيقية. استخدام 10 مل باستور pipet لإجبار ميكانيكيا بيليه في التعليق عن طريق الخدش والأنابيب (تجنب تشكيل فقاعة الهواء في حين الأنابيب). في نهاية المطاف نقل كل من تعليق في أنبوب واحد 50 مل.
- يفضل سونيكات (6X لمدة 15 ق في قوة متوسطة) تعليق.
- جهاز طرد مركزي لمدة 30 دقيقة بسرعة عالية (10000 x g) عند 4 درجة مئوية. قم بتصفية النوافينت على التوالي مع وحدات الفلتر (مثل 0.45 ميكرومتر و0.22 ميكرومتر) على الجليد.
ملاحظة: اعتمادا على الخطوة المركزية السابقة، الترشيح مباشرة من خلال حجم المسام مرشح صغير قد تكون مملة وعادة ما يتطلب الترشيح قبل من خلال حجم المسام أكبر. يمكن إضافة DNAse للحصول على نتائج أفضل. - تخزين العينة على الجليد والمضي قدما على الفور مع إما القسم 3 أو 4، اعتمادا على ما إذا كان البروتين هو له-علامة أو غير الموسومة.
3. تنقية بروتينات فهد التي تحمل علامات ه باستخدام اللوني التقاربي ني-نتا
ملاحظة: ترتبط أيونات Ni2+ عبر حمض النتريلوتريا (NTA) براتنج أجاروز الذي يستخدم في الفصل اللوني التقاربي (كروماتوغرافيا أيون المعادن المتوقفة، IMAC، الشكل 3A). Poly-histidine الأحماض الأمينية العلامات ربط بقوة لهذا ني-مخلب, ويمكن فصل البروتينات له الموسومة من غالبية البروتينات المتبقية. وثمة بديل لإعداد أعمدة ني - إن تا الموصوفة هو استخدام أعمدة Ni-NTA المعبأة مسبقاً ونظام ا.م.م.
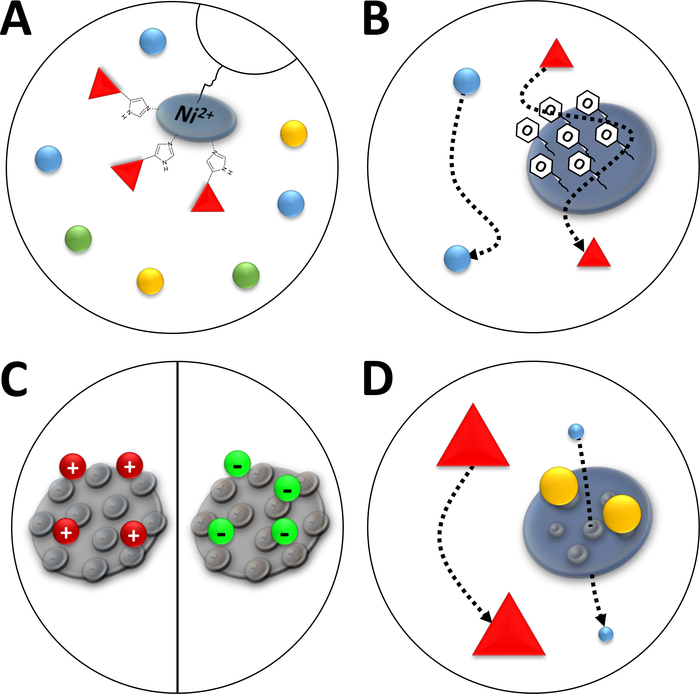
الشكل 3 رسم توضيحي لأنواع شائعة من الكروماتوغرافيا.
(أ) راتنج عمود من نوع Ni-NTA. وتحتفظ شركة NTA بأيونات النيكل ثنائية التكافؤ التي تستخدم من حيث الفصل اللوني المتجانس للأيونات المعدنية المتوقفة (IMAC). ويربط هذا الزخرفة بعلامات الهيستيدين المضلعة، ويمكن أن يُشار إليها بمادة الإيميدازول. (ب) الطلاء النموذجي لجزيئات السيليكا في الفصل اللوني لتفاعل الفينيل المسعور (HIC-phenyl). البروتينات المسعورة تتفاعل مع مواد الطلاء وتتأخر في هجرتها في حين أن الآخرين ليسوا كذلك. (ج) طلاء نموذجي من جزيئات السيليكا في الفصل اللوني التفاعل الأيوني. البروتينات المستقطبة والمشحونة تتفاعل مع مواد الطلاء وتتأخر في هجرتها في حين أن البعض الآخر لا. (د) راتنج هلام السيليكا في حجم استبعاد الكروماتوغرافيا (SEC). استناداً إلى المسام المحددة في مادة السيليكا، يمكن فصل البروتينات بحجمها (في تقريب أول المقابلة لكتلتها الجزيئية). تتخلل البروتينات الصغيرة مادة الأعمدة المسامية ومتخلفة، في حين تهاجر البروتينات الكبيرة بشكل أسرع حول الجزيئات المسامية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- انتقل من الخطوة 2.5 (أي أن البروتين في المخزن المؤقت Ni-NTA قيد التشغيل وتصفيتها من قبل 0.22 وحدات مرشح ميكروم على الجليد).
- إعداد عمود من البلاستيك أو الزجاج فارغة عن طريق غسل العمود فارغة وإرفاقه إلى التجنيب مستقرة. اختر حجم العمود اعتمادا على حجم تعليق البروتين.
- لكل 10 مل من تعليق البروتين، تطبيق 500 μL من الطين ني-NTA agarose في العمود (هز بشدة قبل الاستخدام). تطبيق الطين ببطء وdropwise على مرشح أسفل العمود باستخدام ماصة. دع العمود يستقر، والذي يستغرق بضع ثوان.
- ملء العمود تماما مع Ni-NTA تشغيل العازلة، وضمان عدم تعطيل راتنج الأغاروز. دع العازل يمر من خلال الجاذبية. يمكن تسريع العملية عن طريق تطبيق ضغط الإبهام على السائل (باستخدام غطاء أو قفاز وضغط الإبهام)، ولكن الحرص على عدم تشويه راتنج الأغاروز.
- تطبيق تعليق البروتين. كما كان من قبل، والسماح للعينة من خلال تشغيل من خلال الجاذبية. لا ينصح بتسريع هذه الخطوة باستخدام ضغط الإبهام، كما يتم تعزيز ربط البروتينات إلى العمود إذا كان معدل التدفق منخفضًا. جمع تدفق من خلال في أنبوب (جدول المواد).
- بعد أن تم تمرير العينة من خلال تعبئة العمود بأكمله مرة أخرى مع التخزين المؤقت تشغيل Ni-NTA. الحرص على عدم تعطيل راتنج الأجاروز. السماح للعينة من خلال تشغيل عن طريق الجاذبية، ولكن على النقيض من الخطوة السابقة، وتسريع العملية عن طريق ضغط الإبهام ينصح، كما التلوث المحتملة بسبب التفاعلات غير محددة قد تعطل تتعطل بهذه الطريقة. جمع محلول الغسيل في أنبوب. كرر هذه الخطوة.
- ضع وحدة الأشعة فوق البنفسجية الشفافة أسفل العمود وطبق 1 مل من العازل المؤقت للانتاوين. جمع العينة دون تطبيق أي ضغط الإبهام على الراتنج.
- تحقق من الكثافة البصرية (OD) للعينة عند 280 نانومتر مقابل عينة فارغة (أي، Ni-NTA eution buffer). على النحو الأمثل، تعرض العينة OD أكبر من 2.5. يدل أد أدناه 0.5 أنه لا يوجد كمية كبيرة من البروتين في العينة.
ملاحظة: كما هو موضح في قسم المناقشة، قد يكون من الضروري تكييف تركيزات الملح وimidazole من العازل الأوتيون لكل بروتين من نوع فهد بشكل فردي. - كرر الخطوات 3.1.7 و 3.1.8 حتى ينخفض OD أقل من 0.5. تجمع جميع العينات مع أعلى OD في أنبوب على الجليد.
- ابدأ مرة أخرى بالخطوة 3.1.4 باستخدام تدفق خلال الخطوة 3.1.5 كإدخال جديد لتكرار الخطوة 3.1.5. كرر هذه العملية حتى يعرض العينة الأولى التي تم تجميعها في الخطوة 3.1.6 OD أدناه 0.5.
ملاحظة: كما هو موضح في جزء استكشاف الأخطاء وإصلاحها من قسم المناقشة، قد ربط البروتينات له الموسومة بشكل غير كاف إلى ني2 +الراتنج. وفي هذه الحالات، يلزم تكرار هذه الخطوة أو الأساليب البديلة (مثل الفصل اللوني التبادلي للتبادل بين الأيونات). - أخذ عينات من جميع الكسور الوسيطة لتحليل SDS-PAGE.
- سوف البروتينات فهد في العازلة Ni-NTA الأوتيون يترسب عند تجميد وذوبان. لذلك، dialyze البروتين ضد حاجز مختلف (بين عشية وضحاها على الجليد، وذلك باستخدام 1 μL من DTT لكل 100 مل من العازلة غسيل الكلى). استخدام العازلة منخفضة الملح على أساس أي نوع من chromatography تبادل الأيون ينبغي أن يتم تنفيذها بعد هذه الخطوة. استخدام أنابيب السليلوز المشتركة مع قطع الوزن الجزيئي نموذجية من 14 كدا (جدولالمواد).
- بعد غسيل الكلى بين عشية وضحاها، ركز البروتين اختياريا ً باستخدام وحدات فلتر فائقة التركز. إجراء تحليل SDS-PAGE (12.5٪ تشغيل هلام، 4٪ هلام التراص) للتحقق من فقدان محتمل للبروتين، والإلوتين اتويتي غير كافية، ونقاء البروتين بشكل عام. إذا كان كل شيء على ما يرام، انتقل إلى القسم 5.
4. تنقية بروتينات فهد غير الموسومة عن طريق الفصل اللوني للتفاعلات المائية (HIC)
ملاحظة: فينيل مجموعات على سطح طلاء هلام السيليكا في عمود HIC لFPLC (الشكل3B)تمكين فصل البروتينات وفقا لشخصية رهاب الماء. وينبغي تنفيذ الخطوات الموصوفة بنظام FPLC مجهز بـ 5 مل من عمود HIC-phenyl. يمكن غسل الأعمدة مع 1 M NaOH لإعادة استخدامها لبروتينات مختلفة. ومع ذلك، يجب إعادة استخدام الأعمدة التي كانت تستخدم في أحد أنواع بروتين فهد لهذا النوع من البروتين فقط.
-
كبريتات الأمونيوم (AS) هطول الأمطار
- تابع من الخطوة 2.5. البروتين هو في الجليد الباردة HIC تشغيل العازلة (جدولالمواد).
- تقييم حجم محلول البروتين المعد على وجه التحديد إلى ميكروليتر (Vالأولية). ببطء وقطرة الحكيم إضافة قبل تبريد HIC تشغيل العازلة AS الحل، حتى يتم التوصل إلى 35 حجم٪٪ كما التشبع: VAS وأضاف = Vالأولية * 0.538. حرك المحلول بلطف لمدة 30 دقيقة.
- قم بتصفية الـ supernatant باستخدام وحدة تصفية 0.22 ميكرومتر على الجليد. اختياريا، تأخذ عينة لتحليل SDS-صفحة: تخفيف 1:4 والحرارة على الفور في 95 درجة مئوية لمدة 5 دقيقة وإلا فإن العينة كتلة. ويمكن تجميد العينة عند هذه النقطة (-20 درجة مئوية) من أجل المضي قدما في يوم آخر.
-
FPLC باستخدام عمود HIC
- إعداد نظام FPLC وتوازن عمود HIC-phenyl 5مل مع 5 مجلدات العمود (CV) من 20٪ EtOH (في H2O) تليها 5 السيرة الذاتية من H2O.
- امزج 260 مل من العازلة بتشغيل HIC (بالضبط) مع 140 مل من HIC تشغيل العازلة AS (بالضبط). ينتج عن ذلك حل بحجم 35%AS. تحقق من رقم الـ pH (7.0)؛ هذا هو المخزن المؤقت A. B المخزن المؤقت هو 250 مل من المخزن المؤقت قيد التشغيل. إضافة 1 m DTT إلى كل من المخازن المؤقتة A و B، ثم الاحتفاظ بها على الجليد.
- موازنة العمود مع 8 مل من العازلة A، 8 مل من المخزن المؤقت B، و 8 مل من المخزن المؤقت A في هذا التسلسل. تطبيق العينة المعدة في بروتوكول الخطوة 4.1. اغسله بالمخزن المؤقت A، حتى يصل الامتصاص البصري الأساسي عند 280 نانومتر إلى 1000-500 mAU.
- تطبيق خليط من المخازن المؤقتة A و B، بحيث يكون تركيز AS 33٪ (ث /v). يغسل مع 1 السيرة الذاتية، مما أدى إلى هضبة في كروماتوغرام. إعداد تدرج من العازلة B (حتى 100% المخزن المؤقت B مع مرور الوقت): 1.5 مل من المخزن المؤقت B في 3.8 دقيقة (أي 5.7% المخزن المؤقت B مع 1% B/mL ميل). عندما ترتفع إشارة الأشعة فوق البنفسجية عند 280 نانومتر، ابدأ في جمع الكسر ووضعها على الجليد على الفور.
- في النهاية، اغسل العمود مع المخزن المؤقت B. خذ عينات من جميع الكسور لتحليل SDS-PAGE. تجميد جميع العينات باستخدام النيتروجين السائل، وتخزينها في -80 درجة مئوية.
- إجراء تحليل SDS-PAGE (وبقعة غربية) للكشف عن بروتين فهد في الكسور التي تم جمعها. يتم تجميع الكسور التي تحتوي على البروتين وتطبيقها على مزيد من التنقية، كما هو موضح في خطوات البروتوكول التالية. اغسل العمود بـ H2O و 20% EtOH (في H2O).
5. تنقية بروتينات فهد عن طريق التبادل اللوني
ملاحظة: الجزيئات مع مجموعات وظيفية مشحونة ملزمة إلى عمود جسيمات السيليكا لFPLC (الشكل3C). وهذا يتيح التمييز بين البروتينات وفقا لطابعها الأيوني، مثل تهمة السطح. وينبغي تنفيذ الخطوات الموصوفة مع آلة FPLC والدراية المرتبطة بها، على التوالي. والطريقة الموصوفة هي نفسها بالنسبة للكروماتوغرافيا التبادلية الموجبة أو الأنيونية، ولكن المخازن المؤقتة التي ستستخدم تختلف اختلافا طفيفا.
- اختر نظام كروماتوغرافيا التبادل الكاتيوني أو الأنيوني. هذا الاختيار تجريبي وقد يختلف بين بروتينات فهد. على النحو الأمثل، يمكن استخدام كلا الأسلوبين على التوالي.
- إعداد نظام FPLC وغسل العمود مع 5 CV من 20٪ EtOH (في H2O)، تليها 5 السيرة الذاتية من H2O. التكافؤ العمود مع 1 CV من العازلة الملح منخفضة، وارتفاع الملح العازلة، ومرة أخرى العازلة الملح في هذا التسلسل.
- تطبيق العينة (dialyzed مقابل المخزن المؤقت الملح منخفضة الصحيح من الخطوة 3.1.11) على العمود. جمع تدفق من خلال. اغسل العمود لـ 1 CV مع العازلة الملح منخفضة.
- إعداد تدرج الأوتيل: 100٪ عالية الملح العازلة في 30 دقيقة بمعدل تدفق 1 مل / دقيقة، أو 60 دقيقة بمعدل تدفق 0.5 مل / دقيقة. ويمكن إعادة اختيار هذا استناداً إلى الكروماتوغرام FPLC المعروف بالفعل، من أجل تحسين تنقية. جمع جميع الكسور الذروة.
ملاحظة: قد تختلف الظروف الملحية العالية بين بروتينات فهد، كما هو موضح في قسم المناقشة. - بعد انتهاء التدرج، تشغيل مع العازلة عالية الملح حتى يتم الكشف عن المزيد من القمم على نطاق 1 CV (جمع الكسور).
- أخذ عينات من جميع الكسور التي تم جمعها وإجراء تحليل SDS-PAGE (12.5٪ تشغيل هلام، 4٪ التراص هلام). تجميد العينات الفردية في النيتروجين السائل وتخزينها في -80 درجة مئوية.
- بعد اكتمال تحليل SDS-PAGE، قم بتجميع العينات التي تحتوي على بروتين فهد وتجاهل الآخرين. اختياريًا، ركز البروتين باستخدام وحدات فلتر فائقة التركز.
- ضعي 1 مل من 25% من الـ SDS في 0.5 مليون من الـ NaOH (أو غيرها من المنظفات) لتنظيف العمود. اغسل العمود بـ H2O و 20% EtOH (في H2O).
- اختيارياً، كرر القسم 5 مع العمود البديل (chromatography التبادلية الكاتيوني أو أنيوني). البروتين الذي تم الحصول عليه من هذه الطريقة نقي بما فيه الكفاية لإجراء فحوصات النشاط الأساسية أو يمكن استخدامها في فحص الاختبارات للبلورات. للتطبيقات المتقدمة، تابع القسم 6.
6. تنقية بروتينات فهد عن طريق الكروماتوغرافيا ذات الحجم المنقص
ملاحظة: الجسيمات المسامية في عمود هلام السيليكا لFPLC تمكين التمايز من البروتينات وفقا لحجم الجزيئية، مثل نصف قطرها الهيدروديناميكية (الشكل3D). الخطوات الموصوفة يتم تنفيذها مع نظام FPLC باستخدام أعمدة SEC.
- اختر عمود SEC، معتمدًا على الأوزان الجزيئية للتلوثات التي لا تزال موجودة، كما تم اكتشافها عبر SDS-PAGE وتلطيخ الفضة. الأسلوب الموضحة مناسبة لكلا العمودين. غسل العمود بين عشية وضحاها مع 400 مل من H2O وتوازن مع المخزن المؤقت تشغيل SEC. من المستحسن كتابة برنامج لنظام FPLC لأتمتة هذه الخطوة.
- إضافة 1 m DTT إلى 300 مل من المخزن المؤقت تشغيل SEC ووضعها على الجليد. هذا هو المخزن المؤقت قيد التشغيل. تطبيق 60 مل من هذا المخزن المؤقت إلى العمود.
- طرد مركزي عينة البروتين (10000 x غرام لمدة 10 دقيقة) لإزالة أي الترسيب الجزئي. تطبيق supernatant إلى العمود. ينصح عموما لتصفية supernatant قبل FPLC.
- تطبيق المخزن المؤقت تشغيل إلى العمود حتى يتم eluted كل البروتين. جمع جميع القمم في أجزاء من حجم مناسب (على سبيل المثال، 2 مل). أخذ عينات لSDS-PAGE وتجميد جميع الكسور باستخدام النيتروجين السائل. تخزين الكسور المجمدة في -80 درجة مئوية.
- بعد تحليل SDS-PAGE (وبقعة غربية)، جمع وتجميع جميع الكسور التي تحتوي على بروتين فهد. يوصى بتلطيخ الفضة للكشف عن التلوثات الطفيفة التي قد لا تزال موجودة.
- استخدم وحدات فلتر فائقة التركز من أجل تركيز البروتين. على الرغم من أنها ليست إلزامية لبروتينات فهد، ينصح عموما خطوة إزالة الملحة (على سبيل المثال، عن طريق غسيل الكلى) للاختبارات الإنزيم وبلورة.
- كرر الخطوات 6.3-6.6 عدة مرات مع معدلات تدفق مختلفة وتركيزات الملح (تجريبي) من أجل تعزيز نقاء بروتين فهد. اغسل العمود بين عشية وضحاها مع H2O و 20٪ EtOH (في H2O).
7. فحوصات نشاط فهد الأساسية مع ركائز أوكسالوخلات والأسيتيلبيروفات
ملاحظة: يعرض بروتين فهد 1 (FAHD1) نشاط أوكسالوأسيتات ديكاربوكسيلاس (ODx) وacylpyruvate hydrolase (APH). ويرد هذا بالتفصيل في قسم المناقشة. بسبب زعزعة الاستقرار بواسطة الكيتو-انول tautomerization في محلول مائي (أي، enolization)، يتحلل oxaloacetate في حد ذاته مع مرور الوقت (لصناعة السيارات في decarboxylation) كدالة من تركيز عامل مساعد ورقم الألف. في حوالي درجة الواضة من 7 ودرجة حرارة 25 درجة مئوية، وهذا التأثير ليس دراماتيكيا، ولكن يجب أن تكون فارغة الاختبارات لحساب كل من لصناعة السيارات في decarboxylation وتركيز الإنزيم. مخطط الأنابيب مبين في الشكل 4A. بشكل عام، فمن المستحسن استخدام الماصات معايرة جيدا لهذا التقييم، كما أنها حساسة جدا ً لأخطاء الأنابيب طفيفة.

الشكل 4 مخطط المواسير التقريبي ة للاختبارات الانزيمية.
(أ) مخطط رسم لأنابيب الاختبارات الأساسية القائمة على الركيزة الإنزيم البروتين فهد. الركيزة فارغة: -S/E؛ عينة الركيزة: + S / E؛ الإنزيم فارغ: -S/+E; عينة الإنزيم: + S / + E (S: الركيزة، E: الإنزيم). راجع الخطوة 7 للبروتوكول لمزيد من التفاصيل. (ب) مخطط رسم لأنابيب تقييم حركية مايكليس-مينتن من بروتين فهد. الركيزة فارغة: -S/E؛ عينة الركيزة: + S / E؛ الإنزيم فارغ: -S/+E; عينة الإنزيم: + S / + E (S: الركيزة، E: الإنزيم). راجع القسم 8 من البروتوكول لمزيد من التفاصيل. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- بدء تشغيل قارئ ميكروبلات وتوازن لمدة 30 دقيقة في 25 درجة مئوية. إعداد برنامج لقراءة 12 بئر (كما هو موضح في الشكل 4A)في 255 نانومتر. من المستحسن استخدام 25 قراءة متعددة مع 5 مللي ثانية تأخير الوقت. إعداد دورة لقياس 15x كل 2 دقيقة (30 دقيقة المجموع).
- افتراضياً، قم بإعداد مخزن الإنزيم (انظر جدولالمواد) مع 1 m MgCl2 عند رقم الـ 7.4. قد تتطلب البروتينات متغير ة فهد عوامل مساعدة مختلفة أو مستويات حال. Mg2+ وMn2+ معروفان بالعوامل المساعدة لـ FAHD13,11,12,21.
- إنشاء 1 ميكروغرام / لتر محلول البروتين، مع تخفيفمع الإنزيم اختبار العازلة (جدول المواد).
- إعداد محلول 1 مل من 20 mM الركيزة لاختبارها (حتى الآن يتم سرد ركائزالبروتينات فهد في مكان آخر 3) في العازلة اختبار الإنزيم.
- وفقا لمخطط الأنابيب المعروضة في الشكل 4A، وإعداد الإنزيم فارغة وعينات الآبار: الأنابيب 90 ميكرولتر من الإنزيم اختبار العازلة (جدولالمواد)في الآبار مع 5 ميكرولتر (5 ميكروغرام) من محلول الإنزيم.
- وفقا لمخطط الأنابيب المعروضة في الشكل 4A، وإعداد الركيزة فارغة وعينات الآبار: الأنابيب 95 ميكرولتر من العازلة اختبار الإنزيم في الآبار.
- قبل القياس مباشرة، ضع 5 ميكرولتر من الإنزيم في الآبار الفارغة الستة. تطبيق 5 μL من الحل الركيزة 20 mM على الآبار عينة. من المستحسن استخدام ماصة متعددة القنوات.
- استخدم ماصة متعددة القنوات في إعدادات 50 ميكرولتر لخلط جميع الآبار بلطف. ابدأ بالفراغات وتابع ببئر العينة. الحرص على عدم إنشاء أي فقاعات. أدخل اللوحة في قارئ الألواح الدقيقة ويقيس كل بئر في 255 نانومتر (كما هو موضح في الخطوة 7.1).
- إجراء التحليل في جدول بيانات. انسخ البيانات الأولية من مقياس الصورة إلى جدول بيانات، واكتب كافة الإعدادات (أي جميع الوثائق) في ورقة أخرى. متوسط بيانات الآبار الثلاثة لكل من الاستعدادات الأربعة. طرح الفراغ من العينة. أيضا حساب الانحرافات المعيارية ومجموع الانحرافات فارغة وعينة.
- رسم هذه البيانات (y: الكثافة البصرية، x: الوقت في دقيقة). يجب عرض منحنى تناقص بشكل كبير. اعتمادا على نوع الركيزة في الاستخدام، ويمكن ملاحظة زيادة الأولية في غضون 10 دقيقة الأولى، وبعد ذلك تنخفض الإشارة. ويعزى ذلك إلى تَرَكَمُر الكيتو-إنول للركيزة، كما هو مبين بمزيد من التفصيل في قسم المناقشة.
- تقسيم بيانات الإشارة الضوئية على مر الزمن على القيمة القصوى للمخطط، من أجل قياس البيانات إلى أسفل إلى نطاق [0، 1] (يتم تقديم مثال في الشكل 5A). تحديد النطاق الخطي للمنحنى، بدءاً من النقصان الأولي، وحساب الميل السلبي (1/دقيقة).
- ويرتبط مسار الوقت من الانخفاض في OD إلى الركيزة عن طريق تركيزها الأولي: 100 نمول / بئر * المنحدر. باستخدام تركيز البروتين تقييم ج0، يتم حساب النشاط المحدد: 100 نمول / بئر * المنحدر * 1 / ج0. التعبير عن ج0 في ميكروغرام /جيد، يتم التعبير عن النشاط المحدد المحسوب بهذه الطريقة باستخدام وحدة نمول /دقيقة /ميكروغرام، وهو ما يساوي ميكرومول/دقيقة/ملغ.
8. تقييم حركية الماليس -مينتن لبروتينات فهد
ملاحظة: تقييم حركية Michaelis-Menten لبروتينات فهد أمر ممل، حيث أن نشاط البروتين المحدد يعتمد على كل من تركيز الركيزة النسبية للبروتين والحجم المادي الذي يحدث فيه رد الفعل. يجب تحديد حركية الحالة الثابتة من أجل الحصول على نتائج موثوقة. يتم تحديد بروتوكول اختبار على لوحة شفافة للأشعة فوق البنفسجية 96 جيدا في الخطوات التالية. كل خطوة تحتاج إلى أن يتم تنفيذها بعناية كبيرة، كما أخطاء طفيفة عادة ما يفسد التجربة. ويوصى بإتقان الاختبارات المبينة في القسم 7 قبل محاولة الاختبارات الأكثر تعقيداً الموصوفة أدناه.
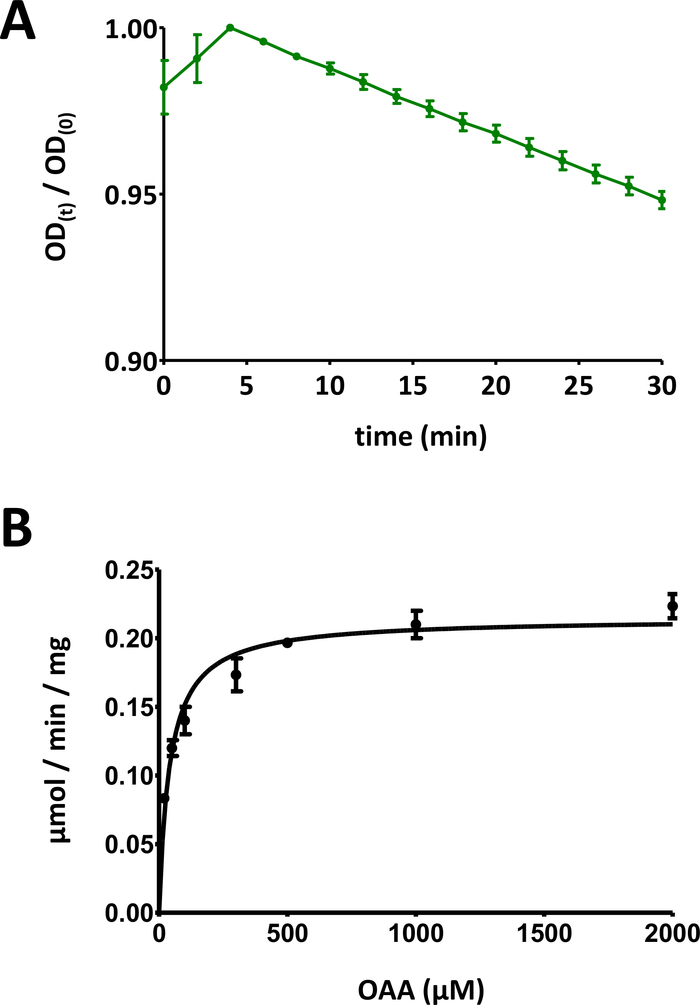
الشكل 5 نتائج اختبار الإنزيم.
(أ) منحنى امتصاص مثالي للأشعة فوق البنفسجية تم الحصول عليه من أجل الاختبارات الأساسية لإنزيم بروتين فهد القائم على الركيزة (تطبيع في نطاق 0 إلى 1) مع الانحراف المعياري. ونسبة الكثافة البصرية [OD(t)/OD(0)] في أي وقت من الأوقات t [OD(t)] يتم تطبيعها إلى OD الأولي [t = 0; OD(0)]. راجع القسم 7 من البروتوكول لمزيد من التفاصيل. (ب) حركية الميكليس-مينتن النموذجية لبروتين فهد 1 البشري مع الانحراف المعياري. راجع القسم 8 من البروتوكول لمزيد من التفاصيل. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- بدء قارئ ميكروبلات وتوازن لمدة 30 دقيقة في 25 درجة مئوية. إعداد برنامج لقراءة 72 بئر (كما هو موضح في الشكل 4B)في 255 نانومتر. من المستحسن استخدام 25 قراءة متعددة مع تأخير الوقت 5 مللي ثانية. إعداد دورة لقياس 15x كل 2 دقيقة (30 دقيقة المجموع).
- تنفيذ الخطوتين 7.2 و 7.3. ثم، إعداد 1 مل من 100 mM الحل الركيزة في الإنزيم العازلة.
- إعداد التخفيفات من محلول الركيزة في الإنزيم اختبار العازلة: 40 m، 20 mM، 10 mM، 6 mM، 4 mM، 2 mM. يتم إجراء الخضوع مع تركيزات الإنزيم/الركيزة ذات الإنزيمات ("المعدلة") لهذا، إعداد التخفيفات التالية من محلول الإنزيم في الإنزيم اختبار العازلة: 0.5 ميكروغرام / لتر، 0.4 ميكروغرام / ميكرولتر، 2.5 ميكروغرام / ميكرولتر، 2 ميكروغرام / لتر، 1.5 ميكروغرام / لتر، 1 ميكروغرام / لتر.
- في جميع الآبار المبينة في الشكل 4B تطبيق 180 μL من الإنزيم اختبار العازلة. تطبيق 10 μL من الإنزيم الخضوع في جميع الآبار للركيزة (فارغة وعينة). تطبيق 10 μL من سلسلة تخفيف البروتين أعدت في الآبار للإنزيم (فارغة وعينة). تطبيق 10 μL من الإنزيم الكبح في جميع الآبار للآبار للطبقة الركيزة فارغة وفارغة الإنزيم.
- قبل القياس مباشرة، ضع 10 ميكرولتر من سلسلة تخفيف الركيزة المعدة في الآبار لعينة الركيزة وعينة الإنزيم.
- استخدم ماصة متعددة القنوات في إعدادات 50 ميكرولتر لخلط جميع الآبار بلطف، بدءاً بالفراغات، والمتابعة إلى الآبار العينة. الحرص على عدم إنشاء أي فقاعات.
- أدخل اللوحة في قارئ الألواح الدقيقة ويقيس كل بئر في 255 نانومتر، كما هو موضح في الخطوة 8.1. إجراء التحليل في جدول بيانات. انسخ البيانات الأولية من مقياس الصورة إلى جدول بيانات، واكتب كافة الإعدادات (أي جميع الوثائق) في ورقة أخرى.
- إجراء تحليل البيانات الفردية لكل نقطة في سلسلة التخفيف كما هو موضح في الخطوات 7.11. إلى 7.14. في نهاية المطاف، الحصول على جميع الأنشطة المحددة ومؤامرة مقابل تركيز الركيزة الأولية: 2 mM، 1 mM، 0.5 m، 0.3 mM، 0.2 mM، 0.1 mM.
- عرض جميع نقاط البيانات مع الانحرافات المعيارية الفردية. الكمبيوتر مايكليس منتن الحركية عن طريق غير الخطية تركيب منحنى، أو عن طريق تحليل لينويفر-بورك. وقد يلزم إعادة قياس النقاط الفردية، وتكييف نسب الزُنَب الفردية بين البروتينات/التركيزات التحتية- التركيز في الخطوتين 8.5 و8.6. يتم توفير الرسم البياني مايكليس منتن لفهد 1 الإنسان في الشكل 5B.
9. بلورة بروتينات فهد
ملاحظة: يمكن أن يتم بلورة بروتينات فهد (HUMAN FAHD1 التي سبق وصفها15)عن طريق طريقة نشر بخار الإسقاط المعلق ة بصيغة 24 بئر (الشكل 6A). ويرد أدناه بروتوكول خطوة بخطوة بشأن بلورة الإنسان فهد1باستخدام هذه التقنية. ويرد وصف أكثر تفصيلا في قسم المناقشة.

الشكل 6 تبلور بروتينات فهد.
(أ) لوحات تبلور في معيار 24 بئر أو 96 بصمة SBS جيدا. راجع القسم 9 لمزيد من التفاصيل. (ب) عملية إعداد اللوحة الأساسية في بلورة بروتينات فهد. هذا الرقم يعاد رسمه بإذن23. راجع القسم 9 لمزيد من التفاصيل. (ج) بلورات بشرية من الـ FAHD1 وأنماط الانعراج المناظرة (الحشوات الصغيرة). ويشار إلى أقرب تباعد شعرية في إدراج كمقياس لنوعية الانعراج من البلورات. تشير الأرقام المنخفضة إلى دقة أعلى وبالتالي بيانات أكثر إفادة. راجع القسم 9 من البروتوكول لمزيد من التفاصيل. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- تأكد من أن البروتين هو dialyzed ضد SEC تشغيل المخزن المؤقت. يجب أن يكون بروتين FAHD1 متوفرًا بتركيزات عالية (2-5 ملغ/مل). في تركيزات أقل، قد لا يتبلور البروتين بسبب عدم وجود نواة عفوية.
- إعداد ≥ 20 مل من محلول الخزان لبلورة. جعل ثلاثة حلول الأسهم، وذلك باستخدام الماء المقطر أو منزوع الديون كمذيب: 1 M Na-HEPES (الحد الأدنى 25 مل، معدلة إلى درجة الألف الأدنى 7.5)، 50٪ (ث / الخامس) البولي ايثيلين جلايكول 4000 (PEG4k) (الحد الأدنى 65 مل)، و 1 M MgCl2 (10 مل).
- إعداد شبكة من 4 × 6 (24 المجموع) مختلفة 15 أنابيب مل. تسمية لهم وفقا لمواقف المقابلة على لوحة (على سبيل المثال، الصف (A، B، C، D) مقابل العمود (1-6) مثل "A1"، "B5"، "D6"، الخ.). ماصة 1 مل من 1 M Na-HEPES في كل أنبوب.
- ماصيت 1 مل من 50٪ (ث / الخامس) PEG4K في الصف A من الأنابيب، 2 مل في الصف B، 3 مل في الصف C، و 4 مل في الصف D. ماصة 100 μL من 1 M MgCl2 في العمود 1 من الأنابيب، 250 μL في العمود 2 ، 500 μL إلى العمود 3، 1.0 مل إلى العمود 4، 1.5 مل إلى العمود 5، و 2.0 مل إلى العمود 6.
- ملء جميع الأنابيب تصل إلى حجم 10 مل مع الماء المقطر أو منزوع الديون، حيث مقياس على الأنابيب دقيقة بما فيه الكفاية.
- خذ عينة بروتين فهد1 البشرية (~5 ملغ/مل) من الثلاجة (أو من الثلج) واخفض هاته السرعة القصوى مع جهاز طرد مركزي أعلى في 4 درجة مئوية لمدة 10 دقائق على الأقل. إذا كان من المرغوب فيه التبلور المشترك مع الأوكسالات، إضافة أوكسالات من محلول الأسهم بحيث تحتوي عينة البروتين على تركيز أوكسالات نهائي من 2 mM. تطبيق 1 m DTT وتخزينها على الجليد.
- في هذه الأثناء، فك 24 لوحة تبلور جيدا، من الناحية المثالية داخل غرفة درجة حرارة التحكم في درجة حرارة عند 18 درجة مئوية. توزيع طبقة رقيقة من زيت البارافين على حافة على رأس كل بئر من لوحة بئر 24 مع مساعدة من الزجاج رقيقة أو قضيب من البلاستيك. أضف 800 ميكرولتر من كوكتيلات البلورة المعدة (A1 إلى D6) في كل بئر مناظر للوحة التبلور.
- ضع غطاء ً جديد 22 مم على سطح نظيف. تجنب تلويث زلات الغطاء بالأوساخ أو الغبار. إذا لزم الأمر، قم بإزالة أي حطام من زلة الغطاء باستخدام الهواء المضغوط أو رذاذ المنفضة.
- بعد اكتمال التمركز، تجنب هز عينة البروتين بحيث المجاميع نسج أسفل والحطام في الجزء السفلي من الأنبوب لا تطفو مرة أخرى. في الخطوات التالية، ماصة من عينة البروتين فقط تحت سطح الحل من أجل تجنب اثارة المجاميع والرواسب من القاع.
- لكل بئر (انظر الشكل 6B)ماصة 1 μL من محلول البروتين على مركز زلة الغطاء وإضافة 1 ميكرولتر من كوكتيل الخزان المعني إلى قطرة البروتين، وتجنب فقاعات. بدوره coverslip رأسا على عقب ووضعها على الجزء العلوي من البئر بحيث النفط ختم البئر مع غطاء الهواء محكم. كرر حتى الانتهاء من لوحة جيدا 24.
- تخزين لوحة في 18 درجة مئوية ومراقبة قطرات على جدول زمني تقدمي مع المجهر السليم. تظهر بلورات فهد 1 البشرية عادة بين عشية وضحاها (انظر الشكل 6C).
النتائج
بدءا من ناقلات الاستنساخ المعدة واشترى BL21 (DE3) plysS E. القولونية، يتم إدراج البلازميد في البكتيريا عن طريق صدمة الحرارة أو أي طريقة بديلة مناسبة (الشكل1). بعد فترة قصيرة من التضخيم، يتم طلاء البكتيريا المحولة على لوحات أجار LB، من أجل النمو بين عشية وضحاها. قد تبدو اللوحات في هذه المرحلة مختلفة، اعتماداً على مجموعة متنوعة من مصادر الخطأ المحتملة. قد تكون الأطباق فارغة (أي لا مستعمرات)، متضخمة تماما من البكتيريا، أو شيء في ما بين، على التوالي. ويصور الشكل 7 ألفمثالين للوحات الغار LB بعد التحويل الأمثل وغير الأمثل. تشير المستعمرات البكتيرية كثيرة جدا ً إما إلى أن الكثير من البكتيريا كانت مطلية (على الأرجح) أو أن المضادات الحيوية التي تستخدم قد تنتهي صلاحيتها (على الأرجح). عدد قليل جدا من المستعمرات البكتيرية قد تشير إلى أنه إما لم يكن يستخدم ما يكفي من البلازميد للتحول (استخدام أكثر في المرة القادمة) أو أن الكثير من المضادات الحيوية استخدمت لتحديد البكتيريا. على أي حال، إذا كانت المستعمرات موجودة، ينبغي أن تكون على ما يرام، واستخدام اثنين من المضادات الحيوية الانتقائية يعني فرصة ضئيلة إلى حد ما من البكتيريا غير المحولة في النمو. ومع ذلك، لا توجد مستعمرات على الإطلاق، تشير إلى أن البكتيريا فقدت كفاءتها التحول (بسبب التخزين الخاطئ أو التخزين على مدى فترات أطول، والتجميد المتكرر والذوبان، وما إلى ذلك)، لم تكن صدمة الحرارة ناجحة (لا امتصاص البلازميد أو البكتيرية الموت عن طريق حرارة أكثر من اللازم)، وتلف ناقلات الاستنساخ، أو عن طريق الخطأ تم استخدام مجموعة خاطئة من المضادات الحيوية الانتقائية (تحقق من الجين المقاومة على ناقلات البلازميد).
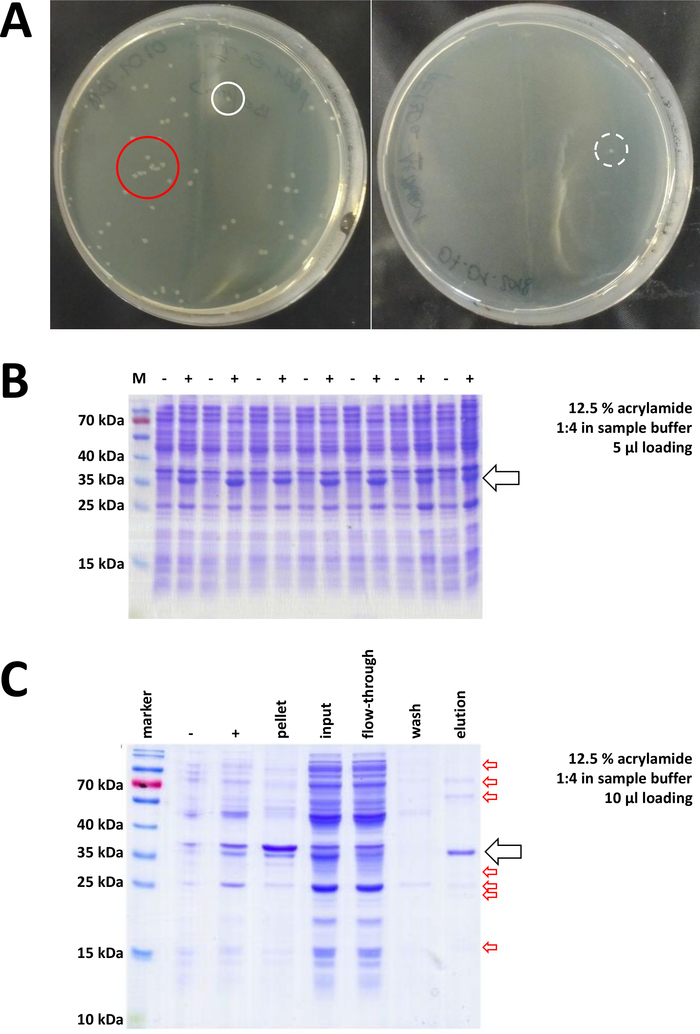
الشكل 7 نتائج تمثيلية لتحويل البكتيريا وIMAC.
(أ) لوحات أجار LB تمثيلية مع BL21(DE3) E. coli، التي تم الحصول عليها عن طريق اتباع الخطوة 1.1 للبروتوكول. يسار: لوحة مع جيّدا يوزّع مستعمرات (مثال إيجابيّة). يمين: لوحة بمستعمرة واحدة فقط (مثال سلبي). الدوائر البيضاء علامة المستعمرات جيدة. الدائرة الحمراء علامات المستعمرات التي تنمو قريبة جدا من بعضها البعض، وينبغي عدم انتقاؤها طالما المستعمرات المعزولة متوفرة. (ب) تحليل 12.5٪ من الأكريلاميد SDS-PAGE لسلسلة من الضوابط التعريفي ("-" يشير قبل التعريفي IPTG؛ "+" يشير بعد الحث IPTG، قبل حصاد بيليه)، وتعديلها لكميات متساوية من البروتين الكلي. يتم وصف هذا في الخطوة 1.2. (ج) تحليل مثالي 12.5٪ أكريلاميد SDS-PAGE من تنقية ني-NTA من له- الموسومة FAHD1 البروتين. ويرد هذا في القسم 3 من البروتوكول. ينتج اللونيّة تقارب بروتين من عال نقاوة ([>]70%, سهم سوداء), مهما, عدّة تلوثات صغيرة أيضا لاحظت (سهام حمراء). وتتألف هذه الملوثات من بروتينات غير من نوع فهد ترتبط بالعمود، ومن بروتينات ترتبط ببروتين فهد. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
يتم اختيار المستعمرات المصادق عليها وانتقاءها. بعد التضخيم في المتوسط المغذي، يتم تشغيل التعبير البروتين عن طريق تطبيق IPTG الكيميائية. يتم حصاد بيليه البكتيرية التي تحتوي على البروتين الذي تم التعبير عنه بكميات مليغرام، ويتم التحقق من التعبير عن طريق SDS-PAGE (انظر على سبيل المثال الشكل 7B). قد تحدث بعض المشاكل أثناء هذه العملية بسيطة خلاف ذلك. أولا، بعض البروتينات تشكل هيئات الشمول، لأنها تتداخل على ما يبدو بطريقة أو بأخرى مع الأيض الطبيعي للبكتيريا المضيفة. وقد لوحظ ذلك بالنسبة لبعض الطفرات في الإنسان فهد 1 وفهد 2. في مثل هذه الحالات ، قد تكون أنظمة التعبير الأخرى مثل خلايا الحشرات أكثر ملاءمة وينبغي النظر فيها. بعد حصاد بيليه من خلايا الحشرات ، على سبيل المثال ، يتبع تنقية البروتينات نفس الخطوات كما هو موضح في هذا البروتوكول. ثانياً، يُوجد في بعض الأحيان أن نظام DE3-pET "مُسَحَّب" (أي أن البروتين يُعبر عنه بالفعل إلى حد ما قبل الحث على الـ IPTG). السبب المحتمل لذلك ليس مفهوما جيدا، ولكن قد يساعد على التعبير عن البروتين ببطء بين عشية وضحاها في حاضنة غرفة باردة. ثالثاً، لا يتم التعبير عن أي بروتين. هذا هو على الأرجح السيناريو أسوأ الحالات، كما أنه يشير على الأرجح إلى متجه بلازميد تالف، وبالتالي من المستحسن لتسلسل البلازميد.
إذا كان له-tag تم استخدامها لوضع علامة على البروتين، والكروماتوغرافيا التقارب مع ني-NTA أغاروز هو وسيلة سهلة ورخيصة التقاط القضاء على معظم التلوث (الشكل 7C). وتوجد أساليب مماثلة لأنظمة الوسم الأخرى (مثل STREP-II). إذا لم يتم استخدام أي علامة، مزيج من هطول الأمطار كبريتات الأمونيوم والتوالي chromatography تبادل هيدروفوبيك قد أيضا فصل البروتين من غالبية البروتينات الأخرى (الشكل8A). ومع ذلك، مقارنة طريقتين (الشكل7C مقابل الشكل 8A)،يمكن أن تظهر تفوق أساليب ني-NTA عن طريق تحليل SDS-PAGE. ولذلك ينصح باستخدام البروتين له الموسومة.
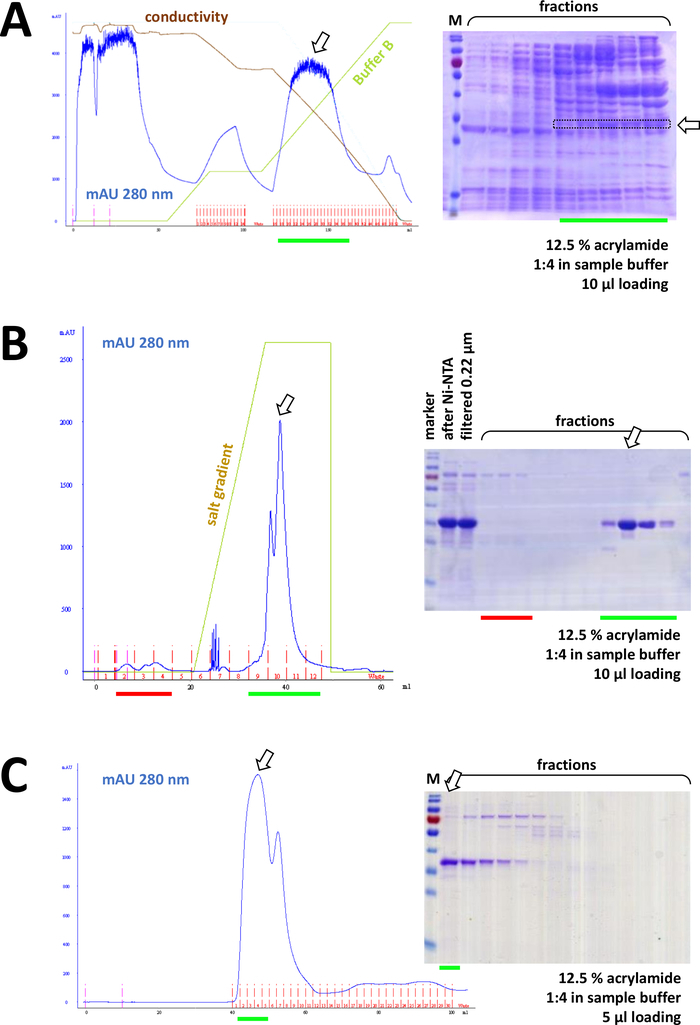
الشكل 8 نتائج تمثيلية لتجارب FPLC (HIC, تبادل الأيون, لجنة الأوراق المالية والبورصة).
(أ) تحليل نموذجي للكروماتوغرام و12.5 في المائة من الأكريلاميد SDS-PAGE لتحليل الكروماتوغرافيا HIC-phenylبعد هطول الترسيبات من بروتين فهد 1 غير الموسوم بعلامات الصوديوم (AS) من كبريتات الأمونيوم، كما هو موضح في القسم 4 من البروتوكول. يعكس الخط الأخضر تدرج المخزن المؤقت B الذي لا يحتوي على AS. خلال عملية يتم غسلها تدريجيا من النظام. مقارنة هذه اللوحة إلى الشكل 7C يعرض قوة لونية تقارب ني-NTA مقارنة مع طريقة HIC-فينيل، وميزة استخدام له-tag نظام لتنقية البروتين. (ب) تحليل نموذجي للكروماتوغرام و12.5% من مادة الأكريلاميد SDS-PAGE للكروماتوغرافيا التبادلية الموجبة لـ"فهد" بعد تنقية Ni-NTA. باستخدام تدرج الملح، يتم فصل العينة المطبقة إلى بروتينات فردية. (ج) تحليل نموذجي للكروماتوغرام و12.5% من مادة الأكريلاميد SDS-PAGE لـ G75 من الكروماتوغرافيا التي تحمل علامة "فهد" بعد أن قام بتمييز اللوني في التبادل الموجبة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
وعلى التوالي، يفصل البروتين أكثر من بقايا التلوث بواسطة chromatography تبادل الموجبة /anion (على سبيل المثال، انظر الشكل 8B)،تليها الكروماتوغرافيا الحجم والاستبعاد (على سبيل المثال، انظر الشكل 8C). وينصح بإعداد استراتيجية تنقية أولية بهذا الترتيب؛ ومع ذلك، يجب أن تستخدم هذه الأعمدة في تركيبة، في وقت لاحق وفي الاختلاف، حتى البروتين هو نقي بما فيه الكفاية.
يمكن إجراء فحوصات بسيطة للنشاط، من أجل اختبار قرارات "نعم أو لا" بشأن الركائز النشطة و/أو العوامل المساعدة، مع بروتيناته الموسومة بعد تنقية Ni-NTA، أو البروتينات غير الموسومة بعد عمود التبادل الأيوني. يجب تحديد الأنشطة المحددة والثوابت الحركية مع البروتين من أعلى نقاء. قد تكون محاولة التبلور مع البروتينات بعد العمود تبادل الأيونية، ولكن نوعية بلورات يرتبط دائما تقريبا مع نقاء البروتين. يمكن رفع الأجسام المضادة متعددة النسيلة ضد البروتينات في أي مرحلة من بروتوكول تنقية; ومع ذلك، هنا ترتبط أيضا نوعية مع نقاء البروتين.
Discussion
الخطوات الحرجة
بروتينات فهد حساسة جدا لتركيزات الملح. عند تركيزات الصوديوم المنخفضة، قد تترسب البروتينات عند الذوبان، ولكن عادة ما يمكن إعادة تشكيلها بشكل كامل في تركيزات الملح الأعلى. أي أنه إذا كان بروتين فهد يترسب لسبب ما، فقد يتم استرداده أو إعادة تركيبه بتركيزات ملحية أعلى (> 300 ميكرومتر). بعض البروتينات أكثر رهاب او ماء, ومع ذلك, قد لا يتم استرداد (على سبيل المثال, HUMAN FAHD2), ولكن المنظفات مثل CHAPS (الحد الأقصى 1%) أو الجلسرين (10%) يمكن استخدامها للحفاظ عليها في حل مستقر. على أي حال، ينصح بتجميد الصدمات باستخدام النيتروجين السائل والتخزين عند -80 درجة مئوية، كما هو لطيف وبطيء عملية الذوبان.
قد تحدث بعض المشاكل غير المتوقعة أثناء تنقية ني-NTA في الخطوة 3.1.10. وتجدر الإشارة إلى أن مادة OD أعلى في العينة الثانية التي تم جمعها مما كانت عليه في العينة الأولى تشير إلى وجود حجم كبير جداً من راتنج الأغاروز (أخذ ملاحظة واستخدام أقل من الراتنج في التجربة التالية). أيضا، وراتنج الأجاروز نفسه يؤدي إلى إشارة OD في 280 نانومتر (أي، وتعطيل السرير راتنج الأجاروز تعطي إشارات اصطناعية). في حالة الشك، ينصح باستخدام أساليب أخرى مثل برادفورد أو BSA اختبار لتحديد تركيزات البروتين.
في الاختبارات الأنزيمية، هناك ثلاثة جوانب حاسمة يجب النظر فيها. أولاً، تقييم تركيز البروتين أمر بالغ الأهمية للحصول على الأنشطة المحددة الصحيحة. مستوى نقاء البروتين يؤثر على النتيجة ويحتاج إلى تقدير. في حالة البروتين الموسومة، يجب حساب كتلة جزء العلامة، ويجب تصحيح النشاط المحدد في المقابل. وبالنسبة للاختبارات البسيطة الموصوفة في القسم 7 من البروتوكول، يكفي نقاء نُهُر ني-NTA للتمييز بين الركيزة النشطة وغير النشطة، والعوامل المساعدة، وما إلى ذلك. في حالة أكثر تعقيدا مايكليس-Menten الحركية، يجب تحديد جميع تركيزات رد الفعل والركيزة بشكل صحيح. خصوصا عند استخدام oxaloacetate (التي لصناعة السيارات decarboxylates مع مرور الوقت) يجب تصحيح الجزء الأنزيمي من رد فعل لصناعة السيارات في decarboxylation (على افتراض أن كلا التفاعليحدث في وقت واحد). يجب النظر في التغيرات الأولية في إشارة الكثافة البصرية الموجهة إلى الكيتو-إنول تودومومراتمن الركيزة. ثالثا، يجب تعديل التركيزات والأحجام. رد فعل مع تركيزات محددة من الإنزيم والركيزة قد تعطي نتائج مختلفة تعتمد على حجم الخفض. إذا كان هناك الكثير من الإنزيم في البئر، قد التصاق السائل في الواقع التحيز النتيجة.
لتقييم حركية Michaelis-Menten فمن المستحسن إجراء التجارب الأولية في 100 ميكرولتر، 200 ميكرولتر، و 300 ميكرولتر من أجل العثور على المزيج الأمثل. تنطبق جوانب مماثلة على نسبة تركيزات الإنزيم الركيزة للاختبارات الحركية. الكثير من الإنزيم لكل ركيزة أو الكثير من الركيزة لكل إنزيم وضع النظام خارج نطاق ماليس ثابت الدولة الخطية. ويلزم إجراء تجارب أولية لتحسين هذه الشروط. يتم توفير التعديل المثالي لبروتين FAHD1 البشري (النوع البري) في القسم 8، مما يؤدي إلى رسم تخطيطي حركي (كما هو معروض في الشكل 5B،على سبيل المثال).
لتبلور هو pipetted قطرة من محلول البروتين في وسط غطاء ومختلطة مع قطرة من كوكتيل تبلور، والذي يتكون عادة من العازلة (على سبيل المثال، تريس-حمض الهيدروكلوريك، HEPES) وسريع (على سبيل المثال، البولي ايثيلين جلايكول، الأمونيوم كبريتات). يمكن اختيارياً تطبيق قطرة محلول مثبط للبلورة المشتركة (مثل الأوكسالات في هذا البروتوكول). ثم يتم وضع coverslip رأسا على عقب فوق بئر من خزان يحتوي على كوكتيل تبلور، وختم الهواء جيدا ضيق مع مساعدة من النفط مانع التسرب (الشكل 6B). من الناحية المثالية، لا يحدث هطول الأمطار داخل قطرة في بداية التجربة مما يعني أن البروتين لا يزال في الحل. وبما أن التركيز السريع في الخزان أعلى منه في القطرة، فإن القطرة تبدأ في فقدان المياه عن طريق التبخر في الغلاف الجوي للبئر حتى يتم التوصل إلى التوازن مع الخزان. انتشار المياه في الخزان يسبب انخفاض بطيء في حجم الانخفاض الذي بدوره يسبب زيادة في كل من, البروتين والتركيز السريع في الانخفاض. إذا وصل محلول البروتين إلى الحالة المطلوبة من التشبع الفائق وبالتالي الاستقرار الفوقية، يمكن أن تحدث النوى التلقائية تليها نمو الكريستال. الوصول إلى الدولة التشبع هو شرط ضروري ولكن ليس كافيا للتبلور. تبلور البروتينات يحتاج على حد سواء، مواتية الحرارة والظروف الحركية، ويعتمد بشكل كبير على خصائص لا يمكن التنبؤ بها من البروتين أن تبلور22.
التعديلات واستكشاف الأخطاء وإصلاحها
قد يكون التعبير عن البروتين في E. القولونية غير فعالة. قد تحتاج تركيزات IPTG المختلفة، ودرجة حرارة التعبير، ووقت التضخيم، مثل درجة حرارة الغرفة لعدة ساعات أو في غرفة باردة بين عشية وضحاها، إلى اختبار لكل بروتين جديد للعثور على الظروف المثلى. في بعض الأحيان لوحظ هطول البروتينات في الجسم الاشتمال لبروتينات فهد أكثر رهابا ً. في مثل هذه الحالات، ينصح التعبير البروتين في أنظمة نموذجية أخرى مثل خلايا الحشرات، كما الهيئات إدراج أقل احتمالا لتشكيل26.
حيث أن بروتينات فهد حساسة لتركيزات الملح والعوامل النافية، وكذلك درجة الـ حف، فإن استراتيجيات تنقية مختلف المتجانسات، وتقويم العظام، ومتغيرات الطفرة النقطية قد تختلف في البيئات الفردية. تم تطوير طرق التنقية الموصوفة لبروتين الفهد 1 من النوع البري. قد يكون تركيز المواد الكيميائية، مثل كلوريد الصوديوم وإيميدازول، وكذلك درجة الألف، قد يكون من الضروري تكييفها للبروتينات الفردية مع نقطة متساوية التساوي مختلفة (PI). أيضا من الجدير بالذكر، ليس كل له-الموسومة البروتين قد ربط جيدا إلى راتنج ني نتا. إذا كان البروتين ملزم لعمود ني-NTA غير فعال، والتركيزات المكيفة من كلوريد الصوديوم وإيميدازول، فضلا عن اختلاف شروط الحموضة في العازلة تشغيل ني-NTA قد تساعد على تحسين نوعية النتيجة. وإذا لم يكن الأمر كذلك، فإن تخطي خطوة ني-نتا والمضى قدماً إلى خطوة الفصل اللوني التبادلي الأيوني قد يؤدي أيضاً إلى استراتيجية تنقية ناجحة. إذا كان البروتين يرتبط بعمود Ni-NTA ولكن لا يمكن أن يكون من العمود، قد تساعد إضافة بعض MM EDTA في تعطيل مجمع Ni2+.
وفيما يتعلق بعملية التبلور، فإنه يلزم أن يكون مفهوما أن التنظيم الذاتي لجزيئات البروتين الكبيرة والمعقدة في شعرية دورية منتظمة هي عملية غير محتملة بطبيعتها تعتمد اعتمادا كبيرا على صعوبة التحكم في المعلمات الحركية. حتى التغييرات الصغيرة في مجموعة المتابعة المستخدمة لبلورة يمكن أن يغير بشكل كبير النتيجة وسوف تشكل أي بلورات. نقاء البروتين هو عموما ذات أهمية قصوى. وكقاعدة عامة، يجب أن هلام SDS-PAGE المثقل بشكل كبير لا تظهر العصابات الأخرى. أيضاً، قد يؤثر التسلسل الذي يتم تنفيذ الخطوات النتيجة. على سبيل المثال، لضمان إعادة الاستنساخ، فإنه من الضروري في كثير من الأحيان للحفاظ على تسلسل الأنابيب نفسه، ثم أولا إضافة البروتين، وأخيرا إضافة سريع إلى قطرة تبلور (أو العكس بالعكس). أيهما الطريقة المستخدمة، فإنه ينبغي أن تبقى هي نفسها عند محاولة إعادة إنتاج أو توسيع نطاق التجارب. إذا لوحظ عدم وجود بلورات بعد هذا البروتوكول، يمكن أن تختلف التركيبة الكيميائية السريعة، والرقم الألف، وحجم الإسقاط، ونسبة البروتين إلى الترسبات بزيادات صغيرة. الصبر والملاحظات الثابتة من قطرات هي الفضيلة.
ملاحظات على الآليات الحفازة للفهد 1
وقد تم تطوير الطرق المقدمة خصيصا للحصول على بروتينات FAHD1 ذات جودة عالية. هذا مكن نمو بلورات فهد1 وكذلك هندسة البلورات التي تحتوي على FAHD1 معقدة إلى مثبط (أوكسالات، PDB: 6FOG). توفر هياكل الأشعة السينية بنية ثلاثية الأبعاد لتجويف الإنزيم الحفاز. هذه النتائج إنشاء وصف شامل للمخلفات التي يحتمل أن تكون مهمة للآليات الحفازة لهذا الإنزيم مثيرة للاهتمام. وقد وصفت FAHD1 لأول مرة لتكون قادرة على cleave acylpyruvates (أسيتيلبيروفات، fumarylpyruvate)11. في وقت لاحق، وجد أن FAHD1 تعمل أيضا كdecarboxylase من oxaloacetate12. على الرغم من أن ركائز acylpyruvate وoxaloacetate هي moieties الكيميائية المختلفة، والتحولات الكيميائية تشترك ميكانيكيا الانقسام الاستراتيجي من مشترك واحد C3-C4 السندات، يسهل بنشاط إذا C3 - مدارات السندات C4 تبقى متعامدة إلى المدارات π من C2-carbonyl15. مثل هذا التشكل يسمح استقرارالرنين من C 3-carbanion شكلت بشكل عابر خلال عملية الانقسام. ركائز FAHD1 (أوكسالوأسيتات وacylpyruvates) هي جزيئات مرنة وقد توجد في الكيتون -enol(كيتو-انول) وكذلك أشكال C 2-رطب (الشكل9A). يتم تحديد التوازن بين الأنواع المختلفة بشكل رئيسي من خلال طبيعة تكوين العازلة المستخدمة، والحموضة ووجود الأيونات المعدنية. في ما يلي نناقش السيناريوهات الآلية الكهتية المستوحاة من تحليل هياكل الأشعة السينية الكريستالية التي كشفت عن مركز الحفاز من FAHD1.
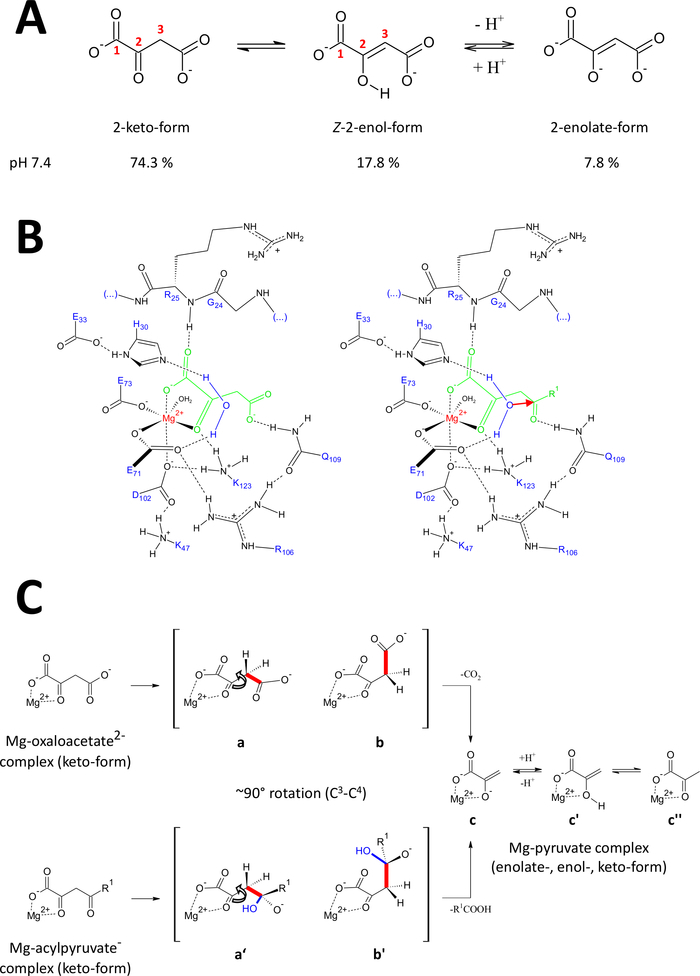
الشكل 9 تفاصيل عن الآلية الحفازة المقترحة لـ FAHD1 البشرية.
(أ) Oxaloacetate موجود في دولة بلورية وكذلك في حل محايد أساسا في شكلz-enol24. ومع ذلك، تحت الفسيولوجية حفية الشروط شكل 2 كيتو هو التمثيل السائد25. (ب) رسم كيميائي لتجويف hFAHD115 مع أوكسالوأسيتات (يسار) وacylpyruvate (يمين، مع R1 كبقية عضوية؛ والسهم الأحمر يدل على هجوم نيوكليوفيليك من جزيء الماء استقرت المجاورة) (انظر المناقشة). (ج) مقارنة التشوهات المفضلةللانشقاق C 3-C4 في decarboxylase (b إلى c) وhydrolase (b' إلى c) آلية FAHD1: تسفر كلتا العمليتين عن البيروفات-الإنوليت المعقد (انظر المناقشة). ومن المتوقع أن تستقر الوسيطتان ب و (ب) بحلول الربع 109، على النحو الوارد في الفريق باء (انظر المناقشة). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
نشاط ديكاربوكسيلاس من فهد1
Oxaloacetate موجود في دولة بلورية وكذلك في حل محايد أساسا في شكلz-enol24. ولكن تبين أنه في ظل الظروف الفسيولوجية للحُص (الظروف العازلة عند الرقم الـ 7.4) شكل 2-كيتو هو التمثيل السائد لأوكسالوأسيتات25 (الشكل9A)، وأن الإنولليس ليس شرطا ً مسبقاً لإزالة الكُبْرْكْر27 . ملاحظة, ملغ2+ الأيونات ليس لها تأثير على نسبة الأنواع oxaloacetate في درجة الألف الالوى 7.4 أو أقل من28. تحويل شكل كيتو الأوكسالوأسيتات إلى مركز الحفاز من FAHD1 (بتوجيه من oxalate ملزمة في الإنزيم المعقد (PDB: 6FOG15)) كشفت بقايا Q109 كمنظم التطابق من oxaloacetate ملزمة15. كما هو مبين في مادة أخرى15، الترابط الهيدروجين لمجموعة كربامويل Q109 استقرار الأوكسالوأسيتات - التشكل الناتجة عن التناوب حول C2-C3 السندات (الشكل9B، لوحة اليسار). ونتيجة لهذا التناوب، فإنالسندات C 3-C4 (التي ستُغلق) تعتمد شبه التخلص المتعامد بالنسبة إلى المدارات المننوعة في الكربون C2(الشكل9C). ويمكن إطلاق ثاني أكسيد الكربون. وسيكون المنتج الرئيسي لهذه العملية هو الرنين استقرت مغ-إيولات من بيروفات. ومن المعروف من التحقيقات من المجمعات oxaloacetate-Mg أن الأنولات يشكل مجمع الأكثر استقرارا28,29. على افتراض استقرار مماثل لmg-pyruvate الأنوليت المعقدة يمكن أن يتم حظر عامل مساعد من FAHD1، ولكن بقايا يسين K123 يمكن بروتون البيروفات-إينولات في توازن لحظر فقدان عامل مساعد15.
ويشير التفسير المعطى إلى أن البيروفات إنول وسيطاً متميزاً في وظيفة الأداة الحفازة للتقنية (FAHD1) . في هذه الخطوة في النموذج المفترض، لا توفر البيانات التجريبية أي إشارة أخرى عن سبب فتح الغطاء المغلق لإطلاق المنتج. يمكن أن يستنتج، مع ذلك، أن الآلية المقترحة تبدو وكأنها تثبيط إنزيم من قبل المنتج: يكشف الهيكل البلوري عن جزيء ماء مُحفظ في اتجاه الاتجاه نحو مركز FAHD1 الحفاز بواسطة بقايا H30 وE33 المقدمة في اللولب ة15، الذي يسبب على ربط الليجان وغطاء الإغلاق. إذا كان enol الأولية البقاء في توازن مع إينولات، يمكن أن تطفئ إينولات استقرار الرنين إلى بيروفات من قبل جزيء الماء. الهيدروكسيل الناتج ة يمكن أن تحل محل البيروفات من عامل الـ Mg الذي سيفتح عليه الغطاء. وأخيرا، سيتم استعادة المركز الحفاز في بيئة الميتوكوندريا. في هذا السيناريو الناقص، فإن جزيء الماء تجويف تعمل كحمض، على التوالي.
نشاط الهيدرولاز في فهد1
يتطلب نشاط هيدروليز من انزيم ضمنا تشكيل وسيط من نوكلوفيل الهيدروكسيل. وعادة ما توجد هذه الآلية في تركيبة مع النشاط الحفاز الحمضي ة القاعدة. حالة انتقالية من رد الفعل يجب أن تكون مستعدة عن طريق التحكم التشكلي من قبل سلاسل جانبية الأحماض الأمينية الحرجة في تجويف. في القياس على مناقشة وظيفة decarboxylase، سيتم وضع acylpyruvate الإنزيم ملزمة في شكل 2 كيتو تحت السيطرة التشكلية عن طريق ربط الهيدروجين من الأكسجين 4-كاربونيل إلى Q109 (الشكل9B، لوحة الحق). يكشف الهيكل البلوري لـ FAHD1 المؤكسد ة عن جزيء الماء المحفوظة في اتجاه اتجاه مركز الحفاز فهد1 ببقايا H30 وE33 التي تم تقديمها في حلزون قصير15. وE33-H30 دياد المختصة لdeprotonate المياه المتمركزة الاتجاه والهيدروكسيل الناتجة هي في التصرف المثالي لمهاجمة 4-carbonyl من acylpyruvate المقدمة تحت مراقبة التطابق ية من قبل Q10915.
وتجدر الإشارة إلى أنه تم اقتراح آلية مماثلة لـ FAH18. ومن المتوقع أن يؤدي الهجوم من قبل nucleophile هيدروكسيل إلى أنواع أوكسيانيون، التي استقرت على مدارية تسيطر C3-C4 السندات الانقسام (الشكل9C). في هذا النموذج، وC3-C4 دوران السندات (الشكل9C)يحدث بعد الهجوم النووي من قبل الهيدروكسيل شكلت المشار إليها في الشكل 9B (أي، فإنه يعد acylpyruvate لانشقاق السندات). المنتجات الأولية هي حمض الخليك وmg-pyruvate enolate. في هذا السيناريو الناقص، يمكن أن حمض الخليك إرواء enol إلى بيروفات وبالتالي مساعدة النزوح من المنتج. فوق حُسْرال الـ7.5 وفي وجود أيونات الممغ، توجد الـacylpyruvates في توازن بين أشكال الكيتو والإنول، وهذه الأخيرة في تفضيل طفيف30. وعلى الأرجح، فإن كلا الشكلين قادران على ربط العامل المساعد لـ FAHD1 تحت غطاء الإغلاق اللاحق. يتم إعاقة معالجة ركائز الميلانيك أسيلبيروفات بواسطة الإنزيم بسبب الهيكل المسطح للشكل enol. وC3-C4 انشقاق يؤدي إلى carbanion الفينيل دون استقرار صدى.
ولذلك، نقترح خطوة الكيتونال الحفاز ة التحضير لهجوم الهيدروكسيل النووي على أسيل كاربونيل. ومع ذلك، فإن عملية الكيتونز هذه تتطلب السيطرة على نقل البروتونات من مخلفات FAHD1، والتي من شأنها أن تعزو نشاط الإيزوماراز المتأصلة إلى FAHD1. ويقال أن حموضة الهيدروجين enol mg-bound يكشف عن زيادة عشرة آلاف أضعاف بالمقارنة مع شكل غير معقد28. [دبروتونأيشن] من ال [مغ] ملزمة [إنول-فورم] كنت يمكن ممكنة ب [أون-بروتوند] [ك123]. يمكن أن يساعد البروتون من K123 من قبل كاربوكسيليت من D102. يمكن لشبكة السندات الهيدروجين التي شكلتها بقايا D102-K47 K123 تعمل كما تتابع البروتون اللازمة في مركز الحفاز من فهد11. ويمكن بعد ذلك أن يتم إخماد هذه الإيولات المتوسطة التي شكلت من قبل E33-H30-H20 الثالوث تحت الكيتونز من الركيزة15. شكل 2 كيتو سوف تأتي تحت السيطرة التطابقية من Q109، والهيدروكسيل شكلت في وقت واحد من شأنه أن يهاجم الكربونيل أسيل. المناقشة الموجزة تعني السيطرة على FAHD1 حول جزيء الماء للتبديل بين الحمض والقاعدة من خلال التفاعل بين بقايا تشكيل تجويف.
التطبيقات المستقبلية أو اتجاهات الأسلوب
تطبيقات المستقبل من الأساليب المذكورة هنا عديدة. لا يزال عدد كبير من أعضاء الأسرة الكبرى من "فاه" ينتظرون التوصيف الوظيفي. وحتى المعلومات المتاحة عن الأنشطة الحفازة لأفراد الأسرة الكبرى المعروفة في الهيئة نادرة، وفي معظم الحالات، تستند إلى افتراضات نظرية بدلا ً من بيانات تجريبية. تطبيق الأساليب المذكورة هنا لأفراد الأسرة الفائقة من أجل الزراعة يعتمد على اهتمامات البحوث المحددة في علم الجراثيم. من ناحية أخرى، فإن المظاهرة الأخيرة التي مفادها أن أفراد الأسرة الفائقة في الهيئة العليا للأفراد الذين يلعبون أدوارا أساسية في مختلف المقصورات الخلوية (مثل السيتوسول مقابل الميتوكوندريا) تسلط الضوء على الحاجة إلى تحسين توصيف هذه البروتينات (ثلاثة منها كانت حددت حتى الآن)، على وجه الخصوص لأن البيانات الحالية تشير إلى أن بعض البروتينات غير مميزة قد تنفذ وظائف مختلفة في سياق البيولوجيا الميتوكوندريا، والبحوث الشيخوخة، وأبحاث السرطان. ومن المقترح أن التوصيف الجزيئي والفسيولوجي الكامل لهذه أفراد الأسرة الفائقة في فاه eukaryotic قد توفر نظرة ثاقبة هامة في المجالات الرئيسية للبحوث المعاصرة في قطاع الطب الحيوي. هناك حاجة إلى مزيد من البحث حول آليات FAHD1 (والإنزيمات ذات الصلة) لفهم أفضل للآليات الكامنة وراء ثنائية الوظائف من FAHD1، والتي لم يتم توضيحها بشكل كامل حتى الآن. وقد تساعد الدراسات الإضافية التي أجريت على المسوخ والتحقيقات في المثبطات ودراسات الهندسة والتركيب الهيكلي في حل السيناريوهات الآلية الحقيقية التي يبدو أن FAHD1 مختصة بها. وعلاوة على ذلك، فإن تصميم محاكاة enol بمساعدة الكمبيوتر قادرة على ربط عامل مساعد Mg سيؤدي في نهاية المطاف إلى مثبطات قوية من FAHD1.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه ولا يعلنون عنه عن أي مصالح مالية متنافسة. H. G. هو CEOCSO في MoleculeCrafting.HuGs e.U. وقدمت acylpyruvates لهذه الدراسة عن طريق توليف مخصص. تم دعم العمل في مختبر P. J. D. من قبل الصندوق العلمي النمساوي (FWF): رقم المشروع P 31582-B26. وقد تم تغطية رسوم النشر لهذه المخطوطة جزئياً من قبل الصندوق العلمي النمساوي تحت رقم المشروع P 31582-B26. أ. ن. و ب. ر. يدعمها صندوق العلوم النمساوي في إطار المشروع P28395-B26.
Acknowledgements
المؤلفون ممتنون جدا للمساعدة التقنية الخبراء من قبل أنابيلا بيتل وتطوير الأسلوب التجريبي من قبل هايمو بيرشر.
Materials
| Name | Company | Catalog Number | Comments |
| BL21(DE3) pLysS competent E. coli | Promega | L1195 | High-efficiency protein expression from gene with T7 promoter and ribosome binding site |
| pET E. coli T7 Expression Vectors | MERCK | - | http://www.merckmillipore.com/AT/de/life-science-research/genomic-analysis/dna-preparation-cloning/pet-expression-vectors/qFSb.qB.mLQAAAFA6.VkiQ0G,nav |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| 15 mL Falcon | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon | VWR | 734-0448 | centrifugal tubes |
| PS Cuvettes Spectrophotometer Semi-Micro | VWR | 30622-758 | VIS transparent cuvettes |
| UV Cuvettes Spectrophotometer Semi-Micro | VWR | 47727-024 | UV/VIS transparent cuvettes |
| isopropyl-β-D-thiogalactopyranosid (IPTG) | ROTH | 2316 | chemical used for induction of protein expression with the DE3/pET system |
| imidazole | ROTH | X998 | chemical used for elution of polyhistidine (6xHis) sequences from a nickel-charged affinity resin |
| Glass Econo-Column Columns | Bio-Rad | - | http://www.bio-rad.com/de-at/product/glass-econo-column-columns?ID=2cfb1c6e-32e8-4c72-b532-dd39013d707d&pcp_loc=catprod |
| chloramphenicol | Sigma-Aldrich | C0378 | antibiotic for bacterial growth selection; resistance endióded in pLysS plasmid of BL21(DE3) E. coli; 25 µg/mL final concentration |
| kanamycin | Sigma-Aldrich | 60615 | antibiotic for bacterial growth selection; to be used if this resistance is encoded in the employed pET vector; 50 µg/mL final concentration |
| ampicillin | Sigma-Aldrich | A1593 | antibiotic for bacterial growth selection; to be used if this resistance is encoded in the employed pET vector; 100 µg/mL final concentration |
| Ultra-15, MWCO 10 kDa | Sigma-Aldrich | Z706345 | centrifigal filters for protein enrichment; https://www.sigmaaldrich.com/catalog/product/sigma/z706345?lang=de®ion=AT |
| Ultra-0.5 Centrifugal Filter Units | Sigma-Aldrich | Z677108 | centrifigal filters for protein enrichment; https://www.sigmaaldrich.com/catalog/product/ALDRICH/Z677108?lang=de®ion=AT&cm_sp=Insite-_-prodRecCold_xviews-_-prodRecCold5-2 |
| oxaloacetic acid | Sigma-Aldrich | O4126 | TCA metabolite |
| sodium oxlalate | Sigma-Aldrich | 71800 | a competitive inhibitor of FAH superfamily enzymes |
| Dialysis tubing cellulose membrane | Sigma-Aldrich | D9277 | https://www.sigmaaldrich.com/catalog/product/sigma/d9277; or comparable |
| Ni-NTA agarose | Thermo-Fischer | R90101 | a nickel-charged affinity resin that can be used to purify recombinant proteins containing a polyhistidine (6xHis) sequence |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | https://www.thermofisher.com/order/catalog/product/26616?SID=srch-hj-26616 |
| ÄKTA FPLC system | GE Healthcare Life Sciences | - | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| HiTrap Phenyl HP column | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/it/shop/chromatography/prepacked-columns/hydrophobic-interaction/hitrap-phenyl-hp-p-05630 |
| Mono S 10/100 GL | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/ion-exchange/mono-s-cation-exchange-chromatography-column-p-00723 |
| Mono Q 10/100 GL | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/ion-exchange/mono-q-anion-exchange-chromatography-column-p-00608 |
| HiLoad Superdex column 75 pg (G75) | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/size-exclusion/hiload-superdex-75-pg-preparative-size-exclusion-chromatography-columns-p-05800 |
| HiLoad Superdex column 200 pg (G200) | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/size-exclusion/hiload-superdex-200-pg-preparative-size-exclusion-chromatography-columns-p-06283 |
| TECAN microplate reader | TECAN Life Sciences | - | https://lifesciences.tecan.com/microplate-readers |
| acetylpyruvate | MoleculeCrafting.HuGs e.U. | - | custom synthesis |
| benzoylpyruvate | MoleculeCrafting.HuGs e.U. | - | custom synthesis |
| VDX™ plate (24 wells) | Hampton | HR3-142 | 24 well plates used for crystallization via Hanging Drop Vapor Diffusion |
| paraffin oil | Hampton | HR3-411 | used for crystallization via Hanging Drop Vapor Diffusion |
| coverslips (22 mm) | Karl Hecht KG | 14043 | coverslips used for crystallization via Hanging Drop Vapor Diffusion |
| Luria broth (LB) medium | self-prepared | - | a general growth medium for E. coli: 5 g/L yeast extract; 10 g/L peptone from casein; 10 g/L sodium chloride; 12 g/L agar-agar |
| NZCYM medium | self-prepared | - | a better growth medium for E. coli, used for amplification: 10 g/L NZ amine; 5 g/L NaCl; 5 g/L yeast extract; 1 g/L casamino acids; 2 g/L MgSO4; adjust pH to 7.4 |
| Luria broth (LB) agarose plates | self-prepared | - | autoclaved agarose plates containing LB-medium and antibiotics for bacterial groth selection; https://www.addgene.org/protocols/pouring-lb-agar-plates/ |
| Ni-NTA running buffer | self-prepared | - | 20 mM Tris-HCl pH 7,4; 50-300 mM NaCl; 10-200 mM imidazole; ranges: optimal value varies among FAHD proteins |
| Ni-NTA elution buffer | self-prepared | - | 20 mM Tris-HCl pH 7,4; 50-300 mM NaCl; 200-500 mM imidazole; ranges: optimal value varies among FAHD proteins |
| HIC running buffer | self-prepared | - | 44 mM NaH2PO4; 6 mM Na2HPO4; 100 mM NaCl; 20 mM DTT; adjust to pH 7 |
| HIC running buffer AS | self-prepared | - | HIC running buffer saturated with ammonium sulfate (AS); adjust to pH 7: 70 g ammonium sulfate + 90 mL buffer, stirred overnight in the cold room; adjust to pH 7.0 |
| Mono S low salt buffer | self-prepared | - | 44 mM NaH2PO4; 6 mM Na2HPO4; 10-300 mM NaCl; ranges: optimal value varies among FAHD proteins |
| Mono S high salt buffer | self-prepared | - | 44 mM NaH2PO4; 6 mM Na2HPO4; 1-2 M NaCl; ranges: optimal value varies among FAHD proteins |
| Mono Q low salt buffer | self-prepared | - | 20 mM Tris-HCl; 15 mM NaCl; adjust to pH 8.0 |
| Mono Q high salt buffer | self-prepared | - | 20 mM Tris-HCl; 1 M NaCl; 10 % glycerol; adjust to pH 8.0 |
| G75 / G200 running buffer | self-prepared | - | 15 mM Tris-HCl; 300 mM NaCl; adjust to pH 7.4 |
| enzyme assay buffer | self-prepared | - | 50 mM Tris-HCl pH7.4; 100 mM KCl; 1 mM MgCl2 |
| protein crystallization buffer | self-prepared | - | G75 / G200 running buffer with 1 mM DTT |
| reservoir solution for crystallization | self-prepared | - | 100 mM Na-HEPES pH 7.5; 5-20 % (w/v) PEG4k; 10 mM-200 mM MgCl2 |
References
- Brouns, S. J. J., et al. Structural Insight into Substrate Binding and Catalysis of a Novel 2-Keto-3-deoxy-d-arabinonate Dehydratase Illustrates Common Mechanistic Features of the FAH Superfamily. Journal of Molecular Biology. 379, 357-371 (2008).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure (London, England: 1993). 7, 1023-1033 (1999).
- Weiss, A. K. H., Loeffler, J. R., Liedl, K. R., Gstach, H., Jansen-Dürr, P. The fumarylacetoacetate hydrolase (FAH) superfamily of enzymes: multifunctional enzymes from microbes to mitochondria. Biochemical Society Transactions. 46, 295 (2018).
- Guimarães, S. L., et al. Crystal Structures of Apo and Liganded 4-Oxalocrotonate Decarboxylase Uncover a Structural Basis for the Metal-Assisted Decarboxylation of a Vinylogous β-Keto Acid. Biochemistry. 55, 2632 (2016).
- Zhou, N. Y., Fuenmayor, S. L., Williams, P. A. nag genes of Ralstonia (formerly Pseudomonas) sp. strain U2 encoding enzymes for gentisate catabolism. Journal of Bacteriology. 183, 700 (2001).
- Izumi, A., et al. Structure and Mechanism of HpcG, a Hydratase in the Homoprotocatechuate Degradation Pathway of Escherichia coli. Journal of Molecular Biology. 370, 899-911 (2007).
- Manjasetty, B. A., et al. X-ray structure of fumarylacetoacetate hydrolase family member Homo sapiens FLJ36880. Biological Chemistry. 385, 935-942 (2004).
- Tame, J. R. H., Namba, K., Dodson, E. J., Roper, D. I. The crystal structure of HpcE, a bifunctional decarboxylase/isomerase with a multifunctional fold. Biochemistry. 41, 2982-2989 (2002).
- Ran, T., et al. Crystal structures of Cg1458 reveal a catalytic lid domain and a common catalytic mechanism for the FAH family. The Biochemical Journal. 449, 51-60 (2013).
- Ran, T., Wang, Y., Xu, D., Wang, W. Expression, purification, crystallization and preliminary crystallographic analysis of Cg1458: A novel oxaloacetate decarboxylase from Corynebacterium glutamicum. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 67, 968-970 (2011).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286, 36500-36508 (2011).
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290, 6755-6762 (2015).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 – a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475, 3561-3576 (2018).
- Taferner, A., et al. FAH domain-containing protein 1 (FAHD-1) Is required for mitochondrial function and locomotion activity in C. elegans. PLoS ONE. 10, 1-15 (2015).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63, 792-794 (2007).
- Bateman, R. L., Bhanumoorthy, P., Witte, J. F., McClard, R. W., Grompe, M., Timm, D. E., et al. Mechanistic Inferences from the Crystal Structure of Fumarylacetoacetate Hydrolase with a Bound Phosphorus-based Inhibitor. Journal of Biological Chemistry. 276, 15284-15291 (2001).
- Zeng, F., et al. Efficient strategy for introducing large and multiple changes in plasmid DNA. Scientific Reports. 8, 1714 (2018).
- Higuchi, R., Krummel, B., Saiki, R. K. A general method of in vitro preparation and specific mutagenesis of DNA fragments: study of protein and DNA interactions. Nucleic Acids Research. 16, 7351-7367 (1988).
- Jansen-Duerr, P., Pircher, H., Weiss, A. K. H. The FAH Fold Meets the Krebs Cycle. Molecular Enzymology and Drug Targets. 2, 1-5 (2016).
- Rupp, B. Origin and use of crystallization phase diagrams. Acta Crystallographica Section F Structural Biology Communications. 71, 247-260 (2015).
- Rupp, B. . Biomolecular Crystallography: Principles, Practice, and Application to Structural Biology. , (2010).
- Flint, D. H., Nudelman, A., Calabrese, J. C., Gottlieb, H. E. Enol oxalacetic acid exists in the Z form in the crystalline state and in solution. The Journal of Organic Chemistry. 57, 7270-7274 (1992).
- Pogson, C. I. I., Wolfe, R. G. G. Oxaloacetic acid tautomeric and hydrated forms in solution. Biochemical and Biophysical Research Communications. 46, 1048-1054 (1972).
- Kost, T. A., Condreay, J. P., Jarvis, D. L., Kost, A. T. Baculovirus as versatile vectors for protein expression in insect and mammalian cells. Nature Biotechnology. 23, 567-575 (2005).
- Steinberger, R., Westheimer, F. H. Metal Ion-catalyzed Decarboxylation: A Model for an Enzyme System 1. Journal of the American Chemical Society. 73, 429-435 (1951).
- Tate, S. S., Grzybowski, A. K., Datta, S. P. The stability constants of the magnesium complexes of the keto and enol isomers of oxaloacetic acid at 25. Journal of Chemical Society. , 1381-1389 (1964).
- Tate, S. S., Grzybowski, A. K., Datta, S. P. The acid dissociations of the keto and enol isomers of oxaloacetic acid at 25. Journal of Chemical Society. 1372, 1380 (1964).
- Brecker, L., et al. Synthesis of 2,4-diketoacids and their aqueous solution structures. New Journal of Chemistry. 23, 437-446 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved