Method Article
Fumarylacetotate 하이드로 아세테이트 도메인 함유 단백질의 발현, 정제, 결정화 및 효소 어세포
요약
fumarylacetotatetate하이드라세아세테이트 도메인 함유 단백질의 발현 및 정제는 예시(대장균, FPLC에서발현)로 기재된다. 정제된 단백질은 결정화 및 항체 생산에 사용되며 효소 공아에 사용됩니다. 선택된 광측정 분석제는 옥살로아세테이트 데카르박실라제 및 아실피루베테 하이드로라제로서 FAHD1의 다기능성을 표시하기 위해 제시된다.
초록
Fumarylacetotate 하이드라제 (FAH) 도메인 함유 단백질 (FAHD)는 진핵생물에 있는 FAH 수퍼패밀리의 확인된 일원입니다. 이 수퍼 패밀리의 효소는 일반적으로 주로 하이드로라제및 데카르복실라아제 메커니즘을 포함하는 다기능성을 나타낸다. 본 문서에서는 FAHD 단백질의 발현 및 정제를 위한 일련의 연속적인 방법을 제시하며, 주로 FAHD 단백질 1(FAHD1) 종(인간, 마우스, 선충류, 식물 등)을 소개한다. 커버된 방법은 대장균,친화성 크로마토그래피, 이온 교환 크로마토그래피, 예비 및 분석 젤 여과, 결정화, X선 회절 및 광측정 분석에서의 단백질 발현입니다. 높은 수준의 순도의 농축 단백질 (>98%) 결정화 또는 항체 생산에 사용될 수 있다. 유사하거나 낮은 품질의 단백질은 효소 검정에 사용되거나 검출 시스템에서 항원으로 사용될 수 있다(Western-Blot, ELISA). 이 작품에 대한 토론에서 FAHD1의 식별된 효소 메커니즘은 하이드라제 및 데카르박실라아제 이중 기능을 보다 자세하게 설명하기 위해 설명되어 있습니다.
서문
fumarylacetotatetate하이드라아제 (FAH)1,2 효소의 수퍼 패밀리는 고도로 보존된 촉매 FAH 도메인3,4,5,6을 공유하는 효소의 그룹을 기술합니다. , 7명 , 8개 , 9개 , 10. 일반적인 촉매 센터에도 불구하고, 이 효소는 다기능이며, 대부분은 원핵생물에서 발견되며, 여기서 그들은 복잡한 탄소 원에서 회수된 화합물을 분해하는 데 사용된다3. 이 가족의 단지 3명의 일원은 지금까지 진핵생물에서 확인되었습니다: FAH2를주는 이름, 뿐 아니라 FAH 도메인 포함 단백질 1 (FAHD1)11,12,13,14 ,15 및 FAH 도메인 함유 단백질 2 (FAHD2). FAHD1의 고갈은 손상된 미토콘드리아 호흡과 연관되었습니다13,16 및 중간 잠재력에 연결되는 세포 노화 표현형14의 가역적인 모형과 연관되었습니다 전자 수송 시스템의 단점. 인간 FAHD1 및 모델 시스템 (마우스, 선충, 암 세포주, 식물 등)에서의 정형 고리 뿐만 아니라 선택된 점 돌연변이 변이체는 잠재적인 관심의 약성 표적이 되었습니다. 이 연구를 위해, 순도의 높은 수준에서 재조합 단백질, 결정 구조 및 선택적 항체에 의해 유도 촉매 메커니즘에 대한 정보뿐만 아니라 중요합니다.
이 원고는 대장균,친화성 크로마토그래피, 이온 교환 크로마토그래피, 황산 암모늄 침전, 준비 및 분석 젤 여과, 결정화, X선 회절, 및 포토메트릭 분석. 여기에 설명된 방법 및 프로토콜의 목적은 세균학, 식물 생물학, 동물 및 인간 연구와 같은 다양한 분야에서 일하는 과학자들에게 FAH 수퍼패밀리의 구성원을 특성화하는 지침을 제공하는 것입니다. 특성이 없는 수퍼패밀리 구성원이 특정 분야에서 관련성이 있어야 합니다. 여기에 설명된 프로토콜은 다른 원핵생물 또는 진핵 FAH 수퍼패밀리 구성원을 특성화하는 것을 목표로 하는 프로젝트에 대한 귀중한 지원을 제공할 수 있습니다.
여기에 설명된 방법의 뒤에 근거는 잘못 기술된 단백질의 특성화 (특히, 알려지지 않은 생리적 관련성의 신진 대사 효소)를 위해, 정제된 재조합 단백질로 시작하는 접근이 허용한다는 사실입니다 체외 활성 효소 제제, 고품질 항체 및 선택된 효소에 대한 강력하고 특정 한 약리학 적 억제제와 같은 귀중한 고품질 연구 도구개발. 기재된 방법은 빠른 단백질 액체 크로마토그래피(FPLC) 및 X선 결정학을 필요로 합니다. 대체 방법(예를 들어, 화학적 유도 없이 단백질을 발현하거나, 열처리 후 원심분리에 의한 단백질 정제를 표시하기 위해 탈염 및 크기 배제 크로마토그래피를 표시하기 위해),다른곳에서 17에서 발견될 수 있다. FAH 슈퍼 패밀리 효소 2, 7,9,17,18의발현 및 정제를 위해 광범위한 방법을 사용할 수 있지만, 이 작업은 발현에 초점을 맞추고 특히 FAHD 단백질의 정제.
본 원고의 토론 섹션에서, FAHD1 단백질(하이드로라제, 데카르복실라제)에 대해 확인된 촉매 메커니즘(15)은 촉매 반응의 화학적 특성을 입증하기 위해 보다 상세하게 설명한다. 전작7,15,18(PDB: 6FOG, PDB:6FOH)을 기반으로 얻은 데이터는 케토-에놀 이소머라아제로서 효소의 제3 활성을 암시한다.
프로토콜
1. 유능한 대장균에서 FAHD 단백질의 발현
- FAHD 단백질의 발현을 위한 벡터를 가진 대장균의 형질전환
참고: 다음 섹션에서 설명하는 단계는 그림 1A,B의스케치에 요약되어 있습니다. 포인트 돌연변이 변이체를 포함한 모든 FAHD 단백질에 대해동일한 프로토콜이 적용됩니다. 이러한 변이체는 야생형 cDNA로부터 사이트 지시 돌연변이 발생 및 PCR 기술 19(예: 양면 SOE PCR20)를통해 수득될 수 있다.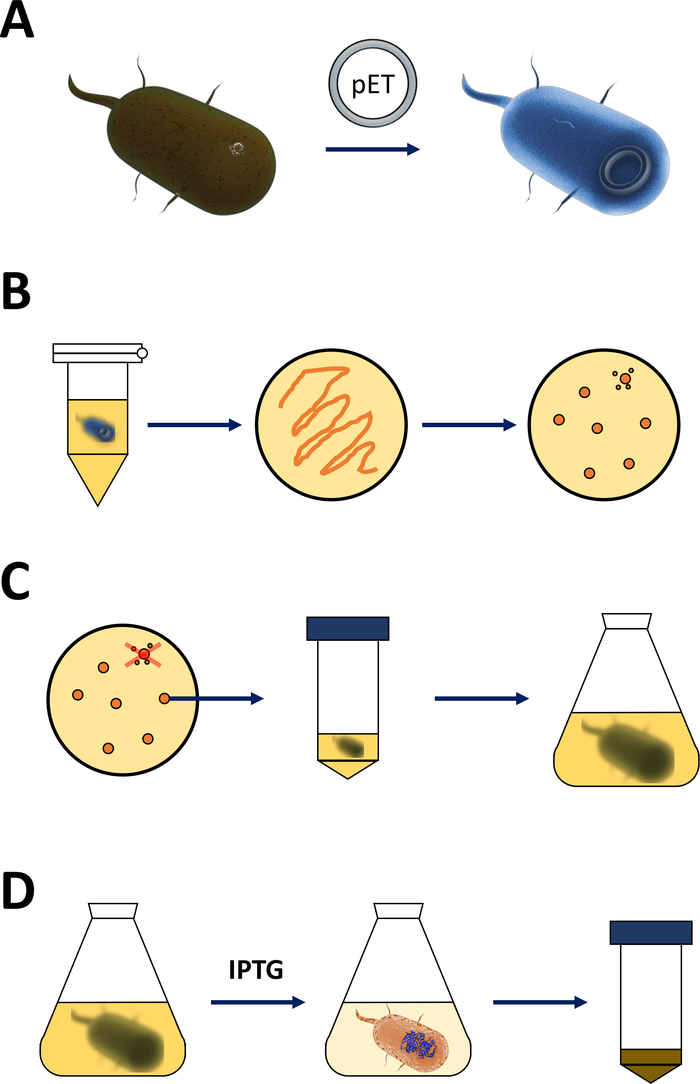
그림 1 : 유능한 대장균의 증폭과 단백질 발현 유도.
(a) pET 벡터를 유능한 BL21(DE3) pLysS 대장균 박테리아에 삽입하고, 섹션 1에 기재하였다. (b) 열 충격 프로토콜 및 pET의 도금은 대장균 박테리아를 형질전환시키고, 프로토콜의 1단계에서 기재하였다. 변형 된 박테리아는 선택을위한 항생제로 LB 한천 접시에 도금됩니다. (C) 섹션 1에 기재된 pET 형질전환 대장균 박테리아의 증폭. 식민지는 LB 한천 접시에서 수확하고 박테리아 밀도가 0.4의 경험적 임계 값에 도달 할 때까지 영양 매체 (LB 또는 NZCYM)에서 증폭됩니다. (D) DE3-IPTG-pET 시스템을 통한 단백질 발현의 유도, 섹션 1에 기재된 및 도2에 스케치. 단백질 생산은 화학 적 IPTG의 적용에 의해 시작됩니다. 섹션 1의 끝에서, 단백질을 포함하는 세균성 펠릿이 수확된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.- 유능한 BL21(DE3) pLysS 대장균 박테리아 및 pET 발현 벡터를 구한다(재료 표참조). 바람직하게는 다음 의 정제 단계를 단순화하기 위해 편의를 위해 N-단말 His-tag 또는 관련 캡처 태그를 인코딩하는 pET 벡터를 선택하는 것이 바람직하다.
- 선택한 FAHD 단백질의 cDNA를 획득하고 PET 발현 벡터의 활성 클로닝 부위에 삽입하고, T7 프로모터와 T7 터미네이터 부위 사이에 각각 삽입한다.
- 성공적인 플라스미드 증폭 및 검증 후 [상용 공급 업체에 의한 시퀀싱을 통해(T7 프라이머는 편의를 위해 pET 시스템과 함께 사용될 수 있다: T7 프로모터, 포워드 프라이머: TAATACGCACTATAGGG; T7 터미네이터, 리버스 프라이머: GCTAGTTATTGCTCAGCGG)], 얼음에 유능한 BL21 (DE3) pLysS 대장균 박테리아의 100 μL에 플라스미드 의 5-10 ng를 삽입합니다. 위아래로 흡인하지 말고 내용물을 혼합하기 위해 튜브를 약간 두드려보십시오.
- 박테리아를 얼음 에 30 분 동안 유지하고 몇 분마다 튜브를 부드럽게 두드려 주세요.
- 가열 장치 또는 수조를 42 °C (정확한)로 가열하십시오. 박테리아가 들어있는 튜브를 장치에 넣고 90 s (정확한)를 유지하십시오. 즉시 얼음에 넣어 (그림1A).
- 얼음에 5-10 분 후, NCZYM 배지의 600 μL을 추가하고 (재료 표참조) 박테리아 인큐베이터에 튜브를 넣습니다. 튜브를 37°C에서 1시간 동안 흔들림 방향을 따라 중간 속도로 흔들어 줍니다.
- 10cm LB-한천 플레이트상에 세균 배양의 플레이트 200 μL(재료표 참조), 선택의 항생제를 함유[예를 들어, BL21(DE3) pLysS 저항성(클로람페니콜)에 대한 특정 하나, 및 내성 용 항생제 1개 pET 벡터에 인코딩(카나마이신 또는 암피실린, 그림1B)].
- 밤새 37°C에서 세균 인큐베이터에서 LB-한천 플레이트 에 박테리아를 배양하였다.
- IPTG 유도에 의한 FAHD 단백질의 발현
참고: 다음 섹션에서 설명하는 첫 번째 단계는 그림 1C,D의 스케치로 요약됩니다. 세균 DE3 카세트 및 pET 벡터 시스템의 조합을 통한 T7 발현 시스템은 도2에 요약되어 있다.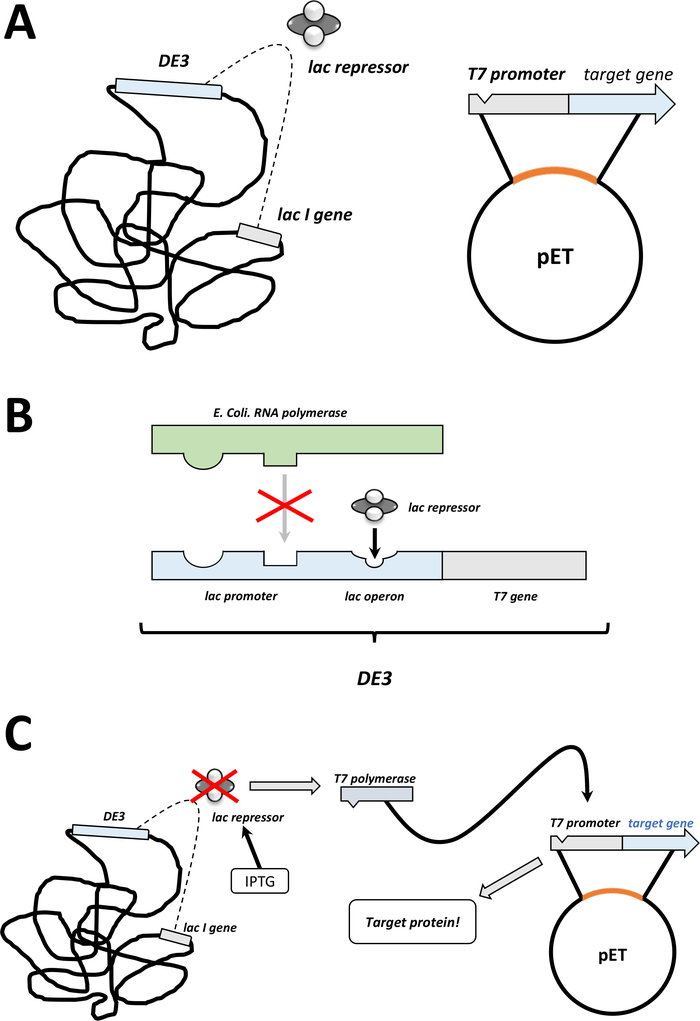
그림 2 : DE3 카세트/pET 벡터 듀얼 시스템 설명.
(A) pET 벡터의 스케치 된 게놈은 BL21 (DE3) pLysS 대장균 박테리아를 형질전환시켰다. 네이티브 세균 게놈은 DE3 카세트 (패널 B 참조)뿐만 아니라 지속적으로 lac 억압기 단위를 발현하는 lac 유전자를 운반합니다. 비-네이티브 pET 벡터는 T7 폴리머라제 프로모터와 터미네이터 서열 사이에 삽입된 단백질 유전자를 운반한다. 패널 B. (B) 네이티브 박테리아 게놈의 DE3 카세트는 대장균 RNA 폴리머라제 오페론의 관점에서 T7 폴리머라제에 대한 정보를 인코딩한다. 그러나 이 단백질은 LAC 압착기 유닛이 RNA 폴리머라제 단백질의 결합을 방지하기 때문에 발현되지 않는다. 따라서 T7 폴리머라제는 발현되지 않으며 외인성 단백질은 발현되지않습니다. (C) 화학 IPTG (재료표)의 적용은 lac 억압기 장치의 구조를 왜곡하고 DE3 카세트에 결합하는 것을 방지합니다. 그 결과, RNA 폴리머라제는 이제 T7 중합효소가 발현되는 카세트에 결합할 수 있으며, 이는 결국 외인성 단백질과 마찬가지로 이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.- 성공적인 식민지 형성 후, 하나의 단일 식민지를 선택 (어떤 위성 식민지없이) 전으로 선택 항생제와 NZCYM 또는 LB 배지의 5 mL에 분산 (단계 1.1.7). 밤새 37°C에서 세균 인큐베이터에서배양(도 1C).
- 성공적인 세균 성장 후, 단백질 량의 수요에 따라 250 mL, 500 mL 또는 1 L 배치의 배지에서 박테리아를 증폭.
- 부피에 적정한, 단계 1.1.7에서 수행으로 선택된 항생제를 적용하고 조밀한 세균 사전 배양 (즉, 2.5-5.0 mL 에서 250 mL 의 배지 부피 등)의 약 1%-2%를 추가합니다. 1.2.5단계(1mL 이상)에서 사용할 샘플을 취하고 600 nm에서 광학 밀도(OD)를 확인합니다. 세균 인큐베이터에서 배양 박테리아를 37°C에서2-3시간 동안(도 1C).
- 2-3시간 후에 포토메트릭 분석을 위해 샘플을 그립니다. 600 nm에서의 OD가 0.4에 도달하면, 최대 1 mM MM 이소프로필-β-D-티오갈라크토피라노시드(IPTG, 재료 표참조)까지 200 μM을 적용한다.
참고: 실제 값은 각 FAHD 단백질 또는 포인트 돌연변이 변이체에 대한 경험적이며, 여기서 1 mM IPTG는 적용되어야 하는 최대값입니다. 이는 단백질 발현을 유도한다(도1D, 도 2C). - 37°C에서 세균 인큐베이터에서 3-5시간 더 후, 단백질 발현이 소진된다.
참고: 온도 제어에 대한 의견은 토론 섹션을 참조하십시오. 유도 후 5 시간 이상 흔들리는 것은 권장되지 않습니다. 1.2.5단계(1mL 이상)에서 사용할 샘플을 채취하고 600 nm에서 광학 밀도(OD)를 확인합니다.- 5,000 x g에서 원심분리를 통해 세균 펠렛을 5 분 동안 수확. 상급제를 버리고 펠릿을 -80 °C에서 동결하여 더 긴 저장을 위해 또는 -20 °C에서 짧은 저장을 위해 (그림1D).
- "-I"(유도 전) 및 "+I"(유도 후)로 표시된 두 개의 검색된 포토메트릭 샘플을 통해 유도를 확인합니다. 세균 펠릿의 원심분리 및 재현탁 후, 동일한 양의 총 단백질을 적재하여 SDS-PAGE에 의해 두 샘플을 분석하였다.
참고: "+I" 샘플은 선택한 단백질의 분자량과 관련된 강한 밴드를 표시해야 하지만 "-I" 샘플은 이 밴드를 포함해서는 안 됩니다. 낮은 유도 수준은 단백질의 생산을 위한 일반적인 문제입니다, 그러나 표현된 단백질의 수준은 수시로 다음 단계를 위해 충분합니다. 높은 유도 수준은 장점이지만 필수는 아닙니다.
2. 세균성 펠릿 의 및 파편 의 여과의 Lysis
- 선택한 단백질이 그의-tagged 또는 태그가 지정되지 않았는지여부에 따라 Ni-NTA 실행 버퍼(-tagged, 재료 표참조) 또는 얼음-차가운 HIC 실행 버퍼(태그가 지정되지 않은)를 선택합니다.
- 원래 세균 현탁액의 각 250 mL에 대해, 세균 펠릿에 선택한 완충액의 5 mL을 적용하십시오 (250 mL의 경우 5 mL, 500 mL의 경우 10 mL 등). 적용된 버퍼의 5 mL당 10 μL β-메르카포에탄올(β-ME)을 첨가합니다. 10 mL 파스퇴르 파이펫을 사용하여 펠릿을 긁거나 피펫팅하여 펠릿을 서스펜션으로 기계적으로 강제로 밀어 넣습니다(파이펫팅 하는 동안 기포 형성을 피하십시오). 결국 모든 현탁액을 하나의 50 mL 튜브로 옮김을 전달합니다.
- 바람직하게는 현탁액 (중간 힘에서 15 s에 대한 6x) 초음파 처리.
- 4 °C에서 고속으로 30 분 (10,000 x g). 얼음위에 필터 유닛(예: 0.45 μm, 0.22 μm)으로 상급체를 연속적으로 걸루다.
참고 : 이전 원심 분리 단계에 따라 작은 필터 기공 크기를 통해 직접 여과하는 것은 지루할 수 있으며 일반적으로 더 큰 기공 크기를 통해 사전 여과가 필요합니다. 더 나은 결과를 위해 DNAse를 추가할 수 있습니다. - 샘플을 얼음에 저장하고 단백질이 그의-tagged 또는 태그가 지정되지 않았는지여부에 따라 섹션 3 또는 4로 즉시 진행하십시오.
3. Ni-NTA 친화성 크로마토그래피를 사용하여 그의-tagged FAHD 단백질의 정제
참고:Ni2+ 이온은 니트로트리아세트산(NTA)을 통해 친화성 크로마토그래피에 사용되는 아가로스 수지(고정화 금속 이온 크로마토그래피, IMAC, 도 3A)에결합된다. 폴리 히스티딘 아미노산 태그는 이 Ni-chelate에 강하게 결합하고, 그의 태그가 붙은 단백질은 나머지 단백질의 대다수에서 분리될 수 있습니다. Ni-NTA 컬럼의 설명된 준비에 대한 대안은 미리 포장된 Ni-NTA 컬럼 및 FPLC 시스템을 사용하는 것입니다.
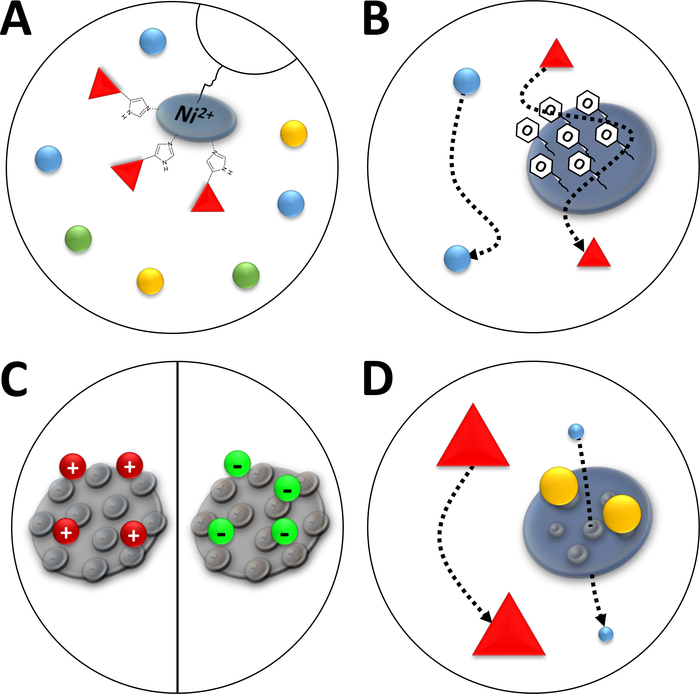
그림 3 : 일반적인 유형의 크로마토그래피의 스케치 일러스트레이션.
(A) Ni-NTA 컬럼의 수지. NTA는 고정화 금속 이온 친화성 크로마토그래피(IMAC)의 관점에서 사용되는 이중 니켈 이온을 보유하고 있습니다. 폴리히스티딘 태그는 이 모티프에 바람직하게 결합하고 이미다졸에 의해 용출될 수 있다. (b) 페닐계 소수성 상호작용 크로마토그래피(HIC-페닐)에서 실리카 입자의 전형적인 코팅. 소수성 단백질은 코팅 물질과 상호 작용하고 다른 것들이 아닌 동안 그들의 이동에 지연된다. (C) 이온 상호 작용 크로마토그래피에서 실리카 입자의 전형적인 코팅. 편광 및 충전 된 단백질은 코팅 재료와 상호 작용하고 다른 단백질은 그렇지 않은 동안 마이그레이션이 지연됩니다. (D) 크기 배제 크로마토그래피(SEC)에서 실리카 겔의 수지. 실리카 물질에서 정의된 기공에 기초하여, 단백질은 그들의 크기(그들의 분자 질량에 대응하는 제1 근사치에서)에 의해 분리될 수 있다. 작은 단백질은 다공성 컬럼 물질에 침투하여 지연되는 반면, 큰 단백질은 다공성 입자 주위로 더 빨리 이동합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 단계 2.5로부터 진행 (즉, 단백질은 Ni-NTA 실행 완충액에 있고 얼음 상에서 0.22 μm 필터 단위로 여과된다).
- 빈 기둥을 세척하고 안정적인 리테이너에 부착하여 빈 플라스틱 또는 유리 컬럼을 준비합니다. 단백질 현탁액의 부피에 따라 컬럼의 크기를 선택합니다.
- 단백질 현탁액 의 각 10 mL에 대해, 500 μL의 Ni-NTA 아가로즈 슬러리를 컬럼에 적용하십시오 (사용 전에 심하게 흔들어주세요). 슬러리를 천천히 바르고 파이펫을 사용하여 컬럼의 바닥 필터에 떨어뜨립니다. 몇 초 정도 걸리는 열을 정착시게 합니다.
- Ni-NTA 실행 버퍼로 열을 완전히 채우고 아가로즈 수지를 방해하지 않도록 합니다. 버퍼가 중력에 의해 실행되도록 합니다. 이 과정은 액체에 엄지 손가락 압력을 가하여 가속화 될 수 있습니다 (뚜껑 이나 장갑과 엄지 손가락 압력을 사용 하 여), 하지만 아가로즈 수 지 왜곡 하지 않도록 주의.
- 단백질 현탁액을 바하십시오. 이전과 마찬가지로, 샘플은 중력에 의해 실행하자. 유량이 낮은 경우 컬럼에 단백질의 결합이 향상되기 때문에 엄지 압을 사용하여 이 단계를 가속화하는 것은 권장되지 않습니다. 튜브 (재료 표)에서흐름을 수집합니다.
- 샘플이 통과한 후 전체 열을 Ni-NTA 실행 버퍼로 다시 채웁니다. 아가로즈 수지의 방해를 하지 않도록 주의하십시오. 샘플이 중력에 의해 실행하자, 하지만 이전 단계와는 달리, 엄지 압을 통해 프로세스를 가속화하는 것이 좋습니다, 때문에 비특정 상호 작용의 잠재적 인 오염이 이 방법으로 중단 될 수 있습니다. 튜브에 세척 용액을 수집합니다. 이 단계를 반복합니다.
- 열 아래에 UV 투명 큐벳을 놓고 Ni-NTA 용출 버퍼 1 mL를 적용합니다. 수지에 엄지 손가락 압력을 가하지 않고 샘플을 수집합니다.
- 280 nm 대 빈 샘플(즉, Ni-NTA 용출 버퍼)에서 샘플의 광학 밀도(OD)를 확인합니다. 최적으로, 샘플은 2.5보다 큰 OD를 표시합니다. 0.5 미만의 OD는 샘플에 상당한 양의 단백질이 없다는 것을 나타냅니다.
참고: 토론 섹션에 설명된 바와 같이, 용출 완충제의 염 및 이미다졸 농도는 각 FAHD 단백질에 대해 개별적으로 적용되어야 할 수도 있다. - OD가 0.5 이하로 떨어질 때까지 3.1.7 및 3.1.8 단계를 반복합니다. 얼음에 튜브에 높은 OD와 모든 샘플을 풀.
- 3.1.4 단계로 다시 시작하여 3.1.5 단계의 이 반복에 대한 새로운 입력으로 3.1.5 단계의 흐름을 사용합니다. 3.1.6단계에서 수집된 첫 번째 샘플이 0.5 미만의 OD를 표시할 때까지 이 과정을 반복합니다.
참고: 토론 섹션의 문제 해결 부분에 설명된 대로, 그의 태그가 붙은 단백질은 Ni2+-수지에 불충분하게 결합할 수 있다. 이러한 경우, 이 단계 또는 대체 방법(예를 들어, 이온 교환 크로마토그래피)의 반복이 요구된다. - SDS-PAGE 분석을 위해 모든 중간 분획의 샘플을 채취합니다.
- Ni-NTA 용출 완충제의 FAHD 단백질은 동결 및 해동 시 침전됩니다. 따라서, 다른 완충제에 대하여 단백질을 투석(밤새 얼음상에서, 투석 완충제의 100 mL당 DTT의 1 μL을 사용). 이 단계 이후에 수행해야 하는 이온 교환 크로마토그래피 유형에 따라 저염 버퍼를 사용하십시오. 일반적인 셀룰로오스 튜브를 사용하여 14 kDa (재료표)의 일반적인 분자량 컷 오프를 사용합니다.
- 하룻밤 투석 후, 선택적으로 초원심분리 필터 유닛을 사용하여 단백질을 농축한다. SDS-PAGE 분석(12.5% 러닝 젤, 4% 스태킹 젤)을 수행하여 단백질의 잠재적 손실, 용출 부족 및 단백질 순도를 전반적으로 확인합니다. 모든 것이 괜찮으면 섹션 5로 진행하십시오.
4. 소수성 상호 작용 크로마토그래피 (HIC)를 통해 태그가 지정되지 않은 FAHD 단백질의 정제
참고: FPLC(그림 3B)에 대한 HIC 컬럼에서 실리카겔의 코팅 표면에 페닐기는 소수성 문자에 따라 단백질의 분리를 가능하게 한다. 설명된 단계는 5mL의 HIC-페닐 컬럼이 장착된 FPLC 시스템으로 수행해야 합니다. 컬럼은 1 M NaOH로 세척하여 상이한 단백질을 재사용할 수 있다. 그러나, 한 번 FAHD 단백질의 한 유형에 대 한 사용 하는 열 단백질의이 유형에 대 한 재사용 해야.
-
황산 암모늄 (AS) 강수량
- 2.5단계에서 진행합니다. 단백질은 얼음 차가운 HIC 실행 버퍼 (재료표)에있습니다.
- 제조된 단백질 용액의 부피를 마이크로리터(V초기)에 정확하게 평가한다. 천천히 및 드롭 와이즈 는 35 볼륨 % AS 포화에 도달 할 때까지, 미리 냉각 HIC 실행 버퍼 AS 솔루션을 추가 : VAS 추가 = V초기 * 0.538. 4°C에서 30분 동안 용액을 고속으로 15분 간(≥10,000 x g)부드럽게 저어줍니다.
- 얼음에 0.22 μm 필터 유닛을 사용하여 상급체를 걸. 선택적으로, SDS-PAGE 분석을 위해 샘플을 채취하십시오: 1:4를 희석하고 95°C에서 즉시 5분 동안 가열하거나 그렇지 않으면 샘플이 덩어리가 됩니다. 시료는 다른 날을 진행하기 위해 이 시점(-20°C)에서 동결될 수 있다.
-
HIC 열을 사용하는 FPLC
- FPLC 시스템을 설정하고 5mL HIC-페닐 컬럼을 20% EtOH(H 2O)의 5개의열 볼륨(CV)으로 평형화한 다음 H2O의 5 CV를 사용합니다.
- HIC 실행 버퍼(정확한)의 260mL를 140mL의 HIC 실행 버퍼 AS(정확한)와 혼합합니다. 그 결과 35개의 볼륨%AS 솔루션이 생성됩니다. pH(7.0);; 버퍼 A. 버퍼 B는 실행 중인 버퍼의 250 mL입니다. 버퍼 A와 B에 1 mM DTT를 추가한 다음 얼음위에 보관합니다.
- 이 순서에서 버퍼 A 8mL, 버퍼 B의 8mL 및 버퍼 A의 8mL로 컬럼을 평형화합니다. 프로토콜 단계 4.1에 준비된 샘플을 적용합니다. 280 nm에서 기준선 광학 흡수가 1000-500 mAU에 도달 할 때까지 버퍼 A로 씻으하십시오.
- AS의 농도가 33 % (v / v)되도록 버퍼 A와 B의 혼합물을 적용합니다. 1 CV로 씻어 크로마토그램에 고원이 됩니다. 버퍼 B의 그라데이션 설정(시간에 따라 최대 100% 버퍼 B): 3.8분동안 버퍼 B의 1.5mL(즉, 1% B/mL 경사가 있는 5.7% 버퍼 B). 280 nm에서 UV 신호가 상승하면 분수를 수집하기 시작하여 즉시 얼음위에 놓습니다.
- 결국 버퍼 B로 열을 세척합니다. SDS-PAGE 분석을 위해 모든 분획의 샘플을 채취합니다. 액체 질소를 사용하여 모든 샘플을 동결하고 -80 °C에 저장합니다.
- 수집된 분획에서 FAHD 단백질을 검출하기 위해 SDS-PAGE(및 웨스턴 블롯) 분석을 수행합니다. 단백질을 포함하는 분획은 다음 프로토콜 단계에 설명된 바와 같이 풀화되고 추가 정제에 적용된다. H2 O및 20% EtOH(H2O)로 컬럼을 세척합니다.
5. 이온 교환 크로마토그래피를 통한 FAHD 단백질 의 정화
참고: 충전된 작용기를 가진 분자는 FPLC에 대한실리카 입자 컬럼에 결합된다(그림 3C). 이것은 표면 전하와 같은 그들의 이온 성 특성에 따라 단백질의 분화를 가능하게 합니다. 설명된 단계는 각각 FPLC 컴퓨터 및 관련 노하우로 수행해야 합니다. 기재된 방법은 양이온 또는 이온 교환 크로마토그래피에 대해 동일하지만 사용되는 버퍼는 약간 다릅니다.
- 양이온 또는 이온 교환 크로마토그래피 시스템을 선택했습니다. 이 선택은 경험적이며 FAHD 단백질에 따라 다를 수 있습니다. 최적으로, 두 가지 방법을 연속적으로 사용할 수 있습니다.
- FPLC 시스템을 설치하고 5 CV 의 20% EtOH (H2O)로 열을 세척한 다음 H2O.의 5 CV가 저염 완충제, 고염 완충제 및 다시 저염 완충액의 1 CV로 컬럼을 평형화합니다.
- 샘플(3.1.11단계에서 올바른 저염 완충제에 대해 투석)을 컬럼에 적용합니다. 흐름을 수집합니다. 낮은 소금 버퍼로 1 CV에 대한 열을 세척합니다.
- 그라데이션 용출 설정: 1mL/min의 유량으로 30분 에서 100% 고염 버퍼, 0.5 mL/min의 유량으로 60분. 이는 정제를 최적화하기 위해 이미 공지된 FPLC 크로마토그램에 기초하여 재선택될 수 있다. 모든 피크 분수를 수집합니다.
참고: 고염 조건은 토론 섹션에 설명된 대로 FAHD 단백질에 따라 다를 수 있습니다. - 그라데이션이 완료된 후 1 CV 범위에서 피크가 더 이상 감지되지 않을 때까지 고염 버퍼로 실행합니다(분수 수집).
- 수집된 모든 분획의 샘플을 채취하고 SDS-PAGE 분석(12.5% 러닝 젤, 4% 스태킹 겔)을 수행합니다. 개별 샘플을 액체 질소에 동결하고 -80 °C에 보관하십시오.
- SDS-PAGE 분석이 완료된 후 FAHD 단백질을 함유한 샘플을 풀링하고 다른 샘플을 폐기합니다. 선택적으로, 초원심분리 필터 유닛을 사용하여 단백질을 농축한다.
- 0.5M NaOH(또는 기타 세제)에 25% SDS 의 1mL를 적용하여 컬럼을 청소합니다. H2 O및 20% EtOH(H2O)로 컬럼을 세척합니다.
- 선택적으로, 대체 컬럼(양이온 또는 음이온 교환 크로마토그래피)으로 섹션 5를 반복한다. 이 방법으로부터 수득된 단백질은 기본적인 활성 검사를 수행하기에 충분히 순수하거나 결정학을 위한 스크리닝 검정 검정검에 사용될 수 있다. 고급 어플리케이션의 경우 섹션 6을 진행합니다.
6. 크기 배제 크로마토그래피를 통한 FAHD 단백질 의 정제 (SEC)
참고: FPLC를 위한 실리카 겔 컬럼내의 다공성 입자는 유체역학적 반경과같은 분자 크기에 따라 단백질의 분화를 가능하게 한다(그림 3D). 설명된 단계는 SEC 열을 사용하여 FPLC 시스템으로 수행해야 합니다.
- SDS-PAGE 및 은 염색을 통해 감지된 오염의 분자량에 따라 SEC 컬럼을 선택하십시오. 설명된 메서드는 두 열 모두에 적합합니다. 400 mL의 H2O로 하룻밤 동안 열을 씻고 SEC 실행 버퍼와 평형화하십시오. 이 단계를 자동화하기 위해 FPLC 시스템에 대한 프로그램을 작성하는 것이 좋습니다.
- SEC 실행 버퍼의 300 mL에 1 mM DTT를 추가하고 얼음에 넣어. 실행 중인 버퍼입니다. 이 버퍼의 60mL를 열에 적용합니다.
- 단백질 샘플(10,000 x g 10분)을 원심분리하여 미세 침전을 제거합니다. 열에 상급체를 적용합니다. 일반적으로 FPLC 전에 상급자를 필터링하는 것이 좋습니다.
- 모든 단백질이 용출될 때까지 러닝 버퍼를 컬럼에 적용합니다. 적절한 부피(예: 2mL)의 분수로 모든 피크를 수집합니다. SDS-PAGE샘플을 채취하고 액체 질소를 사용하여 모든 분획을 동결합니다. 동결된 분획을 -80°C에 보관하십시오.
- SDS-PAGE(및 웨스턴 블롯) 분석 후, FAHD 단백질을 함유하는 모든 분획을 수집하고 풀링합니다. 은 염색은 여전히 존재할 수 있는 경미한 오염을 감지하는 것이 좋습니다.
- 단백질을 농축하기 위해 초원심분리 필터 유닛을 사용하십시오. FAHD 단백질에 필수는 아니지만, 일반적으로 탈염 단계 (예를 들어, 투석에 의해)는 효소 검문 및 결정화에 권장됩니다.
- FAHD 단백질의 순도를 향상시키기 위해 다른 유속 및 염 농도(경험적)로 6.3-6.6단계를 여러 번 반복합니다. H2 O 및20% EtOH(H2 O)로 하룻밤 동안 컬럼을 세척합니다.
7. 기질 옥살로 아세테이트 및 아세틸 피루베테가있는 기본 FAHD 활성 검사
참고: FAHD 단백질 1(FAHD1)은 옥살로아세테이트 데카르박실라제(ODx)와 아실피루바트 하이드로아제(ApH) 활성을 표시합니다. 이 내용은 토론 섹션에 자세히 설명되어 있습니다. 수성 용액에서 케토 에놀 타우토화 (즉, enolization)에 의한 불안정화로 인해, 옥살로 아세테이트는 시간이 지남에 따라 자체적으로 부패 (자동 데카르박실화) 공동 인자 농도 및 pH의 함수로. 7의 pH 및 25 °C의 온도에서, 이 효력은 극적이지 않습니다, 그러나 측정은 자동 탈카르복질 및 효소 사격둘 다를 설명하기 위하여 비워져야 합니다. 파이펫팅 방식은 그림 4A에설명되어 있습니다. 일반적으로 이 분석에 잘 보정된 파이펫을 사용하는 것이 좋습니다.

그림 4 : 효소 시약용 파이펫팅 방식.
(A) 기본 기질 기반 FAHD 단백질 효소 검사에 대한 스케치 파이펫팅 방식. 기판 블랭크: -S/-E; 기판 샘플: +S/-E; 효소 블랭크: -S/+E; 효소 샘플: +S/+E (S: 기판, E: 효소). 자세한 내용은 프로토콜 7단계를 참조하십시오. (B) FAHD 단백질의 마이클리스-멘텐 역학을 평가하기 위한 스케치된 파이펫팅 방식. 기판 블랭크: -S/-E; 기판 샘플: +S/-E; 효소 블랭크: -S/+E; 효소 샘플: +S/+E (S: 기판, E: 효소). 자세한 내용은 프로토콜의 섹션 8을 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 마이크로플레이트 리더를 시동하고 25°C에서 30분 동안 평형화합니다. 255 nm에서 12 개의 우물 (그림 4A에설명 된 대로)을 읽기위한 프로그램을 설정합니다. 5 ms 시간 지연이있는 25 개의 여러 판독을 사용하는 것이 좋습니다. 2분(총 30분)마다 15배씩 측정할 수 있는 주기를 설정합니다.
- 기본적으로, pH 7.4에서 1 mM MgCl 2와 함께 효소 분석 버퍼 (재료 표참조)를 준비합니다. 변이체 FAHD 단백질은 상이한 보조 인자 또는 pH 수준을 요구할 수 있다. Mg2+ 및 Mn2+는 FAHD13,11,12,21에대한 알려진 보조 인자입니다.
- 효소 분석 버퍼로 희석하여 1 μg/μL 단백질용액을 만듭니다(재료 표).
- 시험될 기질의 20 mM 용액의 1 mL을 설정(지금까지 확인된 FAHD 단백질의 기질은 효소 분석 버퍼에서다른곳에 열거되어 3) .
- 그림 4A에표시된 파이펫팅 방식에 따르면, 효소 블랭크 및 시료 웰을 준비합니다: 효소 분석 버퍼(물자 표)의 파이펫 90 μL을 5 μL(5 μg)의 효소 용액으로 우물에 넣습니다.
- 그림 4A에표시된 파이펫팅 방식에 따르면, 기판 블랭크 및 샘플 웰을 준비합니다: 파이프95 μL의 효소 분석 버퍼를 웰에 넣습니다.
- 측정 직전에 효소 분석 버퍼 5 μL을 6개의 빈 우물에 적용합니다. 시료 웰에 20 mM 기판 용액의 5 μL을 적용합니다. 멀티 채널 파이펫을 사용하는 것이 좋습니다.
- 50 μL 설정에서 멀티채널 파이펫을 사용하여 모든 웰을 부드럽게 혼합합니다. 공백으로 시작하여 샘플 우물을 진행합니다. 거품을 만들지 않도록 주의하십시오. 플레이트를 마이크로 플레이트 판독기에 삽입하고 255 nm(7.1단계에서 설명한 대로)에서 각각 잘 측정합니다.
- 스프레드시트에서 분석을 수행합니다. 포토미터의 원시 데이터를 스프레드시트에 복사하고 모든 설정(예: 모든 설명서)을 다른 시트에 씁니다. 4개의 제제 각각의 3개의 웰의 데이터를 평균한다. 샘플에서 공백을 뺍니다. 또한 표준 편차를 계산하고 공백 및 샘플의 편차를 합산합니다.
- 이 데이터를 플로팅합니다(y: 광학 밀도, x: 최소 시간). 기하급수적으로 감소하는 곡선이 표시되어야 합니다. 사용 중인 기판의 종류에 따라 처음 10분 이내에 초기 증가가 관찰될 수 있으며, 그 후에는 신호가 감소합니다. 이는 토론 부에서 보다 상세히 설명된 바와 같이 기판의 케토에놀 토토화에 상이하게 된다.
- 시간에 따른 광 신호 데이터를 플롯의 최대값으로 분할하여 데이터를 [0, 1] 범위로 축소합니다(예는 도 5A에제공된다). 초기 감소에서 시작하여 곡선의 선형 범위를 식별하고 음수 경사(1/min)를 계산합니다.
- OD 감소의 시간 과정은 초기 농도를 통해 기판에 연관됩니다 : 100 nmol / well * 경사. 평가된 단백질 농도 c0을 사용하여, 특정 활성이 계산된다: 100 nmol/well * 경사 * 1/c0. μg/well에서 c0을 발현하면, 이런 식으로 계산된 특정 활동은 μmol/min/mg과 동일한 단위 nmol/min/μg를 사용하여 표현됩니다.
8. FAHD 단백질의 마이클리스-멘텐 역학 평가
참고: 특정 단백질 활성은 반응이 일어나고 있는 상대적인 단백질 기질 농도 및 물리적 부피 둘 다에 의존하기 때문에 FAHD 단백질의 Michaelis-Menten 역학을 평가하는 것은 지루합니다. 신뢰할 수 있는 결과를 얻으려면 정상 상태 역학을 설정해야 합니다. 96 웰 UV 투명 플레이트에서 테스트된 프로토콜은 다음 단계에 설명되어 있습니다. 사소한 오류는 일반적으로 실험을 망치기 때문에 모든 단계는 세심한주의를 기울여 수행해야합니다. 아래에 설명된 보다 복잡한 분석방법을 시도하기 전에 섹션 7에 설명된 분석방법을 마스터하는 것이 좋습니다.
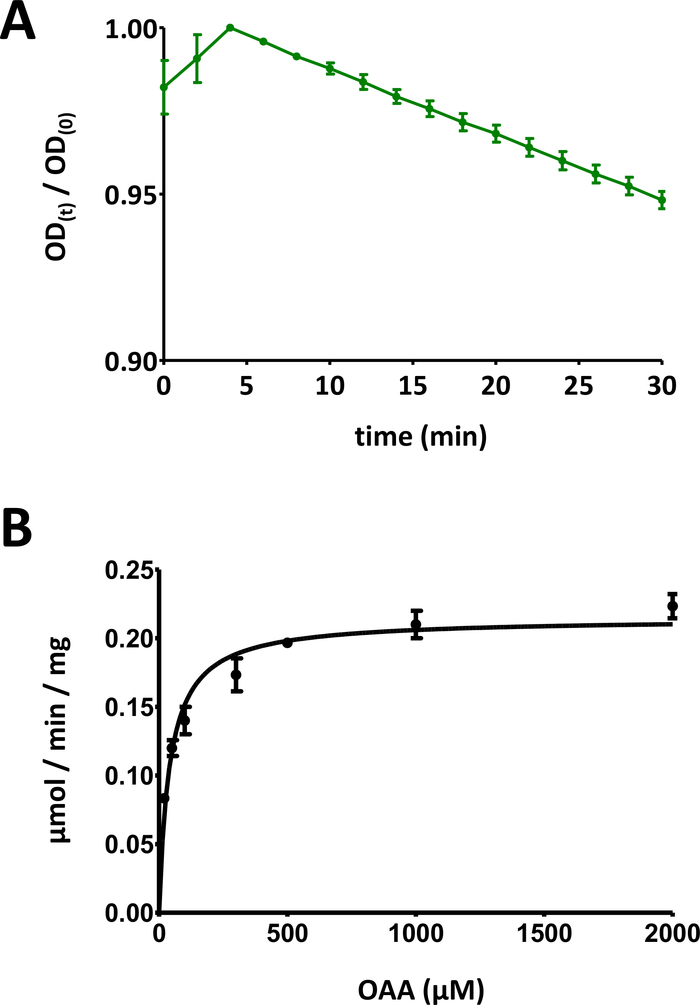
그림 5 : 효소 검사의 예시적인 결과.
(A) 표준 편차로 기본 기질 기반 FAHD 단백질 효소 효소 검사(0 대 1의 범위로 정규화)에 대해 수득된 예시적인 UV 흡수 곡선. 주어진 시간에 광학 밀도(OD)(OD)/OD(0)]는 초기 OD[t=0]로 정규화됩니다. OD(0)]. 자세한 내용은 프로토콜의 섹션 7을 참조하십시오. (b) 표준 편차를 가진 인간 FAHD1 단백질의 예시적인 마이클리스-멘텐 역학. 자세한 내용은 프로토콜의 섹션 8을 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 마이크로플레이트 리더를 시작하고 25°C에서 30분 동안 평형화합니다. 255 nm에서 72개의 우물(그림 4B에설명된 대로)을 판독하기 위한 프로그램을 설정합니다. 5ms 시간 지연으로 25개의 다중 판독을 사용하는 것이 좋습니다. 사이클을 설정하여 2분(총 30분)마다 15배씩 측정합니다.
- 7.2 및 7.3 단계를 수행합니다. 이어서, 효소 분석 완충액에 1mL의 100 mM 기질 용액을 설정한다.
- 효소 분석 버퍼에서 기질 용액의 희석을 준비하십시오 : 40 mM, 20 mM, 10 mMM, 6 mM, 4 mM, 2 mMM. 이 분석은 쌍으로 ("조정") 효소 / 기질 농도로 수행됩니다. 이를 위해 효소 분석 버퍼에서 효소 용액의 다음과 같은 희석을 준비하십시오 : 0.5 μg / μL, 0.4 μg / μL, 2.5 μg / μL, 2 μg / μL, 1.5 μg / μL, 1 μg / μL.
- 도 4B에 도시된 모든 웰에 효소 분석 완충액의 180 μL을 적용한다. 기질 (빈 및 샘플)에 대한 모든 우물에 효소 분석 버퍼 10 μL을 적용합니다. 준비된 단백질 희석 시리즈의 10 μL을 효소(블랭크 및 샘플)에 대한 웰에 적용합니다. 기판 블랭크 및 효소 블랭크용 웰을 위해 모든 우물에 10 μL의 효소 분석 버퍼를 적용합니다.
- 측정 직전에, 준비된 기질 희석 계열의 10 μL을 기질 샘플 및 효소 시료용 웰에 적용한다.
- 50 μL 설정에서 멀티 채널 파이펫을 사용하여 빈 칸에서 시작하여 샘플 웰로 진행하는 모든 웰을 부드럽게 혼합합니다. 거품을 만들지 않도록 주의하십시오.
- 플레이트를 마이크로플레이트 리더에 삽입하고 8.1단계에서 설명한 대로 255 nm에서 각각 잘 측정합니다. 스프레드시트에서 분석을 수행합니다. 포토미터의 원시 데이터를 스프레드시트에 복사하고 모든 설정(예: 모든 설명서)을 다른 시트에 씁니다.
- 7.11 단계에 설명된 대로 희석 계열의 점당 개별 데이터 분석을 수행합니다. 7.14. 결국, 초기 기판 농도에 대하여 모든 특정 활동을 얻고 플롯: 2 mMM, 1 mM, 0.5 mM, 0.3 mM, 0.2 mM, 0.1 mM.
- 개별 표준 편차로 모든 데이터 점을 표시합니다. 컴퓨터 마이클리스-멘텐 역학비선형 곡선 피팅을 통해 또는 라인위버-버크 해석을 통해. 개별 포인트를 재측정하고 개별 단백질 농도/기질 농도 쌍 비율을 단계 8.5 및 8.6단계로 조정해야 할 수 있습니다. 인간 FAHD1에 대한 Michaelis-Menten 다이어그램은 그림 5B에제공됩니다.
9. FAHD 단백질의 결정화
참고: FAHD 단백질의 결정화(인간 FAHD1 은 앞서15일설명한)는 24웰 포맷의 매달려 있는 투하 증기 확산 방법에 의해 달성될 수 있다(도6A). 이 기술을 사용하여 인간 FAHD1의 결정화에 대한 단계별 프로토콜은15아래에 제시된다. 자세한 설명은 토론 섹션에 제공됩니다.

그림 6 : FAHD 단백질의 결정화.
(A) 표준 24 웰 또는 96 웰 SBS 풋 프린트의 결정화 플레이트. 자세한 내용은 섹션 9를 참조하십시오. (B) FAHD 단백질의 결정화에 있는 기본적인 격판덮개 설치 과정. 이 그림은 권한23으로다시 그려집니다. 자세한 내용은 섹션 9를 참조하십시오. (C) 인간 FAHD1 결정 및 해당 회절 패턴 (작은 삽입). 가장 가까운 격자 간격은 결정의 회절 품질에 대한 측정으로 인서트에 표시됩니다. 숫자가 낮을수록 해상도가 높아져 보다 유익한 데이터가 표시됩니다. 자세한 내용은 프로토콜의 섹션 9를 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 단백질이 SEC 실행 버퍼에 대해 투석되었는지 확인하십시오. FAHD1 단백질은 고농도(2-5 mg/mL)에서 사용할 수 있어야 합니다. 더 낮은 농도에서, 단백질은 자발적인 핵 형성의 부족 때문에 결정화되지 않을 수 있습니다.
- 결정화를 위해 저수지 용액의 ≥20 mL를 준비합니다. 증류수 또는 탈이온수를 용매로 사용하여 3가지 스톡 솔루션을 만드세요: 1 M Na-HEPES(최소 25mL, pH 7.5로 조정), 50% (w/v) 폴리에틸렌 글리콜 4000(PEG4k) (최소 65mL), 1 M MgCl 2(10 mL).
- 4 x 6 (총 24) 다른 15 mL 튜브의 그리드를 설정합니다. 플레이트의 해당 위치에 따라 레이블을 지정합니다(예: 행(A, B, C, D) 대 열(1-6) "A1", "B5", "D6" 등). 각 튜브에 1 M Na-HEPES의 파이펫 1 mL.
- 파이프 의 행 A로 50 %의 50 %(w / v) PEG4k의 피펫 1 mL, 행 B로 2 mL, 행 C로 3 mL, 행 D. 파이펫 100 μL의 1 M MgCl 2의 튜브의 열 1로, 250 μL을 열 2로 , 500 μL을 열 3으로, 1.0 mL을 열 4로, 열 5로 1.5 mL, 컬럼 6에 2.0 mL로 합니다.
- 모든 튜브를 증류수 또는 탈이온수로 최대 10mL 부피까지 채우고 튜브의 스케일이 충분히 정확합니다.
- 냉장고(또는 얼음)에서 인간 FAHD1 단백질 샘플(~5 mg/mL)을 꺼내서 테이블 상단 원심분리기를 4°C에서 10분 이상 최대 속도로 회전시킵니다. 옥살레이트와의 공동 결정화가 필요한 경우, 단백질 샘플에 2 mMM의 최종 옥살레이트 농도가 포함되도록 스톡 용액에서 옥살레이트(oxalate)를 첨가한다. 1 mM DTT를 적용하고 얼음에 저장합니다.
- 그 동안, 18°C에서 온도 제어 실 내부에 이상적으로 24개의 잘 결정화 플레이트를 언포장한다. 얇은 유리 또는 플라스틱 막대의 도움으로 24 웰 플레이트의 모든 우물 위에 가장자리에 파라핀 오일의 얇은 층을 배포합니다. 제조된 결정화 칵테일(A1 to D6)의 800 μL을 결정화 플레이트의 각각의 상응하는 웰에 넣는다.
- 깨끗한 표면에 신선한 22mm 커버슬립을 놓습니다. 커버 슬립을 먼지나 먼지로 오염하지 마십시오. 필요한 경우 압축 공기 또는 먼지 제거 스프레이를 사용하여 커버 슬립에서 이물질을 제거하십시오.
- 원심 분리가 완료된 후, 튜브 바닥의 스펀다운 응집체와 파편이 다시 뜨지 않도록 단백질 샘플을 흔들지 마십시오. 다음 단계에서, 아래에서 응집체 및 침전물을 교반하지 않도록 하기 위해 용액의 표면 바로 아래에 있는 단백질 샘플로부터의 피펫.
- 각 웰(도 6B참조)에 대해 피펫 1 μL의 단백질 용액을 커버 슬립의 중앙에 놓고, 각 저수지 칵테일의 1 μL을 단백질 액적에 첨가하여 기포를 피하였다. 커버슬립을 거꾸로 뒤집어 우물 의 상부에 놓아 오일이 커버슬립을 단단히 밀봉하도록 합니다. 24 웰 플레이트가 완성될 때까지 반복합니다.
- 플레이트를 18°C에 보관하고 적절한 현미경으로 진행성 일정으로 방울을 관찰합니다. 인간 FAHD1 결정은 일반적으로 하룻밤 사이에 나타납니다(그림 6C참조).
결과
준비된 클로닝 벡터로 시작하여 BL21(DE3) pLysS 대장균을구입하였고, 플라스미드는 열 충격 또는 임의의 적절한 대체 방법을 통해 박테리아 내로 삽입된다(도 1). 증폭의 짧은 기간 후, 형질전환 된 박테리아는 LB 한천 플레이트에 도금되어 하룻밤 사이에 성장합니다. 이 시점에서 플레이트는 다양한 잠재적 오류 소스에 따라 다르게 보일 수 있습니다. 플레이트는 비어 있을 수 있습니다 (즉, 콜로니 없음), 완전히 박테리아에 의해 자란, 또는 사이 뭔가, 각각. 최적의 및 비최적 변환 후 LB 한천 플레이트의 두 가지 예는 그림 7A에도시되어 있습니다. 너무 많은 세균성 식민지는 너무 많은 박테리아가 도금되었다는 것을 나타냅니다 (가능성) 또는 사용 항생제가 만료 될 수 있음을 (가능성). 너무 적은 세균성 식민지는 충분하지 않은 플라스미드가 변형을 위해 사용되었거나 (다음 번에 더 많이 사용) 또는 너무 많은 항생제가 박테리아를 선택하는 데 사용되었다는 것을 나타낼 수 있습니다. 어쨌든, 식민지가 존재하는 경우에, 2개의 선택적인 항생제를 사용하는 것은 성장하는 변형되지 않은 박테리아의 다소 미미한 기회를 의미하기 때문에, 그(것)들은 잘되어야 합니다. 그러나 콜로니는 박테리아가 변형 능력을 상실했음을 나타냅니다 (장기간 잘못된 저장 또는 저장, 반복적 동결 및 해동 등으로 인해), 열 충격이 성공하지 못했습니다 (플라스미드 섭취 또는 세균 없음) 너무 많은 열에 의해 사망), 복제 벡터가 손상되거나 실수로 잘못된 세트의 선택적 항생제가 사용되었습니다(플라스미드 벡터에서 내성 유전자 확인).
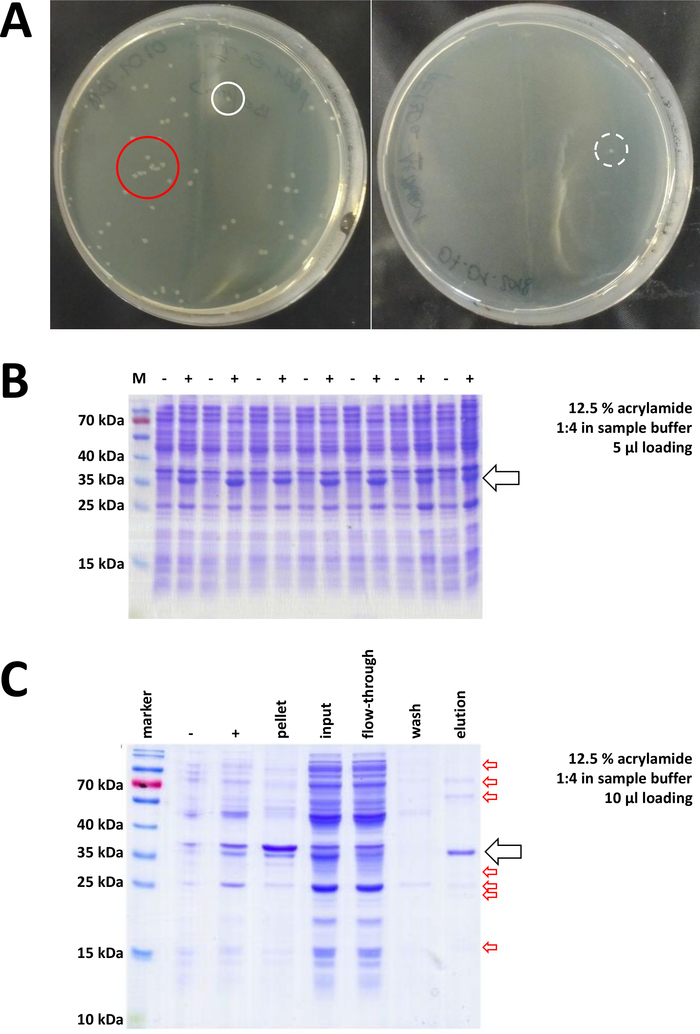
그림 7 : 박테리아 변형 및 IMAC에 대한 대표적인 결과.
(a) 변형된 BL21(DE3) 대장균을가진 대표적인 LB 한천 플레이트, 다음 프로토콜 단계 1.1에 의해 얻어진다. 왼쪽: 잘 분포된 콜로니가 있는 접시(긍정적인 예). 오른쪽: 단일 콜로니가 하나뿐인 플레이트(음수 예). 흰색 원은 좋은 식민지를 표시합니다. 빨간색 원은 서로 너무 가깝게 자라는 식민지를 표시하며 격리된 콜로니를 사용할 수 있는 한 선택해서는 안 됩니다. (B) 일련의 유도 제어의 12.5% 아크릴아미드 SDS-PAGE 분석("-"는 IPTG 유도 전에 나타낸다; "+"는 IPTG 유도 후, 펠릿 수확 전에, 총 단백질의 동일한 양으로 조정된 것을 나타낸다. 이는 1.2단계에서 설명한다. (c) 그의-태그된 FAHD1 단백질의 Ni-NTA 정제의 예시적인 12.5% 아크릴아미드 SDS-PAGE 분석. 이것은 프로토콜의 섹션 3에 설명되어 있습니다. 친화성 크로마토그래피는 고순도 (>70 %, 검은 색 화살표)의 단백질을 산출하지만, 몇 가지 작은 오염도 관찰됩니다 (빨간색 화살표). 이 오염은 열에 묶는 비 FAHD 단백질, 및 FAHD 단백질에 묶는 단백질에서 이루어져 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
검증된 콜로니가 선택되고 선택됩니다. 영양 배지에서 증폭 후, 단백질 발현은 화학 IPTG의 적용에 의해 유발된다. 밀리그램 수량으로 발현된 단백질을 함유하는 세균 펠릿은 수확되고, 발현은 SDS-PAGE를 통해 검증된다(예를 들어 도 7B참조). 이 간단한 프로세스 중에 일부 문제가 발생할 수 있습니다. 첫째, 일부 단백질은 분명히 어떻게 든 숙주 박테리아의 자연 대사를 방해하기 때문에 포함 시체를 형성합니다. 이것은 인간 FAHD1 및 FAHD2의 일부 포인트 돌연변이에 대해 관찰되었다. 이러한 경우에, 곤충 세포 와 같은 다른 발현 시스템은 더 적합 할 수 있으며 고려되어야한다. 곤충 세포로부터 펠릿을 수확한 후, 예를 들어, 단백질의 정제는 본 프로토콜에 기재된 것과 동일한 단계를 따른다. 둘째, DE3-pET 시스템은 때때로 "새는" 것으로 밝혀져 있다(즉, 단백질은 이미 IPTG 유도 전에 어느 정도 발현된다). 이것에 대한 잠재적인 이유는 잘 이해되지 않습니다, 그러나 차가운 방 인큐베이터에서 천천히 밤새 단백질을 표현하는 것을 도울 수 있습니다. 셋째, 단백질이 발현되지 않는다. 이것은 아마도 최악의 시나리오, 그것은 가능성이 손상 된 플라스미드 벡터를 나타내기 때문에 따라서 플라스미드를 순서를 정하는 것이 좋습니다.
그의-태그가 단백질을 태그하는 데 사용된 경우, Ni-NTA 아가로즈를 이용한 친화도 크로마토그래피는 대부분의 오염을 제거하는 쉽고 저렴한 포획 방법이다(도 7C). 다른 태그 시스템(예: STREP-II)에도유사한 방법이 존재합니다. 태그가 사용되지 않은 경우, 황산 암모늄 침전및 연속적인 소수성 교환 크로마토그래피의 조합은 또한 대부분의다른 단백질로부터 단백질을 분리할 수 있다(도 8A). 그러나, 두 가지 방법(도7C 대 도 8A)을비교하면, Ni-NTA 방법의 우수성은 SDS-PAGE 분석에 의해 입증될 수 있다. 따라서 그의태그가 붙은 단백질을 사용하는 것이 좋습니다.
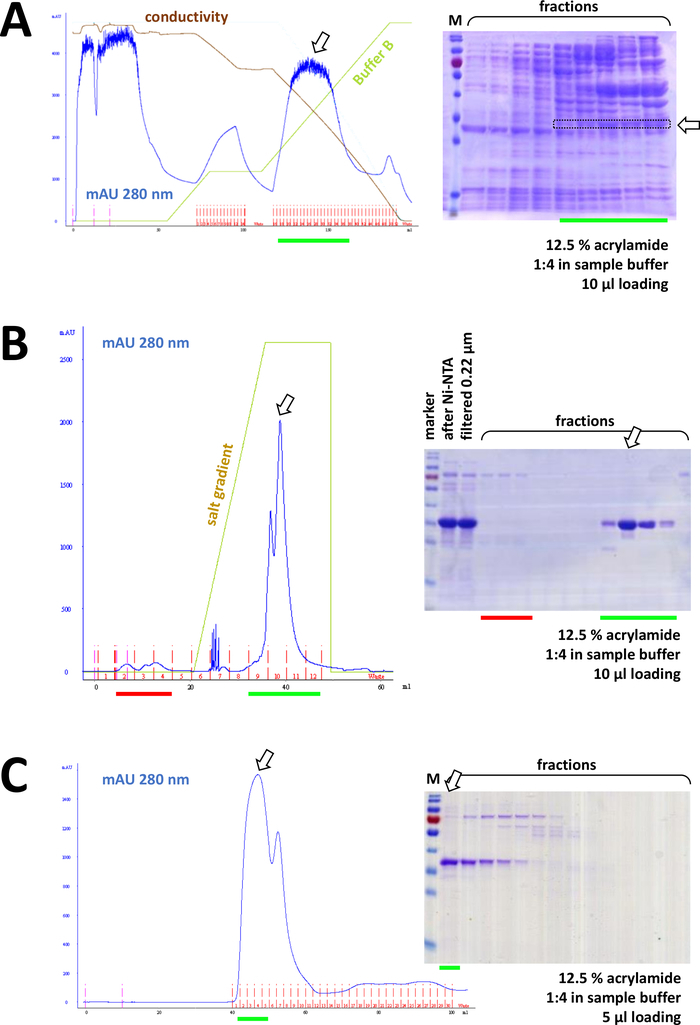
그림 8 : FPLC 실험(HIC, 이온 거래소, SEC)의 대표적인 결과.
(a) 프로토콜의 섹션 4에 기재된 바와 같이, 전형적인 크로마토그램 및 12.5% 아크릴아미드 SDS-PAGE 분석 후 암모늄 황산염(AS) 침전 후 의학적 FAHD1 단백질의 침전. 녹색 선은 AS를 포함하지 않는 버퍼 B의 그라데이션을 반영합니다. 이 과정에서 AS는 점차 시스템에서 씻어 내다낸다. 이 패널을 도 7C와 비교하면 HIC-페닐 방법에 비해 Ni-NTA 친화성 크로마토그래피의 위력이 표시되며, 단백질 정제를 위한 His-tag 시스템을 사용하는 장점이 있다. (b) Ni-NTA 정제 후 그의-태그된 FAHD의 예시적인 크로마토그램 및 12.5% 아크릴아미드 SDS-PAGE 양이온 교환 크로마토그래피 분석. 소금 구배를 사용하여, 적용된 견본은 개별적인 단백질로 분리됩니다. (c) 예시적인 크로마토그램 및 12.5% 아크릴아미드 SDS-PAGE 분석의 G75 크기 배제 크로마토그래피 그의-태그가 붙은 FAHD 다음 의 양이온 교환 크로마토그래피. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
연속적으로, 단백질은 양이온/음이온 교환 크로마토그래피에 의해 남은 오염으로부터 더 분리된다(예를 들어, 도 8B참조), 크기 배제 크로마토그래피(예를 들어, 도 8C참조). 이 순서대로 초기 정제 전략을 설정하는 것이 좋습니다; 그러나, 이 컬럼은 단백질이 충분히 순수할 때까지, 이후에 그리고 변이에서 조합해서 이용되어야 합니다.
간단한 활성 반응 실험은 활성 기질 및/또는 보조 인자에 대한 "예 또는 아니오" 결정을 테스트하기 위해, Ni-NTA 정제 후 그의-tagged 단백질, 또는 이온 교환 컬럼 후 태그가 지정되지 않은 단백질로 수행될 수 있다. 특정 활동 및 운동 상수는 가장 높은 순도의 단백질로 결정되어야 합니다. 결정화는 이온 교환 컬럼 후에 단백질로 시도될 수 있습니다, 그러나 결정의 질은 거의 항상 단백질 순도와 상관관계가 있습니다. 폴리클로날 항체는 정제 프로토콜의 임의의 단계에서 단백질에 대하여 제기될 수 있다; 그러나, 여기에서 질은 또한 단백질 순도와 상관관계가 있습니다.
토론
중요한 단계
FAHD 단백질은 염분 농도에 매우 민감합니다. 낮은 NaCl 농도에서, 단백질은 해동 시 침전 수 있습니다., 하지만 그들은 일반적으로 완전히 높은 소금 농도에서 재구성 될 수 있습니다. 즉, FAHD 단백질이 어떤 이유로 침전되는 경우, 더 높은 염 농도(>300 μM)로 회수또는 재접을 할 수 있다. 그러나 좀 더 소수성 단백질은 회복되지 않을 수 있지만(예: 인간 FAHD2), CHAPS(최대 1%)와 같은 세제 또는 글리세롤 (10%) 안정된 용액을 유지하는 데 사용할 수 있습니다. 어쨌든 액체 질소를 사용하여 충격 동결을 하고 -80 °C에서 보관하는 것이 부드럽고 느린 해동 과정이므로 권장됩니다.
3.1.10 단계에서 Ni-NTA 정제 중에 몇 가지 예기치 않은 문제가 발생할 수 있습니다. 참고로, 제2 수집시료에서 더 높은 OD는 아가로즈 수지의 부피가 너무 높다는 것을 나타낸다(다음 실험에서 적은 수지를 사용한다). 또한, 아가로즈 수지 자체는 280 nm에서 OD 신호로 이어집니다 (즉, 아가로스 수지 베드의 붕괴는 인공 신호를 줄 것이다). 의심의 경우, 단백질 농도 를 결정 하기 위해 브래드포드 또는 BSA 분석 같은 다른 방법을 사용 하는 것이 좋습니다.
효소 성 검안에는 고려해야 할 세 가지 중요한 측면이 있습니다. 첫째, 단백질 농도를 평가하는 것은 정확한 특정 활동을 얻기 위하여 중요합니다. 단백질의 순도 수준은 결과에 영향을 미치고 추정될 필요가 있습니다. 태그가 지정된 단백질의 경우 태그 부분의 질량을 계산해야 하며 특정 활성을 그에 따라 수정해야 합니다. 프로토콜의 섹션 7에 기재된 간단한 분석의 경우, Ni-NTA 순도는 활성 기질과 비활성 기질, 보조 인자 등을 구별하기에 충분하다. 더 복잡한 Michaelis-Menten 역학의 경우 모든 반응물 및 기질 농도를 올바르게 결정해야 합니다. 특히 옥살로아세테이트(시간이 지남에 따라 자동 카르박스실레이트)를 사용할 때 반응의 효소 부분은 자동 탈카르박실화를 위해 수정되어야 합니다(두 반응이 동시에 발생한다는 가정 하에). 기판의 케토 에놀 토토머화로 처리된 광학 밀도 신호의 초기 변화를 고려해야 합니다. 셋째, 농도와 부피를 조정해야 합니다. 효소 및 기질의 정의된 농도와의 반응은 분석 부피에 의존하는 상이한 결과를 줄 수 있다. 잘 당 너무 많은 효소가있는 경우, 액체의 접착은 사실 결과를 편향 할 수있다.
Michaelis-Menten 역학을 평가하기 위해 최적의 조합을 찾기 위해 100 μL, 200 μL 및 300 μL 배치에서 초기 실험을 수행하는 것이 좋습니다. 유사한 양상은 운동 분석학을 위한 효소 기질 농도의 비율에 적용됩니다. 기질당 너무 많은 효소 또는 효소당 너무 많은 기질은 시스템을 선형 정상 상태 마이클리스 범위 밖으로 둔다. 이러한 조건을 최적화하려면 초기 실험이 필요합니다. 인간 FAHD1(야생형) 단백질에 대한 예시적인 조정은 섹션 8에 제공되어 운동 다이어그램을 생성합니다(예: 도 5B에제시된 바와 같이).
결정화를 위해 단백질 용액의 액적은 커버슬립의 중앙에 파이펫을 투과하고 일반적으로 완충제(예: Tris-HCl, HEPES)와 침전물(예를 들어, 폴리에틸렌 글리콜, 암모늄)으로 구성된 결정화 칵테일 방울과 혼합됩니다. 황산염). 공동 결정화를 위한 억제제 용액의 액적(예: 이 프로토콜의 옥살레이트)은 선택적으로 적용될 수 있다. 커버 슬립은 결정화 칵테일을 포함하는 저수지의 우물 위에 거꾸로 배치, 실란트 오일의 도움으로잘 공기를 밀봉 (그림 6B). 이상적으로, 단백질이 용액에 남아 있는 것을 의미하는 실험의 시작 부분에 있는 투하 내의 아무 침수도 일어나지 않습니다. 저수지내의 침전물 농도가 낙하량보다 높기 때문에, 저수지와의 평형에 도달할 때까지 우물의 대기로 증발하여 물을 잃기 시작한다. 저수지로 물을 확산시키는 것은 드롭의 느린 부피 감소를 야기하고, 이는 차례로 드롭, 단백질 및 침전물 농도모두의 증가를 야기한다. 단백질 용액이 필요한 포화 상태에 도달하면 메타 안정성, 결정 성장에 따른 자발적인 핵 형성이 발생할 수 있습니다. 과포화 상태에 도달하는 것은 결정화를 위해 필요하지만 충분하지 않은 조건이다. 단백질의 결정화는 둘 다, 유리한 열역학 및 운동 조건을 필요로 하며, 결정화될 단백질의예측할 수 없는 특성에 크게 의존한다.
수정 및 문제 해결
대장균에서 단백질의 발현은 비효율적일 수 있다. 다양한 IPTG 농도, 발현 온도 및 증폭 시간(예: 몇 시간 동안 또는 추운 방에서 하룻밤 동안 실온)은 최적의 조건을 찾기 위해 각각의 새로운 단백질에 대해 테스트해야 할 수도 있습니다. 포함 체에서 단백질의 침전은 때때로 더 소수성 FAHD 단백질에 대 한 관찰. 이러한 경우에, 곤충 세포와 같은 다른 모델 시스템에서 단백질 발현이 권장되며, 포함 체는26을형성할 가능성이 적기 때문에 권장된다.
FAHD 단백질은 염분 및 보조 인자 농도뿐만 아니라 pH에 민감하기 때문에, 다른 상동체, 정형 화 및 점 돌연변이 변이체에 대한 정제 전략은 개별 설정에서 다를 수 있습니다. 기재된 정제 방법은 야생형 인간 및 마우스 FAHD1 단백질을 위해 개발된다. PH뿐만 아니라 NaCl 및 imidazole와 같은 화학 물질의 농도는 다른 등전점 (pI)을 가진 개별 단백질에 대해 조정되어야 할 수 있습니다. 또한 주의, 모든 그의태그 단백질 Ni-NTA 수 지에 잘 바인딩할 수 있습니다. Ni-NTA 컬럼에 결합하는 단백질이 비효율적이라면, NaCl 및 imidazole의 적응된 농도뿐만 아니라 Ni-NTA 실행 완충제에서의 다양한 pH 조건은 결과의 품질을 향상시키는 데 도움이 될 수 있다. 그렇지 않은 경우, Ni-NTA 단계를 건너뛰고 이온 교환 크로마토그래피의 단계로 진행하는 것은 또한 성공적인 정제 전략으로 이어질 수 있다. 단백질이 Ni-NTA 컬럼에 결합하지만 컬럼에서 용출될 수 없는 경우, 일부 mM EDTA를 첨가하면 Ni2+ 복합체를 방해하는 데 도움이 될 수 있습니다.
결정화 과정에 관하여, 정규 주기 격자로 크고 복잡한 단백질 분자의 자기 조직은 운동 파라미터를 통제하기 어려운에 크게 의존하는 본질적으로 가능성 있는 프로세스이다는 것을 이해될 필요가 있습니다. 결정화에 사용되는 셋업의 작은 변화조차도 결과를 극적으로 바꿀 수 있으며 결정이 형성되지 않습니다. 단백질 순도는 일반적으로 가장 중요합니다. 엄지 손가락의 규칙으로, 심하게 과부하 SDS-PAGE 젤 다른 밴드를 표시 하지 않아야 합니다. 또한 단계가 수행되는 순서는 결과에 영향을 줄 수 있습니다. 일례로, 재현성을 보장하기 위해, 종종 파이펫팅 서열을 동일하게 유지하고, 먼저 단백질을 첨가하고, 마지막으로 결정화 액적에 침전제를 추가(또는 그 반대의 경우도 마찬가지)하는 것이 필요하다. 어떤 방법을 사용하든 실험을 재현하거나 확장하려고 할 때 동일하게 유지되어야 합니다. 이 프로토콜에 따라 결정이 관찰되지 않으면 화학 적 침전물 조성물, pH, 투하 크기 및 단백질 대 침전비 비율이 작은 단위로 변할 수 있습니다. 인내와 방울에 대한 일관된 관찰은 미덕입니다.
FAHD1의 촉매 메커니즘에 대한 발언
제시된 방법은 고품질의 FAHD1 단백질을 얻기 위해 특별히 개발되었다. 이를 통해 FAHD1 결정의 성장뿐만 아니라 억제제(oxalate, PDB:6FOG)에 복잡한 FAHD1을 함유하는 결정의 엔지니어링이 가능해졌습니다. X 선 구조는 효소의 촉매 공동의 3D 아키텍처를 제공합니다. 이 결과는 이 흥미로운 효소의 촉매 기계장치에 잠재적으로 중요한 잔기의 포괄적인 설명을 설치합니다. FAHD1은 아실피루바트(아세틸피루바테, 푸마릴피루바테)를 분리할 수 있도록 먼저 기술되었다11. 나중에, FAHD1은 옥살로아세테이트12의탈카르박실라제로서도 작동한다는 것을 발견했습니다. 기판 아실피루바테와 옥살로아세테이트는 서로 다른 화학적 모이티에이트이지만, 화학적 변형은공통단일 C3-C4 결합의 전략적 분열을 기계적으로 공유하며, C3의 경우 정력적으로 촉진된다. -C4 결합 궤도는 C2-카본15의 π-궤도에 직교상태를 유지한다. 이러한 형태는 절단 과정 동안 일시적으로 형성된 C3-카르바니온의 공명 안정화를 허용한다. 상기 FAHD1 기질(oxaacacetate 및 아실피루바트)은 유연한 분자이며, 타우토머릭(keto-enol)뿐만아니라 C2-하이드레이트 형태로 존재할 수 있다(도9A). 상이한 종들 사이의 평형은 주로 사용되는 완충조성의 성질, pH 및 금속 이온의 존재에 의해 결정된다. 다음에서 우리는 FAHD1의 촉매 중심을 개시한 X 선 결정 구조물의 분석에서 영감을 받은 가설 기계론 시나리오를 토론합니다.
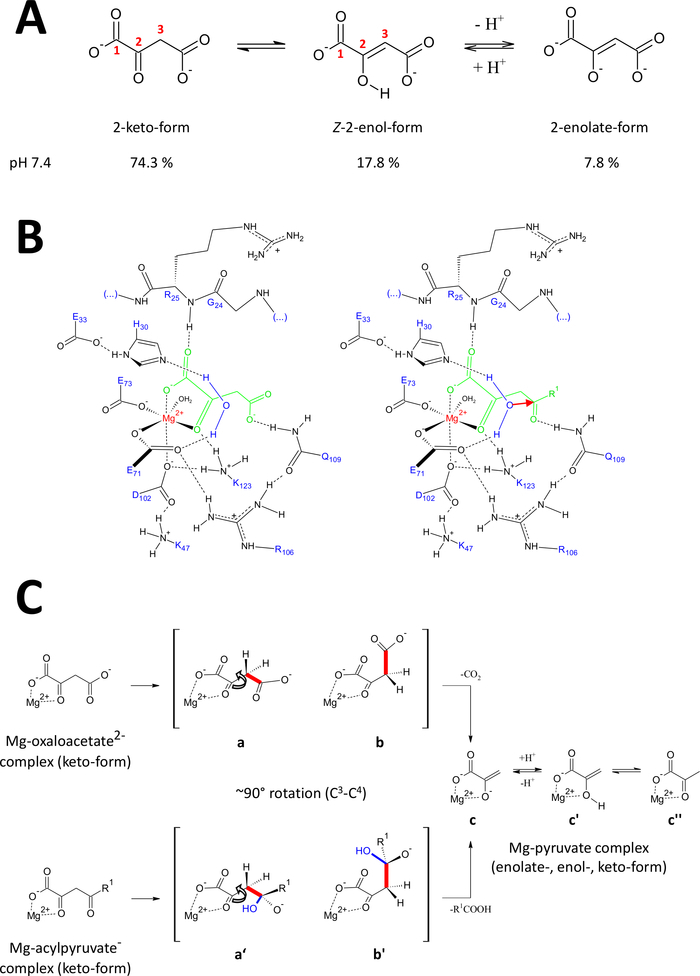
그림 9 : 인간 FAHD1의 촉매 메커니즘에 대한 세부 사항.
(a) 옥살로아세테이트는 주로Z-에놀 형태24에서중성 용액뿐만 아니라 결정성 상태이다. 그러나, 생리적 pH 조건 하에서 2-케토 형태는 우세한 표현(25)이다. (B) mg-바운드 옥살로아세테이트(왼쪽)와 아실피루바트(오른쪽, R1을 유기적 나머지로, 적색 화살표는 인접한 안정화된 물 분자의 핵애호가 공격을 나타낸다)를 가진 hFAHD1 캐비티(15)의 화학적 스케치(토론 참조). (C) FAHD1의 decarboxylase (bto c) 및 하이드라제 (b'to c) 메커니즘에서 C 3-C4 분열에 대한 선호 된 적합성의 비교 : 두 공정 모두 Mg 복합화 피루바테 -enolate를 초래합니다 (토론 참조). 중간값 b와 b'는 패널 B에 스케치된 대로 Q109까지 안정화될 것으로 예상됩니다(토론 참조). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
FAHD1의 데카르복실라제 활동
옥살로아세테이트는 주로Z-에놀 형태24에서중성 용액뿐만 아니라 결정성 상태로 존재한다. 그러나 생리학적 pH 조건(pH 7.4에서 완충조건)에서 2-케토 형태는 옥살로아세테이트 25(도9A)의우세한 표현이며, 박균화(27)의 전제조건이 아님을 나타내었으나, . 참고로, Mg2+ 이온은 7.4 이하의 pH 또는28이하의 옥살레아세테이트 종의 비율에 영향을 미치지 않습니다. FAHD1의 촉매 중심에 옥살로아세테이트 케토 형태의 전치(복합효소의 결합 된 옥살레이트에 의해 유도(PDB: 6FOG 15))는 결합된 옥살로아세테이트(15)의형태 조절자로서 잔류물 Q109를 밝혀낸다. 또 다른 조15에설명된 바와 같이, Q109의 카르바모일 그룹에 수소 결합은 C2-C3 결합 주위의 회전으로부터 발생하는 옥살로아세테이트 형태형성을 안정화한다(도9B,좌측 패널). 이러한 회전의 결과로서,C3-C4 결합(갈라질 수 있음)은 C2-카보닐의 π 궤도에 대한 직교 성향에 근접한 것을 채택한다(도 9C). 이산화탄소를 방출할 수 있습니다. 이 과정의 주요 생성물은 공진 안정화 된 피루브의 Mg-enolate일 것입니다. 옥살로아세테이트-Mg 복합체의 조사에서 에놀레이트가 가장 안정한 복합체(28,29)를형성하는 것으로 알려져 있다. MG-피루바트-복합체에 대한 비교 가능한 안정성을 가정하면 FAHD1의 보조 인자가 차단될 수 있지만, 리신 잔류물 K123은 평형에서 피루바테-에놀레이트(pyruvate-enolate)를 프로토질화하여 공동인자(15)의 손실을 금지할 수 있다.
주어진 해석은 FAHD1의 촉매 ODx 기능에 있는 명백한 중간으로 pyruvate enol를 건의합니다. 가설 모델의 이 단계에서 실험 데이터는 제품을 출시하기 위해 닫힌 뚜껑을 열어야 하는 이유에 대한 추가 표시를 제공하지 않습니다. 그러나 제안된 메커니즘이 제품에 의한 효소 억제처럼 보인다고 추론할 수 있습니다: 결정 구조는 잔기 H30 및 E33에 의해 FAHD1 촉매 센터를 향한 방향 방향으로 유지된 보존된 물 분자를 나타낸다. 짧은 나선(15)이는 리간드 결합 및 뚜껑 폐쇄시 유도된다. 1 차 에놀이 enolate와 평형에 머무르면, 안정화된 에놀레이트 공진은 물 분자에 의해 pyruvate에 담금질될 수 있었습니다. 생성된 하이드록실은 뚜껑이 열리는 Mg-보조인자로부터 피루브를 대체할 수 있을 것이다. 마지막으로, 촉매 센터는 미토콘드리아 환경에서 복원될 것입니다. 이 가설 시나리오에서, 공동 물 분자는 각각 산으로 작동할 것이다.
FAHD1의 하이드로라제 활동
효소의 하이드라아제 활성은 암시적으로 하이드록실 뉴클레오필의 중간 형성을 필요로 한다. 이 기계장치는 일반적으로 산 염기 촉매 활동과 조합에서 있습니다. 반응의 과도 상태는 공동에서 중요한 아미노산 측사슬에 의한 형태 조절을 통해 제조되어야 한다. 데카르복실라제 기능에 대한 논의와 유사하게, 2-케토 형태의 효소 결합 아실피루베제는 Q109에 4-카보닐 산소의 수소 결합에 의해 형태 제어하에 놓일 것이다(도9B,우측 패널). 옥살레이트 결합 FAHD1(PDB:6FOG)의 결정 구조는 짧은 나선15에제시된 잔류물 H30 및 E33에 의해 FAHD1 촉매 중심을 향한 방향 방향으로 유지된 보존된 물 분자를 나타낸다. E33-H30 다이드는 방향성 위치수를 탈보하는 능력이 있으며, 생성된 하이드록실은 Q10915에의해 시형 제어하에 제시된 아실피루바트의 4-카보닐을 공격하는 이상적인 처리에 있다.
참고로, FAH18에대해 유사한 메커니즘이 제안되었습니다. 하이드록실 뉴클레오필에 의한 공격은 옥시내온 종을 초래할 것으로 예상되며, 이는궤도 제어 C3-C4 결합 절단에 안정화된다(도9C). 이 모델에서,C3-C4 결합 회전(도9C)은 도 9B에 도시된 형성된 하이드록실에 의한 핵성 공격 후에 발생한다(즉, 결합 절단을 위한 아실피루브를 준비한다). 주요 제품은 아세트산과 Mg-피루바테 에놀레이트일 것입니다. 이 가설 시나리오에서, 아세트산은 피루바테에 에놀을 담금질하고 이후에 제품의 변위를 지원할 수 있었다. 7.5의 pH 이상및 Mg 이온의 존재, 아실피루바트는 케토-및 에놀 형태 사이의 평형에 존재하며, 후자는 약간의 선호도30에서존재한다. 대부분의 아마 두 형태는 후속 뚜껑 폐쇄에서 FAHD1의 공동 인자에 바인딩할 수 있습니다. 효소에 의한 에놀릭 아실피루브염 의 처리는 에놀 형태의 평평한 구조로 인해 방해를 받고 있다. C3-C4 분열은 공진 안정화 없이 비닐 카바니를 초래할 것이다.
따라서, 아실 카보닐 상에서 하이드록실 뉴클레오필의 공격을 준비하기 위한 촉매 케톤화 단계를 제안한다. 그러나 케톤화의 이 과정은 FAHD1 잔류물로 양성자 전위를 제어해야 하며, 이는 FAHD1에 내재된 이소머라아아제 활성을 기인합니다. Mg-바운드 에놀 수소의 산도는 비복합형28에비해 1만배 증가한 것으로 보고되고 있다. Mg 바운드 에놀 형태의 분해는 비 프로톤화 된 K123에 의해 가능할 것이다. K123의 분해는 D102의 카복실레이트에 의해 지원될 수 있다. 잔류물 D102-K47-K123에 의해 형성된 수소 결합 네트워크는 FAHD115의촉매 중심에 필요한 양성자 릴레이로 작동할 수 있습니다. 이러한 형성된 중간 에놀레이트는 기판(15)의 케톤화 하에 E33-H30-H20트라이어드에 의해 담금질될 수 있었다. 2-케토 형태는 Q109의 형태 제어하에 올 것이고, 수반되는 형성된 하이드록실은 아실 카보닐을 공격할 것이다. 요약된 토론은 공동 형성 잔기의 상호 작용을 통해 산과 염기 사이를 전환하기 위한 물 분자에 관하여 FAHD1의 통제를 의미합니다.
방법의 향후 응용 프로그램 또는 방향
여기에 설명된 메서드의 향후 응용 프로그램은 많습니다. FAH 슈퍼 패밀리의 원핵 생물의 과다 여전히 기능적 특성화를 기다리고 있습니다. 알려진 FAH 수퍼패밀리 구성원의 촉매 활동에 대한 사용 가능한 정보조차도 부족하며, 대부분의 경우 실험 데이터보다는 이론적 가정에 근거합니다. 원핵 요법 FAH 수퍼 패밀리 구성원에 대해 여기에 기술된 방법의 적용은 세균학에서 특정 한 연구 관심사에 따라 달라집니다. 한편, 진핵 FAH 수퍼패밀리 회원들이 다양한 세포 구획(예: 시토솔 대 미토콘드리아)에서 필수적인 역할을 한다는 최근의 시연은 이러한 단백질을 더 잘 특성화할 필요성을 강조합니다(그 중 3개는 지금까지 확인), 특히 현재 데이터는 일부 특성화되지 않은 단백질이 미토콘드리아 생물학, 노화 연구 및 암 연구의 맥락에서 다른 기능을 수행 할 수 있음을 시사하기 때문에. 이러한 진핵 FAH 수퍼패밀리 구성원의 완전한 분자 및 생리학적 특성은 생물 의학 분야에서 현대 연구의 주요 분야에 대한 중요한 통찰력을 제공할 수 있다고 제안된다. FAHD1의 메커니즘에 대 한 더 많은 연구 (그리고 관련 효소) FAHD1의 이중 기능의 기본 메커니즘을 더 잘 이해 하는 데 필요한, 아직 완전히 명확 하지. FAHD1 돌연변이체, NMR-조사 및 억제제 복합체에 대한 구조적 연구를 통해 FAHD1이 유능해 보이는 진정한 기계적 시나리오를 해결하는 데 도움이 될 수 있습니다. 더욱이, Mg-코팩터에 결합할 수 있는 에놀 모방의 컴퓨터 지원 디자인은 결국 FAHD1의 강력한 억제제로 이끌어 낼 것이다.
공개
저자는 경쟁적인 금전적 이익을 공개하고 선언할 것이 없습니다. H. G. MoleculeCrafting.Hugs e.U.에서 CEOCSO이며 사용자 정의 합성을 통해이 연구를위한 아실피루브를 제공했습니다. P.J.D.의 연구실에서 일하는 것은 오스트리아 과학 기금(FWF): 프로젝트 번호 P 31582-B26에 의해 지원되었습니다. 이 원고에 대한 출판 비용은 프로젝트 번호 P 31582-B26에 따라 오스트리아 과학 기금 (FWF)에 의해 부분적으로 충당되었습니다. A. N. 및 B. R.은 프로젝트 P28395-B26에 따라 오스트리아 과학 기금(FWF)의 지원을 받습니다.
감사의 말
저자는 애너벨라 피틀의 전문적인 기술 지원과 Haymo Pircher의 파일럿 방법 개발에 매우 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| BL21(DE3) pLysS competent E. coli | Promega | L1195 | High-efficiency protein expression from gene with T7 promoter and ribosome binding site |
| pET E. coli T7 Expression Vectors | MERCK | - | http://www.merckmillipore.com/AT/de/life-science-research/genomic-analysis/dna-preparation-cloning/pet-expression-vectors/qFSb.qB.mLQAAAFA6.VkiQ0G,nav |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| 15 mL Falcon | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon | VWR | 734-0448 | centrifugal tubes |
| PS Cuvettes Spectrophotometer Semi-Micro | VWR | 30622-758 | VIS transparent cuvettes |
| UV Cuvettes Spectrophotometer Semi-Micro | VWR | 47727-024 | UV/VIS transparent cuvettes |
| isopropyl-β-D-thiogalactopyranosid (IPTG) | ROTH | 2316 | chemical used for induction of protein expression with the DE3/pET system |
| imidazole | ROTH | X998 | chemical used for elution of polyhistidine (6xHis) sequences from a nickel-charged affinity resin |
| Glass Econo-Column Columns | Bio-Rad | - | http://www.bio-rad.com/de-at/product/glass-econo-column-columns?ID=2cfb1c6e-32e8-4c72-b532-dd39013d707d&pcp_loc=catprod |
| chloramphenicol | Sigma-Aldrich | C0378 | antibiotic for bacterial growth selection; resistance endióded in pLysS plasmid of BL21(DE3) E. coli; 25 µg/mL final concentration |
| kanamycin | Sigma-Aldrich | 60615 | antibiotic for bacterial growth selection; to be used if this resistance is encoded in the employed pET vector; 50 µg/mL final concentration |
| ampicillin | Sigma-Aldrich | A1593 | antibiotic for bacterial growth selection; to be used if this resistance is encoded in the employed pET vector; 100 µg/mL final concentration |
| Ultra-15, MWCO 10 kDa | Sigma-Aldrich | Z706345 | centrifigal filters for protein enrichment; https://www.sigmaaldrich.com/catalog/product/sigma/z706345?lang=de®ion=AT |
| Ultra-0.5 Centrifugal Filter Units | Sigma-Aldrich | Z677108 | centrifigal filters for protein enrichment; https://www.sigmaaldrich.com/catalog/product/ALDRICH/Z677108?lang=de®ion=AT&cm_sp=Insite-_-prodRecCold_xviews-_-prodRecCold5-2 |
| oxaloacetic acid | Sigma-Aldrich | O4126 | TCA metabolite |
| sodium oxlalate | Sigma-Aldrich | 71800 | a competitive inhibitor of FAH superfamily enzymes |
| Dialysis tubing cellulose membrane | Sigma-Aldrich | D9277 | https://www.sigmaaldrich.com/catalog/product/sigma/d9277; or comparable |
| Ni-NTA agarose | Thermo-Fischer | R90101 | a nickel-charged affinity resin that can be used to purify recombinant proteins containing a polyhistidine (6xHis) sequence |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | https://www.thermofisher.com/order/catalog/product/26616?SID=srch-hj-26616 |
| ÄKTA FPLC system | GE Healthcare Life Sciences | - | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| HiTrap Phenyl HP column | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/it/shop/chromatography/prepacked-columns/hydrophobic-interaction/hitrap-phenyl-hp-p-05630 |
| Mono S 10/100 GL | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/ion-exchange/mono-s-cation-exchange-chromatography-column-p-00723 |
| Mono Q 10/100 GL | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/ion-exchange/mono-q-anion-exchange-chromatography-column-p-00608 |
| HiLoad Superdex column 75 pg (G75) | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/size-exclusion/hiload-superdex-75-pg-preparative-size-exclusion-chromatography-columns-p-05800 |
| HiLoad Superdex column 200 pg (G200) | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/size-exclusion/hiload-superdex-200-pg-preparative-size-exclusion-chromatography-columns-p-06283 |
| TECAN microplate reader | TECAN Life Sciences | - | https://lifesciences.tecan.com/microplate-readers |
| acetylpyruvate | MoleculeCrafting.HuGs e.U. | - | custom synthesis |
| benzoylpyruvate | MoleculeCrafting.HuGs e.U. | - | custom synthesis |
| VDX™ plate (24 wells) | Hampton | HR3-142 | 24 well plates used for crystallization via Hanging Drop Vapor Diffusion |
| paraffin oil | Hampton | HR3-411 | used for crystallization via Hanging Drop Vapor Diffusion |
| coverslips (22 mm) | Karl Hecht KG | 14043 | coverslips used for crystallization via Hanging Drop Vapor Diffusion |
| Luria broth (LB) medium | self-prepared | - | a general growth medium for E. coli: 5 g/L yeast extract; 10 g/L peptone from casein; 10 g/L sodium chloride; 12 g/L agar-agar |
| NZCYM medium | self-prepared | - | a better growth medium for E. coli, used for amplification: 10 g/L NZ amine; 5 g/L NaCl; 5 g/L yeast extract; 1 g/L casamino acids; 2 g/L MgSO4; adjust pH to 7.4 |
| Luria broth (LB) agarose plates | self-prepared | - | autoclaved agarose plates containing LB-medium and antibiotics for bacterial groth selection; https://www.addgene.org/protocols/pouring-lb-agar-plates/ |
| Ni-NTA running buffer | self-prepared | - | 20 mM Tris-HCl pH 7,4; 50-300 mM NaCl; 10-200 mM imidazole; ranges: optimal value varies among FAHD proteins |
| Ni-NTA elution buffer | self-prepared | - | 20 mM Tris-HCl pH 7,4; 50-300 mM NaCl; 200-500 mM imidazole; ranges: optimal value varies among FAHD proteins |
| HIC running buffer | self-prepared | - | 44 mM NaH2PO4; 6 mM Na2HPO4; 100 mM NaCl; 20 mM DTT; adjust to pH 7 |
| HIC running buffer AS | self-prepared | - | HIC running buffer saturated with ammonium sulfate (AS); adjust to pH 7: 70 g ammonium sulfate + 90 mL buffer, stirred overnight in the cold room; adjust to pH 7.0 |
| Mono S low salt buffer | self-prepared | - | 44 mM NaH2PO4; 6 mM Na2HPO4; 10-300 mM NaCl; ranges: optimal value varies among FAHD proteins |
| Mono S high salt buffer | self-prepared | - | 44 mM NaH2PO4; 6 mM Na2HPO4; 1-2 M NaCl; ranges: optimal value varies among FAHD proteins |
| Mono Q low salt buffer | self-prepared | - | 20 mM Tris-HCl; 15 mM NaCl; adjust to pH 8.0 |
| Mono Q high salt buffer | self-prepared | - | 20 mM Tris-HCl; 1 M NaCl; 10 % glycerol; adjust to pH 8.0 |
| G75 / G200 running buffer | self-prepared | - | 15 mM Tris-HCl; 300 mM NaCl; adjust to pH 7.4 |
| enzyme assay buffer | self-prepared | - | 50 mM Tris-HCl pH7.4; 100 mM KCl; 1 mM MgCl2 |
| protein crystallization buffer | self-prepared | - | G75 / G200 running buffer with 1 mM DTT |
| reservoir solution for crystallization | self-prepared | - | 100 mM Na-HEPES pH 7.5; 5-20 % (w/v) PEG4k; 10 mM-200 mM MgCl2 |
참고문헌
- Brouns, S. J. J., et al. Structural Insight into Substrate Binding and Catalysis of a Novel 2-Keto-3-deoxy-d-arabinonate Dehydratase Illustrates Common Mechanistic Features of the FAH Superfamily. Journal of Molecular Biology. 379, 357-371 (2008).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure (London, England: 1993). 7, 1023-1033 (1999).
- Weiss, A. K. H., Loeffler, J. R., Liedl, K. R., Gstach, H., Jansen-Dürr, P. The fumarylacetoacetate hydrolase (FAH) superfamily of enzymes: multifunctional enzymes from microbes to mitochondria. Biochemical Society Transactions. 46, 295 (2018).
- Guimarães, S. L., et al. Crystal Structures of Apo and Liganded 4-Oxalocrotonate Decarboxylase Uncover a Structural Basis for the Metal-Assisted Decarboxylation of a Vinylogous β-Keto Acid. Biochemistry. 55, 2632 (2016).
- Zhou, N. Y., Fuenmayor, S. L., Williams, P. A. nag genes of Ralstonia (formerly Pseudomonas) sp. strain U2 encoding enzymes for gentisate catabolism. Journal of Bacteriology. 183, 700 (2001).
- Izumi, A., et al. Structure and Mechanism of HpcG, a Hydratase in the Homoprotocatechuate Degradation Pathway of Escherichia coli. Journal of Molecular Biology. 370, 899-911 (2007).
- Manjasetty, B. A., et al. X-ray structure of fumarylacetoacetate hydrolase family member Homo sapiens FLJ36880. Biological Chemistry. 385, 935-942 (2004).
- Tame, J. R. H., Namba, K., Dodson, E. J., Roper, D. I. The crystal structure of HpcE, a bifunctional decarboxylase/isomerase with a multifunctional fold. Biochemistry. 41, 2982-2989 (2002).
- Ran, T., et al. Crystal structures of Cg1458 reveal a catalytic lid domain and a common catalytic mechanism for the FAH family. The Biochemical Journal. 449, 51-60 (2013).
- Ran, T., Wang, Y., Xu, D., Wang, W. Expression, purification, crystallization and preliminary crystallographic analysis of Cg1458: A novel oxaloacetate decarboxylase from Corynebacterium glutamicum. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 67, 968-970 (2011).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286, 36500-36508 (2011).
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290, 6755-6762 (2015).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 – a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475, 3561-3576 (2018).
- Taferner, A., et al. FAH domain-containing protein 1 (FAHD-1) Is required for mitochondrial function and locomotion activity in C. elegans. PLoS ONE. 10, 1-15 (2015).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63, 792-794 (2007).
- Bateman, R. L., Bhanumoorthy, P., Witte, J. F., McClard, R. W., Grompe, M., Timm, D. E., et al. Mechanistic Inferences from the Crystal Structure of Fumarylacetoacetate Hydrolase with a Bound Phosphorus-based Inhibitor. Journal of Biological Chemistry. 276, 15284-15291 (2001).
- Zeng, F., et al. Efficient strategy for introducing large and multiple changes in plasmid DNA. Scientific Reports. 8, 1714 (2018).
- Higuchi, R., Krummel, B., Saiki, R. K. A general method of in vitro preparation and specific mutagenesis of DNA fragments: study of protein and DNA interactions. Nucleic Acids Research. 16, 7351-7367 (1988).
- Jansen-Duerr, P., Pircher, H., Weiss, A. K. H. The FAH Fold Meets the Krebs Cycle. Molecular Enzymology and Drug Targets. 2, 1-5 (2016).
- Rupp, B. Origin and use of crystallization phase diagrams. Acta Crystallographica Section F Structural Biology Communications. 71, 247-260 (2015).
- Rupp, B. . Biomolecular Crystallography: Principles, Practice, and Application to Structural Biology. , (2010).
- Flint, D. H., Nudelman, A., Calabrese, J. C., Gottlieb, H. E. Enol oxalacetic acid exists in the Z form in the crystalline state and in solution. The Journal of Organic Chemistry. 57, 7270-7274 (1992).
- Pogson, C. I. I., Wolfe, R. G. G. Oxaloacetic acid tautomeric and hydrated forms in solution. Biochemical and Biophysical Research Communications. 46, 1048-1054 (1972).
- Kost, T. A., Condreay, J. P., Jarvis, D. L., Kost, A. T. Baculovirus as versatile vectors for protein expression in insect and mammalian cells. Nature Biotechnology. 23, 567-575 (2005).
- Steinberger, R., Westheimer, F. H. Metal Ion-catalyzed Decarboxylation: A Model for an Enzyme System 1. Journal of the American Chemical Society. 73, 429-435 (1951).
- Tate, S. S., Grzybowski, A. K., Datta, S. P. The stability constants of the magnesium complexes of the keto and enol isomers of oxaloacetic acid at 25. Journal of Chemical Society. , 1381-1389 (1964).
- Tate, S. S., Grzybowski, A. K., Datta, S. P. The acid dissociations of the keto and enol isomers of oxaloacetic acid at 25. Journal of Chemical Society. 1372, 1380 (1964).
- Brecker, L., et al. Synthesis of 2,4-diketoacids and their aqueous solution structures. New Journal of Chemistry. 23, 437-446 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유