Method Article
Fumarylacetoasetat Hydrolase etki alanı Içeren proteinleri ifade, arıtma, kristalizasyon ve enzim Asdimleri
Bu Makalede
Özet
Fumarilasetoasetik hidrolaz etki alanı içeren proteinlerin ifade ve arıtma örnekleri ( E. coli, FPLC ifadesi) ile açıklanmıştır. Arıtılmış proteinler kristalizasyon ve antikor üretimi için kullanılır ve enzim asdında istihdam edilir. Seçilen fotometrik asdalar, oxaloasetat dekarboksilaz ve acylpyruvate hydrolase olarak FAHD1 Multi-functionality görüntülemek için sunulmaktadır.
Özet
Fumarylacetoasetat hidrolaz (Fah) etki alanı içeren proteinlerin (Fahd) Ökaryotlar Fah süper ailesinin üyeleri tanımlanır. Bu süper ailenin enzimleri genellikle hidrolaz ve dekarboksilaz mekanizmaları içeren çoklu işlevsellik görüntüler. Bu makalede, bir dizi ifade ve FAHD proteinlerinin arıtma için ardışık yöntemler sunar, ağırlıklı olarak FAHD protein 1 (FAHD1) türler arasında orthologues (insan, fare, nematdes, bitkiler, vb.). E. coli'de protein ifadesi, yakınlık kromatografi, iyon değişimi kromatografi, hazırlık ve analitik jel filtrasyon, kristalizasyon, X-ışını kırığı ve fotometrik çeşitli yöntemler bulunmaktadır. Yüksek saflık seviyeleri konsantre protein (> 98%) kristalizasyon veya antikor üretimi için kullanılabilir. Benzer veya daha düşük kalitede proteinler enzim analizinde veya algılama sistemlerinde antijenler olarak kullanılan (Western-blot, ELıSA) olabilir. Bu çalışmanın tartışılmasında, FAHD1 'in tanımlanan enzimatik mekanizmaları daha ayrıntılı olarak hidrolaz ve decarboksilaz bi-işlevselliğini açıklamak için özetlenmiştir.
Giriş
Fumarilasetoasetik hidrolaz (Fah)1,2 süper aile enzimleri, son derece uyumlu katalizör Fah etki alanını paylaşan bir grup enzimi anlatıyor3,4,5,6 , 7 , 8 , 9 , 10. onların ortak katalitik merkezi rağmen, bu enzimler çok fonksiyonlu, ve çoğu prokaryotlar bulunur, onlar karmaşık karbon kaynaklardan alınan bileşikleri kırmak için kullanılan nerede3. Bu ailenin sadece üç üyesi şimdiye kadar ökaryotlarda tespit edildi: adı Fah2vererek, yanı sıra Fah etki alanı içeren protein 1 (FAHD1)11,12,13,14 ,15 ve Fah etki alanı içeren PROTEIN 2 (FAHD2). FAHD1 'ın tükenmesi, mitokondriyal solunum bozukluğu ile ilişkilidir13,16 ve orta potansiyele bağlı hücresel senesans fenotip14 geri dönüşümlü bir tür ile ilişkili Elektron taşıma sistemindeki eksiklikleri. Human FAHD1 ve model sistemleri (fare, Nematode, kanser hücresi hatları, bitkiler, vb), yanı sıra seçilen nokta mutasyon türevleri içinde ortolog, potansiyel ilgi uyuşturucu hedefleri haline gelmiştir. Bu araştırma için, yüksek saflık düzeylerinde Rekombinant protein yanı sıra kristal yapıları ve seçici antikorlar tarafından yönlendirilen katalizör mekanizmaları hakkında bilgi hayati önem taşımaktadır.
Bu yazıda E. coli'de Fahd protein ifadesi, yakınlık kromatografi, iyon değişimi kromatografi, amonyum sülfat yağması, Preparatif ve analitik jel filtrasyon, kristalizasyon, X-ışını kırıklaştırma yöntemleri ve fotometrik olarak. Burada açıklanan yöntemlerin ve protokollerin amacı, FAH süper ailesinin üyelerini karakterize etmek için, bakteriyoloji, bitki biyolojisi, hayvan ve insan çalışmaları gibi çeşitli alanlarda çalışan bilim adamları için rehberlik sağlamaktır. belirli bir alanda alakalı olmaları gerekir karakterize olmayan süper aile üyeleri. Burada açıklanan protokoller, diğer prokaryotik veya ökaryotik FAH süper ailesi üyelerini karakterize etmek amacıyla projeler için değerli destek sağlayabilir.
Burada açıklanan yöntemlerin arkasındaki mantık, kötü tarif edilen proteinlerin karakterizasyonu için (özellikle, bilinmeyen fizyolojik alaka düzeyinin metabolik enzimleri), saflaştırılmış rekombinant proteinleri ile başlama yaklaşımı, in vitro aktif enzim preparatları, yüksek kaliteli antikorlar ve seçilmiş enzimlerin güçlü ve spesifik farmakolojik inhibitörleri gibi paha biçilemez, yüksek kaliteli araştırma araçlarının geliştirilmesi. Açıklanan yöntemler, hızlı protein sıvı kromatografi (FPLC) ve X-ışını Kristalografi gerektirir. Alternatif Yöntemler (örn., kimyasal İndüksiyonsuz proteini ifade etmek ya da ısıl işlemden sonra santrifüjleme ile protein arıtımı göstermek ve ardından tuz çözme ve boyut dışlama kromatografisi), başka bir yerde17bulunabilir. Yöntem daha geniş bir spektrum, Fah üst aile enzimlerin ifade ve arıtma için kullanılabilir iken2,7,9,17,18, bu çalışma ifade odaklanır ve Özellikle FAHD proteinleri arıtma.
Bu makalenin tartışma bölümünde, katalizör reaksiyonlarının kimyasal karakterini göstermek için FAHD1 proteini (hydrolase, dearboksilaz)15 ' te tanımlanan katalitik mekanizmalar daha ayrıntılı olarak açıklanmıştır. Önceki çalışmaya göre elde edilen veriler7,15,18 (pdb: 6fog, pdb: 6foh) Keto-Enol izomeraz olarak enzim üçüncü bir aktivite anlamına gelir.
Protokol
1. yetkili E. coli 'de Fahd proteinlerinin ifadesi
- FAHD proteininin ifadesi için vektörler ile E. coli dönüşümü
Not: aşağıdaki bölümde açıklanan adımlar, Şekil 1a, B'de çizimde özetlenmiştir. Aynı protokol, nokta mutant türevleri de dahil olmak üzere herhangi bir FAHD proteini için geçerlidir. Bu tür varyasyonlar, vahşi tip cDNA 'dan siteye yönlendirilmiş mutagenez ve PCR teknikleri19 (iki taraflı SOE PCR20gibi) aracılığıyla elde edilebilir.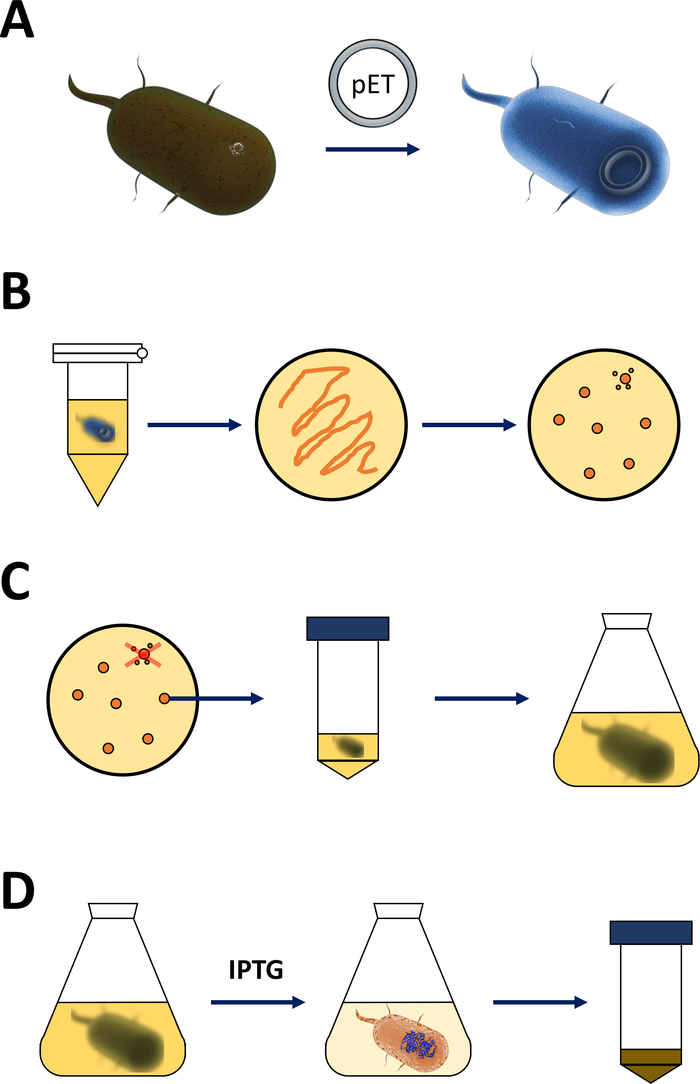
Şekil 1 : Yetkili E. coli ve protein ifadesinin Indüksiyonunda amplifikasyon.
(A) yetkili BL21 içine pET VEKTÖRÜNÜN eklenmesi (de3) plyss E. coli bakteriler, Bölüm 1 ' de açıklanmıştır. (B) Isı şok Protokolü ve pET kaplama E. coli bakteriler, adım 1 protokolün açıklanan dönüştürülmüş. Dönüştürülmüş bakteriler seçim için antibiyotikler ile LB agar plakaları üzerinde kaplamadır. (C) pET amplifikasyon dönüştürülmüş E. coli bakteriler, Bölüm 1 ' de açıklanmıştır. Koloniler LB agar plaka ve besleyici Orta (LB veya NZCYM) bakteri yoğunluğu 0,4 ampirik eşik ulaştı kadar amplifikatörlü tarafından seçilir. (D) de3-IPTG-pET sistemi aracılığıyla protein ifadesinin indüksiyonu, Bölüm 1 ' de açıklanmıştır ve Şekil 2' de çizilmiş. Protein üretimi kimyasal IPTG uygulaması ile başlatılır. 1. bölümün sonunda, proteini içeren bakteriyel Pelet hasat edilir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.- Yetkili BL21 (DE3) Plyss E. coli bakteriler ve bir pET ifade vektörü (bkz. malzeme tablosu) alın. Tercihen, aşağıdaki arıtma adımlarını basitleştirmek için bir N-Terminal onun etiketi veya ilgili yakalama etiketini kodlayan bir pET vektörü seçin.
- Tercih edilen Fahd proteininin cDNA 'yı edinin ve sırasıyla T7 organizatör ve T7 Terminator siteleri arasında pET ifade vektörünün etkin klonlama sitesine yerleştirin.
- Başarılı Plasmid amplifikasyon ve doğrulama sonra [ticari bir tedarikçi tarafından sıralama yoluyla (T7 astarlar kolaylık sağlamak için pET sistemi ile kullanılabilir: T7 Promoter, Forward astar: taatacgactcactataggg; T7 Terminator, Reverse primer: GCTAGTTATTGCTCAGCGG)], Ekle 5-10 ng Plasmid içine 100 μL yetkili BL21 (DE3) Plyss E. coli bakteri buz üzerinde. Yukarı ve aşağı Aspire değil, ancak biraz içeriği karıştırmak için tüp dokunun.
- 30 dakika boyunca buzda bakterileri tutun, hafifçe her birkaç dakika tüp dokunarak.
- Bir ısıtma cihazı veya su banyosu 42 °C (tam) ısı. Cihazın içine bakteri içeren tüp koyun ve 90 s (tam) için onları tutmak. Hemen buz üzerine koyun (Şekil 1a).
- Buz üzerinde 5 – 10 dk sonra, 600 NCZYM orta μL ekleyin ( malzeme tablosunabakın) ve bir bakteri kuluçl içine tüp koymak. 37 °C ' de sallama yönü boyunca orta hızda yönelten tüpü 1 saat boyunca sallayın.
- Plaka 200 bir 10 cm LB-agar plaka üzerinde bakteriyel kültürün μL ( malzeme tablosunabakın), tercih seçim antibiyotikler içeren [Örneğin, bir BL21 için özel (de3) plyss direnci (chloramphenicol), ve direnç için bir hayvan vektörü (kanamycin veya ampisilin, Şekil 1B)] üzerinde kodlanmış.
- 37 °C ' de bir bakteriyel kuluçağında LB-agar plaka üzerindeki bakterileri gece.
- ITG indüksiyon tarafından FAHD proteinlerinin ifadesi
Not: aşağıdaki bölümde açıklanan ilk adımları Şekil 1C, D'de bir çizim olarak özetlenmiştir. T7 ifade sistemi, bakteriyel de3 kaset ve pET vektör sistemi kombinasyonu ile Şekil 2' de özetlenmiştir.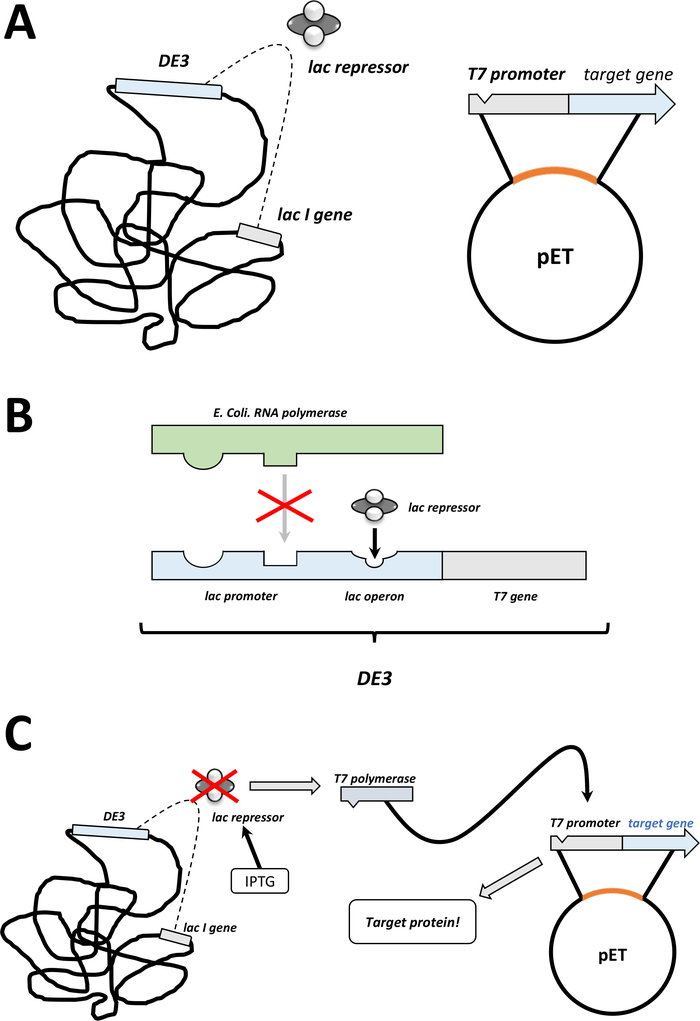
Şekil 2 : De3 kaset/pET vektör çift sistem açıkladı.
(A) hayvan vektörünün ÇIZILMIŞ genomu dönüştürülmüş bl21 (de3) plyss E. coli bakterileri. Yerel bakteriyel genom bir DE3 kaseti taşır (B paneline bakın), hem de sürekli olarak Lac baskıcı birimlerini ifade eden bir Lac geni. Yerel olmayan Evcil hayvan vektörü, T7 polimeraz promotör ve Terminator Sequence arasında eklenen protein geni taşır. B panelinde daha fazla ayrıntı (b) yerel bakteriyel GENOMUN de3 kaseti bir E. coli RNA polimeraz operon açısından T7 polimeraz bilgilerini kodlar. Ancak bu protein, Lac baskıcı ünitesi RNA polimeraz proteini bağlamanın engellediği için ifade edilmez. Bu nedenle hiçbir T7 polimeraz ifade edilir ve hiçbir eksojen protein ifade edilir. (C) kimyasal IPTG (malzeme tablosu) uygulaması Lac baskıcı birimlerinin yapısını BOZUR ve de3 kasetine bağlanmalarını önler. Sonuç olarak, RNA polimeraz artık, T7 polimeraz olarak ifade edilen kasete bağlanabilir, sonunda eksojen protein olduğu gibi. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.- Başarılı koloni oluşumundan sonra, tek bir koloni seçin (herhangi bir uydu kolonisi olmadan) ve onu 5 mL NZCYM veya LB orta antibiyotiklerle dağıtın, daha önce olduğu gibi seçilir (adım 1.1.7). 37 °C ' de bakteriyel kuluçte kültürü (Şekil 1C).
- Başarılı bakteriyel büyüme sonra, 250 mL, 500 mL, ya da 1 L orta toplu, protein miktarı talep bağlı olarak bakterileri yükseltmek.
- Hacim için uygun, adım 1.1.7 yapılan gibi seçilmiş antibiyotikler uygulamak ve yaklaşık ekleyin 1% – 2% yoğun bakteriyel ön Kültür (yani, 2.5 – 5.0 mL için 250 mL hacmi orta, vb.). Adım 1.2.5 (1 mL veya daha fazla) kullanılmak üzere bir örnek alın ve 600 Nm 'de optik yoğunluğu (OD) kontrol edin. 37 °C ' de bakteriyel kuluçte kültür bakterileri 2 – 3 saat (Şekil 1C).
- 2 – 3 saat sonra, fotometrik analiz için bir örnek çizin. 600 Nm 'de bulunan OD 0,4 ' e ulaştığında, 1 mM isopropresl-β-D-thiogalactopyranosid (ıPTG, bkz. malzeme tablosu) ' a kadar 200 μM uygulanır.
Not: gerçek değer her FAHD protein veya nokta mutasyon varyantı, 1 mM ıPTG uygulanması gereken maksimum olduğu için ampirical. Bu protein ifadesi (Şekil 1D, Şekil 2C) indükler. - 37 °C ' de bakteriyel kuluçte 3 – 5 saat daha sonra protein ifadesi tükenir.
Not: sıcaklık kontrolü hakkında yorumlar için tartışma bölümüne bakın. İndüksiyon sonra sallayarak 5 h daha uzun tavsiye edilmez. Adım 1.2.5 (1 mL veya daha fazla) kullanmak için bir örnek alın ve 600 Nm 'de optik yoğunluğu (OD) kontrol edin.- 5 dakika boyunca 5.000 x g 'de santrifüjleme ile bakteri peletleri topla ve daha uzun süre depolama için-80 °c ' de (Şekil 1D) kısa depolama için Pelet at-1-$ ' ı dondurur.
- "-I" (İndüksiyon öncesi) ve "+ ı" (İndüksiyondan sonra) etiketli iki alınan fotometrik numune ile indüksiyon doğrulayın. Santrifüj ve bakteriyel Pelet Resuspension sonra, toplam protein aynı miktarda yükleyerek SDS-PAGE tarafından iki numune analiz.
Not: "+ ı" örneği, seçilen proteinin moleküler ağırlığı ile ilişkili güçlü bir bant görüntülemelisiniz, ancak "-ı" örneği bu bandı içermemelidir. Düşük indüksiyon seviyesi protein üretimi için yaygın bir sorundur, ancak ifade edilen protein seviyesi genellikle aşağıdaki adımlar için yeterlidir. Yüksek indüksiyon seviyesi bir avantajdır ama zorunlu değildir.
2. bakteriyel Pellet ve enkaz filtrasyon Lysis
- Seçilen proteinin onun-etiketli veya etiketlenmemiş olup olmadığına bağlı olarak, nı-NTA ' n l i çalışan tampon (onun-etiketli, malzeme tablosunugörmek) veya buz-soğuk yok çalışan tampon (etiketlenmemiş).
- Her 250 ml orijinal bakteriyel süspansiyon için, seçilen tamponun 5 ml 'yi bakteriyel Pelet 'e (250 ml için 5 ml, 500 ml için 10 ml, vb.) uygulayın. 5 mL uygulanan tampon başına 10 μL β-mercaptoetanol (β-ME) ekleyin. 10 mL Pasteur pipet kullanın ve pipetleme (pipetleme sırasında hava balonu oluşumundan kaçının) ile peletleri süspansiyon içine mekanik olarak zorlar. Sonunda tüm süspansiyon 1 50 mL tüp içine aktarmak.
- Tercihen sonikat (orta güçle 15 s için 6x) süspansiyon.
- 4 °C ' de yüksek hızda (10.000 x g) 30 dakika Santrifüjü. Buzun üzerinde filtre üniteleri (örn. 0,45 μm, 0,22 μm) ile süpernatant 'ı ardışık olarak filtreleyin.
Not: önceki santrifüjleme adımına bağlı olarak, küçük bir filtre gözenek boyutu ile doğrudan filtrasyon sıkıcı olabilir ve genellikle daha büyük bir gözenek boyutu ile ön filtrasyon gerektirir. DNAse daha iyi sonuçlar için eklenebilir. - Örnek buz üzerinde saklayın ve hemen ya Bölüm 3 veya 4, proteinin onunetiketli veya etiketlenmemiş olup olmadığına bağlı olarak devam edin.
3. ni- NTA benzeşimi Kromatografi KULLANıLARAK etiketlenmiş Fahd proteinlerinin arıtılması
Not: ni2 + iyonlarının nitrilotriacetic asit (NTA) ile yakınlık Kromatografi (immobilize Metal İyon Kromatografi, IMAC, Şekil 3A) kullanılan bir agaroz reçine ile bağlanır. Poly-histidin amino asit etiketleri bu ni-şelat şiddetle bağlamak, ve onun-Tagged protein kalan proteinlerin çoğunluğu ayrılır. Ni-NTA sütunlarının açıklanan hazırlanmasına alternatif olarak önceden paketlenmiş ni-NTA sütunları ve FPLC sistemi kullanılır.
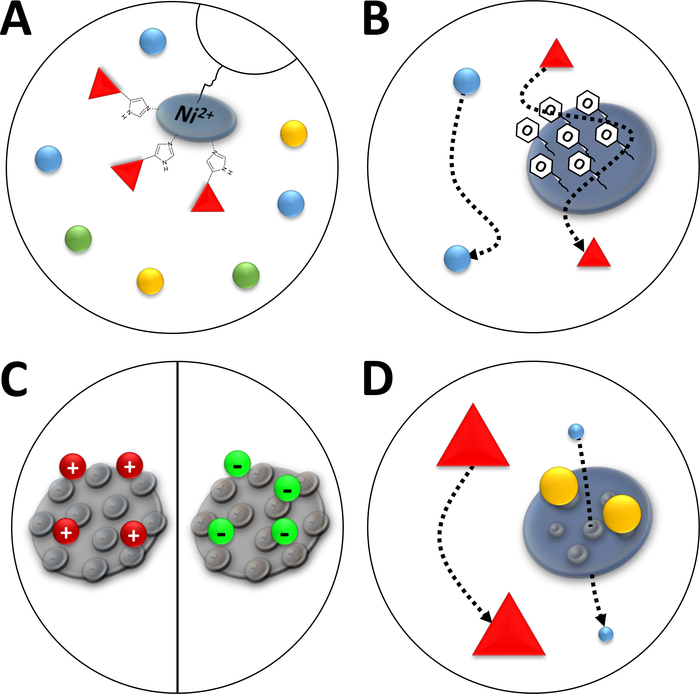
Şekil 3 : Yaygın Kromatografi türlerinin çizilmiş çizimleri.
(A) bir nı-NTA sütununun reçine. NTA immobilize Metal İyon benzeşme Kromatografi (IMAC) açısından kullanılan iki bivalent nikel iyonlarının tutar. Poly-histidin etiketleri bu motif tercihen bind ve imidazol tarafından elüe olabilir. (B) fenil bazlı hidrofobik etkileşim Kromatografi (Don-fenil) içinde silika partiküllerinin tipik kaplama. Hidrofobik proteinler kaplama malzemesi ile etkileşime girebilir ve diğerleri yokken göç ederken gecikir. (C) iyonik etkileşim kromatografisinde silis parçacıklarının tipik kaplaması. Polarize ve şarj proteinleri kaplama malzemesi ile etkileşim ve diğerleri değilken onların göç gecikmeli. (D) boyutu-dışlama Kromatografi (SEC) bir silika jel reçine. Silika malzemesinde tanımlanan gözeneklere dayanarak, proteinler boyutlarına göre ayrılabilir (moleküler kütlesine karşılık gelen ilk yaklaşımlı olarak). Küçük proteinler gözenekli sütun malzemesi nüfuz ve geri zekalı, büyük proteinler gözenekli parçacıklar etrafında daha hızlı göç ederken. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
- Adım 2,5 (yani, protein ni-NTA tampon çalışan ve buz üzerinde 0,22 μm filtre üniteleri tarafından filtre) devam edin.
- Boş bir sütunu yıkayarak ve onu kararlı bir tutucu ile takarak boş bir plastik veya cam sütun hazırlayın. Protein süspansiyonunun hacmine bağlı olarak sütunun boyutunu seçin.
- Her 10 ml protein süspansiyon için, sütun içine ni-NTA agaroz Bulamaç 500 μL uygulayın (kullanımdan önce ağır bir şekilde sallayın). Bulamaç yavaşça uygulayın ve bir pipet kullanarak sütunun alt filtre üzerine dropwise. Bir kaç saniye sürer sütun yerleşmek edelim.
- Ni-NTA çalışan tampon ile sütunu tamamen doldurun, agaroz reçinesini bozmamayı sağlar. Tamponun yerçekimi ile çalışmasını sağlar. Süreç sıvı üzerine başparmak basıncı uygulayarak hızlandırılabilir (bir kapak veya eldiven ve başparmak basıncı kullanarak), ama agaroz reçine deforme etmek için dikkat çekmek.
- Protein süspansiyonunu uygulayın. Daha önce olduğu gibi, örnek yerçekimi ile çalıştırmak izin verin. Akış hızı düşükse, kolon proteinleri bağlama artırılıyor gibi başparmak basıncı kullanarak bu adımı hızlandırma, tavsiye edilmez. Bir tüp içinde akışı toplamak (malzeme tablosu).
- Örnek geçtikten sonra tüm sütunu yeniden ni-NTA arabellek çalışan ile doldurun. Agaroz reçinesini bozmamak için özen yapın. Numunenin yerçekimi ile çalışmasını sağlar, ancak önceki adımın aksine, belirli etkileşimlerden dolayı potansiyel kontaminasyonlar bu şekilde bozulabilir gibi başparmak basıncı ile süreci hızlandırarak, önerilir. Yıkama solüsyonu bir tüpte toplayın. Bu adımı yineleyin.
- Sütunun altına UV şeffaf bir küvet yerleştirin ve 1 mL ni-NTA elüsyon tamponunu uygulayın. Reçine herhangi bir başparmak basıncı uygulamadan örnek toplayın.
- Numunenin optik yoğunluğunu (OD) 280 nm vs. boş bir örneğe (örn., ni-NTA elüsyon arabelleği) kontrol edin. En iyi şekilde, örnek 2,5 'den büyük bir OD görüntüler. 0,5 altında bir OD, numunenin önemli miktarda protein olduğunu gösterir.
Not: tartışma bölümünde belirtildiği gibi, elüsyon tamponunun tuz ve imidazol konsantrasyonları her FAHD proteini için bireysel olarak adapte edilmelidir. - 3.1.7 ve 3.1.8, OD 0,5 altında düşene kadar adımları yineleyin. Buz üzerinde bir tüp daha yüksek OD ile tüm örnekleri havuz.
- Adım 3.1.4 ile yeniden başlatın, adım 3.1.5 bu tekrarlama için yeni giriş olarak adım 3.1.5 akışını kullanarak. Adım 3.1.6 toplanan ilk örnek 0,5 altında bir OD görüntüler kadar bu işlemi yineleyin.
Not: tartışma bölümünün sorun giderme bölümünde özetlendiği gibi, onun etiketli proteinler ni2 +-reçine için yetersiz bağlanabilir. Bu gibi durumlarda, bu adımın veya alternatif yöntemlerin (örn. iyon değişimi Kromatografi) tekrarı gereklidir. - SDS-PAGE analizi için tüm ara kesirlerin örneklerini alın.
- Ni-NTA elüsyon tamponunun içinde FAHD proteinleri donma ve çözülme üzerine çökelecektir. Bu nedenle, protein farklı bir tampon (buz üzerinde bir gecede, 100 mL Dializ tampon başına 1 μL DTT kullanarak) Dialyze. Bu adımdan sonra hangi iyon değişimi Kromatografi tipine bağlı olarak düşük tuz arabelleği kullanın. Tipik bir moleküler ağırlık Cut-off 14 kDa (malzeme tablosu) ile ortak selüloz boru kullanın.
- Gece diyaliz sonra, opsiyonel olarak Ultra santrifüjleme filtre üniteleri kullanarak protein konsantre. SDS-PAGE analizi gerçekleştirin (12,5% çalışan jel,% 4 istifleme jeli) protein kaybı, yetersiz elüsyon ve genel olarak protein saflığını kontrol etmek için. Her şey yolunda ise, Bölüm 5 ' e geçin.
4. etiketsiz FAHD proteinlerinin hidrofobik etkileşim Kromatografi yoluyla arıtılması (hıc)
Not: FPLC için bir SII sütunundaki silika jel kaplama yüzeyinde fenil-gruplar (Şekil 3B) proteinlerin hidrofobik karaktere göre ayrılmasını sağlar. Açıklanan adımlar 5 mL yok-fenil sütunuyla donatılmış bir FPLC sistemiyle yapılmalıdır. Sütunlar, farklı proteinlerde yeniden kullanılması için 1 M NaOH ile yıkanabilir. Ancak, bir kez FAHD proteini bir tür için kullanılan sütunlar sadece bu tür protein için yeniden kullanılmalıdır.
-
Amonyum sülfat (AS) yağış
- 2,5 adımda devam edin. Protein, buz gibi soğuk çalışan tampon (malzeme tablosu) içinde.
- Hazırlanmış protein çözeltisi hacminin mikrolitre (V Initial) ile tamolarak değerlendirilmesi. Yavaşça ve Drop-Wise eklemek önceden soğutmalı hıc çalışan tampon AS çözüm, bir 35 kadar hacim-% AS doygunluk ulaşılana kadar : v Added = v Initial * 0,538. Çözeltinin yavaşça 30 dakika boyunca karıştırın. 4 °C ' de yüksek hızda (≥ 10.000 x g) 15 dakika santrifüjle.
- Buz üzerinde bir 0,22 μm filtre ünitesi kullanarak süpernatant filtre. İsteğe bağlı olarak, SDS-PAGE analizi için bir örnek alın: 1:4 ve ısıyı hemen 95 °C ' de 5 dakika veya başka bir örnekte şişkinlik olacak şekilde seyreltin. Örnek, başka bir gün devam etmek için bu noktada (-20 °C) dondurulmuş olabilir.
-
HıC sütunu kullanan FPLC
- FPLC sistemi kurulumu ve 5 sütun hacimleri (CV) ile 5ml hiç fenil sütun doğrultma 20% EtOH (h2o) sonra 5 h2o CV.
- Mix 260 mL hıc çalışan tampon (tam) ile 140 mL hıc çalışan tampon AS (tam). Bu, 35 birim% AS çözümünde sonuçlanır. PH (7,0) kontrol edin; Bu arabellek A. arabellek B 250 mL çalışan arabellek olduğunu. İki tampon A ve B 'ye 1 mM DTT ekleyin, sonra buz üzerinde tutun.
- 8 ml arabellek A, 8 ml arabellek B ve 8 mL arabellek A ile bu sırada sütun equilibrate. Protokol adım 4,1 hazırlanmış örnek uygulayın. 280 nm 'de temel optik emilimi 1000 – 500 mAU 'ya ulaşana kadar A tampon ile yıkayın.
- A ve B tamponların bir karışımını uygulayın, böylece konsantrasyonu gıbı 33% (w/v). 1 CV ile yıkayın, kromatogram bir plato sonuçlanan. B tamponunun gradyanının ayarlanması (zaman içinde% 100 tampon B 'ye kadar): 3,8 dk 'da B tampon 1,5 mL (örn.% 1 B/mL eğim ile% 5,7 tampon B). 280 nm 'de UV sinyali yükseldiğinde, fraksiyonu toplamaya başlayın ve hemen buza yerleştirin.
- Sonunda, sütun B tampon ile yıkayın. SDS-PAGE analizi için tüm fraksiyonlar örneklerini alın. Sıvı nitrojen kullanarak tüm numuneleri dondurur ve-80 °C ' de saklayın.
- Toplanan Kesirlerde FAHD proteini algılamak için SDS-PAGE (ve Batı Blot) analizini gerçekleştirin. Proteini içeren kesirler havuza alınmış ve aşağıdaki protokol adımlarında belirtildiği gibi daha fazla arıtma için uygulanır. Sütunu H2o ve% 20 EtOH (h2o) ile yıkayın.
5. iyon değişimi kromatografi ile FAHD proteinlerinin arıtılması
Not: şarj edilmiş fonksiyonel gruplarla moleküller FPLC için bir silis parçacık sütununa bağlıdır (Şekil 3c). Bu, proteinleri yüzey şarj gibi iyonik karakterlerine göre farklılaşmasını sağlar. Açıklanan adımlar, sırasıyla bir FPLC makinesi ve ilişkili know-how ile yapılmalıdır. Açıklanan yöntem, katyonik veya anyonik Exchange kromatografi için aynıdır, ancak kullanılacak arabellekler biraz farklıdır.
- Katyonik veya anyonik değişim Kromatografi sistemini seçti. Bu seçim ampirik ve FAHD proteinleri arasında farklılık gösterebilir. En iyi şekilde, her iki yöntem de ardışık olarak kullanılabilir.
- FPLC sistemini kur ve sütun 5 CV ile yıkayın 20% EtOH (H2o), ardından 5 CV H2o. düşük tuz tampon 1 CV Ile sütun equilibrate, yüksek tuz tampon, ve yine bu sırada düşük tuz tampon.
- Örnek (adım 3.1.11 doğru düşük tuz arabelleği karşı dialyzed) sütun üzerine uygulayın. Akışı toplayın. Düşük tuz tampon ile 1 CV için sütun yıkayın.
- Gradyan elüsyonu Kur: 100% yüksek tuz arabelleği 30 dk, 1 mL/dak debisi veya 0,5 mL/dak debisi 60 dk. Bu, arıtma optimize etmek için zaten bilinen FPLC kromatogram dayalı yeniden seçilebilir. Tüm tepe kesirleri toplayın.
Not: yüksek tuz koşulları, tartışma bölümünde belirtildiği gibi FAHD proteinleri arasında farklılık gösterebilir. - Gradyan bittikten sonra, 1 CV (fraksiyonları toplayın) aralığında daha fazla zirve algılanıncaya kadar yüksek tuz arabelleği ile çalıştırın.
- Toplanan tüm fraksiyonlar örneklerini alın ve SDS-PAGE analizi gerçekleştirin (12,5% çalışan jel,% 4 istifleme jeli). Sıvı azot bireysel numuneleri dondurmak ve onları-80 °C ' de saklayın.
- SDS-PAGE Analizi tamamlandıktan sonra, FAHD proteinini içeren numuneleri havuzlayıp diğerlerini atın. İsteğe bağlı olarak, protein Ultra santrifüjleme filtre üniteleri kullanarak konsantre.
- Sütun temizlemek için 0,5 M NaOH (veya diğer deterjanlar) 1 mL% 25 SDS uygulayın. Sütunu H2o ve% 20 EtOH (h2o) ile yıkayın.
- İsteğe bağlı olarak, alternatif sütun (cationic veya anyonik değişim Kromatografi) ile Bölüm 5 tekrarlayın. Bu yöntemden elde edilen protein, temel aktiviteyi gerçekleştirmek için yeterince saf olup, kristalografinin taramasında kullanılabilir. Gelişmiş uygulamalar için Bölüm 6 ' ya geçin.
6. FAHD proteinlerinin boyut-dışlama Kromatografi (SEC) yoluyla arıtılması
Not: FPLC için silika jel sütunundaki gözenekli parçacıklar, proteinlerin hidrodinamik yarıçaplı (şekil 3D) gibi moleküler boyuta göre farklılaşması sağlar. Açıklanan adımlar, SEC sütunlarını kullanarak bir FPLC sistemiyle gerçekleştirilecektir.
- SDS-PAGE ve Silver stainıng ile algılandığı gibi, hala mevcut olan kontaminasyonların moleküler ağırlıklarına bağlı olarak bir SEC sütunu seçin. Anahat yöntemi her iki sütun için de uygundur. Sütun gece 400 ml H2O ve doğrultma sec çalışan tampon ile yıkayın. Bu adımı otomatikleştirmek için FPLC sistemi için bir program yazmak için tavsiye edilir.
- 1 mM DTT için 300 mL SEC çalışan tampon ekleyin ve buza koyun. Bu, çalışan arabellek. Uygulama 60 Bu arabellek mL sütuna.
- Herhangi bir mikro-yağış kaldırmak için protein örneği (10.000 x g 10 dk) Santrifüjü. Sütun için süpernatant uygulayın. Genellikle FPLC önce süpernatant filtre önerilir.
- Tüm protein alınıncaya kadar çalışma arabelleğini sütuna uygulayın. Tüm doruklarına uygun hacim (örn., 2 mL) kesirler toplayın. SDS-PAGE için numune alın ve sıvı nitrojen kullanarak tüm kesirleri dondurur. Dondurulmuş kesirleri-80 °C ' de saklayın.
- SDS-PAGE (ve Western blot) analizinden sonra, FAHD proteini içeren tüm fraksiyonları toplayın ve havuzla. Gümüş boyama hala mevcut olabilir küçük kontaminasyonlar tespit etmek için tavsiye edilir.
- Protein konsantrasyonu için Ultra-santrifüjleme filtre üniteleri kullanın. FAHD proteinleri için zorunlu olmasa da, genel olarak bir tuz çözme adımı (örn. Dializ) enzimleri ve kristalizasyonu için tavsiye edilir.
- FAHD proteininin saflığını arttırmak için farklı akış hızları ve tuz konsantrasyonları (Ampirik) ile birkaç kez 6.3 – 6.6 arasındaki adımları yineleyin. Sütun gece H2o ve% 20 EtOH (h2o) ile yıkayın.
7. temel FAHD aktivite Altlar oxaloasetat ve asetilpyruvate ile gösteriyor
Not: Fahd protein 1 (FAHD1) oxaloasetat dekarboksilaz (ODX) ve acylpyruvate hidrolaz (APH) etkinliğini görüntüler. Bu, tartışma bölümünde daha ayrıntılı olarak özetlenmiştir. Sulu çözelti içinde Keto-Enol tautomerization tarafından istikrarsızlık nedeniyle (yani, enolization), bir kofaktör konsantrasyon ve pH işlevi olarak zaman içinde (Auto-decarboxylation) kendisi tarafından oxaloacetate bozunmaları. Yaklaşık 7 PH ve 25 °c sıcaklık, bu etkisi dramatik değildir, ancak her iki otomatik dearboksilasyon ve enzim konsantrasyonu için hesaba kesim gerekir. Pipetleme şeması Şekil 4A'da özetlenmiştir. Genel olarak, küçük pipetleme hatalarına oldukça duyarlı olduğu için, bu tahlil için iyi kalibre edilmiş pipetler kullanılması tavsiye edilir.

Şekil 4 : Enzimleri Için çizilmiş pipetleme şeması.
(A) temel SUBSTRAT bazlı Fahd protein enzimi için çizilmiş bir pipetleme şeması. Boş substrat:-S/-E; substrat örneği: + S/-E; boş enzim:-S/+ E; enzim örneği: + S/+ E (S: substrat, E: enzim). Bkz: protokol adım 7 daha fazla ayrıntı için. (B) Fahd proteininin Michaelis-Menten kinetiği değerlendirmesi için çizilmiş bir pipetleme şeması. Boş substrat:-S/-E; substrat örneği: + S/-E; boş enzim:-S/+ E; enzim örneği: + S/+ E (S: substrat, E: enzim). Daha fazla ayrıntı için protokol 8 bölümüne bakın. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
- Bir Mikroplaka okuyucusu başlatın ve 25 °c ' de 30 dakika için doğrultma yapın. 255 nm 'de 12 kuyu ( Şekil 4A'da belirtildiği gibi) okumak için bir program Kur. 5 MS zaman gecikmesi ile 25 çoklu okuma kullanılması tavsiye edilir. Kurulum bir döngü 15x her 2 dakika (30 dk toplam) ölçmek için.
- Varsayılan olarak, bir enzim tahlil tampon hazırlamak ( malzeme tablosunabakın) Ile 1 mm MgCl2 pH 7,4. Varyant Fahd proteinleri farklı Kofaktörler veya pH seviyeleri gerektirebilir. Mg2 + ve mn2 + FAHD13,11,12,21için bilinen Kofaktörler vardır.
- 1 μg/μL protein çözeltisi oluşturun, enzim tahlil tamponunu (malzeme tablosu) seyreltir.
- Test edilecek bir substrat 1 mL 20 mM çözeltisi ayarlayın (FAHD proteinlerinin şimdiye kadar tanımlanan substratlar başka bir yerde listelenmiştir3) enzim tahlil tampon.
- Şekil 4A'da gösterilen pipetleme planına göre, enzim boş ve numune kuyuları hazırlayın: pipet 90 μL enzim tahlil tamponu (malzeme tablosu) 5 μL (5 μg) enzim çözeltisi ile kuyulara yerleştirin.
- Şekil 4A'da gösterilen pipetleme planına göre, substrat boş ve numune kuyuları hazırlayın: pipet 95 μL enzim tahlil tamponu kuyuların içine.
- Ölçümden hemen önce, altı boş kuyuya 5 μL enzim tahlil tamponu uygulayın. Örnek kuyulara 20 mM 'Lik substrat çözeltisi için 5 μL uygulayın. Çok kanallı pipet kullanılması tavsiye edilir.
- Tüm kuyuları hafifçe karıştırmak için 50 μL ayarlarında çok kanallı pipet kullanın. Boşluklar ile başlayın ve örnek kuyuları ile devam edin. Herhangi bir kabarcıklar oluşturmak için dikkat alın. Plakayı bir Mikroplaka okuyucuya yerleştirin ve 255 nm 'de her iyi ölçün (7,1 adımda açıklandığı gibi).
- Bir elektronik tabloda analiz gerçekleştirin. Fotometreden ham verileri bir elektronik tabloya kopyalayın ve tüm ayarları (örn. tüm belgeler) başka bir sayfaya yazın. Dört hazırlıkların her biri üç kuyuların ortalama veri. Örnekten boş çıkarın. Ayrıca standart sapmaları hesaplamak ve boş ve örnek sapmaları toplamı.
- Bu verileri (y: optik yoğunluk, x: dakika cinsinden zaman) çizin. Katlanarak azalan eğri görüntülenmesi gerekir. Kullanımda substrat türüne bağlı olarak, ilk 10 dakika içinde bir ilk artış görülebilir, sonra sinyal azalır. Bu, alt substrat Keto-Enol tautomerization için asribed, tartışma bölümünde daha ayrıntılı olarak özetlenmiştir.
- Verileri [0,0] aralığına ölçeklendirmek için optik sinyal verilerini zaman içinde grafinin en büyük değerine göre bölün ( Şekil 5A'da bir örnek sağlanır). İlk düşüşden başlayarak eğrinin doğrusal aralığını tanımlayın ve negatif eğimi (1/dak) hesaplayın.
- OD azalma zaman kursu ilk konsantrasyonu ile substrat ilişkilidir: 100 nmol/iyi * eğim. Değerlendirilen protein konsantrasyonu c0 kullanarak, belirli aktivite hesaplanır: 100 nmol/iyi * eğim * 1/c0. Μg/Well 'de c0 ' ı ifade etme, bu şekilde hesaplanan özel aktivite, μmol/min/mg değerine eşittir nmol/min/μg birimini kullanarak ifade edilir.
8. FAHD proteinlerinin Michaelis-Menten kinetiği değerlendirilmesi
Not: özel protein aktivitesinin hem bağıl protein-substrat konsantrasyonu hem de reaksiyonun yapıldığı fiziksel hacmine bağımlı olduğu için, FAHD proteinlerinin Michaelis-Menten kinetiği değerlendirmesi sıkıcı bir iştir. Güvenilir sonuçlar elde etmek için istikrarlı devlet kinetiği kurulmalıdır. 96 iyi UV şeffaf plaka üzerinde test edilmiş bir protokol aşağıdaki adımlarda özetlenmiştir. Küçük hatalar genellikle deney yağma gibi her adım, büyük bir bakım ile gerçekleştirilmesi gerekir. Aşağıda açıklanan daha karmaşık tahlil denemeden önce bölüm 7 özetlenen deneyleri ustalaşmak için tavsiye edilir.
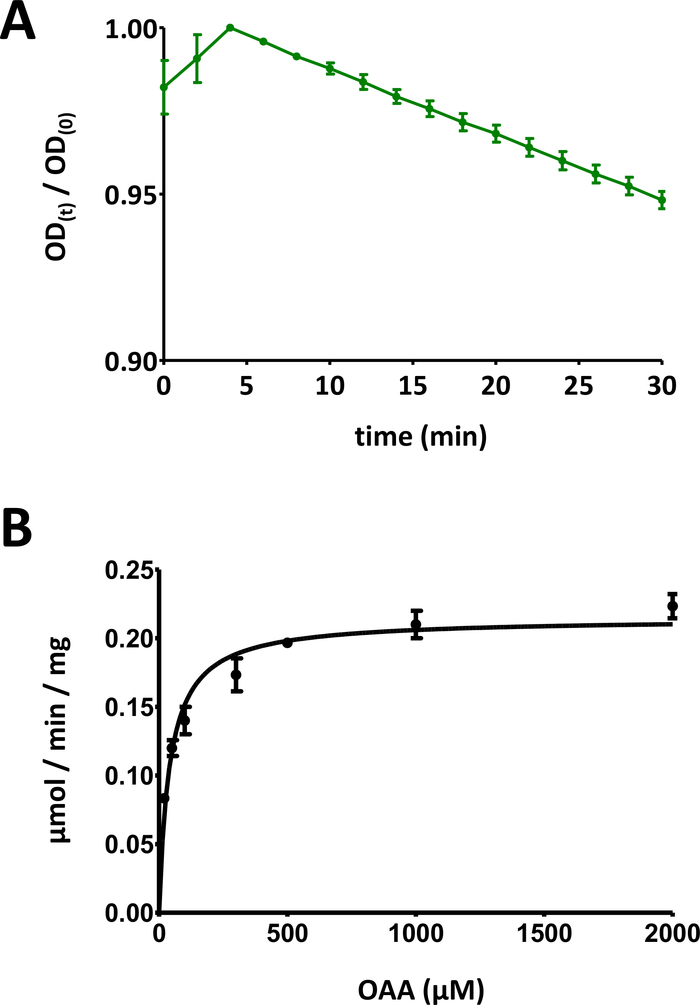
Şekil 5 : Enzimlerin örnek sonuçları.
(A) standart sapma ile temel SUBSTRAT bazlı Fahd protein enzim analizlerine (0 ile 1 aralığında normalleştirilmiş) elde edilen örnek bir UV emme eğrisi. Optik yoğunluk (OD) oranı [OD (t)/OD (0)] herhangi bir zamanda t [OD (t)] ilk OD normalleştirilmiş [t = 0; OD (0)]. Daha fazla ayrıntı için protokol 7 bölümüne bakın. (B) standart sapma Ile insan FAHD1 proteinin örnek Michaelis-Menten kinetiği. Daha fazla ayrıntı için protokol 8 bölümüne bakın. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
- Bir Mikroplaka Okuyucu başlatın ve 25 °c ' de 30 dakika için doğrultma. 255 nm 'de 72 kuyuları ( Şekil 4b'de belirtildiği gibi) okumak için bir program ayarlayın. 5 ms gecikme süresi ile 25 çoklu okuma kullanılması önerilir. 15x her 2 dakika (30 dk toplam) ölçmek için bir döngü ayarlayın.
- 7,2 ve 7,3 adımları gerçekleştirin. Daha sonra, 1 mL 100 mM substrat çözeltisi enzim tahlil tampon ayarlayın.
- Enzim tahlil tamponunun substrat çözeltisi seyreltme hazırlama: 40 mM, 20 mM, 10 mM, 6 mM, 4 mM, 2 mM. Tahlil, ikili ("düzeltilmiş") enzim/substrat konsantrasyonları ile gerçekleştirilir. Bunun için, enzim solüsyonu tampon içinde enzim çözeltisi aşağıdaki seyreltme hazırlayın: 0,5 μg/μL, 0,4 μg/μL, 2,5 μg/μL, 2 μg/μL, 1,5 μg/μL, 1 μg/μL.
- Figure 4B 'de tasvir edilen tüm kuyuların Içine 180 μL enzim tahlil tamponu uygulanır. Substrat için tüm kuyuları içine 10 μL enzim tahlil tampon uygulayın (boş ve örnek). Hazırlanmış protein seyreltme serisinin 10 μL 'i enzim için kuyulara uygulayın (boş ve numune). Alt substrat için kuyular için tüm kuyuları içine 10 μL enzim tahlil tampon uygulamak ve boş enzim.
- Ölçümden hemen önce, substrat numunesi ve enzim numunesi için hazır substrat seyreltme serisinin 10 μL 'i kuyulara uygulayın.
- 50 μL ayarlarında çok kanallı pipet kullanarak tüm kuyuları yavaşça karıştırın, boşluklar ile başlayarak örnek kuyulara gidin. Herhangi bir kabarcıklar oluşturmak için dikkat alın.
- Plaka bir Mikroplaka Okuyucu içine takın ve 255 nm de her iyi ölçmek, adım 8,1 özetlenen gibi. Bir elektronik tabloda analiz gerçekleştirin. Fotometreden ham verileri bir elektronik tabloya kopyalayın, tüm ayarları (örn. tüm belgeler) başka bir sayfaya yazın.
- 7,11 adımda özetlendiği gibi, dilüsyon serisindeki nokta başına bireysel veri analizini gerçekleştirin. 7,14 için. Sonunda, tüm özel faaliyetler elde ve ilk substrat konsantrasyonu karşı Plot: 2 mM, 1 mM, 0,5 mM, 0,3 mM, 0,2 mM, 0,1 mM.
- Tüm veri noktalarını bireysel standart sapmaları ile görüntüleyin. Bilgisayar Michaelis-Menten kinetiği doğrusal olmayan eğri montaj veya Lineweaver-burk analizi yoluyla. Bireysel noktaları yeniden ölçmek ve 8,5 ve 8,6 adımda bireysel protein-konsantrasyon/substrat-konsantrasyon çifti oranlarını adapte etmek için gerekli olabilir. İnsan FAHD1 için Michaelis-Menten diyagramı Şekil 5B'de sağlanmaktadır.
9. FAHD proteinlerinin kristalizasyonu
Not: FAHD proteinlerinin kristalizasyonu (daha önce15tarif EDILEN insan FAHD1), 24 iyi formatta asılı damla buharı difüzyon yöntemi ile elde edilebilir (Şekil 6a). Bu tekniği kullanarak insan FAHD1 kristalizasyonu hakkında adım adım bir protokol15aşağıda sunulmaktadır. Tartışma bölümünde daha ayrıntılı bir açıklama sağlanmıştır.

Şekil 6 : Fahd proteinlerinin kristalizasyonu.
(A) Standart 24 iyi veya 96 iyi SBS ayak izi kristalizasyon plakaları. Daha fazla ayrıntı için Bölüm 9 ' a bakın. (B) Fahd proteinleri kristalizasyonu temel plaka kurulum süreci. Bu rakam23izni ile yeniden çizilir. Daha fazla ayrıntı için Bölüm 9 ' a bakın. (C) Human FAHD1 kristalleri ve ilgili kırınım desenleri (küçük ekler). En yakın kafes aralığı, kristallerin kırınım kalitesi için bir ölçü olarak ekler içinde belirtilir. Daha düşük sayılar daha yüksek çözünürlüğü ve böylece daha bilgilendirici verileri gösterir. Daha fazla ayrıntı için protokol 9 bölümüne bakın. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
- Proteinin sec çalışan tampona karşı Medil olduğundan emin olun. FAHD1 protein yüksek konsantrasyonlarda mevcut olmalıdır (2 – 5 mg/mL). Düşük konsantrasyonlarda, protein spontan nükleme eksikliği nedeniyle kristalize olmayabilir.
- Kristalizasyon için rezervuar çözeltisi ≥ 20 mL hazırlayın. Damıtılmış veya deiyonize suyu solvent olarak kullanarak üç stok solüsyonu yapın: 1 M na-HEPES (minimum 25 mL, pH 7,5 'ye ayarlanmış), 50% (w/v) Polietilen glikol 4000 (PEG4k) (minimum 65 mL) ve 1 M MgCl2 (10 ml).
- Kurulum 4 x 6 (24 Toplam) farklı 15 mL tüpler bir ızgara. Onları plaka üzerindeki ilgili pozisyonlara göre etiketleyin (örn. satır (A, B, C, D), "a1", "B5", "D6" gibi sütun (1 – 6). Her tüpün içine 1 M na-HEPES 1 mL pipet.
- Pipet 1 mL 50% (w/v) PEG4k satır A tüpler, 2 mL satır B, 3 mL satır C, ve 4 mL satır D. pipet 100 μL 1 M MgCl2 ' ye 1 ' i tüpler, 250 μL sütun 2 içine 500, μL sütun 3, 1,0 mL sütun 4, 1,5 mL içine sütun 5 ve 2,0 mL sütun 6 içine =.
- Tüm tüpleri, tüplerin üzerindeki ölçeğin yeterince doğru olduğu damıtılmış veya deiyonize su ile 10 mL 'Lik bir hacme kadar doldurun.
- İnsan FAHD1 protein örneğini (~ 5 mg/mL) buzdolabından (veya buzdan) alın ve en az 10 dakika boyunca 4 °C ' de masa üstü Santrifüjü ile maksimum hızda aşağı doğru döndürün. Oksalat ile Co-kristalizasyon istenirse, protein örneği 2 mm son oksalat konsantrasyonu içeren böylece bir stok çözümden oksalat ekleyin. 1 mM DTT uygulayın ve buzda saklayın.
- Bu arada, 18 °C ' de sıcaklık kontrollü bir odanın içinde ideal bir şekilde 24 iyi kristalizasyon plakası açın. İnce bir cam veya plastik çubuk yardımıyla 24 iyi plaka her kuyunun üstüne jant üzerine parafin yağı ince bir tabaka dağıtın. Hazırlanan kristalizasyon kokteyllerinin (A1-D6) 800 μL değerini kristalizasyon plakasının her bir kuyunda ekleyin.
- Temiz bir yüzeye taze 22 mm kapak yerleştirin. Kapak fişlerin kir veya tozla kirletmesini önlemek. Gerekirse, sıkıştırılmış hava veya bir Duster sprey kullanarak kapak kayma herhangi bir enkaz çıkarın.
- Santrifüjleme tamamlandıktan sonra, böylece tüpün altındaki dökülmüş toplar ve enkaz tekrar yüzer değil, böylece protein örneği sallayarak kaçının. Aşağıdaki adımlarda, altından toplamları ve tortuları karıştırmamak için çözümün yüzeyinin hemen altında protein örneğinden pipet.
- Her bir kuyu için (bkz. Şekil 6B) 1 μL protein çözeltisi ile bir kapak kaymanın ortasına yerleştirin ve 1 μL ile ilgili rezervuar kokteylini protein damlacığına ekleyin, kabarcıklar kaçınarak. Lamel magazini baş aşağı çevirin ve böylece yağ mühürler iyi lamel magazini hava-Tight ile iyi üst üzerine yerleştirin. 24 kuyu plakası tamamlanana kadar tekrarlayın.
- Plaka 18 °C ' de saklayın ve uygun bir mikroskop ile ilerici bir programda damlaları gözlemlemek. Human FAHD1 kristalleri genellikle bir gecede görünür (bkz. Şekil 6C).
Sonuçlar
Hazırlanmış bir klonlama vektörü ile başlayarak ve satın alınan BL21 (DE3) Plyss E. coli, plazmid Isı-şok veya herhangi bir uygun alternatif yöntem ile bakterilere yerleştirilir (Şekil 1). Amplifikasyon kısa bir süre sonra, dönüştürülmüş bakteri LB agar plakaları üzerinde kaplama, amacıyla bir gecede büyümek için. Bu noktada plakalar çeşitli olası hata kaynaklarına bağlı olarak farklı görünebilir. Plakaları boş olabilir (yani, koloni yok), tamamen bakteriler tarafından büyümüş, ya da arasında bir şey, sırasıyla. En uygun ve optimum olmayan dönüşümden sonra LB agar plakalarının iki örneği şekil 7a'da tasvir edilir. Çok fazla bakteriyel koloniler ya çok fazla bakteri kaplama olduğunu gösterir (muhtemelen) veya kullanımda antibiyotikler süresi dolmuş olabilir (olası). Çok az bakteriyel koloniler ya da yeterli plazmid dönüşüm için kullanılan olduğunu gösterebilir (daha sonraki kez kullanın) ya da çok fazla antibiyotik bakteri seçmek için kullanıldı. Her durumda, koloniler varsa, onlar iyi olmalıdır, iki seçici antibiyotikler kullanarak olarak dönüşmemiş bakteri büyümeye oldukça önemsiz bir şans anlamına gelir. Hiçbir koloniler, ancak, ya bakterilerin dönüşüm yetkinliğini kaybetti gösterir (çünkü uzun dönemlerde yanlış depolama veya depolama, tekrarlayan dondurma ve çözülme, vb), Isı-şok başarılı değildi (hiçbir Plasmid alımı veya bakteriyel çok fazla ısı tarafından ölüm), klonlama vektör bozulmuş, ya da yanlışlıkla seçici antibiyotik yanlış bir dizi kullanıldı (Plasmid vektöründe direnç geni doğrulayın).
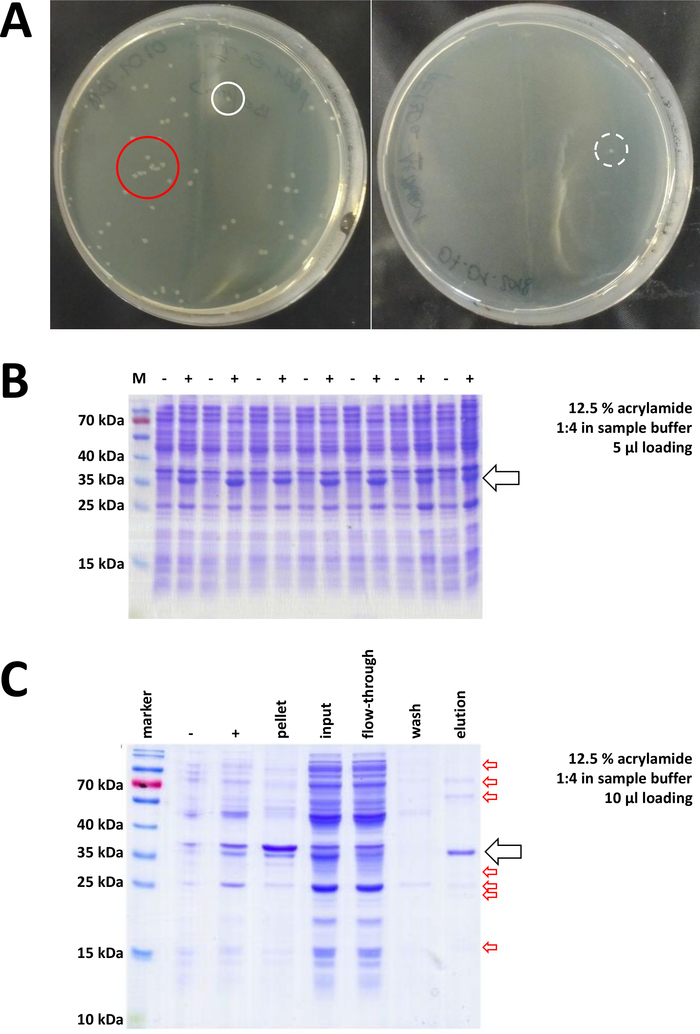
Şekil 7 : Bakteri dönüşümü ve IMAC Için temsilci sonuçları.
(A) temsilci lb agar plakaları Ile dönüştürülmüş bl21 (de3) E. coli, aşağıdaki protokol adım 1,1 tarafından elde edilir. Sol: iyi dağıtılmış koloniler içeren bir plaka (pozitif örnek). Sağ: tek bir koloniye sahip bir plaka (negatif örnek). Beyaz çemberler iyi kolonileri işaretler. Kırmızı daire birbirlerine çok yakın büyüyen ve izole koloniler mevcut olduğu sürece çekilmemelidir koloniler işaretler. (B) bir seri indüksiyon kontrollerinin a 12,5% AKRILAMID sds-page Analizi ("-" IPTG indüksiyon önce gösterir; "+" iptg indüksiyon sonra gösterir, Pelet hasat önce), toplam protein eşit miktarlarda ayarlandı. Bu, 1,2 adımda açıklanmıştır. (C) bir örnek 12,5% AKRILAMID SDS-sayfa analizi nı-NTA arıtma onun-etiketli FAHD1 protein. Bu, protokol 3 bölümünde açıklanmıştır. Benzeşme Kromatografi yüksek saflıkta protein verir (> 70%, siyah ok), ancak, birkaç küçük kontaminasyon da görülür (kırmızı oklar). Bu kontaminasyonlar, kolona bağlanan FAHD olmayan proteinlerden ve FAHD proteine bağlanan proteinlerden oluşur. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Doğrulanmış koloniler seçilir ve seçildi. Besleyici ortamda amplifikasyon sonra, protein ifadesi kimyasal IPTG uygulaması ile tetiklenir. Miligram miktarlarda ifade edilen proteini içeren bakteriyel Pelet hasat edilir ve ifade SDS-PAGE (örneğin şekil 7b) ile doğrulanmıştır. Bu başka basit bir işlem sırasında bazı sorunlar ortaya çıkabilir. Onlar görünüşte bir şekilde ev sahibi bakterilerin doğal metabolizmasını müdahale çünkü ilk olarak, bazı proteinler, dahil organları oluşturur. Bu insan FAHD1 ve FAHD2 bazı nokta mutasyonlar için gözlenmiştir. Bu gibi durumlarda, böcek hücreleri gibi diğer ifade sistemleri daha uygun olabilir ve dikkate alınmalıdır. Örneğin, böcek hücrelerinden bir Pelet hasat ettikten sonra, proteinleri arıtma Bu protokolde açıklandığı gibi aynı adımları izler. İkinci olarak, DE3-pET sistemi bazen "sızdıran" olarak bulundu (yani, protein zaten IPTG indüksiyon önce bir ölçüde ifade edilir). Bunun olası nedeni iyi anlaşılır değildir, ama soğuk bir oda kuluçta bir gecede protein yavaşça ifade etmek için yardımcı olabilir. Üçüncü olarak, hiçbir protein ifade edilmez. Büyük olasılıkla bozuk bir Plasmid vektörü gösterir ve böylece Plasmid sırası için tavsiye muhtemelen en kötü durumda senaryodur.
Proteini etiketlemek için bir onunetiketi kullanılırsa, ni-NTA agaroz ile benzeşme kromatografi, kontaminasyonların çoğunu ortadan kaldıran kolay ve ucuz bir yakalama yöntemidir (Şekil 7c). Diğer etiket sistemleri (örn., strep-II) için benzer yöntemler mevcut. Herhangi bir etiket kullanılmıyordu, amonyum sülfat yağış ve ardışık hidrofobik değişim Kromatografi kombinasyonu da diğer proteinlerin çoğunluğu protein ayırabilir (Şekil 8A). Ancak, iki yöntemi karşılaştırarak (Şekil 7C vs. Şekil 8A), ni-NTA YÖNTEMLERININ üstünlüğü sds-page analizi ile gösterilebilir. Onunetiketli proteini kullanarak bu nedenle tavsiye edilir.
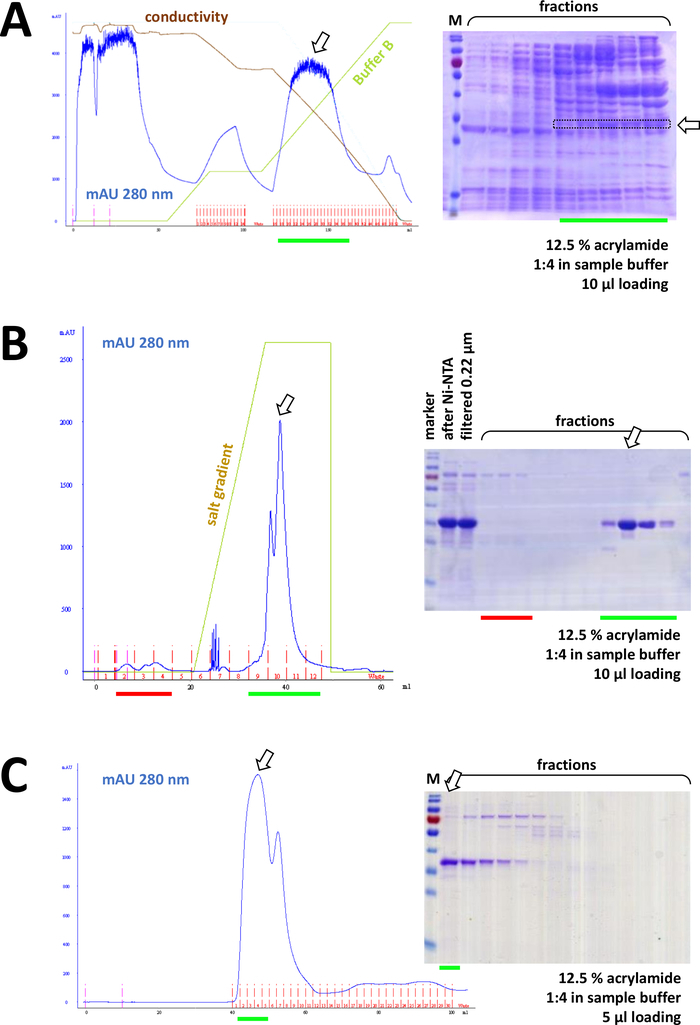
Şekil 8 : FPLC deneylerinin temsili sonuçları (HIS, Iyon değişimi, sn).
(A) tipik bir kromatogram ve 12,5% AKRILAMID SDS-sayfa, amonyum sülfat (as), ETIKETLENMEMIŞ FAHD1 protein yağışının ardından, protokolün 4. Yeşil çizgi, AS içermeyen arabellek B degradenin yansıtır. Süreç sırasında AS aşamalı olarak sistemden yıkanır. Bu panelin Şekil 7C 'ye karşılaştırılması, nı-NTA benzeşimi kromatografinin gücünü yok-fenil yöntemine göre ve protein arıtma Için bir onunetiket sistemini kullanmanın avantajını görüntüler. (B) s -NTA arıtma SONRASıNDA etiketli Fahd 'ın katyonik değişim kromatografisinin örnek bir kromatogram ve 12,5% AKRILAMID sds-page analizi. Tuz degradesini kullanarak, uygulanan numune bireysel proteinlere ayrılır. (C) cationik değişim Kromatografi aşağıdaki G75 boyutu dışlama Kromatografi bir örnek kromatogram ve 12,5% AKRILAMID sds-page analizi. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Ardışık olarak, proteinli kalan kontaminasyonlarla (örneğin, bkz. Şekil 8B), akımlı/aniyon değişimi kromatografi ile daha da ayrılır (örneğin, bkz. Şekil 8C). Bu sırada bir ilk arıtma stratejisi kurmak için tavsiye edilir; Ancak bu sütunlar, protein yeterince saf olana kadar, daha sonra ve varyasyonda kombinasyon halinde kullanılmalıdır.
Basit aktivite, etkin substratlar ve/veya cofactors üzerinde "Evet ya da hayır" kararları için test etmek için, ni-NTA arıtma sonra onunetiketli proteinler ile yapılabilir, ya da iyonik değişim sütun sonra etiketleri etiketlenmemiş. Özel faaliyetler ve kinetik sabitler en yüksek saflıkta protein ile belirlenmelidir. İyonik değişim sütunundan sonra kristalizasyon proteinlerle denenebilir, ancak kristallerin kalitesi neredeyse her zaman protein saflığıyla ilişkilidir. Polikklonal antikorlar arıtma protokolünün herhangi bir aşamasında proteinlere karşı yükseltilebilir; Ancak, burada kalite de protein saflık ile ilişkilidir.
Tartışmalar
Kritik adımlar
FAHD proteinleri tuz konsantrasyonlarına karşı çok duyarlıdır. Düşük NaCl konsantrasyonlarda, proteinler çözülme üzerine çökelebilir, ancak genellikle daha yüksek tuz konsantrasyonlarında tamamen reconstituted olabilir. Yani, Eğer bir FAHD proteini herhangi bir nedenden dolayı çökelse, daha yüksek tuz konsantrasyonları (> 300 μM) ile kurtarılabilir veya yeniden katlanabilir. Bazı daha hidrofobik proteinler, ancak, (örneğin, insan FAHD2) kurtarılamaz olabilir, ama CHAPS gibi deterjanlar (maksimum 1%) veya gliserol (% 10) istikrarlı bir çözüm içinde tutmak için kullanılabilir. Her durumda, hafif ve yavaş bir çözme işlemi olduğu için,-80 °C ' de sıvı nitrojen ve depolama kullanarak şok donma önerilir.
Adım 3.1.10 ni-NTA arıtma sırasında bazı beklenmeyen sorunlar ortaya çıkabilir. Not, ikinci toplanan örnekteki ilk örnekteki daha yüksek bir od, agaroz reçine çok yüksek bir hacim gösterir (bir not alın ve bir sonraki denemede daha az reçine kullanın). Ayrıca, agaroz reçine kendisi 280 nm bir od sinyal yol açar (yani, agaroz reçine yatak bozulma yapay sinyaller verecektir). Şüphe durumunda, protein konsantrasyonlarını belirlemek için bir Bradford veya BSA tahlil gibi diğer yöntemleri kullanmak için tavsiye edilir.
Enzimatik konularda, dikkate alınmalıdır üç kritik yönleri vardır. İlk olarak, protein konsantrasyonunun değerlendirilmesi doğru belirli faaliyetleri elde etmek için önemlidir. Protein saflık düzeyi sonucu etkileyen ve tahmin edilmesi gerekir. Etiketli protein durumunda, etiket parçasının kütlesi hesaplanmalıdır ve belirli aktivite buna karşılık olarak düzeltilmelidir. Protokol Bölüm 7 ' de açıklanan basit bir şekilde, ni-NTA saflık aktif ve etkin olmayan substratlar arasında ayırt etmek için yeterlidir, cofactors, vb. Daha karmaşık Michaelis-Menten kinetiği durumunda, tüm reaktanı ve substrat konsantrasyonları doğru şekilde belirlenmelidir. Özellikle oxaloasetat kullanırken (zaman içinde otomatik decarboxylates) reaksiyonunun enzimatik kısmı otomatik dearboksilasyon için düzeltilmelidir (her iki reaksiyonda aynı anda meydana gelen varsayım altında). Substrat Keto-Enol tautomerization ele optik yoğunluk sinyalinde ilk değişiklikler dikkate alınmalıdır. Üçüncü olarak, konsantrasyonlar ve birimler ayarlanması gerekir. Tanımlanan enzim ve substrat konsantrasyonlarına karşı bir reaksiyon, test hacmine bağlı olarak farklı sonuçlar verebilir. Eğer iyi başına çok fazla enzim varsa, sıvı yapışma aslında önyargı sonucu olabilir.
Michaelis-Menten kinetiği değerlendirmesi için en uygun kombinasyonu bulmak için 100 μL, 200 μL ve 300 μL toplu işlemlerde ilk deneylerin yapılması önerilir. Benzer yönleri kinetik asder için enzim-substrat konsantrasyonları oranı için geçerlidir. Substrat başına çok fazla enzim veya enzim başına çok fazla substrat, sistemi doğrusal sabit devlet Michaelis aralığının dışına koydu. Bu koşullar en iyi duruma getirmek için ilk denemeler gereklidir. İnsan FAHD1 (Wild-tip) proteini için örnek ayar, Bölüm 8 ' de sağlanır ve kinetik diyagramlar (örneğin Şekil 5B'de sunulmuştur) ile sonuçlanır.
Kristalizasyon için bir damlacık protein çözeltisi bir lamel magazini merkezinde pipetli ve genellikle bir tampon (örn., Tris-HCL, HEPES) ve bir çökeltme (örneğin, Polietilen glikol, amonyum oluşur kristalizasyon kokteyl bir damlacık ile karışık sülfat). (Bu protokolde oksalat gibi) ortak kristalizasyon için inhibitör çözeltisi bir damlacık isteğe bağlı olarak uygulanabilir. Lamel magazini daha sonra kristalizasyon kokteyli içeren bir rezervuar kuyuyu üzerinde ters yerleştirilir, sızdırmazlık yağı yardımıyla iyi havayı mühürleme (Şekil 6B). İdeal olarak, herhangi bir yağış, protein solüsyonu kalır anlamı deneme başlangıcında damla içinde oluşur. Rezervuar içinde çökelen konsantrasyon damla daha yüksek olduğundan, düşüş rezervuar ile denge kadar kuyu atmosferine buharlaşma ile su kaybetmeye başlar ulaştı. Rezervuar içine su difüzyon sırayla her ikisi de bir artış neden düşüş yavaş bir hacim azalması neden, damla protein ve çökelme konsantrasyonu. Protein çözeltisi gerekli süper doygunluk durumuna ulaştığında ve böylece meta-stabilite, spontan nükleme kristal büyüme ortaya çıkabilir. Süper doymuş duruma ulaşmak kristalizasyon için gerekli ama yeterli değildir. Proteinleri kristalizasyon hem de ihtiyaç, uygun termodinamik ve kinetik koşullar, ve ağır kristalize olmak protein öngörülemeyen özelliklerine bağlıdır22.
Değişiklikler ve sorun giderme
E. coli 'de protein ifadesi verimsiz olabilir. Çeşitli ıPTG konsantrasyonları, ifade sıcaklığı ve amplifikasyon süresi, örneğin Oda sıcaklığı birkaç saat veya soğuk odada bir gecede, optimum koşulları bulmak için her yeni protein için test edilmesi gerekebilir. Dahil organları protein yağış bazen daha fazla hidrofobik FAHD proteinleri için gözlenmektedir. Bu gibi durumlarda, böcek hücreleri gibi diğer model sistemlerinde protein ifadesi, dahil organları26formu daha az olasıdır gibi tavsiye edilir.
Fahd proteinlerinin tuz ve kofaktör konsantrasyonlarına duyarlı olduğu ve pH 'nin yanı sıra farklı homologlar, ortolog ve nokta mutasyon türevleri için arıtma stratejileri bireysel ayarlarında farklılık gösterebilir. Tanımlanan arıtma yöntemleri vahşi tip insan ve fare FAHD1 protein için geliştirilmiştir. NaCl ve imidazol gibi kimyasalların konsantrasyonlarının yanı sıra pH, farklı bir izoelektrik noktası (pI) ile bireysel proteinler için adapte edilmelidir. Ayrıca Not, her onunetiketli protein bir nı-NTA reçine iyi bağlamak olabilir. Ni-NTA sütununa protein bağlayıcılığı verimsiz ise, NaCl ve imidazol konsantrasyonları adapte, yanı sıra ni-NTA çalışan tampon içinde değişen pH koşulları sonucu kalitesini artırmak için yardımcı olabilir. Değilse, ni-NTA adımını atlamak ve iyonik değişim Kromatografi adımına devam etmek de başarılı bir arıtma stratejisine yol açabilir. Bir protein ni-NTA sütununa bağlanır ancak sütundan elüe edilemez, bazı mm EDTA eklenmesi ni2 + kompleksi bozmasına yardımcı olabilir.
Kristalizasyon süreci ile ilgili olarak, büyük ve Kompleks protein moleküllerinin düzenli periyodik kafes içine kendi kendini örgütlenme oldukça zor kinetik parametreleri kontrol etmek için bağlıdır doğal olarak olası bir süreçtir anlaşılması gerekir. Kristalizasyon için kullanılan ayarda küçük değişiklikler bile önemli ölçüde sonucu değiştirebilir ve hiçbir kristaller oluşturacaktır. Protein saflık genellikle önemli öneme sahiptir. Başparmak bir kural olarak, ağır aşırı yüklenmiş SDS-PAGE jel diğer bantları göstermemelidir. Ayrıca, adımların gerçekleştirildiği sıra sonucu etkileyebilir. Örnek olarak, yeniden Üretilebilirlik sağlamak için, genellikle pipetleme sırasını aynı tutmak için gereklidir, sonra ilk protein ekleyin ve nihayet kristalizasyon damlacık (veya tersi) için çökelme ekleyin. Hangi yöntemi kullandıysanız, yeniden oluşturmaya veya ölçeklendirmeye çalışırken aynı tutulması gereken deneyler. Bu protokol sonrasında hiçbir kristaller gözlemlenirse, kimyasal çökelme bileşimi, pH, damla boyutu ve protein-çöktürme oranı küçük artışlarla değişebilir. Sabır ve damla tutarlı gözlemler erdem vardır.
FAHD1 katalitik mekanizmalara açıklamalar
Sunulan yöntemler, yüksek kalitede FAHD1 proteinleri elde etmek için özel olarak geliştirilmiştir. Bu FAHD1 kristallerin yanı sıra, bir inhibitör (oxalate, pdb: 6fog) FAHD1 boronetanolamin içeren kristallerin mühendislik büyüme etkin. X-ışını yapıları enzim katalitik boşluğu 3D mimarisi sağlar. Bu sonuçlar, bu ilginç enzimin katalitik mekanizmaları için potansiyel olarak önemli olan kalıntılar için kapsamlı bir açıklama kurar. FAHD1 ilk olarak acylpyruvates (asetilpyruvat, fumarylpyruvate)11Cleave edebilmek için tanımlanmıştır. Daha sonra, FAHD1 oxaloacetate12dearboksilaz olarak da çalışır bulundu. Substratlar acylpyruvate ve oxaloasetat farklı kimyasal moisanlı olmasına rağmen, kimyasal dönüşümler mekanik ortak bir tek c3-c4 Bond stratejik bölünme paylaşmak, enerji kolaylaştırılmış c3 -C4 Bond orbitaller c2-Carbonyl15π-orbitaller ortogonal kalmak. Bu tür bir konformasyon, C3-karbanyonunun rezonans stabilizasyonu ile bölünmesi sırasında oluşur. FAHD1 substratlar (oxaloasetat ve acylpyruvates) esnek moleküllerdir ve tautomerik (Keto-Enol) yanı sıra C2-hidrat formları (Şekil 9a) bulunabilir. Farklı türler arasındaki denge, esas olarak kullanılan tampon bileşiminin doğası, pH ve metal iyonlarının varlığı ile belirlenir. Aşağıda, FAHD1 katalitik merkezini ifşa eden X-ışını kristal yapıların analizinden esinlenilen hipotetik mekanik senaryolar tartışılacaktır.
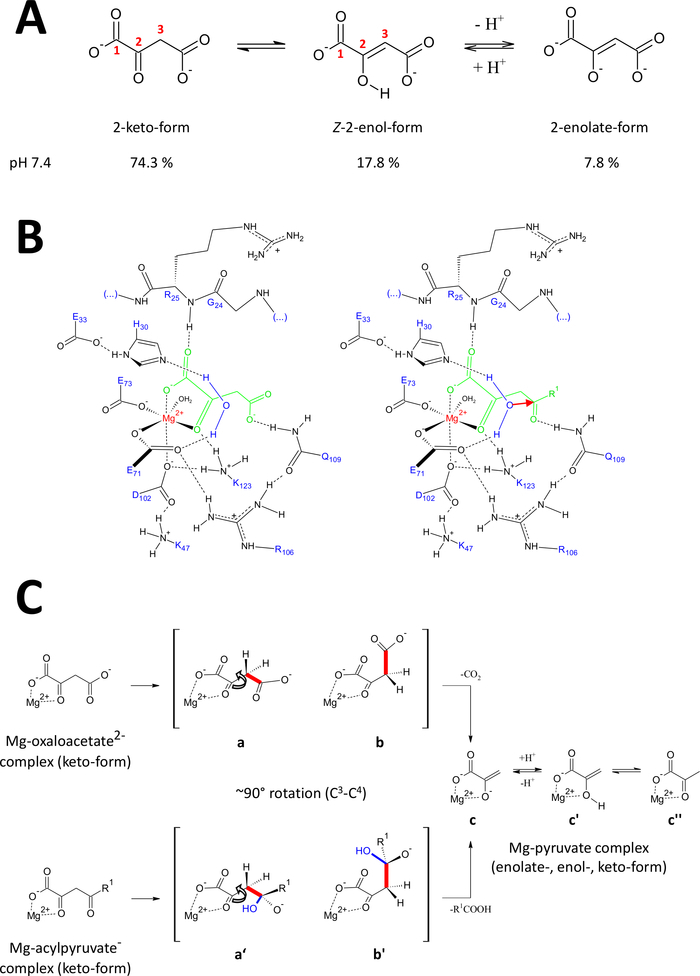
Şekil 9 : Insan FAHD1 önerilen katalitik mekanizmayla Ilgili detaylar.
(A) oxaloasetat özellikle Z-enol formunda24kristalin durumda yanı sıra nötr çözüm bulunmaktadır. Ancak, fizyolojik pH koşullarında 2-keto formu baskın temsil25. (B) hFAHD1 boşluğu15 ' in mg-Bound oxaloasetat (sol) ve acylpyruvate (sağ, organik dinlenme olarak R1 ile) kimyasal çizimi; kırmızı ok, bitişik stabilize su molekülünün bir çekirdekte saldırısını gösterir) (tartışma konusuna bakın). (C) c3-c4 bölünme in dekarboksilaz (b-c) ve hidrolaz (b ' to c) mekanizması FAHD1 için tercih edilen konformasyonların karşılaştırılması: her iki proses de mg-complexed pyruvate-enolate (tartışma konusuna bakın) ile sonuçlanır. Ara b ve b ' Q109 tarafından stabilize edilmesi bekleniyor, panel B çizilmiş olarak (tartışma bakın). Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
FAHD1 Decarboxylase aktivitesi
Oxaloasetat kristalin durumda yanı sıra Z-enol formu24ağırlıklı nötr çözüm bulunmaktadır. Ancak, fizyolojik pH-koşulları altında (pH 7,4 tampon koşulları) 2-keto formu oxaloacetate25 (Şekil 9a) baskın temsili olduğunu ve bu enolization dekarboksilasyon için bir önkoşul değildir gösterildi27 . Not, mg2 + Iyonlarının pH 7,4 veya28altında oxaloasetat türlerinin oranı üzerinde hiçbir etkisi yoktur. Oxaloacetate keto formunun katalitik merkezi haline aktarılması (boronetanolamin enzim (pdb: 6fog15) içinde bağlı okalat tarafından yönlendirilir), bağlı oxaloacetate15' in Konformasyonel regülatörü olarak kalıntı Q109 saptandı. Başka bir makalede açıklandığı gibi15, Q109 karbamil grubuna hidrojen yapıştırma c2-c3 Bond (Şekil 9B, sol panel) etrafında rotasyon kaynaklanan bir oxaloasetat-conformation stabilize. Bu rotasyonun bir sonucu olarak, C3-c4 Bond (cleaved olmak) c2-Carbonyl (Şekil 9C) π-Orbitals göreceli bir ortogonal eğilim yakın benimser. Karbondioksit salınabilir. Bu sürecin primer ürünü rezonans, pyruvat mg-enolat stabilize olacaktır. Oxaloasetat-mg kompleksler araştırmalarından bilinmektedir, enolat en istikrarlı kompleksi oluşturur28,29. FAHD1 bir mg-pyruvate enolate-kompleks kofaktör için karşılaştırılabilir bir kararlılık varsayarak bloke olabilir, ama lizin kalıntı K123 kofaktör kaybını yasaklamak için bir denge içinde pyruvate-enolate protonate olabilir15.
Verilen yorumlama FAHD1 katalitik ODX fonksiyonunda ayrı bir ara olarak piruvat enol önerir. Hipotez modelinde bu adımda, deneysel veriler kapalı kapağın ürünü serbest bırakmak için neden açık olması gerektiği konusunda başka bir belirti sağlamaz. Ancak, önerilen mekanizma ürün tarafından bir enzim inhibisyonu gibi görünüyor: kristal yapısı, FAHD1 katalizör merkezine doğru yönlü oryantasyonda tutulan bir tutulmuş su molekülü ortaya H30 ve E33 bir ligand bağlayıcı ve kapak kapatılması üzerine indüklenen kısa Helix15. Primer enol, enolat ile bir denge içinde kalacaktı, rezonans stabilize enolat su molekül tarafından piruvat için söndürülü olabilir. Ortaya çıkan hidroksil, kapağın açılacağı mg-cofactor ' d a körü kesmeye yetenekli olacaktır. Son olarak, katalitik merkezi mitokondriyal ortamda restore edilecektir. Bu hipotetik senaryoda, kavite su molekülü sırasıyla bir asit olarak çalışacak.
FAHD1 hydrolase aktivitesi
Bir enzimin hydrolase aktivitesi dolaylı olarak bir hidroksil nükofil ara oluşumunu gerektirir. Bu mekanizma genellikle asit-baz katalitik aktivite ile birlikte bulunur. Reaksiyonda geçiş durumu, boşlukta kritik amino asit yan zincirler tarafından Konformasyonel kontrolü ile hazırlanmalıdır. Dearboksilaz fonksiyonunun tartışılmasında, 2-keto formunda enzime bağlı acylpyruvat, 4-karbonil oksijenin Q109 (Şekil 9B, sağ panel) ' e hidrojen-yapışma ile uyumlu kontrol altına konulacaktır. Oxalate-Bound FAHD1 kristal yapısı (PDB: 6FOG), H30 ve E33 kısa bir Helix15' te sunulan KALıNTıLARıN FAHD1 katalitik merkezine doğru yönlü oryantasyonda tutulan bir su molekülü ortaya çıkarır. E33-H30 DYAD, yönlü konumlandırılmış suyu deprotonate etmek için yetkin ve elde edilen hidroksil, Q10915ile Konformasyonel kontrol altında sunulan acylpyruvate 4-karbonil saldırmak için ideal bir eğilimi olduğunu.
Dikkat, FAH18için benzer bir mekanizma önerilmiştir. Hidroksil nükleofil tarafından saldırı bir oxyanion türü sonucu bekleniyor, bu orbital kontrollü C3-c4 Bond bölünme üzerine stabilize (Şekil 9C). Bu modelde, C3-c4 Bond rotasyonu (Şekil 9C), Şekil 9B 'de belirtilen kurulan hidroksil tarafından yapılan nükleil saldırısından sonra gerçekleşir (yani, bu, Bond yarık için acylpyruvate hazırlar). Primer ürünler asetik asit ve mg-pyruvate enolat olacaktır. Bu hipotez senaryoda, asetik asit piruvat için enol gidermek ve daha sonra ürünün deplasmanında yardımcı olabilir. 7,5 ve mg iyonlarının varlığında bir pH üzerinde, acylpyruvates keto-ve enol-formları arasında bir denge var, hafif tercihte ikincisi30. Çoğu muhtemelen her iki form sonraki kapak kapatılması altında FAHD1 kofaktör bağlamak için yeteneğine sahiptir. Enolik acylpyruvate substratın enzimin tarafından işlenmesi, inol formunun düz yapısına bağlı olarak engellenir. C3-c4 bölünme rezonans stabilizasyonu olmadan bir vinil karbanyon neden olur.
Bu nedenle, asil karbonil üzerinde hidroksil nükeofil saldırılarına hazırlanmak için Katalitik ketonizasyon adımını öneriyoruz. Bu ketonization süreci, ancak, FAHD1 kalıntıları tarafından proton transpoziteleri üzerinde kontrol gerektirir, hangi FAHD1 için bir doğal izomeraz aktivite özniteliği olacaktır. Bu mg-Bound enol hidrojen asitliği un-kompleks formu28ile karşılaştırıldığında 10000 kat artış ortaya bildirilmektedir. Mg bağlı enol-form bir deprotonasyon un-protonated K123 tarafından uygulanabilir olacaktır. K123 deprotonasyon D102 karboksgeç tarafından yardımcı olabilir. D102-K47-K123 kalıntıları tarafından oluşturulan bir hidrojen Bond ağı, FAHD115katalitik merkezinde gerekli proton rölesi olarak çalışabilir. Böyle biçimlendirilmiş bir ara enolat daha sonra E33-H30-H20 Triad tarafından alt substrat ketonization altında tarafından söndürül olabilir15. 2-keto formu Q109 ve Konformasyonel kontrolü altında gelecek, ve birlikte kurulan hidroksil asil karbonil saldıracak. Özetlenen tartışma, kavite oluşturan kalıntıları etkileşim yoluyla asit ve baz arasında geçiş için bir su molekülü hakkında FAHD1 bir denetim anlamına gelir.
Gelecekteki uygulamalar veya yöntemin Yön
Burada açıklanan yöntemlerin gelecekteki uygulamaları sayısız. FAH süper ailesinin prokaryotik üyelerinin bir bolluk hala fonksiyonel karakterizasyonu bekliyor. Hatta bilinen FAH süper aile üyelerinin katalizör faaliyetleri hakkında mevcut bilgiler az ve çoğu durumda, deneysel veri yerine teorik varsayımlar dayanmaktadır. Prokaryotik FAH süper aile üyeleri için burada açıklanan yöntemlerin uygulanması, bakteriyolojideki özel araştırma menfaatlerine bağlıdır. Öte yandan, son gösteri, ökaryotik Fah süper aile üyelerinin çeşitli hücresel bölmeler (örn., sitosol vs mitokondri) önemli roller oynarlar bu proteinleri daha iyi karakterize etme ihtiyacını vurgular (üç kişi Şimdiye kadar tanımlanan), özellikle çünkü mevcut veriler bazı karakterize proteinlerin mitokondriyal biyoloji, yaşlanma araştırması ve kanser araştırması bağlamında farklı fonksiyonlar gerçekleştirebilir olduğunu düşündürmektedir. Bu ökaryotik FAH süper aile üyelerinin tam moleküler ve fizyolojik karakterizasyonu Biyomedikal sektörde çağdaş araştırma önemli alanlar önemli anlayış sağlayabilir önerilmiştir. FAHD1 mekanizmaları hakkında daha fazla araştırma (ve ilgili enzimler) daha iyi hala tam olarak açıklığa kavuşturulmaz FAHD1, iki işlevselliği temel mekanizmaları anlamak için gereklidir. FAHD1 mutantlar, NMR-soruşturma ve inhibitör kompleksleri üzerinde yapısal çalışmalar ile ek çalışmalar FAHD1 yetkili gibi görünüyor gerçek mekanik senaryolar çözmek yardımcı olabilir. Ayrıca, mg-cofactor bağlamak için yetenekli enol taklit bilgisayar destekli tasarım sonunda FAHD1 güçlü inhibitörleri yol açacaktır.
Açıklamalar
Yazarların hiçbir rakip mali çıkarları ifşa ve beyan hiçbir şey yok. H. G. CEOCSO 'da Molekülecrafting. HuGs AB ve özel sentezi ile bu çalışma için acylpyruvates sağladı. P. J. D. ' nin laboratuarında çalışmak Avusturya Bilim Fonu (FWF) tarafından destekleniyordu: proje numarası P 31582-B26. Bu makale için yayın ücretleri kısmen Avusturya Bilim Fonu (FWF) tarafından P 31582-B26 proje numarası kapsamında ele alınmıştır. A. N. ve B. R. proje P28395-B26 kapsamında Avusturya Bilim Fonu (FWF) tarafından desteklenmektedir.
Teşekkürler
Yazarlar Annabella Pittl ve Haymo Pircher tarafından pilot Yöntem geliştirme tarafından uzman teknik yardım için çok müteşekkir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BL21(DE3) pLysS competent E. coli | Promega | L1195 | High-efficiency protein expression from gene with T7 promoter and ribosome binding site |
| pET E. coli T7 Expression Vectors | MERCK | - | http://www.merckmillipore.com/AT/de/life-science-research/genomic-analysis/dna-preparation-cloning/pet-expression-vectors/qFSb.qB.mLQAAAFA6.VkiQ0G,nav |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| 15 mL Falcon | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon | VWR | 734-0448 | centrifugal tubes |
| PS Cuvettes Spectrophotometer Semi-Micro | VWR | 30622-758 | VIS transparent cuvettes |
| UV Cuvettes Spectrophotometer Semi-Micro | VWR | 47727-024 | UV/VIS transparent cuvettes |
| isopropyl-β-D-thiogalactopyranosid (IPTG) | ROTH | 2316 | chemical used for induction of protein expression with the DE3/pET system |
| imidazole | ROTH | X998 | chemical used for elution of polyhistidine (6xHis) sequences from a nickel-charged affinity resin |
| Glass Econo-Column Columns | Bio-Rad | - | http://www.bio-rad.com/de-at/product/glass-econo-column-columns?ID=2cfb1c6e-32e8-4c72-b532-dd39013d707d&pcp_loc=catprod |
| chloramphenicol | Sigma-Aldrich | C0378 | antibiotic for bacterial growth selection; resistance endióded in pLysS plasmid of BL21(DE3) E. coli; 25 µg/mL final concentration |
| kanamycin | Sigma-Aldrich | 60615 | antibiotic for bacterial growth selection; to be used if this resistance is encoded in the employed pET vector; 50 µg/mL final concentration |
| ampicillin | Sigma-Aldrich | A1593 | antibiotic for bacterial growth selection; to be used if this resistance is encoded in the employed pET vector; 100 µg/mL final concentration |
| Ultra-15, MWCO 10 kDa | Sigma-Aldrich | Z706345 | centrifigal filters for protein enrichment; https://www.sigmaaldrich.com/catalog/product/sigma/z706345?lang=de®ion=AT |
| Ultra-0.5 Centrifugal Filter Units | Sigma-Aldrich | Z677108 | centrifigal filters for protein enrichment; https://www.sigmaaldrich.com/catalog/product/ALDRICH/Z677108?lang=de®ion=AT&cm_sp=Insite-_-prodRecCold_xviews-_-prodRecCold5-2 |
| oxaloacetic acid | Sigma-Aldrich | O4126 | TCA metabolite |
| sodium oxlalate | Sigma-Aldrich | 71800 | a competitive inhibitor of FAH superfamily enzymes |
| Dialysis tubing cellulose membrane | Sigma-Aldrich | D9277 | https://www.sigmaaldrich.com/catalog/product/sigma/d9277; or comparable |
| Ni-NTA agarose | Thermo-Fischer | R90101 | a nickel-charged affinity resin that can be used to purify recombinant proteins containing a polyhistidine (6xHis) sequence |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | https://www.thermofisher.com/order/catalog/product/26616?SID=srch-hj-26616 |
| ÄKTA FPLC system | GE Healthcare Life Sciences | - | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| HiTrap Phenyl HP column | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/it/shop/chromatography/prepacked-columns/hydrophobic-interaction/hitrap-phenyl-hp-p-05630 |
| Mono S 10/100 GL | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/ion-exchange/mono-s-cation-exchange-chromatography-column-p-00723 |
| Mono Q 10/100 GL | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/ion-exchange/mono-q-anion-exchange-chromatography-column-p-00608 |
| HiLoad Superdex column 75 pg (G75) | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/size-exclusion/hiload-superdex-75-pg-preparative-size-exclusion-chromatography-columns-p-05800 |
| HiLoad Superdex column 200 pg (G200) | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/size-exclusion/hiload-superdex-200-pg-preparative-size-exclusion-chromatography-columns-p-06283 |
| TECAN microplate reader | TECAN Life Sciences | - | https://lifesciences.tecan.com/microplate-readers |
| acetylpyruvate | MoleculeCrafting.HuGs e.U. | - | custom synthesis |
| benzoylpyruvate | MoleculeCrafting.HuGs e.U. | - | custom synthesis |
| VDX™ plate (24 wells) | Hampton | HR3-142 | 24 well plates used for crystallization via Hanging Drop Vapor Diffusion |
| paraffin oil | Hampton | HR3-411 | used for crystallization via Hanging Drop Vapor Diffusion |
| coverslips (22 mm) | Karl Hecht KG | 14043 | coverslips used for crystallization via Hanging Drop Vapor Diffusion |
| Luria broth (LB) medium | self-prepared | - | a general growth medium for E. coli: 5 g/L yeast extract; 10 g/L peptone from casein; 10 g/L sodium chloride; 12 g/L agar-agar |
| NZCYM medium | self-prepared | - | a better growth medium for E. coli, used for amplification: 10 g/L NZ amine; 5 g/L NaCl; 5 g/L yeast extract; 1 g/L casamino acids; 2 g/L MgSO4; adjust pH to 7.4 |
| Luria broth (LB) agarose plates | self-prepared | - | autoclaved agarose plates containing LB-medium and antibiotics for bacterial groth selection; https://www.addgene.org/protocols/pouring-lb-agar-plates/ |
| Ni-NTA running buffer | self-prepared | - | 20 mM Tris-HCl pH 7,4; 50-300 mM NaCl; 10-200 mM imidazole; ranges: optimal value varies among FAHD proteins |
| Ni-NTA elution buffer | self-prepared | - | 20 mM Tris-HCl pH 7,4; 50-300 mM NaCl; 200-500 mM imidazole; ranges: optimal value varies among FAHD proteins |
| HIC running buffer | self-prepared | - | 44 mM NaH2PO4; 6 mM Na2HPO4; 100 mM NaCl; 20 mM DTT; adjust to pH 7 |
| HIC running buffer AS | self-prepared | - | HIC running buffer saturated with ammonium sulfate (AS); adjust to pH 7: 70 g ammonium sulfate + 90 mL buffer, stirred overnight in the cold room; adjust to pH 7.0 |
| Mono S low salt buffer | self-prepared | - | 44 mM NaH2PO4; 6 mM Na2HPO4; 10-300 mM NaCl; ranges: optimal value varies among FAHD proteins |
| Mono S high salt buffer | self-prepared | - | 44 mM NaH2PO4; 6 mM Na2HPO4; 1-2 M NaCl; ranges: optimal value varies among FAHD proteins |
| Mono Q low salt buffer | self-prepared | - | 20 mM Tris-HCl; 15 mM NaCl; adjust to pH 8.0 |
| Mono Q high salt buffer | self-prepared | - | 20 mM Tris-HCl; 1 M NaCl; 10 % glycerol; adjust to pH 8.0 |
| G75 / G200 running buffer | self-prepared | - | 15 mM Tris-HCl; 300 mM NaCl; adjust to pH 7.4 |
| enzyme assay buffer | self-prepared | - | 50 mM Tris-HCl pH7.4; 100 mM KCl; 1 mM MgCl2 |
| protein crystallization buffer | self-prepared | - | G75 / G200 running buffer with 1 mM DTT |
| reservoir solution for crystallization | self-prepared | - | 100 mM Na-HEPES pH 7.5; 5-20 % (w/v) PEG4k; 10 mM-200 mM MgCl2 |
Referanslar
- Brouns, S. J. J., et al. Structural Insight into Substrate Binding and Catalysis of a Novel 2-Keto-3-deoxy-d-arabinonate Dehydratase Illustrates Common Mechanistic Features of the FAH Superfamily. Journal of Molecular Biology. 379, 357-371 (2008).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure (London, England: 1993). 7, 1023-1033 (1999).
- Weiss, A. K. H., Loeffler, J. R., Liedl, K. R., Gstach, H., Jansen-Dürr, P. The fumarylacetoacetate hydrolase (FAH) superfamily of enzymes: multifunctional enzymes from microbes to mitochondria. Biochemical Society Transactions. 46, 295 (2018).
- Guimarães, S. L., et al. Crystal Structures of Apo and Liganded 4-Oxalocrotonate Decarboxylase Uncover a Structural Basis for the Metal-Assisted Decarboxylation of a Vinylogous β-Keto Acid. Biochemistry. 55, 2632 (2016).
- Zhou, N. Y., Fuenmayor, S. L., Williams, P. A. nag genes of Ralstonia (formerly Pseudomonas) sp. strain U2 encoding enzymes for gentisate catabolism. Journal of Bacteriology. 183, 700 (2001).
- Izumi, A., et al. Structure and Mechanism of HpcG, a Hydratase in the Homoprotocatechuate Degradation Pathway of Escherichia coli. Journal of Molecular Biology. 370, 899-911 (2007).
- Manjasetty, B. A., et al. X-ray structure of fumarylacetoacetate hydrolase family member Homo sapiens FLJ36880. Biological Chemistry. 385, 935-942 (2004).
- Tame, J. R. H., Namba, K., Dodson, E. J., Roper, D. I. The crystal structure of HpcE, a bifunctional decarboxylase/isomerase with a multifunctional fold. Biochemistry. 41, 2982-2989 (2002).
- Ran, T., et al. Crystal structures of Cg1458 reveal a catalytic lid domain and a common catalytic mechanism for the FAH family. The Biochemical Journal. 449, 51-60 (2013).
- Ran, T., Wang, Y., Xu, D., Wang, W. Expression, purification, crystallization and preliminary crystallographic analysis of Cg1458: A novel oxaloacetate decarboxylase from Corynebacterium glutamicum. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 67, 968-970 (2011).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286, 36500-36508 (2011).
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290, 6755-6762 (2015).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 – a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475, 3561-3576 (2018).
- Taferner, A., et al. FAH domain-containing protein 1 (FAHD-1) Is required for mitochondrial function and locomotion activity in C. elegans. PLoS ONE. 10, 1-15 (2015).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63, 792-794 (2007).
- Bateman, R. L., Bhanumoorthy, P., Witte, J. F., McClard, R. W., Grompe, M., Timm, D. E., et al. Mechanistic Inferences from the Crystal Structure of Fumarylacetoacetate Hydrolase with a Bound Phosphorus-based Inhibitor. Journal of Biological Chemistry. 276, 15284-15291 (2001).
- Zeng, F., et al. Efficient strategy for introducing large and multiple changes in plasmid DNA. Scientific Reports. 8, 1714 (2018).
- Higuchi, R., Krummel, B., Saiki, R. K. A general method of in vitro preparation and specific mutagenesis of DNA fragments: study of protein and DNA interactions. Nucleic Acids Research. 16, 7351-7367 (1988).
- Jansen-Duerr, P., Pircher, H., Weiss, A. K. H. The FAH Fold Meets the Krebs Cycle. Molecular Enzymology and Drug Targets. 2, 1-5 (2016).
- Rupp, B. Origin and use of crystallization phase diagrams. Acta Crystallographica Section F Structural Biology Communications. 71, 247-260 (2015).
- Rupp, B. . Biomolecular Crystallography: Principles, Practice, and Application to Structural Biology. , (2010).
- Flint, D. H., Nudelman, A., Calabrese, J. C., Gottlieb, H. E. Enol oxalacetic acid exists in the Z form in the crystalline state and in solution. The Journal of Organic Chemistry. 57, 7270-7274 (1992).
- Pogson, C. I. I., Wolfe, R. G. G. Oxaloacetic acid tautomeric and hydrated forms in solution. Biochemical and Biophysical Research Communications. 46, 1048-1054 (1972).
- Kost, T. A., Condreay, J. P., Jarvis, D. L., Kost, A. T. Baculovirus as versatile vectors for protein expression in insect and mammalian cells. Nature Biotechnology. 23, 567-575 (2005).
- Steinberger, R., Westheimer, F. H. Metal Ion-catalyzed Decarboxylation: A Model for an Enzyme System 1. Journal of the American Chemical Society. 73, 429-435 (1951).
- Tate, S. S., Grzybowski, A. K., Datta, S. P. The stability constants of the magnesium complexes of the keto and enol isomers of oxaloacetic acid at 25. Journal of Chemical Society. , 1381-1389 (1964).
- Tate, S. S., Grzybowski, A. K., Datta, S. P. The acid dissociations of the keto and enol isomers of oxaloacetic acid at 25. Journal of Chemical Society. 1372, 1380 (1964).
- Brecker, L., et al. Synthesis of 2,4-diketoacids and their aqueous solution structures. New Journal of Chemistry. 23, 437-446 (1999).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır