Method Article
富玛莱酸氢酶含含蛋白质的表达、纯化、结晶和酶测定
摘要
用实例描述了含紫酯水酶的表达和纯化(在大肠杆菌、FPLC中的表达)。纯化蛋白用于结晶和抗体生产,并用于酶测定。提出了选定的光度测定法,以显示FAHD1的多功能性,如牛酸脱碳酶和丙烯酰胺水酶。
摘要
富玛莱沙酸氢酶 (FAH) 含域蛋白 (FAHD) 是真核生物中 FAH 超级家族的成员。这种超级系列的酶通常表现出多功能性,主要涉及水酶和脱碳酶机制。本文介绍了一系列连续的法脱蛋白表达和纯化方法,主要是FAHD蛋白1(FAHD1)在物种(人类、小鼠、线虫、植物等)之间的矫形。覆盖的方法包括大肠杆菌中的蛋白质表达、亲和色谱、电子交换色谱、预准备和分析凝胶过滤、结晶、X射线衍射和光度测定。高纯度的浓缩蛋白(>98%)可用于结晶或抗体生产。类似或低质量的蛋白质可用于酶测定,或用作检测系统中的抗原(西布洛特、ELISA)。在讨论这项工作时,概述了FAHD1的识别酶机制,以更详细地描述其水酶和脱碳酶的双功能。
引言
紫软糖酯水酶(FAH)1,2酶的超级系列描述了一组酶,这些酶共享高度保守的催化FAH域3,4,5,6,7,8,9,10.尽管这些酶具有共同的催化中心,但它们是多功能的,而且大多数是在原核生物中发现的,它们被用来分解从复杂碳源中回收的化合物3。到目前为止,这个家族中只有三个成员被鉴定为真核生物:给FAH2的名字,以及含有FAH域的蛋白质1(FAHD1)11,12,13,14 ,15和 FAH 域含域蛋白 2 (FAHD2)。FAHD1 的消耗与线粒体呼吸受损13、16相关,并与与中间电位相关的可逆型细胞衰老表型14相关电子运输系统的缺陷。人类FAHD1及其在模型系统(小鼠、线虫、癌细胞系、植物等)中的矫形器,以及选定的点突变变异,已成为潜在感兴趣的药物靶点。对于这项研究,高纯度的重组蛋白,以及晶体结构和选择性抗体引导的催化机制的信息至关重要。
本手稿描述了大肠杆菌中FAHD蛋白表达的方法、亲和色谱、离子交换色谱法、硫酸铵沉淀、准备和分析凝胶过滤、结晶、X射线衍射和光度测定。本文所述的方法和协议的目的是为在细菌学、植物生物学以及动物和人类研究等不同领域工作的科学家提供指导,以描述FAH超级家族的成员,包括无名超家庭成员,如果他们成为相关的特定领域。此处描述的协议可能为旨在描述其他原核生物或真核FAH超级家族成员的项目提供有价值的支持。
这里描述的方法背后的原理是,对于描述不佳的蛋白质(特别是未知生理相关性的代谢酶)的表征,从纯化重组蛋白开始的方法允许开发宝贵的高质量研究工具,如体外活性酶制剂、高质量抗体以及选定酶的强效和特异性药理抑制剂。所述方法要求快速蛋白质液相色谱(FPLC)和X射线晶体学。替代方法(例如,表达蛋白质没有化学诱导,或显示蛋白质纯化后,热处理后,脱盐和大小排除色谱),可在其他地方找到17。虽然有更广泛的方法可用于FAH超级家族酶2、7、9、17、18的表达和纯化,但这项工作侧重于表达和特别是FAHD蛋白的纯化。
在本手稿的讨论部分,更详细地描述了为FAHD1蛋白(水酶、脱碳酶)15确定的催化机制,以展示催化反应的化学性质。根据先前工作7,15,18(PDB:6FOG,PDB:6FOH)获得的数据暗示酶的第三种活性为酮-醇异构酶。
研究方案
1. 在合格的大肠杆菌中表达FAHD蛋白
- 大肠杆菌与法氏蛋白表达载体的转化
注:下一节中讨论的步骤在图1A,B中的草图中进行了总结。相同的协议适用于任何FAHD蛋白,包括点突变变异。这种变异可以通过场位导向的诱变和PCR技术19(如双面SOE PCR20)从野生型cDNA获得。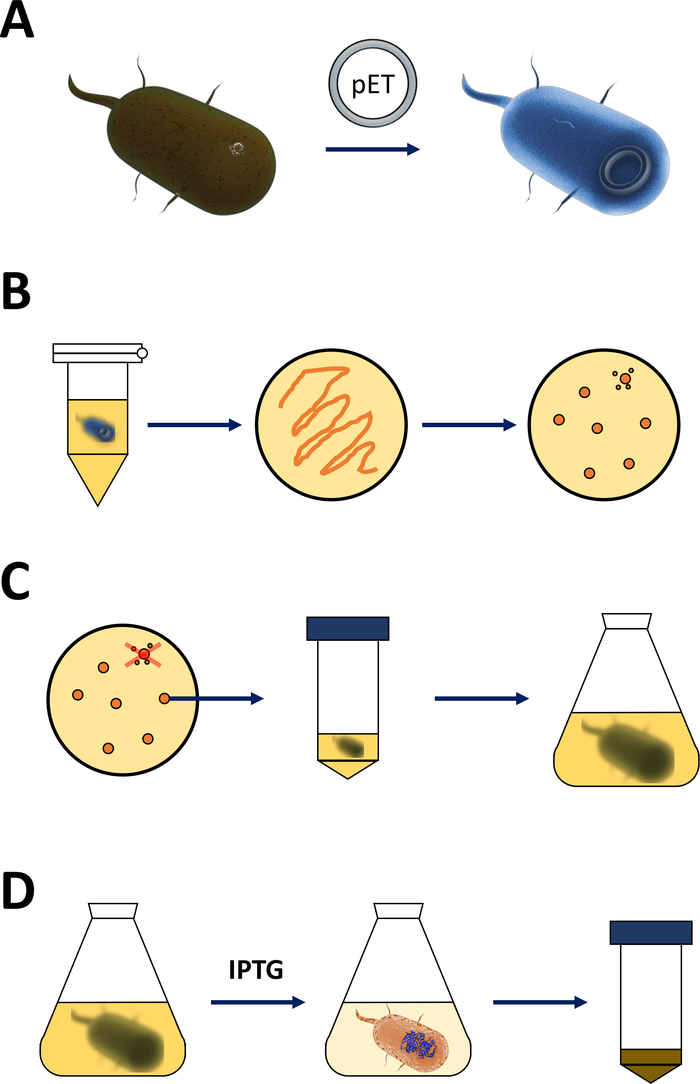
图 1:扩能大肠杆菌和诱导蛋白质表达。
(A) 将pET载体插入第1节所述的胜任的BL21(DE3)大肠杆菌中。(B)热休克协议和电镀的pET转化大肠杆菌,在协议的第1步中描述。转化的细菌在LB琼脂板上镀有抗生素进行选择。(C)第1节所述的pET转化大肠杆菌的扩增。 菌落从LB琼脂板中采摘,并在滋养介质(LB或NZCYM)中放大,直到细菌密度达到0.4的经验阈值。(D)通过 DE3-IPTG-pET系统诱导蛋白质表达,第 1 节中所述,图 2中已绘制。蛋白质生产由化学IPTG的应用开始。在第1节结束时,收获含有蛋白质的细菌颗粒。请点击此处查看此图的较大版本。- 获得合格的BL21(DE3)大肠杆菌和pET表达载体(见材料表)。优选一个pET矢量,该载体也编码N-终端His-tag或相关的捕获标记,以方便简化以下纯化步骤。
- 获得选择的FAHD蛋白的cDNA,并将其插入pET表达载体的活性克隆位点,分别位于T7启动子位和T7终止位点之间。
- 在成功进行质粒扩增和验证后,通过商业供应商的测序(T7引种可与pET系统一起使用,方便:T7启动剂,前引基:TAATACGACTACTATAGGG;T7终结器,反向引物:GCTAGTTGCTCGCGG)*,在冰上插入100 μ0μL的合格BL21(DE3)大肠杆菌中。不要上下吸气,但稍微轻点管子,以便混合内容。
- 将细菌留在冰上30分钟,每隔几分钟轻轻敲击管子。
- 将加热装置或水浴加热到 42 °C(精确)。将含有细菌的管子放入设备中,并将其保存 90 s(精确)。立即将它们放在冰上 (图 1A)。
- 在冰上5~10分钟后,加入600μL的NCZYM介质(见材料表),并将管放入细菌培养箱中。沿 37°C 的摇动方向沿摇动方向以中等速度摇动管 1 小时。
- 10 厘米 LB-agar 板上细菌培养板 200 μL(参见材料表),包含精选抗生素 ,例如,一种针对 BL21 (DE3) pLysS耐药性 (氯霉素), 一种用于耐药性编码在pET载体上(卡那霉素或安比林,图1B)。*
- 在37°C的细菌培养箱中培养LB-琼脂板上的细菌。
- 通过IPTG诱导表达FAHD蛋白
注:下一节中讨论的第一步将总结为图1C,D中的草图。图2中总结了通过细菌DE3盒和pET矢量系统相结合的T7表达系统。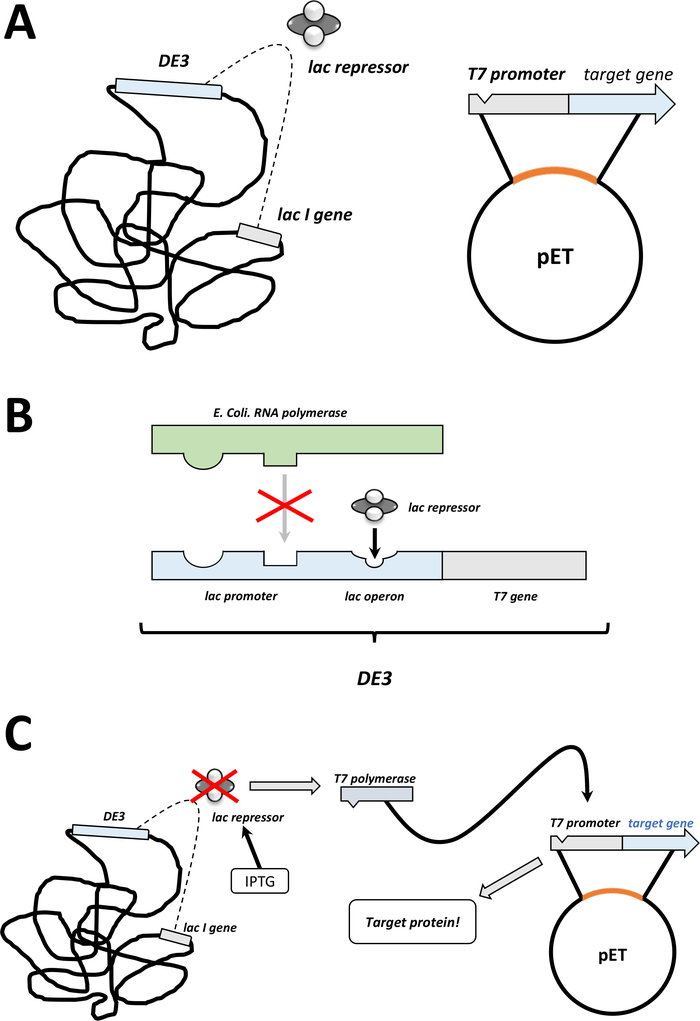
图 2:DE3盒式/pET矢量双系统解释。
(A) pET载体的草图基因组转化了BL21(DE3)大肠杆菌。本地细菌基因组携带DE3盒式(见面板B),以及不断表达乳压抑制器单位的乳胶基因。非原生pET载体携带在T7聚合酶启动子和终止器序列之间插入的蛋白质基因。面板 B. (B)本地细菌基因组的 DE3 盒式编码T7聚合酶的信息,以大肠杆菌RNA 聚合酶操作子为参数。然而,这种蛋白质没有表达,因为乳压抑制器单元阻止RNA聚合酶蛋白结合。因此,不表达T7聚合酶,不表达外源蛋白。(C)化学IPTG(材料表)的应用扭曲了压印机装置的结构,并防止它们与DE3盒装。因此,RNA聚合酶现在可以与盒体结合,T7聚合酶被表达,最终是外源蛋白。请点击此处查看此图的较大版本。- 成功形成菌落后,选择一个殖民地(没有任何卫星殖民地),用抗生素将其分散在5 mL的NZCYM或LB培养基中,并像以前那样选择(步骤1.1.7)。在细菌培养箱中培养在37°C过夜(图1C)。
- 细菌成功生长后,根据蛋白质数量的需求,将细菌放大至250 mL、500 mL 或 1 L 批次的培养基。
- 适合体积,应用步骤 1.1.7 中选择的抗生素,并添加约 1%-2% 的致密细菌预培养物(即 2.5~5.0 mL 至 250 mL 的介质体积等)。抽取步骤 1.2.5(1 mL 或更多)中使用的样本,并检查 600 nm 处的光学密度 (OD)。培养细菌在细菌培养箱在37°C为2~3小时(图1C)。
- 2~3小时后,绘制样品进行光度分析。如果 600 nm 处的 OD 达到 0.4,则应用 200 μM 至 1 mM 异丙基-β-D-硫拉多拉诺西德(IPTG,参见材料表)。
注: 每个 FAHD 蛋白质或点突变变异的实际值是经验值,其中 1 mM IPTG 是应应用的最大值。这诱导蛋白质表达 (图1D,图2C). - 在37°C的细菌培养箱中再工作3~5小时后,蛋白质表达就耗尽。
注:有关温度控制的评论,请参阅讨论部分。不建议感应后超过 5 小时的晃动。在步骤 1.2.5(1 mL 或更多)中抽取用于的样本,并检查 600 nm 处的光学密度 (OD)。- 通过5,000 x g离心将细菌颗粒收获5分钟。丢弃上清液,将颗粒冷冻至-80°C,以延长储存时间,或-20°C进行短暂储存(图1D)。
- 通过两个已检索到的光度测量样本验证感应,这些样本标记为"-I"(感应前)和"+I"(感应后)。在细菌颗粒离心和重悬浮后,通过SDS-PAGE通过加载相同量的总蛋白质来分析两个样品。
注:"+I"样本应显示与所选蛋白质的分子量相关的强带,而"-I"样本不应包含此带。低诱导水平是蛋白质生产的常见问题,但表达的蛋白质水平通常足以执行以下步骤。高诱导水平是一个优势,但不是强制性的。
2. 细菌颗粒的莱沙和碎片过滤
- 根据所选蛋白质是他的标记还是未标记,选择Ni-NTA运行缓冲器(他的标记,见材料表)或冰冷的HIC运行缓冲器(未标记)。
- 对于每 250 mL 的原始细菌悬浮液,将所选缓冲液的 5 mL 涂抹到细菌颗粒上(250 mL 为 5 mL,500 mL 为 10 mL,等等)。每5mL施用缓冲液加入10μLβ-甲氧醇(β-ME)。使用 10 mL Pasteur 移液器通过刮擦和移液(在移液时避免气泡形成)以机械方式将颗粒推入悬浮状态。最终将所有悬架转移到一个 50 mL 管中。
- 优选地将悬浮液(6x为15s,以中等力)进行。
- 在4°C下高速(10,000 x g)离心30分钟。在冰上连续过滤上清液(例如 0.45 μm,0.22 μm)。
注:根据以前的离心步骤,直接通过小滤孔孔尺寸进行过滤可能非常繁琐,通常需要通过较大的孔径进行预过滤。可以添加脱当酶,以取得更好的效果。 - 将样品储存在冰上,然后立即执行第 3 节或第 4 节,具体取决于蛋白质是他的标记还是未标记。
3. 使用Ni-NTA亲和色谱纯化他标记的FAHD蛋白
注:Ni2+离子通过硝酸 (NTA) 与用于亲和色谱的角质树脂(固定金属离子色谱,IMAC,图 3A) 结合在一起。聚他氨酸氨基酸标记与这种Ni-chelate强结合,His标记的蛋白质可以从大多数剩余的蛋白质中分离出来。所述 Ni-NTA 列的制备替代方法是使用预包装的 Ni-NTA 列和 FPLC 系统。
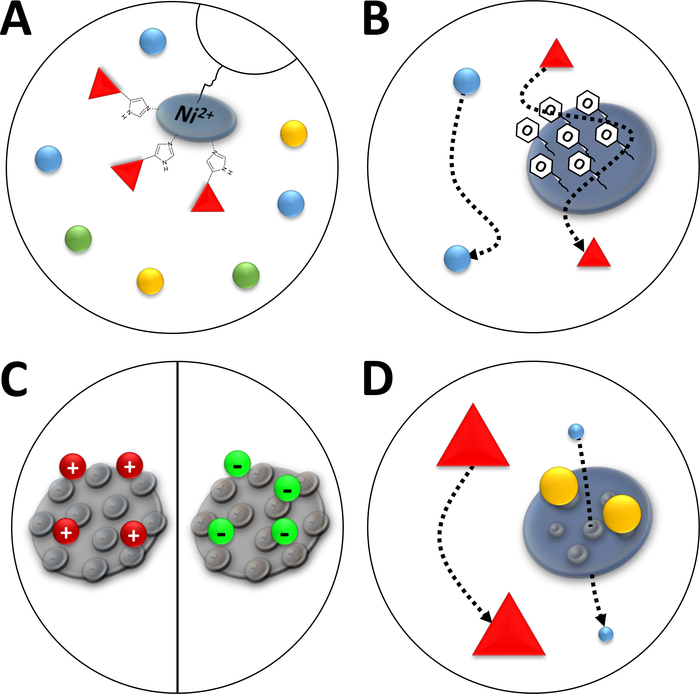
图 3:常见色谱类型的素描插图。
(A) Ni-NTA 柱的树脂。NTA 包含用于固定金属离子亲缘色谱 (IMAC) 的双价镍离子。聚二丁标记最好与这个主题结合,并且可能由 imidazole 洗脱。(B)苯基疏水性相互作用色谱(HIC-苯基)中硅颗粒的典型涂层。疏水性蛋白质与涂层材料相互作用,在迁移时延迟,而其他则不。(C)离子相互作用色谱中硅颗粒的典型涂层。极化和带电蛋白与涂层材料相互作用,在迁移时延迟,而其他蛋白质则不。(D)尺寸排除色谱 (SEC) 中硅胶的树脂。根据二氧化硅材料中定义的孔隙,蛋白质可以按其大小(在与其分子质量对应的第一个近似值中)进行分离。小蛋白质渗透到多孔柱材料中,并且会减速,而大蛋白质在多孔颗粒周围迁移得更快。请点击此处查看此图的较大版本。
- 从步骤 2.5 开始(即蛋白质在 Ni-NTA 运行缓冲液中,并在冰上由 0.22 μm 过滤单元过滤)。
- 通过清洗空柱并将其连接到稳定的固定器,准备空塑料或玻璃柱。根据蛋白质悬浮液的体积选择列的大小。
- 对于每10mL的蛋白质悬浮液,将500μL的Ni-NTA抗氧化蔗脂放入柱中(在使用前剧烈摇动)。使用移液器缓慢地将浆料滴到柱的底部过滤器上。让列稳定,这需要几秒钟。
- 用 Ni-NTA 运行缓冲液完全填充柱,确保不会破坏角玫瑰树脂。让缓冲区通过重力运行。通过在液体上施加拇指压力(使用盖子或手套和拇指压力),可以加速该过程,但注意不要扭曲甘蔗树脂。
- 应用蛋白质悬浮液。和以前一样,让样本通过重力运行。不建议使用拇指压力加速此步骤,因为如果流速较低,蛋白质与柱的结合会增强。在管子中收集流水(材料表)。
- 通过示例后,使用 Ni-NTA 运行缓冲区再次填充整个列。注意不要破坏甘蔗树脂。让样品通过重力运行,但与上一步相比,建议通过拇指压力加速过程,因为由于非特定相互作用的潜在污染可能会以这种方式中断。将洗涤液收集在管子中。重复此步骤。
- 在柱子下方放置一个UV透明比色皿,并应用1 mL的Ni-NTA洗脱缓冲液。收集样品时不要对树脂施加任何拇指压力。
- 在 280 nm 时检查样品的光密度 (OD) 与空白样品(即 Ni-NTA 洗脱缓冲液)。最佳程度上,该示例显示的 OD 大于 2.5。低于 0.5 的 OD 表示样品中没有大量蛋白质。
注:如讨论部分所述,洗脱液液的盐和硫丹浓度可能必须针对每种FAHD蛋白分别进行调整。 - 重复步骤 3.1.7 和 3.1.8,直到 OD 低于 0.5。将所有具有较高 OD 的样品放在冰上的管子中。
- 从步骤 3.1.4 重新开始,使用步骤 3.1.5 中的流作为步骤 3.1.5 重复的新输入。重复此过程,直到步骤 3.1.6 中收集的第一个样本显示的 OD 低于 0.5。
注:如讨论部分的故障排除部分所述,His 标记的蛋白质可能与 Ni2+树脂结合不足。在这种情况下,需要重复此步骤或替代方法(例如,电子交换色谱)。 - 采集所有中间馏分的样本,用于 SDS-PAGE 分析。
- Ni-NTA洗脱缓冲液中的FAHD蛋白在冷冻和解冻后会沉淀。因此,将蛋白质与不同的缓冲液进行透析(在冰上过夜,使用每100 mL透析缓冲液1μL的DTT)。使用低盐缓冲液,基于此步骤后应执行的电一交换色谱类型。使用具有14 kDa(材料表)的典型分子量截止的常用纤维素管。
- 通宵透析后,选择使用超离心过滤器单元浓缩蛋白质。执行 SDS-PAGE 分析(12.5% 运行凝胶,4% 堆叠凝胶),以检查蛋白质的潜在损失、洗脱不足和一般蛋白质纯度。如果一切正常,请继续执行第 5 节。
4. 通过疏水相互作用色谱(HIC)纯化未标记的FAHD蛋白
注:在FPLC的HIC柱中,硅胶涂层表面的苯基组(图3B)能够根据疏水特性分离蛋白质。所述步骤应在配备 5 mL HIC-苯基柱的 FPLC 系统中执行。可用1M NaOH洗涤柱,以用于不同的蛋白质。然而,曾经用于一种FAHD蛋白的列应只用于这种类型的蛋白质。
-
硫酸铵(AS)降水
- 从步骤 2.5 开始。蛋白质在冰冷的HIC运行缓冲液(材料表)。
- 精确评估制备的蛋白质溶液对微升(V初始)的体积。缓慢且滴落地添加预冷却 HIC 运行缓冲器 AS 解决方案,直到达到 35 卷-% AS 饱和度:VAS添加 = V初始= 0.538。在4°C下,在高速(±10,000 x g)下轻轻搅拌溶液30分钟。
- 使用冰上 0.22 μm 过滤单元过滤上清液。或者,采取SDS-PAGE分析样本:稀释1:4,在95°C下立即加热5分钟,否则样品将成块。此时(-20 °C),样品可能会冻结,以便再进行一天。
-
使用 HIC 列的 FPLC
- 设置 FPLC 系统,并平衡 5mL HIC-苯基柱,5 列体积 (CV) 为 20% EtOH(H2O),后跟 5 CV H2O。
- 将 260 mL 的 HIC 运行缓冲(精确)与 140 mL 的 HIC 运行缓冲器 AS(精确)混合。这会产生 35 个容量%的 AS 解决方案。检查 pH 值 (7.0);这是缓冲区 A. 缓冲区 B 是运行缓冲区的 250 mL。向缓冲器 A 和 B 添加 1 mM DTT,然后将它们保存在冰上。
- 在此序列中,使用 8 mL 的缓冲 A、8 mL 的缓冲 B 和 8 mL 的缓冲区 A 对列进行平衡。应用协议步骤 4.1 中准备的示例。用缓冲液A清洗,直到280nm处的基线光学吸收达到1000~500 mAU。
- 应用缓冲液A和B的混合物,使AS的浓度为33%(w/v)。用 1 CV 洗涤,导致色谱图中出现高原。设置缓冲器 B 的梯度(随时间时高达 100% 缓冲 B):在 3.8 分钟内将缓冲器 B 的 1.5 mL(即 5.7% 缓冲 B,B%B/mL 斜率)。当 280 nm 处的紫外线信号上升时,开始收集分数并立即将其放在冰上。
- 最后,用缓冲器 B 清洗列。采集所有分数的样本,用于 SDS-PAGE 分析。使用液氮冷冻所有样品,并将其储存在-80°C。
- 执行 SDS-PAGE(和西部污点)分析,以检测收集的馏分中的 FAHD 蛋白。含有蛋白质的分数被汇集并应用于进一步纯化,如以下协议步骤所述。用 H2O 和 20% EtOH(H2O 中)清洗列。
5. 通过电一交换色谱法纯化FAHD蛋白
注:带电功能组的分子与FPLC的二氧化硅粒子柱绑定(图3C)。这使得蛋白质能够根据其离子特性(如表面电荷)进行分化。应分别使用 FPLC 机器和相关诀窍执行所述步骤。所述方法对于阳离子或阴离子交换色谱相同,但所使用的缓冲液略有不同。
- 选择阳离子或阴离子交换色谱系统。这种选择是经验性的,在FAHD蛋白之间可能有所不同。最好地,这两种方法可以连续使用。
- 设置 FPLC 系统,用 5 CV 的 20% EtOH(H2O 中)洗涤列,然后用 5 CV H2O 平衡该列,其中 1 CV 低盐缓冲液、高盐缓冲液以及在此序列中再次使用低盐缓冲液和低盐缓冲液。
- 将样品(对步骤 3.1.11 中正确的低盐缓冲液进行透析)应用于列上。收集流通过。用低盐缓冲液清洗 1 CV 的列。
- 设置梯度洗脱:在 30 分钟内以 1 mL/min 的流速(1 mL/min)或 0.5 mL/min 的流速 60 分钟为 100% 高盐缓冲液。这可以通过已知的FPLC色谱图重新选择,以优化纯化。收集所有峰值分数。
注:高盐条件可能因FAHD蛋白而异,如讨论部分所述。 - 梯度完成后,使用高盐缓冲液运行,直到在 1 CV 范围内不再检测到峰值(收集分数)。
- 采集所有采集的分数样本,并进行 SDS-PAGE 分析(12.5% 流胶,4% 堆叠凝胶)。将单个样品冷冻在液氮中,并将其储存在-80°C。
- SDS-PAGE分析完成后,汇集含有FAHD蛋白的样品,并丢弃其他样品。或者,使用超离心过滤装置浓缩蛋白质。
- 在 0.5 M NaOH(或其他洗涤剂)中涂抹 1 mL 的 25% SDS 以清洁柱子。用 H2O 和 20% EtOH(H2O 中)清洗列。
- 或者,使用备用列(阳离子或离子交换色谱)重复第 5 节。从这种方法获得的蛋白质足够纯,可以进行基本活性测定,或可用于晶体学筛选测定。对于高级应用程序,请继续第 6 节。
6. 通过尺寸排除色谱法(SEC)纯化FAHD蛋白
注:FPLC的硅胶柱中的多孔颗粒能够根据分子大小(如流体动力学半径)对蛋白质进行分化(图3D)。描述的步骤将使用 FPLC 系统使用 SEC 列执行。
- 选择 SEC 列,具体取决于通过 SDS-PAGE 和银染色检测到的污染物的分子量。概述的方法适用于两列。用 400 mL 的 H2O 清洗柱,并与 SEC 运行的缓冲器平衡。建议为 FPLC 系统编写程序以自动执行此步骤。
- 将 1 mM DTT 添加到 300 mL 的 SEC 运行缓冲器中,并将其放在冰上。这是正在运行的缓冲区。将此缓冲区的 60 mL 应用于列。
- 将蛋白质样品(10,000 x g 10 分钟)离心,以去除任何微沉淀。将上清液应用于列。通常建议在FPLC之前过滤上清液。
- 将正在运行的缓冲液应用到柱上,直到所有蛋白质都洗脱。以适当体积的分数收集所有峰值(例如,2 mL)。对SDS-PAGE进行取样,并使用液氮冷冻所有馏分。将冻结的馏分储存在-80°C。
- 在SDS-PAGE(和西斑)分析后,收集和汇集所有含有FAHD蛋白的分数。建议使用银染色来检测可能仍然存在的轻微污染。
- 使用超离心过滤装置来浓缩蛋白质。虽然对FAHD蛋白不是强制性的,但一般来说,对于酶测定和结晶,建议进行脱盐步骤(例如,通过透析)。
- 重复步骤6.3~6.6多次,不同流速和盐浓度(经验),以提高FAHD蛋白的纯度。用 H2O 和 20% EtOH(H2O 中)清洗柱过夜。
7. 使用基质奥沙醋酸盐和乙酰乙酰乙酸酯进行基本FAHD活性测定
注:FAHD蛋白1(FAHD1)显示草酸脱碳酶(ODx)和丙烯酰胺水酶(ApH)活性。讨论部分对此进行了更详细的概述。由于在水溶液中通过酮-烯醇tautome变坏,牛油酸盐会随着时间(自动脱脂)本身衰变(自动脱脂)作为共因子浓度和pH的函数。在pH值7左右,温度为25°C时,这种效果并不显著,但必须加盖检测,以考虑自脱酸和酶浓度。移液方案如图4A所示。通常,建议使用经过良好校准的移液器进行此测定,因为它对轻微的移液错误相当敏感。

图 4:酶测定的草图移液方案。
(A)基本基质FAHD蛋白酶测定的草图移液方案。基底空白: -S/-E;基板样品: +S/-E;酶空白: -S/+E;酶样品:+S/+E(S:基质,E:酶)。有关详细信息,请参阅协议步骤 7。(B)评估FAHD蛋白的Michaelis-Menten动力学的草图移液方案。基底空白: -S/-E;基板样品: +S/-E;酶空白: -S/+E;酶样品:+S/+E(S:基质,E:酶)。有关详细信息,请参阅协议的第 8 节。请点击此处查看此图的较大版本。
- 启动微孔板读卡器,在 25°C 下平衡 30 分钟。设置一个程序,用于在 255 nm 处读取 12 口井(如图4A中所述)。建议使用 25 个多读出,延迟 5 毫秒。设置一个周期,每 2 分钟测量 15 倍(共 30 分钟)。
- 默认情况下,在pH 7.4处制备1 mM MgCl2的酶测定缓冲液(见材料表)。变异FAHD蛋白可能需要不同的辅助因子或pH水平。Mg2+和 Mn2+是 FAHD13、11、12、21的已知辅助因子。
- 创建1μg/μL蛋白溶液,用酶测定缓冲液稀释(材料表)。
- 在酶测定缓冲液中设置待测试的基质的1 mL的20 mM溶液(到目前为止已识别的FAHD蛋白基质列于其他位置3)。
- 根据图4A所示的移液方案,用5μL(5μg)的酶溶液将酶空白和样品井制备:将酶测定缓冲液(材料表)移液90μL。
- 根据图4A所示的移液方案,将基底坯和样品井制备:移液95μL酶测定缓冲液进入井中。
- 在测量之前,将5μL的酶测定缓冲液涂入6个空白井中。将 20 mM 基板溶液的 5 μL 涂在样品井上。建议使用多通道移液器。
- 在 50 μL 设置下使用多通道移液器,轻轻混合所有井。从空白开始,然后继续样井。注意不要产生任何气泡。将板插入微孔板读取器,并在 255 nm 处测量每个孔(如步骤 7.1 中所述)。
- 在电子表格中执行分析。将光度计的原始数据复制到电子表格中,并将所有设置(即所有文档)写入另一张工作表。对四个准备工作中每口三口井的数据进行平均。从示例中减去空白。还要计算标准差,并合计空白和样本的偏差。
- 绘制此数据(y:光学密度,x:时间(以分钟)。应显示指数级递减曲线。根据使用的基材种类,在前 10 分钟内可以观察到初始增加,之后信号会减小。这归因于基材的酮-enol tautomerin,如讨论部分中更详细地概述。
- 将光信号数据随时间划分,除以图的最大值,以便将数据缩小到 [0, 1] 范围内(图 5A中提供了一个示例)。确定曲线的线性范围(从初始下降开始),并计算负斜率(1/min)。
- OD 减少的时间过程通过基板的初始浓度与基板相关联:100 nmol/well = 斜率。使用评估的蛋白质浓度 c0,计算特定活性:100 nmol/well = 斜率 = 1/c0。以μg/well表示c0,以这种方式计算的特定活性使用单位nmol/min/μg表示,等于μmol/min/mg。
8. 评估FAHD蛋白的迈克尔-门顿动力学
注:评估FAHD蛋白的Michaelis-Menten动力学是乏味的,因为特定的蛋白质活性取决于反应发生的相对蛋白质基质浓度和物理体积。必须建立稳态动力学才能获得可靠的结果。以下步骤概述了 96 孔 UV 透明板上的测试协议。每个步骤都需要非常小心地执行,因为小错误通常会破坏实验。建议在尝试下面描述的更复杂的测定之前,掌握第 7 节中概述的测定。
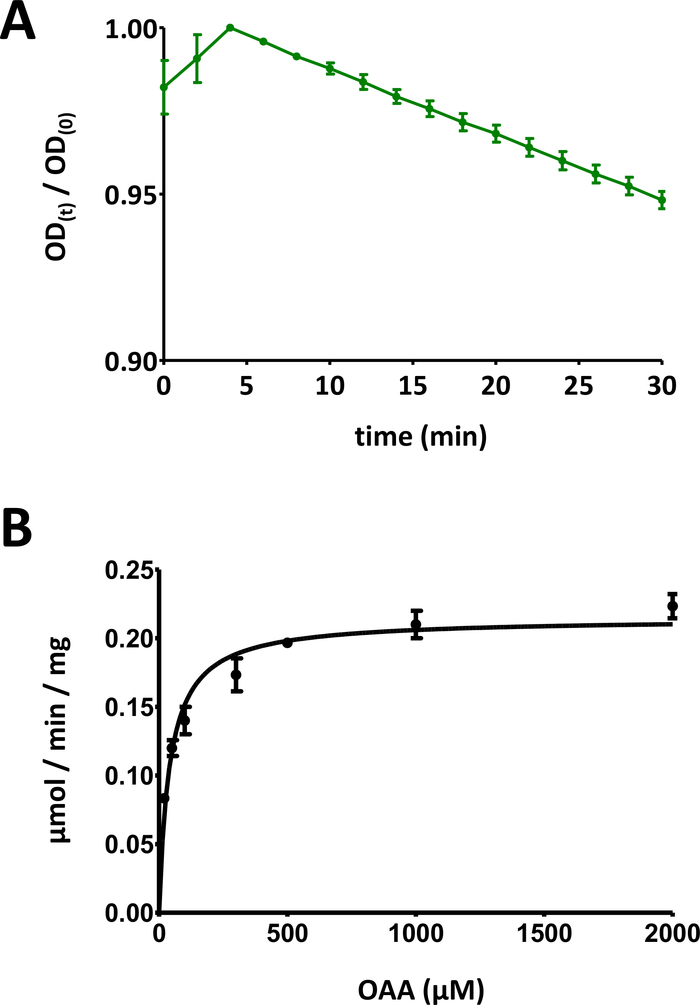
图 5:酶测定的示范性结果。
(A)基本基质FAHD蛋白酶测定(归化为0至1)的示范性紫外线吸收曲线,具有标准偏差。在任何给定时间 t [OD(t)] 时,光密度 (OD) 比 [OD)/OD(0)] 归一化为初始 OD [t = 0;d]OD(0)*。有关详细信息,请参阅协议的第 7 部分。(B)具有标准偏差的人类FAHD1蛋白的示范米夏埃尔-门顿动力学。有关详细信息,请参阅协议的第 8 节。请点击此处查看此图的较大版本。
- 启动微孔板读卡器,在 25°C 下平衡 30 分钟。设置一个程序,在 255 nm 处读取 72 口井(如图4B中概述)。建议使用 25 个多读出,延迟 5 毫秒。设置循环,每 2 分钟测量 15 倍(共 30 分钟)。
- 执行步骤 7.2 和 7.3。然后,在酶测定缓冲液中设置1mL的100mM基质溶液。
- 在酶测定缓冲液中制备基质溶液的稀释:40 mM、20 mM、10 mM、6 mM、4 mM、2 mM。测定使用成对("调整")酶/基质浓度进行。为此,在酶测定缓冲液中制备以下酶溶液稀释:0.5 μg/μL,0.4 μg/μL,2.5 μg/μL,2微克/μL,1.5微克/μL,1微克/μL。
- 在图4B所示的所有井中应用180μL的酶测定缓冲液。将10μL的酶测定缓冲液涂入基材(空白和样品)的所有井中。将制备的蛋白质稀释系列的10μL涂入酶(空白和样品)的井中。将10μL的酶测定缓冲液涂入基底空白和酶空白的所有井中。
- 在测量之前,将制备的基质稀释系列的10 μL应用到基材样品和酶样品的井中。
- 在 50 μL 设置下使用多通道移液器,从空白开始,轻轻混合所有井,然后进入样品井。注意不要产生任何气泡。
- 如步骤 8.1 所述,将板插入微孔板读取器,并在 255 nm 处测量每个孔。在电子表格中执行分析。将光度计的原始数据复制到电子表格中,将所有设置(即所有文档)写入另一张工作表。
- 执行稀释系列中每个点的各个数据分析,如步骤 7.11 中所述。到 7.14。最终,获得针对初始基板浓度的所有特定活动和绘图:2 mM、1 mM、0.5 mMM、0.3 mM、0.2 mM、0.1 mM。
- 显示具有各个标准偏差的所有数据点。计算机Michaelis-Menten动力学通过非线性曲线拟合,或通过线织-伯克分析。可能需要在步骤8.5和8.6中重新测量单个点,并调整单个蛋白质浓度/基质浓度对比率。图5B提供了人类FAHD1的迈克尔斯-门滕图。
9. FAHD蛋白的结晶
注:FAHD蛋白(前文15所述的人类FAHD1)的结晶可以通过悬挂滴蒸汽扩散方法以24井格式实现(图6A)。下面给出了一个使用这种技术的人类FAHD1结晶的分步协议。讨论部分提供了更详细的说明。

图 6:FAHD蛋白的结晶。
(A)标准 24 孔或 96 孔 SBS 封装中的结晶板。有关详细信息,请参阅第 9 节。(B)FAHD蛋白结晶的基本板设置过程。此图使用权限23重绘。有关详细信息,请参阅第 9 节。(C)人类FAHD1晶体和相应的衍射模式(小刀片)。刀片中指示最接近的晶格间距,作为晶体衍射质量的度量。数字越小表示分辨率越高,数据信息量就越高。有关详细信息,请参阅协议的第 9 部分。请点击此处查看此图的较大版本。
- 确保蛋白质与 SEC 运行的缓冲液进行透析。FAHD1蛋白应在高浓度(2~5毫克/升/升)下提供。在较低的浓度下,由于缺乏自发的成核,蛋白质可能无法结晶。
- 准备 ±20 mL 的储液罐溶液进行结晶。制作三种库存溶液,使用蒸馏水或脱离子水作为溶剂:1 M Na-HEPES(最小25 mL,调整为pH 7.5)、50%(w/v)聚乙烯乙二醇4000(PEG4k)(最低65 mL)和1M MMgCl 2(10 mL)。
- 设置一个 4 x 6 (共 24 个)不同 15 mL 管的网格。根据板上的相应位置(例如,行(A、B、C、D)与列(1⁄6)(如"A1"、"B5"、"D6"等)标记它们。移液器 1 mL 的 1 M Na-HEPES 到每个管。
- 移液器 1 mL 的 50% (w/v) PEG4k 到管的 A 行,2 mL 到行 B,3 mL 到行 C,4 mL 到行 D. 移液器 100 μL 1M MgCl2到管的列 1,250 μL 到列 2,500 μL 成列 3,1.0 mL 成列 4,1.5 mL 到列 5,2.0 mL 到列 6。
- 用蒸馏水或去离子水填充所有管材,达到 10 mL 体积,其中管上的刻度足够精确。
- 从冰箱(或冰)取取人类FAHD1蛋白样品(约5毫克/mL),在4°C的台式离心机下以最大速度旋转至少10分钟。如果需要与草酸盐共结晶,从库存溶液中加入草酸盐,使蛋白质样品含有最终草酸盐浓度为2 mM。应用 1 mM DTT 并储存在冰上。
- 同时,解压24孔结晶板,最好在18°C的温度控制室内。在薄玻璃或塑料棒的帮助下,将一层薄薄的石蜡油分配到 24 口井板每个井的顶部的边缘上。将800 μL的结晶鸡尾酒(A1至D6)加入结晶板的每个相应孔中。
- 将新鲜的 22 mm 盖玻片放在干净的表面上。避免用污垢或灰尘污染盖滑。如有必要,使用压缩空气或除尘器喷雾清除盖玻片上的任何碎屑。
- 离心完成后,避免摇动蛋白质样品,以免管底的旋转聚集物和碎屑不再浮起来。在以下步骤中,从溶液表面正下方的蛋白质样品中移液器,以避免从底部搅拌聚集物和沉积物。
- 对于每口井(见图6B)移液器1μL的蛋白质溶液到盖滑的中心,并添加1μL各自的储液罐鸡尾酒到蛋白质液滴,避免气泡。将盖玻片倒置,并将其放在井顶部,以便机油密封油井,使盖玻片密封气密。重复此操作,直到 24 孔板完成。
- 将板储存在 18°C,用适当的显微镜在渐进的时间表上观察滴。人类FAHD1晶体通常在一夜之间出现(见图6C)。
结果
从制备的克隆载体和购买的BL21(DE3)pLysS大肠杆菌开始,质粒通过热休克或任何适当的替代方法插入细菌中(图1)。经过短暂的扩增后,转化后的细菌被镀在LB琼脂板上,以便一夜之间生长。此时的板可能看起来不同,具体取决于各种潜在的误差源。板可能是空的(即没有菌落),完全由细菌过度生长,或介于两者之间。图7A中描述了在最佳和非最佳变换后LB琼脂板的两个示例。细菌菌落过多表明,有太多的细菌被镀(可能),或者正在使用的抗生素可能过期(不太可能)。细菌菌落太少可能表明,要么没有足够的质粒用于转化(下次使用更多),要么使用太多的抗生素来选择细菌。在任何情况下,如果菌落存在,它们应该很好,因为使用两种选择性抗生素意味着细菌生长的机会相当渺茫。然而,没有菌落表明细菌失去了转化能力(由于储存不当或储存时间过长、重复冷冻和解冻等),热休克不成功(没有质粒的接收或细菌死亡过热),克隆载体被损坏,或误用一组错误的选择性抗生素(验证质粒载体上的抗药性基因)。
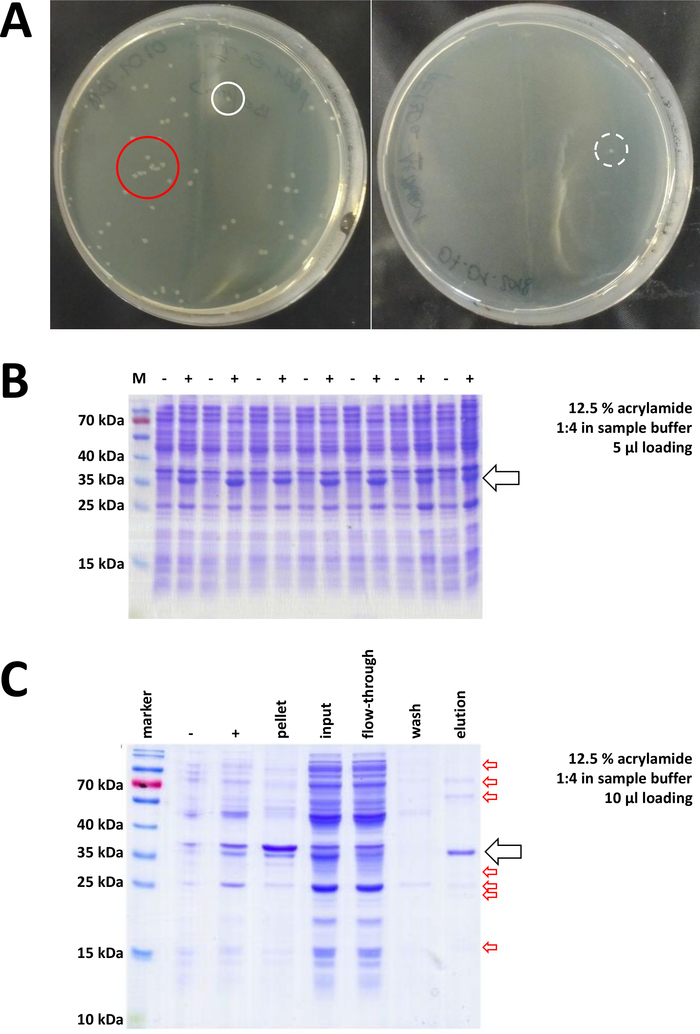
图 7:细菌转化和IMAC的代表性结果。
(A)代表LB琼脂板与转化BL21(DE3)大肠杆菌,通过以下协议步骤1.1获得。左图:具有分布良好的菌落的盘子(正面示例)。右:只有一个殖民地的盘子(负例)。白色圆圈标记良好的殖民地。红色圆圈标记彼此生长太近的殖民地,只要有孤立的殖民地,就不应该采摘。(B)对一系列感应控制进行12.5%丙烯酰胺SDS-PAGE分析("-"表示在IPTG感应之前;"+"表示IPTG诱导后,在颗粒收获之前),调整为总蛋白质的等量。步骤 1.2 中对此进行了说明。(C)对尼-NTA纯化的NI-NTA纯化的他标记的FAHD1蛋白的示范性12.5%丙烯酰胺SDS-PAGE分析。该协议的第 3 节对此进行了说明。亲和色谱产生高纯度蛋白质(>70%,黑色箭头),然而,也观察到几个小污染(红色箭头)。这些污染由与柱结合的非FAHD蛋白质和与FAHD蛋白结合的蛋白质组成。请点击此处查看此图的较大版本。
选择并选取经过验证的菌落。在滋养介质中扩增后,通过施用化学IPTG触发蛋白质表达。含有以毫克为单位的表达蛋白质的细菌颗粒被收获,并通过SDS-PAGE验证表达(参见图7B)。在这个否则简单的过程中,可能会出现一些问题。首先,一些蛋白质形成内含体,因为它们显然以某种方式干扰宿主细菌的自然代谢。在人类FAHD1和FAHD2的某些点突变中观察到这一点。在这种情况下,其他表达系统,如昆虫细胞可能更合适,应考虑。例如,从昆虫细胞中采集颗粒后,蛋白质的纯化遵循本协议中所述的步骤。其次,DE3-pET 系统有时被发现是"泄漏的"(即,在 IPTG 诱导之前,蛋白质已经在某种程度上表达)。潜在的原因还没有得到很好的理解,但它可能有助于在冷室孵化器中缓慢地表达蛋白质。第三,不表达蛋白质。这可能是最坏的情况,因为它可能表示一个损坏的质粒载体,因此建议对质粒进行测序。
如果使用His-tag 标记蛋白质,则使用 Ni-NTA 抗氧化剂进行亲和色谱是一种简单且廉价的捕获方法,可消除大多数污染(图 7C)。其他标签系统(例如,STREP-II)也有类似的方法。如果没有使用标记,硫酸铵沉淀和连续疏水交换色谱的组合也可以将蛋白质从大多数其他蛋白质中分离出来(图8A)。然而,比较这两种方法(图7C与图8A),可以通过SDS-PAGE分析来证明Ni-NTA方法的优越性。因此,建议使用他标记的蛋白质。
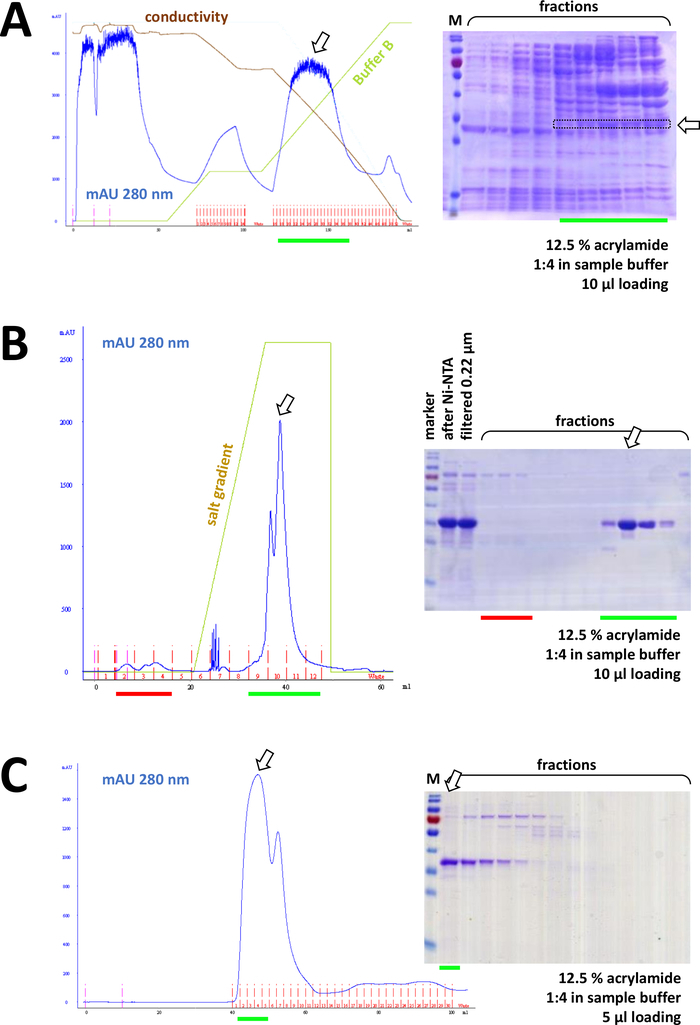
图 8:FPLC实验(HIC、子交换、SEC)的代表性结果。
(A)在未标记的FAHD1蛋白沉淀后,对HIC-苯基质图进行典型的色谱图和12.5%丙烯酰胺SDS-PAGE分析,如协议第4节所述。绿线反映缓冲区 B 的渐变,其中不包含 AS。在此过程中,AS 逐渐从系统中洗出。将此面板与图 7C进行比较,显示了与 HIC-phenyl 方法相比,Ni-NTA 亲缘色谱的威力,以及使用His标记系统进行蛋白质纯化的优势。(B)在Ni-NTA纯化后,对标记其标记的FAHD的阳离子交换色谱进行示范性色谱图和12.5%丙烯酰胺SDS-PAGE分析。使用盐梯度,应用的样品被分离成单个蛋白质。(C)在阳离子交换色谱调查后,对G75尺寸排除色谱的G75尺寸排除色谱进行示范性色谱图和12.5%丙烯酰胺SDS-PAGE分析。 请点击此处查看此图的较大版本。
连续,蛋白质通过阳离子/离子交换色谱法进一步从剩余污染中分离出来(例如,参见图8B),然后是大小排除色谱(例如,参见图8C)。建议按此顺序建立初始纯化策略;然而,这些柱应该结合使用,随后和变化,直到蛋白质是足够纯净。
简单的活性测定,为了测试活性基质和/或辅助因子上的"是或否"决定,可在Ni-NTA纯化后使用His标记蛋白,或在离子交换柱后使用未标记的蛋白质进行。特定活动和动力学常数必须用纯度最高的蛋白质确定。离子交换柱后可以尝试与蛋白质结晶,但晶体的质量几乎总是与蛋白质纯度相关。在纯化方案的任何阶段,可针对蛋白质升高多克隆抗体;然而,这里的质量也与蛋白质纯度有关。
讨论
关键步骤
FAHD蛋白质对盐浓度非常敏感。在低NaCl浓度下,蛋白质在解冻时可能沉淀,但它们通常可以在较高的盐浓度下完全重组。也就是说,如果FAHD蛋白由于某种原因沉淀,它可能会恢复或重新折叠与较高的盐浓度(>300 μM)。然而,一些更多的疏水性蛋白质可能无法回收(例如,人类FAHD2),但洗涤剂如CHAPS(最大1%)或甘油 (10%)可用于将它们保存在稳定的溶液中。在任何情况下,建议使用液氮进行冲击冻结,并在-80°C下储存,因为它是一个温和而缓慢的解冻过程。
步骤 3.1.10 中的 Ni-NTA 纯化过程中可能会出现一些意外问题。值得注意的是,第二个采集的样品中比第一个样品的OD值高,表明甘油树脂的体积过高(注意一下,在下一个实验中使用更少的树脂)。此外,甘蔗树脂本身导致280nm的OD信号(即,对甘蔗树脂床的中断将发出人工信号)。如有疑问,建议使用其他方法,如布拉德福德或BSA测定来确定蛋白质浓度。
在酶测定中,需要考虑三个关键方面。首先,评估蛋白质浓度对于获得正确的特定活性至关重要。蛋白质的纯度水平正在影响结果,需要估计。在标记蛋白的情况下,必须计算标记部分的质量,并且必须相应地更正特定活动。对于协议第7节所述的简单检测,Ni-NTA纯度足以区分活性基基和非活性基质、辅助因子等。对于更复杂的Michaelis-Menten动力学,必须正确确定所有反应物和基板浓度。特别是在使用牛乙酸酯(随着时间的推移自动脱氧)时,反应的酶部分必须纠正为自动脱氧(假设两种反应同时发生)。必须考虑光密度信号的初始变化,这些信号是基板的酮-enol tautoininin。第三,必须调整浓度和体积。具有确定浓度的酶和基质的反应可能给出不同的结果,取决于测定量。如果每口井有太多的酶,液体的粘附实际上可能会偏袒结果。
为了评估Michaelis-Menten动力学,建议在100μL、200μL和300μL批次中进行初始实验,以找到最佳组合。类似的方面也适用于动力学测定的酶基质浓度的比例。每个基质的酶过多或每个酶的基板过多,使系统超出线性稳态 Michaelis 范围。需要进行初步实验以优化这些条件。第 8 节提供了人类 FAHD1(野生型)蛋白质的示范性调整,从而产生动力学图(如图5B所示)。
对于结晶,蛋白质溶液滴在盖玻片的中心移液,并与结晶鸡尾酒滴混合,通常由缓冲液(例如,Tris-HCl,HEPES)和沉淀物(例如聚乙烯乙二醇、铵)组成硫酸盐)。可选择应用用于共结晶的抑制剂溶液滴(如本协议中的草酸盐)。然后,盖玻片倒置在含有结晶鸡尾酒的储层井上方,在密封油的帮助下密封井气(图6B)。理想情况下,在实验开始时的落差中不会发生沉淀,这意味着蛋白质仍然存在于溶液中。由于储层中的沉淀浓度高于下降,下降开始通过蒸发到井内,直到达到与储层的平衡。水扩散到储层中会导致下降量缓慢下降,进而导致下降中蛋白质和沉淀浓度的增加。如果蛋白质溶液达到所需的超饱和状态,从而达到元稳定性,则会发生自发成核,随后是晶体生长。达到超饱和状态是结晶的必要条件,但不是充分条件。蛋白质的结晶既需要有利的热力学和动力学条件,又在很大程度上取决于要结晶的蛋白质的不可预知特性。
修改和故障排除
大肠杆菌中蛋白质的表达可能效率低下。不同的IPTG浓度、表达温度和扩增时间(如室温几个小时或在冷室过夜)可能需要针对每种新蛋白质进行测试,以找到最佳条件。有时观察到含有体中蛋白质的沉淀,以产生疏水性强的FAHD蛋白。在这种情况下,建议在昆虫细胞等其他模型系统中表达蛋白质,因为包含体不太可能形成26。
由于 FAHD 蛋白质对盐和副因子浓度以及 pH 敏感,因此不同同源体、正交和点突变变异的纯化策略在单个环境中可能有所不同。为野生型人和小鼠FAHD1蛋白开发了所述纯化方法。化学物质的浓度,如NaCl和imidazole,以及pH值,可能必须适应具有不同等电点(pI)的单个蛋白质。还值得注意的是,并不是每个他标记的蛋白质都能很好地与Ni-NTA树脂结合。如果与Ni-NTA柱结合的蛋白质效率不高,则适应的NaCl和imidazole浓度,以及Ni-NTA运行缓冲液中不同的pH条件可能有助于提高结果的质量。如果不是,跳过Ni-NTA步骤,继续离子交换色谱步骤,也可能导致成功的纯化策略。如果蛋白质与Ni-NTA列结合,但不能从该柱中洗脱,添加一些mM EDTA可能有助于破坏Ni2+复合物。
关于结晶过程,需要理解的是,将大而复杂的蛋白质分子自组织成一个定期的周期性晶格是一个固有的不可能的过程,它严重依赖难以控制的动力学参数。即使用于结晶的设置的微小变化也会显著地改变结果,并且不会形成晶体。蛋白质纯度通常至关重要。根据经验,严重超载的SDS-PAGE凝胶不应显示其他带。此外,执行步骤的顺序可能会影响结果。例如,为了确保可重复性,通常需要保持移液序列不变,然后首先添加蛋白质,最后向结晶液滴添加沉淀物(反之亦然)。无论使用哪种方法,在尝试复制或放大实验时,都应保持不变。如果按照此协议未观察到晶体,则化学沉淀成分、pH 值、滴大小和蛋白质与沉淀比可以以较小的增量变化。耐心和对滴的一贯观察是美德。
对FAHD1催化机制的讲话
所介绍的方法是专门为获得高质量的FAHD1蛋白而开发的。这促进了FAHD1晶体的生长,以及含有FAHD1复合物的晶体的工程(草酸盐,PDB:6FOG)。X射线结构提供酶催化腔的3D结构。这些结果建立了对残留物的全面描述,对于这种有趣的酶的催化机制可能很重要。FAHD1首先被描述为能够切化丙烯酸(乙酰丙酮酸盐,紫霉素)11。后来,发现FAHD1还作为甲氧乙酸酯12的脱血酶。虽然基质丙烯酰胺和牛沙乙酸酯是不同的化学基质,但化学转化在机械上共享了共同单C 3-C4键的战略裂解,如果C 3,则大力促进-C4键轨道保持正交到C2-碳基15的+轨道。这种构象允许在裂解过程中瞬时形成的C3-卡巴尼的共振稳定。FAHD1基质(乙酸乙酯和丙烯酸盐)是柔性分子,可能存在于陶土(酮-醇)和C2-水合形式(图9A)。不同物种之间的平衡主要取决于使用的缓冲成分的性质、pH值和金属离子的存在。下面我们将讨论从X射线晶体结构分析中激发的假设力学情景,这些分析揭示了FAHD1的催化中心。
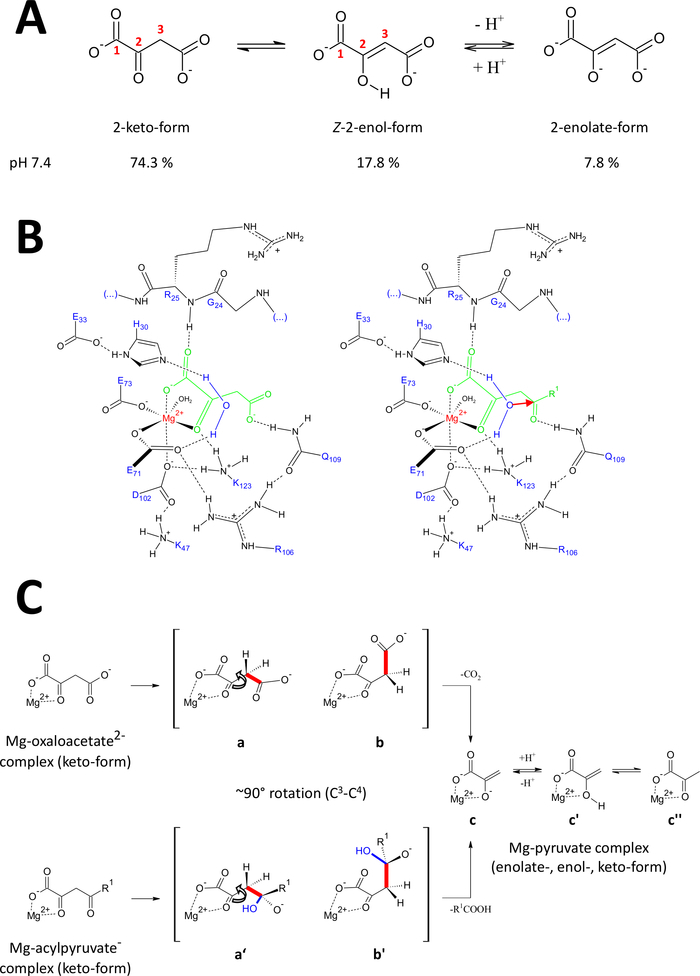
图 9:关于人类FAHD1的拟议催化机制的详情。
(A)氧化乙酸酯存在于晶体状态以及中性溶液中,主要存在于Z-enol形式24中。然而,在生理pH条件下,2-酮形式是主要表示25。(B) hFAHD1腔15的化学草图,含有Mg约束的甲氧乙酸酯(左)和丙烯酰胺(右,R1为有机休息;红色箭头表示相邻稳定水分子的核攻击)(见讨论)。(C) FAHD1的C 3-C4裂解(b至c)和氢酶(b'至c)机制的有利符合物的比较:这两种过程都会产生Mg复合丙酸酯(见讨论)。中间体 b 和 b' 预计将在 Q109 前稳定下来,如小组 B 中所勾画的(参见讨论)。请点击此处查看此图的较大版本。
FAHD1的脱卡苯酶活性
奥萨洛乙酸盐存在于晶体状态以及中性溶液中,主要存在于Z-enol形式24中。 但研究表明,在生理pH条件(缓冲区条件在pH7.4)中,2-酮形式是牛乙酸酯25(图9A)的主要表现,而脱脂不是脱脂性的先决条件27.值得注意的是,Mg2+离子对pH值为7.4或低于28的甲氧乙酸酯物种的比例没有影响。 将牛油酸酮形式转置到FAHD1的催化中心(由复合酶中的结合草酸盐(PDB:6FOG15)引导)显示残留Q109作为界形甲酸酯15的构象调节器。如另一条第15条所述,氢键与Q109的卡巴莫基组结合稳定了围绕C2-C3键旋转产生的氧化乙酸-构象(图9B,左侧面板)。由于这种旋转,C 3-C4键(待切)采用相对于 C 2-碳基的 α-轨道的接近正交处理(图9C)。二氧化碳可以释放。这个过程的主要产物是共振稳定,是丙酮的Mg-enolate。据了解,从牛乙酸酯-Mg复合物的调查,乙酸酯形成最稳定的复合物28,29。假设Mg-pyruv酸酯-亚洛感复合物具有可比稳定性,FAHD1的副因子可以被阻断,但碱残留物K123可以在平衡中质子中使丙酸酯-eno酸,以禁止失去副因子15。
给出的解释表明,在FAHD1的催化ODx函数中,苯丙胺作为一种独特的中间体。在假设模型中的此步骤中,实验数据没有进一步说明为什么关闭的盖子应该打开以释放产品。然而,可以推断出,拟议的机制看起来像一种酶抑制产品:晶体结构揭示了一个保存的水分子保持方向向FAHD1催化中心由残留H30和E33呈现在短螺旋15,这是诱导在配体结合和盖关闭。如果原发性烯醇与酯酸盐保持平衡,则谐振稳定化的enolate可以被水分子淬火以灭酸。由此产生的羟基将能够取代丙酮酸盐从Mg-cofactor上盖子将打开。最后,催化中心将在线粒体环境中恢复。在这个假设场景中,腔水分子将分别作为酸运行。
FAHD1的氢酶活性
一种酶的氢酶活性隐含地要求羟基核亲基的中期形成。这种机制通常与酸碱催化活性相结合。反应的过渡状态必须通过腔内的关键氨基酸侧链的构象控制来制备。与脱碳酶功能的讨论类似,将4碳基氧与Q109氢结合(图9B,右侧面板)以2酮形式结合的乙酰乙酰乙酸酯置于构象控制之下。草酸盐结合FAHD1(PDB:6FOG)的晶体结构揭示了一个保存水分子,其方向是向FAHD1催化中心方向,由残留H30和E33在短螺旋15中呈现。E33-H30 dyad 能够对定向定位水进行脱质子处理,所得的羟基是理想的配置,可攻击 Q109 15 Q10915在构象控制下呈现的 4 碳基。
值得注意的是,已为FAH18提出了类似的机制。羟基核友的攻击预计将导致一个氧化物种,在轨道控制C 3-C4键裂解(图9C)上稳定。在此模型中,C 3-C4键旋转(图 9C)发生在图 9B所示的成形羟基核攻击后(即,它为粘结裂解准备丙烯酰胺)。主要产品为醋酸和甲酸酯。在此假设场景中,醋酸可以淬火苯丙酸,并随后帮助产品位移。在pH7.5以上,在Mg离子的存在下,丙烯酸盐在酮状和烯醇形式之间处于平衡状态,后者略偏30。很可能这两种形式都能够在随后盖闭合下与FAHD1的联因结合。由于苯醇形式的扁平结构,酶的乙酰乙酰乙酸基质的加工受到阻碍。C3-C4裂解会导致无共振稳定的乙烯基卡巴宁。
因此,我们提出了一个催化酮化步骤,为对甲基碳基的羟基核亲子细胞的攻击做准备。然而,这种酮化过程需要控制FAHD1残留物的质子转位,这将把固有的异构酶活性归因于FAHD1。据报道,与未复合的28型氢相比,镁结合的苯氢的酸度增加了一万倍。通过未质子的K123,Mg结合的苯丙酮的脱制是可行的。K123的脱胶可以通过D102的卡盒酸盐辅助。由残留物D102-K47-K123形成的氢键网络可以在FAHD115的催化中心作为必要的质子继电器运行。然后,在基板15的基质基化下,E33-H30-H2 0三重轴可以淬火这种成型的中间体。2酮形式将受到Q109的构象控制,同时形成的羟基会攻击丙基碳基。总结讨论意味着对FAHD1的控制,即通过腔形成残留物的相互作用,在酸和碱之间切换的水分子。
方法的未来应用或方向
此处描述的方法的未来应用很多。大量FAH超级家族的原核成员仍在等待功能特征。甚至关于已知FAH超级家庭成员催化活动的现有信息也很少,在大多数情况下,都是基于理论假设,而不是基于实验数据。此处描述的方法适用于原核FAH超家族成员取决于细菌学的具体研究兴趣。另一方面,最近证明真核FAH超级家族成员在各种细胞隔间(例如,细胞醇与线粒体)中起着至关重要的作用,这突出表明需要更好地描述这些蛋白质的特征(其中三种是特别是由于目前的数据表明,一些未定性的蛋白质在线粒体生物学、衰老研究和癌症研究方面可能具有不同的功能。建议对这些真核FAH超级家族成员进行完整的分子和生理特征,为生物医学领域当代研究的主要领域提供重要的见解。需要对FAHD1(和相关酶)的机制进行更多的研究,以更好地了解FAHD1双功能背后的机制,但还没有完全澄清。对FAHD1突变体、NMR-调查和抑制剂复合物结构研究的其他研究可能有助于解决FAHD1似乎有能力的真正机械情景。此外,计算机辅助设计的能与Mg-cofactor结合的苯醇模拟,最终将导致FAHD1的强效抑制剂。
披露声明
作者没有什么可透露的,也没有宣布任何相互竞争的经济利益。H.G. 是分子工艺的CEOCSO.HuGs e.U.,并通过定制合成为本研究提供丙草酸盐。P.J.D.实验室的工作得到了奥地利科学基金(FWF)的支持:项目编号P 31582-B26。奥地利科学基金(FWF)在项目编号P 31582-B26下部分支付了该手稿的出版费。A. N. 和 B. R. 由奥地利科学基金(FWF)在P28395-B26项目下提供支持。
致谢
作者非常感谢安纳贝拉·皮特尔的专家技术援助和海莫·皮尔彻的试验方法开发。
材料
| Name | Company | Catalog Number | Comments |
| BL21(DE3) pLysS competent E. coli | Promega | L1195 | High-efficiency protein expression from gene with T7 promoter and ribosome binding site |
| pET E. coli T7 Expression Vectors | MERCK | - | http://www.merckmillipore.com/AT/de/life-science-research/genomic-analysis/dna-preparation-cloning/pet-expression-vectors/qFSb.qB.mLQAAAFA6.VkiQ0G,nav |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| 15 mL Falcon | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon | VWR | 734-0448 | centrifugal tubes |
| PS Cuvettes Spectrophotometer Semi-Micro | VWR | 30622-758 | VIS transparent cuvettes |
| UV Cuvettes Spectrophotometer Semi-Micro | VWR | 47727-024 | UV/VIS transparent cuvettes |
| isopropyl-β-D-thiogalactopyranosid (IPTG) | ROTH | 2316 | chemical used for induction of protein expression with the DE3/pET system |
| imidazole | ROTH | X998 | chemical used for elution of polyhistidine (6xHis) sequences from a nickel-charged affinity resin |
| Glass Econo-Column Columns | Bio-Rad | - | http://www.bio-rad.com/de-at/product/glass-econo-column-columns?ID=2cfb1c6e-32e8-4c72-b532-dd39013d707d&pcp_loc=catprod |
| chloramphenicol | Sigma-Aldrich | C0378 | antibiotic for bacterial growth selection; resistance endióded in pLysS plasmid of BL21(DE3) E. coli; 25 µg/mL final concentration |
| kanamycin | Sigma-Aldrich | 60615 | antibiotic for bacterial growth selection; to be used if this resistance is encoded in the employed pET vector; 50 µg/mL final concentration |
| ampicillin | Sigma-Aldrich | A1593 | antibiotic for bacterial growth selection; to be used if this resistance is encoded in the employed pET vector; 100 µg/mL final concentration |
| Ultra-15, MWCO 10 kDa | Sigma-Aldrich | Z706345 | centrifigal filters for protein enrichment; https://www.sigmaaldrich.com/catalog/product/sigma/z706345?lang=de®ion=AT |
| Ultra-0.5 Centrifugal Filter Units | Sigma-Aldrich | Z677108 | centrifigal filters for protein enrichment; https://www.sigmaaldrich.com/catalog/product/ALDRICH/Z677108?lang=de®ion=AT&cm_sp=Insite-_-prodRecCold_xviews-_-prodRecCold5-2 |
| oxaloacetic acid | Sigma-Aldrich | O4126 | TCA metabolite |
| sodium oxlalate | Sigma-Aldrich | 71800 | a competitive inhibitor of FAH superfamily enzymes |
| Dialysis tubing cellulose membrane | Sigma-Aldrich | D9277 | https://www.sigmaaldrich.com/catalog/product/sigma/d9277; or comparable |
| Ni-NTA agarose | Thermo-Fischer | R90101 | a nickel-charged affinity resin that can be used to purify recombinant proteins containing a polyhistidine (6xHis) sequence |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | https://www.thermofisher.com/order/catalog/product/26616?SID=srch-hj-26616 |
| ÄKTA FPLC system | GE Healthcare Life Sciences | - | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| HiTrap Phenyl HP column | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/it/shop/chromatography/prepacked-columns/hydrophobic-interaction/hitrap-phenyl-hp-p-05630 |
| Mono S 10/100 GL | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/ion-exchange/mono-s-cation-exchange-chromatography-column-p-00723 |
| Mono Q 10/100 GL | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/ion-exchange/mono-q-anion-exchange-chromatography-column-p-00608 |
| HiLoad Superdex column 75 pg (G75) | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/size-exclusion/hiload-superdex-75-pg-preparative-size-exclusion-chromatography-columns-p-05800 |
| HiLoad Superdex column 200 pg (G200) | GE Healthcare Life Sciences | - | https://www.gelifesciences.com/en/ch/shop/chromatography/prepacked-columns/size-exclusion/hiload-superdex-200-pg-preparative-size-exclusion-chromatography-columns-p-06283 |
| TECAN microplate reader | TECAN Life Sciences | - | https://lifesciences.tecan.com/microplate-readers |
| acetylpyruvate | MoleculeCrafting.HuGs e.U. | - | custom synthesis |
| benzoylpyruvate | MoleculeCrafting.HuGs e.U. | - | custom synthesis |
| VDX™ plate (24 wells) | Hampton | HR3-142 | 24 well plates used for crystallization via Hanging Drop Vapor Diffusion |
| paraffin oil | Hampton | HR3-411 | used for crystallization via Hanging Drop Vapor Diffusion |
| coverslips (22 mm) | Karl Hecht KG | 14043 | coverslips used for crystallization via Hanging Drop Vapor Diffusion |
| Luria broth (LB) medium | self-prepared | - | a general growth medium for E. coli: 5 g/L yeast extract; 10 g/L peptone from casein; 10 g/L sodium chloride; 12 g/L agar-agar |
| NZCYM medium | self-prepared | - | a better growth medium for E. coli, used for amplification: 10 g/L NZ amine; 5 g/L NaCl; 5 g/L yeast extract; 1 g/L casamino acids; 2 g/L MgSO4; adjust pH to 7.4 |
| Luria broth (LB) agarose plates | self-prepared | - | autoclaved agarose plates containing LB-medium and antibiotics for bacterial groth selection; https://www.addgene.org/protocols/pouring-lb-agar-plates/ |
| Ni-NTA running buffer | self-prepared | - | 20 mM Tris-HCl pH 7,4; 50-300 mM NaCl; 10-200 mM imidazole; ranges: optimal value varies among FAHD proteins |
| Ni-NTA elution buffer | self-prepared | - | 20 mM Tris-HCl pH 7,4; 50-300 mM NaCl; 200-500 mM imidazole; ranges: optimal value varies among FAHD proteins |
| HIC running buffer | self-prepared | - | 44 mM NaH2PO4; 6 mM Na2HPO4; 100 mM NaCl; 20 mM DTT; adjust to pH 7 |
| HIC running buffer AS | self-prepared | - | HIC running buffer saturated with ammonium sulfate (AS); adjust to pH 7: 70 g ammonium sulfate + 90 mL buffer, stirred overnight in the cold room; adjust to pH 7.0 |
| Mono S low salt buffer | self-prepared | - | 44 mM NaH2PO4; 6 mM Na2HPO4; 10-300 mM NaCl; ranges: optimal value varies among FAHD proteins |
| Mono S high salt buffer | self-prepared | - | 44 mM NaH2PO4; 6 mM Na2HPO4; 1-2 M NaCl; ranges: optimal value varies among FAHD proteins |
| Mono Q low salt buffer | self-prepared | - | 20 mM Tris-HCl; 15 mM NaCl; adjust to pH 8.0 |
| Mono Q high salt buffer | self-prepared | - | 20 mM Tris-HCl; 1 M NaCl; 10 % glycerol; adjust to pH 8.0 |
| G75 / G200 running buffer | self-prepared | - | 15 mM Tris-HCl; 300 mM NaCl; adjust to pH 7.4 |
| enzyme assay buffer | self-prepared | - | 50 mM Tris-HCl pH7.4; 100 mM KCl; 1 mM MgCl2 |
| protein crystallization buffer | self-prepared | - | G75 / G200 running buffer with 1 mM DTT |
| reservoir solution for crystallization | self-prepared | - | 100 mM Na-HEPES pH 7.5; 5-20 % (w/v) PEG4k; 10 mM-200 mM MgCl2 |
参考文献
- Brouns, S. J. J., et al. Structural Insight into Substrate Binding and Catalysis of a Novel 2-Keto-3-deoxy-d-arabinonate Dehydratase Illustrates Common Mechanistic Features of the FAH Superfamily. Journal of Molecular Biology. 379, 357-371 (2008).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure (London, England: 1993). 7, 1023-1033 (1999).
- Weiss, A. K. H., Loeffler, J. R., Liedl, K. R., Gstach, H., Jansen-Dürr, P. The fumarylacetoacetate hydrolase (FAH) superfamily of enzymes: multifunctional enzymes from microbes to mitochondria. Biochemical Society Transactions. 46, 295 (2018).
- Guimarães, S. L., et al. Crystal Structures of Apo and Liganded 4-Oxalocrotonate Decarboxylase Uncover a Structural Basis for the Metal-Assisted Decarboxylation of a Vinylogous β-Keto Acid. Biochemistry. 55, 2632 (2016).
- Zhou, N. Y., Fuenmayor, S. L., Williams, P. A. nag genes of Ralstonia (formerly Pseudomonas) sp. strain U2 encoding enzymes for gentisate catabolism. Journal of Bacteriology. 183, 700 (2001).
- Izumi, A., et al. Structure and Mechanism of HpcG, a Hydratase in the Homoprotocatechuate Degradation Pathway of Escherichia coli. Journal of Molecular Biology. 370, 899-911 (2007).
- Manjasetty, B. A., et al. X-ray structure of fumarylacetoacetate hydrolase family member Homo sapiens FLJ36880. Biological Chemistry. 385, 935-942 (2004).
- Tame, J. R. H., Namba, K., Dodson, E. J., Roper, D. I. The crystal structure of HpcE, a bifunctional decarboxylase/isomerase with a multifunctional fold. Biochemistry. 41, 2982-2989 (2002).
- Ran, T., et al. Crystal structures of Cg1458 reveal a catalytic lid domain and a common catalytic mechanism for the FAH family. The Biochemical Journal. 449, 51-60 (2013).
- Ran, T., Wang, Y., Xu, D., Wang, W. Expression, purification, crystallization and preliminary crystallographic analysis of Cg1458: A novel oxaloacetate decarboxylase from Corynebacterium glutamicum. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 67, 968-970 (2011).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286, 36500-36508 (2011).
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290, 6755-6762 (2015).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 – a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475, 3561-3576 (2018).
- Taferner, A., et al. FAH domain-containing protein 1 (FAHD-1) Is required for mitochondrial function and locomotion activity in C. elegans. PLoS ONE. 10, 1-15 (2015).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63, 792-794 (2007).
- Bateman, R. L., Bhanumoorthy, P., Witte, J. F., McClard, R. W., Grompe, M., Timm, D. E., et al. Mechanistic Inferences from the Crystal Structure of Fumarylacetoacetate Hydrolase with a Bound Phosphorus-based Inhibitor. Journal of Biological Chemistry. 276, 15284-15291 (2001).
- Zeng, F., et al. Efficient strategy for introducing large and multiple changes in plasmid DNA. Scientific Reports. 8, 1714 (2018).
- Higuchi, R., Krummel, B., Saiki, R. K. A general method of in vitro preparation and specific mutagenesis of DNA fragments: study of protein and DNA interactions. Nucleic Acids Research. 16, 7351-7367 (1988).
- Jansen-Duerr, P., Pircher, H., Weiss, A. K. H. The FAH Fold Meets the Krebs Cycle. Molecular Enzymology and Drug Targets. 2, 1-5 (2016).
- Rupp, B. Origin and use of crystallization phase diagrams. Acta Crystallographica Section F Structural Biology Communications. 71, 247-260 (2015).
- Rupp, B. . Biomolecular Crystallography: Principles, Practice, and Application to Structural Biology. , (2010).
- Flint, D. H., Nudelman, A., Calabrese, J. C., Gottlieb, H. E. Enol oxalacetic acid exists in the Z form in the crystalline state and in solution. The Journal of Organic Chemistry. 57, 7270-7274 (1992).
- Pogson, C. I. I., Wolfe, R. G. G. Oxaloacetic acid tautomeric and hydrated forms in solution. Biochemical and Biophysical Research Communications. 46, 1048-1054 (1972).
- Kost, T. A., Condreay, J. P., Jarvis, D. L., Kost, A. T. Baculovirus as versatile vectors for protein expression in insect and mammalian cells. Nature Biotechnology. 23, 567-575 (2005).
- Steinberger, R., Westheimer, F. H. Metal Ion-catalyzed Decarboxylation: A Model for an Enzyme System 1. Journal of the American Chemical Society. 73, 429-435 (1951).
- Tate, S. S., Grzybowski, A. K., Datta, S. P. The stability constants of the magnesium complexes of the keto and enol isomers of oxaloacetic acid at 25. Journal of Chemical Society. , 1381-1389 (1964).
- Tate, S. S., Grzybowski, A. K., Datta, S. P. The acid dissociations of the keto and enol isomers of oxaloacetic acid at 25. Journal of Chemical Society. 1372, 1380 (1964).
- Brecker, L., et al. Synthesis of 2,4-diketoacids and their aqueous solution structures. New Journal of Chemistry. 23, 437-446 (1999).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。