A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أداء العضلات الهيكلية البشرية Xenografts في الفئران نقص المناعة
In This Article
Summary
ويمكن أن تكون الأمراض البشرية المعقدة صعبة في نموذج النظم النموذجية المختبرية التقليدية. هنا، ونحن نصف النهج الجراحي لنموذج مرض العضلات البشرية من خلال زرع الخزعات العضلات الهيكلية البشرية في الفئران نقص المناعة.
Abstract
آثار العلاج التي لوحظت في الدراسات الحيوانية غالبا ما تفشل في تلخيصها في التجارب السريرية. وفي حين أن هذه المشكلة متعددة الأوجه، فإن أحد أسباب هذا الفشل هو استخدام نماذج مختبرية غير كافية. ومن الصعب وضع نموذج للأمراض البشرية المعقدة في الكائنات المختبرية التقليدية، ولكن يمكن التحايل على هذه المسألة من خلال دراسة xenografts البشرية. الطريقة الجراحية التي نصفها هنا يسمح لخلق العضلات والهيكل العظمي البشري xenografts، والتي يمكن استخدامها لنموذج مرض العضلات وإجراء الاختبارات العلاجية قبل السريرية. بموجب بروتوكول وافق عليه مجلس المراجعة المؤسسية (IRB)، يتم الحصول على عينات العضلات الهيكلية من المرضى ومن ثم زرعها في NOD-Rag1فارغةIL2rγnull (NRG) الفئران المضيفة. هذه الفئران هي المضيفين المثاليين لدراسات زرع بسبب عدم قدرتها على جعل الخلايا الليمفاوية ناضجة وبالتالي غير قادرة على تطوير الخلايا بوساطة والفكاهة الاستجابات المناعية التكيفية. يتم التخدير الفئران المضيفة مع isoflurane، وإزالة العضلات الطويلة الرقمي الفأر الأمامي والموسعة. ثم يتم وضع قطعة من العضلات البشرية في المقصورة الفارغة الساقية وخياطة إلى الأوتار القريبة والبعيدة من العضلات الطويلة البريونة. يتم الأوعية الدموية بشكل عفوي العضلات xenografted وinnervated من قبل المضيف الماوس, مما أدى إلى العضلات البشرية تجدد بقوة التي يمكن أن تكون بمثابة نموذج للدراسات ما قبل السريرية.
Introduction
وقد أفيد أن 13.8٪ فقط من جميع برامج تطوير الأدوية التي تخضع لتجارب سريرية ناجحة وتؤدي إلى العلاجات المعتمدة1. في حين أن معدل النجاح هذا أعلى من 10.4٪ التي تم الإبلاغ عنها سابقا2، لا يزال هناك مجال كبير للتحسين. أحد النهج لزيادة معدل نجاح التجارب السريرية هو تحسين النماذج المختبرية المستخدمة في البحوث ما قبل السريرية. تتطلب إدارة الغذاء والدواء (FDA) دراسات حيوانية لإظهار فعالية العلاج وتقييم السمية قبل المرحلة 1 من التجارب السريرية. ومع ذلك، غالبا ما يكون هناك توافق محدود في نتائج العلاج بين الدراسات الحيوانية والتجارب السريرية3. وبالإضافة إلى ذلك، فإن الحاجة إلى دراسات حيوانية قبل السريرية يمكن أن تكون حاجزا لا يمكن التغلب عليه للتنمية العلاجية في الأمراض التي تفتقر إلى نموذج حيواني مقبول، وهو ما يحدث في كثير من الأحيان بالنسبة للأمراض النادرة أو المتفرقة.
إحدى الطرق لنمذجة المرض البشري هي عن طريق زرع الأنسجة البشرية في الفئران التي تعاني من نقص المناعة لتوليد xenografts. هناك ثلاث مزايا رئيسية لنماذج xenograft: أولا، أنها يمكن أن تلخص التشوهات الوراثية والجينية المعقدة الموجودة في الأمراض البشرية التي قد لا تكون قابلة للاستنساخ في نماذج حيوانية أخرى. ثانياً، يمكن استخدام الجرافوجرافات لنمذجة الأمراض النادرة أو المتفرقة إذا كانت عينات المرضى متوفرة. ثالثا، xenografts نموذج المرض داخل نظام كامل في الجسم الحي. لهذه الأسباب، ونحن نفترض أن نتائج فعالية العلاج في نماذج xenograft هي أكثر عرضة للترجمة إلى التجارب في المرضى. وقد استخدمت بالفعل xenografts الورم البشري بنجاح لتطوير علاجات للسرطانات الشائعة، بما في ذلك الورم النقوي المتعدد، فضلا عن العلاجات الشخصية للمرضى الفردية4،5،6، 7.
في الآونة الأخيرة، وقد استخدمت xenografts لتطوير نموذج من أمراض العضلات البشرية8. في هذا النموذج، يتم زرع عينات خزعة العضلات البشرية في الأطراف الخلفية من الفئران NRG نقص المناعة لتشكيل xenografts. يموت الميوفيبر البشري المزروع، ولكن الخلايا الجذعية للعضلات البشرية الموجودة في xenograft في وقت لاحق توسيع وتمييز إلى myofibers الإنسان الجديد الذي يعيد ملء لامينا القاعدية البشرية engrafted. ولذلك، فإن myofibers مجددة في هذه xenografts هي الإنسان تماما ويتم تلقائيا إعادة الأوعية الدموية وinnervated من قبل المضيف الماوس. الأهم من ذلك، ضمور العضلات اللفافة (FSHD) أنسجة العضلات المريض زرعها في الفئران يلخص السمات الرئيسية للمرض البشري، وهي التعبير عن عامل النسخ DUX4 8. ويتسبب FSHD من الإفراط في التعبير عن DUX4، الذي يتم إسكاته جينيا في أنسجة العضلات الطبيعية9،10. في نموذج xenograft FSHD, وقد ثبت العلاج مع morpholino DUX4 محددة لقمع بنجاح التعبير DUX4 وظيفة, وقد يكون خيارا علاجيا محتملا للمرضى FSHD11. وتبين هذه النتائج أن xenografts العضلات البشرية هي نهج جديد لنموذج مرض العضلات البشرية واختبار العلاجات المحتملة في الفئران. هنا، ونحن نصف بالتفصيل الطريقة الجراحية لخلق العضلات والهيكل العظمي البشري xenografts في الفئران نقص المناعة.
Protocol
وقد وافق مجلس الاستعراض المؤسسي في جامعة جونز هوبكنز على جميع استخدامات عينات البحوث من البشر لحماية حقوق المشاركين ورفاههم. تمت الموافقة على جميع التجارب الحيوانية من قبل لجنة الرعاية والاستخدام الحيوانية المؤسسية التابعة لجامعة جونز هوبكنز (IACUC) وفقا ً لدليل المعاهد الوطنية للصحة (NIH) لرعاية واستخدام الحيوانات المختبرية. ذكر NOD-Rag1فارغةIL2rγnull (NRG) الفئران المضيفة (8-12 أسابيع من العمر) وتستخدم لإجراء تجارب xenograft. وتوجد هذه الفئران في رفوف مهواة وتعطى الهواء المفلتر والمعتدل والمرطب من HEPA، فضلا ً عن المياه الفائقة الكلور التي تمت تصفيتها من التناضح العكسي. يتم توفير الفئران المياه واتباع نظام غذائي المضادات الحيوية المشعة(جدول المواد)ad libitum، ويوفر المرفق 14 ساعة من الضوء إلى 10 ساعة من الظلام كما تسيطر عليها الموقت المركزي.
1. إعداد المعدات
- الحصول على NOD-Rag1فارغةIL2r γفارغة (NRG) الفئران، 8-12 أسابيع من العمر.
- الأوتوكلاف المعدات الجراحية: مقص، ملقط، حامل إبرة، دباسة الجراحية(جدول المواد)،مقاطع الجرح، مناديل جراحية(جدول المواد)،والكأس(الشكل 1A).
- إعداد 50 مل من وسائل الإعلام العضلات (20٪ مصل البقر الجنيني، 2٪ استخراج الجنين الفرخ، 1٪ مضاد حيوي / مضاد للنمو في Hams F10 المتوسطة). الحفاظ على جميع المواد الكيميائية / الأدوية / الحلول المستخدمة للجراحة في درجة حرارة الغرفة ما لم يذكر بشكل مختلف في البروتوكول.
- إعداد حقنة 1 مل مع إبرة 26 G التي هي 3/8 بوصة طويلة تحتوي على 2 ملغ / مل مسكن(جدول المواد)،ووضعها على الجليد. يمكن تخفيف مسكن إلى التركيز السليم باستخدام الفوسفات المعقمة المخزنة المالحة (PBS).
2. الإعداد الجراحي
- الحصول على خزعة العضلات البشرية بموجب بروتوكول وافق عليه IRB من المرضى الذين تظهر عضلاتهم قوة > 4-/5 على MRC (مجلس البحوث الطبية) مقياس12. ضع عينة البحث في طبق بيتري 100 مم × 15 مم يحتوي على وسائط العضلات.
ملاحظة: يتم استخدام مقياس MRC في الممارسة السريرية كتقييم لقوة العضلات مع 0 تظهر أي انكماش، 5 تظهر القوة الطبيعية، و 4 (4- إلى 4+) تظهر الحركة ضد المقاومة12. لقد وجدنا أن العضلات مع ضعف معتدل إلى معتدل (MRC > 4-5) تظهر عادة أمراض المرض ولكن لا يتم استبدالها على نطاق واسع من قبل الأنسجة الدهنية أو التليف، وكلاهما يعوق تجديد xenograft. في حالة أنسجة التشريح حيث درجة MRC الأخيرة غير متوفرة، يمكن الوصول إلى نوعية العضلات عن طريق المراقبة الإجمالية. الخزعات العضلية التي هي وردي شاحب في المظهر أو لديها مناطق واسعة من الأنسجة الدهنية ليس من المرجح أن xenograft بنجاح. - إزالة أي اللفافة المتبقية أو الأنسجة الدهنية من العينة مع مقص الجراحية باستخدام مجهر ستيريو ومصدر الضوء للمساعدة في التصور.
- تشريح خزعة العضلات إلى ما يقرب من 7 مم × 3 مم × 3 مم القطع مع مقص الجراحية باستخدام المجهر ستيريو ومصدر الضوء. تأكد من ترتيب الألياف طوليا داخل العينة.
- ضع طبق بيتري الذي يحتوي على العضلات المنسّلة على الجليد. في المتوسط، يتم الاحتفاظ xenografts في وسائل الإعلام لمدة 4 ساعات في حين يتم إجراء العمليات الجراحية. ومع ذلك، تم تخزين الخزعات في وسائل الإعلام لمدة 24 ساعة قبل xenografting، وهذا التأخير لا يبدو أن تؤثر سلبا على زرع أو تجديد.
- ضع الغرز الاصطناعية غير القابلة للامتصاص(جدول المواد)في طبق بيتري 100 مم × 15 مم يحتوي على 70٪ من الإيثانول.
- إنشاء دائرة التخدير الإجراء المزدوج: ترتيب دائرة التنفس القيقبسون E على المجهر ستيريو ووضع غرفة التعريفي في مجلس الوزراء السلامة البيولوجية(الشكل 1A،B).
- الحصول على وزن الماوس NRG عن طريق وضع في الكأس الأوتوكلاف على مقياس، ونقل إلى غرفة التعريفي. حث التخدير تحت 3٪ isoflurane. بمجرد تحقيق عمق التخدير المناسب - كما هو مُقيّم من خلال مراقبة معدل التنفس، واسترخاء العضلات، وعدم الحركة الطوعية - يقلل من إعداد المرذاذ إلى 1.5% لبقية الجراحة.
- نقل الماوس من غرفة الحث إلى دائرة التنفس القيقب وE وتطبيق مرهم العيون على العينين.
- إزالة الشعر فوق الساقية الأمامية (TA) من الكاحل إلى الركبة مع الانتهازي، تليها علاج 1 دقيقة مع غسول إزالة الشعر(جدول المواد)(الشكل 2A).
- تطهير الموقع الجراحي عن طريق مسح الساق مع محلول اليود البوفيدون. ثم يغسل ما تبقى من البوفيدون اليود مع 70٪ الإيثانول.
- حقن الماوس تحت الجلد مع مسكن، مثل كاربروفين،(جدول المواد)بجرعة 5 ملغ / كغ.
3. جراحة الترقيع
- الشريط أسفل الساق وجعل شق مستقيم على العضلات التيبلالية الأمامية (TA) مع مقص وملقط قزحية تنشأ في الأوتار البعيدة وتنتهي تحت الركبة(الشكل 2B).
- فصل الجلد عن العضلات باستخدام تشريح حادة مع مقص الجراحية.
- قطع من خلال epimysium من العضلات TA مع مقص بدءا من الوتر وتنتهي في الركبة.
ملاحظة: هذا هو قطع سطحية جدا (أقل من 0.5 ملم; الشكل 2B،خط متقطع أسود)، وTA الأساسية لا ينبغي أن تكون معطوبة في هذه العملية لأن هذا من شأنه أن يجعل إزالة أكثر تحديا. عند تنفيذها بشكل صحيح، فإن ألياف العضلات الاسترخاء بشكل واضح. - قطع الوتر القاصي من TA مع مقص، والاستيلاء على الوتر مع ملقط قزحية، وسحب TA حتى نحو الركبة(الشكل 2C).
- قطع الوتر القاصي للرقمية الموسعة longus (EDL) مع مقص وسحب EDL حتى نحو الركبة(الشكل 2D). مرة واحدة في وتر قريب من العضلات طول ية (PL) بيرونا، وإزالة EDL مع مقص(الشكل 2D، خط متقطع الأخضر).
- إزالة TA مع مقص(الشكل 2D،خط متقطع الأزرق) واستخدام مسح الجراحية مبللة مع PBS وضغط طفيف لتحقيق الهيموستاسي(الشكل 2E).
- خيط خياطة من خلال القريبة بيرونوس لونغوس (PL) وتر وتقليم، وترك ما يقرب من 1.5 بوصة من الخيط على جانبي الوتر(الشكل 2F).
- أداء النصف الأول من عقدة مربعة جراحية من يدين، ولكن لا تشديد: وهذا سوف تشكل دائرة. وضع xenograft في هذه الدائرة وتشديد حلقة لتأمين xenograft. إكمال النصف الآخر من عقدة مربعة(الشكل 2G،H). وهذا سوف خياطة xenograft إلى وتر قريب من PL.
- خياطة الموضوع من خلال وتر PL القاصي وتكرار تقنية عقدة مربعة من الخطوة 3.8 لربط xenograft إلى وتر القاصي(الشكل 2H،أنا).
ملاحظة: يمكن أن يكون الشريان المُرَكِّم والوريد على مقربة من الوتر القاصي للـ PL أو على أعلىه. لا تضع الغرز من خلال أو حول هذه السفن. فمن السهل معرفة ما إذا كان قد تم وضع خياطة بشكل غير صحيح كما الأوعية سوف بلانش أو تنزف. في حالة حدوث ذلك، قم بإزالة الخياطة وضعها في موقع مختلف. - سحب الجلد على العضلات xenografted، وختم مع الغراء الجراحية، ووضع 2-3 المواد الغذائية الجراحية على شق(الشكل 2J).
- وضع الماوس في قفص نظيف على لوحة ساخنة لاسترداد. مراقبة الماوس حتى واعية تماما وبشكل دوري على مدى الأيام القليلة القادمة لعلامات العدوى الجهازية المحلية وضمان عدم إعادة فتح الموقع الجراحي.
ملاحظة: جرعة واحدة من مسكن كما هو موضح في الخطوة 2.11 عادة ما تكون كافية لتخفيف الألم. ومع ذلك، ينبغي أيضا رصد الفئران للألم المستمر (على سبيل المثال عرجاء، معطف تكدرت، موقف حدس)، وإذا لزم الأمر، إعادة الدوس مع مسكن في 24 ح بعد العملية.
4. مجموعة Xenograft
ملاحظة: عادة ما يتم جمع Xenografts بين 4 إلى 6 أشهر بعد الجراحة. ومع ذلك، تم إجراء مجموعات تصل إلى 12 شهرا بعد الجراحة.
- ضع كوب مغطى يحتوي على 200 مل من 2-ميثيل بيوتان في صندوق يحتوي على الثلج الجاف لمدة لا تقل عن 30 دقيقة قبل جمع xenograft.
- حث التخدير تحت 3٪ isoflurane في غرفة الحث. بمجرد تحقيق عمق التخدير المناسب، تقليل إعداد المرذاذ إلى 1.5٪ لبقية الجراحة.
- نقل الماوس من غرفة التعريفي إلى دائرة التنفس القيقب E مرتبة على المجهر ستيريو.
- إزالة الشعر فوق الساقية الأمامية من الكاحل إلى الركبة مع الانتهازي وغسول إزالة الشعر. ويمكن رؤية الغرز التي تحمل xenograft في مكان من خلال الجلد(الشكل 3A).
- الشريط أسفل الساق واستخدام مقص وملقط قزحية لفتح الجلد على xenograft حتى كلا الغرز مرئية(الشكل 3B). يمكن إزالة الجلد فوق xenograft كما هو مبين لجعل إزالة xenograft أسهل.
- استخدام مشرط لقطع بين xenograft والساق(الشكل 3B، السهم يدل على الموقع الأولي واتجاه شق). هذا سيحرر جانب واحد من xenograft.
- استخدام مشرط لقطع بين العضلات PL والعضلات الجهاز الهضمي(الشكل 3C، أناncision على طول epimysium المسمى مع السهم). سيتم إزالة PL مع xenograft.
- قطع تحت خياطة القاصي ومن خلال وتر القاصي من PL(الشكل 3D،وقطع على طول خط منقط).
- إزالة xenograft وPL عن طريق الاستيلاء على خياطة مع ملقط قزحية وانحرافه نحو الركبة أثناء استخدام مقص لقطع بعيدا عن العضلات الكامنة(الشكل 3E).
- قطع فوق خياطة القريبة مع مقص لإزالة xenograft وPL(الشكل 3F،وقطع على طول خط منقط في 3E).
- وضع العينة على قطعة صغيرة من الورق المقوى أو البلاستيك، ودبوس أقرب إلى الغرز قدر الإمكان. أثناء تثبيت العينة، تمتد بلطف العضلات لضمان الحفاظ على اتجاه الألياف خلال عملية التجميد المفاجئة. بعد دبابيس بشكل آمن في مكان، حرك العضلات حتى دبابيس بحيث تقع فقط فوق الورق المقوى.
ملاحظة: بدلا من ذلك، يمكن تركيب نهاية واحدة من xenograft في tragacanth على الفلين، أو يمكن أن تكون مغمورة تماما في درجة حرارة القطع المثلى (O.C.T.) مركب في cryomold. مع الرعاية، يمكن الاحتفاظ بمطابقة العضلات مع كلا الأسلوبين. - التقط تجميد xenograft في تبريد هاقبل 2-ميثيلبيوتان.
- تخزين xenograft في -80 درجة مئوية.
- مباشرة بعد جمع xenograft، قتل الفئران وفقا للمبادئ التوجيهية للجمعية الطبية البيطرية الأمريكية:
- وضع الفئران في غرفة مختومة مع نظام النفايات المناسبة مسح الغاز. استخدام isoflurane بتركيز 3-4٪ للحث على التخدير.
- بمجرد تحقيق عمق التخدير المناسب - كما هو مُقيّم من خلال مراقبة معدل التنفس، واسترخاء العضلات، وعدم الحركة الطوعية - تزيد من إعداد المرذاذ إلى 5% للحث على الوفاة. ترك الفئران في الغرفة لمدة دقيقتين إضافية بعد توقف التنفس. يتم التحقق من الوفاة من خلال ملاحظة أن الفئران تفشل في التعافي في غضون 10 دقائق بعد جرعة زائدة من isoflurane.
- وأخيرا، إجراء خلع عنق الرحم على الفئران.
ملاحظة: في حالة الفئران xenografted ثنائيا، يمكن حفظ xenograft contralateral لجمع في وقت لاحق. لإجراء مجموعة البقاء على قيد الحياة، فتح الجلد فوق xenograft مع قطع واحد على التوالي مع مقص الجراحية، وإزالة xenograft كما هو موضح في الخطوات 4.6 إلى 4.10. ثم أغلق الجلد فوق المقصورة الفارغة باستخدام الغراء الجراحي والدبابيس. علاج الماوس مع مسكن كما هو موضح في الخطوة 2.11 ووضع الماوس في قفص نظيف على لوحة ساخنة لاسترداد. مراقبة الماوس حتى واعية تماما وبشكل دوري على مدى الأيام القليلة القادمة لعلامات العدوى الجهازية المحلية وضمان عدم إعادة فتح الموقع الجراحي.
5. الكيمياء المناعية Xenograft
- استخدام cryostat لقطع 10 إلى 12 أقسام ميكرومتر من xenograft التي تم جمعها على الشرائح المشحونة بشكل إيجابي(جدول المواد).
- ملء جرة تلطيخ مع الميثانول وقبل بارد في -20 درجة مئوية لمدة 30 دقيقة.
- ضع الشرائح في الميثانول البارد ة الجليد لمدة 10 دقائق لإصلاح وpermeabilize أقسام xenograft.
- ضع الشرائح في جرة تلطيخ وغسل 3X مع الفوسفات المخزنة المالحة (PBS) لمدة 5 دقائق.
- كتلة مع IgG المضادة للماوس(جدول المواد)لمدة 2 ساعة في 4 درجة مئوية.
- لطخة مع الأجسام المضادة الأولية، مثل spectrin، لامين A / C، وmyosin الجنينية(جدول المواد)في PBS تستكمل مع 2٪ مصل الماعز بين عشية وضحاها في 4 درجة مئوية.
- ضع الشرائح في جرة تلطيخ واغسل 3x مع الفوسفات المخزنة المالحة (PBS) لمدة 5 دقائق.
- وصمة عار مع الفلورسنت صبغ مترافق الأجسام المضادة الثانوية(جدول المواد)في PBS تستكمل مع 2٪ مصل الماعز لمدة 1 ساعة في درجة حرارة الغرفة.
- ضع الشرائح في جرة تلطيخ وغسل 3X مع الفوسفات المخزنة المالحة (PBS) لمدة 5 دقائق.
- وضع تصاعد المتوسطة(جدول المواد)على أقسام xenografts، وضع غطاء على رأس، واستخدام طلاء الأظافر لختم غطاء.
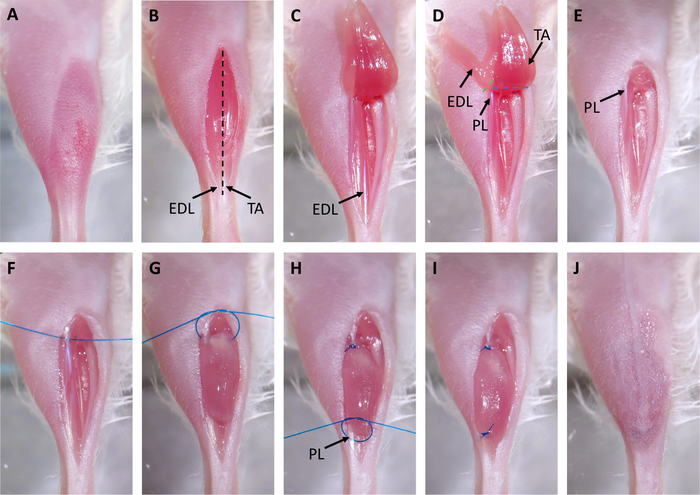
الشكل 2: جراحة الترقيع. (أ)تتم إزالة الشعر من الموقع الجراحي. (ب)يتم إجراء شق على الساقية الأمامية (TA). يتم وضع علامة على الأوتار البعيدة من TA والموسعة رقمي longus (EDL) مع الأسهم. يشير الخط المتقطع الأسود إلى المكان الذي سيتم فيه قطع الظهارة في الخطوة 3.3. (C)يتم قطع الوتر القاصي لTA ويتم سحب العضلات حتى الركبة. (د)يتم قطع وتر EDL ويتم سحب EDL تصل إلى الركبة. هذا يكشف الوتر القريب من طول العبة (PL) ملحوظ مع سهم. خطوط متقطعة تشير إلى مكان قطع مع مقص لإزالة EDL (الأخضر) وPL (الأزرق). (E)تتم إزالة EDL وTA. (F)يتم وضع خياطة من خلال وتر قريب من PL.(G)يتم وضع xenograft في مقصورة الساقية الفارغة وsutured إلى وتر PL القريبة باستخدام عقدة مربعة جراحية من يدين. (H)يتم وضع خياطة من خلال وتر القاصي من PL، ملحوظ مع سهم، ويستخدم عقدة أخرى من ناحيتين مربع الجراحية لخياطة xenograft إلى وتر القاصي. (I)يتم زرع xenograft بالكامل وخياطة إلى PL.(J)يتم إغلاق الجلد مع الغراء الجراحية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
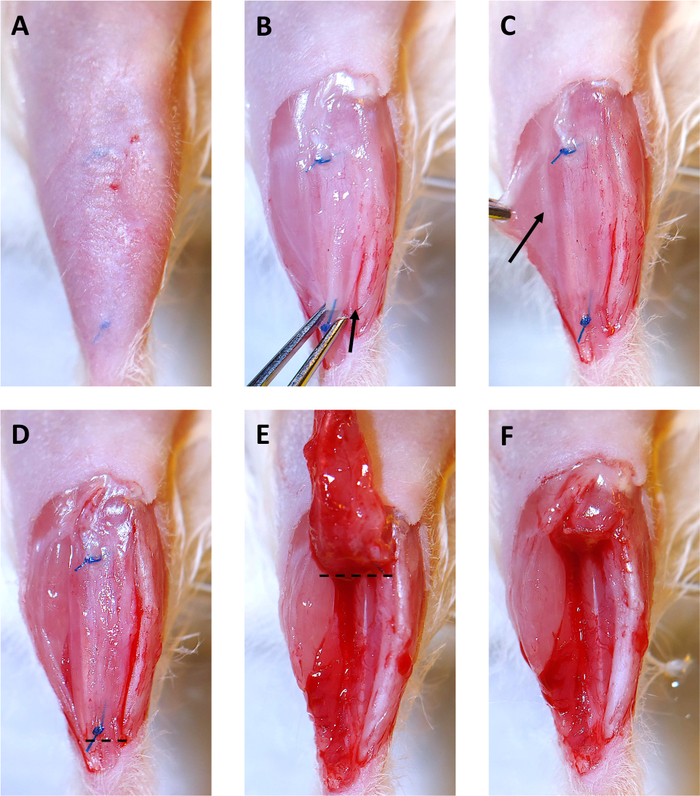
الشكل 3: مجموعة Xenograft لمدة 4 أشهر. (أ)تتم إزالة الشعر من الموقع الجراحي. الغرز مرئية تحت الجلد. (ب)تتم إزالة الجلد الذي يزيد على xenograft. ثم يتم الاستيلاء على xenograft مع ملقط قزحية في خياطة القاصي وسحبت بلطف صعودا. بدءا من الكاحل، يتم استخدام مشرط لقطع على طول الساق وتحرير xenograft. يظهر السهم بداية الشق على طول الساق. (C)عن طريق سحب العضلات المعدة إلى الجانب، خط أبيض خافت من epimysium فصل العضلات لونغوس (PL) والجهاز الهضمي (كما هو مبين من قبل السهم) يصبح مرئيا. استخدام مشرط لقطع على طول هذا الخط لفصل PL من عضلات الساق الأخرى. (D)الجانب الأيمن من xenograft، وPL هي الآن خالية من العضلات الأخرى في الساق وعلى استعداد لإزالة. خط متقطع يشير إلى أين قطع مع مقص الجراحية لبدء إزالة xenograft وPL.(E)بعد قطع تحت خياطة القاصي، وحرف xenograft نحو الركبة. يشير الخط المتقطع إلى مكان القطع بالمقص الجراحي لإزالة xenograft وPL من المقصورة الساقية. (F)تم إزالة المقصورة الفارغة ذات الجرافة وPL بنجاح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
كما يتضح من Yuanfan تشانغ وآخرون، وهذا البروتوكول الجراحي هو وسيلة مباشرة لإنتاج العضلات الهيكلية البشرية xenografts8. تصبح xenografts المجددة بشكل عفوي داخلي وعرض الانقباض الوظيفي. وبالإضافة إلى ذلك، فإن العضلات xenografted من المرضى FSHD يلخص التغيرات في التعبير الجيني لوحظ في المرضى FSHD
Discussion
xenografts المستمدة من المريض هي وسيلة مبتكرة لنموذج مرض العضلات وإجراء دراسات ما قبل السريرية. الطريقة الموضحة هنا لإنشاء xenografts العضلات الهيكلية سريعة ومباشرة، واستنساخ. يمكن إجراء العمليات الجراحية من جانب واحد في 15 إلى 25 دقيقة، أو ثنائيا في 30 إلى 40 دقيقة. يمكن أن توفر xenografts الثنائية مرونة ت?...
Disclosures
ويعلن صاحبا البلاغ أنهما ليس لديهما مصالح مالية متنافسة.
Acknowledgements
وقد حظيت هذه الأعمال بدعم من رابطة استئصال الميوست ومؤسسة بيتر باك. نود أن نشكر الدكتورة يوانفان تشانغ على مشاركتها خبرتها وتدريبها في تقنية xenograft الجراحية.
Materials
| Name | Company | Catalog Number | Comments |
| 100 mm x 15 mm Petri dish | Fisher Scientific | FB0875712 | |
| 2-Methylbutane | Fisher | O3551-4 | |
| 20 mm x 30 mm micro cover glass | VWR | 48393-151 | |
| Animal Weighing Scale | Kent Scientific | SCL- 1015 | |
| Antibiotic-Antimycotic Solution | Corning, Cellgro | 30-004-CI | |
| AutoClip System | F.S.T | 12020-00 | |
| Castroviejo Needle Holder | F.S.T | 12565-14 | |
| Chick embryo extract | Accurate | CE650TL | |
| CM1860 UV cryostat | Leica Biosystems | CM1860UV | |
| Coplin staining jar | Thermo Scientific | 19-4 | |
| Dissection Pins | Fisher Scientific | S13976 | |
| Dry Ice - pellet | Fisher Scientific | NC9584462 | |
| Embryonic Myosin antibody | DSHB | F1.652 | recommended concentration 1:10 |
| Ethanol | Fisher Scientific | 459836 | |
| Fetal Bovine Serum | GE Healthcare Life Sciences | SH30071.01 | |
| Fiber-Lite MI-150 | Dolan-Jenner | Mi-150 | |
| Forceps | F.S.T | 11295-20 | |
| Goat anti-mouse IgG1, Alexa Fluor 488 | Invitrogen | A-21121 | recommended concentration 1:500 |
| Goat anti-mouse IgG2b, AlexaFluor 594 | Invitrogen | A-21145 | recommended concentration 1:500 |
| Gum tragacanth | Sigma | G1128 | |
| Hams F-10 Medium | Corning | 10-070-CV | |
| Histoacryl Blue Topical Skin Adhesive | Tissue seal | TS1050044FP | |
| Human specific lamin A/C antibody | Abcam | ab40567 | recommended concentration 1:50-1:100 |
| Human specific spectrin antibody | Leica Biosystems | NCLSPEC1 | recommended concentration 1:20-1:100 |
| Induction Chamber | VetEquip | 941444 | |
| Iris Forceps | F.S.T | 11066-07 | |
| Irradiated Global 2018 (Uniprim 4100 ppm) | Envigo | TD.06596 | Antibiotic rodent diet to protect again respiratory infections |
| Isoflurane | MWI Veterinary Supply | 502017 | |
| Kimwipes | Kimberly-Clark | 34155 | surgical wipes |
| Mapleson E Breathing Circuit | VetEquip | 921412 | |
| Methanol | Fisher Scientific | A412 | |
| Mobile Anesthesia Machine | VetEquip | 901805 | |
| Mouse on Mouse Basic Kit | Vector Laboratories | BMK-2202 | mouse IgG blocking reagent |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| NAIR Hair remover lotion/oil | Fisher Scientific | NC0132811 | |
| NOD-Rag1null IL2rg null (NRG) mice | The Jackson Laboratory | 007799 | 2 to 3 months old |
| O.C.T. Compound | Fisher Scientific | 23-730-571 | |
| Oxygen | Airgas | OX USPEA | |
| PBS (phosphate buffered saline) buffer | Fisher Scientific | 4870500 | |
| Povidone Iodine Prep Solution | Dynarex | 1415 | |
| ProLong™ Gold Antifade Mountant | Fisher Scientific | P10144 (no DAPI); P36935 (with DAPI) | |
| Puralube Ophthalmic Ointment | Dechra | 17033-211-38 | |
| Rimadyl (carprofen) injectable | Patterson Veterinary | 10000319 | surgical analgesic, administered subcutaneously at a dose of 5 mg/kg |
| Scalpel Blades - #11 | F.S.T | 10011-00 | |
| Scalpel Handle - #3 | F.S.T | 10003-12 | |
| Stereo Microscope | Accu-scope | 3075 | |
| Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Suture, Synthetic, Non-Absorbable, 30 inches long, CV-11 needle | Covidien | VP-706-X | |
| 1ml Syringe (26 gauge, 3/8 inch needle) | BD Biosciences | 329412 | |
| Trimmer | Kent Scientific | CL9990-KIT | |
| Vannas Spring Scissors, 8.0 mm cutting edge | F.S.T | 15009-08 | |
| VaporGaurd Activated Charcoal Filter | VetEquip | 931401 | |
| Wound clips, 9 mm | F.S.T | 12022-09 |
References
- Wong, C. H., Siah, K. W., Lo, A. W. Estimation of clinical trial success rates and related parameters. Biostatistics. , 1-14 (2018).
- Hay, M., Thomas, D. W., Craighead, J. L., Economides, C., Rosenthal, J. Clinical development success rates for investigational drugs. Nature Biotechnology. 32, 40-51 (2014).
- Perel, P., et al. Comparison of treatment effects between animal experiments and clinical trials: systematic review. BMJ. 334, 1-6 (2007).
- Rubio-Viqueira, B., Hidalgo, M. Direct in vivo xenograft tumor model for predicting chemotherapeutic drug response in cancer patients. Clinical Pharmacology Therapeutics. 85, 217-221 (2009).
- Roberts, K. G., et al. Targetable Kinase-Activating Lesions in Ph-like Acute Lymphoblastic Leukemia. New England Journal of Medicine. 371, 1005-1015 (2014).
- Kim, J., et al. GDF11 Controls the Timing of Progenitor Cell Competence in Developing Retina. Science. 308, 1927-1930 (2005).
- Sako, D., et al. Characterization of the ligand binding functionality of the extracellular domain of activin receptor type IIB. Journal of Biological Chemisty. 285, 21037-21048 (2010).
- Zhang, Y., et al. Human skeletal muscle xenograft as a new preclinical model for muscle disorders. Human Molecular Genetics. 23, 3180-3188 (2014).
- Gabellini, D., Green, M. R., Tupler, R. Inappropriate Gene Activation in FSHD : A Repressor Complex Binds a Chromosomal Repeat Deleted in Dystrophic Muscle. Cell. 110, 339-348 (2002).
- Lemmers, R. J. L. F., et al. A Unifying Genetic Model for Facioscapulohumeral Muscular Dystrophy. Science. 329, 1650-1654 (2010).
- Chen, J. C. J., et al. Morpholino-mediated Knockdown of DUX4 Toward Facioscapulohumeral Muscular Dystrophy Therapeutics. Molecular Therapy. 24, 1405-1411 (2016).
- Medical Research Council. . Aids to the investigation of the peripheral nervous system. , (1943).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21, 2348-2356 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved