Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Realización de Xenoinjertos musculares esqueléticos humanos en ratones inmunodeficientes
En este artículo
Resumen
Las enfermedades humanas complejas pueden ser difíciles de modelar en los sistemas de modelos de laboratorio tradicionales. Aquí, describimos un enfoque quirúrgico para modelar la enfermedad muscular humana a través del trasplante de biopsias musculares esqueléticas humanas en ratones inmunodeficientes.
Resumen
Los efectos del tratamiento observados en estudios con animales a menudo no se recapitulan en ensayos clínicos. Si bien este problema es multifacético, una de las razones de este fallo es el uso de modelos de laboratorio inadecuados. Es difícil modelar enfermedades humanas complejas en organismos de laboratorio tradicionales, pero esta cuestión puede eludirse mediante el estudio de xenoinjertos humanos. El método quirúrgico que describimos aquí permite la creación de xenoinjertos musculares esqueléticos humanos, que se pueden utilizar para modelar la enfermedad muscular y para llevar a cabo pruebas terapéuticas preclínicas. Bajo un protocolo aprobado por la Junta de Revisión Institucional (IRB), las muestras de músculo esquelético se adquieren de los pacientes y luego se trasplantan en ratones huésped NOD-Rag1nullIL2r. Estos ratones son huéspedes ideales para estudios de trasplante debido a su incapacidad para producir linfocitos maduros y, por lo tanto, son incapaces de desarrollar respuestas inmunitarias adaptativas mediadas por células y humorales. Los ratones huésped son anestesiados con isoflurano, y se eliminan los músculos del ratón tibialis anterior y digitorum longus extensor. Luego se coloca un pedazo de músculo humano en el compartimento tibial vacío y se sutura a los tendones proximales y distales del músculo peroneus longus. El músculo xenoinjerado es vascularizado e inervado espontáneamente por el huésped del ratón, lo que resulta en un músculo humano robusto mente regenerado que puede servir como modelo para estudios preclínicos.
Introducción
Se ha informado que sólo 13.8% de todos los programas de desarrollo de fármacos sometidos a ensayos clínicos son exitosos y conducen a terapias aprobadas1. Si bien esta tasa de éxito es superior al 10,4% reportado anteriormente2, todavía hay un margen significativo de mejora. Un enfoque para aumentar la tasa de éxito de los ensayos clínicos es mejorar los modelos de laboratorio utilizados en la investigación preclínica. La Administración de Alimentos y Medicamentos (FDA) requiere estudios en animales para mostrar la eficacia del tratamiento y evaluar la toxicidad antes de los ensayos clínicos de fase 1. Sin embargo, a menudo hay una concordancia limitada en los resultados del tratamiento entre los estudios en animales y los ensayos clínicos3. Además, la necesidad de estudios preclínicos en animales puede ser una barrera insuperable para el desarrollo terapéutico en enfermedades que carecen de un modelo animal aceptado, que a menudo es el caso de enfermedades raras o esporádicas.
Una forma de modelar enfermedades humanas es trasplantando tejido humano en ratones inmunodeficientes para generar xenoinjertos. Hay tres ventajas clave para los modelos de xenoinjerto: en primer lugar, pueden recapitular las complejas anomalías genéticas y epigenéticas que existen en la enfermedad humana que pueden nunca ser reproducibles en otros modelos animales. En segundo lugar, los xenoinjertos se pueden utilizar para modelar enfermedades raras o esporádicas si hay muestras de pacientes disponibles. En tercer lugar, los xenoinjertos modelan la enfermedad dentro de un sistema in vivo completo. Por estas razones, hipotetizar que los resultados de eficacia del tratamiento en modelos de xenoinjerto son más propensos a traducirse en ensayos en pacientes. Los xenoinjertos tumorales humanos ya se han utilizado con éxito para desarrollar tratamientos para cánceres comunes, incluyendo mieloma múltiple, así como terapias personalizadas para pacientes individuales4,5,6, 7.
Recientemente, xenoinjertos se han utilizado para desarrollar un modelo de enfermedad muscular humana8. En este modelo, las muestras de biopsia muscular humana se trasplantan en las extremidades posteriores de ratones NRG inmunodeficientes para formar xenoinjertos. Las miofibers humanas trasplantadas mueren, pero las células madre musculares humanas presentes en el xenoinjerto posteriormente se expanden y diferencian en nuevas miofibers humanas que repoblan la lámina basal humana injertada. Por lo tanto, las miofibers regeneradas en estos xenoinjertos son completamente humanas y son espontáneamente revascularizadas e inervadas por el huésped del ratón. Es importante destacar que el tejido muscular del paciente trasplantado en ratones recapitula las características clave de la enfermedad humana, a saber, la expresión del factor de transcripción DUX4 8. La FSHD es causada por la sobreexpresión de DUX4, que se silencia epigenéticamente en el tejido muscular normal9,10. En el modelo de xenoinjerto FSHD, se ha demostrado que el tratamiento con un mortorfino específico de DUX4 reprime con éxito la expresión y la función de DUX4, y puede ser una opción terapéutica potencial para los pacientes con FSHD11. Estos resultados demuestran que los xenoinjertos musculares humanos son un nuevo enfoque para modelar la enfermedad muscular humana y probar posibles terapias en ratones. Aquí, describimos en detalle el método quirúrgico para crear xenoinjertos musculares esqueléticos humanos en ratones inmunodeficientes.
Protocolo
Todo uso de especímenes de investigación de sujetos humanos fue aprobado por la Junta de Revisión Institucional de Johns Hopkins (IRB) para proteger los derechos y el bienestar de los participantes. Todos los experimentos con animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Johns Hopkins (IACUC) de acuerdo con la Guía de los Institutos Nacionales de Salud (NIH) para el Cuidado y Uso de Animales de Laboratorio. Los ratones host nulantes (NRG) no-varones NOD-Rag1nulos (NRG) (8-12 semanas de edad) se utilizan para llevar a cabo experimentos de xenoinjerto. Estos ratones se alojan en estantes ventilados y reciben aire filtrado, templado y humidificado por HEPA, así como agua hiperclorada filtrada por ósmosis inversa. A los ratones se les proporciona agua y una dieta antibiótica irradiada(Tabla de Materiales)ad libitum, y la instalación proporciona 14 h de luz a 10 h de oscuridad según lo controlado por el temporizador central.
1. Preparación del equipo
- Adquirir noD-Rag1nullIL2r -null (NRG) ratones, 8-12 semanas de edad.
- Equipo quirúrgico de autoclave: tijeras, fórceps, porta agujas, grapadora quirúrgica(Tabla de materiales),clips de heridas, toallitas quirúrgicas(Tabla de materiales)y vaso de precipitados(Figura 1A).
- Preparar 50 ml de medios musculares (20% suero bovino fetal, 2% extracto de embrión de polluelo, 1% antibiótico/antimicótico en El medio Hams F10). Mantenga todos los productos químicos/drogas/soluciones utilizados para la cirugía a temperatura ambiente a menos que se indique de manera diferente en el protocolo.
- Prepare una jeringa de 1 ml con una aguja de 26 G de 3/8 pulgadas de largo que contenga 2 mg/ml de analgésico(Tabla de materiales)y colóquela sobre hielo. El analgésico se puede diluir a la concentración adecuada utilizando solución salina tamponada de fosfato estéril (PBS).
2. Preparación quirúrgica
- Obtener una biopsia muscular humana bajo un protocolo aprobado por el IRB de pacientes cuyos músculos muestran fuerza > 4-/5 en la escala12de MRC (Consejo de Investigación Médica). Coloque el espécimen de investigación en una placa Petri de 100 mm x 15 mm que contenga medios musculares.
NOTA: La escala MRC se utiliza en la práctica clínica como una evaluación de la fuerza muscular con 0 que no muestra contracción, 5 que muestran potencia normal, y 4 (4- a 4+) mostrando movimiento contra la resistencia12. Hemos encontrado que los músculos con debilidad leve a moderada (MRC > 4-/5) suelen mostrar patología de la enfermedad, pero no son reemplazados ampliamente por tejido graso o fibrosis, que impiden la regeneración del xenoinjerto. En el caso del tejido de la autopsia donde no se dispone de una puntuación reciente de MRC, se puede acceder a la calidad muscular a través de la observación bruta. Las biopsias musculares que son de color rosa pálido en apariencia o tienen grandes áreas de tejido graso no son propensos a xenoinjerto con éxito. - Retire cualquier fascia o tejido graso restante de la muestra con tijeras quirúrgicas utilizando un microscopio estéreo y una fuente de luz para ayudar a la visualización.
- Diseccionar la biopsia muscular en piezas de aproximadamente 7 mm x 3 mm x 3 mm con tijeras quirúrgicas utilizando el microscopio estéreo y una fuente de luz. Asegúrese de que las fibras estén dispuestas longitudinalmente dentro de la muestra.
- Coloque el plato Petri que contiene músculo diseccionado sobre hielo. En promedio, los xenoinjertos se mantienen en los medios durante 4 horas mientras se realizan cirugías. Sin embargo, las biopsias se han almacenado en medios durante 24 horas antes de la xenosauna, y este retraso no pareció afectar negativamente el trasplante o la regeneración.
- Coloque suturas sintéticas no absorbibles(Tabla de materiales)en una placa Petri de 100 mm x 15 mm que contenga 70% de etanol.
- Configure un circuito de anestesia de doble procedimiento: organice el circuito respiratorio Mapleson E en el microscopio estéreo y coloque la cámara de inducción en un gabinete de bioseguridad(Figura 1A,B).
- Obtenga el peso del ratón NRG colocando un vaso de precipitados autoclave en una báscula y transfiera a la cámara de inducción. Inducir la anestesia por debajo del 3% de isoflurano. Una vez que se alcanza la profundidad anestésica adecuada, según se evalúa mediante la observación de la frecuencia respiratoria, la relajación muscular y la falta de movimiento voluntario, reducir el ajuste del vaporizador al 1,5% para el resto de la cirugía.
- Transfiera el ratón de la cámara de inducción al circuito respiratorio Mapleson E y aplique pomada oftálmica a los ojos.
- Retire el cabello que cubre los tibialis anteriores (TA) del tobillo a la rodilla con una recortadora, seguido de un tratamiento de 1 min con loción de depilación(Tabla de Materiales)(Figura 2A).
- Desinfectar el sitio quirúrgico frotando la pierna con solución de povidona-yodo. A continuación, lave el resto de povidona-yodo con 70% de etanol.
- Inyectar el ratón por vía subcutánea con analgésico, como carprofeno,(Tabla de materiales)a una dosis de 5 mg/kg.
3. Cirugía de xenoinjerto
- Tape la pierna y haga una incisión recta sobre el músculo tibilalis anterior (TA) con tijeras y fórceps del iris que se originan en los tendones distales y terminan por debajo de la rodilla(Figura 2B).
- Separe la piel del músculo usando disección contundente con tijeras quirúrgicas.
- Cortar a través del epimisio del músculo TA con tijeras comenzando en el tendón y terminando en la rodilla.
NOTA: Se trata de un corte muy superficial (menos de 0,5 mm; Figura 2B,línea discontinua negra), y el TA subyacente no debe dañarse en el proceso, ya que esto haría que la eliminación sea más difícil. Cuando se realiza correctamente, las fibras musculares se relajarán visiblemente. - Cortar el tendón distal de la TA con tijeras, agarrar el tendón con fórceps de iris, y tirar de la TA hacia arriba hacia la rodilla (Figura 2C).
- Cortar el tendón distal del extensor digitorum longus (EDL) con tijeras y tirar de la EDL hacia arriba hacia la rodilla (Figura 2D). Una vez que el tendón proximal del músculo peroneus longus (PL) sea visible, retire el EDL con tijeras(Figura 2D, línea discontinua verde).
- Retire el TA con tijeras(Figura 2D,línea discontinua azul) y utilice una toallita quirúrgica humedecida con PBS y una ligera presión para lograr la hemostasis(Figura 2E).
- Enrosque una sutura a través del tendón y el guarnecido de peroneus longus proximal (PL), dejando aproximadamente 1,5 pulgadas de rosca a cada lado del tendón(Figura 2F).
- Realice la primera mitad de un nudo cuadrado quirúrgico de dos manos, pero no apriete: esto formará un círculo. Coloque un xenoinjerto en este círculo y apriete el lazo para asegurar el xenoinjerto. Complete la otra mitad del nudo cuadrado(Figura 2G,H). Esto suturará el xenoinjerto al tendón proximal del PL.
- Sutura de rosca a través del tendón PL distal y repetir la técnica de nudo cuadrado del paso 3.8 para atar el xenoinjerto al tendón distal(Figura 2H,I).
NOTA: La arteria tarsal medial y la vena pueden estar cerca o encima del tendón distal del PL. No coloque suturas a través o alrededor de estos recipientes. Es fácil saber si una sutura ha sido colocada incorrectamente como los vasos se blanquearán o sangrarán. Si esto ocurre, quite la sutura y colóquela en una ubicación diferente. - Tire de la piel sobre el músculo xenointizado, selle con pegamento quirúrgico y coloque 2-3 grapas quirúrgicas sobre la incisión(Figura 2J).
- Coloque el ratón en una jaula limpia sobre una almohadilla calentada para recuperarse. Supervise el ratón hasta que esté completamente consciente y periódicamente durante los próximos días en busca de signos de infección sistémica local y para asegurarse de que el sitio quirúrgico no se vuelva a abrir.
NOTA: Una dosis única de analgésico como se describe en el paso 2.11 es típicamente suficiente para aliviar el dolor. Sin embargo, los ratones también deben ser monitorizados para el dolor persistente (por ejemplo, cojera, capa con volantes, postura encorvada) y, si es necesario, re-dosificado con analgésico a 24 h postoperatorio.
4. Colección Xenograft
NOTA: Los xenoinjertos se recogen típicamente entre 4 y 6 meses después de la cirugía. Sin embargo, las colecciones se han realizado hasta 12 meses después de la cirugía.
- Colocar un vaso de precipitados cubierto que contenga 200 ml de 2-metilbutano en una caja que contenga hielo seco durante un mínimo de 30 minutos antes de la recolección del xenoinjerto.
- Inducir anestesia por debajo del 3% de isoflurano en la cámara de inducción. Una vez alcanzada la profundidad anestésica adecuada, reduzca el ajuste del vaporizador al 1,5% para el resto de la cirugía.
- Transfiera el ratón de la cámara de inducción al circuito respiratorio Mapleson E dispuesto en un microscopio estéreo.
- Retire el cabello que cubre los tibialis anteriores desde el tobillo hasta la rodilla con una recortadora y una loción de depilación. Las suturas que sostienen el xenoinjerto en su lugar se pueden ver a través de la piel(Figura 3A).
- Tape la pierna y use tijeras y fórceps de iris para abrir la piel sobre el xenoinjerto hasta que ambas suturas estén visibles(Figura 3B). La piel que cubre el xenoinjerto se puede eliminar como se muestra para facilitar la extracción del xenoinjerto.
- Utilice un bisturí para cortar entre el xenoinjerto y la tibia(Figura 3B,flecha denota el sitio inicial y la dirección de la incisión). Esto liberará un lado del xenoinjerto.
- Utilice un bisturí para cortar entre el músculo PL y el músculo gastrocnemius(Figura 3C, incision a lo largo del epimisio etiquetado con flecha). El PL se eliminará con el xenoinjerto.
- Corte por debajo de la sutura distal y a través del tendón distal del PL(Figura 3D,corte a lo largo de la línea punteada).
- Retire el xenoinjerto y pl agarrando la sutura con fórceps de iris y desvelándolo hacia la rodilla mientras usa tijeras para cortarlo del músculo subyacente(Figura 3E).
- Corte por encima de la sutura proximal con tijeras para eliminar el xenoinjerto y PL(Figura 3F,corte a lo largo de la línea punteada en 3E).
- Coloque la muestra sobre un pequeño trozo de cartón o plástico, y pin lo más cerca posible de las suturas. Mientras fija la muestra, estire suavemente el músculo para asegurarse de que la orientación de la fibra se mantiene durante el proceso de congelación rápida. Después de que los pines estén firmemente en su lugar, deslice el músculo hacia arriba de los pines para que se apoye justo encima del cartón.
NOTA: Alternativamente, un extremo del xenoinjerto se puede montar en tragacanto en un corcho, o puede sumergirse completamente en la temperatura de corte óptima (O.C.T.) compuesto en un criomold. Con cuidado, la conformación muscular se puede retener con ambos métodos. - Congele el xenoinjerto en 2-metilbutano preenfriado.
- Conservar el xenoinjerto a -80oC.
- Inmediatamente después de la recolección de xenoinjertos, eutanasia ratones de acuerdo con las directrices de la Asociación Médica Veterinaria Americana:
- Coloque ratones en una cámara sellada con un sistema de barrido de gas residual adecuado. Use isoflurano a una concentración de 3-4% para inducir anestesia.
- Una vez que se alcanza la profundidad anestésica adecuada, según se evalúa mediante la observación de la frecuencia respiratoria, la relajación muscular y la falta de movimiento voluntario, aumentan el ajuste del vaporizador al 5% para inducir la muerte. Deje a los ratones en la cámara durante 2 minutos adicionales después de que la respiración haya cesado. La muerte se verifica observando que los ratones no se recuperan dentro de los 10 minutos después de la sobredosis de isoflurano.
- Finalmente, realice la luxación cervical en los ratones.
NOTA: En el caso de ratones xenoinjertados bilateralmente, el xenoinjerto contralateral se puede guardar para una recolección posterior. Para realizar una colección de supervivencia, abra la piel que cubre el xenoinjerto con un solo corte recto con tijeras quirúrgicas, y retire el xenoinjerto como se describe en los pasos 4.6 a 4.10. A continuación, cierre la piel sobre el compartimento tibial vacío con pegamento quirúrgico y grapas. Trate el ratón con analgésico como se describe en el paso 2.11 y coloque el ratón en una jaula limpia en una almohadilla calentada para recuperarlo. Supervise el ratón hasta que esté completamente consciente y periódicamente durante los próximos días en busca de signos de infección sistémica local y para asegurarse de que el sitio quirúrgico no se vuelva a abrir.
5. Inmunohistoquímica de Xenoinjerto
- Utilice un criostato para cortar secciones de 10 a 12 m del xenoinjerto recogido en diapositivas cargadas positivamente(Tabla de materiales).
- Llene el frasco de tinción con metanol y preenfríe a -20 oC durante 30 min.
- Coloque los portaobjetos en metanol helado durante 10 minutos para fijar y permeabilizar las secciones de xenoinjerto.
- Coloque los portaobjetos en el frasco de tinción y lave 3 veces con solución salina tamponada de fosfato (PBS) durante 5 min.
- Bloquear con IgG antiratón(Tabla de Materiales)durante 2 h a 4oC.
- Blot con anticuerpos primarios, tales como espectrina, lamina A/C, y miosinembriones embrionarios(Tabla de Materiales)en PBS complementado con 2% de suero de cabra durante la noche a 4 oC.
- Coloque los portaobjetos en un frasco de tinción y lave 3 veces con solución salina tamponada de fosfato (PBS) durante 5 min.
- Blot con anticuerpos secundarios conjugados con colorante fluorescente(Tabla de Materiales)en PBS complementado con 2% de suero de cabra durante 1 h a temperatura ambiente.
- Coloque los portaobjetos en el frasco de tinción y lave 3 veces con solución salina tamponada de fosfato (PBS) durante 5 min.
- Coloque el medio de montaje(Tabla de materiales)sobre las secciones de xenoinjertos, coloque el cubreobjetos en la parte superior y use esmalte de uñas para sellar la cubierta.
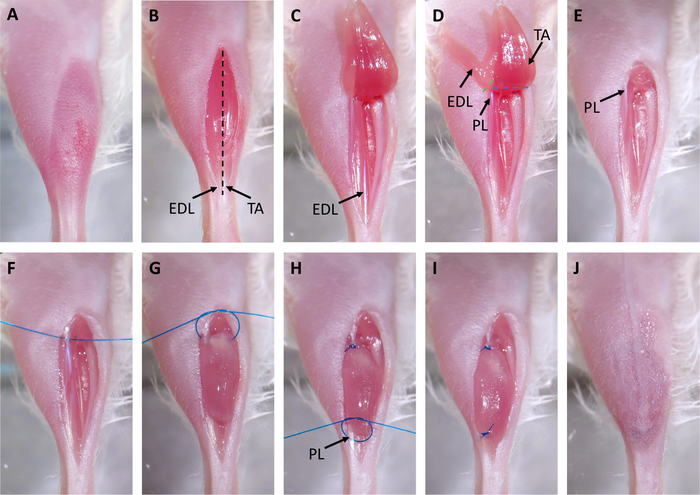
Figura 2: Cirugía de xenoinjerto. (A) El cabello se extrae del sitio quirúrgico. (B) Se realiza una incisión sobre los tibialis anteriores (TA). Los tendones distales del TA y del digitorum longus extensor (EDL) están marcados con flechas. La línea discontinua negra indica dónde se cortará el epimio en el paso 3.3. (C) El tendón distal de la TA se corta y el músculo se tira hasta la rodilla. (D) Se corta el tendón de la EDL y se tira de la EDL hasta la rodilla. Esto expone el tendón proximal del peroneus longus (PL) marcado con una flecha. Las líneas discontinuas indican dónde cortar con tijeras para eliminar el EDL (verde) y el PL (azul). (E) Se retiran el EDL y el TA. (F) Se coloca una sutura a través del tendón proximal del PL. (G) El xenoinjerto se coloca en el compartimento tibial vacío y se sutura al tendón PL proximal utilizando un nudo cuadrado quirúrgico de dos manos. (H) Se coloca una sutura a través del tendón distal del PL, marcado con una flecha, y otro nudo cuadrado quirúrgico de dos manos se utiliza para suturar el xenoinjerto al tendón distal. (I) El xenoinjerto está completamente trasplantado y suturado a la PL. (J) La piel se cierra con pegamento quirúrgico. Haga clic aquí para ver una versión más grande de esta figura.
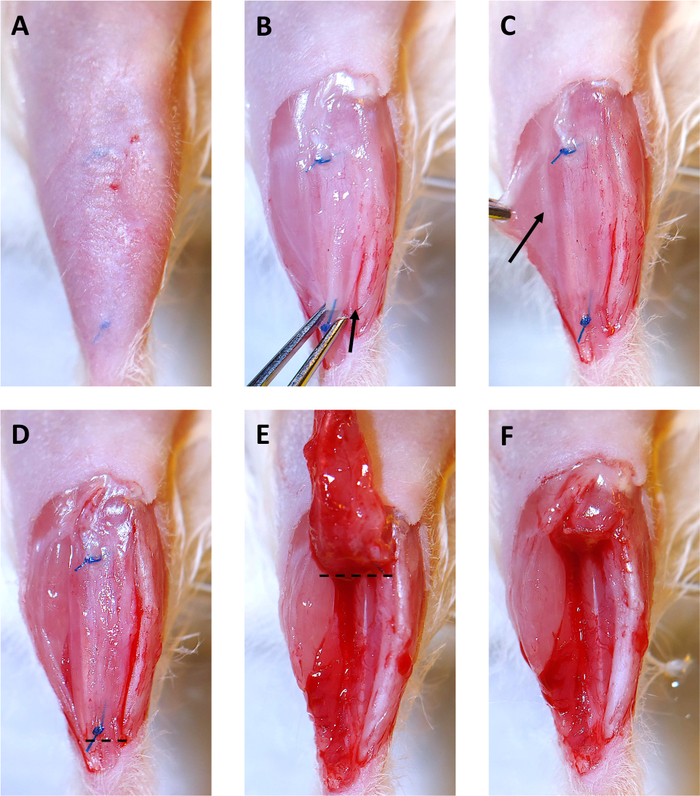
Figura 3: Colección xenoinjerto de 4 meses. (A) El cabello se extrae del sitio quirúrgico. Las suturas son visibles bajo la piel. (B) Se retira la piel que cubre el xenoinjerto. Luego el xenoinjerto es agarrado con los fórceps del iris en la sutura distal y suavemente tirado hacia arriba. A partir del tobillo, se utiliza un bisturí para cortar a lo largo de la tibia y liberar el xenoinjerto. La flecha muestra el comienzo de la incisión a lo largo de la tibia. (C) Al tirar del músculo gastrocnemius hacia un lado, se hace visible una débil línea blanca de epimisio que separa el músculo peroneus longus (PL) y el gastrocnemius (mostrado por la flecha). Utilice el bisturí para cortar a lo largo de esta línea para separar el PL de los otros músculos de la pierna. (D) El lado derecho del xenoinjerto, y el PL ahora están libres de los otros músculos de la pierna y están listos para la eliminación. La línea discontinua indica dónde cortar con tijeras quirúrgicas para comenzar a extraer el xenoinjerto y PL. (E) Después de cortar por debajo de la sutura distal, desviar el xenoinjerto hacia la rodilla. La línea discontinua indica dónde cortar con tijeras quirúrgicas para eliminar el xenoinjerto y PL del compartimiento tibial. (F) El compartimento tibial vacío con el xenoinjerto y PL eliminado con éxito. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Como lo demuestra Yuanfan Zhang et al., este protocolo quirúrgico es un método sencillo para producir xenoinjertos de músculo esquelético humano8. Los xenoinjertos regenerados se inerten espontáneamente y muestran contractilidad funcional. Además, el xenoinjerto muscular de pacientes con FSHD recapitula los cambios en la expresión génica observados en pacientes con FSHD8.
En nuestra experiencia, aproximadamente 7 de los 8 xenoinjertos rea...
Discusión
Los xenoinjertos derivados del paciente son una forma innovadora de modelar la enfermedad muscular y llevar a cabo estudios preclínicos. El método descrito aquí para crear xenoinjertos musculares esqueléticos es rápido, sencillo y reproducible. Las cirugías unilaterales se pueden realizar en 15 a 25 minutos, o bilateralmente en 30 a 40 minutos. Los xenoinjertos bilaterales pueden proporcionar flexibilidad experimental adicional. Por ejemplo, los investigadores pueden realizar un tratamiento localizado de un xenoinj...
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Este trabajo fue apoyado por la Asociación de Myositis y la Fundación Peter Buck. Nos gustaría dar las gracias a la Dra. Yuanfan Zhang por compartir su experiencia y formación en la técnica quirúrgica de xenoinjerto.
Materiales
| Name | Company | Catalog Number | Comments |
| 100 mm x 15 mm Petri dish | Fisher Scientific | FB0875712 | |
| 2-Methylbutane | Fisher | O3551-4 | |
| 20 mm x 30 mm micro cover glass | VWR | 48393-151 | |
| Animal Weighing Scale | Kent Scientific | SCL- 1015 | |
| Antibiotic-Antimycotic Solution | Corning, Cellgro | 30-004-CI | |
| AutoClip System | F.S.T | 12020-00 | |
| Castroviejo Needle Holder | F.S.T | 12565-14 | |
| Chick embryo extract | Accurate | CE650TL | |
| CM1860 UV cryostat | Leica Biosystems | CM1860UV | |
| Coplin staining jar | Thermo Scientific | 19-4 | |
| Dissection Pins | Fisher Scientific | S13976 | |
| Dry Ice - pellet | Fisher Scientific | NC9584462 | |
| Embryonic Myosin antibody | DSHB | F1.652 | recommended concentration 1:10 |
| Ethanol | Fisher Scientific | 459836 | |
| Fetal Bovine Serum | GE Healthcare Life Sciences | SH30071.01 | |
| Fiber-Lite MI-150 | Dolan-Jenner | Mi-150 | |
| Forceps | F.S.T | 11295-20 | |
| Goat anti-mouse IgG1, Alexa Fluor 488 | Invitrogen | A-21121 | recommended concentration 1:500 |
| Goat anti-mouse IgG2b, AlexaFluor 594 | Invitrogen | A-21145 | recommended concentration 1:500 |
| Gum tragacanth | Sigma | G1128 | |
| Hams F-10 Medium | Corning | 10-070-CV | |
| Histoacryl Blue Topical Skin Adhesive | Tissue seal | TS1050044FP | |
| Human specific lamin A/C antibody | Abcam | ab40567 | recommended concentration 1:50-1:100 |
| Human specific spectrin antibody | Leica Biosystems | NCLSPEC1 | recommended concentration 1:20-1:100 |
| Induction Chamber | VetEquip | 941444 | |
| Iris Forceps | F.S.T | 11066-07 | |
| Irradiated Global 2018 (Uniprim 4100 ppm) | Envigo | TD.06596 | Antibiotic rodent diet to protect again respiratory infections |
| Isoflurane | MWI Veterinary Supply | 502017 | |
| Kimwipes | Kimberly-Clark | 34155 | surgical wipes |
| Mapleson E Breathing Circuit | VetEquip | 921412 | |
| Methanol | Fisher Scientific | A412 | |
| Mobile Anesthesia Machine | VetEquip | 901805 | |
| Mouse on Mouse Basic Kit | Vector Laboratories | BMK-2202 | mouse IgG blocking reagent |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| NAIR Hair remover lotion/oil | Fisher Scientific | NC0132811 | |
| NOD-Rag1null IL2rg null (NRG) mice | The Jackson Laboratory | 007799 | 2 to 3 months old |
| O.C.T. Compound | Fisher Scientific | 23-730-571 | |
| Oxygen | Airgas | OX USPEA | |
| PBS (phosphate buffered saline) buffer | Fisher Scientific | 4870500 | |
| Povidone Iodine Prep Solution | Dynarex | 1415 | |
| ProLong™ Gold Antifade Mountant | Fisher Scientific | P10144 (no DAPI); P36935 (with DAPI) | |
| Puralube Ophthalmic Ointment | Dechra | 17033-211-38 | |
| Rimadyl (carprofen) injectable | Patterson Veterinary | 10000319 | surgical analgesic, administered subcutaneously at a dose of 5 mg/kg |
| Scalpel Blades - #11 | F.S.T | 10011-00 | |
| Scalpel Handle - #3 | F.S.T | 10003-12 | |
| Stereo Microscope | Accu-scope | 3075 | |
| Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Suture, Synthetic, Non-Absorbable, 30 inches long, CV-11 needle | Covidien | VP-706-X | |
| 1ml Syringe (26 gauge, 3/8 inch needle) | BD Biosciences | 329412 | |
| Trimmer | Kent Scientific | CL9990-KIT | |
| Vannas Spring Scissors, 8.0 mm cutting edge | F.S.T | 15009-08 | |
| VaporGaurd Activated Charcoal Filter | VetEquip | 931401 | |
| Wound clips, 9 mm | F.S.T | 12022-09 |
Referencias
- Wong, C. H., Siah, K. W., Lo, A. W. Estimation of clinical trial success rates and related parameters. Biostatistics. , 1-14 (2018).
- Hay, M., Thomas, D. W., Craighead, J. L., Economides, C., Rosenthal, J. Clinical development success rates for investigational drugs. Nature Biotechnology. 32, 40-51 (2014).
- Perel, P., et al. Comparison of treatment effects between animal experiments and clinical trials: systematic review. BMJ. 334, 1-6 (2007).
- Rubio-Viqueira, B., Hidalgo, M. Direct in vivo xenograft tumor model for predicting chemotherapeutic drug response in cancer patients. Clinical Pharmacology Therapeutics. 85, 217-221 (2009).
- Roberts, K. G., et al. Targetable Kinase-Activating Lesions in Ph-like Acute Lymphoblastic Leukemia. New England Journal of Medicine. 371, 1005-1015 (2014).
- Kim, J., et al. GDF11 Controls the Timing of Progenitor Cell Competence in Developing Retina. Science. 308, 1927-1930 (2005).
- Sako, D., et al. Characterization of the ligand binding functionality of the extracellular domain of activin receptor type IIB. Journal of Biological Chemisty. 285, 21037-21048 (2010).
- Zhang, Y., et al. Human skeletal muscle xenograft as a new preclinical model for muscle disorders. Human Molecular Genetics. 23, 3180-3188 (2014).
- Gabellini, D., Green, M. R., Tupler, R. Inappropriate Gene Activation in FSHD : A Repressor Complex Binds a Chromosomal Repeat Deleted in Dystrophic Muscle. Cell. 110, 339-348 (2002).
- Lemmers, R. J. L. F., et al. A Unifying Genetic Model for Facioscapulohumeral Muscular Dystrophy. Science. 329, 1650-1654 (2010).
- Chen, J. C. J., et al. Morpholino-mediated Knockdown of DUX4 Toward Facioscapulohumeral Muscular Dystrophy Therapeutics. Molecular Therapy. 24, 1405-1411 (2016).
- Medical Research Council. . Aids to the investigation of the peripheral nervous system. , (1943).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21, 2348-2356 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados