Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İmmün eksik farelerde İnsan İskelet Kası Ksenogreftlerinin
Bu Makalede
Özet
Karmaşık insan hastalıkları geleneksel laboratuvar modeli sistemlerinde modellemek zor olabilir. Burada, insan iskelet kası biyopsilerinin immünyonfik farelere nakli yoluyla insan kas hastalığını modellemek için cerrahi bir yaklaşım tanımlıyoruz.
Özet
Hayvan çalışmalarında gözlenen tedavi etkileri genellikle klinik çalışmalarda recapitulated başarısız. Bu sorun çok yönlü olmakla birlikte, bu başarısızlığın nedenlerinden biri yetersiz laboratuvar modellerinin kullanılmasıdır. Bu geleneksel laboratuvar organizmalarında karmaşık insan hastalıkları modeli zor, ama bu konu insan ksenogreftçalışmaları ile atlatılabilir. Burada tanımladığımız cerrahi yöntem, kas hastalığını modellemek ve klinik öncesi terapötik testler yapmak için kullanılabilen insan iskelet kası ksenogreftlerinin oluşturulmasına olanak sağlamaktadır. Kurumsal İnceleme Kurulu (IRB) onaylı protokol uyarınca, iskelet kası örnekleri hastalardan alınarak NOD-Rag1nullIL2rγnull (NRG) host farelere nakledilir. Bu fareler olgun lenfositler yapmak için yetersizlik nedeniyle transplantasyon çalışmaları için ideal konakve bu nedenle hücre aracılı ve humoral adaptif bağışıklık yanıtları geliştirmek mümkün değildir. Konak fareler izofluran ile uyuşturulur ve fare tibialis anterior ve ekstansör digitorum longus kasları kaldırılır. İnsan kasının bir parçası daha sonra boş tibial bölmeye yerleştirilir ve peroneus longus kasının proksimal ve distal tendonlar için dikişli. Ksenogreftli kas spontan vaskülarize ve fare konak tarafından innerve, preklinik çalışmalar için bir model olarak hizmet verebilir sağlam rejenere insan kası ile sonuçlanan.
Giriş
Klinik çalışmalardan geçirilen tüm ilaç geliştirme programlarının sadece %13.8'inin başarılı olduğu ve onaylı tedavilere yol açıldığı bildirilmiştir1. Bu başarı oranı daha öncebildirilen%10.4 daha yüksek iken 2 , iyileştirme için hala önemli bir oda var. Klinik çalışmaların başarı oranını artırmak için bir yaklaşım preklinik araştırmalarda kullanılan laboratuvar modellerini geliştirmektir. Gıda ve İlaç İdaresi (FDA) tedavi etkinliğini göstermek ve Faz 1 klinik çalışmalar dan önce toksisite değerlendirmek için hayvan çalışmaları gerektirir. Ancak, genellikle hayvan çalışmaları ve klinik çalışmalar arasında tedavi sonuçlarında sınırlı uyum vardır3. Buna ek olarak, preklinik hayvan çalışmaları için ihtiyaç kabul edilen bir hayvan modeli eksikliği hastalıklarda terapötik gelişim için aşılmaz bir engel olabilir, genellikle nadir veya sporadik hastalıklar için durumdur.
İnsan hastalığını modellemenin bir yolu, insan dokusunu immünoffik farelere naklederek ksenogreft ler üretmektir. Ksenogreft modellerinin üç temel avantajı vardır: Birincisi, diğer hayvan modellerinde asla tekrarlanabilir olmayan insan hastalığında var olan karmaşık genetik ve epigenetik anormallikleri yeniden özetleyebilirler. İkinci olarak, hasta örnekleri mevcutsa nadir veya sporadik hastalıkların modelini yapmak için ksenogreftler kullanılabilir. Üçüncü olarak, ksenogreftler tam bir in vivo sistem içinde hastalığı modeller. Bu nedenlerden dolayı, ksenogreft modellerinde tedavi etkinliği sonuçlarının hastalardaki deneylere daha fazla çevrilme olasılığının daha yüksek olduğunu varsabiliyoruz. İnsan tümör ksenogreftler zaten başarıyla multipl miyelom da dahil olmak üzere ortak kanserler için tedavi geliştirmek için kullanılmıştır, yanı sıra bireysel hastalar için kişiselleştirilmiş tedaviler4,5,6, 7 .
Son zamanlarda, ksenogreftler insan kas hastalığı bir model geliştirmek için kullanılmıştır8. Bu modelde insan kas biyopsisi örnekleri immünopsiyoksun NRG farelerin arka eklerine naklederek ksenogreftler oluşturur. Nakledilen insan miyofiberleri ölür, ancak ksenogreftte bulunan insan kas kök hücreleri daha sonra genişleyen ve engreftlenmiş insan bazal laminasını yeniden dolduran yeni insan miyofiberlerine ayrılır. Bu nedenle, bu ksenogreftlerde rejenere miyolifler tamamen insandır ve fare konakları tarafından kendiliğinden revaskülarve innerve edilir. Önemli olarak, fascioscapulohumeral kas distrofisi (FSHD) hasta kas dokusu fareler içine nakledilen insan hastalığının temel özellikleri özetler, yani DUX4 transkripsiyon faktörüifade 8. FSHD dux4 aşırı ekspresyonu neden olur, hangi epigenetik normal kasdokusundasusturuldu 9,10. FSHD ksenogreft modelinde, DUX4 spesifik morfolino ile tedavi başarıyla DUX4 ifade ve fonksiyonu bastırmak için gösterilmiştir, ve FSHD hastalar için potansiyel bir tedavi seçeneği olabilir11. Bu sonuçlar insan kas ksenogreftlerinin insan kas hastalığını modellemek ve farelerde potansiyel tedavileri test etmek için yeni bir yaklaşım olduğunu göstermektedir. Burada, immünyonfik farelerde insan iskelet kası ksenogreftleri oluşturmak için cerrahi yöntemi ayrıntılı olarak açıklıyoruz.
Protokol
Katılımcıların haklarını ve refahını korumak için insan deneklerden elde edilen tüm araştırma örneklerinin kullanımı Johns Hopkins Kurumsal İnceleme Kurulu (IRB) tarafından onaylanmıştır. Tüm hayvan deneyleri Johns Hopkins Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından Ulusal Sağlık Enstitüleri (NIH) Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu uyarınca onaylanmıştır. Erkek NOD-Rag1nullIL2rγnull (NRG) konak fareler (8-12 haftalık) ksenogreft deneyleri yapmak için kullanılır. Bu fareler havalandırmalı raflarda yer almaktadır ve HEPA filtreli, temperli ve nemlendirilmiş havanın yanı sıra ters ozmoz filtrelenmiş hiperklorlu su verilir. Farelere su ve ışınlanmış antibiyotik diyeti(Malzeme Tablosu)reklam libitum sağlanır ve tesis merkezi zamanlayıcı tarafından kontrol edildiği şekilde 14 saat ile 10 saat karanlık arasında ışık sağlar.
1. Ekipman Hazırlama
- NoD-Rag1nullIL2r γnull (NRG) fareler, 8-12 haftalık fareler edinin.
- Otoklav cerrahi ekipmanları: makas, forceps, iğne tutucu, cerrahi zımba ( MalzemeTablosu ), yara klipleri, cerrahi mendil(Malzeme Tablosu), ve beher (Şekil 1A).
- 50 mL kas ortamı (%20 fetal sığır serumu, %2 civciv embriyo ekstresi, %1 antibiyotik/antimikotik Hams F10 Medium) hazırlayın. Protokolde farklı belirtilmedikçe ameliyat için kullanılan tüm kimyasalları/ilaçları/solüsyonları oda sıcaklığında saklayın.
- 2 mg/mL analjezik(Malzeme Tablosu)içeren 26 G uzunluğunda 26 G iğneli 1 mL'lik bir şırınga hazırlayın ve buz üzerinde yerleştirin. Analjezik steril fosfat tamponlu salin (PBS) kullanılarak uygun konsantrasyona seyreltilebilir.
2. Cerrahi Hazırlık
- Kasları güç gösterisi > MRC (Tıbbi Araştırma Konseyi) ölçeğinde 4-5 olan hastalardan IRB onaylı protokol altında insan kas biyopsisi alın12. Araştırma örneğini kas ortamı içeren 100 mm x 15 mm Petri kabına yerleştirin.
NOT: MRC ölçeği klinik uygulamada kas gücünün değerlendirilmesinde 0 kasılma, 5'i normal güç ve 4 (4-4+) direnç direncine karşı hareket gösteren12olarak kullanılmaktadır. Hafif ila orta derecede güçsüzlüğü olan kasların (MRC > 4-5) tipik olarak hastalık patolojisi gösterdiğini, ancak her ikisi de ksenogreft rejenerasyonuna engel olan yağ dokusu veya fibrozis ile yaygın olarak yer değiştirmediğini bulduk. Yeni mrc skorunun mevcut olmadığı otopsi dokusunda kas kalitesine brüt gözlem yoluyla ulaşılabilir. Görünüşte soluk pembe veya yağ dokusunun geniş alanlara sahip kas biyopsileri başarılı bir şekilde ksenograft olası değildir. - Görselleştirmeye yardımcı olmak için stereo mikroskop ve ışık kaynağı kullanarak cerrahi makas ile numuneden kalan fasya veya yağ dokusunu çıkarın.
- Stereo mikroskop ve ışık kaynağı kullanarak kas biyopsisini cerrahi makas ile yaklaşık 7 mm x 3 mm x 3 mm parçalara ayırın. Liflerin numune içinde uzunlamasına olarak düzenlendiğinden emin olun.
- Petri kabını buz üzerine incelenmiş kas içeren yerleştirin. Ortalama olarak ksenogreftler ameliyatlar yapılırken 4 saat medyada tutulur. Ancak, biyopsiler ksenogreftlemeden önce 24 saat medyada depolanmış ve bu gecikme transplantasyon veya rejenerasyonu olumsuz etkilememiş gibi görünmedi.
- Sentetik, emilemeyen dikişleri(Malzeme Tablosu)%70 etanol içeren 100 mm x 15 mm Petri kabına yerleştirin.
- Çift işlemli anestezi devresi ayarlayın: Mapleson E solunum devresini stereo mikroskop üzerinde düzenleyin ve indüksiyon odasını biyogüvenlik kabinine yerleştirin(Şekil 1A,B).
- Bir ölçekte otoklavlı bir kabı yerleştirerek NRG farenin ağırlığını elde edin ve indüksiyon odasına aktarın. % 3 isoflurane altında anestezi indüklemek. Uygun anestezik derinlik elde edildikten sonra-solunum hızı, kas gevşemesi ve gönüllü hareket eksikliği gözlemi ile değerlendirildiği gibi- vaporizer ayarını ameliyatın geri kalanı için %1,5'e düşürün.
- Fareyi indüksiyon odasından Mapleson E solunum devresine aktarın ve gözlere oftalmik merhem uygulayın.
- Bir düzeltici ile ayak bileğinden dize tibialis anterior (TA) örten saç çıkarın, epilasyon losyonu ile 1 dk tedavi takip(Malzeme Tablosu) (Şekil 2A).
- Povison-iyot solüsyonu ile bacak temizleyerek cerrahi site dezenfekte. Sonra kalan povison-iyot% 70 etanol ile yıkayın.
- Fareye 5 mg/kg dozda karprofen ,(Malzeme Tablosu)gibi analjezik enjekte edin.
3. Ksenogreft Cerrahisi
- Bacak aşağı bant ve distal tendonlarla kaynaklanan ve diz altında sonlanan makas ve iris forceps ile tibilalis anterior (TA) kas üzerinde düz bir kesi yapmak (Şekil 2B).
- Cerrahi makas ile künt diseksiyon kullanarak kas ayrı deri.
- Tendondan başlayıp dizde biten makasla TA kasının epimisini kesin.
NOT: Bu çok yüzeysel bir kesimdir (0,5 mm'den az; Şekil 2B, siyah kesikçizgi) ve altta yatan TA bu kaldırma daha zor hale getirecek gibi işlemde zarar görmemelidir. Doğru yapıldığında, kas lifleri gözle görülür bir şekilde rahatlayacaktır. - Makas ile TA distal tendonu kesin, iris forceps ile tendon kapmak, ve diz doğru TA çekin(Şekil 2C).
- Ekstansör digitorum longusun distal tendonu (EDL) makasla kesin ve EDL'yi dize doğru çekin(Şekil 2D). Peroneus longus (PL) kasının proksimal tendonu görünür olduğunda, MAKasile EDL'yi çıkarın (Şekil 2D, yeşil kesikçizgi).
- Makasla TA'yı çıkarın(Şekil 2D, mavi kesikli çizgi) ve hemostaz(Şekil 2E)elde etmek için PBS ve hafif basınç la ıslak bir cerrahi silme kullanın .
- Proksimal peroneus longus (PL) tendon ve döşeme ile iplik bir dikiş, tendonun her iki tarafında iplik yaklaşık 1,5 inç bırakarak(Şekil 2F).
- İki el cerrahi kare düğüm ilk yarısında gerçekleştirin, ama sıkın yok: Bu bir daire oluşturacaktır. Bu daireiçine bir ksenogreft yerleştirin ve ksenogrefti sabitlemek için döngüyü sıkın. Kare düğümün diğer yarısını tamamlayın (Şekil 2G,H). Bu PL proksimal tendon ksenograft dikiş olacaktır.
- Distal PL tendonu ile iplik sütür ve distal tendon ksenogreft bağlamak için adım 3.8 kare düğüm tekniği tekrarlayın(Şekil 2H,I).
NOT: Medial tarsal arter ve ven yakın veya PL distal tendon üstüne yatabilirsiniz. Dikişleri bu gemilerin içinden veya çevresine yerleştirmeyin. Damarlar beyazlatmak veya kanamak gibi bir dikiş yanlış yerleştirilmiş olup olmadığını söylemek kolaydır. Bu durumda, sütür ve farklı bir konuma yerleştirin kaldırın. - Ksenogreftli kas üzerinde deri çekin, cerrahi tutkal ile mühür, ve kesi üzerine 2-3 cerrahi zımba yerleştirin(Şekil 2J).
- Kurtarmak için fareyi ısıtmalı bir pedin üzerine temiz bir kafese yerleştirin. Lokal sistemik enfeksiyon belirtileri için önümüzdeki birkaç gün boyunca tam bilinçli ve periyodik olarak fareyi izleyin ve cerrahi alanın yeniden açılmamasını sağlayın.
NOT: Adım 2.11 açıklandığı gibi analjezik tek bir doz genellikle ağrı kesici için yeterlidir. Ancak, fareler de kalıcı ağrı için izlenmelidir (örneğin topallık, fırfırlı ceket, kambur duruş), ve gerekirse, tekrar analjezik ile tekrar dosed 24 saat post-operatif.
4. Xenograft Koleksiyonu
NOT: Ksenogreftler genellikle ameliyat sonrası 4 ila 6 ay arasında toplanır. Ancak ameliyat sonrası 12 aya kadar koleksiyonlar yapılmıştır.
- Ksenogreft toplamadan önce kuru buz içeren bir kutuya 200 mL 2-metilbütan içeren kapalı bir kabı yerleştirin.
- İndüksiyon odasında %3 isofluran altında anestezi edin. Uygun anestezik derinlik elde edince, vaporizer ayarını ameliyatın geri kalanı için %1,5'e düşürün.
- Fareyi indüksiyon odasından stereo mikroskop üzerinde düzenlenmiş Mapleson E solunum devresine aktarın.
- Bir düzeltici ve epilasyon losyonu ile ayak bileğinden dize tibialis anterior örten saç çıkarın. Ksenogrefti yerinde tutan dikişler deriden görülebilir (Şekil 3A).
- Bacak aşağı bant ve her iki dikiş görünür kadar ksenogreft üzerinde cilt açmak için makas ve iris forseps kullanın(Şekil 3B). Ksenogrefti örten deri, ksenogreftin çıkarılmasını kolaylaştırmak için gösterildiği gibi çıkarılabilir.
- Ksenogreft ve tibia(Şekil 3B,ok ilk site ve kesi yönünü gösterir) arasında kesmek için bir neşter kullanın. Bu ksenogreft bir tarafı serbest olacaktır.
- PL kas ve gastroknemius kas(Şekil 3C ,i epimisyum boyunca ok ile etiketlenmiş) arasında kesmek için bir neşter kullanın. PL ksenogreft ile kaldırılacak.
- Distal sütür altında ve PL distal tendonu ile kesin(Şekil 3D, noktalı çizgi boyunca kesilmiş).
- Altta yatan kasuzak kesmek için makas kullanırken iris forceps ile dikiş kapma ve diz doğru saptırma ksenogreft ve PL çıkarın(Şekil 3E).
- Ksenogreft ve PL kaldırmak için makas ile proksimal sütür üzerinde kesilmiş(Şekil 3F, 3Enoktalı çizgi boyunca kesilmiş ).
- Numuneyi küçük bir karton veya plastik parçasının üzerine yerleştirin ve dikişlere mümkün olduğunca yakın sabitle. Numuneyi sabitlerken, lif yönünün ani dondurma işlemi sırasında korunmasını sağlamak için kasları hafifçe gerin. Pimleri güvenli bir şekilde yerleştirildikten sonra, kaslarını pimleri yukarı kaydırın, böylece kartonun hemen üzerinde durun.
NOT: Alternatif olarak, ksenoft bir ucu bir mantar üzerine tragacanth monte edilebilir, ya da bir kriyomold optimal kesme sıcaklığında tamamen batık olabilir (O.C.T.) bileşik. Dikkatli bir şekilde her iki yöntemle de kas konformasyonu tutulabilir. - Önceden soğutulmuş 2-metilbütan ksenogrefti tutturun.
- Ksenogrefti -80 °C'de saklayın.
- Ksenogreft toplama hemen ardından, Amerikan Veteriner Tıp Derneği yönergeleriuyarınca fareler ötenazi:
- Uygun bir atık gaz atma sistemi ile kapalı bir odaya fareler yerleştirin. Anesteziyi tetiklemek için %3-4 oranında isofluran kullanın.
- Uygun anestezik derinlik elde edildikten sonra-solunum hızı, kas gevşemesi ve gönüllü hareket eksikliği gözlemi ile değerlendirildiği gibi- ölüme neden olmak için buharlaştırıcı ayarını %5'e çıkarır. Nefes kesildikten sonra ek bir 2 dakika için odada fareler bırakın. Ölüm, farelerin aşırı dozislurandan sonra 10 dakika içinde toparlanamadığı gözlemlenerek doğrulanır.
- Son olarak, fareler üzerinde servikal dislokasyon gerçekleştirin.
NOT: Bilateral ksenogreftli farelerde kontralateral ksenogreft daha sonraki bir koleksiyon için kaydedilebilir. Bir sağkalım toplama gerçekleştirmek için, cerrahi makas ile tek bir düz kesim ile ksenogreft kaplama deri açık ve adımlar 4.6-4.10 açıklandığı gibi ksenogreft kaldırın. Sonra cerrahi tutkal ve zımba kullanarak boş tibial bölmesi üzerinde cilt kapatın. Adım 2.11'de açıklandığı gibi fareyi analjezik le tedavi edin ve fareyi kurtarmak için ısıtılmış pedin üzerine temiz bir kafese yerleştirin. Lokal sistemik enfeksiyon belirtileri için önümüzdeki birkaç gün boyunca fareyi tam bilinçli ve periyodik olarak izleyin ve cerrahi alanın yeniden açılmamasını sağlayın.
5. Xenograft İmmünohistokimya
- Toplanan ksenogreftten 10 ila 12 m'lik kesitleri pozitif yüklü slaytlara kesmek için bir kriyostat kullanın(Malzeme Tablosu).
- Boyama kavanozu metanol ile doldurun ve -20 °C'de 30 dakika boyunca önceden soğutun.
- Xenogreft kesitlerini düzeltmek ve permeabilize etmek için 10 dakika boyunca buz gibi metanol slaytlar yerleştirin.
- Boya kavanozuna slaytlar yerleştirin ve 5 dakika boyunca fosfat tamponlu salin (PBS) ile 3x yıkayın.
- 4 °C'de 2 saat boyunca fare karşıtı IgG(Malzeme Tablosu)ile blok.
- PBS'de 4 °C'de bir gecede %2 keçi serumu ile takviye edilen spektrin, lamin A/C ve embriyonik miyozin(Malzeme Tablosu)gibi primer antikorlarla birlikte lekeler.
- Bir boyama kavanozuna slaytlar yerleştirin ve 5 dakika boyunca fosfat tamponlu salin (PBS) ile 3x yıkayın.
- PBS'de floresan boya konjuge sekonder antikorlar(Malzeme Tablosu)ile birlikte oda sıcaklığında 1 saat boyunca %2 keçi serumu ile desteklenmiştir.
- Boya kavanozuna slaytlar yerleştirin ve 5 dakika boyunca fosfat tamponlu salin (PBS) ile 3x yıkayın.
- Ksenogreft ler bölümlerinin üzerine montaj ortamı(Malzeme Tablosu)yerleştirin, üzerine kapak kaydırın ve kapak fişini kapatmak için oje kullanın.
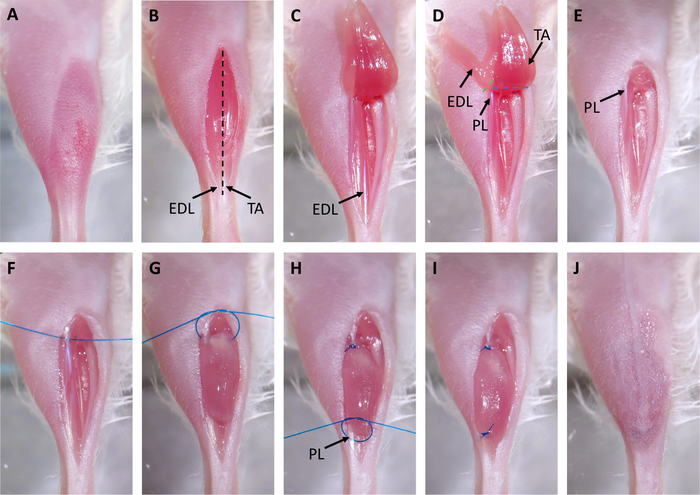
Şekil 2: Ksenogreft Cerrahisi. (A) Saç cerrahi bölgeden çıkarılır. (B) Tibialis anterior (TA) üzerinde kesi yapılır. TA ve ekstansör digitorum longus (EDL) distal tendonlar oklarla işaretlenir. Siyah kesik çizgi, epimisinin 3.3 adımda nerede kesileceğini gösterir. (C) TA distal tendonu kesilir ve kas diz kadar çekilir. (D) EDL tendonu kesilir ve EDL diz kadar çekilir. Bu peroneus longus proksimal tendon ortaya çıkarır (PL) bir ok ile işaretlenmiş. Kesik çizgiler EDL (yeşil) ve PL (mavi) kaldırmak için makasla nerede kesilsin ilerler. (E) EDL ve TA kaldırılır. (F) Bir dikiş PL proksimal tendon yoluyla yerleştirilir. (G) Ksenogreft boş tibial bölmesi yerleştirilir ve iki el cerrahi kare düğüm kullanılarak proksimal PL tendon dikişli. (H) Bir dikiş PL distal tendonundan yerleştirilir, bir ok ile işaretlenmiş, ve başka bir iki el cerrahi kare düğüm distal tendon ksenograft dikiş için kullanılır. (I) Ksenogreft tamamen nakledilir ve PL. (J) Cilt cerrahi tutkal ile kapatılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
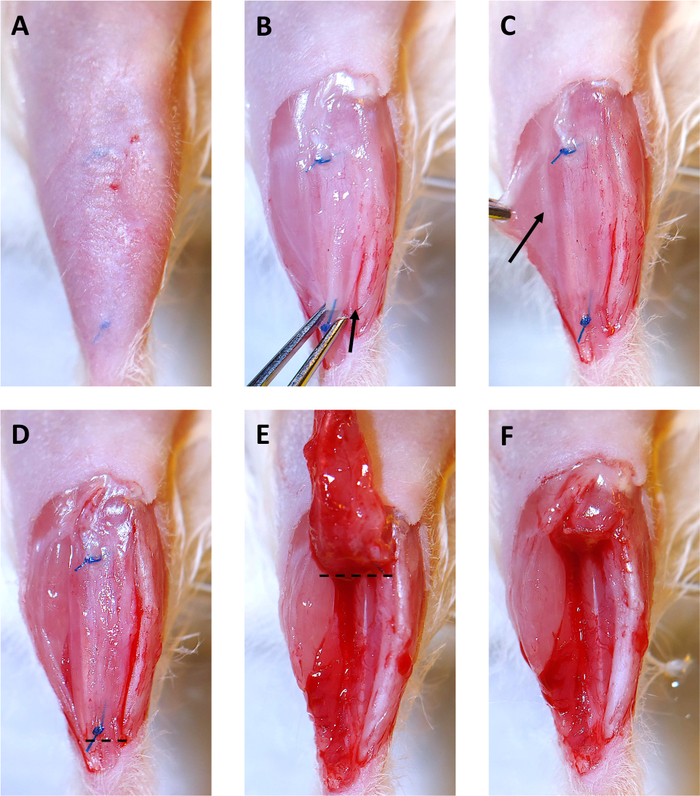
Şekil 3: 4 Ay Ksenogreft Koleksiyonu. (A) Saç cerrahi bölgeden çıkarılır. Dikişler deri altında görülebilir. (B) Ksenogrefti örten deri çıkarılır. Daha sonra ksenogreft distal sütür de iris forceps ile yakaladı ve yavaşça yukarı doğru çekilir. Ayak bileğinden başlayarak, bir neşter kaval kemiği boyunca kesmek ve ksenogreft serbest kullanılır. Ok kaval kemiği boyunca kesibaşlangıcını gösterir. (C) Gastroknemius kasını kenara çekerek peroneus longus (PL) kasını ve gastroknemiusu (ok ile gösterilen) ayıran soluk beyaz bir epimiyum çizgisi görünür hale gelir. Diğer bacak kasları PL ayırmak için bu çizgi boyunca kesmek için neşter kullanın. (D) Ksenogreftsağ tarafında, ve PL şimdi bacaktaki diğer kaslardan arınma ve çıkarılması için hazır. Kesik çizgi ksenogreft ve PL. (E)distal sütür altında kestikten sonra, diz doğru ksenogreft saptırmak başlatmak için cerrahi makas ile kesmek için nerede gösterir. Kesikçizgi tibial bölmesi ksenogreft ve PL kaldırmak için cerrahi makas ile kesmek için nerede gösterir. (F) Ksenogreft ve PL ile boş tibial bölmesi başarıyla çıkarılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Yuanfan Zhang ve ark tarafından gösterildiği gibi, bu cerrahi protokol insan iskelet kası ksenogreftler üretmek için basit bir yöntemdir8. Rejenere ksenogreftler kendiliğinden innerve hale gelir ve fonksiyonel kontraktilite gösterir. Ayrıca FSHD hastalarından ksenogreftlenen kas, FSHD hastalarında gözlenen gen ekspresyonundaki değişiklikleri özetler8.
Deneyimlerimize göre, kontrol hasta örneklerinden yapılan 8 ksenogreftten yak...
Tartışmalar
Hasta kaynaklı ksenogreftler kas hastalığını modellemek ve klinik öncesi çalışmalar yapmak için yenilikçi bir yoldur. Burada iskelet kası ksenogreftleri oluşturmak için açıklanan yöntem hızlı, basit ve tekrarlanabilir. Tek taraflı ameliyatlar 15-25 dakika, bilateral ameliyatlar 30-40 dakikada yapılabilir. Bilateral ksenogreftler ek deneysel esneklik sağlayabilir. Örneğin, araştırmacılar bir ksenogreft lokalize tedavi gerçekleştirebilirsiniz, diğer bir kontrol olarak sol. NRG fareler, patojen...
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları olduğunu beyan.
Teşekkürler
Bu çalışma Myositis Derneği ve Peter Buck Vakfı tarafından desteklendi. Dr. Yuanfan Zhang'a ksenogreft cerrahi tekniğindeki uzmanlığını ve eğitimini paylaştığı için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100 mm x 15 mm Petri dish | Fisher Scientific | FB0875712 | |
| 2-Methylbutane | Fisher | O3551-4 | |
| 20 mm x 30 mm micro cover glass | VWR | 48393-151 | |
| Animal Weighing Scale | Kent Scientific | SCL- 1015 | |
| Antibiotic-Antimycotic Solution | Corning, Cellgro | 30-004-CI | |
| AutoClip System | F.S.T | 12020-00 | |
| Castroviejo Needle Holder | F.S.T | 12565-14 | |
| Chick embryo extract | Accurate | CE650TL | |
| CM1860 UV cryostat | Leica Biosystems | CM1860UV | |
| Coplin staining jar | Thermo Scientific | 19-4 | |
| Dissection Pins | Fisher Scientific | S13976 | |
| Dry Ice - pellet | Fisher Scientific | NC9584462 | |
| Embryonic Myosin antibody | DSHB | F1.652 | recommended concentration 1:10 |
| Ethanol | Fisher Scientific | 459836 | |
| Fetal Bovine Serum | GE Healthcare Life Sciences | SH30071.01 | |
| Fiber-Lite MI-150 | Dolan-Jenner | Mi-150 | |
| Forceps | F.S.T | 11295-20 | |
| Goat anti-mouse IgG1, Alexa Fluor 488 | Invitrogen | A-21121 | recommended concentration 1:500 |
| Goat anti-mouse IgG2b, AlexaFluor 594 | Invitrogen | A-21145 | recommended concentration 1:500 |
| Gum tragacanth | Sigma | G1128 | |
| Hams F-10 Medium | Corning | 10-070-CV | |
| Histoacryl Blue Topical Skin Adhesive | Tissue seal | TS1050044FP | |
| Human specific lamin A/C antibody | Abcam | ab40567 | recommended concentration 1:50-1:100 |
| Human specific spectrin antibody | Leica Biosystems | NCLSPEC1 | recommended concentration 1:20-1:100 |
| Induction Chamber | VetEquip | 941444 | |
| Iris Forceps | F.S.T | 11066-07 | |
| Irradiated Global 2018 (Uniprim 4100 ppm) | Envigo | TD.06596 | Antibiotic rodent diet to protect again respiratory infections |
| Isoflurane | MWI Veterinary Supply | 502017 | |
| Kimwipes | Kimberly-Clark | 34155 | surgical wipes |
| Mapleson E Breathing Circuit | VetEquip | 921412 | |
| Methanol | Fisher Scientific | A412 | |
| Mobile Anesthesia Machine | VetEquip | 901805 | |
| Mouse on Mouse Basic Kit | Vector Laboratories | BMK-2202 | mouse IgG blocking reagent |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| NAIR Hair remover lotion/oil | Fisher Scientific | NC0132811 | |
| NOD-Rag1null IL2rg null (NRG) mice | The Jackson Laboratory | 007799 | 2 to 3 months old |
| O.C.T. Compound | Fisher Scientific | 23-730-571 | |
| Oxygen | Airgas | OX USPEA | |
| PBS (phosphate buffered saline) buffer | Fisher Scientific | 4870500 | |
| Povidone Iodine Prep Solution | Dynarex | 1415 | |
| ProLong™ Gold Antifade Mountant | Fisher Scientific | P10144 (no DAPI); P36935 (with DAPI) | |
| Puralube Ophthalmic Ointment | Dechra | 17033-211-38 | |
| Rimadyl (carprofen) injectable | Patterson Veterinary | 10000319 | surgical analgesic, administered subcutaneously at a dose of 5 mg/kg |
| Scalpel Blades - #11 | F.S.T | 10011-00 | |
| Scalpel Handle - #3 | F.S.T | 10003-12 | |
| Stereo Microscope | Accu-scope | 3075 | |
| Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Suture, Synthetic, Non-Absorbable, 30 inches long, CV-11 needle | Covidien | VP-706-X | |
| 1ml Syringe (26 gauge, 3/8 inch needle) | BD Biosciences | 329412 | |
| Trimmer | Kent Scientific | CL9990-KIT | |
| Vannas Spring Scissors, 8.0 mm cutting edge | F.S.T | 15009-08 | |
| VaporGaurd Activated Charcoal Filter | VetEquip | 931401 | |
| Wound clips, 9 mm | F.S.T | 12022-09 |
Referanslar
- Wong, C. H., Siah, K. W., Lo, A. W. Estimation of clinical trial success rates and related parameters. Biostatistics. , 1-14 (2018).
- Hay, M., Thomas, D. W., Craighead, J. L., Economides, C., Rosenthal, J. Clinical development success rates for investigational drugs. Nature Biotechnology. 32, 40-51 (2014).
- Perel, P., et al. Comparison of treatment effects between animal experiments and clinical trials: systematic review. BMJ. 334, 1-6 (2007).
- Rubio-Viqueira, B., Hidalgo, M. Direct in vivo xenograft tumor model for predicting chemotherapeutic drug response in cancer patients. Clinical Pharmacology Therapeutics. 85, 217-221 (2009).
- Roberts, K. G., et al. Targetable Kinase-Activating Lesions in Ph-like Acute Lymphoblastic Leukemia. New England Journal of Medicine. 371, 1005-1015 (2014).
- Kim, J., et al. GDF11 Controls the Timing of Progenitor Cell Competence in Developing Retina. Science. 308, 1927-1930 (2005).
- Sako, D., et al. Characterization of the ligand binding functionality of the extracellular domain of activin receptor type IIB. Journal of Biological Chemisty. 285, 21037-21048 (2010).
- Zhang, Y., et al. Human skeletal muscle xenograft as a new preclinical model for muscle disorders. Human Molecular Genetics. 23, 3180-3188 (2014).
- Gabellini, D., Green, M. R., Tupler, R. Inappropriate Gene Activation in FSHD : A Repressor Complex Binds a Chromosomal Repeat Deleted in Dystrophic Muscle. Cell. 110, 339-348 (2002).
- Lemmers, R. J. L. F., et al. A Unifying Genetic Model for Facioscapulohumeral Muscular Dystrophy. Science. 329, 1650-1654 (2010).
- Chen, J. C. J., et al. Morpholino-mediated Knockdown of DUX4 Toward Facioscapulohumeral Muscular Dystrophy Therapeutics. Molecular Therapy. 24, 1405-1411 (2016).
- Medical Research Council. . Aids to the investigation of the peripheral nervous system. , (1943).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21, 2348-2356 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır