È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Esecuzione di Xenografi muscolari scheletrici umani in topi immunodeficienti
In questo articolo
Riepilogo
Le malattie umane complesse possono essere difficili da modellare nei sistemi di modelli di laboratorio tradizionali. Qui, descriviamo un approccio chirurgico per modellare la malattia muscolare umana attraverso il trapianto di biopsie muscolari scheletriche umane in topi immunodeficienti.
Abstract
Gli effetti del trattamento osservati negli studi sugli animali spesso non vengono riassunti negli studi clinici. Mentre questo problema è multiforme, uno dei motivi di questo fallimento è l'uso di modelli di laboratorio inadeguati. È difficile modellare malattie umane complesse negli organismi di laboratorio tradizionali, ma questo problema può essere aggirato attraverso lo studio degli xenografi che si possono fare attraverso l'uomo. Il metodo chirurgico che descriviamo qui permette la creazione di xenogratti muscolari scheletrici umani, che possono essere utilizzati per modellare la malattia muscolare e per effettuare test terapeutici preclinici. In base a un protocollo approvato dall'IRB (Institutional Review Board), i campioni muscolari scheletrici vengono acquisiti dai pazienti e poi trapiantati in topi ospiti NOD-Rag1nullIL2r . Questi topi sono ospiti ideali per gli studi di trapianto a causa della loro incapacità di fare linfociti maturi e sono quindi in grado di sviluppare risposte immunitarie adattative mediate dalle cellule e morali. I topi ospiti sono anestetizzati con isoflurane e i muscoli del tibialis anteriore ed estensore del digitalum vengono rimossi. Un pezzo di muscolo umano viene quindi collocato nello scomparto tibiale vuoto e suturato ai tendini prossimali e distali del muscolo longus peroneo. Il muscolo xenotrapianto è spontaneamente vascolarizzato e innervato dall'ospite del topo, risultando in un muscolo umano robustamente rigenerato che può servire come modello per gli studi preclinici.
Introduzione
È stato riferito che solo 13.8% di tutti i programmi di sviluppo di farmaci in fase di sperimentazione clinica hanno successo e portano a terapie approvate1. Mentre questo tasso di successo è superiore al 10,4% precedentemente riportato2, c'è ancora significativo margine di miglioramento. Un approccio per aumentare il tasso di successo degli studi clinici è quello di migliorare i modelli di laboratorio utilizzati nella ricerca preclinica. La Food and Drug Administration (FDA) richiede studi sugli animali per mostrare l'efficacia del trattamento e valutare la tossicità prima degli studi clinici di fase 1. Tuttavia, c'è spesso una concordanza limitata negli esiti del trattamento tra studi sugli animali e studi clinici3. Inoltre, la necessità di studi sugli animali preclinici può essere una barriera insormontabile per lo sviluppo terapeutico in malattie che non hanno un modello animale accettato, che spesso accade per le malattie rare o sporadiche.
Un modo per modellare la malattia umana è trapiantare il tessuto umano in topi immunodeficienti per generare xenografi. Ci sono tre vantaggi principali per i modelli di xenotrapianto: in primo luogo, possono ricapitolare le complesse anomalie genetiche ed epigenetiche che esistono nella malattia umana che potrebbero non essere mai riproducibili in altri modelli animali. In secondo luogo, gli xenografi possono essere utilizzati per modellare malattie rare o sporadiche se sono disponibili campioni di pazienti. In terzo luogo, gli xenogratto modellano la malattia all'interno di un sistema in vivo completo. Per questi motivi, ipotizziamo che i risultati dell'efficacia del trattamento nei modelli di xenotrapianto siano più propensi a tradursi in sperimentazioni in pazienti. Gli xenografi tumorali umani sono già stati utilizzati con successo per sviluppare trattamenti per tumori comuni, tra cui mieloma multiplo, così come terapie personalizzate per singoli pazienti4,5,6, 7.
Recentemente, gli xenogratto sono stati utilizzati per sviluppare un modello di malattia muscolare umana8. In questo modello, i campioni di biopsia muscolare umana vengono trapiantati negli arti posteriori di topi NRG immunodeficienti per formare xenografi. Le miofibre umane trapiantate muoiono, ma le cellule staminali muscolari umane presenti nello xenotrapianto successivamente si espandono e si differenziano in nuove miofibre umane che ripopolano la lamina basale umana innestata. Pertanto, le miofibre rigenerate in questi xenotrapianto sono interamente umane e vengono spontaneamente vascolarizzate e innervate dall'ospite del topo. è importante sottolineare che il fascio, la distrofia muscolare scapopulohumerale (FSHD) del tessuto muscolare del paziente trapiantato nei topi ricapitola le caratteristiche chiave della malattia umana, vale a dire l'espressione del fattore di trascrizione DUX4 8. La FSHD è causata dalla sovraespressione del DUX4, che è epigeneticamente silenziato nel tessuto muscolare normale9,10. Nel modello xenotrapianto FSHD, il trattamento con un morfolino specifico del DUX4 ha dimostrato di reprimere con successo l'espressione e la funzione di DUX4 e può essere una potenziale opzione terapeutica per i pazienti fsHD11. Questi risultati dimostrano che gli xenogratti muscolari umani sono un nuovo approccio per modellare la malattia muscolare umana e testare potenziali terapie nei topi. Qui, descriviamo in dettaglio il metodo chirurgico per la creazione di xenografi muscolari scheletrici umani in topi immunodeficienti.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutto l'uso di campioni di ricerca da soggetti umani è stato approvato dal Johns Hopkins Institutional Review Board (IRB) per proteggere i diritti e il benessere dei partecipanti. Tutti gli esperimenti sugli animali sono stati approvati dal Johns Hopkins University Institutional Animal Care and Use Committee (IACUC) in conformità con la Guida dei National Institutes of Health (NIH) per la cura e l'uso degli animali da laboratorio. Maschio NOD-Rag1nullil2r -null topi ospiti (NRG) sono utilizzati per effettuare esperimenti di xenotrapianto. Questi topi sono alloggiati in rack ventilati e ricevono aria filtrata, temperata e umidificata HEPA, nonché acqua iperclorinata filtrata per osmosi inversa. Ai topi viene fornita acqua e una dieta antibiotica irradiata (Tabella dei materiali) al libitum, e la struttura fornisce 14 h di luce a 10 h di scuro come controllato dal timer centrale.
1. Preparazione dell'attrezzatura
- Acquisire NOD-Rag1nullIL2r -null (NRG) topi, 8-12 settimane di età.
- Apparecchiature chirurgiche autoclave: forbici, pinpe, portaa ago, cucitrice chirurgica (Tabella dei materiali), clip della ferita, salviette chirurgiche ( Tabelladei materiali) e becher ( Figura1A).
- Preparare 50 mL di mezzi muscolari (20% siero bovino fetale, 2% estratto di embrione di pulcino, 1% antibiotico/antimicotico in Prosciutti F10 Medium). Mantenere tutte le sostanze chimiche / farmaci / soluzioni utilizzati per la chirurgia a temperatura ambiente a meno che non indicato in modo diverso nel protocollo.
- Preparare una siringa da 1 mL con un ago da 26 G lungo 3/8 pollici contenente 2 mg/mL analgesiche (Tabella dei materiali) e posizionare sul ghiaccio. L'analgesico può essere diluito alla giusta concentrazione utilizzando salina tamponata sterile (PBS).
2. Preparazione chirurgica
- Ottenere una biopsia muscolare umana in base a un protocollo approvato dall'IRB da pazienti i cui muscoli mostrano forza > 4-/5 sulla scala MRC (Medical Research Council)12. Collocare il campione di ricerca in una tela Petri da 100 mm x 15 mm contenente supporti muscolari.
NOT: La scala MRC viene utilizzata nella pratica clinica come una valutazione della forza muscolare con 0 che non mostra alcuna contrazione, 5 che mostra la potenza normale e 4 (da 4 a 4) che mostra noto movimento contro la resistenza12. Abbiamo scoperto che i muscoli con debolezza da lieve a moderata (MRC > 4-5) in genere mostrano patologia della malattia, ma non sono ampiamente sostituiti da tessuto adiposo o fibrosi, entrambi che impediscono la rigenerazione dello xenotrapianto. Nel caso di tessuto autoptico in cui non è disponibile un recente punteggio MRC, la qualità muscolare è accessibile tramite osservazione lorda. Biopsie muscolari che sono rosa pallido in apparenza o hanno grandi aree di tessuto adiposo non sono suscettibili di xenotrapianto con successo. - Rimuovere qualsiasi fascia o tessuto adiposo rimanente dal campione con forbici chirurgiche utilizzando un microscopio stereo e una fonte di luce per aiutare la visualizzazione.
- Dissezionare la biopsia muscolare in circa 7 x 3 mm x 3 mm pezzi con forbici chirurgiche utilizzando il microscopio stereo e una fonte di luce. Assicurarsi che le fibre siano disposte longitudinalmente all'interno del campione.
- Posizionare il piatto Petri contenente il muscolo sezionato sul ghiaccio. In media, gli xenografi sono tenuti in media per 4 ore mentre vengono eseguiti interventi chirurgici. Tuttavia, le biopsie sono state conservate nei supporti per 24 h prima dello xenotrapianto, e questo ritardo non sembra avere un impatto negativo sul trapianto o sulla rigenerazione.
- Mettere suture sintetiche non assorbibili (Tabella dei materiali) in una piastra Petri da 100 mm x 15 mm contenente 70% di etanolo.
- Impostare un circuito di anestesia a doppia procedura: organizzare il circuito respiratorio Mapleson E al microscopio stereo e posizionare la camera di induzione in un armadio di biosicurezza (Figura 1A,B).
- Ottenere il peso del mouse NRG mettendo in un becher autoclaved su una scala, e trasferire alla camera di induzione. Indurre l'anestesia sotto il 3% isoflurane. Una volta raggiunta la profondità anestetica appropriata, come valutato dall'osservazione della frequenza respiratoria, del rilassamento muscolare e della mancanza di movimento volontario, ridurre l'impostazione del vaporizzatore all'1,5% per il resto dell'intervento.
- Trasferire il mouse dalla camera di induzione al circuito respiratorio Mapleson E e applicare unguento oftalmico agli occhi.
- Rimuovere i capelli sovrapposti al tibialis anteriore (TA) dalla caviglia al ginocchio con un trimmer, seguiti da un trattamento di 1 min con lozione per la rimozione dei capelli (Tabella dei materiali) ( Figura2A).
- Disinfettare il sito chirurgico tamponando la gamba con soluzione povidone-iodio. Quindi lavare via il restante povidone-iodio con 70% di etanolo.
- Iniettare il topo sottocutaneo con analgesico, come il carprofene, (Tabella dei materiali) ad una dose di 5 mg/kg.
3. Chirurgia Xenotrapianto
- Nastro lungo la gamba e fare un'incisione dritta sopra il muscolo tibilalis anteriore (TA) con forbici e pinze iride provenienti dai tendini distale e terminando sotto il ginocchio (Figura 2B).
- Separare la pelle dal muscolo utilizzando la dissezione smussata con forbici chirurgiche.
- Tagliare l'epimysio del muscolo TA con le forbici a partire dal tendine e terminando al ginocchio.
NOT: Questo è un taglio molto superficiale (meno di 0,5 mm; Figura 2B, linea tratteggiata nera) e la TA sottostante non dovrebbe essere danneggiata nel processo in quanto ciò renderebbe la rimozione più impegnativa. Se eseguite correttamente, le fibre muscolari si rilasseranno visibilmente. - Tagliare il tendine distale della TA con le forbici, afferrare il tendine con pinze di iride e tirare la TA verso il ginocchio (Figura 2C).
- Tagliare il tendine distale dell'estensore digitorum longus (EDL) con le forbici e tirare l'EDL verso il ginocchio (Figura 2D). Una volta che il tendine prossimale del muscolo peroneso longus (PL) è visibile, rimuovere l'EDL con le forbici (Figura 2D, linea tratteggiata verde).
- Rimuovere la TA con forbici (Figura 2D, linea tratteggiata blu) e utilizzare una salvietta chirurgica bagnata con PBS e una leggera pressione per ottenere l'epitisi (Figura 2E).
- Infilare una sutura attraverso il tendine peroneo longus (PL) prossimale (PL), lasciando circa 1,5 pollici di filo su entrambi i lati del tendine (Figura 2F).
- Eseguire la prima metà di un nodo quadrato chirurgico a due mani, ma non stringere: questo formerà un cerchio. Mettere uno xenotrapianto in questo cerchio e stringere il ciclo per fissare lo xenotrapianto. Completare l'altra metà del nodo quadrato (Figura 2G,H). Questo sutura lo xenotrapianto al tendine prossimale del PL.
- Infilare attraverso tendine PL distale e ripetere la tecnica del nodo quadrato dal passo 3.8 per legare lo xenotrapianto al tendine distale (Figura 2H,I).
NOT: L'arteria tarsale mediale e la vena possono trovarsi vicino o sopra il tendine distale del PL. Non posizionare suture attraverso o intorno a queste navi. È facile dire se una sutura è stata posizionata in modo improprio in quanto i vasi saranno sbollentare o sanguinare. In questo caso, rimuovere la sutura e posizionarla in una posizione diversa. - Tirare la pelle sul muscolo xenotrapianto, sigillare con colla chirurgica e posizionare 2-3 graffette chirurgiche sull'incisione (Figura 2J).
- Posizionare il mouse in una gabbia pulita su un pad riscaldato per recuperare. Monitorare il mouse fino a quando completamente consapevole e periodicamente nei prossimi giorni per segni di infezione sistemica locale e per garantire che il sito chirurgico non viene riaperto.
NOT: Una singola dose di analgesico come descritto al passo 2.11 è in genere sufficiente per alleviare il dolore. Tuttavia, i topi devono anche essere monitorati per il dolore persistente (ad esempio zoppia, cappotto arruffato, postura curva), e, se necessario, nuovamente dosato con analgesico a 24 ore post-operatori.
4. Collezione Xenograft
NOT: Xenografts sono in genere raccolti tra 4 A 6 mesi post-chirurgia. Tuttavia, le collezioni sono state eseguite fino a 12 mesi dopo l'intervento chirurgico.
- Mettere un becher coperto contenente 200 mL di 2 metilbutane in una scatola contenente ghiaccio secco per un minimo di 30 min prima della raccolta dello xenotrapianto.
- Indurre l'anestesia sotto il 3% di isoflurane nella camera di induzione. Una volta raggiunta la profondità anestetica appropriata, ridurre l'impostazione del vaporizzatore all'1,5% per il resto dell'intervento.
- Trasferire il mouse dalla camera di induzione al circuito respiratorio Mapleson E disposto su un microscopio stereo.
- Rimuovere i capelli sovrapposti al tibialis anteriore dalla caviglia al ginocchio con un trimmer e lozione per la rimozione dei peli. Le suture che tengono lo xenotrapianto in posizione possono essere viste attraverso la pelle (Figura 3A).
- Nastro lungo la gamba e utilizzare forbici e pinze iride per aprire la pelle sopra lo xenotrapianto fino a quando entrambe le suture sono visibili (Figura 3B). La pelle che sovrasta lo xenotrapianto può essere rimossa come dimostrato per facilitare la rimozione dello xenotrapianto.
- Utilizzare un bisturi per tagliare tra lo xenotrapianto e la tibia (Figura 3B, freccia indica il sito iniziale e la direzione di incisione). Questo libererà un lato dello xenotrapianto.
- Utilizzare un bisturi per tagliare tra il muscolo PL e il muscolo gastrocnemio(Figura 3C, incision lungo epimysium etichettato con freccia). Il PL verrà rimosso con lo xenotrapianto.
- Tagliare sotto la sutura distale e attraverso il tendine distale del PL(Figura 3D, tagliata lungo la linea tratteggiata).
- Rimuovere lo xenotrapianto e PL afferrando la sutura con pinze dell'iride e deviandola verso il ginocchio mentre si utilizzano le forbici per tagliarlo lontano dal muscolo sottostante (Figura 3E).
- Tagliare sopra la sutura prossimale con le forbici per rimuovere lo xenotrapianto e PL (Figura 3F, tagliata lungo la linea tratteggiata in 3E).
- Posizionare il campione su un piccolo pezzo di cartone o di plastica e pin il più vicino possibile alle suture. Durante l'pinning del campione, allungare delicatamente il muscolo per garantire che l'orientamento della fibra venga mantenuto durante il processo di congelamento dello snap. Dopo che i perni sono saldamente in posizione, far scorrere il muscolo fino ai perni in modo che poggia appena sopra il cartone.
NOT: In alternativa, un'estremità dello xenotrapianto può essere montata in tragacanth su un tappo di sughero, oppure può essere sommersa interamente in un composto di temperatura di taglio ottimale (O.C.T.) in un criomold. Con cura, la conformazione muscolare può essere mantenuta con entrambi i metodi. - Snap congelare lo xenotrapianto in 2 metilbutane pre-raffreddato.
- Conservare lo xenotrapianto a -80 gradi centigradi.
- Subito dopo la raccolta xenotrapianto, i topi eutanasia in conformità con le linee guida dell'American Veterinary Medical Association:
- Collocare i topi in una camera sigillata con un adeguato sistema di scavenging del gas di scarico. Uso isoflurane ad una concentrazione di 3-4% per indurre l'anestesia.
- Una volta raggiunta la profondità anestetica appropriata, come valutato dall'osservazione della frequenza respiratoria, del rilassamento muscolare e della mancanza di movimento volontario, aumentare l'impostazione del vaporizzatore al 5% per indurre la morte. Lasciare i topi nella camera per altri 2 min dopo che la respirazione è cessata. La morte è verificata osservando che i topi non riescono a recuperare entro 10 min dopo sovradosaggio di isoflurane.
- Infine, eseguire lussazione cervicale sui topi.
NOT: Nel caso di topi xenotrapianto bilaterali, lo xenotrapianto contralaterale può essere salvato per una raccolta successiva. Per eseguire una raccolta di sopravvivenza, aprire la pelle sovrapposta allo xenotrapianto con un singolo taglio dritto con forbici chirurgiche e rimuovere lo xenotrapianto come descritto nei passi da 4.6 a 4.10. Quindi chiudere la pelle sopra il vano tibiale vuoto utilizzando colla chirurgica e graffette. Trattare il topo con analgesico come descritto al punto 2.11 e posizionare il mouse in gabbia pulita su tampone riscaldato per recuperare. Monitorare il mouse fino a quando completamente consapevole e periodicamente nei prossimi giorni per segni di infezione sistemica locale e per garantire che il sito chirurgico non viene riaperto.
5. Immunohistochimica Xenotrapianto
- Utilizzare un criostato per tagliare da 10 a 12 sezioni m dalle xenogratrine raccolte su vetrini caricati positivamente (Tabella dei materiali).
- Riempire il barattolo di colorazione con metanolo e pre-raffreddare a -20 gradi centigradi per 30 min.
- Mettere i vetrini in metanolo freddo ghiaccio per 10 min per fissare e permeabilizzare le sezioni xenotrapianto.
- Mettere i vetrini in barattolo di colorazione e lavare 3x con salina tampone fosfato (PBS) per 5 min.
- Blocco con IgG antitomouse (Tabella dei materiali) per 2 h a 4 gradi centigradi.
- Blot con anticorpi primari, come la spettrostrina, laminA/C, e la miosina embrionale (Tabella dei materiali) in PBS integrato con il 2% di siero di capra durante la notte a 4 gradi centigradi.
- Mettere i vetrini in un barattolo di colorazione e lavare 3x con salina tampone fosfato (PBS) per 5 min.
- Blot con anticorpi secondari coniugati fluorescente (Tabella dei materiali) in PBS integrati con siero di capra del 2% per 1 h a temperatura ambiente.
- Mettere i vetrini in barattolo di colorazione e lavare 3x con salina tampone fosfato (PBS) per 5 min.
- Posizionare il supporto di montaggio (Table of Materials) sopra le sezioni di xenogri, posizionare coverslip sulla parte superiore e utilizzare lo smalto per sigillare il coperchio.
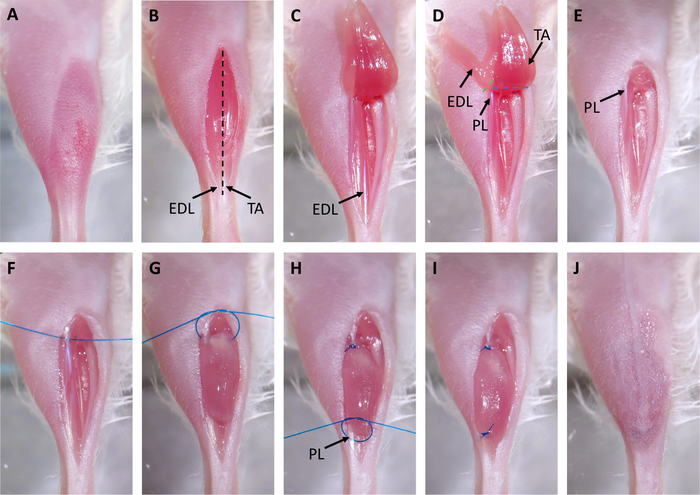
Figura 2: Chirurgia dello Xenotrapianto. (A) I capelli vengono rimossi dal sito chirurgico. (B) Un'incisione viene effettuata sopra il tibialis anteriore (TA). I tendini distale del TA e dell'estensore digitorum longus (EDL) sono contrassegnati con frecce. La linea tratteggiata nera indica dove verrà tagliato l'epimysio al punto 3.3. (C) Il tendine distale della TA viene tagliato e il muscolo viene tirato fino al ginocchio. (D) Il tendine dell'EDL viene tagliato e l'EDL viene tirato fino al ginocchio. Questo espone il tendine prossimale del peroneo longus (PL) contrassegnato con una freccia. Le linee tratteggiate indicano dove tagliare con le forbici per rimuovere l'EDL (verde) e il PL (blu). (E) L'EDL e la TA vengono rimossi. (F) Una sutura viene posta attraverso il tendine prossimale del PL. (G) Lo xenotrapianto viene posto nel compartimento tibiale vuoto e suturato al tendine pISciale PL utilizzando un nodo quadrato chirurgico a due mani. (H) Una sutura viene posta attraverso il tendine distale del PL, contrassegnato con una freccia, e un altro nodo quadrato chirurgico a due mani viene utilizzato per suturare lo xenotrapianto al tendine distale. (I) Lo xenotrapianto è completamente trapiantato e suturato al PL. (J) La pelle è chiusa con colla chirurgica. Fare clic qui per visualizzare una versione più grande di questa figura.
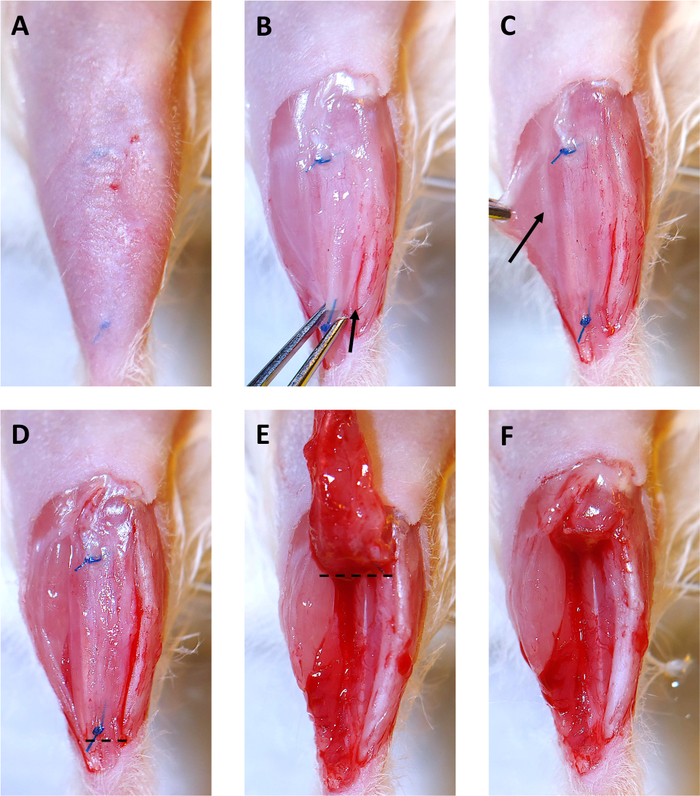
Figura 3: Collezione Xenotrapianto di 4 mesi. (A) I capelli vengono rimossi dal sito chirurgico. Le suture sono visibili sotto la pelle. (B) La pelle sovrastante lo xenotrapianto viene rimossa. Quindi lo xenotrapianto viene afferrato con le pinze dell'iride alla sutura disal e delicatamente tirato verso l'alto. A partire dalla caviglia, un bisturi viene utilizzato per tagliare lungo la tibia e liberare lo xenotrapianto. La freccia mostra l'inizio dell'incisione lungo la tibia. (C) Tirando il muscolo gastrocnemio di lato, una debole linea bianca di epimysio che separa il muscolo peroneo longus (PL) e il gastrocnemio (mostrato dalla freccia) diventa visibile. Utilizzare il bisturi per tagliare lungo questa linea per separare il PL dagli altri muscoli delle gambe. (D) Il lato destro dello xenotrapianto, e il PL sono ora liberi dagli altri muscoli della gamba e sono pronti per la rimozione. La linea tratteggiata indica dove tagliare con le forbici chirurgiche per iniziare a rimuovere lo xenotrapianto e PL. (E) Dopo il taglio sotto la sutura distale, deviare lo xenotrapianto verso il ginocchio. La linea tratteggiata indica dove tagliare con le forbici chirurgiche per rimuovere lo xenotrapianto e il PL dal vano tibiale. (F) Lo scomparto tibiale vuoto con lo xenotrapianto e il PL sono stati rimossi con successo. Fare clic qui per visualizzare una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
Come dimostrato da Yuanfan e altri, questo protocollo chirurgico è un metodo semplice per produrre xenografi muscolari scheletrici umani8. Gli xenogratto rigenerati diventano spontaneamente innervati e mostrano contrattilità funzionale. Inoltre, lo xenotrapianto muscolare da parte dei pazienti affetti da FSHD riassume i cambiamenti nell'espressione genica osservati nei pazienti affetti da FSHD8.
Nella nostra esperienza, circa 7 degli 8 xenograf...
Access restricted. Please log in or start a trial to view this content.
Discussione
Gli xenografi derivati dal paziente sono un modo innovativo per modellare le malattie muscolari e condurre studi preclinici. Il metodo qui descritto per creare xenogratti muscolari scheletrici è rapido, diretto e riproducibile. Gli interventi chirurgici unilaterali possono essere eseguiti in 15-25 minuti, o bilateralmente in 30 a 40 minuti. Gli xenotrapianto bilaterali possono fornire ulteriore flessibilità sperimentale. Per esempio, i ricercatori possono eseguire il trattamento localizzato di uno xenotrapianto, con l'...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto da The Myositis Association e dalla Peter Buck Foundation. Ringraziamo il Dr. Yuanfan e sprondin per aver condiviso la sua esperienza e la sua formazione nella tecnica chirurgica dello xenotrapianto.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 100 mm x 15 mm Petri dish | Fisher Scientific | FB0875712 | |
| 2-Methylbutane | Fisher | O3551-4 | |
| 20 mm x 30 mm micro cover glass | VWR | 48393-151 | |
| Animal Weighing Scale | Kent Scientific | SCL- 1015 | |
| Antibiotic-Antimycotic Solution | Corning, Cellgro | 30-004-CI | |
| AutoClip System | F.S.T | 12020-00 | |
| Castroviejo Needle Holder | F.S.T | 12565-14 | |
| Chick embryo extract | Accurate | CE650TL | |
| CM1860 UV cryostat | Leica Biosystems | CM1860UV | |
| Coplin staining jar | Thermo Scientific | 19-4 | |
| Dissection Pins | Fisher Scientific | S13976 | |
| Dry Ice - pellet | Fisher Scientific | NC9584462 | |
| Embryonic Myosin antibody | DSHB | F1.652 | recommended concentration 1:10 |
| Ethanol | Fisher Scientific | 459836 | |
| Fetal Bovine Serum | GE Healthcare Life Sciences | SH30071.01 | |
| Fiber-Lite MI-150 | Dolan-Jenner | Mi-150 | |
| Forceps | F.S.T | 11295-20 | |
| Goat anti-mouse IgG1, Alexa Fluor 488 | Invitrogen | A-21121 | recommended concentration 1:500 |
| Goat anti-mouse IgG2b, AlexaFluor 594 | Invitrogen | A-21145 | recommended concentration 1:500 |
| Gum tragacanth | Sigma | G1128 | |
| Hams F-10 Medium | Corning | 10-070-CV | |
| Histoacryl Blue Topical Skin Adhesive | Tissue seal | TS1050044FP | |
| Human specific lamin A/C antibody | Abcam | ab40567 | recommended concentration 1:50-1:100 |
| Human specific spectrin antibody | Leica Biosystems | NCLSPEC1 | recommended concentration 1:20-1:100 |
| Induction Chamber | VetEquip | 941444 | |
| Iris Forceps | F.S.T | 11066-07 | |
| Irradiated Global 2018 (Uniprim 4100 ppm) | Envigo | TD.06596 | Antibiotic rodent diet to protect again respiratory infections |
| Isoflurane | MWI Veterinary Supply | 502017 | |
| Kimwipes | Kimberly-Clark | 34155 | surgical wipes |
| Mapleson E Breathing Circuit | VetEquip | 921412 | |
| Methanol | Fisher Scientific | A412 | |
| Mobile Anesthesia Machine | VetEquip | 901805 | |
| Mouse on Mouse Basic Kit | Vector Laboratories | BMK-2202 | mouse IgG blocking reagent |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| NAIR Hair remover lotion/oil | Fisher Scientific | NC0132811 | |
| NOD-Rag1null IL2rg null (NRG) mice | The Jackson Laboratory | 007799 | 2 to 3 months old |
| O.C.T. Compound | Fisher Scientific | 23-730-571 | |
| Oxygen | Airgas | OX USPEA | |
| PBS (phosphate buffered saline) buffer | Fisher Scientific | 4870500 | |
| Povidone Iodine Prep Solution | Dynarex | 1415 | |
| ProLong™ Gold Antifade Mountant | Fisher Scientific | P10144 (no DAPI); P36935 (with DAPI) | |
| Puralube Ophthalmic Ointment | Dechra | 17033-211-38 | |
| Rimadyl (carprofen) injectable | Patterson Veterinary | 10000319 | surgical analgesic, administered subcutaneously at a dose of 5 mg/kg |
| Scalpel Blades - #11 | F.S.T | 10011-00 | |
| Scalpel Handle - #3 | F.S.T | 10003-12 | |
| Stereo Microscope | Accu-scope | 3075 | |
| Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Suture, Synthetic, Non-Absorbable, 30 inches long, CV-11 needle | Covidien | VP-706-X | |
| 1ml Syringe (26 gauge, 3/8 inch needle) | BD Biosciences | 329412 | |
| Trimmer | Kent Scientific | CL9990-KIT | |
| Vannas Spring Scissors, 8.0 mm cutting edge | F.S.T | 15009-08 | |
| VaporGaurd Activated Charcoal Filter | VetEquip | 931401 | |
| Wound clips, 9 mm | F.S.T | 12022-09 |
Riferimenti
- Wong, C. H., Siah, K. W., Lo, A. W. Estimation of clinical trial success rates and related parameters. Biostatistics. 0, 1-14 (2018).
- Hay, M., Thomas, D. W., Craighead, J. L., Economides, C., Rosenthal, J. Clinical development success rates for investigational drugs. Nature Biotechnology. 32, 40-51 (2014).
- Perel, P., et al. Comparison of treatment effects between animal experiments and clinical trials: systematic review. BMJ. 334, 1-6 (2007).
- Rubio-Viqueira, B., Hidalgo, M. Direct in vivo xenograft tumor model for predicting chemotherapeutic drug response in cancer patients. Clinical Pharmacology Therapeutics. 85, 217-221 (2009).
- Roberts, K. G., et al. Targetable Kinase-Activating Lesions in Ph-like Acute Lymphoblastic Leukemia. New England Journal of Medicine. 371, 1005-1015 (2014).
- Kim, J., et al. GDF11 Controls the Timing of Progenitor Cell Competence in Developing Retina. Science. 308, 1927-1930 (2005).
- Sako, D., et al. Characterization of the ligand binding functionality of the extracellular domain of activin receptor type IIB. Journal of Biological Chemisty. 285, 21037-21048 (2010).
- Zhang, Y., et al. Human skeletal muscle xenograft as a new preclinical model for muscle disorders. Human Molecular Genetics. 23, 3180-3188 (2014).
- Gabellini, D., Green, M. R., Tupler, R. Inappropriate Gene Activation in FSHD : A Repressor Complex Binds a Chromosomal Repeat Deleted in Dystrophic Muscle. Cell. 110, 339-348 (2002).
- Lemmers, R. J. L. F., et al. A Unifying Genetic Model for Facioscapulohumeral Muscular Dystrophy. Science. 329, 1650-1654 (2010).
- Chen, J. C. J., et al. Morpholino-mediated Knockdown of DUX4 Toward Facioscapulohumeral Muscular Dystrophy Therapeutics. Molecular Therapy. 24, 1405-1411 (2016).
- Medical Research Council. Aids to the investigation of the peripheral nervous system. , Her Majesty’s Stationary Office. London. (1943).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21, 2348-2356 (2017).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon