このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
免疫不全マウスにおけるヒト骨格筋異種移植片の実行
要約
複雑な人間の疾患は、従来の実験室モデルシステムでモデル化するのが難しい場合があります。ここでは、ヒト骨格筋生検を免疫不不十分マウスに移植することにより、ヒト筋疾患をモデル化する外科的アプローチについて述べた。
要約
動物実験で観察される治療効果は、多くの場合、臨床試験で要約に失敗します。この問題は多面的ですが、この失敗の理由の1つは、不十分なラボモデルの使用です。従来の実験室生物における複雑なヒト疾患のモデル化は困難であるが、この問題はヒト異種移植片の研究を通じて回避することができる。ここで説明する外科的方法は、筋肉疾患をモデル化し、前臨床試験を行うために使用することができるヒト骨格筋異種移植片の作成を可能にする。機関レビュー委員会(IRB)承認プロトコルの下で、骨格筋標本は患者から取得され、その後NOD-Rag1 nullIL2rγヌル(NRG)宿主マウスに移植される。これらのマウスは、成熟したリンパ球を作ることができないため、移植研究のための理想的な宿主であり、したがって、細胞媒介性および体液性適応免疫応答を開発することができない。宿主マウスはイソルランで麻酔され、マウス脛骨前部および伸張デジコラム長い筋肉が除去される。人間の筋肉の一部は、空の脛骨コンパートメントに配置され、ペロンヌス長い筋肉の近位および遠位腱に縫合される。異種移植された筋肉は、マウス宿主によって自発的に血管化され、活性化され、前臨床研究のモデルとして機能し得るヒト筋肉を強く再生する。
概要
臨床試験を受けているすべての薬剤開発プログラムのわずか13.8%が成功し、承認された治療法1につながることが報告されています。この成功率は、以前に報告された10.4%よりも高いですが、まだ改善の余地があります。臨床試験の成功率を高めるための1つのアプローチは、前臨床研究で使用される実験室モデルを改善することです。食品医薬品局(FDA)は、第1相臨床試験の前に治療効果を示し、毒性を評価するために動物研究を必要とします。しかし、動物実験と臨床試験3の間の治療結果には、しばしば限られた一致がある。さらに、前臨床動物研究の必要性は、受け入れられた動物モデルを欠いている疾患の治療開発のための克服不可能な障壁であり、これはしばしば稀または散発性疾患の場合である。
ヒト疾患をモデル化する1つの方法は、ヒト組織を免疫不全マウスに移植して異種移植片を生成することである。異種移植片モデルには3つの主要な利点があります:まず、他の動物モデルでは再現できない可能性のあるヒト疾患に存在する複雑な遺伝的およびエピジェネティックな異常を要約することができます。第二に、異種移植片は、患者のサンプルが利用可能な場合、希少または散発性疾患をモデル化するために使用することができる。第三に、異種移植片は、生体内の完全な内で疾患をモデル化する。これらの理由から、異種移植片モデルにおける治療効果の結果は、患者の試験に翻訳する可能性が高いと仮定する。ヒト腫瘍異種移植片は、多発性骨髄腫を含む一般的な癌の治療法の開発に既に成功しており、個々の患者に対する個別化療法4、5、6、 7.
最近、異種移植片は、ヒト筋疾患8のモデルを開発するために使用されている。このモデルでは、ヒト筋肉生検標本を免疫不全NRGマウスの後肢に移植し、異種移植片を形成する。移植されたヒト筋線維は死ぬが、異種移植片に存在するヒト筋肉幹細胞は、その後、生着したヒト基底ラミナを再び生人口する新しいヒト筋線維に拡大して分化する。したがって、これらの異種移植片中の再生されたミオ繊維は完全にヒトであり、マウス宿主によって自発的に可逆化され、インビナー化される。重要なことに、マウスに移植された筋組織筋ジストロフィー(FSHD)患者の筋肉組織は、ヒト疾患の主要な特徴、すなわちDUX4転写因子8の発現を要約する。FSHDは、正常な筋肉組織9、10でエピジェネティックに沈黙しているDUX4の過剰発現によって引き起こされる。FSHD異種移植片モデルでは、DUX4特異的モルフォリノによる治療は、DUX4発現および機能を正常に抑圧することが示されており、FSHD患者11に対する潜在的な治療選択肢となりうる。これらの結果は、ヒト筋異種移植片がヒト筋肉疾患をモデル化し、マウスの潜在的な治療法をテストする新しいアプローチであることを示している。ここでは、免疫不全マウスにおけるヒト骨格筋異種移植片を作成する外科的方法を詳細に説明する。
Access restricted. Please log in or start a trial to view this content.
プロトコル
ヒト被験者からの研究標本の使用はすべて、参加者の権利と福祉を保護するためにジョンズ・ホプキンス機関審査委員会(IRB)によって承認されました。すべての動物実験は、ジョンズ・ホプキンス大学の施設動物管理・使用委員会(IACUC)によって、実験動物のケアと使用に関する国立衛生研究所(NIH)ガイドに従って承認されました。雄NOD−Rag1ヌルIL2rγ(NRG)宿主マウス(生後8〜12週)は、異種移植片実験を行うために使用される。これらのマウスは、換気ラックに収容され、HEPA濾過、強化、加湿空気、逆浸透濾過過塩素水を与えられる。マウスには水と照射された抗生物質食(材料表)アドリビタムが提供され、施設は中央タイマーによって制御される暗い10時間に14時間の光を提供する。
1. 設備の準備
- NOD-Rag1ヌルIL2rγ(NRG)マウスを取得し、8〜12週齢。
- オートクレーブ手術器具:はさみ、鉗子、針ホルダー、手術用ホッチキス(材料の表)、創傷クリップ、外科ワイプ(材料の表)、ビーカー(図1A)。
- 筋肉培地の50 mLを調(20%胎児ウシ血清、2%ひよこ胚抽出物、ハムF10培地で1%の抗生物質/抗マイコティック)を調剤する。プロトコルで異なる方法で記載されていない限り、手術に使用されるすべての化学物質/薬物/溶液を室温で保管してください。
- 2mg/mL鎮痛薬(材料の表)を含む長さ3/8インチの26G針で1 mL注射器を準備し、氷の上に置きます。鎮痛薬は、無菌リン酸緩衝生理食生(PBS)を用いて適切な濃度に希釈することができる。
2. 外科的準備
- MRC(医学研究評議会)スケール12で筋肉が強度>4-/5を示す患者からIRB承認プロトコルの下でヒト筋肉生検を得る。研究標本を筋肉媒体を含む100mm x 15mmペトリ皿に入れます。
注:MRCスケールは、収縮を示さない0、正常な力を示す5、抵抗12に対する動きを示す4(4-4+)との筋力の評価として臨床実践で使用される。軽度から中等度の衰弱(MRC>4-/5)を有する筋肉は、通常、疾患病理を示すが、脂肪組織または線維症に広範囲に置き換えられていないことが判明した。最近のMRCスコアが利用できない解剖組織の場合、筋肉の質は総観察によってアクセスすることができる。外観が薄いピンク色または脂肪組織の大きな領域を持つ筋肉生検は、異種移植片が正常に起こりそうにない。 - ステレオ顕微鏡と光源を使用して、可視化を支援する外科用ハサミで標本から残りの筋膜または脂肪組織を取り除きます。
- ステレオ顕微鏡と光源を使用して、外科的はさみで約7mm x 3 mm x 3 mmの部分に筋肉生検を解剖します。繊維が試料内に縦方向に配置されていることを確認します。
- 解剖した筋肉を含むペトリ皿を氷の上に置きます。平均して、異種移植片は、手術が行われている間、4時間メディアに保持されます。しかし、生検は異種移植前に24時間培地に保存されており、この遅延は移植や再生に悪影響を及ぼすようには見えなかった。
- 70%エタノールを含む100mm x 15mmペトリ皿に合成、非吸収性縫合糸(材料の表)を置きます。
- 二重手順麻酔回路をセットアップする:ステレオ顕微鏡上にメープルソンE呼吸回路を配置し、誘導室をバイオセーフティキャビネットに配置する(図1A、B)。
- スケール上のオートクレーブビーカーに入れ、誘導室に転送することにより、NRGマウスの重量を得る。3%イソファルランの下で麻酔を誘発する。呼吸数、筋肉の弛緩、自発的な運動の欠如の観察によって評価される適切な麻酔深さが達成されると、残りの手術の気化器の設定を1.5%に減らす。
- 誘導室からメープルソンE呼吸回路にマウスを移し、眼のオチントを眼に塗布する。
- 脛骨前部(TA)をトリマーで足首から膝に覆った毛を取り除き、続いて脱毛ローション(材料表)で1分の治療を行う(図2A)。
- ポビドネヨウ素溶液で脚を洗い流すことによって外科部位を消毒する。その後、残りのポビドネヨウ素を70%エタノールで洗い流します。
- 5mg/kgの用量で、カルプロフェン(材料の表)などの鎮痛薬でマウスを皮下に注入する。
3. 異種移植手術
- 脚をテープで留め、遠位腱から生じ、膝の下に終端するはさみと虹彩鉗子を持つチビラリス前部(TA)筋の上にまっすぐ切開する(図2B)。
- 外科的はさみで鈍い解剖を使用して筋肉から皮膚を分離する。
- 腱から始まり膝で終わるはさみでTA筋肉のエピミウムを切り取る。
注:これは非常に表面的なカットです(0.5ミリメートル未満。図2B、黒い破線)と基礎となるTAは、除去がより困難になるため、プロセスで損傷を受けるべきではありません。正しく行われると、筋線維は目に見えてリラックスします。 - TAの遠位腱をハサミで切り、虹彩鉗子で腱をつかみ、TAを膝に向かって引き上げる(図2C)。
- 伸縮性ジトジョルム長さ(EDL)の遠位腱をはさみで切り、EDLを膝に向かって引き上げる(図2D)。胸膜長い(PL)筋の近位腱が見えたら、はさみでEDLを取り除く(図2D、緑色の破線)。
- はさみでTAを取り外し(図2D、青い破線)、PBSとわずかな圧力で濡れた外科的ワイプを使用して止止めを達成します(図2E)。
- 近位ペロンロン(PL)腱とトリムを通して縫合糸を通し、腱の両側に約1.5インチの糸を残します(図2F)。
- 両手の外科正方形の結び目の前半を実行しますが、締め付けないでください:これは円を形成します。この円に異種移植片を置き、異種移植片を確保するためにループを締めます。正方形の結び目の残りの半分を完了します (図 2G,H).これは、異種移植片をPLの近位腱に縫合する。
- 遠位PL腱を通して糸縫合し、ステップ3.8から正方形結び目技術を繰り返し、異種移植片を遠位腱に結びつける(図2H,I)。
注:中間タール動脈および静脈はPLの遠位腱の近くまたは上にある。縫合糸を通して、またはこれらの容器の周りに配置しないでください。縫合糸が不適切に配置されているかどうかは、血管がブランチまたは出血する場合に簡単にわかります。この場合は、縫合糸を取り外し、別の場所に配置します。 - 異種移植された筋肉の上に皮膚を引っ張り、外科接着剤でシールし、切開部の上に2-3の外科ステープルを置く(図2J)。
- 回復するために、加熱されたパッド上のきれいなケージにマウスを置きます。局所的な全身感染の兆候のために、そして外科部位が再び開かれないようにするために、完全に意識し、今後数日間定期的にマウスを監視してください。
注:ステップ2.11に記載されている鎮痛薬の単回投与は、通常、痛みの軽減のために十分である。しかし、マウスはまた、持続的な痛み(例えば、ラメネス、フリルコート、ハンチング姿勢)を監視し、必要に応じて、術後24時間で鎮痛剤で再剤薬を行う必要があります。
4. 異種移植片コレクション
注:異種移植片は通常、手術後4~6ヶ月の間に採取される。しかし、コレクションは手術後12ヶ月まで行われています。
- 2-メチルブタンの200mLを含む覆われたビーカーを、異種移植片採取の前に最低30分間ドライアイスを含む箱に入れます。
- 誘導室で3%イソファルランの下で麻酔を誘発する。適切な麻酔深さが達成されたら、手術の残りの部分のための気化器の設定を1.5%に減らす。
- 誘導室からステレオ顕微鏡に配置されたメープルソンE呼吸回路にマウスを移します。
- トリマーと脱毛ローションで足首から膝に脛骨前に覆われた髪を取り除きます。異種移植片を所定の位置に保持する縫合糸は、皮膚を通して見ることができる(図3A)。
- 脚をテープで留め、はさみと虹彩鉗子を使用して、両方の縫合糸が見えるまで異種移植片の上に皮膚を開きます(図3B)。異種移植片の上に皮膚は、異種移植片の除去を容易にするために示されているように除去することができる。
- メスを使用して異種移植片と脛間の間を切断する(図3B、矢印は切開の初期部位および方向を示す)。これは異種移植片の片側を解放します。
- PL筋と胃腸筋の間を切り取るためにメスを使用する(図3C、矢印で標識されたエピミシウムに沿ってi ncision)。PLは異種移植片で除去される。
- 遠位縫合糸の下とPLの遠位腱を通してカットします(図3D、点線に沿ってカット)。
- 異種移植片とPLを虹彩鉗子でつかみ、ハサミを使って下の筋肉から切り離しながら膝に向かって偏向させる(図3E)。
- 異種移植片とPLを除去するためにハサミで近位縫合糸の上にカットします(図3F、3Eの点線に沿ってカット)。
- 試料を段ボールやプラスチックの小片に置き、できるだけ縫合糸の近くにピンを置きます。試料を固定しながら、筋肉をそっと伸ばして、スナップ凍結プロセス中に繊維の向きが維持されるようにします。ピンがしっかりと所定の位置に置かれたら、筋肉をピンの上にスライドさせて、段ボールのすぐ上に置きます。
注:あるいは、異種移植片の一方の端をコルク上のトラガカンスに取り付けることができるか、またはクライモルド中の最適な切断温度(O.C.T.)化合物に完全に沈めることができる。注意して、筋肉の立体構造は両方の方法で保持することができる。 - スナップは、予め冷却された2-メチルブタンで異種移植片を凍結します。
- 異種移植片を-80 °C.で保存します。
- 異種移植片の採取直後に、米国獣医学会のガイドラインに従ってマウスを安楽死させる:
- 適切な廃棄物ガス清掃システムを備えた密閉室にマウスを置きます。麻酔を誘発するために3-4%の濃度でイソファランを使用する。
- 呼吸数、筋肉の弛緩、自発的な運動の欠如の観察によって評価される適切な麻酔深さが達成されると、気化器の設定を5%に増やして死を誘発する。呼吸が止まった後、さらに2分間、マウスをチャンバーに残します。イソムランの過剰摂取後10分以内にマウスが回復しないのを観察することによって死亡が確認される。
- 最後に、マウスの子宮頸部脱臼を行う。
注:両側異種移植マウスの場合、反対方異種異片片片は、後のコレクションのために保存することができる。生存コレクションを実行するには、異種移植片の上に外科はさみで単一のストレートカットで皮膚を開き、ステップ4.6から4.10に記載されている異種移植片を除去する。その後、外科的接着剤とステープルを使用して、空の脛骨コンパートメントの上に皮膚を閉じます。手順 2.11 に記載されているように鎮痛薬でマウスを扱い、回復するために加熱されたパッドのきれいなケージにマウスを置きます。局所的な全身感染の兆候を数日間にわたって完全に意識し、定期的にマウスを監視し、外科的部位が再び開かれないようにする。
5. 異種移植片免疫組織化学
- クライオスタットを使用して、収集した異種移植片から正に帯電したスライド(材料の表)に10~12μmのセクションを切断します。
- 染色瓶をメタノールで充填し、-20°Cで30分間予冷します。
- 氷冷メタノールにスライドを10分間置き、異種移植片の切片を固定し、透過させます。
- 染色瓶にスライドを入れ、リン酸緩衝生理食生(PBS)で3倍を5分間洗います。
- 4°Cで2時間の抗マウスIgG(材料のテーブル)でブロックします。
- PBS中のスペクトルリン、ラミンA/C、胚性ミオシン(材料表)などの一次抗体を含むブロットは、4°Cで一晩2%ヤギ血清を補充した。
- スライディングジャーにスライドを入れ、リン酸緩衝生理食生(PBS)で3倍を5分間洗います。
- PBSにおける蛍光色素共役二次抗体(材料表)を用いたブロットを室温で1時間2%ヤギ血清で補充した。
- 染色瓶にスライドを入れ、リン酸緩衝生理食生(PBS)で3倍を5分間洗います。
- 異種移植片のセクションの上に取り付け媒体(材料のテーブル)を置き、カバースリップを上に置き、カバースリップを密封するためにマニキュアを使用します。
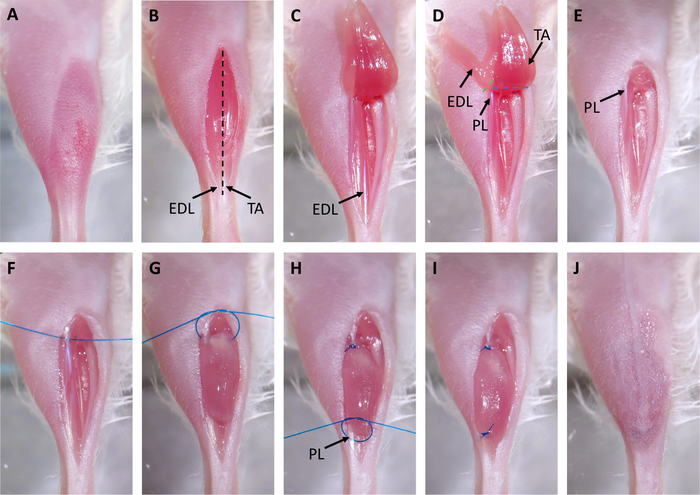
図2:異種移植片手術。(A)毛髪は手術部位から取り除かれる。(B)脛骨前部(TA)上に切開が行われます。TAおよび伸張デジコラム長年(EDL)の遠位腱は矢印でマークされる。黒い破線は、ステップ 3.3 でエピミシウムが切断される場所を示します。(C)TAの遠位腱を切り、筋肉を膝まで引き上げる。(D)EDLの腱を切断し、EDLを膝まで引き上げる。これは、矢印でマークされたペロンロンダス(PL)の近位腱を露出させる。破線は、EDL(緑)とPL(青)を取り除くためにはさみで切る場所を示します。(E)EDL と TA が削除されます。(F)縫合糸は、PL.(G)異種移植片を空の脛骨室に置き、両手外科正方形結び目を用いて近位PL腱に縫合する。(H)縫合糸は、矢印でマークされたPLの遠位腱を通して配置され、別の両手外科正方形結び目が遠位腱に異種移植片を縫合するために使用される。(I)異種移植片は完全に移植され、PLに縫合される(J)皮膚は外科的接着剤で閉じられる。この図のより大きなバージョンを表示するには、ここをクリックしてください。
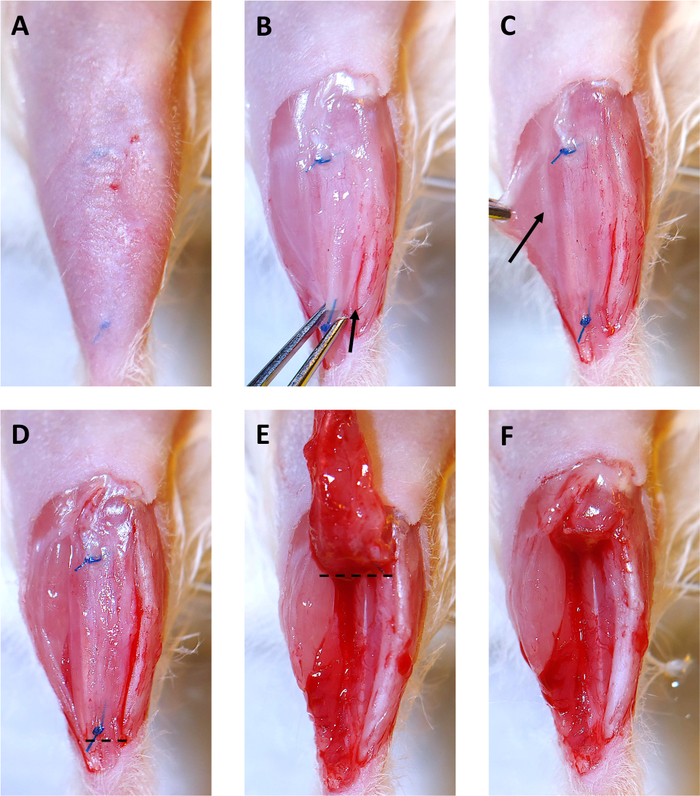
図3:4ヶ月異種移植片コレクション。(A)毛髪は手術部位から取り除かれる。縫合糸は皮膚の下に見える。(B)異種移植片の上に重なった皮膚が除去される。その後、異種移植片は遠位縫合糸で虹彩鉗子でつかまれ、穏やかに上向きに引っ張られる。足首から始まり、メスは脛に沿って切断し、異種移植片を解放するために使用されます。矢印は脛間に沿って切開の始まりを示す。(C)胃筋を横に引っ張ることで、腹膜長体(PL)筋と胃腸血症(矢印で示す)を分離するエピミウムのかすかな白線が見えるようになります。他の脚の筋肉からPLを分離するために、このラインに沿ってカットするためにメスを使用してください。(D)異種移植片の右側、およびPLは現在、脚の他の筋肉から解放され、除去の準備ができています。破線は、異種移植片およびPL.(E)を遠位縫合糸の下に切断した後、膝に向かって異種移植片を偏向させるために外科ハサミで切断する場所を示す。破線は脛骨のコンパートメントから異種移植片およびPLを取除くために外科はさみで切る場所を示す。(F)異種移植片とPLを持つ空の脛骨コンパートメントが正常に除去された。この図のより大きなバージョンを表示するには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
結果
Yuanfan Zhangらによって示されるように、この外科的プロトコルは、ヒト骨格筋異種移植片8を産生する簡単な方法である。再生された異種移植片は自発的にインナーベーター化し、機能的収縮性を示す。加えて、FSHD患者から移植された筋肉異種移植片は、FSHD患者8で観察された遺伝子発現の変化を要約する。
我々の経験では、コントロー...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
患者由来の異種移植片は、筋肉疾患をモデル化し、前臨床試験を行う革新的な方法です。骨格筋異種移植片を作成するためにここで説明する方法は、迅速、簡単、および再現性があります。一方的な手術は15~25分、または30~40分で両側手術が可能です。両側異種移植片は、追加の実験的柔軟性を提供することができます。例えば、研究者は、一方の異種移植片の局所的な治療を行うことができ...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、彼らが競合する金銭的利益を持っていないと宣言します。
謝辞
この作品は、筋炎協会とピーターバック財団によって支援されました。異種移植片の外科技術に関する専門知識と訓練を共有してくれたユアンファン・チャン博士に感謝します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 100 mm x 15 mm Petri dish | Fisher Scientific | FB0875712 | |
| 2-Methylbutane | Fisher | O3551-4 | |
| 20 mm x 30 mm micro cover glass | VWR | 48393-151 | |
| Animal Weighing Scale | Kent Scientific | SCL- 1015 | |
| Antibiotic-Antimycotic Solution | Corning, Cellgro | 30-004-CI | |
| AutoClip System | F.S.T | 12020-00 | |
| Castroviejo Needle Holder | F.S.T | 12565-14 | |
| Chick embryo extract | Accurate | CE650TL | |
| CM1860 UV cryostat | Leica Biosystems | CM1860UV | |
| Coplin staining jar | Thermo Scientific | 19-4 | |
| Dissection Pins | Fisher Scientific | S13976 | |
| Dry Ice - pellet | Fisher Scientific | NC9584462 | |
| Embryonic Myosin antibody | DSHB | F1.652 | recommended concentration 1:10 |
| Ethanol | Fisher Scientific | 459836 | |
| Fetal Bovine Serum | GE Healthcare Life Sciences | SH30071.01 | |
| Fiber-Lite MI-150 | Dolan-Jenner | Mi-150 | |
| Forceps | F.S.T | 11295-20 | |
| Goat anti-mouse IgG1, Alexa Fluor 488 | Invitrogen | A-21121 | recommended concentration 1:500 |
| Goat anti-mouse IgG2b, AlexaFluor 594 | Invitrogen | A-21145 | recommended concentration 1:500 |
| Gum tragacanth | Sigma | G1128 | |
| Hams F-10 Medium | Corning | 10-070-CV | |
| Histoacryl Blue Topical Skin Adhesive | Tissue seal | TS1050044FP | |
| Human specific lamin A/C antibody | Abcam | ab40567 | recommended concentration 1:50-1:100 |
| Human specific spectrin antibody | Leica Biosystems | NCLSPEC1 | recommended concentration 1:20-1:100 |
| Induction Chamber | VetEquip | 941444 | |
| Iris Forceps | F.S.T | 11066-07 | |
| Irradiated Global 2018 (Uniprim 4100 ppm) | Envigo | TD.06596 | Antibiotic rodent diet to protect again respiratory infections |
| Isoflurane | MWI Veterinary Supply | 502017 | |
| Kimwipes | Kimberly-Clark | 34155 | surgical wipes |
| Mapleson E Breathing Circuit | VetEquip | 921412 | |
| Methanol | Fisher Scientific | A412 | |
| Mobile Anesthesia Machine | VetEquip | 901805 | |
| Mouse on Mouse Basic Kit | Vector Laboratories | BMK-2202 | mouse IgG blocking reagent |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| NAIR Hair remover lotion/oil | Fisher Scientific | NC0132811 | |
| NOD-Rag1null IL2rg null (NRG) mice | The Jackson Laboratory | 007799 | 2 to 3 months old |
| O.C.T. Compound | Fisher Scientific | 23-730-571 | |
| Oxygen | Airgas | OX USPEA | |
| PBS (phosphate buffered saline) buffer | Fisher Scientific | 4870500 | |
| Povidone Iodine Prep Solution | Dynarex | 1415 | |
| ProLong™ Gold Antifade Mountant | Fisher Scientific | P10144 (no DAPI); P36935 (with DAPI) | |
| Puralube Ophthalmic Ointment | Dechra | 17033-211-38 | |
| Rimadyl (carprofen) injectable | Patterson Veterinary | 10000319 | surgical analgesic, administered subcutaneously at a dose of 5 mg/kg |
| Scalpel Blades - #11 | F.S.T | 10011-00 | |
| Scalpel Handle - #3 | F.S.T | 10003-12 | |
| Stereo Microscope | Accu-scope | 3075 | |
| Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Suture, Synthetic, Non-Absorbable, 30 inches long, CV-11 needle | Covidien | VP-706-X | |
| 1ml Syringe (26 gauge, 3/8 inch needle) | BD Biosciences | 329412 | |
| Trimmer | Kent Scientific | CL9990-KIT | |
| Vannas Spring Scissors, 8.0 mm cutting edge | F.S.T | 15009-08 | |
| VaporGaurd Activated Charcoal Filter | VetEquip | 931401 | |
| Wound clips, 9 mm | F.S.T | 12022-09 |
参考文献
- Wong, C. H., Siah, K. W., Lo, A. W. Estimation of clinical trial success rates and related parameters. Biostatistics. 0, 1-14 (2018).
- Hay, M., Thomas, D. W., Craighead, J. L., Economides, C., Rosenthal, J. Clinical development success rates for investigational drugs. Nature Biotechnology. 32, 40-51 (2014).
- Perel, P., et al. Comparison of treatment effects between animal experiments and clinical trials: systematic review. BMJ. 334, 1-6 (2007).
- Rubio-Viqueira, B., Hidalgo, M. Direct in vivo xenograft tumor model for predicting chemotherapeutic drug response in cancer patients. Clinical Pharmacology Therapeutics. 85, 217-221 (2009).
- Roberts, K. G., et al. Targetable Kinase-Activating Lesions in Ph-like Acute Lymphoblastic Leukemia. New England Journal of Medicine. 371, 1005-1015 (2014).
- Kim, J., et al. GDF11 Controls the Timing of Progenitor Cell Competence in Developing Retina. Science. 308, 1927-1930 (2005).
- Sako, D., et al. Characterization of the ligand binding functionality of the extracellular domain of activin receptor type IIB. Journal of Biological Chemisty. 285, 21037-21048 (2010).
- Zhang, Y., et al. Human skeletal muscle xenograft as a new preclinical model for muscle disorders. Human Molecular Genetics. 23, 3180-3188 (2014).
- Gabellini, D., Green, M. R., Tupler, R. Inappropriate Gene Activation in FSHD : A Repressor Complex Binds a Chromosomal Repeat Deleted in Dystrophic Muscle. Cell. 110, 339-348 (2002).
- Lemmers, R. J. L. F., et al. A Unifying Genetic Model for Facioscapulohumeral Muscular Dystrophy. Science. 329, 1650-1654 (2010).
- Chen, J. C. J., et al. Morpholino-mediated Knockdown of DUX4 Toward Facioscapulohumeral Muscular Dystrophy Therapeutics. Molecular Therapy. 24, 1405-1411 (2016).
- Medical Research Council. Aids to the investigation of the peripheral nervous system. , Her Majesty’s Stationary Office. London. (1943).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21, 2348-2356 (2017).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved