Method Article
التنميط العالي الاستبانة بواسطة Cryoslicing BN-MS التحليل
In This Article
Summary
يتم تقديم البروتوكول متعدد الاستخدامات الذي يستخدم ميكروتومي لتحديد السمات المعقدة عاليه الدقة.
Abstract
البروتينات عموما ممارسه الوظائف البيولوجية من خلال التفاعلات مع البروتينات الأخرى, اما في الجمعيات البروتين الحيوي أو كجزء من المجمعات التي شكلت باقتدار. ويمكن حل هذه الاخيره باناقه وفقا للحجم الجزيئي باستخدام الأصلي بولياكرياميد هلام الكهربائي (BN الصفحة). وقد ثبت جيدا اقتران هذه الحالات بالطيف الكتلي الحساس ويسمح نظريا باجراء تقييم شامل للمعقد القابل للاستخراج في العينات البيولوجية. بيد ان هذا النهج شاق إلى حد ما ويوفر قدرا محدودا من الدقة المعقدة والحساسية. أيضا ، وقد ظل تطبيقه يقتصر علي وفره البروتينات الميتوكوندريا والبلازما. التالي ، بالنسبة لغالبيه البروتينات ، لا تزال هناك نقص في المعلومات المتعلقة بالاندماج في مجمعات البروتين المستقرة. العرض هنا هو نهج الأمثل لتنميط المعقدة التي تتالف من الفصل الاعداديه BN-الصفحة ، والعينات الفرعية ملليمتر من الممرات هلام واسعه من قبل تقطيع بالتبريد ، وتحليل الطيف الشامل مع كميه البروتين خاليه من التسمية. يتم وصف الإجراءات والاداات اللازمة للخطوات الهامه بالتفصيل. وكتطبيق ، يصف التقرير التحليل المعقد لجزء من غشاء التنظير الداخلي المخصب المذاب من الكلي الفاره ، مع 2,545 البروتينات في المجموع. وتبين النتائج تحديد البروتينات الغشائية الموحدة والمنخفضة الوفرة مثل القناات الايونيه داخل الخلايا بالاضافه إلى الدقة العالية ، وأنماط تجميع البروتين المعقدة ، بما في ذلك ايزوفورم غليكويليشن. وتتفق النتائج مع التحاليل الكيميائية الحيوية المستقلة. وباختصار ، تسمح هذه المنهجية لتحديد شامله وغير متحيزة من البروتين (سوبر) المجمعات وتكوينها الوحدة الفرعية ، وتوفير أساس للتحقيق في القياس ، والتجمع ، وديناميكيات التفاعل من المجمعات البروتينية في اي النظام البيولوجي.
Introduction
وقد اقترن فصل الصفحات الاولي بالتحليل المباشر لل LC-MS بواسطةالمجموعتين البحثيتين majeran1 و wessels 2 باستخدام التقطيع اليدوي لممرات جل الصفحات bn. وقد حددت تحاليلهم عددا من مجمعات البروتينات الغشائية الوفيرة المعروفة بتكوين الوحدة الفرعية من البلازما النباتية والميتوكوندريا الخلوية ، علي التوالي. ومع ذلك ، فان هذه التحليلات ابعد ما تكون عن الشمول ولا تسمح بالتحديد غير المتحيز للجمعيات الجديدة. ومنذ ذلك الحين ، تحسن أداء مقاييس الطيف الجماهيري وأساليب القياس الكمي الخالية من العلامات إلى حد كبير ، مما مكن من اجراء تحليلات شامله لهذه المقاييس. وقد صاغ هذا مصطلح "التنميط المعقد". علي سبيل المثال, وحللت هايد وزملاءه الفئران الميتوكوندريا القلب تحديد وتجميع 464 البروتينات الميتوكوندريا, مما يؤكد العديد من الجمعيات المعروفة. الاضافه إلى ذلك ، وجدوا TMEM126B ان تكون الوحدة الفرعية الجديدة والحاسمة لمجمع التجميع المحدد3. وقد تم الحصول علي نتائج مماثله (مع ملفات تعريف البروتين الميتوكوندريا 437) في دراسة موازيه من الخلية يشيك الميتوكوندريا4.
وعلي الرغم من هذه التحسينات ، فقد ظلت هناك عده قضايا تحد من الإمكانات الكاملة لهذه المجموعة من أجل التنميط المعقد. ومن القيود الرئيسية هو دقه حجم المجمعات التي يتم تحديدها من قبل عاملين: (1) نوعيه الفصل BN-PAGE ، والذي يعتمد علي التوحيد من التدرج المسام هلام مصفوفة ، فضلا عن استقرار/الذوبان في المجمعات عينه ، و (2) حجم الخطوة من أخذ العينات هلام ، وهو في أفضل 1 ملم عند استخدام اليدوية التقليدية تشريح5،6. ضعف القرار الحجم لا يخطئ فقط المعقدة المتشابكة والتغاير ، ولكنه يؤثر سلبا أيضا علي المدى الديناميكي والثقة من التخصيص غير متحيزة ، والوحدة الفرعية من نوفو والتقدير الكمي.
وتشمل التحديات الأخرى دقه القياس الكمي للبروتين وتغطيه المجموعة الدينامية الفعلية لوفره البروتينية في العينة عن طريق تحليل الطيف الكتلي. ولذلك ، فقد ظل تطبيق التنميط المعقد لل BN-MS مقتصرا إلى حد كبير علي العينات البيولوجية ذات التعقيد الأقل ، والتعبير العالي عن المجمعات المستهدفة ، وخصائص الاذابه المواتية (اي البلازما ، الميتوكوندريا ، الكائنات المجهرية)6،7،8،9،10.
وقد أدخلنا مؤخرا بمساعده التشريح الدقيق لل BN-MS (csBN-MS) ، والذي يجمع بين العينات الدقيقة الفرعية من الممرات الهلامية من BN-PAGE مع تحليل MS الشامل ومعالجه بيانات MS المفصلة لتحديد ملامح البروتين مع ارتفاع الثقة11. التطبيق علي اعداد غشاء الميتوكوندريا من أدمغه الفئران أظهرت سابقا غير الملبية القرار الفعال المعقدة الحجم والتغطية القصوى لسلسله الجهاز التنفسي المؤكسد (OXPHOS) الوحدات الفرعية (اي ، 90 من 90 MS الوصول اليها). وقد حدد هذا المثال أيضا عددا من الجمعيات البروتينية الجديدة.
وصفت هنا الإجراءات الأمثل للجدول المعد الفصل BN-PAGE من المجمعات البروتينية (لا تقتصر علي مصدر بيولوجي معين) ، والصب من الهلام اعداد كبير من الصفحات BN ، التقطيع بالتبريد من الممرات هلام واسعه ، وبيانات MS معالجه. ويظهر أداء التنميط عاليه الدقة لاعداد معقده البروتين من الاغشيه الكلي الفئران المخصب التنظير. وأخيرا ، تناقش الفوائد الناجمة عن زيادة الاستبانة والدقة في تحديد الكميات الطيفية الشاملة.
Protocol
1-الصفحة الاعداديه (BN)
- اعداد هلام
- استخدام المتوسطة إلى الكبيرة شكل العمودي هلام النظام الكهربائي (> 10 سم المسافة الانفصال هلام ؛ 14 سم × 11 سم ، 1.5 mm فاصل) مع مجموعه تبريد فعاله إلى 10 درجه مئوية.
- يلقي هلام التدرج المسام الخطية أو القطعية (1.5-3.0 ملم الفواصل) باستخدام التحريك خلاط التدرج اثنين من غرفه مدفوعة بواسطة مضخة (انظر جدول المواد والكواشف). في المثال المقدم (التدرج الخطي هلام 1 ٪-13 ٪):
- اعداد حل 13 مل للغرفة (الاختلاط) الجبهة تتكون من: 13 ٪ اكريلاميد (من 30 ٪ حل الأوراق المالية ، 37.5:1.0 الاكريلاميد: بيساكرياميد) ، 0.75 M حمض امينوكابرويك ، 50 mM Bis-تريس (pH = 7.0) ، و 10 ٪ الجلسرين.
- اعداد محلول 10 مل لغرفه الخزان تتكون من: 1 ٪ اكريلاميد (من 30 ٪ حل الأوراق المالية ، 37.5:1.0 الاكريلاميد: بيساكرياميد) ، 0.75 M حمض امينوكابرويك ، 50 mM Bis-تريس (pH = 7.0) ، و 0.2 ٪ CL-47 المنظفات.
- بدء الركاب وأضافه 30 ميكروليتر من APS (الأمونيوم peroxodisulfate ، 10 ٪ حل الأوراق المالية) و 2.5 μL من TEMED (N ، N ، N ' ، N'-tetramethyl ايثينديمين) و 2.5 ميكروليتر من TEMED إلى الحل في الغرفة الاماميه. بدء تشغيل المضخة وفتح الصمام الامامي (وينبغي تعديل تدفق لاستكمال الصب في 10 دقيقه). بعد 1 دقيقه أضافه 90 μL من APS و 5 μL من TEMED إلى الحل في غرفه الخزان وفتح اتصال الغرفة.
- السماح للهلام لتتبلمر ببطء ولكن جيدا لمده 24 ساعة علي الأقل في درجه حرارة الغرفة (RT) لتوليد متجانسة الانحدار حجم المسام. عندما تبقي رطبه ، يمكن تخزين هلام بلمره تستقيم في 4 درجه مئوية لمده تصل إلى 1 أسبوع.
ملاحظه: عمدا ، سيكون الأعلى من هلام الاتساق لينه/لزجه. سيتم أزاله هذا في وقت لاحق ولكن يسمح لدخول سلس من البروتينات في هلام, مع الحد الأدنى من خطر هطول البروتين التي قد تؤدي خلاف ذلك إلى القطع الاثريه الهجرة (اي, يتساقط أو البروتين هطول الامطار).
- اعداد العينات والتحميل
- اعداد فتحات التحميل عن طريق ادراج الفواصل المناسبة (علي سبيل المثال ، أنابيب السيليكون) بين لوحات زجاجيه لفصل 0.5-2.0 ملغ من البروتين. وينبغي جعل فتحات علي الأقل 3 سم واسعه (أو أفضل ، 5-6 سم واسعه).
- Solubilize ~ 2.5 ملغ من الغشاء (الماوس الكلي التنظير المخصب التحضير) في 2 مل من العازلة المذاب التي تحتوي علي 1 ٪ (ث/ف) غير التسميد المنظفات (المعقدة CL-47) لمده 30 دقيقه علي الجليد. Ultracentrifugate (الترسيب القطع = 200 S أو اقل ؛ 130,000 x g/11 دقيقه يتم استخدامها هنا).
- التركيز علي solubilisate علي مسافة قصيرة 50%/20% (ث/الخامس ، 0.3 مل لكل منهما) التدرج السكروز خطوه بواسطة نبذ حلول ل 1 ح في 400,000 x ز. يجب ان يكون المحصول البروتين النهائي 1 ملغ علي الأقل.
- أضافه 0.05% (w/v) كوماسي G-250 إلى solubilisate وتحميل العينة علي هلام. الحد من تحميل البروتين إلى 10-15 ميكروغرام/مم2 هلام لين المقطع العرضي للحصول علي دقه عاليه وتجنب القطع الاثريه الناتجة عن هطول البروتين.
- شروط تشغيل الصفحة BN
- لتشغيل المخازن المؤقتة ، واعداد الحاجز الكاثود القياسية التي تتكون من 50 mM tricine ، 15 مم Bis-تريس ، و 0.01 ٪ كوماسي G-250. اعداد الحاجز الآنود القياسية التي تتكون من 50 mM Bis-تريس (pH = 7.0).
- تشغيل الصفحة الاعداديه BN في 10 درجه مئوية بين عشيه وضحيها باستخدام بروتوكول الجهد ثلاث خطوات13 تتكون من: مرحله تاخيرمن لمده 30 دقيقه في 100 v ، ثم بطيئه (3 ح) المنحدر إلى اقصي الجهد (40-50 v/سم طول هلام) التي يتم الاحتفاظ أخيرا لمده 6 ساعات علي الأقل نقطه النهاية التركيز من البروتينات.
ملاحظه: فمن المستحسن لإيقاف الكهربائي مؤقتا عندما وصلت جبهة الهجرة إلى منتصف هلام وتبادل المخزن المؤقت الكاثود للمخزن المؤقت الطازجة دون كوماسي G250. وهذا يساعد علي تجنب القطع الاثريه هطول الامطار في هلام الناتجة عن انهيار المحلية للهيكل المسام مصفوفة.
2. هلام أخذ العينات والهضم
- استئصال المسالك الهلامية
- بعد التشغيل ، امسح الهلام لأغراض التوثيق مع إبقائه بين ألواح الزجاجية.
- تفكيك لوحات والمكوس القسم (ق) حاره من الفائدة.
- اتخاذ شريط عينه من حاره للتحليل بواسطة 2D BN/SDS-الصفحة وتلطيخ البروتين أو الغربية التنقيط (كما هو مبين في الشكل 1ب) لتحديد مناطق الاهتمام ، والقرار الفعال الحجم المعقد ، ووفره البروتين.
- إصلاح الممرات هلام المحدد مرتين علي الأقل 30 دقيقه مع 30 ٪ (v/v) الايثانول و 15 ٪ (v/v) حمض الخليك.
- نقل العينة إلى تضمين المتوسطة والسماح لها لنقع وتتوازن علي الأقل 2 ح في 4 درجه مئوية ، مع الحفاظ علي بلاطه هلام في الحركة البطيءه علي شاكر المداري.
ملاحظه: يجب ان يتم فحص الفصل هلام بعناية لجوده الفصل الكلي والقطع الاثريه الهجرة. وينبغي ان تكون عصابات هلام التي تمثل البروتينات المهيمنة خاليه من التشويه ومتجانسة في الكثافة. القطع الاثريه المحلية علي الهلام يجب ان تكون مثيره أو تركت خارج التحليل.
- التضمين وتقطيع الجليد بالتبريد
ملاحظه: هذا هو نسخه محسنه من اجراء التضمين الموصوفة والصور الموثقة سابقا التي تسمح لتضمين وتقطيع الممرات هلام أوسع تصل إلى 8 سم11.- أولا ، قطع الممرات هلام ثابت في أقسام (هنا ، 3 سم) موازيه تماما لنمط الهجرة البروتين الجبهة/الفرقة. لسهوله المناولة ، ضع كل قسم علي دعم فيلم من البلاستيك مع ابعاد متساوية.
- نقل الممرات إلى أنبوب مفتوح مع سدادات (مغلقه علي الجزء السفلي ، مثقبه مركزيا في الجزء العلوي ، علي حد سواء محاذاة بدقه مع نهايات العلوي والسفلي من القسم هلام).
- تراجع الاسطوانه لفتره وجيزة إلى النيتروجين السائل للبدء بسرعة في التصلب. الشفافة تضمين المتوسطة تصلب في غضون ثوان ويصبح ابيض في اللون.
- ملء تجويف مع تضمين المتوسطة ، وتراجع لفتره وجيزة في النيتروجين السائل ، وتجميد الاسطوانه في-20 درجه مئوية لعده ساعات.
ملاحظه: تبريد الاسطوانه بسرعة عن طريق غمسها في النيتروجين السائل يساعد علي تجنب أزاحه بلاطه هلام داخل الأنبوب. يجب تجنب التشويه لضمان دقه عاليه في تحليل MS التالية. - بعد التفكيك ، وأزاله الفيلم من البلاستيك ونقل كتله مع قسم هلام جزءا لا يتجزا من تبريد ، أكبر في القطر ، اسطوانه معدنيه وضعت علي دعم مسطح (اي طبق بيتري) ومختومه مع تضمين المتوسطة علي الخارج من الاسطوانه. أملا الاسطوانه بالتضمين المتوسط وقم بالتجميد جيدا.
- كرر هذا الاجراء مع الجانب الآخر من الاسطوانه للحصول علي كتله صلبه مع أسطح مستو.
- أزاله كتله من الاسطوانه ، والغراء مع تضمين المتوسطة علي حامل المعادن precooled ، وادراج حامل في الجهاز cryoslicing (كريتومي). يجب محاذاة سطح الكتلة بعناية فيما يتعلق بمستوي التقطيع. السماح لها لتتوازن في درجه الحرارة المثلي لعمليه التقطيع (هنا ،-15 درجه مئوية).
ملاحظه: استخدام دوره تقطيع يدوية تتقدم ببطء من حجم الخطوة 0.1 مم حتى تصل إلى سطح قسم هلام جزءا لا يتجزا لضمان تحديد المواقع الصحيح. - حصاد شرائح هلام واحدا تلو الآخر ، مع سماكه المطلوب النهائي من 0.25 ملم حجم الخطوة ، ونقلها بشكل فردي إلى أنابيب رد الفعل مع انخفاض خصائص ربط البروتين.
ملاحظه: في هذا الاعداد ، يمكن الحصول علي شرائح هلام موحده بسهوله ورقيقه مثل 0.1 ملم وسميكه مثل 0.5 مم.
- الهضم التريتيك
- أداء الهضم التريتيك في هلام بعد غسل واسعه من شرائح هلام (ويوصي علي الأقل ثلاث جولات اضافيه من الغسيل لأزاله المكونات البوليمريه من الوسط التضمين) اتباع اجراء قياسي11.
- فراغ-الجافة الببتيدات التملص وذوبان في 0.5 ٪ (v/v) حمض التريفلورواستيك عن طريق الاهتزاز في 37 درجه مئوية (10 دقيقه) تليها سونيكيشن حمام (5 دقائق) ووجيزة طرد.
3-قياس الطيف الكتلي
- nanoHPLC و MS اعداد
- تحميل عينات هضم علي C18 بريكولومن (حجم الجسيمات = 5 μm; قطر = 300 μm) مع 0.05 ٪ (v/v) حمض التريفلورواستيك باستخدام (انقسام خاليه) نانو HPLC إلى جانب مطياف الشامل مع ارتفاع القرار.
- Elute القبض علي الببتيدات مع التدرج المائية العضوية (الآن A): 5 دقيقه 3 ٪ ب ، 120 دقيقه من 3 ٪ ب إلى 30 ٪ ب ، 20 دقيقه من 30 ٪ ب إلى 99 ٪ ب ، 5 دقيقه 99 ٪ ب ، 5 دقيقه من 99 ٪ ب إلى 3 ٪ ب ، 15 دقيقه 3 ٪ ب (معدل التدفق = 300 nL/دقيقه).
ملاحظه: تنتج شرائح هلام csBN-MS عاده في عينات ذات وفره الببتيد منخفضه إلى متوسطه ودرجه محدوده من التعقيد. ولذلك ينبغي ان يتم تحليل nanoLC-MS/MS مع إنشاء توفير حساسية معقولة وسرعه التسلسل ، وارتفاع القرار الشامل (> 100000) والنطاق الديناميكي الأقصى (بشكل فعال 3-4 أوامر الحجم). ومع ذلك ، فانه لا يتطلب ابعاد العمود طويلة أو التدرجات التملص امتدت إلى ما بعد 3 ح. - الببتيدات منفصلة التملص في باعث (هويه 75 μm ؛ غيض = 8 μm) معباه يدويا تقريبا 20 سم مع المواد C18 (حجم الجسيمات = 3 μm). [الكترورش] العينات في 2.3 [كف] (ايجابيه أيون وضع) داخل ال يسخن نقل شعريه (250 [ك]) من مطياف شامله.
- اجراء تحليلات مع إعدادات الاداات التالية11: الحد الأقصى MS/ms وقت الحقن = 400 ms ؛ مده الاستبعاد = 60 s; عتبه اشاره الحد الأدنى = 5,000 التهم ، والسلائف اعلي 10 مجزاه ؛ عزل عرض = 1.0 [م/ز]).
ملاحظه: لتسهيل معايره الكتلة ، والاحتفاظ بالوقت ، وتعيين إشارات الببتيد في عدد كبير من مجموعات البيانات أو القياسات ، فمن المستحسن لتنفيذ سلسله قياس MS المعنية دون انقطاع أو تغييرات في المعلمات والاجهزه ( اي ، علي نفس العمود C18/باعث).
- تحديد البروتين (تقييم بيانات MS علي النحو الموصوف سابقا11)
- استخراج قوائم الذروة من أطياف أيون الجزء باستخدام الاداه "msconvert. exe" (جزء من بروتينومعالج).
- تحويل جميع السلائف m/z القيم لكل مجموعه من البيانات من قبل الازاحه m/z المتوسطة لجميع الببتيدات المعينة للبروتينات في قاعده بيانات البحث الاولي مع 50 جزء في المليون الببتيد التسامح الجماعي.
- البحث في قوائم الذروة المصححة مع محرك بحث مناسب (هنا ، 2.6.2 التميمة) ضد جميع إدخالات الماوس من قاعده بيانات UniProtKB/Swiss-Prot (الإصدار 2018_11).
- حدد "اسيتيل (بروتين N-مصطلح)", "Carbamidomethyl (ج)", "Gln | بيورو-غلو (ن-المدى Q) ، غلو | pyro-Glu (N-المصطلح E) "،" الاكسده (M) "، و" بروبيواميد (C) "كتعديلات متغيرة.
- تعيين الببتيد وجزء التسامح الجماعي إلى ± 5 جزء في المليون و ± 0.8 Da ، علي التوالي ، والسماح لأحد الانشقاقات التريتيك غاب. قم بتعيين القيمة المتوقعة للقطع لتحديد الببتيد إلى 0.5 أو اقل. استخدم البحث عن قاعده بيانات شرك لتحديد معدل الاكتشاف الإيجابي الزائف (روزفلت). تعيين روزفلت إلى 1 ٪ أو تطبيق معايير الجودة الاضافيه لضمان تحديد موثوق بها.
ملاحظه: التجربة المقدمة حددت أكثر من 3,500 البروتينات ، مع متوسط الببتيد روزفلت من 4.4 ± 0.77 ٪ (ن = 101 شريحة عينات) ، أو 3,000 البروتينات عندما تم تعيين الببتيد روزفلت إلى 1 ٪. الأهم من ذلك ، تم استخدام معايير أكثر صرامة لاختيار البروتينات لمحه (2,568). وشملت جميع البروتينات التي تم تحديدها مع الببتيدات اثنين علي الأقل, واحد علي الأقل منهم يجري البروتين الخاصة, في واحد علي الأقل من العينات شريحة 101.
- كميه البروتين
- استخدام كثافة اشاره الببتيد (وحدات التخزين الذروة [PVs]) لتحديد كميه البروتين التي يتم الحصول عليها من المسح الضوئي الكامل FT وتصحيح لوقت الاستبقاء والتحولات الجماعية باستخدام البرامج المناسبة (هنا ، MaxQuant v 1.6.3).
- محاذاة مجموعات البيانات MS واحدا تلو الآخر للاشاره (المتوسط الإجمالي) الببتيد مرات التملص باستخدام الانحدار LOESS. تعيين PVs الببتيدات اما مباشره (MS/MS-القائم علي التعريف) أو بشكل غير مباشر (علي سبيل المثال ، استنادا إلى مطابقه م/ز والوقت التملص ضمن التحمل ضيقه جدا).
ملاحظه: يستخدم هذا البروتوكول برمجيات داخلية لتعيين الببتيدات المسمية "المدرجة". مجموعه المعلمات نتيجة في m/z فعاله والتسامح الوقت المطابقة من ± 2 جزء في المليون و ± 1 دقيقه ، علي التوالي (انظر الشكل 2ا ، ب). - تصحيح لاختلافات التشغيل المنتظمة في الحمل الببتيد وكفاءه التاين بواسطة الببتيد كثافة أعاده قياس محسوبة من الاختلافات المتوسطة من كثافة الببتيد النسبية بين عينات شريحة المجاورة (الشكل 2ج).
- تصفيه البيانات الكهروضوئية للقيم المتطرفة والتعيينات الايجابيه الزائفة المتبقية التي تم تحديدها بواسطة تحليل تناسق PV داخلي.
- تطبيع PVs من كل الببتيد إلى قيمها القصوى علي جميع مجموعات البيانات شريحة تسفر عن ملامح وفره الببتيد النسبية.
- وأخيرا ، حساب السمات النسبية لوفره البروتين كمتوسطات اثنين علي الأقل (وتصل إلى سته أو 50 ٪ ، أيهما قيمه أكبر) من أفضل الملامح الببتيد المرتبطة علي نافذه من ثلاث شرائح متتالية. وهذا يسمح بسد القيم الكهروضوئية المفقودة والحد من الضوضاء.
ملاحظه: ادي هذا أخيرا في 2,545 (من 2,568 المختارة مسبقا) ملفات البروتين (الشكل 2د).
- توصيف مركبات البروتين
- تحليل لمحات البروتين من خلال أداء أول اكتشاف الذروة باستخدام طريقه الحد الأقصى المحلية ، وتناسب علي التوالي التوزيعات العادية لهذه القمم ، مما أسفر عن موقف (اي ، مؤشر شريحة أو حجم المعقدة الظاهر) من اقصي حد لها و FWHM (عرض كامل في نصف الأقصى كثافة) القيم (أقحم الشكل 4).
ملاحظه: في مجموعه البيانات ، يتم تحليل ملفات التعريف تلقائيا باستخدام البرامج النصية المخصصة. أصغر FWHM القيم تشير إلى دقه حجم فعاله للنهج (هنا ، 6 × 0.25 = 1.5 مم). - استخدم البروتينات المرجعية المعقدة مع الكتلة الجزيئية المحددة (كما ورد في قاعده بيانات UniProtKB/Swiss-Prot) لتحليل الانحدار الخطي لقيم log10 (الكتلة الجزيئية المتوقعة) لتحويل مؤشرات أرقام الشرائح إلى الاحجام الجزيئية الظاهرة (اي حجم المعقد الظاهر في كده).
ملاحظه: تم اختيار 23 مجمعا للعلامة في العينة في هذه الدراسة (الشكل 4) استنادا إلى (1) اشكال أحاديه التشتت لقمم البروفيلات ، و (2) الدعم التجريبي للوزن الجزيئي ، و (3) التوزيعات علي طول أقسام هلام الصفحة التي تم التحقيق فيها.
- تحليل لمحات البروتين من خلال أداء أول اكتشاف الذروة باستخدام طريقه الحد الأقصى المحلية ، وتناسب علي التوالي التوزيعات العادية لهذه القمم ، مما أسفر عن موقف (اي ، مؤشر شريحة أو حجم المعقدة الظاهر) من اقصي حد لها و FWHM (عرض كامل في نصف الأقصى كثافة) القيم (أقحم الشكل 4).
النتائج
وقد طبقت الغالبية العظمي من الدراسات التقليدية التي أعدتها الشركة وكذلك نهج csBN-MS العالي الاستبانة الذي تم إنشاؤه مؤخرا علي المستحضرات المتقدريه والبلازما التي هي ' 1 ' متاحه بسهوله ، ' 2 ' محدوده التعقيد ، و ' 3 ' التعبير عن الهدف (غشاء) مجمعات البروتين في كثافة عاليه. يوسع هذا البروتوكول تطبيق التنميط المعقد عالي الاستبانة لاغشيه غير الميتوكوندريا التي تعبر عن البروتينات المنخفضة الوفرة ، والتي تتوفر عنها معلومات قليله عن اندماجها في المجمعات. لأغراض العرض التوضيحي ، اخترنا اعداد غشاء المخصب التنظير الداخلي من الكلي الماوس التي حصلت عليها طرد التدرج الكثافة.
وقد استرشدت الأمثل لهذا الاعداد من قبل البروتين علامة TPC1 التي تشكل قنوات أيون داخل الخلايا في الغالب المترجمة إلى التنظير الباطني في وقت مبكر وأعاده التدوير12. كما يتم التعبير عنه بشكل كبير في الخلايا الانبوبيه القريبة الكلوية ، كما هو مبين في التحليل المناعي لأقسام انسجه الكلي (الشكل 1ا). وقد تم أذابه هذه الاغشيه بلطف (المركب 47 في بروتين منخفض: نسبه المنظفات من 1:8) وركزت علي وساده السكروز بواسطة ultracentrifugation حلول. وتبين ان هذه الاخيره خطوه هامه لأزاله المكونات الزائدة من الوزن الجزيئي المنخفض (اي المنظفات والدهون والأملاح والبوليمرات العضوية والأيض) التي تميل إلى التاثير سلبا علي حل فواصل الصفحات الاعداديه BN.
الفصل المعقد علي الأصلي 1 ٪-13 ٪ (ث/ف) هلام التدرج بولياكريلاميد (الشكل 1ب، اللوحة الوسطي) أظهرت عصابات البروتين الملون بقوة مع القليل جدا من التحف الهجرة. واظهر فصل الصفحات من شريط هلام الصفحة الضيقة BN (الشكل 1ب، الإطار محاصر باللون الأحمر) كبعد ثان يتبعه تحليل لطخه الغربية نمطا جيد الحل من المجموعات السكانية المعقدة المرتبطة TPC1 (الشكل 1ب ، واللوحة العليا ، والتي تميزت بالسهام الحمراء) ، علي الأرجح الناجمة عن الارتباط مع وحدات فرعيه البروتين اضافيه و/أو التعديلات بعد الانتقالية (مثل glycosylation12). وكان قسم 3 سم من الفائدة المثيرة ، والثابتة ، ومعالجتها لتشريح البكاء كما هو موضح11. يتم توثيق الخطوات الفردية لهذا الاجراء (علي وجه الخصوص ، المحاذاة الدقيقة لقسم الهلام العريض) ، والتي تكتسي اهميه حاسمه للمحافظة علي الدقة اثناء أخذ العينات ، في الفيديو المصاحب. مقطع جل جزءا لا يتجزا تم قطع أخيرا إلى شرائح هلام 101 مع سماكه موحده من 0.25 مم (الشكل 1ب، اللوحة السفلي) ، والتي تم هضمها بشكل منفصل وتحليلها من قبل عاليه الأداء القياس الطيفي الشامل بالاقتران LC.
بالاضافه إلى دقه الحجم ، فان نوعيه البروتين الكمي هي المفتاح لتشكيل السمات المعقدة الناجحة. مع MS اعداد والإعدادات المستخدمة, تحليل العينات كانت شامله جدا, مما ادي إلى تحديد متوسط أكثر من 1,000 البروتينات و 10,000 الببتيدات (8,200 منها البروتين محدده) لكل شريحة, وحول 3,000 البروتينات و 43,000 الببتيدات (38,500 التي كانت البروتين محدده) في المجموع. ومع ذلك ، نظرا للطبيعة العشوائية لتسلسل MS/MS المعتمد علي البيانات وحدودها في النطاق الديناميكي ، كانت المعلومات المكثفة لا تزال مجزاه للبروتينات الأقل وفره. ولذلك ، تم اجراء عمليه معالجه بيانات MS مفصله11التي تستند إلى تعيين دقيق للإشارات الببتيد (احجام الذروة [pvs] = كثافة الإشارات المرتبطة الببتيد متكاملة علي m/z والوقت) علي كامل سلسله من مجموعات البيانات.
وكما هو مبين في الشكل 2ا ، ب، فان انحرافات إشارات الببتيد في الكتلة ووقت الاستبقاء التي بقيت بعد المعايرة كانت متطابقة بالنسبة لل MS-المتسلسلة ولل pvs غير المباشر المعين (مع التحمل الضيق جدا من < 1 جزء في المليون و < 0.5 دقيقه ل95% PVs) ، مما يدل علي معدل منخفض جدا للتعيين الكهروضوئية ايجابيه كاذبه. تمت تصفيه القيم المتطرفة المتبقية استنادا إلى تناسقها مع PVs الأخرى ذات الصلة. وبما ان جميع قياسات MS تم تنفيذها علي التوالي علي نفس المجموعة من ال LC-MS دون تغييرات في المعلمات أو مكونات الاجهزه ، والاختلافات تشغيل لتشغيل (تحديد المتوسط لجميع كثافة PV في عينه نسبه إلى تلك الموجودة في الشرائح المجاورة) كانت صغيره وسهله القضاء عليها باعاده التشكيل الضوئي لمجموعات البيانات الكهروضوئية (الشكل 2ج). ثم استخدمت معلومات كثافة الببتيد الناتجة لأعاده بناء 2,545 البروتينات النسبية وفره الملفات الشخصية. كما هو مبين في الشكل 2د, أكثر من 75% من هذه الملفات البروتينية واستند علي ما لا يقل عن ثلاثه الببتيدات البروتين المستقلة الخاصة.
وبعد ذلك ، قام البروتوكول بتقييم مدي ملاءمة حجم الخطوة الخاصة بأخذ عينات الهلام من الصفحة BN لحل مجمعات البروتين. ولهذا الغرض ، تم ضم مجموعات بيانات الشرائح بجمع المعلومات الكهروضوئية من شريحتين أو ثلاث أو أربع شرائح متتالية ، التالي محاكاة النتيجة لاحجام الخطوات من 0.5 مم ، 0.75 مم ، و 1 مم (مقارنه بعينات الاصليه من 0.25 مم). ويوضح الشكل 3 ملامح الوفرة الناتجة عن TPC1 البروتين كمثال (ا-د). في 0.25 mm, كثافة نسبيه وحجم فصل من [TPC1-رلتيف] مجمعه السكان (شكل 3[ا]) كان بلطف في اتفاق مع النتيجات من غربيه لطخه تحليل (شكل 1[ب], لوح علويه); علي الرغم من ان ، أظهرت الشخصية بعض الضجيج ، والناجمة في الغالب عن القيم المفقودة ("الثغرات") في مصفوفة PV المستخدمة للقياس الكمي.
الانضمام إلى اثنين من شرائح المقابلة ل 0.5 مم الحفاظ علي الكثافة الصحيحة والفصل بين المجمعات المرتبطة TPC1 وأزاله الضوضاء الكمية (الشكل 3ب). وعلي النقيض من ذلك ، فان احجام الخطوات الأكبر من 0.75 مم و 1 مم (الشكل 3ج ، د) أدت إلى فقدان قرار الحجم وألغيت التمييز بين TPC1 من السكان الفرعيين المعقدين. تجدر الاشاره إلى ان الغالبية العظمي من التحليلات المنشورة التقليدية BN-MS استخدام يدويا قطع 2 مم شرائح (حوالي 60 لتغطيه كامل حاره هلام)7,8,9,10.
ويستند تحويل مسافة الهجرة أو فهرس الشريحة إلى الحجم الجزيئي عموما علي علامات ، اما البروتينات القياسية الاصليه المتاحة تجاريا أو المجمعات البروتين الذاتية تتميز جيدا مع تكوين وحده فرعيه معروفه (في الغالب [سوبر] المجمعات من سلسله الميتوكوندريا الاكسده الجهاز التنفسي [OXPHOS])13. ومع ذلك ، منذ الفصل BN الصفحة يستند إلى المقطع العرضي الجزيئية الفعالة التي يتم تحديدها ليس فقط من الكتلة الجزيئية ولكن أيضا من قبل هيكل 3D وعدد من الدهون المرتبطة بها ، والمنظفات ، وجزيئات كوماسي ، قد تظهر البروتينات الفردية انحرافات أكبر. لذلك ، تم اختياره لاستخدام مجموعات أكبر من مجمعات البروتين كعلامات11. المؤامرة في الشكل 4 يظهر 23 علامات مختاره مع الوحدة الفرعية التمثيلية المبينة كدائره سوداء ، مما يدل علي قيم log10 من كتلتها الجزيئية المتوقعة (وفقا لقاعده بيانات UniProtKB/سويسرا-prot) مقابل. فهرس الشريحة الخاص بالحد الأقصى لذروه التشكيل الجانبي المطابق. وقد تم الحصول علي هذه الاخيره من الاستخدامات التلقائية التي تناسب بيانات الوفرة النسبية ، كما هو مبين في الرسم الداخلي لشكل 4 الذي يظهر المثال مع الوصي BCS1. قدم الانحدار الخطي (الخط الأحمر) وظيفة لتحويل قيم مؤشر الشريحة إلى الاحجام الجزيئية الظاهرة ، والتي تراوحت من 160-630 كده ، علي طول قسم هلام التحقيق.
وأخيرا ، قدم التحليل معلومات عن المجمعات الجيدة التوصيف واظهر وجود وحدات فرعيه وتجمعات معقده جديده. وترد الامثله التي تسلط الضوء علي جوانب مختلفه من المجمع في الشكل 5 (ا-ج: البروتينات المعرب عنها أو يفضل ان تكون موجودة في المقصورات الباطنية ؛ D-F: مجمعات من التعريب الخلوية الأخرى). ومن المعروف ان البروتين الذي ينقل الحديد فيريتين لتشكيل المجمعات من 24 الخفيفة (FRIL1) و/أو الثقيلة (FRIH) الوحدات الفرعية ، مع الوزن الجزيئي الكلي من 440 كده14 (الشكل 5ا، السهم مليئه). وتشير لمحاتالوحدةالفرعية (الشكل 5ا) إلى وجود ما لا يقل عن نموذجين أصغر من المجمع (مع كتله واضحة من 360 كده و 340 كده ؛ سهام مفتوحة) مع ستويتشيوميتريس سلسله ثقيله/خفيفه مميزه (أفضل وضوحا بعد أعاده الإرسال وفره ، أقحم من الشكل 5ا) التي هي موجودة بوفره في التنظير الداخلي.
في المقابل ، المجمعات nicalin-nomo115 (الشكل 5د) ، والمجمع الأساسي غاما-سيكريداز16 (الشكل 5ب) ، و gpi-transamidase آلات17 (الشكل 5ه) تظهر ثابته نسب وفره من وحداتها الفرعية الاساسيه علي مدي حجم كامل ومستقله عن الارتباط مع البروتينات الاضافيه. وهذا يشير إلى ان وحداتها الفرعية هي حصريه لبعضها البعض. فاكولارH +-atpases هي مجمعات متعددة البروتينات تجمع من مجموعه من أكثر من 20 وحدات فرعيه بطريقه نمطيه مع الوزن الجزيئي الكلي لحوالي 900 ده. الشكل 5(ج ) يكشف عن المجمعات الفرعية ذات التراكيب المتميزة من 17 وحده علي الأقل ، اما تمثل وسيطات التجميع البيولوجية (ديس) أو المجمعات الفرعية المتولدة عن الظروف التجريبية ، والتي تم أيضا لاحظت في دراسة حديثه BN-MS18. ومن الامثله المعقدة المتعددة البروتينات الأخرى المثال المركب البروتيني19 (الشكل 5و). ويشير الفحص الدقيق للمحات الوفرة من الوحدات الفرعية الفا وبتا التي تشكل النواة البروتينية البالغة 20 ثانيه إلى وجود مجموعتين رئيسيتين من السكان المعقدين مع اختلافات طفيفه في الحجم (590 ده كده و 575 كده ، المشار اليها بالأسهم الرمادية).
وباختصار ، فان تصنيف csBN-MS لاغشيه الكلي المخصبة بالتنظير الباطني يوفر نتائج شامله ومفصله فيما يتعلق ب (1) دمج البروتينات المستهدفة الموحدة والمنخفضة الوفرة في المجمعات ، و (2) تكوين الوحدة الفرعية العامة المعقدة القياس ، و (3) تغاير المعقدة ، والهياكل الفرعية ، و (ديس) وسيطه التجمع.

الشكل 1: الفصل المعد من الصفحة BN من الاغشيه المذابة بالتنظير الباطني من الكلي الماوس باستخدام قناه TPC1 كعلامة. (ا) مناعي توطين TPC1 بروتين في الأنابيب الكلوية القريبة عن طريق المجهر البؤري. الأخضر: المضادة لTPC112 تلطيخ تصور مع الثانوية Cy3-بيوتينيلاتيد الماعز مكافحه الأرنب مفتش ؛ الأحمر: اللوتس تيتراغونولوبوس يكتين (LTL ، 10 ميكروغرام/مل ، fitc-مترافق) بمناسبه سطح الاناره من خلايا الأنابيب القريبة. يظهر الجزء الداخلي تلطيخ المقطع المطابق من الكلي TPC1 كعنصر تحكم سلبي. قضبان المقياس الأبيض هي 20 ميكرومتر. أيضا من ملاحظه قويه TPC1 التعبير في الحويصلات داخل الخلايا ، والمعروف من التجارب المستقلة لتمثيل التنظير المبكر وأعاده التدوير12. (ب) فصل الصفحات الاعداديه التي تبلغ 2.5 ملغ من الاغشيه المذابة بالتنظير الباطني علي 1%-13% (w/v) هلام التدرج البولياكريلاميد. تم قطع حاره ضيقه (مؤطره باللون الأحمر) للتحليل اللاحق SDS-صفحه/وصمه عار الغربية (اللوحة العليا) ، وحل مختلف المجمعات TPC1 المرتبطة بها وأنماط glycosylation (السهام الحمراء: المضادة لTPC1/المضادة للأرانب/ECL رئيس الوزراء ؛ الأخضر الجماهير [MDa] من المجمعات البروتين علامة المحددة من قبل مجموع تلطيخ البروتين [SYPRO روبي لطخه وصمه عار]) من وصمه عار. من اليمين إلى اليسار:Na +/K +-نقل Atpase ، سيتوكروم b-c1 معقده dimer ، ATP SYNTHASE ، nadh: اوبيكينون اوكسينوريدكتيز. وكان قسم 3 سم من الفائدة من حاره هلام المثيرة ، وجزءا لا يتجزا من الانسجه تضمين المتوسطة ، التي شنت ، وشرائح في 101 الأقسام (0.25 ملم) علي طول الجبهة الهجرة البروتين باستخدام التبريد (اللوحة السفلي ؛ انظر وصله الفيديو). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 2: المعلمات الرئيسية التي تحدد دقه تعيين اشاره MS وكميتها وكذلك عمق التحليل. (ا) توزيع الأخطاء الجماعية النسبية (في جزء في المليون) بعد معايره m/z المتسلسلة MS/ms (القضبان الحمراء) والمعينة بشكل غير مباشر (علي سبيل المثال ، استنادا إلى مطابقه الكتلة وأوقات الاستبقاء ، انظر البروتوكول ؛ الاشرطه الزرقاء) الببتيد إشارات. وهذا يوحي خطا كتله النهائي من < 1 جزء في المليون (ل 95 ٪ من الإشارات/المخصصة PVs) ومعدل منخفض جدا من التعيينات الايجابيه كاذبه. (ب) توزيع الانحرافات الزمنيه للاحتفاظ بالنانو-hplc من المتوسط الكلي بعد التوافق الزمني للإشارات الببتيد ، باستخدام انحدار loess (انظر البروتوكول) وترميز اللون كما هو مستخدم في (A). خطا الوقت اقل من 30 ثانيه ل > 95% من الإشارات الببتيد/المخصصة PVs. (ج) تباين التشغيل إلى التشغيل لكثافة MS الاجماليه المرسومة بالنسبة لمتوسط العينتين المتجاورتين. وقد طبقت عوامل القياس هذه علي جداول PV الخام للتقليل إلى ادني حد من الأخطاء التقنية المنهجية. (د) المعلومات الببتيد المستخدمة لحساب الوفرة النسبية للبروتينات. بعد تصفيه الببتيدات البروتينية الخاصة بالقيم المتطرفة ، وسجل سيئه ، أو تحديد الهوية واحد (انظر البروتوكول) ، 2,545 وحددت ملامح وفره البروتين ، > 75 ٪ منها كانت تعتمد علي ما لا يقل عن ثلاثه الببتيدات مع ثقة معقولة. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
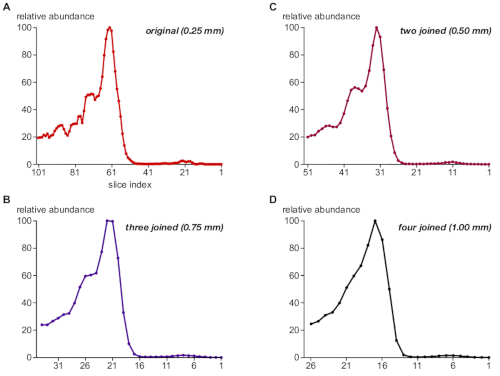
الشكل 3: التاثير الحاسم لحجم الخطوة في أخذ عينات الهلام علي الدقة المعقدة لTPC1. وقد انضمت مجموعات البيانات من خلال جمع كثافة الاشاره في مجموعات من 1 ، 2 ، 3 ، و 4 شرائح متتالية (A-D ، علي التوالي) ومعالجتها بشكل مماثل لمحاكاة احجام مختلفه من الخطوات في تشريح هلام كما هو مبين. يظهر الملف الشخصي TPC1 بعض (الاختزال) الضوضاء في 0.25 مم ولكن دقه الحجم الجيد من ثلاثه السكان المعقدة (انظر أيضا الشكل 1ب) ، والتي يتم الحفاظ عليها إلى حد كبير في عرض خطوه 0.5 مم. ويصبح التمييز بين هؤلاء السكان ضائعا باقتراب 1 ملم. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
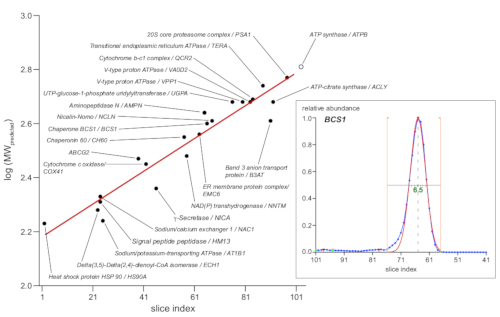
الشكل 4: تحديد الوزن الجزيئي الظاهر. 23 المجمعات علامة مع تكوين الجزيئية المحددة (كما هو مبين ، وفقا ل UniProtKB/السويسرية-Prot) واستخدمت علامات الحجم. تم رسم القيم اللوغاريتمية لأوزانها الجزيئية المتوقعة (في كده) مقابل. الملف الشخصي ذروه الحد الأقصى شريحة فهرس الوحدة الفرعية البروتين الممثل المشار اليه (الدوائر المملوءة باللون الأسود). قدم الانحدار الخطي المناسب لهذه البيانات (الخط الأحمر) وظيفة تحويل قيم مؤشر الشريحة إلى الأوزان الجزيئية الظاهرة. حددت [كبيك] قصوى كان ب [اوتومتيد] [غاوسي] يلائم إلى بروتين تشكيل جانبي قمم بما ان يبدي في ال أقحمت (يصح) ل ال [شبورون] بروتين BCS1 (معطيات أوليه في زرقاء, يلائم حدود يشير بخطوط برتقالية, يصلح عمل في احمر). الاضافه إلى ذلك ، فان هذه تناسبها تحديد الذروة نصف العرض الأقصى (الخط الأخضر ، 6.5 شرائح ، أو 1.6 مم علي سبيل المثال هو مبين) مع المجمعات التركيز الأكبر التي تغطي حول هلام 1.5 ملم. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
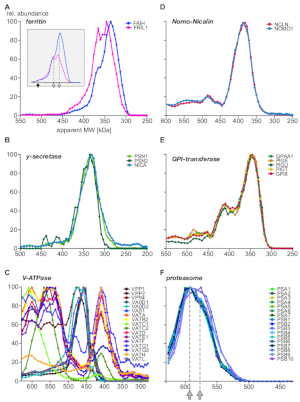
الشكل 5: أمثله لملفات تعريف الوحدات الفرعية المعقدة للبروتين. وفره البروتين النسبية مقابل الوزن الجزيئي الظاهر تامر لسلسله الثقيلة والخفيفة من فيريتين (ا) الكشف عن التغاير الجزيئي منالوحدةالفرعية فيريتين القياس ، أكثر وضوحا بعد أعاده قياس من وفره (أقحم). السهم الممتلئ والأسهم المفتوحة تدل علي المجمع الكامل (440 كده) والمجمعين الفرعيين ، علي التوالي. وقد أدمجت الوحدات الفرعية (B) من غاما-سيكريداز بكمياتها في مجموعه أساسيه واحده من السكان المجمعين. المجمعات الفرعية لفاكولارH +-atpases (C) عرضت تجميعات متعددة مع تكوين الوحدات الخاصة متميزة ، وكلها عبرت في التنظير الباطني. شكلت البروتينات nomo1 و nicalin (D) مجمعا حصريا (gpi-transamidase) ، وهي اله انزيميه متعددة الوحدات الفرعية تشكل عده مجمعات. (ه) المجمع الأساسي للبروتينات 20s الذي يظهر (و) نمطا فرعيا دقيقا مع اثنين من السكان المشار اليها بواسطة السهام في الرمادي ، وجميعها منشؤها التعريب تحت الخلوية الأخرى. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
Discussion
الدراسة المقدمة التي بنيت علي تقنيه csBN-MS قياسها سابقا مع اعداد الميتوكوندريا11 ودمج التحسينات في اعداد العينة ، ومعالجه هلام ، وتقييم البيانات MS. وقدم التحليل المركز لقسم من هلام الفصل واسعه النطاق BN-PAGE مجموعه شامله من البيانات التي تبين تدابير الجودة مماثله للدراسة مع اغشيه الميتوكوندريا. وظلت الأخطاء التي طرات علي الكتلة ووقت الاستبقاء ، فضلا عن الاختلافات في التشغيل ، منخفضه جدا ووفرت الأساس لتحديد ملامح موثوقه لوفره البروتين. حجم القرار يبدو ان تكون جيده ، مع عرض الذروة نصف القصوى منخفضه مثل سته شرائح (المقابلة 1.5 مم ، الشكل 4) والاختلافات النسبية حجم اقل من 10 ٪ حل (الشكل 3، الشكل 5ا). هذه القيم لم تلبي تماما جوده دقه الحجم من تحليل csBN-MS السابقة من الميتوكوندريا (علي الرغم من أصغر حجم الخطوة أخذ العينات هلام المختار) ، لكنها أفضل بكثير من أداء التقليدية BN-MS أو حجم الاستبعاد MS تقترب من20 التي أصبحت في الاونه الاخيره شعبيه.
وتبرز اهميه دقه الحجم المعقدة العالية الفعالية في تجربه المحاكاة في الشكل 3 (باستخدام المجمعات المرتبطة بالTPC1) التي يصعب حلها بواسطة تحليل اللطخه الغربية من الدرجة الثانية (الشكل 1ب). وتشير هذه النتائج إلى ان تشريح 0.25 مم في هذه الحالة ادي إلى بعض الإفراط في أخذ العينات ، ولكن هذا ثبت انه لا يزال مفيدا للقضاء علي "التشويش الكمي" دون المساومة علي دقه الحجم الفعال. التالي ، تمشيا مع النتائج السابقة11، حجم خطوه أخذ العينات من ~ 0.3 مم هو عموما الموصي بها.
ولا سيما ان التمييز في المجمعات المرتبطة بالTPC1 يفقد تماما مع أخذ عينات هلام 1 مم ، وهو أصغر حجم الخطوة المقدمة من التقطيع اليدوي في التقليدية BN-MS5،6. وهذا قد يفسر حقيقة انه علي الرغم من التكنولوجيات MS قويه المتاحة, وقد تم تحديد عدد قليل جدا من مجمعات البروتين والوحدات الفرعية من قبل التنميط المعقدة. بالاضافه إلى قوه حل جيده ، csBN-MS يقدم براعة عاليه. يمكن حل المجمعات المرتبطة بغشاء ومجمعات البروتين القابلة للذوبان التي تتراوح من 50 كده إلى عده MDa بشكل فعال في تجربه واحده مع الحد الأدنى من التحيز11. هذا يتناقض مع تقنيات الفصل البديلة المستخدمة لتنميط المعقدة مثل حجم الاستبعاد أو اللوني تبادل الأيونات ، التي تعمل مع مجموعات من البروتينات القابلة للذوبان مع نطاقات معينه من حجم أو تهمه خصائص. علي الجانب السلبي ، csBN-MS اقل قابليه للتطوير (الحمولة القصوى من ~ 3 ملغ بروتين لكل هلام) ، قد تكون صعبه من الناحية الفنية ، ولا يمكن ان تكون تلقائية.
وإجمالا ، تبين النتائج ان التنميط المعقد القائم علي csBN MS يمكن تطبيقه بنجاح علي الأهداف غير المتقدريه ولكنه يشير أيضا إلى بعض التحديات المرتبطة به. التالي ، يتطلب الاستخراج الفعال والاستقرار البيوكيميائي لمجمعات البروتين المزيد من التحسين ، وخطوات التنظيف وقد لا تزال محدوده. وفي اطار حجم التحقيق ، كان عدد المجمعات البروتينية المركزة بشكل جيد ، والمكونات أحاديه التشتت ، في الواقع اقل بكثير (لم تظهر البيانات) بالمقارنة مع عينه من الميتوكوندريا. ويوصي أيضا لخفض الأحمال العينة BN-PAGE للحصول علي انفصال هلام مقبوله. قد تتطلب الأحمال العالية ممرات جل أوسع أكثر صعوبة لمعالجتها بشكل صحيح لتقطيعها (انظر الفيديو المصاحب). وعلاوة علي ذلك ، كان تعقيد البروتين من العينات اعلي (حوالي ضعفين) من الهضم شريحة المشتقة من الميتوكوندريا ، مما يؤدي إلى المزيد من القيم الكهروضوئية المفقودة والنطاق الديناميكي المنخفض. في الواقع ، بعض البروتينات الصغيرة المتوقع ان تكون جزءا من المجمعات المبينة في الشكل 5 كانت مفقوده في التحليلات. ويمكن حل هذه المشاكل في المستقبل باستخدام أدوات MS أسرع وأكثر حساسية أو أوضاع اكتساب مستقله للبيانات.
اعداد العينة أمر بالغ الاهميه لاستخلاص البروتين المعقدة ، والاستقرار ، ونوعيه الانفصال هلام. يجب ان تكون المعلمات والإجراءات الأمثل لكل مصدر الانسجه ، الخلية lysate ، غشاء (كسر) ، والبروتين المعقدة من الفائدة. وترد التوصيات العامة التالية التي قد تساعد علي توسيع نطاق تطبيقات csBN-MS:
' 1 ' اعداد عينات جديده وتجنب الاحترار/التجميد ، والتخفيفات القوية ، والتغيرات في الظروف العازلة ، والتاخيرات غير الضرورية ؛
' 2 ' استخدام المخازن المؤقتة الخالية أساسا من الأملاح (يستعاض عنها بالبيتين 500-750 مم أو بحمض امينوكابرويك) ، وعن درجه الحموضة المحايدة ، وتحتوي علي ما يصل إلى 1 في المائة (ث/ف) من المنظفات غير المزيلة (البروتين: نسبه المنظفات بين 1:4-1:10 لأذابه الغشاء مجمعات البروتين ، لا المنظفات اللازمة لمركبات البروتين القابلة للذوبان) ؛
' 3 ' الاختبار الدقيق وضبط ظروف المنظفات بواسطة الصفحة التحليلية BN ، لأنها قد تؤثر بشده علي كفاءه الذوبان المعقد ، وتمثيل مجمعات البروتين الغشائي في العينة ، والاستقرار ، وتجانس البروتين المنظفات micelles. هذه الاخيره هي الشروط المسبقة للبروتينات للتركيز كفرق متميزة/المجموعات السكانية المعقدة علي الهلام BN-PAGE. الأدب السابق يقدم مجموعه واسعه من المنظفات المحايدة. ومع ذلك ، DDM (ن-دوديسيل β-د-مالتوسيدي)1،2،4،5،6 و ديجيتونين3،5،7،8، 9,10,13,18 وكانت الخيارات الأكثر شعبيه لتحليلات BN-MS حتى الآن. ويجب التاكيد علي ان اي حاله من حالات المنظفات تمثل بالضرورة حلا توفيقيا بين كفاءه الذوبان والحفاظ علي تفاعلات البروتين وقد لا تكون مناسبه بالتساوي لجميع أنواع البروتين المستهدف والمواد المصدرية ؛
' 4 ' أزاله البوليمرات المشحونة مثل ألياف الليفية ، والخيوط ، وبوليلسين ، والحمض النووي ، ومكونات الوزن الجزيئي المنخفضة الوفيرة (اي نواتج الأيض أو الدهون أو الببتيدات). ويمكن تحقيق ذلك عن طريق التسميد ، والترشيح هلام ، أو غسيل الكلي. وهذا مهم بشكل خاص لمجموع الخلايا أو الانسجه lysates;
' 5 ' أضافه كوماسي G-250 (التركيز النهائي 0.05%-0.1%) والسكروز (لزيادة الكثافة للتحميل ، والتركيز النهائي 10 ٪-20 ٪ [ث/ف]) إلى العينة قبل التحميل فقط ، لمسح بواسطة ultracentrifugation قصيرة ، وتحميل العينة دون اضطراب ، وبدء تشغيل مباشره بعد ذلك.
وكمنظور مستقبلي ، يقدم التنميط القائم علي csBN MS خيارات لمضاعفه الإرسال لدراسة ديناميات معقده البروتين أو التغييرات المتعلقة بالظروف البيولوجية المحددة. ويبدو الفصل المشترك بين العينات الموسومة بالأيض علي النحو المقترح لتحديد الحجم القائم علي الاستبعاد21 واضحا ، ولكنه قد يعوقه تبادل الوحدات الفرعية العفوية في مجمعات تحدث بشكل مستقل عن الانفصال المستخدم الاسلوب. بدلا من ذلك ، يمكن حل العينات الموسومة في الممرات هلام المجاورة ، والتي يمكن بعد ذلك ان تكون مشتركه في شرائح أو مجتمعه بعد هضم للتحليل التفاضلي مع حساسية عاليه ومتانة.
Disclosures
المؤلف أوى شولتي هو موظف ومساهم في Logopharm GmbH التي تنتج المجمع 47 المستخدمة في هذه الدراسة. وتقدم الشركة الكواشف المعقدة إلى المؤسسات الاكاديميه علي أساس غير ربحي.
Acknowledgements
ساندت هذا دراسة كان ب ال [ديوتسكه] [فورسكهنغجميندسكهفت] ([دغ], المانيه بحث مؤسسه)-[بروجكت-معرف] 403222702-[سفيس] 1381 وتحت ألمانيا امتياز استراتيجية [كسبس-اكسك-2189-مشروع [فيد] 390939984. نشكر كاتيا زابي علي المساعدة الفنية.
Materials
| Name | Company | Catalog Number | Comments |
| 30% Acrylamide/Bis Solution, 37.5:1 | Bio Rad | #1610158 | Recommended for acrylamide gradient gel solutions up to 13% |
| 30% Acrylamide/Bis Solution, 19:1 | Bio Rad | #1610154 | Recommended for acrylamide gradient gel solutions >13% |
| SYPRO Ruby Protein Blot Stain | Bio Rad | #1703127 | Total protein stain on blot membranes; sensitive and compatible with immunodetection |
| Coomassie Brilliant Blue G-250 | Serva | no. 35050 | Centrifugate stock solutions prior to use |
| ComplexioLyte 47 | Logopharm | CL-47-01 | Ready-to-use detergent buffer (1%) for mild solubilization of membrane proteins |
| Embedding Medium / Tissue Freezing Medium | Leica Biosystems | 14020108926 | Embedding medium for gel sections to be sliced by a cryo-microtome |
| Immobilon-P Membrane, PVDF, 0,45 µm | Merck | IPVH00010 | |
| ECL Prime Western Blotting Detection Reagent | GE Healthcare | RPN2232 | |
| Plastic syringe with rubber stopper, 20-30 ml | n.a. | n.a. | any supplier, important for making gel section embedding tool |
| broad razor blade | n.a. | n.a. | any supplier, for BN-PAGE gel trimming / excision of lanes |
| metal tube / cylinder, ca. 4 cm long | n.a. | n.a. | mold for embedding and freezing of gel samples |
| Protein LoBind Tubes, 1.5 ml | Eppendorf | Nr. 0030108116 | highly recommended to minimize protein/peptide loss due to absorption |
| sequencing-grade modified trypsin | Promega | V5111 | |
| C18 PepMap100 precolumn, particle size 5 µm | Dionex / Thermo Scientific | P/N 160454 | |
| PicoTip emitter (i.d. 75 µm; tip 8 µm) | New Objective | FS360-75-8 | |
| ReproSil-Pur 120 ODS-3 (C18, 3 µm) | Dr. Maisch GmbH | r13.93. | columns packed manually |
| rabbit anti-TPC1 antibody | Gramsch Laboratories | custom production | described in Castonguay, et al., 2017 (Reference 12) |
| Cy3-biotinylated goat anti-rabbit IgG | Vector Laboratories | CY-1300 | described in Castonguay, et al., 2017 (Reference 12) |
| biotinylated Lotus tetragonolobus lectin, FITC-conjugated | Vector Laboratories | #B1325 | described in Castonguay, et al., 2017 (Reference 12) |
| cryo-microtome Leica CM1950 | Leica Biosystems | 14047743905 | |
| Mini Protean II Cell with wetblot unit | Bio Rad | n.a. | for SDS-PAGE and Westernblot (not sold any more) |
| Penguin Midi Gel Electrophoresis System | PeqLab | n.a. | for BN-PAGE (not sold any more) |
| Zeiss Axiovert 200 M microscope + Photometrics Coolsnap 2 digital camera | Zeiss / Photometrics | n.a. | |
| peristaltic pump (IP high precision multichannel) | Ismatec | ISM940 | for casting of gradient polyacrylamide gels |
| gradient mixer with stirring (two chambers) | selfmade, alternatively Bio Rad | 1652000 or 1652001 | for casting of gradient polyacrylamide gels, manual provides instructions to cast linear or hyperbolic gradient gels (http://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1652000.pdf) |
| ultracentrifuge Sorvall M120 with S80 AT3 rotor | Sorvall / Thermo Scientific | n.a. | for sample preparation (not sold any more) |
| UltiMate 3000 RSLCnano HPLC | Dionex / Thermo Scientific | ULTIM3000RSLCNANO | |
| Orbitrap Elite mass spectrometer | Thermo Scientific | IQLAAEGAAPFADBMAZQ |
References
- Majeran, W., et al. Consequences of C4 Differentiation for Chloroplast Membrane Proteomes in Maize Mesophyll and Bundle Sheath Cells. Molecular & Cellular Proteomics. 7, 1609-1638 (2008).
- Wessels, H. J., et al. LC-MS/MS as an alternative for SDS-PAGE in blue native analysis of protein complexes. Proteomics. 9 (17), 4221-4228 (2009).
- Heide, H., et al. Complexome profiling identifies TMEM126B as a component of the mitochondrial complex I assembly complex. Cell Metabolism. 16 (4), 538-549 (2012).
- Wessels, H. J., et al. Analysis of 953 human proteins from a mitochondrial HEK293 fraction by complexome profiling. PLoS ONE. 8 (7), e68340 (2013).
- Wöhlbrand, L., et al. Analysis of membrane-protein complexes of the marine sulfate reducer Desulfobacula toluolica Tol2 by 1D blue native-PAGE complexome profiling and 2D blue native-/SDS-PAGE. Proteomics. 16 (6), 973-988 (2016).
- Takabayashi, A., et al. PCoM-DB Update: A Protein Co-Migration Database for Photosynthetic Organisms. Plant and Cell Physiology. 58 (1), e10 (2017).
- Senkler, J., et al. The mitochondrial complexome of Arabidopsis thaliana. The Plant Journal. 89 (6), 1079-1092 (2017).
- de Almeida, N. M., et al. Membrane-bound electron transport systems of an anammox bacterium: A complexome analysis. Biochimica et Biophysica Acta. 1857 (10), 1694-1704 (2016).
- Anand, R., Strecker, V., Urbach, J., Wittig, I., Reichert, A. S. Mic13 Is Essential for Formation of Crista Junctions in Mammalian Cells. PLoS ONE. 11 (8), e0160258 (2016).
- Eydt, K., Davies, K. M., Behrendt, C., Wittig, I., Reichert, A. S. Cristae architecture is determined by an interplay of the MICOS complex and the F1FO ATP synthase via Mic27 and Mic10. Microbial Cell. 4 (8), 259-272 (2017).
- Müller, C. S., et al. Cryoslicing Blue Native-Mass Spectrometry (csBN-MS), a Novel Technology for High Resolution Complexome Profiling. Molecular & Cellular Proteomics. 15 (2), 669-681 (2016).
- Castonguay, J., et al. The two-pore channel TPC1 is required for efficient protein processing through early and recycling endosomes. Scientific Reports. 7 (1), 10038 (2017).
- Schägger, H., Pfeiffer, K. Supercomplexes in the respiratory chains of yeast and mammalian mitochondria. The EMBO Journal. 19 (8), 1777-1783 (2000).
- Banyard, S. H., Stammers, D. K., Harrison, P. M. Electron density map of apoferritin at 2.8-A resolution. Nature. 271 (5642), 282-284 (1978).
- Dettmer, U., et al. Transmembrane protein 147 (TMEM147) is a novel component of the Nicalin-NOMO protein complex. The Journal of Biological Chemistry. 285 (34), 26174-26181 (2010).
- Kimberly, W. T., et al. Gamma-secretase is a membrane protein complex comprised of presenilin, nicastrin Aph-1, and Pen-2. Proceedings of the National Academy of Sciences of the United States of America. 100 (11), 6382-6387 (2003).
- Hong, Y., et al. Human PIG-U and yeast Cdc91p are the fifth subunit of GPI transamidase that attaches GPI-anchors to proteins. Molecular Biology of the Cell. 14 (5), 1780-1789 (2003).
- Van Damme, T., et al. Mutations in ATP6V1E1 or ATP6V1A Cause Autosomal-Recessive Cutis Laxa. The American Journal of Human Genetics. 100 (2), 216-227 (2017).
- Budenholzer, L., Cheng, C. L., Li, Y., Hochstrasser, M. Proteasome Structure and Assembly. Journal of Molecular Biology. 429 (22), 3500-3524 (2017).
- Heusel, M., et al. Complex-centric proteome profiling by SEC-SWATH-MS. Molecular Systems Biology. 15 (1), e8438 (2019).
- Kristensen, A. R., Gsponer, J., Forster, L. J. A high-throughput approach for measuring temporal changes in the interactome. Nature Methods. 9 (9), 907-919 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved