Method Article
הפרדה ברזולוציה גבוהה בפרופיל מלא-ניתוח בהקפאה בסון-MS
In This Article
Summary
הפרוטוקול BN-MS רב-תכליתי באמצעות מיקרוטומה מוצג ברזולוציה גבוהה complexome פרופיל.
Abstract
חלבונים בדרך כלל להפעיל פונקציות ביולוגיות באמצעות אינטראקציות עם חלבונים אחרים, או בתוך הרכבות חלבון דינמי או כחלק של מתחמי שנוצרו באופן בלתי נשכח. האחרון יכול להיפתר באלגנטיות בהתאם לגודל המולקולרי באמצעות אלקטרופורזה ב-אלקטרופורזה ג'ל (בסון-עמוד). זיווג של הפרדות הצבע האלה לספקטרומטר מסה רגיש (BN-MS) כבר מבוסס היטב, תיאורטית מאפשר הערכה ממצה של המיולפרולשולחן בדגימות ביולוגיות. עם זאת, גישה זו הוא מפרך למדי ומספק מוגבלת רזולוציה בגודל מורכב ורגישות. כמו כן, היישום שלו נשאר מוגבל השפע חלבונים מיטוכונדריאני ומפלטיד. כך, עבור רוב של חלבונים, מידע לגבי אינטגרציה לתוך מכלולי חלבון יציב עדיין חסר. מוצג כאן היא גישה ממוטבת עבור הפרופיל complexome הכוללת הפרדת בקנה מידה של BN-עמוד הפרדה, מילימטר מרובע של נתיבי ג'ל רחבים על ידי cryomicrotome חותך, ניתוח ספקטרומטר המוני עם כימות חלבון ללא תווית. ההליכים והכלים לשלבים קריטיים מתוארים בפרוטרוט. כיישום, הדו ח מתאר ניתוח complexome של שבריר הממברנה המועשרת מסיסות מועשר מכליות העכבר, עם 2,545 חלבונים הפרופיל בסך הכל. התוצאות להפגין זיהוי של מדים, דל שפע חלבונים קרום כגון ערוצי יונים תאיים, כמו גם ברזולוציה גבוהה, דפוסי הרכבה חלבון מורכבים, כולל הגליקוזילציה isoforms. התוצאות הן בהסכמה עם ניתוחים ביוכימיים עצמאיים. לסיכום, מתודולוגיה זו מאפשרת זיהוי מקיף ולא משוחד של מכלולי חלבון (סופר) והרכב תת-יחידתי שלהם, המספק בסיס לחקירת סטויכמטריה, הרכבה ודינמיקה של מכלולי חלבונים בכל . מערכת ביולוגית
Introduction
בסון-עמוד הפרדה היה הראשון ישירות ביחד לניתוח LC-MS (BN-MS) על ידי Majeran1 ו-Wessels2 קבוצות מחקר באמצעות חיתוך ידני של בסון-עמוד מסלולים ג'ל. הניתוחים שלהם זיהו מספר מתחמים שופע חלבון ממברנה עם הרכב יחידת ידוע מהמפעל הצמח ו hek תא המיטוa, בהתאמה. עם זאת, ניתוחים אלה היו רחוקים מקיף ולא אפשרו זיהוי משוחדת של הרכבות הרומן. ביצועי הספקטרומטר מסה ושיטות הקוונדות ללא תווית השתפרו במידה ניכרת מאז, אשר אפשרה ניתוח מקיף של בסון-MS. זה טבע את המונח. " לדוגמה, הייב ועמיתים לעבודה ניתחו לב חולדה המיטו, זיהוי ובאשכולות 464 חלבונים מיטוכונדריאלי, ובכך מאשרים מכלולים ידועים רבים. בנוסף, הם מצאו TMEM126B להיות משנה הספר העיקרי של קומפלקס הרכבה מסוים3. תוצאות דומות (עם 437 פרופילי חלבון מיטוכונדריאלי) הושגו במחקר מקבילי של תא HEK המיטו,4.
למרות שיפורים אלה, כמה בעיות נשארו כי לרסן את הפוטנציאל המלא של בסון-MS עבור פרופיל complexome. מגבלה משמעותית היא ברזולוציה בגודל אפקטיבי של מתחמי שנקבע על ידי שני גורמים: the (אני) איכות של הפרדת בסון-PAGE, אשר תלוי אחידות של הנקבוביות מטריצה ג'ל, כמו גם את היציבות/מסיסות של מתחמי לדוגמה, ו (ii) גודל צעד של הדגימה ג'ל, אשר במקרה הטוב ביותר 1 מ"מ כאשר משתמש בפריסה ידניתהידני 5,6. החלטה בגודל המסכן לא רק מחמיץ מורכבות איזופורמים מורכבים הטרוסקסואלים, אבל זה גם משפיע לרעה על טווח דינמי ביטחון של משוחדת, דה נובו הקצאה יחידת וכימות.
אתגרים אחרים כוללים את הדיוק של כימות החלבון וכיסוי של הטווח הדינמי בפועל של מחולות החלבונים במדגם על ידי ניתוח ספקטרומטרי המוני. לכן, היישום של בסון-MS בפרופיל complexome נשארה מוגבלת במידה רבה לדגימות ביולוגיות עם מורכבות נמוכה יותר, ביטוי גבוה של מתחמי היעד, מאפייני פתרונות נוחים (כלומר, פלסטלינה, המיטוגרם, ו מיקרואורגניזמים)6,7,8,9,10.
הצגנו לאחרונה cryomicrotome חותך-בסיוע BN-MS (csBN-MS), אשר משלבת מדויק sub-מילימטר דגימה של בסון-עמוד מסלולים ג'ל עם ניתוח MS מקיפה ועיבוד נתונים MS משוכלל לקביעת פרופילי חלבון עם גבוה ביטחון11. יישום להכנת קרום מיטוכונדריאלי מהמוח חולדה הפגינו בעבר ברזולוציה יעילה מורכבת בגודל וכיסוי מרבי של מורכבות שרשרת הנשימה חמצוני (oxphos) חלבוניות (כלומר, 90 של 90 MS נגיש). דוגמה זו זיהתה גם מספר הרכבות של חלבון הרומן.
מתוארים כאן הם הליכים ממוטבים לקנה מידה המותאם להיקף בסון-PAGE הפרדת מכלולי חלבון (לא מוגבל למקור ביולוגי מסוים), הליהוק של בסון BN-עמוד גדול הcryomicrotome, חיתוך של נתיבי ג'ל רחבים, ו-MS נתונים עיבוד. ביצועים של פרופיל ברזולוציה גבוהה מוצג עבור הכנה מורכבת חלבון מפני כליה העכבר המועשר ממברנות. לבסוף, היתרונות של הרזולוציה הגוברת והדיוק של הקוונפיקציה ההמונית מודנים.
Protocol
1. הסדר בסון-עמוד
- הכנת ג'ל
- השתמש במערכת אלקטרופורזה בתבנית האמצעית של ג'ל אנכי (> 10 ס מ מרחק הפרדת ג'ל; 14 ס"מ x 11 ס"מ, 1.5 מ"מ מרווח) עם קירור יעיל להגדיר 10 ° c.
- הגבס ליניארי או היפרבולי נקבובית ג'ל מעבר הצבע (1.5-3.0 מ"מ מרווחים) באמצעות מערבל מעבר שני קאמרית מונע על ידי משאבה (ראה לוח חומרים ריאגנטים). בדוגמה המוצגת (ג'ל מעבר צבע ליניארי 1%-13%):
- הכינו פתרון של 13 מ ל לחדר הקדמי (ערבוב) המורכב מ-13% אקרילאמיד (מתוך 30% תמיסת מניות, 37.5:1.0 אקרילאמיד: ביאקרילאמיד), 0.75 M עמינח מדיום חומצה, 50 mM Bis-Tris (pH = 7.0) ו-10% גליצרול.
- הכינו פתרון של 10 מ ל לחדר האגירה המורכב מ-1% אקרילאמיד (מתוך 30% פתרון מניות, 37.5:1.0 אקרילאמיד: ביאקרילאמיד), 0.75 מ ' חומצה עמינח, 50 mM Bis-Tris (pH = 7.0), ו 0.2% קלרנית-47 כביסה.
- הפעל את שטירר ולהוסיף 30 מיקרו ליטרים של APS (אמוניום peroxodisulfate, 10% מניות פתרון) ו-2.5 μL של TEMED (N, n, N ', N'-טטרמתיל ethylenediamine) ו 2.5 מיקרויטר של TEMED לפתרון בחדר הקדמי. הפעל את המשאבה ופתח את השסתום הקדמי (הזרימה צריכה להיות מותאמת להשלמת הליהוק בתוך 10 דקות). לאחר 1 דקות להוסיף 90 μL של APS ו 5 μL של TEMED לפתרון בחדר האגירה ולפתוח את החיבור הקאמרי.
- הניחו לג לעשות זאת באיטיות, אך ביסודיות לפחות 24 שעות בטמפרטורת החדר (RT) כדי להפיק מעבר צבע הומוגנית בגודל נקבובית. כאשר המשיכו לחות, ניתן לאחסן את הג הפילמור זקוף בארבע מעלות צלזיוס עד שבוע אחד.
הערה: במכוון, החלק העליון של הג יהיה בעל עקביות רכה/מגעיל. זה יוסר מאוחר יותר, אך מאפשר כניסה חלקה של חלבונים לתוך הג, עם סיכון מינימלי של משקעים בחלבון שעלולים להוביל באופן אחר ממצאים הגירה (כלומר, הגשם או משקעים בחלבון).
- הכנה לדוגמה וטעינה
- הכינו חריצי טעינה באמצעות הוספת מרווחים מתאימים (לדוגמה, צינורות סיליקון) בין צלחות זכוכית להפרדת 0.5-2.0 מ ג של חלבון. את החריצים יש לעשות לפחות 3 ס"מ (או יותר, 5-6 ס מ רחב).
- מסיסות ~ 2.5 מ ג של קרום (כליה העכבר אנדוכמה מועשר הכנה) ב 2 מ ל של מאגר מסיסות המכיל 1% (w/v) ללא הצפת אבקת (ComplexioLyte CL-47) עבור 30 דקות על קרח. שער ultracentrifugate (לגזור משקעי שכבות = 200 S או פחות; 130,000 x g/11 דקות משמש כאן).
- לרכז את הפתרון על קצר 50% 20% (w/v, 0.3 ml כל אחד) הדרגתי צעד בהדרגה על ידי מעבר של 1 h ב 400,000 x g. תפוקת החלבון הסופית. צריכה להיות לפחות 1 מ ג
- הוסף 0.05% (w/v) Coomassie G-250 כדי מסיסות וטען את המדגם על ג'ל. הגבל את עומס החלבון ל-10-15 μg/mm2 ג'ל לנתיב חתך כדי להשיג ברזולוציה גבוהה ולהימנע מחפצים הנובעים ממשקעים בחלבון.
- בסון-עמוד תנאי ריצה
- עבור מאגרי ריצה, להכין מאגר קתודה תקן המורכב של 50 mM tricine, 15 mM Bis-Tris, ו 0.01% Coomassie G-250. הכן מאגר אנודת סטנדרטי המורכב של 50 mM Bis-Tris (pH = 7.0).
- הפעל בסון מזמין-עמוד ב 10 ° c לילה באמצעות פרוטוקול מתח שלושה שלבים13 המורכב: שלב משקל עבור 30 דקות ב 100 V, ואז איטי (3 שעות) השיפוע כדי מתח מירבי (40-50 v/ס מ אורך ג'ל) כי הוא נשמר לבסוף עבור לפחות 6 h עבור נקודת קצה התמקדות של חלבונים.
הערה: מומלץ להשהות את האלקטרופורזה כאשר חזית ההגירה הגיעה למרכז הג ולהחליף את מאגר הקתודה עבור מאגר טרי ללא Coomassie G250. זה עוזר למנוע חפצי משקעים בג כתוצאה מקריסה מקומית של מבנה נקבוביות המטריקס.
2. דגימת ג'ל ועיכול
- כריתה של נתיבי ג'ל
- לאחר הריצה, לסרוק את ג'לים למטרות תיעוד תוך שמירה על זה בין צלחות זכוכית.
- פרק את הלוחות והבלו את חלק הנתיב של הריבית.
- קח לדוגמה רצועה של הנתיב לניתוח על ידי 2D בסון/SDS-עמוד וצביעת חלבון או בלוק מערבי (כפי שמוצג באיור 1B) כדי לקבוע אזורים של עניין, רזולוציה אפקטיבית בגודל מורכב, ושפע של חלבון.
- לתקן את נתיבי ג'ל נבחר פעמיים עבור לפחות 30 דקות עם 30% (v/v) אתנול ו 15% (v/v) חומצה אצטית.
- העבר את המדגם כדי להטביע בינונית ולאפשר לו להשרות ומשקל עבור לפחות 2 h ב 4 ° c, תוך שמירה על לוח ג'ל בהילוך איטי על שייקר מסלולית.
הערה: הפרדת הג צריכה להיבדק בקפידה על איכות ההפרדה וחפצי ההגירה הכוללים. להקות ג'ל המייצגות חלבונים דומיננטיים אמורות להיות ללא עיוות והומוגנית בעוצמה. יש להוציא את החפצים המקומיים על הג או להשאיר אותו מחוץ לניתוח.
- הטבעה וחיתוך cryomicrotome
הערה: זוהי גרסה משופרת של הליך ההטבעה המתוארת והתמונה המתועדת בעבר, המאפשרת הטבעה וחיתוך של נתיבי ג'ל רחבים יותר של עד 8 ס מ11.- ראשית, חותכים נתיבים ג'ל קבוע למקטעים (כאן, 3 ס מ) בדיוק במקביל לתבנית הגירה החלבון הקדמי/הלהקה. לטיפול קל יותר, מניחים כל מקטע בסרט פלסטיק עם מימדים שווים.
- להעביר את הנתיבים לתוך צינור פתוח עם פקקים (סגור בתחתית, מחורר באופן מרכזי על גבי, שניהם מיושרים במדויק עם הקצוות העליונים והתחתונים של המקטע ג'ל).
- טובלים את הצילינדר לזמן קצר לתוך חנקן נוזלי כדי ליזום במהירות את המיצוק. בינונית הטבעה שקופה מתקשה בתוך שניות והופכת ללבן בצבע.
- ממלאים את חלל עם הטבעה בינונית, לטבול אותו לזמן קצר לתוך חנקן נוזלי, ולהקפיא את גליל ב-20 ° c במשך מספר שעות.
הערה: קירור גליל במהירות על ידי טבילה אותו לתוך חנקן נוזלי מסייע למנוע תזוזה של לוח ג'ל בתוך הצינור. יש להימנע מעיוות כדי להבטיח רזולוציה גבוהה בניתוח MS הבא. - לאחר פירוק, להסיר את הסרט פלסטיק ולהעביר את הבלוק עם חתך ג'ל מוטבע מקורר, גדול קוטר, גליל מתכת ממוקם על תמיכה שטוחה (כלומר, צלחת פטרי) אטום עם הטבעה בינונית על החלק החיצוני של הצילינדר. למלא את הצילינדר עם הטבעה בינונית ולהקפיא ביסודיות.
- חזור על הליך זה עם הצד השני של הצילינדר כדי לקבל גוש מוצק עם משטחי ישור.
- להסיר את הבלוק מהצילינדר, להדביק אותו עם הטבעה בינונית על מחזיק מתכת מקורר, ולהכניס את המחזיק לתוך מכונת ההקפאה (קריוטומה). המשטח של הבלוק צריך להיות מיושר בזהירות ביחס למישור הפרוסות. הניחו לו להתמצא בטמפרטורה האופטימלית לתהליך החיתוך (כאן, 15 ° c).
הערה: השתמש במחזוריות ידנית מתקדמת לחתוך מחזור של 0.1 mm גודל הצעד עד להכות את פני השטח של סעיף ג'ל מוטבע כדי להבטיח מיקום נכון. - הקציר פרוסות ג'ל אחד אחרי השני, עם עובי הסופי הרצוי של 0.25 mm גודל צעד, ולהעביר אותם בנפרד צינורות התגובה עם תכונות כריכה נמוכה חלבון.
הערה: בהגדרה זו, פרוסות ג'ל אחיד ניתן להשיג בקלות כמו דק כמו 0.1 מ"מ ועבה כמו 0.5 מ"מ.
- עיכול טריפטי
- לבצע את העיכול באמצעות ג'ל טריפטי לאחר כביסה מקיפה של פרוסות ג'ל (לפחות שלושה סיבובים נוספים של כביסה מומלץ להסיר רכיבים פולימריים של המדיום הטבעה) לאחר הליך סטנדרטי11.
- ואקום-יבש פפטידים והתמוססות ב 0.5% (v/v) חומצה trifluoroacetic על ידי טלטול ב 37 ° צ' (10 דקות) ואחריו אמבטיה sonication (5 דקות) ו צנטריפוגה קצר.
3. ספקטרומטר מסה
- הגדרת לוגי מיתכנת ו-MS
- לטעון דגימות מתעכל על סי18 precolumn (גודל החלקיקים = 5 μm; קוטר = 300 μm) עם 0.05% (v/v) חומצה trifluoroacetic באמצעות (מפוצל ללא) ננו-כלים בשילוב עם ספקטרומטר מסה עם רזולוציה גבוהה.
- אליוט כבשו פפטידים עם מעבר מימית אורגני הדרגתי (להתחמק A): 5 דקות 3% B, 120 דקות מ 3% B ל 30% B, 20 דקות מ 30% b ל 99% b, 5 דקות 99% B, 5 דקות מ 99% B עד 3% b, 15 דקות 3% B (קצב הזרימה = 300 nL/min)
הערה: הפרוסות של csBN-MS gel גורמות בדרך כלל לדגימות עם שפע פפטיד בינוני נמוך ורמת מורכבות מוגבלת. ניתוח nanoLC-MS/MS צריך אפוא להתבצע עם הגדרת מתן רגישות סבירה מהירות רצף, רזולוציה גבוהה המוני (> 100,000) וטווח דינמי מרבי (ביעילות 3-4 הזמנות של גודל). עם זאת, הוא אינו דורש ממדי טור ארוך או מעברי מדרגות המורחבת מעבר 3 h. - הפרדה פפטידים שונים ב פולט (זיהה 75 μm; עצה = 8 μm) ארוז ידנית כ 20 ס מ עם חומר סי18 (חלקיק גודל = 3 μm). Electrospray את הדגימות ב 2.3 kV (מצב יון חיובי) לתוך נימי העברה מחומם (250 ° c) של ספקטרומטר המסה.
- בצע ניתוחים עם הגדרות המכשיר הבאות11: מקסימום MS/ms זמן ההזרקה = 400 MS; משך הדרה = 60 s; הסף המינימלי של האות = 5,000 ספירות מקדימות למעלה 10 סמנים מפוצלים; רוחב בידוד = 1.0 מטר/z).
הערה: כדי להקל על כיול של מסה, זמן שמירה והקצאה של אותות פפטיד במספר רב של ערכות נתונים או מדידות, מומלץ לבצע סדרת מדידה בהתאמה לטרשת נפוצה ללא הפרעות או שינויים בפרמטרים ובחומרה ( i.e., על אותו עמודה סי18/פולט).
- זיהוי חלבונים (נתוני MS מוערכים כמתואר בעבר11)
- חלץ רשימות מרב מתוך מקטע של המקטע באמצעות הכלי "msconvert. exe" (חלק מפרוטאוזארד).
- הזזת כל ערכי m/z הקודמן עבור כל ערכת נתונים על-ידי היסט החציון m/z של כל הפפטידים המוקצים לחלבונים בחיפוש מסד נתונים ראשוני עם 50 לדקה עמידות בפני המוני.
- חיפוש ברשימות שיא מתוקן עם מנוע חיפוש מתאים (כאן, קמיע 2.6.2) נגד כל ערכי העכבר של מסד הנתונים UniProtKB/שוויצרי-פרוט (שחרור 2018_11).
- בחר "מרחריל (חלבון N-טווח)", "קרבאדאואתיל (ג)", "Gln | פיירו-גלו (N-מונח Q), לגלו | פיירו-גלו (N-טווח E) "," חמצון (ז) ", ו-" Propionamide (ג) "כשינויים משתנים.
- הגדר פפטיד ו המסה עמידות מסת ל ± 5 עמודים לדקה ו-± 0.8 Da, בהתאמה, ולאפשר מחשוף טריפטי אחד החמיץ. הגדר את ערך המכירה הקצר עבור זיהוי פפטיד ל-0.5 או פחות. השתמש בחיפוש במסד נתונים דמה כדי לקבוע את קצב הגילוי החיובי (רוזוולט) הכוזב. הגדר את ה-רוזוולט ל-1% או החל קריטריוני איכות נוספים כדי להבטיח זיהוי אמין.
הערה: הניסוי המוצג מזוהה יותר מ 3,500 חלבונים, עם ממוצע פפטיד רוזוולט של 4.4 ± 0.77% (n = 101 דגימות פרוסה), 3,000 או בשנת העשרה חלבונים כאשר פפטיד הוגדר 1%. חשוב מכך, קריטריונים מחמירים יותר שימשו לבחירת חלבונים מפרופיל (2,568). זה כלל את כל החלבונים שזוהו עם לפחות שני פפטידים, לפחות אחד מהם להיות מסוים חלבון, באחד לפחות 101 דגימות פרוסה.
- קוונפיקציה חלבוניות
- השתמש בעוצמות אות פפטיד (השיא כרכים [PVs]) עבור כימות החלבון המתקבלים מ-FT סריקות מלא ונכון עבור זמן השמירה ושינויי המסה באמצעות התוכנה המתאימה (כאן, MaxQuant v 1.6.3).
- יישור הנתונים של MS מגדיר אחת-על-אחת להפניה (ממוצע כולל) פפטיד פעמים באמצעות רגרסיה LOESS. הקצאת PVs פפטידים גם ישירות (מבוסס על MS/MS מבוססי זיהוי) או בעקיפין (כלומר, מבוסס על ההתאמה שלהם m/z ו הזמן הימנעות בתוך טולרנסים צר מאוד).
הערה: פרוטוקול זה משתמש בתוכנה בתוך הבית עבור הקצאה של "הוסיף" פפטידים נקרא. הגדר את התוצאה של הפרמטרים ב-m/z אפקטיבי ו טולרנסים התאמת זמן של ± 2 עמודים לדקה ו ± 1 דקות, בהתאמה (ראה איור 2א, ב). - נכון עבור וריאציות שיטתית של הפעלה-to-הפעלה של עומס פפטיד ויעילות האינון על-ידי שינוי קנה מידה של העוצמה פפטיד מתוך הבדלים החציוני של עוצמות פפטיד יחסיות בין דגימות הפרוסה השכנה (איור 2ג).
- סנן נתוני PV עבור מיירס והקצאות שנותרו שגויות שזוהו על-ידי ניתוח עקביות של PV פנימי.
- נרמל PVs של כל פפטיד לערכים המרביים שלהם על כל מאגר הפרוסות מגדיר פרופילי שפע פפטיד מניב יחסיים.
- לבסוף, לחשב פרופילי שפע של חלבון יחסית כממוצעים של לפחות שניים (עד שישה או 50%, לפי הערך הגדול ביותר) של הפרופילים הגדולים ביותר של הפפטיד על גבי חלון של שלוש פרוסות רצופות. הדבר מאפשר גישור של ערכי PV חסרים והפחתת רעש.
הערה: בסופו של דבר התוצאה היא 2,545 (של 2,568 מראש) פרופילי חלבון (איור 2ד).
- אפיון מכלולי חלבון
- לנתח פרופילי חלבונים על ידי ביצוע הראשון זיהוי שיא באמצעות שיטה מקסימה מקומית, ולהתאים ברציפות הפצות נורמלי לפסגות אלה, מניב את העמדה (כלומר, לחתוך את הפרוסה או גודל מורכב לכאורה) של מקסימה שלהם fwhm (רוחב מלא ב ערכים חצי מרביים) (הזחה של איור 4).
הערה: בערכת הנתונים, פרופילים מנתחים באופן אוטומטי באמצעות סקריפטים מותאמים אישית. ערכי ה-FWHM הקטנים ביותר מצביעים על רזולוציית הגודל האפקטיבית של הגישה (כאן, 6 x 0.25 = 1.5 מ"מ). - השתמש בפסגות מורכבות של חלבון עם מסה מולקולרית מוגדרת (כפי שדווח במסד הנתונים UniProtKB/שוויצרי) עבור ניתוח רגרסיה לינארית של log10 (מסה מולקולרית חזוי) כדי להמיר מדדי מספר פרוסה לגדלים מולקולריים לכאורה (כלומר, גודל מורכב לעין ב kDa).
הערה: 23 מתחמי סמן במדגם נבחרו במחקר זה (איור 4) מבוסס על (i) צורות monodisperse של פסגות פרופיל, (ii) תמיכה ניסויית של משקולות מולקולריים, ו (iii) הפצות לאורך מקטעי החקירה BN-דף ג ' ל.
- לנתח פרופילי חלבונים על ידי ביצוע הראשון זיהוי שיא באמצעות שיטה מקסימה מקומית, ולהתאים ברציפות הפצות נורמלי לפסגות אלה, מניב את העמדה (כלומר, לחתוך את הפרוסה או גודל מורכב לכאורה) של מקסימה שלהם fwhm (רוחב מלא ב ערכים חצי מרביים) (הזחה של איור 4).
תוצאות
הרוב המכריע של המחקר הקונבנציונלי בסון-MS, כמו גם לאחרונה הוקמה ברזולוציה גבוהה csBN-MS הגישה הוחלו על ההכנות מיטוכונדרילי הפלסטיות כי הם (אני) זמין בקלות, (ii) יש מורכבות מוגבלת, ו (iii) אקספרס היעד (קרום) חלבון מתחמי בצפיפות גבוהה. פרוטוקול זה מרחיב את היישום של פרופיל ברזולוציה גבוהה complexome לקרומים לא מיטוכונדריאלי המבטא חלבונים שופע נמוך, על איזה מידע קטן על האינטגרציה שלהם לתוך מכלולי זמין. למטרות הדגמה, בחרנו ממברנה אנדוכמה מועשר הכנה מכליות העכבר המתקבל על ידי צפיפות צנטריפוגה הדרגתי.
אופטימיזציה של הכנה זו הונחה על ידי סמן חלבון TPC1 כי טפסים ערוצי יון תאיים בעיקר מקומי מוקדם מיחזור אנדוזומים12. הוא גם מתבטא במידה רבה כליות האבוביות תאים הכרישים, כפי שמוצג על ידי ניתוח אימונוהיסטוכימיה של מקטעים רקמת כליות (איור 1א). הקרומים הללו היו מסיסות בעדינות (ComplexioLyte 47 בחלבון נמוך: יחס חומרי הניקוי של 1:8) ומרוכז בכרית של סוכרוז באמצעות הפוגות. האחרון התברר להיות צעד חשוב להסרת מרכיבים עודפים נמוך מולקולרית משקל (כלומר, חומרי ניקוי, שומנים, מלחים, פולימרים אורגניים, מטבוליטים) הנוטים להשפיע לרעה על הרזולוציה של הפרדות בסון-PAGE הניתנים ליישום.
הפרדה מורכבת על יליד 1%-13% (w/v) מעבר צבע אלקטרופורזה ג'ל (איור 1B, הפאנל האמצעי) הראה להקות חלבון מוכתם בחוזקה עם חפצי הגירה מעט מאוד. SDS-הפרדת העמוד של רצועה צרה של הג BN-PAGE (איור 1B, מסגרת מסגרות באדום) כממד שני ואחריו ניתוח כתמי מערבי הראה דפוס מוחלט של אוכלוסיות מורכבות הקשורות TPC1 (איור 1b , הלוח העליון, המסומן על-ידי חיצים אדומים), סביר להניח שנובע משיוך עם יחידות משנה נוספות ו/או שינויים בדואר האלקטרוני (כגון גליקוזילציה12). קטע של ריבית של 3 ס מ היה מוכן ומעובד עבור cryomicrotome לחיתוך כמתואר11. הצעדים הבודדים של הליך זה (בפרט, היישור המדויק של מקטע הג הרחב), המהווה חשיבות קריטית לשימור הרזולוציה במהלך הדגימה, מתועדים בווידאו הנלווה. מקטע ג'ל מוטבע נחתך לבסוף לתוך 101 פרוסות ג'ל עם עובי אחיד של 0.25 מ"מ (איור 1B, פאנל תחתון), אשר מתעכל בנפרד מנותח על ידי ביצועים גבוהים LC-מצמידים ספקטרומטר מסה.
בנוסף לרזולוציית גודל, איכות הקוונפיקציה של החלבון היא המפתח ליצירת פרופיל מוצלח של complexome. עם MS הגדרת והגדרות בשימוש, ניתוח של הדגימות היה מקיף למדי, וכתוצאה מכך זיהוי ממוצע של יותר מ 1,000 חלבונים ו 10,000 פפטידים (8,200 שהיו ספציפיים חלבון) לכל פרוסה, סביב 3,000 חלבונים ו-43,000 פפטידים (38,500 שהיו ספציפיים לחלבונים) בסך הכל. אף על פי כן, בשל האופי הסטוכסטי של רצפי הנתונים התלויים MS/MS והמגבלות שלה בטווח דינמי, המידע האינטנסיביות היה עדיין מפרגמיסטיים עבור חלבונים שופע פחות. לכן, הליך משוכלל MS עיבוד נתונים11בוצע כי הוא מבוסס על הקצאה מדויקת של אותות פפטיד (השיא כרכים [pvs] = פפטיד-הקשורות האות עוצמות משולבים מעל m/z וזמן) על הסדרה כולה של ערכות נתונים.
כפי שמוצג באיור 2A, B, סטיות של אותות פפטיד בזמן מסה ושמירה שנותרו לאחר כיול היו זהים עבור MS-רצף ועבור pvs בעקיפין הוקצה (עם טולרנסים צר מאוד של < 1 ppm ו < 0.5 דקות עבור 95% של PVs), הרומז על שיעור נמוך מאוד עבור הקצאה חיובית מזויפת PV. הערים הנותרות סוננו בהתבסס על העקביות שלהם עם PVs אחרים הקשורים. מאז כל מדידות MS נערכו ברציפות על אותו הגדרת LC-MS ללא שינויים פרמטרים או רכיבי חומרה, הפעלה-to-הפעל וריאציות (נקבע כחציון של כל עוצמות PV במדגם יחסית אלה בפרוסות השכנות) היו קטנים ובקלות בוטלו על ידי שינוי קנה מידה של ערכות הנתונים PV (איור 2ג). המידע בחוזק פפטיד כתוצאה מכן היה משמש לשחזר 2,545 חלבון ביחס שפע פרופילי. כפי שמוצג באיור 2D, יותר מ 75% של פרופילי חלבון אלה היו מבוססים על לפחות שלושה פפטידים עצמאיים חלבונים ספציפיים.
לאחר מכן, את הפרוטוקול המשוער רלוונטיות של גודל הצעד של BN-עמוד ג'ל דגימה לרזולוציה של מכלולי חלבון. למטרה זו, ערכות נתונים פרוסה הצטרפו על ידי סיכום מידע PV מתוך שתיים, שלוש, או ארבע פרוסות רצופות, ובכך להדמיית התוצאה עבור גודלי צעד של 0.5 מ"מ, 0.75 מ"מ, ו 1 מ"מ (לעומת הדגימה המקורית של 0.25 מ"מ). איור 3 ממחיש את פרופילי שפע שנוצר עבור חלבון TPC1 כדוגמה (A-D). ב 0.25 מ"מ, עוצמות יחסיות והפרדת הגודל של אוכלוסיות מורכבות הקשורות ל-TPC1 (איור 3א) היו נחמדות בהסכמה עם התוצאות מניתוח כתמי אבן המערבי (איור 1ב', הלוח העליון); למרות, הפרופיל הראה קצת רעש, בעיקר כתוצאה מערכים חסרים ("פערים") במטריצה PV המשמש לכימות.
הצטרפות לשתי פרוסות המתאימות ל-0.5 מ"מ שמרו על עוצמות הכוונות הנכונות ועל הפרדת המערכות המשויכות ל-TPC1 והוסרו רעש הקוונפיקציה (איור 3ב). לעומת זאת, גודל שלב גדול יותר של 0.75 מ"מ ו 1 מ"מ (איור 3ג, ד) הובילו לאובדן ברזולוציה של גודל וביטלה אפליה של TPC1 תת אוכלוסיות מורכבות. יש לציין כי הרוב המכריע של המתפרסמים בסון MS קונבנציונאלי מנתח להשתמש ידנית לחתוך 2 מ"מ פרוסות (סביב 60 לכסות את כל ג'ל ליין)7,8,9,10.
המרה של מרחק הגירה או אינדקס פרוסה לגודל מולקולרי מבוססת בדרך כלל על סמנים, או מסחרית זמינים מקומיים חלבונים או מתחמים חלבון אנדודוגני מאופיין עם הרכב יחידת ידוע (בעיקר [סופר] מכלולי שרשרת הנשימה היטוכונדריאלי של חמצוני [OXPHOS])13. עם זאת, מאז בסון-PAGE הפרדה מבוססת על חתך אפקטיבי מולקולרי שנקבע לא רק על ידי מסה מולקולרית אלא גם על ידי מבנה 3D ומספר של שומנים משויכים, חומרי ניקוי, ומולקולות Coomassie חלבונים בודדים עשוי להראות סטיות גדולות יותר. לכן, הוא נבחר להשתמש בסטים גדולים יותר של מכלולי חלבונים כמו סמנים11. העלילה באיור 4 מציגה 23 סמנים שנבחרו עם יחידת משנה ייצוגית המוצגת כמעגל שחור, המציינת את ערכי log10 של המסה המולקולרית החזוי שלה (בהתאם למסד הנתונים UniProtKB/שוויצרי-פרוט) לעומת. אינדקס הפרוסה של הפרופיל המתאים מירבי לשיא. האחרון הושג מתוך הרכב גאוס מתאים לנתוני שפע יחסית, כפי שמוצג בכניסה של איור 4 מציג את הדוגמה עם המלווה BCS1. רגרסיה לינארית (קו אדום) סיפקה פונקציה כדי להמיר ערכי אינדקס פרוסה לגדלים מולקולריים לכאורה, אשר נע בין 160-630 kDa, לאורך סעיף ג'ל נחקר.
בסופו של דבר, הניתוח סיפק מידע על מתחמי מאופיינים היטב והפגינו הקיום של הספר יחידות משנה והרכבות מורכבות. דוגמאות להדגיש היבטים שונים של complexome מוצגים באיור 5 (A-C: חלבונים הביע או רצוי ממוקם בתאי אנדוזומבית; D-F: מכלולים מתוך לוקליזציה אחרים של תת-תאי. ברזל הובלת חלבון ferritin ידוע טופס מתחמים מ 24 אור (FRIL1) ו/או כבד (FRIH) subunits, עם משקל מולקולרי כולל של 440 kDa14 (איור 5a, מלא חץ). הפרופילים של יחידת המשנה (איור 5א) מציעים את קיומו של לפחות שתי צורות קטנות יותר של הקומפלקס (עם מסה לכאורה של 360 kDa ו 340 kda; חיצים פתוחים) עם שרשרת כבדה/אור שונה באופן ברור (הנראה טוב יותר לאחר שינוי קנה מידה של שיבוץ של איור 5א) המצויים בשפע באנזומים.
לעומת זאת, nicalin-nomo1 מתחמי15 (איור 5ד), מתחם הדפטאז ליבת הגאמה16 (איור 5ב) ומכונות gpi-טרנסאמידאז17 (איור 5E) מציגות תיקון יחסי השפע של הליבה שלהם יחידות משנה על טווח הגודל כולו עצמאי מקשר עם חלבונים נוספים. הדבר מצביע על כך שיחידות המשנה שלהם בלעדיות זו לזו. שואבי H+-atpases הם מתחמי רב חלבון התאספו מתוך בריכה של יותר מ -20 יחידות משנה באופן מודולרי עם משקל מולקולרי כולל של סביב 900 kda. איור 5ג חושף תת מתחמי עם יצירות שונות של לפחות 17 יחידות משנה, או ייצוג ביולוגי (דיס) הרכבה intermediates או subunits שנוצרו על ידי התנאים ניסיוני, כמה מהם היו גם נצפתה במחקר בסון-MS האחרונות18. עוד דוגמה מורכבת multi-חלבון הוא הפרוטאסאום19 (איור 5F). סגור את הבדיקה של פרופילי שפע של אלפא וביתא תת להרכיב ליבה של 20 s פרוטאסדום מציע שתי אוכלוסיות מורכבות גדולות עם הבדלים עדינים גודל (590 kDa ו 575 kDa, המצוין על ידי חצים אפורים) ואינטגרציה של שלוש יחידות משנה בטא.
לסיכום, csbn-MS complexome פרופיל של ממברנות כליות אנדוזום מועשר לספק תוצאות מקיפות ומפורטות לגבי (i) שילוב של אחיד, נמוך שופע חלבונים היעד לתסביכים, (ii) כללי מורכב יחידת הלחנה ו סטויכמטריה ו-(iii) מורכבים מintermediates הטרוסקסואלים, מבני משנה ו (דיס).

איור 1: הפרדת העמוד בהפרדה של הקרומים המועשרת מפני כליות העכבר באמצעות ערוץ תאיים TPC1 כסמן. (א) אימונוהיסטוכימיה לוקליזציה של חלבון TPC1 בבית הכליה האבותית מיקרוסקופיה. ירוק: נוגדן anti-TPC112 צביעת דמיינו עם משנית Cy3-biotinylated עז הארנב igg; אדום: לוטוס ביולוגי (LTL, 10 μg/mL, FITC-מצוק) מסמנים את משטח הלומיאל של התאים האבובולוס. ההזחה מראה כתמים של חתך מקביל מכליה TPC1 KO כשליטה שלילית. פסי הקנה הלבן הם 20 μm. כמו כן, הערה היא חזקה TPC1 ביטוי בשלפוחיות תאיים, הידוע מפני ניסויים עצמאיים לייצג מוקדם ומיחזור אנדוזומים12. (ב) הסדר בסון-עמוד הפרדה של 2.5 מ ג של הקרומים המועשרת מסיסות באמצעות ממברנות על 1%-13% (w/v) מעבר הדרגתי ג'ל פוליאקרילמיד. נתיב צר (ממוסגר באדום) נחתך עבור SDS-עמוד הבאים/ניתוח כתמי המערבי (הפאנל העליון), בפתרון שונים TPC1-הקשורים מתחמי דפוסי הגליצלציה (חיצים אדומים: anti-TPC1/האנטי ארנב HRP/ECL הממשלה; ירוק: עמדות וחזויים ההמונים [מד הדרך] של מכלולי חלבון סמן מזוהה על ידי הכולל חלבון מכתים [SYPRO רובי כתמים כתם]) של האבן החשופה. מימין לשמאל: Na+/k+-העברה של Atpase, ציטוכרום b-c1 מורכב dimer, ATP סטנדרטים, נדיה: אוביקווינה oxidoreductase. קטע 3 ס מ של עניין מן הנתיב ג'ל היה מגורש, מוטבע בינוני הטבעה רקמות, רכוב, ופרוס לתוך 101 סעיפים (0.25 מ"מ) לאורך הגירה חלבון החזית באמצעות cryomicrotome (פאנל תחתון; ראה קישור וידאו). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: פרמטרי מפתח לקביעת דיוק של הקצאת אות MS וכימות, כמו גם עומק של ניתוח. (א) התפלגות שגיאות המסה היחסית (בעמודים לדקה) לאחר כיול m/z של MS/ms רצף (ברים אדומים) ומוקצה בעקיפין (כלומר, בהתבסס על זמני התאמת המסה וההחזקה, ראה פרוטוקול; ברים כחולים) אותות פפטיד. זה מציע טעות המסה הסופית של < 1 עמודים לדקה (עבור 95% של אותות/מוקצה PVs) ושיעור נמוך מאוד של הקצאות חיוביות שווא. (ב) הפצת סטיות זמן שמירה של ננו-כלים מהממוצע הכולל לאחר שימוש ביישור הזמן של אותות פפטיד, באמצעות רגרסיה loess (ראה פרוטוקול) וקידוד צבעים בשימוש ב (א). שגיאת זמן היא פחות מ-30 עבור > 95% של אותות פפטיד/מוקצה PVs. (ג) הווריאציה הפעלה-to-הפעלה של סה כ עוצמות MS המותווים ביחס לממוצע של שתי דגימות השכנות. גורמי קנה מידה אלה הוחלו על טבלאות ה-PV הגולמי כדי למזער שגיאות טכניות שיטתיות. (ד) מידע פפטיד המשמש לחישוב פרופילי שפע יחסית של חלבונים. לאחר סינון פפטידים ספציפיים לחלבון עבור מיירס, הבקיע היטב, או זהויות בודדות (ראה פרוטוקול), 2,545 מכיל פרופילי שפע חלבונים שנקבעו, > 75% מהם היו מבוססים על לפחות שלושה פפטידים עם ביטחון סביר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
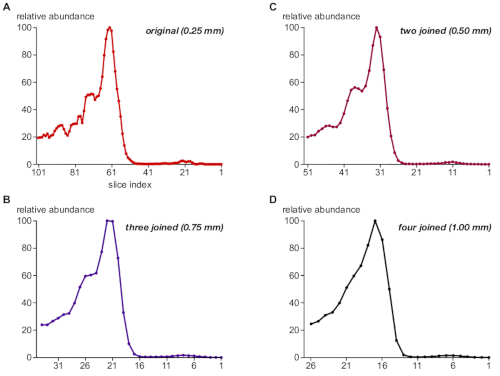
איור 3: ההשפעה הקריטית של גודל השלב בדגימה ג'ל על הרזולוציה complexome של TPC1. ערכות נתונים הצטרפו לסיכום של עוצמות האות בקבוצות של 1, 2, 3 ו-4 פרוסות רצופות (A-D, בהתאמה) ועיבוד זהה כדי לדמות גודלי שלב שונים בחיתוך ג'ל כמצוין. הפרופיל TPC1 מראה כמה (דגימה) רעש ב 0.25 מ"מ, אבל ברזולוציה בגודל טוב של שלוש אוכלוסיות מורכבות (ראה גם איור 1B), אשר נשמר במידה רבה ברוחב צעד 0.5 מ"מ. האפליה של אוכלוסיות אלה הופכת לאבודה כאשר 1 מ"מ מתקרב. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
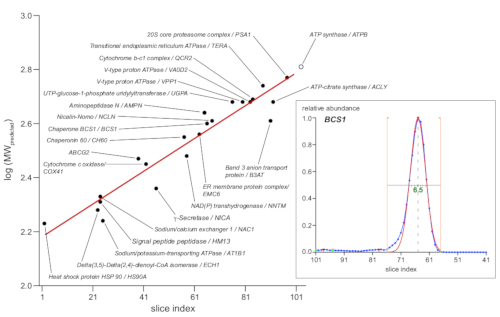
איור 4: קביעת משקל מולקולרי לכאורה. 23 מתחמי סמן עם קומפוזיציה מולקולרית מוגדרת (כפי שמצוין, על פי UniProtKB/שוויצרי-פרוט) שימשו סמנים גודל. ערכים לוגריתמי של המשקולות המולקולריות הצפויות שלהם (ב-kDa) הותוו לעומת את הפרופיל לשיא מרבית אינדקס הפרוסות של יחידת המשנה המצוינת של חלבון מייצג (עיגולים מלאים בשחור). התאמת רגרסיה ליניארית לנתונים אלה (קו אדום) באמצעות פונקציה המרת ערכי אינדקס פרוסות למשקולות מולקולריות לכאורה. שיא מקסימה נקבע על ידי הרכב גאוס מתאים לפסגות פרופיל חלבונים כפי שמוצג הכניסה (מימין) עבור חלבון המלווה BCS1 (הנתונים העיקריים כחול, גבולות להתאים המצוין על ידי קווים כתומים, להתאים את הפונקציה באדום). בנוסף, אלה מתאים לשיא רוחב חצי מקסימלי (קו ירוק, 6.5 פרוסות, או 1.6 מ"מ לדוגמה המוצגת) עם מתחמי המיקוד החדים ביותר המשתרעים סביב ג'ל של 1.5 מ"מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
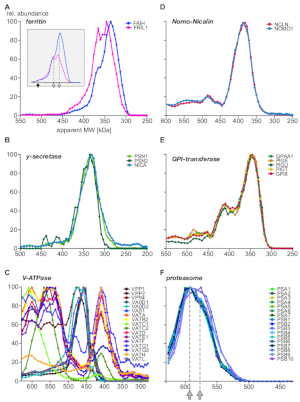
איור 5: דוגמאות לפרופילי משנה מורכבים בחלבון. שפע של חלבון יחסי לעומת משקל מולקולרי לכאורה התווה לשרשרת כבדה וקלה של ferritin (A) חשיפת טרוגניות מולקולרית של ferritin משנה סטולאימטריה, יותר ברור לעין לאחר שינוי קנה מידה של מחולות מחדש (שיבוץ). חץ מלא וחצים פתוחים מציינות את המכלול המלא (440 kDa) ושני מכלולי משנה, בהתאמה. יחידות המשנה של גאמא-הסודי (B) משולבות לאוכלוסיה מורכבת בעלת ליבה אחת. מכלולי המשנה של וולאואר H+-atpases (C) הציגו הרכבות מרובות עם הרכב משנה ברורים, כולם באים לידי ביטוי באנזומים. Nomo1 ו-nicalin חלבונים (D) יצרו מתחם בלעדי (gpi-transamidase), שהיא מכונות אנזימטיות מרובת יחידות היוצרים מספר תסביכים. (ה) מורכבות הליבה של 20 ס מ המציגות (F) תבנית תת-מרכזית עדינה עם שתי אוכלוסיות המסומנות בחיצים באפור, כולן שמקורן בלוקליזציה של מבני משנה אחרים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
המחקר המוצג בנוי על הטכניקה csBN-MS בעבר ספסל עם הכנה מיטוכונדריאלי11 ו משולבים שיפורים הכנה לדוגמה, ג'ל עיבוד, ו-MS נתונים הערכה. ניתוח ממוקד של קטע של הפרדה בקנה מידה גדול ההפרדה BN עמוד סיפק מערכת מקיפה של נתונים המראים מדדים איכותיים הדומים למחקר עם קרומים מיטוכונדריאלי. שגיאות בזמן המסה והשמירה, כמו גם וריאציות הפעלה-להפעלה נשמרו בפרופיל נמוך מאוד וסיפקו את הבסיס לקביעת פרופילי השפע האמינים בחלבון. רזולוציית הגודל הייתה טובה, עם רוחב השיא של חצי המקסימלי נמוך משישה פרוסות (המתאים ל-1.5 מ"מ, איור 4) והבדלי גודל יחסיים של פחות מ-10% שנפתרו (איור 3, איור 5א). ערכים אלה לא לגמרי לענות על איכות רזולוציית הגודל של ניתוח csBN-MS הקודם של המיטו, (למרות גודל הצעד הקטן ג'ל דגימה נבחר), אבל הם טובים יותר באופן משמעותי מאשר הביצועים של המקובלת BN-MS או גודל הדרה MS מתקרב ל-20 שלאחרונה הפכו לפופולריים.
החשיבות של רזולוציה גבוהה מורכבת בגודל מורכב מודגש על ידי ניסוי סימולציה באיור 3 (באמצעות TPC1-הקשורים מתחמי) כי בקושי ניתן לפתור על ידי 2d בסון/sds-עמוד בניתוח כתמי המערבי (איור 1B). תוצאות אלה מראים כי 0.25 mm חיתוך במקרה זה הביא כמה oversampling, אבל זה עדיין הוכיח להיות שימושי עבור חיסול "רעש הקוונפיקציה" מבלי להתפשר על רזולוציה בגודל אפקטיבי. כך, בשורה עם תוצאות קודמות11, גודל שלב דגימה של ~ 0.3 מ"מ בדרך כלל recommendable.
בעיקר, האפליה של מכלולי TPC1-הקשורים הוא איבד לחלוטין עם 1 מ"מ דגימת ג'ל, שהוא גודל הצעד הקטן ביותר המסופק על ידי חיתוך ידני ב בסון-MS קונבנציונלי5,6. זה עשוי להסביר את העובדה כי למרות הטכנולוגיות MS חזק להיות זמין, מאוד מתחמי חלבונים ויחידות משנה זוהו דה נובו על ידי הפרופיל complexome. מלבד הכוח לפתרון טוב שלה, csBN-MS מציע רב-תכליתיות גבוהה. ממברנה מאוגד מתחמי מסיסים חלבון מסיסי החל מ 50 kDa כדי מד א ניתן לפתור ביעילות בניסוי אחד עם הטיה מינימלית11. זה ניגודים עם טכניקות הפרדה חלופית המשמשים ליצירת פרופיל complexome כמו הדרה הוצאה לאור או כרומטוגרפיה החלפת יונים, אשר פועלים עם קבוצות משנה של חלבונים מסיסים עם טווחי גודל מסוימים או מאפייני חיוב. על החיסרון, csBN-MS הוא פחות מדרגי (עומס מרבי של ~ 3 מ ג חלבון לכל ג'ל), יכול להיות מאתגר טכנית, ולא ניתן להיות יצרנית.
בסך הכל, התוצאות להפגין כי מבוסס Csxome פרופילים מבוססי פרופיל ניתן להחיל בהצלחה על מטרות לא מיטוכונדריאלי אלא גם לציין כמה אתגרים הקשורים. לפיכך, הוצאה יעילה ויציבות ביוכימית של מתחמי חלבונים דורשים אופטימיזציה רבה יותר, ומשלבי ניקוי ועדיין עשויים להיות מוגבלים. בתוך החלון הנחקר, מספר מתחמי החלבונים המושווים והמתמקדים היה בהחלט נמוך במידה ניכרת (הנתונים אינם מוצגים) בהשוואה למדגם מיטוכונדריאלי. כמו כן, מומלץ להפחית בהורדת מדגם בסון-עמוד לקבלת הפרדת ג'ל סבירה. טעינות גבוהות יותר עשויות לדרוש נתיבי ג'ל רחבים יותר שקשה יותר לעבד אותם כראוי לחיתוך (ראה וידאו). יתרה מזאת, מורכבות החלבון של הדגימות הייתה גבוהה יותר (בסביבות קיפול לשניים) מאשר מעכל הפרוסות המיטוסטים, המובילים לערכי PV חסרים וטווח דינמי מופחת. למעשה, כמה חלבונים קטנים צפויים להיות חלק מתחמי המוצג באיור 5 חסרים בניתוחים. ניתן לפתור בעיות אלה בעתיד על-ידי שימוש בכלי MS מהירים ורגישים יותר או במצבי רכישה עצמאיים.
הכנת המדגם היא קריטית מאוד לאחזור מורכבות חלבון, יציבות, ואיכות הפרדת ג'ל. פרמטרים ונהלים צריכים להיות ממוטבים עבור כל רקמת מקור, ליפוסט תא, קרום (שבר), ומורכבות חלבון של עניין. ההמלצות הכלליות הבאות מסופקות, העשויות לסייע בהרחבת יישומים של csBN-MS:
(i) הכנת דגימות טריות והימנעות מהתחממות/הקפאה, הפרעות חזקות, שינויים בתנאי האגירה ועיכובים מיותרים;
(ii) שימוש במאגרים שאינם נטולי מלחים (מחליפים ב500-750 אמצעות החומצה הקגית או האמינו), כ-pH נייטרלי, ומכיל עד 1% (w/v) של אבקת ניקוי (חלבון: היחס לחומרי ניקוי בין 1:4-1:10 לפתרון ממברנה מכלולי חלבון, ללא חומרי ניקוי הדרושים למערכות חלבונים מסיסים);
(iii) זהירות בדיקה והסתגלות של מצבי ניקוי על ידי ניתוח בסון-PAGE, מאז אלה עשויים בתוקף להשפיע על יעילות של פתרונות מורכבים, ייצוג של מכלולי חלבון ממברנה במדגם, יציבות, והומוגניות של מיקרולים לניקוי חלבונים בחלבון. האחרון הם הדרישות המוקדמות עבור חלבונים להתמקד כמו להקות שונות/אוכלוסיות מורכבות על בסון-דף ג'לים. הספרות הקודמת מציעה מגוון רחב של חומרי ניקוי ניטרליים. עם זאת, ddm (n-dodecyl β-d-maltoside)1,2,4,5,6 ו הדיגיטלי3,5,7,8, 9,10,13,18 היו הבחירות הפופולריות ביותר עבור ניתוחים בסון-MS עד כה. יש להדגיש כי כל תנאי ניקוי בהכרח מייצג פשרה בין יעילות מסיסות ושימור של אינטראקציות חלבונים לא יכול להיות מתאים באותה מידה לכל סוגי חלבון היעד חומר המקור;
(iv) הסרת פולימרים טעונים כמו fibrils, חוטים, פולילייזין, דנ א, משקל מולקולרי שופע נמוך יותר מרכיבים (כלומר, מטבוליטים, שומנים, או פפטידים). הדבר עשוי להתבצע באמצעות הארכה, סינון ג'ל או דיאליזה. הדבר חשוב במיוחד עבור מספר התאים או הרקמה הכוללת;
(v) הוספת Coomassie G-250 (הריכוז הסופי 0.05%-0.1%) וסוכות (כדי להגביר את צפיפות ההעמסה, הריכוז הסופי 10%-20% [w/v]) למדגם בדיוק לפני הטעינה, כדי לנקות על ידי הפחתת מטען קצר, לטעון את המדגם בלי להזיע, ולהתחיל את הריצה מיד לאחר מכן.
כנקודת מבט עתידית, מבוסס Csxome מבוססת פרופיל מציעה אפשרויות ריבוב כדי ללמוד דינמיקה מורכבת חלבון או שינויים הקשורים לתנאים ביולוגיים ספציפיים. הפרדה משולבת של דגימות metabolically המסומנת כפי שהוצע עבור פרופיל מבוסס על הדרה21 מופיע באופן ישיר, אבל זה עשוי להיות מושפע מחילופי תת-משתמשים ספונטנית במערכות המתרחשות ללא תלות בהפרדה הנמצאת בשימוש שיטה. לחילופין, ניתן לפתור דגימות המסומנת בנתיבי ג'ל שכנים, שניתן לאחר מכן לפרוס במשותף או לשלב את העיכול לניתוח דיפרנציאלי עם רגישות גבוהה וחוסן.
Disclosures
המחבר הינו העובד ובעלי המניות של לוגופארם GmbH המייצרת ComplexioLyte 47 בשימוש במחקר זה. החברה מספקת ComplexioLyte ריאגנטים למוסדות אקדמיים על בסיס ללא כוונת רווח.
Acknowledgements
מחקר זה היה נתמך על ידי הגרמני Forsch, הקרן מחקר (DFG, בסיס המחקר הגרמני) – פרויקט-ID 403222702 – SFB 1381 ותחת אסטרטגיית מצוינות של גרמניה CIBSS-EXC-2189-מזהה הפרויקט 390939984. אנו מודים לקאטג'ה Zappe לקבלת סיוע טכני.
Materials
| Name | Company | Catalog Number | Comments |
| 30% Acrylamide/Bis Solution, 37.5:1 | Bio Rad | #1610158 | Recommended for acrylamide gradient gel solutions up to 13% |
| 30% Acrylamide/Bis Solution, 19:1 | Bio Rad | #1610154 | Recommended for acrylamide gradient gel solutions >13% |
| SYPRO Ruby Protein Blot Stain | Bio Rad | #1703127 | Total protein stain on blot membranes; sensitive and compatible with immunodetection |
| Coomassie Brilliant Blue G-250 | Serva | no. 35050 | Centrifugate stock solutions prior to use |
| ComplexioLyte 47 | Logopharm | CL-47-01 | Ready-to-use detergent buffer (1%) for mild solubilization of membrane proteins |
| Embedding Medium / Tissue Freezing Medium | Leica Biosystems | 14020108926 | Embedding medium for gel sections to be sliced by a cryo-microtome |
| Immobilon-P Membrane, PVDF, 0,45 µm | Merck | IPVH00010 | |
| ECL Prime Western Blotting Detection Reagent | GE Healthcare | RPN2232 | |
| Plastic syringe with rubber stopper, 20-30 ml | n.a. | n.a. | any supplier, important for making gel section embedding tool |
| broad razor blade | n.a. | n.a. | any supplier, for BN-PAGE gel trimming / excision of lanes |
| metal tube / cylinder, ca. 4 cm long | n.a. | n.a. | mold for embedding and freezing of gel samples |
| Protein LoBind Tubes, 1.5 ml | Eppendorf | Nr. 0030108116 | highly recommended to minimize protein/peptide loss due to absorption |
| sequencing-grade modified trypsin | Promega | V5111 | |
| C18 PepMap100 precolumn, particle size 5 µm | Dionex / Thermo Scientific | P/N 160454 | |
| PicoTip emitter (i.d. 75 µm; tip 8 µm) | New Objective | FS360-75-8 | |
| ReproSil-Pur 120 ODS-3 (C18, 3 µm) | Dr. Maisch GmbH | r13.93. | columns packed manually |
| rabbit anti-TPC1 antibody | Gramsch Laboratories | custom production | described in Castonguay, et al., 2017 (Reference 12) |
| Cy3-biotinylated goat anti-rabbit IgG | Vector Laboratories | CY-1300 | described in Castonguay, et al., 2017 (Reference 12) |
| biotinylated Lotus tetragonolobus lectin, FITC-conjugated | Vector Laboratories | #B1325 | described in Castonguay, et al., 2017 (Reference 12) |
| cryo-microtome Leica CM1950 | Leica Biosystems | 14047743905 | |
| Mini Protean II Cell with wetblot unit | Bio Rad | n.a. | for SDS-PAGE and Westernblot (not sold any more) |
| Penguin Midi Gel Electrophoresis System | PeqLab | n.a. | for BN-PAGE (not sold any more) |
| Zeiss Axiovert 200 M microscope + Photometrics Coolsnap 2 digital camera | Zeiss / Photometrics | n.a. | |
| peristaltic pump (IP high precision multichannel) | Ismatec | ISM940 | for casting of gradient polyacrylamide gels |
| gradient mixer with stirring (two chambers) | selfmade, alternatively Bio Rad | 1652000 or 1652001 | for casting of gradient polyacrylamide gels, manual provides instructions to cast linear or hyperbolic gradient gels (http://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1652000.pdf) |
| ultracentrifuge Sorvall M120 with S80 AT3 rotor | Sorvall / Thermo Scientific | n.a. | for sample preparation (not sold any more) |
| UltiMate 3000 RSLCnano HPLC | Dionex / Thermo Scientific | ULTIM3000RSLCNANO | |
| Orbitrap Elite mass spectrometer | Thermo Scientific | IQLAAEGAAPFADBMAZQ |
References
- Majeran, W., et al. Consequences of C4 Differentiation for Chloroplast Membrane Proteomes in Maize Mesophyll and Bundle Sheath Cells. Molecular & Cellular Proteomics. 7, 1609-1638 (2008).
- Wessels, H. J., et al. LC-MS/MS as an alternative for SDS-PAGE in blue native analysis of protein complexes. Proteomics. 9 (17), 4221-4228 (2009).
- Heide, H., et al. Complexome profiling identifies TMEM126B as a component of the mitochondrial complex I assembly complex. Cell Metabolism. 16 (4), 538-549 (2012).
- Wessels, H. J., et al. Analysis of 953 human proteins from a mitochondrial HEK293 fraction by complexome profiling. PLoS ONE. 8 (7), e68340 (2013).
- Wöhlbrand, L., et al. Analysis of membrane-protein complexes of the marine sulfate reducer Desulfobacula toluolica Tol2 by 1D blue native-PAGE complexome profiling and 2D blue native-/SDS-PAGE. Proteomics. 16 (6), 973-988 (2016).
- Takabayashi, A., et al. PCoM-DB Update: A Protein Co-Migration Database for Photosynthetic Organisms. Plant and Cell Physiology. 58 (1), e10 (2017).
- Senkler, J., et al. The mitochondrial complexome of Arabidopsis thaliana. The Plant Journal. 89 (6), 1079-1092 (2017).
- de Almeida, N. M., et al. Membrane-bound electron transport systems of an anammox bacterium: A complexome analysis. Biochimica et Biophysica Acta. 1857 (10), 1694-1704 (2016).
- Anand, R., Strecker, V., Urbach, J., Wittig, I., Reichert, A. S. Mic13 Is Essential for Formation of Crista Junctions in Mammalian Cells. PLoS ONE. 11 (8), e0160258 (2016).
- Eydt, K., Davies, K. M., Behrendt, C., Wittig, I., Reichert, A. S. Cristae architecture is determined by an interplay of the MICOS complex and the F1FO ATP synthase via Mic27 and Mic10. Microbial Cell. 4 (8), 259-272 (2017).
- Müller, C. S., et al. Cryoslicing Blue Native-Mass Spectrometry (csBN-MS), a Novel Technology for High Resolution Complexome Profiling. Molecular & Cellular Proteomics. 15 (2), 669-681 (2016).
- Castonguay, J., et al. The two-pore channel TPC1 is required for efficient protein processing through early and recycling endosomes. Scientific Reports. 7 (1), 10038 (2017).
- Schägger, H., Pfeiffer, K. Supercomplexes in the respiratory chains of yeast and mammalian mitochondria. The EMBO Journal. 19 (8), 1777-1783 (2000).
- Banyard, S. H., Stammers, D. K., Harrison, P. M. Electron density map of apoferritin at 2.8-A resolution. Nature. 271 (5642), 282-284 (1978).
- Dettmer, U., et al. Transmembrane protein 147 (TMEM147) is a novel component of the Nicalin-NOMO protein complex. The Journal of Biological Chemistry. 285 (34), 26174-26181 (2010).
- Kimberly, W. T., et al. Gamma-secretase is a membrane protein complex comprised of presenilin, nicastrin Aph-1, and Pen-2. Proceedings of the National Academy of Sciences of the United States of America. 100 (11), 6382-6387 (2003).
- Hong, Y., et al. Human PIG-U and yeast Cdc91p are the fifth subunit of GPI transamidase that attaches GPI-anchors to proteins. Molecular Biology of the Cell. 14 (5), 1780-1789 (2003).
- Van Damme, T., et al. Mutations in ATP6V1E1 or ATP6V1A Cause Autosomal-Recessive Cutis Laxa. The American Journal of Human Genetics. 100 (2), 216-227 (2017).
- Budenholzer, L., Cheng, C. L., Li, Y., Hochstrasser, M. Proteasome Structure and Assembly. Journal of Molecular Biology. 429 (22), 3500-3524 (2017).
- Heusel, M., et al. Complex-centric proteome profiling by SEC-SWATH-MS. Molecular Systems Biology. 15 (1), e8438 (2019).
- Kristensen, A. R., Gsponer, J., Forster, L. J. A high-throughput approach for measuring temporal changes in the interactome. Nature Methods. 9 (9), 907-919 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved