Method Article
通过低温BN-MS分析进行高分辨率复杂分析
摘要
提出了一种使用微体体进行多功能冷冻BN-MS协议,用于高分辨率复杂体分析。
摘要
蛋白质通常通过与其他蛋白质的相互作用发挥生物功能,无论是在动态蛋白质组装中,还是作为稳定形成的复合物的一部分。后者可以通过原生聚丙烯酰胺凝胶电泳(BN-PAGE)的分子大小优雅地解决。这种分离与敏感质谱(BN-MS)的耦合已经确立,理论上可以详尽地评估生物样品中的可萃取复合体。但是,这种方法相当费力,并且提供了有限的复杂大小分辨率和灵敏度。此外,其应用仍然局限于丰富的线粒体和板体蛋白。因此,对于大多数蛋白质,仍然缺乏关于与稳定蛋白质复合物整合的信息。这里介绍了一种复杂体分析的优化方法,包括预置量级 BN-PAGE 分离、通过低温显微切片对宽凝胶通道进行亚毫米采样,以及无标签蛋白质定量的质谱分析。详细介绍了关键步骤的步骤和工具。作为一项应用,报告描述了小鼠肾脏中溶解内膜富集膜分数的复杂研究,共分析了2,545种蛋白质。结果表明,识别了均匀、低丰度膜蛋白,如细胞内电子通道以及高分辨率、复杂的蛋白质组装模式,包括糖基化异形。结果与独立的生化分析一致。总之,该方法允许全面和无偏见地识别蛋白质(超级)复合物及其亚单位组合物,为研究任何蛋白质复合物的化学计量、组装和相互作用动力学提供了基础。生物系统。
引言
BN-PAGE分离首先由Majeran1和Wesels2研究小组使用BN-PAGE凝胶通道的手动切片直接耦合到LC-MS分析(BN-MS)。他们的分析分别从植物板菌和HEK细胞线粒体中发现了一些具有已知亚单位成分的丰度膜蛋白复合物。然而,这些分析远非全面,无法公正地识别新装配体。自那时以来,质谱仪和无标签定量方法的性能有了很大的提高,从而实现了全面的 BN-MS 分析。这创造了"复杂分析"一词。例如,海德和同事分析了大鼠心脏线粒体识别和聚类464线粒体蛋白,从而证实了许多已知的组件。此外,他们发现TMEM126B是特定装配综合体3的新颖而关键的子单元。在HEK细胞线粒体4的平行研究中获得了可比结果(437线粒体蛋白谱)。
尽管取得了这些改进,但仍然存在一些问题,限制了 BN-MS 在复杂分析方面的全部潜力。一个主要限制是由两个因素决定的复合物的有效尺寸分辨率:(i) BN-PAGE分离的质量,取决于凝胶基孔梯度的均匀性以及样品复合物的稳定性/溶解度,和 (ii) 凝胶采样的步长大小,在使用常规手动切片时最多为 1 mm,使用常规手动切片5、6。不良尺寸分辨率不仅忽略了细微的复杂异构和异构性,而且对无偏、非新子单元分配和量化的动态范围和信心也产生了负面影响。
其他挑战包括蛋白质定量的精确性,以及通过质谱分析覆盖样品中蛋白质丰度的实际动态范围。因此,BN-MS复合体分析的应用基本上仍然局限于复杂性低、目标复合物表达高、溶解性能好的生物样品(即,石膏、线粒体和微生物)6,7,8,9,10。
我们最近推出了低温显微切片辅助 BN-MS (csBN-MS),它将 BN-PAGE 凝胶通道的精确亚毫米采样与全面的 MS 分析和精细的 MS 数据处理相结合,用于测定高蛋白型信心11.从大鼠大脑中的线粒体膜制备中的应用表明,以前未满足的有效复杂尺寸分辨率和氧化呼吸链复合物(OXPHOS)亚单位的最大覆盖范围(即90 MS可访问性90)。此示例还确定了一些新型蛋白质组件。
这里描述的是蛋白质复合物的维持性规模BN-PAGE分离(不限于特定的生物源)、大型预相BN-PAGE凝胶的铸造、宽凝胶通道的低温显微切片和MS数据的优化程序处理。对小鼠肾内膜富集膜的蛋白质复杂制剂的性能进行了演示。最后,讨论了提高质谱定量分辨率和精度的好处。
研究方案
1. 准备性 BN-PAGE
- 凝胶制备
- 使用中到大型垂直凝胶电泳系统(>10 cm 凝胶分离距离;14 厘米 x 11 厘米,1.5 mm 间隔),有效冷却设置为 10°C。
- 使用由泵驱动的搅拌双室梯度混合器(参见材料和试剂表)铸造线性或双曲孔梯度凝胶(1.5-3.0 mm 垫片)。在所展示的示例中(线性梯度凝胶 1%-13%):
- 为前(混合)室制备13 mL溶液,包括:13%丙烯酰胺(来自30%库存溶液,37.5:1.0丙烯酰胺:二环酰胺),0.75 M氨基丙酸,50 mM Bis-Tris(pH = 7.0)和10%甘油。
- 为储层室制备10 mL溶液,包括:1%丙烯酰胺(来自30%库存溶液,37.5:1.0丙烯酰胺:双环酰胺),0.75 M氨基丙酸,50 mM Bis-Tris(pH = 7.0)和0.2%CL-47洗涤剂。
- 启动搅拌器,在前室溶液中加入 30 微升的 APS(过氧硫酸铵、10% 库存溶液)和 2.5 μL 的 TEMED(N、N、N'、N'-四甲基乙烯二胺)和 2.5 微升 TEMED。启动泵并打开前阀(流量应在 10 分钟内调整到完成铸造)。1分钟后,在储液罐室中向溶液中加入90 μL的APS和5μL的TEMED,并打开腔室连接。
- 在室温 (RT) 下,让凝胶缓慢而彻底地聚合至少 24 小时,从而产生均匀的孔径梯度。保持湿润时,聚合凝胶可直立在4°C下储存长达1周。
注:有意,凝胶的顶部将具有柔软/粘稠的一致性。这将稍后被移除,但允许蛋白质顺利进入凝胶,蛋白质沉淀的风险最小,否则可能导致迁移工件(即条纹或蛋白质沉淀)。
- 样品制备和装载
- 通过在玻璃板之间插入适当的垫片(例如硅管)来分离 0.5-2.0 mg 的蛋白质,准备装载槽。插槽应至少制作3厘米宽(或更好,5-6厘米宽)。
- 在含有1%(w/v)非变性洗涤剂(复合性CL-47)的2mL溶解液中溶解+2.5mg膜(小鼠肾内膜富集制剂),在冰上30分钟。超正敏电阻(沉淀截止=200 S或更少;此处使用130,000 x g/11分钟)。
- 通过超离心在400,000 x g下通过超离心1小时,将溶解液浓缩在短的50%/20%(w/v,每根0.3ml)蔗糖步梯度上。最终的蛋白质产量应至少为1毫克。
- 在溶解物中加入 0.05%(w/v) Coomassie G-250,并将样品加载到凝胶上。将蛋白质负载限制在 10-15 μg/mm2凝胶通道横截面,以获得高分辨率并避免蛋白质沉淀产生的伪影。
- BN-PAGE 运行条件
- 对于运行缓冲液,准备一个标准阴极缓冲液,包括 50 mM 三元肌、15 mM 比斯-特里斯和 0.01% Coomassie G-250。准备由 50 mM Bis-Tris (pH = 7.0) 组成的标准阳极缓冲液。
- 使用三步电压协议13在 10°C 运行预置 BN-PAGE,其组成包括:在 100 V 下,平衡相30分钟,然后缓慢(3小时)斜坡到最大电压(40-50 V/cm 凝胶长度),最终维持至少 6 小时蛋白质的端点聚焦。
注:建议在迁移前到达凝胶中间时暂停电泳,并在没有Coomassie G250的情况下将阴极缓冲液更换为新鲜缓冲液。这有助于避免因基质孔结构局部坍塌而导致凝胶中的沉淀伪影。
2. 凝胶取样和消化
- 凝胶通道的切口
- 运行后,扫描凝胶以进行记录,同时将其放在玻璃板之间。
- 拆开板并切除感兴趣的车道部分。
- 以2D BN/SDS-PAGE和蛋白质染色或西方印迹(如图1B所示)分析车道的样本条,以确定感兴趣的区域、有效的复杂尺寸分辨率和蛋白质丰度。
- 用 30% (v/v) 乙醇和 15% (v/v) 醋酸修复选定的凝胶通道两次,至少 30 分钟。
- 将样品转移到嵌入介质,使其在4°C下浸泡和平衡至少2小时,同时在轨道摇摇器上保持凝胶板的慢动作。
注:应仔细检查凝胶分离的整体分离质量和迁移伪影。代表显性蛋白质的凝胶带应无失真,强度均匀。凝胶上的局部伪影应切除或遗漏分析。
- 嵌入和低温缩微切片
注:这是前面描述和照片记录的嵌入过程的改进版本,允许嵌入和切片范围更宽的凝胶通道高达8厘米11。- 首先,将固定凝胶通道切成部分(此处为 3 厘米),与蛋白质迁移前/波段模式完全平行。为便于操作,将每个部分放在尺寸相等的塑料薄膜支架上。
- 将车道转移到带塞子的开放式管中(底部封闭,顶部中央穿孔,与凝胶部分的上端和下端精确对齐)。
- 将气缸短暂浸入液氮中,以快速启动凝固。透明嵌入介质在几秒钟内凝固,变成白色。
- 用嵌入介质填充腔,将其短暂浸入液氮中,并将气缸在-20°C冷冻数小时。
注:将气缸浸入液氮中快速冷却,有助于避免管内凝胶板位移。应避免失真,以确保在以下 MS 分析中实现高分辨率。 - 拆卸后,取出塑料薄膜,将嵌入凝胶部分的块转移到一个冷却的、直径更大的金属圆柱体上,金属圆柱体放置在平坦的支架上(即培养皿),并在气缸外侧用嵌入介质密封。用嵌入介质填充气缸并彻底冻结。
- 对圆柱体的另一侧重复此步骤,以获得具有共平面表面的实心块。
- 从气缸中取出块,用嵌入介质将其粘附在预冷却的金属支架上,然后将支架插入冷冻机(冷冻体)。块的表面必须相对于切片平面仔细对齐。允许它在切片过程的最佳温度下进行平衡(此处为 -15 °C)。
注:使用 0.1 mm 步长大小的缓慢手动切片循环,直到击中嵌入凝胶部分的表面,以确保正确定位。 - 收获凝胶切片一个接一个,最终所需厚度为0.25毫米步长,并分别转移到具有低蛋白质结合特性的反应管中。
注:在此设置中,均匀的凝胶片可轻易获得薄至0.1毫米,厚达0.5毫米。
- 胰皮消化
- 在广泛清洗凝胶片后进行凝胶内胰胶消化(建议至少再进行三轮洗涤以去除嵌入介质的聚合物成分),遵循标准程序11。
- 真空干燥洗脱肽,在37°C(10分钟)下摇动,然后沐浴声波(5分钟)和短暂离心,在0.5%(v/v)三氟乙酸中重新溶解。
3. 质谱法
- 纳米HPLC和MS设置
- 使用(无分裂)纳米HPLC与高分辨率的质谱仪耦合,将消化样品加载到C18预柱上(颗粒大小 =5 μm;直径=300μm),使用0.05%(v/v)三氟乙酸。
- 具有水性有机梯度的 Elute 捕获肽(eluent A):5 分钟 3% B,120 分钟从 3% B 到 30% B,20 分钟从 30% B 到 99% B,5 分钟从 99% B 到 3% B,5 分钟从 99% B 到 3% B,15 分钟 3% B(流速 = 300 nL/min)。
注:csBN-MS凝胶切片通常会导致样品具有低至中间肽丰度且复杂程度有限。因此,纳米LC-MS/MS分析应采用提供合理灵敏度和测序速度、高质量分辨率(>100,000)和最大动态范围(有效为3-4个数量级)的设置。但是,它不需要长柱尺寸或洗脱梯度超过 3 小时。 - 在发射器中分离洗脱肽(即 75 μm;尖端 = 8 μm)使用 C18 材料手动包装约 20 厘米(颗粒大小 = 3 μm)。以2.3 kV(正电模式)将样品电喷到质谱仪的加热转移毛细管(250°C) 中。
- 使用以下仪器设置11执行分析:最大 MS/MS 注射时间 = 400 ms;排除持续时间 = 60 s;最小信号阈值 = 5,000 计数,前 10 个前体碎片化;隔离宽度 = 1.0 m/z)。
注:为了便于校准大量数据集或测量中的质量、保留时间和肽信号分配,建议在参数和硬件不中断或更改的情况下执行相应的 MS 测量系列(即,在同一 C18 柱/发射器上)。
- 蛋白质识别(MS数据,如前11所述)
- 使用"msconvert.exe"工具(ProteoWizard的一部分)从片段子光谱中提取峰列表。
- 在具有 50 ppm 肽质量容差的初步数据库搜索中,通过分配给蛋白质的所有肽的中值 m/z 值移动每个数据集的所有前体 m/z 值。
- 使用合适的搜索引擎(此处,Mascot 2.6.2)搜索更正的峰值列表,以查找 UniProtKB/Swiss-Prot 数据库的所有鼠标条目(版本 2018_11)。
- 选择"乙酰(蛋白N-术语)","卡巴多甲基(C)","Gln |热胶胶 (N-术语 Q), 格鲁 |热胶-Glu(N-术语E)","氧化(M)"和"丙胺(C)"作为可变修饰。
- 将肽和片段质量容差分别设置为 ± 5 ppm 和 ± 0.8 Da,并允许一个缺失的胰蛋白裂解。将肽识别的预期值截止值设置为 0.5 或更少。使用诱饵数据库搜索确定误报发现率 (FDR)。将 FDR 设置为 1% 或应用其他质量标准以确保可靠的识别。
注:提出的实验确定了3,500多个蛋白质,平均肽FDR为4.4 ± 0.77%(n = 101片样品),或当肽FDR设置为1%时,3,000个蛋白质。重要的是,在选择轮廓蛋白时使用了更严格的标准(2,568)。它包括所有被识别为至少两个肽的蛋白质,其中至少有一个是蛋白质特异性,在101片样本中至少一个。
- 蛋白质定量
- 使用肽信号强度(峰值体积 [PV])进行蛋白质定量,从 FT 全扫描中获得,并使用适当的软件校正保留时间和质量偏移(此处为 MaxQuant v1.6.3)。
- 使用 LOESS 回归逐个对齐 MS 数据集,以引用(总平均)肽洗脱时间。直接(基于MS/MS的识别)或间接(即,根据其匹配的m/z和洗脱时间在非常狭窄的容差内)将PV分配给肽。
注:此协议使用内部软件分配"插入"称为肽。设置参数可产生有效的 m/z 和洗脱时间匹配公差分别为 ± 2 ppm 和 ± 1 分钟(参见图 2A,B)。 - 通过根据相邻切片样本之间相对肽强度的中位差计算,通过肽强度重新缩放计算出肽载荷和电离效率的系统运行变化,请正确进行校正(图2C)。
- 筛选由内部 PV 一致性分析识别的异常值和剩余误报分配的 PV 数据。
- 在产生相对肽丰度曲线的所有切片数据集上,将每个肽的 PV 标准化为其最大值。
- 最后,将相对蛋白质丰度曲线计算为三个连续切片窗口上最佳相关肽型材的至少两个平均值(最多六或五十%,以较大值为准)。这允许桥接缺失的PV值并降低噪声。
注:这最终导致2,545(2,568个预选)蛋白质谱(图2D)。
- 蛋白质复合物的特性
- 首先使用局部最大值方法执行峰值检测来分析蛋白质曲线,并连续将正态分布拟合到这些峰值,从而生成其最大值和 FWHM 的位置(即切片索引或表面复杂大小)(全宽度在半最大强度值(图 4的内影 )。
注: 在数据集中,使用自定义脚本自动分析配置文件。最小的 FWHM 值表示方法的有效尺寸分辨率(此处为 6 x 0.25 = 1.5 mm)。 - 使用具有定义分子质量的参考蛋白质复合峰(如 UniProtKB/Swiss-Prot 数据库中报告)对 log10(预测分子质量)值进行线性回归分析,将切片数指数转换为表观分子大小(即克达中明显复杂的尺寸)。
注:本研究(图4)根据(i)轮廓峰的单分散形状、(ii)分子量的实验支持和(iii)沿研究的BN-PAGE凝胶部分分布,选取了样本中的23个标记复合物(图4)。
- 首先使用局部最大值方法执行峰值检测来分析蛋白质曲线,并连续将正态分布拟合到这些峰值,从而生成其最大值和 FWHM 的位置(即切片索引或表面复杂大小)(全宽度在半最大强度值(图 4的内影 )。
结果
绝大多数传统的BN-MS研究以及最近建立的高分辨率csBN-MS方法已应用于线粒体和成体制剂,这些制剂(一)随时可用,(二)复杂性有限,(三)表达高密度的目标(膜)蛋白质复合物。该协议将高分辨率复合体分析的应用扩展到表达低富蛋白的非线粒体膜,关于它们与复合物的整合信息很少。为了演示目的,我们从小鼠肾脏中选择了密度梯度离心获得的内体富集膜制备。
这种制剂的优化一直由标记蛋白TPC1指导,它形成细胞内离子通道,主要本地化为早期和回收内体12。它也在肾脏近端管状细胞中高度表达,如肾组织部分的免疫组织化学分析所示(图1A)。这些膜被轻轻溶解(在低蛋白下复合47:1:8),并通过超离心浓缩集中在蔗糖垫上。后者是去除多余的低分子量成分(即洗涤剂、脂质、盐、有机聚合物和代谢物)的重要一步,这些成分往往对预置BN-PAGE分离的分辨率产生负面影响。
原生1%-13%(w/v)聚丙烯酰胺梯度凝胶(图1B,中间面板)的复杂分离显示具有极少迁移伪影的强染色蛋白带。SDS-PAGE 分离一个狭窄的 BN-PAGE 凝胶条(图 1B,框架装成红色)作为第二维,其次是西方污点分析显示,不同 TPC1 相关复杂人群的解算模式(图 1B上面板,用红色箭头标记,很可能是由于与附加蛋白质亚单位和/或翻译后修饰(如糖基化12)的关联。3厘米的兴趣部分被切除,固定,并处理低温显微切片,如描述11。随附的视频中记录了本程序的各个步骤(特别是宽凝胶部分的精确对齐),这对于在采样过程中保持分辨率至关重要。嵌入式凝胶部分最终被切成101个凝胶片,均匀厚度为0.25 mm(图1B,下面板),通过高性能LC耦合质谱法分别消化和分析。
除了尺寸分辨率外,蛋白质定量的质量也是成功进行复杂体分析的关键。使用MS设置和设置后,对样品的分析相当全面,平均每片共发现1000多个蛋白质和10,000个肽(其中8,200个是蛋白质特异性),以及大约3,000个蛋白质和43,000个肽(其中38,500是蛋白质特异性)的总和。然而,由于数据依赖性MS/MS测序的随机性质及其在动态范围上的局限性,对于不太丰富的蛋白质,强度信息仍然是零碎的。因此,基于整个数据集系列中肽信号的精确分配(峰值体积 [PV] = 与肽相关的信号强度,通过 m/z 和时间集成),执行了详细的 MS 数据处理过程11。
如图2A,B所示,对于 MS 序列和间接分配的 PV,在质量和保留时间中,肽信号的偏差是相同的(对于 95% 的PV),表明误报PV分配的比率非常低。根据剩余异常值与其他相关 PV 的一致性对其进行筛选。由于所有 MS 测量都在同一 LC-MS 设置上连续执行,且参数或硬件组件没有变化,因此运行到运行的变化(确定为样本中相对于相邻切片中所有 PV 强度的中位数)通过重新缩放 PV 数据集(图 2C) 小而容易消除。由此产生的肽强度信息然后用于重建2,545蛋白质相对丰度曲线。如图2D所示,超过75%的蛋白质谱基于至少三个独立的蛋白质特异性肽。
接下来,该协议评估了BN-PAGE凝胶采样的步长大小对蛋白质复合物的解析的相关性。为此,通过从两个、三个或四个连续切片中求和 PV 信息来联接切片数据集,从而模拟步长大小为 0.5 mm、0.75 mm 和 1 mm 的结果(与 0.25 mm 的原始采样相比)。图3以A-D为例说明了蛋白质TPC1的丰度谱。在 0 . 25 毫米时, TPC1 相关复群的相对强度和大小分离(图 3A )与西方污点分析的结果(图 1B ,上面板)完全一致 ;但是,配置文件显示一些噪声,这主要是由于用于量化的 PV 矩阵中缺少值("间隙")。
两个切片的联接对应于0.5 mm,保持了TPC1相关复合物的正确强度和分离,并消除了量化噪声(图3B)。相比之下,0.75 mm 和 1 mm 的较大步长(图 3C,D)导致尺寸分辨率损失,并消除了对 TPC1 复杂亚种群的歧视。需要注意的是,绝大多数已发表的传统BN-MS分析使用手动切割2毫米片(约60片覆盖整个凝胶通道)7,8,9,10。
迁移距离或切片指数转换为分子大小通常基于标记,无论是市售的本地标准蛋白,还是具有已知亚单位组合物的具有良好特征的内源性蛋白质复合物(大多数[超级]线粒体氧化呼吸链的复合物[OXPHOS])13。然而,由于BN-PAGE分离基于有效的分子横截面,不仅由分子质量决定,而且由3D结构和相关脂质、洗涤剂和Coomassie分子的数量决定,因此单个蛋白质可能显示较大的偏差。因此,它选择使用较大的蛋白质复合物集作为标记11。图 4中的图显示了 23 个选定的标记,其中代表的子单位显示为黑色圆圈,指示其预测分子质量的 log10 值(根据 UniProtKB/Swiss-Prot 数据库)与。相应轮廓峰值最大值的切片索引。后者是从自动化高斯拟合到相对丰度数据中获得的,如图4的内影所示,显示了与伴郎BCS1一起的例子。线性回归(红线)提供了一个函数,用于将切片指数值转换为表观分子大小,其范围为 160-630 kDa,沿研究的凝胶部分。
最后,分析提供了特征良好的复合物,并论证了新型亚单位和复杂组件的存在。图5(A-C:表达或优选位于内生腔中的蛋白质;以及优异物体体的不同方面所示;D-F:来自其他亚细胞定位的复合物)。铁运输蛋白铁蛋白铁蛋白已知由24轻(FRIL1)和/或重(FRIH)亚单位形成复合物,总分子量为440 kDa14(图5A,填充箭头)。亚单元轮廓(图5A)表明,该复合物至少存在两种较小形式(其表面质量为360 kDa和340 kDa;开式箭头),具有明显的重/轻链链状(重新缩放后更好可见。丰度,图5A的内联体中大量存在的丰度。
相比之下,尼西林-诺莫1复合物15(图5D),伽马分泌酶核心复合物16(图5B),GPI-转氨酶机械17(图5E)显示固定其核心亚单位的丰度比在整个大小范围内,独立于与其他蛋白质关联。这表明其子单元彼此独占。VacuolarH +-ATPass 是多蛋白复合物,以模块化方式从 20 多个亚单位池中组装而成,总分子量约为 900 kDa。图5C显示了至少17个亚单位的具有不同成分的亚复合物,这些亚复合物要么代表由实验条件产生的生物(分离)装配中间体,要么代表亚复合物,其中一些也具有在最近的BN-MS研究中观察到18。另一个多蛋白复合体的例子是蛋白酶体19(图5F)。仔细观察形成 20S 蛋白酶体核心的α和β亚单位的丰度剖面表明,两个主要复群在大小( 590 kDa 和 575 kDa ,以灰色箭头表示)和三个β亚单位的整合方面存在细微差异。
总之,内体富集肾膜的csBN-MS复合体分析提供了关于(i) 均匀、低丰度靶蛋白与复合物的整合,(二) 一般复杂亚单位组合和化学计量学和(iii)复杂异质性、亚结构和(分离)装配中间体。

图1:使用细胞内通道TPC1作为标记,从小鼠肾脏分离溶解内膜富集膜。(A) 通过共聚焦显微镜将TPC1蛋白在肾近端小管中的免疫组织化学定位。绿色:抗TPC1抗体12染色,用次生Cy3-生物氨酸山羊抗兔IgG显示;红色:生物素化莲花四溴二体素(LTL,10μg/mL,FITC-结合),标记近端管状细胞的亮度表面。内印显示TPC1-KO肾脏相应部分的染色作为阴性对照。白色刻度条为 20 μm。还值得注意的是强TPC1表达在细胞内囊泡,从独立实验已知代表早期和回收内质体12。(B) 在1%-13%(w/v)聚丙烯酰胺梯度凝胶上分离2.5mg溶解内体富集膜的先量BN-PAGE。为后续的 SDS-PAGE/西斑分析(上面板)切割了一条狭窄的通道(以红色框框),解决了不同的 TPC1 相关复合物和糖基化模式(红色箭头:抗 TPC1/防兔子 HRP/ECL 质数;绿色:位置和预测由总蛋白染色 [SYPRO Ruby 印迹染色] 识别的标记蛋白复合物的质量 [MDa]) 的印迹。从右到左: Na+/K=- 运输 ATPase, 细胞色素 b-c1 复合二聚体, ATP 合成酶, NADH: ubiquinone 氧化还原酶.从凝胶通道的3厘米的兴趣部分被切除,嵌入在组织嵌入介质中,安装,并切片成101部分沿蛋白质迁移前使用低温显素(下面板;见视频链接)。请点击此处查看此图的较大版本。

图2:确定MS信号赋值和定量精度以及分析深度的关键参数。(A) 在 MS/MS 序列(红条)进行 m/z 校准后相对质量误差(ppm)的分布,并间接分配(即,基于紧密匹配质量和保留时间,参见协议;蓝色条)肽信号。这表明最终质量误差为 <1 ppm(对于 95% 的信号/分配的 PV)和极低的误报分配率。(B) 使用黄土回归(参见协议)和颜色编码(A)中所使用的黄土回归(参见协议)和颜色编码,将纳米-HPLC保留时间与肽信号洗脱时间对齐后的总平均值的分布。对于大于 95% 的肽信号/分配的 PV,时间误差小于 30 s。这些比例因子应用于原始光伏表,以尽量减少系统技术误差。(D) 用于计算蛋白质相对丰度曲线的肽信息.在对异常值、评分差或单一识别(参见协议)过滤蛋白质特异性肽后,确定了2,545个蛋白质丰度谱,其中>75%基于至少三种具有合理信心的肽。请点击此处查看此图的较大版本。
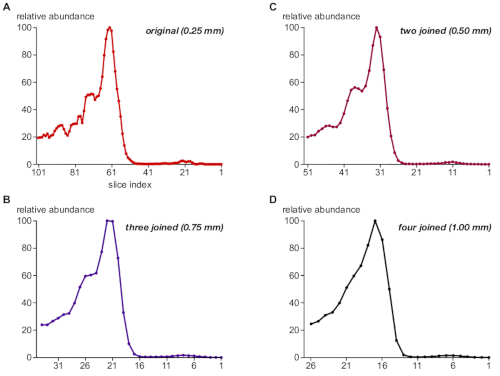
图3:凝胶采样中步长大小对TPC1复杂体分辨率的临界影响。数据集通过将1、2、3和4个连续切片(分别为A-D)组的信号强度求和,并进行相同处理,以模拟凝胶切片中不同的步长大小。TPC1 轮廓显示一些(过采样)噪声在0.25毫米,但良好的大小分辨率的三个复杂的种群(另见图1B),这在很大程度上保留在0.5毫米步宽。随着1毫米的临近,对这些人群的歧视就会消失。请点击此处查看此图的较大版本。
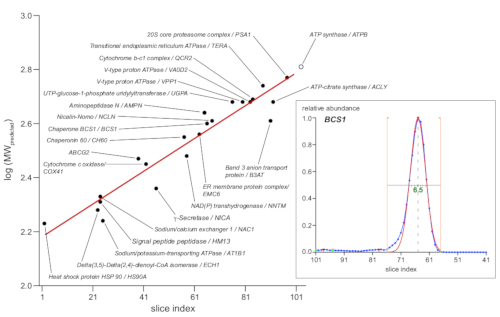
图4:确定表观分子量。23个标记复合物与定义的分子组成(如指示,根据UniProtKB/Swiss-Prot)被用作大小标记。绘制了预期分子量(以 kDa 表示)的对数值。指示的代表性蛋白质亚单位的轮廓峰值最大切片指数(黑色填充圆圈)。与这些数据(红线)的线性回归拟合提供了一个函数,将切片索引值转换为表观分子权重。峰值最大值由自动高斯拟合到蛋白质轮廓峰确定,如恰人均酮蛋白 BCS1 的内联(右)所示(蓝色主要数据,橙色线条指示的拟合边界,红色拟合功能)。此外,这些适合确定的峰值半最大宽度(绿线,6.5 切片,或 1.6 毫米的例子所示)与最锋利的聚焦复合物跨越围绕 1.5 毫米凝胶。请点击此处查看此图的较大版本。
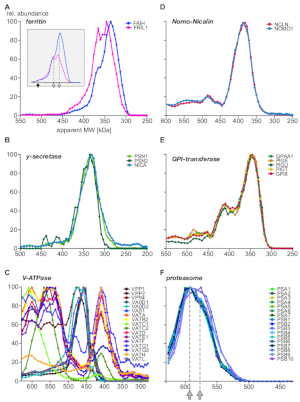
图5:蛋白质复合亚单位谱例。相对蛋白质丰度与。为铁蛋白的重链和轻链绘制的表位分子量(A),揭示铁蛋白亚基质的分子异质性,在重缩放丰度(内分)后更加明显。填充箭头和打开箭头分别表示完整的复合体(440 kDa)和两个子复合体。伽马 - 分泌酶(B)亚单位定量地集成到单核复群中 .真空H+-ATPass(C)的亚复合体表现出具有不同亚单位成分的多个组件,所有组件均以内体表示。诺莫1蛋白和尼卡林蛋白(D)形成一种排他性复合物(GPI-转氨酶),这是一种多亚单位酶机制,形成多个复合物。(E) 20S蛋白酶体核心复合体显示(F) 一个微妙的亚复杂模式,两个种群以灰色箭头表示,全部来自其他亚细胞定位。请点击此处查看此图的较大版本。
讨论
所提出的研究基于csBN-MS技术,该技术以前以线粒体制备11为基准,并纳入了样品制备、凝胶处理和MS数据评估方面的改进。对大规模分离BN-PAGE凝胶的一部分进行了重点分析,提供了一套全面的数据,显示与线粒体膜研究类似的质量测量。质量和保留时间误差以及运行到运行的变化保持在非常低的,并为确定可靠的蛋白质丰度曲线提供了基础。尺寸分辨率似乎不错,半最大峰值宽度低至6个切片(对应于1.5毫米,图4),相对大小差异小于10%的解析(图3,图5A)。这些值并不完全满足先前对线粒体进行 csBN-MS 分析的尺寸分辨率质量(尽管选择的凝胶采样步长较小),但它们的性能明显优于传统的 BN-MS 或尺寸排除 MS 的性能接近20最近变得流行。
图3(使用TPC1相关复合物)中的模拟实验强调了高效复杂尺寸分辨率的重要性,这很难通过2D BN/SDS-PAGE西斑分析来解决(图1B)。这些结果表明,在这种情况下,0.25 mm 切片导致一些过采样,但它仍然证明有助于消除"量化噪声",同时不影响有效的尺寸分辨率。因此,根据之前的结果11,通常推荐±0.3 mm的采样步长大小。
值得注意的是,TPC1相关复合物的鉴别性完全丧失于1mm凝胶采样,这是传统BN-MS5,6中手动切片提供的最小步长尺寸。这或许可以解释这样一个事实,即尽管有强大的MS技术,但通过复合体分析,已经识别出很少的蛋白质复合物和亚单位。除了良好的解析能力外,csBN-MS 还具有很高的多功能性。膜结合复合物和可溶性蛋白质复合物范围从50 kDa到几个MDa可以在一个单一的实验中有效解决,最小偏置11。这与用于复杂体分析的替代分离技术形成对比,如尺寸排除或电离色色谱,后者适用于具有一定尺寸范围或电荷特性的可溶性蛋白质子集。缺点是,csBN-MS 的可扩展性较低(每凝胶的最大负载为 ±3 mg 蛋白质),在技术上可能具有挑战性,并且无法实现自动化。
总体而言,结果表明,基于csBN-MS的复杂体分析可以成功地应用于非线粒体靶,但也表明一些相关的挑战。因此,蛋白质复合物的有效提取和生化稳定性需要更多的优化和清洁步骤,而且可能仍然有限。在被调查者大小窗口内,与线粒体样本相比,重点突出的单分散蛋白复合物的数量确实要低得多(未显示数据)。还建议降低BN-PAGE样品负载,以获得可接受的凝胶分离。较高的负载可能需要较宽的凝胶通道,而这些通道更难正确处理切片(请参阅随附的视频)。此外,样品的蛋白质复杂度(约两倍)高于线粒体衍生切片消化,导致更多的PV值缺失和较低的动态范围。事实上,在分析中缺少一些有望成为图5所示复合物一部分的小蛋白质。这些问题可以通过使用更快、更灵敏的 MS 仪器或独立于数据的采集模式在将来得到解决。
样品制备对蛋白质复合检索、稳定性和凝胶分离质量至关重要。参数和程序应针对每个源组织、细胞莱沙、膜(分体)和感兴趣的蛋白质复合物进行优化。提供了以下一般性建议,可能有助于扩展 csBN-MS 的应用:
(一) 新鲜制备样品,避免变暖/冻结、强稀释、缓冲条件变化和不必要的延误;
(ii) 使用基本上不含盐的缓冲液(替换为 500-750 mM βine 或氨基酸),约中性 pH 值,且含有高达 1%(w/v)的非变性洗涤剂(蛋白质:1:4-1:10 之间的溶解率,用于膜溶解蛋白质复合物,可溶性蛋白复合物无需洗涤剂;
(iii) 通过分析性 BN-PAGE 对洗涤剂条件进行仔细测试和调整,因为这可能严重影响复杂溶解的效率、膜蛋白复合物在样品中的表示、稳定性和同质性。蛋白质洗涤器。后者是蛋白质作为不同的带/复杂群体聚焦于BN-PAGE凝胶的先决条件。以前的文献提供了广泛的中性洗涤剂。但是,DDM (n-decyl +-d-麦芽糖)1,2,4,5,6和数字宁3,5,7,8, 9,10,13,18是迄今为止BN-MS分析最受欢迎的选择。必须强调,任何洗涤剂状况必然代表溶解效率和蛋白质相互作用的保存之间的折衷,可能并不同样适用于所有类型的靶蛋白和源材料;
(iv) 去除带电聚合物,如纤维、细丝、多脂、DNA 和丰富的低分子量成分(即代谢物、脂质或肽)。这可以通过超离心、凝胶过滤或透析来实现。这对整个细胞或组织莱沙尤其重要;
(五) 增加库马西G-250(最终浓度0.05%-0.1%)和蔗糖(增加加载密度,最终浓度10%-20%[w/v])到样品之前,通过短超离心清除,加载样品没有扰动,并立即开始运行。
从未来的角度来看,基于 csBN-MS 的复合体分析提供了多路复用选项,用于研究蛋白质复杂动力学或与特定生物条件相关的变化。代谢标记样品的联合分离,如建议基于尺寸排除的剖析21似乎很简单,但它可能会受到独立于所使用的分离的复合物中自发亚单位交换的阻碍方法。或者,标签样品可以在相邻的凝胶通道中解析,然后可以共同切片或组合后消化,以便进行高灵敏度和鲁棒性的差分分析。
披露声明
作者 Uwe Schulte 是 Logopharm GmbH 的一名雇员和股东,该公司生产本研究中使用的复杂Lyte 47。该公司以非营利方式向学术机构提供复合型试剂。
致谢
这项研究得到了德国金融研究所(DFG,德国研究基金会)的支持——项目ID-403222702–SFB 1381,并在德国卓越战略CIBSS - EXC-2189 - 项目ID 390939984下。我们感谢卡佳·扎佩的技术援助。
材料
| Name | Company | Catalog Number | Comments |
| 30% Acrylamide/Bis Solution, 37.5:1 | Bio Rad | #1610158 | Recommended for acrylamide gradient gel solutions up to 13% |
| 30% Acrylamide/Bis Solution, 19:1 | Bio Rad | #1610154 | Recommended for acrylamide gradient gel solutions >13% |
| SYPRO Ruby Protein Blot Stain | Bio Rad | #1703127 | Total protein stain on blot membranes; sensitive and compatible with immunodetection |
| Coomassie Brilliant Blue G-250 | Serva | no. 35050 | Centrifugate stock solutions prior to use |
| ComplexioLyte 47 | Logopharm | CL-47-01 | Ready-to-use detergent buffer (1%) for mild solubilization of membrane proteins |
| Embedding Medium / Tissue Freezing Medium | Leica Biosystems | 14020108926 | Embedding medium for gel sections to be sliced by a cryo-microtome |
| Immobilon-P Membrane, PVDF, 0,45 µm | Merck | IPVH00010 | |
| ECL Prime Western Blotting Detection Reagent | GE Healthcare | RPN2232 | |
| Plastic syringe with rubber stopper, 20-30 ml | n.a. | n.a. | any supplier, important for making gel section embedding tool |
| broad razor blade | n.a. | n.a. | any supplier, for BN-PAGE gel trimming / excision of lanes |
| metal tube / cylinder, ca. 4 cm long | n.a. | n.a. | mold for embedding and freezing of gel samples |
| Protein LoBind Tubes, 1.5 ml | Eppendorf | Nr. 0030108116 | highly recommended to minimize protein/peptide loss due to absorption |
| sequencing-grade modified trypsin | Promega | V5111 | |
| C18 PepMap100 precolumn, particle size 5 µm | Dionex / Thermo Scientific | P/N 160454 | |
| PicoTip emitter (i.d. 75 µm; tip 8 µm) | New Objective | FS360-75-8 | |
| ReproSil-Pur 120 ODS-3 (C18, 3 µm) | Dr. Maisch GmbH | r13.93. | columns packed manually |
| rabbit anti-TPC1 antibody | Gramsch Laboratories | custom production | described in Castonguay, et al., 2017 (Reference 12) |
| Cy3-biotinylated goat anti-rabbit IgG | Vector Laboratories | CY-1300 | described in Castonguay, et al., 2017 (Reference 12) |
| biotinylated Lotus tetragonolobus lectin, FITC-conjugated | Vector Laboratories | #B1325 | described in Castonguay, et al., 2017 (Reference 12) |
| cryo-microtome Leica CM1950 | Leica Biosystems | 14047743905 | |
| Mini Protean II Cell with wetblot unit | Bio Rad | n.a. | for SDS-PAGE and Westernblot (not sold any more) |
| Penguin Midi Gel Electrophoresis System | PeqLab | n.a. | for BN-PAGE (not sold any more) |
| Zeiss Axiovert 200 M microscope + Photometrics Coolsnap 2 digital camera | Zeiss / Photometrics | n.a. | |
| peristaltic pump (IP high precision multichannel) | Ismatec | ISM940 | for casting of gradient polyacrylamide gels |
| gradient mixer with stirring (two chambers) | selfmade, alternatively Bio Rad | 1652000 or 1652001 | for casting of gradient polyacrylamide gels, manual provides instructions to cast linear or hyperbolic gradient gels (http://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1652000.pdf) |
| ultracentrifuge Sorvall M120 with S80 AT3 rotor | Sorvall / Thermo Scientific | n.a. | for sample preparation (not sold any more) |
| UltiMate 3000 RSLCnano HPLC | Dionex / Thermo Scientific | ULTIM3000RSLCNANO | |
| Orbitrap Elite mass spectrometer | Thermo Scientific | IQLAAEGAAPFADBMAZQ |
参考文献
- Majeran, W., et al. Consequences of C4 Differentiation for Chloroplast Membrane Proteomes in Maize Mesophyll and Bundle Sheath Cells. Molecular & Cellular Proteomics. 7, 1609-1638 (2008).
- Wessels, H. J., et al. LC-MS/MS as an alternative for SDS-PAGE in blue native analysis of protein complexes. Proteomics. 9 (17), 4221-4228 (2009).
- Heide, H., et al. Complexome profiling identifies TMEM126B as a component of the mitochondrial complex I assembly complex. Cell Metabolism. 16 (4), 538-549 (2012).
- Wessels, H. J., et al. Analysis of 953 human proteins from a mitochondrial HEK293 fraction by complexome profiling. PLoS ONE. 8 (7), e68340 (2013).
- Wöhlbrand, L., et al. Analysis of membrane-protein complexes of the marine sulfate reducer Desulfobacula toluolica Tol2 by 1D blue native-PAGE complexome profiling and 2D blue native-/SDS-PAGE. Proteomics. 16 (6), 973-988 (2016).
- Takabayashi, A., et al. PCoM-DB Update: A Protein Co-Migration Database for Photosynthetic Organisms. Plant and Cell Physiology. 58 (1), e10 (2017).
- Senkler, J., et al. The mitochondrial complexome of Arabidopsis thaliana. The Plant Journal. 89 (6), 1079-1092 (2017).
- de Almeida, N. M., et al. Membrane-bound electron transport systems of an anammox bacterium: A complexome analysis. Biochimica et Biophysica Acta. 1857 (10), 1694-1704 (2016).
- Anand, R., Strecker, V., Urbach, J., Wittig, I., Reichert, A. S. Mic13 Is Essential for Formation of Crista Junctions in Mammalian Cells. PLoS ONE. 11 (8), e0160258 (2016).
- Eydt, K., Davies, K. M., Behrendt, C., Wittig, I., Reichert, A. S. Cristae architecture is determined by an interplay of the MICOS complex and the F1FO ATP synthase via Mic27 and Mic10. Microbial Cell. 4 (8), 259-272 (2017).
- Müller, C. S., et al. Cryoslicing Blue Native-Mass Spectrometry (csBN-MS), a Novel Technology for High Resolution Complexome Profiling. Molecular & Cellular Proteomics. 15 (2), 669-681 (2016).
- Castonguay, J., et al. The two-pore channel TPC1 is required for efficient protein processing through early and recycling endosomes. Scientific Reports. 7 (1), 10038 (2017).
- Schägger, H., Pfeiffer, K. Supercomplexes in the respiratory chains of yeast and mammalian mitochondria. The EMBO Journal. 19 (8), 1777-1783 (2000).
- Banyard, S. H., Stammers, D. K., Harrison, P. M. Electron density map of apoferritin at 2.8-A resolution. Nature. 271 (5642), 282-284 (1978).
- Dettmer, U., et al. Transmembrane protein 147 (TMEM147) is a novel component of the Nicalin-NOMO protein complex. The Journal of Biological Chemistry. 285 (34), 26174-26181 (2010).
- Kimberly, W. T., et al. Gamma-secretase is a membrane protein complex comprised of presenilin, nicastrin Aph-1, and Pen-2. Proceedings of the National Academy of Sciences of the United States of America. 100 (11), 6382-6387 (2003).
- Hong, Y., et al. Human PIG-U and yeast Cdc91p are the fifth subunit of GPI transamidase that attaches GPI-anchors to proteins. Molecular Biology of the Cell. 14 (5), 1780-1789 (2003).
- Van Damme, T., et al. Mutations in ATP6V1E1 or ATP6V1A Cause Autosomal-Recessive Cutis Laxa. The American Journal of Human Genetics. 100 (2), 216-227 (2017).
- Budenholzer, L., Cheng, C. L., Li, Y., Hochstrasser, M. Proteasome Structure and Assembly. Journal of Molecular Biology. 429 (22), 3500-3524 (2017).
- Heusel, M., et al. Complex-centric proteome profiling by SEC-SWATH-MS. Molecular Systems Biology. 15 (1), e8438 (2019).
- Kristensen, A. R., Gsponer, J., Forster, L. J. A high-throughput approach for measuring temporal changes in the interactome. Nature Methods. 9 (9), 907-919 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。