Method Article
تجزئه خلايا سرطان الدم اللمفاوية المزمنة الاوليه لرصد الاتجار بالبروتين النووي/الخلوي
In This Article
Summary
هذا البروتوكول يتيح الأمثل والجيل اللاحق كفاءه من الكسور النووية والسيتوبلازمي من خلايا سرطان الدم اللمفاوية المزمنة الاوليه. وتستخدم هذه العينات لتحديد توطين البروتين وكذلك التغيرات في الاتجار بالبروتين الذي يحدث بين المقصورات النووية والخلوية علي تحفيز الخلايا والعلاج من المخدرات.
Abstract
وغالبا ما يتم تحرير الصادرات النووية من الجزيئات في الخلايا السرطانية. يمكن جعل البروتينات المثبطة للورم ، مثل p53 ، غير نشطه بسبب التعريب الخلوي الشاذ الذي يعطل اليه عملها. ويساعد علي بقاء خلايا سرطان الدم اللمفاوية المزمنة (CLL) ، من بين الخلايا السرطانية الأخرى ، من خلال تحرير الاسلحه النووية إلى المكوكات الخلوية ، علي الأقل جزئيا عن طريق إلغاء القيود التي XPO1 مستقبلات النقل والتنشيط التاسيسي مسارات الإشارات بوساطة PI3K. من الضروري فهم دور البروتينات الفردية في سياق موقعها داخل الخلايا للحصول علي فهم أعمق لدور هذه البروتينات في البيولوجيا المرضية للمرض. وعلاوة علي ذلك ، فان تحديد العمليات التي تكمن وراء تحفيز الخلايا واليه العمل لمثبطات دوائية محدده ، في سياق الاتجار بالبروتين دون الخلوي ، سيوفر فهما اشمل لليه العمل. البروتوكول الموصوف هنا يتيح الأمثل والجيل التالي الفعال من الكسور النووية والسيتوبلازمية من خلايا سرطان الدم اللمفاوية المزمنة الاوليه. ويمكن استخدام هذه الكسور لتحديد التغيرات في الاتجار بالبروتين بين الكسور النووية والخلايا الخلوية علي تحفيز الخلية والعلاج من المخدرات. ويمكن قياس البيانات كميا وعرضها بالتوازي مع صور النيون المناعية ، التالي توفير بيانات قويه وقابله للقياس الكمي.
Introduction
وقد أنشئت لفتره طويلة نقل الجزيئات بين النواة والخلايا الخلوية للعب دورا رئيسيا في وظيفة الخلية العادية ، وغالبا ما يتم تحريرها في الخلية السرطانية1,2. ويمكن ان تنجم هذه القيود عن الإفراط في التعبير/طفرة البروتينات التي تتحكم في التصدير النووي. واحد من هذه البروتين اكسبورتين (XPO1) ، هو مستقبلات النقل التي تصدر > 200 اشاره التصدير النووية (NES)-التي تحتوي علي البروتينات في السيتوبلاسما من النواة2. XPO1-cargos تشمل الp53 ، وافراد الاسره foxo و IB ، والمساهمة في عدم تفعيلها عن طريق تثبيط أليتها للعمل1،2،3. يمكن ان يحدث المزيد من البروتين الخاطئ عندما الإشارات البيئية الدقيقة تؤثر علي الخلايا السرطانية ، مما يؤدي إلى تنشيط مسارات الإشارات داخل الخلايا مثل الفوسفاتيديل-اينوزيتول-3-كيناز (PI3K)/المسار akt ، مما ادي إلى التنشيط من [فوكسو] أسره أعضاء وتصدير لاحقه من النواة4,5. وقد تورط هذا الخطا من البروتينات المثبطة الورم في تطور عدد من الأورام الدموية والصلبة1,2,6.
تطوير مثبطات جزيء صغير للاستخدام السريري في الأورام الخبيثة الدموية (ابيضاض الدم النقوي الحاد (AML)/cll) ، والتي ترتبط وتمنع بشكل انتقائي وظيفة XPO1 ، ويؤكد علي اهميه تطوير التقنيات المناسبة لمعالجه تاثير العوامل الدوائية علي إغلاق البروتينات بين المقصورات النووية والسيتوبلازمية6،7،8. وقد أحرزت تقنيات التصوير تقدما كبيرا مما مكن من تحديد البروتينات في المقصورات شبه الخلوية علي التحفيز الخارجي لعلاج المخدرات ، ومع ذلك ، فان اهميه التقنيات الموازية القوية والداعمة أمر بالغ الاهميه لموثوقيه اعلام الجمهور العلمي بصحة النتيجة.
اللمفاويات يستريح والخبيثة CLL-B الخلايا المعزولة من عينات الدم المريض تمثل تحديا في توليد الكسور النووية والسيتوبلازمية بسبب ارتفاع النووية: نسبه سيتوبلازمي. ان الاستفادة المثلي من الظروف التجريبية لتوليد بيانات تجريبية قويه وموثوقه أمر بالغ الاهميه بالطبع من أجل تخطيط البرامج التجريبية في المستقبل. الطريقة الموصوفة هنا تمكن القياس الكمي للبروتينات في الكسور النووية والخلوية وتحدد كيف يمكن ان تتاثر هذه البروتينات بالتحفيز الخلوي و/أو العلاج بالمخدرات.
Protocol
وقد تمت الموافقة علي استخدام العينات الاوليه من المرضي CLL الموصوفة هنا من قبل دائره الأخلاقيات البحثية الغربية في اسكتلندا ، نهس الكبرى غلاسكو وكلايد (المملكة العربية البريطانية) وتم تنفيذ جميع الاعمال وفقا للمبادئ التوجيهية المعتمدة.
1. عزل خلايا CLL من عينات دم المريض
-
يتم استلام عينات الدم المحيطيه من مرضي CLL التي تم قبولها مسبقا من العيادة في أنابيب جمع الدم من المستشفى ، مصحوبة بعدد الخلايا البيضاء (WCC). تنقيه الدم المحيطي العينات CLL وفقا لل WCC. ل WCC < 40 x 106 خلايا/مل ، انتقل إلى الخطوة 1.1.1 ؛ ل WCC ≥ 40 x 106 خلايا/مل ، والمضي قدما إلى الخطوة 1.1.2.
- صب محتويات جميع أنابيب الدم أدتا إلى 50 mL أنبوب الطرد المركزي المخروطية وأضافه 50 μL من الإنسان B الخلية إثراء كوكتيل لكل 1 مل من الدم. احتضان في درجه حرارة الغرفة (RT) لمده 20 دقيقه. انتقل إلى الخطوة 1.1.2.
- تمييع العينة بنسبه 1:1 مع المخزن المؤقت RT cll غسل (الفوسفات-مخزنه سالين (تلفزيوني) ، 0.5 ٪ الجنين البقري المصل (ار) و 2 مم أدتا).
- Aliquot RT كثافة وسائل الاعلام التدرج في أنبوب الطرد المركزي المخروطية الحجم بشكل مناسب للعينه (10 مل في أنبوب 50 mL لمده 30 مل من عينه أو 4 مل في أنبوب 15 مل ل 10 مل من عينه).
- بعناية طبقه العينة علي راس الكثافة الانحدار وسائل الاعلام والطرد المركزي في 400 x g لمده 30 دقيقه في RT.
ملاحظه: تاكد من ان الطرد المركزي هو في RT قبل وضع العينات في جهاز الطرد المركزي كما تغيير في درجه الحرارة سوف يؤدي إلى ضعف تخصيب الخلايا الاحاديه النواة ، وإيقاف الفرامل علي الطرد المركزي ، كما الكبح المفاجئ يمكن ان يعطل واجهه السائل. - حصاد بلطف الطبقة البيضاء من الخلايا أحاديه النوى التي تجمع في واجهه الكثافة الانحدار وسائل الاعلام و CLL غسل العازلة ، إلى أنبوب الطرد المركزي المخروطي 50 mL جديده باستخدام ماصه البلاستيك باستور.
- أضافه 40 mL من CLL غسل العازلة إلى أحاديه معزولة لغسل الخلايا وأجهزه الطرد المركزي في 300 x ز لمده 10 دقيقه في RT.
- تجاهل supernatant ، وأعاده تعليق بيليه عن طريق الوخز في الجزء السفلي من الأنبوب ، ثم كرر خطوه الغسيل الموصوفة في الخطوة 1.5.
- تجاهل supernatant ، أعاده تعليق بيليه كما هو موضح في الخطوة 1.6 ، ثم أعاده تعليق بيليه في حجم مجموعه من CLL غسل العازلة (تصل إلى 40 mL ، اعتمادا علي حجم بيليه الخلية).
- عد الخلايا باستخدام التريكان الأزرق والكريات الدموية. ثم انتقل إلى تدفق الخلوي للتحقق من نقاء خلايا CLL.
ملاحظه: في هذه المرحلة يمكن ان تكون مثقف خلايا cll في تركيز 10 × 106 خلايا/مل في وسائل الاعلام لاستخدامها في التجارب ، و/أو بالتبريد في 10 ٪ ثنائي ميثيل سلفوكسيد (dmso)/للعمل في المستقبل في تركيزات تصل إلى 100 x 106 خلايا/قارورة.
2. تدفق الخلوي من خلايا CLL
- التسمية 12 مم × 75 مم الجولة أنابيب البوليسترين القاع علي النحو المبين في الجدول 1.
- في أنابيب 2 – 5 ، وضع قطره واحده من الخرز التعويض وتخزينها علي الجليد. أضافه 1 μL من الأجسام المضادة المناسبة (CD5 ، CD19 ، CD23 أو CD45 ، كما هو مبين في الجدول 1) إلى أنابيب 2 – 5 ، واحتضان علي الجليد لمده 20 دقيقه ، محمية من الضوء عن طريق وضع رقائق القصدير علي دلو الجليد.
ملاحظه: هذه الأنابيب بمثابه ضوابط التعويض لاعداد قالب التدفق الخلوي. -
وضع ما يصل إلى 1 × 106 خلايا cll في أنابيب 1 ، 6 و 7 ، أضافه 2 مل من المخزن المؤقت FACS (تلفزيوني + 2 ٪) لكل أنبوب والطرد المركزي في 300 x g لمده 5 دقائق في RT لغسل الخلايا. تجاهل ماده طافي وتخزين الأنابيب التي تحتوي علي كريات الخلية علي الجليد.
- أعاده تعليق كريات الخلية وأضافه التركيبة المناسبة من الأجسام المضادة إلى الخلايا في أنبوب 7 وفقا للتعليمات في الجدول 1، في حجم النهائي من 100 μl مع المخزن المؤقت facs. يتم استخدام الأجسام المضادة بتركيز مناسب وفقا لإرشادات الشركة المصنعة.
- أعاده تعليق كريات الخلايا في أنابيب 2 و 6 في 100 μL من المخزن المؤقت FACS.
- احتضان الخلايا علي الجليد ، إلى جانب الخرز الملون في أنابيب 2 – 5 ، محمية من الضوء لمده 20 دقيقه.
- بعد الحضانة ، أضافه 2 مل من العازلة FACS لجميع الأنابيب وأجهزه الطرد المركزي في 300 x g لمده 5 دقائق في RT لغسل الخلايا. تجاهل ماده طافي وأعاده تعليق الكريات حبه/الخلية عن طريق التحريك بلطف الأنابيب.
- أعاده تعليق أنابيب 1-5 في 100 μL من المخزن المؤقت FACS ومكان علي الجليد حتى علي استعداد لتحليل علي تدفق المضخم.
- تمييع محلول DAPI إلى 0.05-0.2 ميكروغرام/مل في المخزن المؤقت FACS قبل الاستخدام مباشره. قد يختلف التركيز الأمثل ، ويوصي بالمعايرة بالنسبة للمعايرة.
- أعاده تعليق أنابيب 6 و 7 مع 100 μL من محلول DAPI المخفف واحتضان الأنابيب علي الجليد لمده لا تقل عن 5 دقيقه للسماح للخلايا وصمه عار.
ملاحظه: لا يلزم المزيد من الغسيل لأنه يجب ان تكون DAPI موجودة في المخزن المؤقت للخلايا الميتة لتبقي موسومة. مره واحده وقد تم أضافه DAPI ، يجب تحليل الخلايا علي تدفق المضخم الخلوي في غضون 4 ساعات. - تحليل الخلايا باستخدام مقياس التدفق الخلوي.
3. اعداد الكسور شبه الخلوية من خلايا CLL
ملاحظه: عند التخطيط لإنشاء التجريبية ، وتشمل بئر من الخلايا غير المحفزة/غير المعالجة التي يمكن ان تتولد من استخراج الخلية بأكملها.
- اجراء التحفيز المطلوب و/أو علاج المخدرات من خط الخلية MEC1 CLL أو خلايا CLL الاساسيه المعزولة باستخدام 10-20 × 106 خلايا/حاله. ثم سيتم استخدام الخلايا لتجزئه فرعيه (الخطوات 3.4 & 3.5) أو لإنشاء استخراج الخلية بأكملها (الخطوة 3.6).
- اعداد الحلول/الأنابيب: اعداد جميع الحلول/المخازن المؤقتة الطازجة في يوم التجزئة ، قبل ان يتم حصاد الخلايا. تخزين الحلول علي الجليد حتى المطلوبة واستخدامها في غضون 4 ساعات من التحضير.
- تلفزيوني/الفوسفاتيز المانع الحل: اعداد مثبطات الفوسفاتيز في الاذاعه التلفزيونية عن طريق تمييع مثبطات الفوسفاتيز 1:20 في 1x تلفزيوني (اي ، 0.5 mL من مثبطات الفوسفاتيز في 9.5 mL من 1x تلفزيوني).
ملاحظه: تاكد من ان مثبطات الفوسفاتيز لم تكن قد عجلت. إذا كان الراسب موجودا ، يسخن إلى 50 درجه مئوية لمده 10 دقائق. - العازلة الوتر: اعداد 1x العازلة الناقص بجعل 1:10 التخفيف من 10x العازلة الوتر في الماء المقطر (اي ، 50 μL من 10x الحاجز الفاصل في 450 μ L من dH2س).
- 10 ملم ديثيوثريتول (dtt): اعداد dtt 10 مم عن طريق جعل 1:100 التخفيف من dtt 1m مع الماء المقطر (اي ، 10 μl من 1 m dtt في 990 μl من dH2س).
ملاحظه: Dtt هو عطوب جدا اعداد هذا الطازج في كل مره. تجنب دورات التجميد/الذوبان المتكررة. - إكمال المخزن المؤقت لتحلل: تحديد مقدار المخزن المؤقت المطلوب لكل تجربه. يتطلب كل عينه 50 μL من المخزن المؤقت تحلل كامله ، لذلك أضافه 5 μL من 10 مم DTT (الخطوة 3-2-3) إلى 44.5 μL من تحلل المخزن المؤقت ومن ثم أضافه 0.5 μL من كوكتيل مثبطات الانزيم البروتيني. يمكن زيادة حجم هذا المبلغ اعتمادا علي عدد العينات في التجربة.
- تسميه أربع مجموعات من أنابيب الطارد المجهري 1.5 mL لكل التحفيز و/أو علاج المخدرات للخلايا حفزت حديثا (الخطوة 3.3) ، والكسور الخلوية المتولدة حديثا (خطوه 3.4.3) ، والكسور النووية المتولدة حديثا (الخطوة 3.5.3) ، والخلية بأكملها لست] (خطوه 3.6.3). قبل البرد هذه أنابيب الطارد المجهري علي الجليد حتى المطلوب.
- تلفزيوني/الفوسفاتيز المانع الحل: اعداد مثبطات الفوسفاتيز في الاذاعه التلفزيونية عن طريق تمييع مثبطات الفوسفاتيز 1:20 في 1x تلفزيوني (اي ، 0.5 mL من مثبطات الفوسفاتيز في 9.5 mL من 1x تلفزيوني).
- نقل الخلايا إلى الموسومة بشكل فردي 1.5 mL أنابيب الطارد المجهري وبيليه من قبل يطرد في 200 x g لمده 5 دقائق في 4 ° c. أزاله ماده طافي وأعاده تعليق الخلايا في 1 مل من الجليد الباردة الفوسفاتيز/مثبطات (الخطوة 1.2.3). بيليه الخلايا بواسطة طرد في 200 x g ل 5 دقيقه في 4 °c. أزاله سوبرناتانت والحفاظ علي كريات الخلية علي الجليد.
- اعداد الكسور السيتوبلازمية: أعاده التعليق برفق الكريات الخلية لاستخدامها لتجزئه تحت الخلوية في 50 μL من 1x العازلة الوتر (الخطوة 3-2-2). احتضان الخلايا علي الجليد لمده 15 دقيقه للسماح للخلايا تنتفخ.
ملاحظه: يمكن زيادة حجم المخزن المؤقت ناقص الوتر المستخدمة تجريبيا اعتمادا علي رقم الخلية.- أضافه 0.8-2.5 μL (1:20 إلى 1:60) من المنظفات في كل عينه ودوامه علي اعلي اعداد ل 10 ثانيه.
- لتحديد التركيز الأمثل من المنظفات لاستخدامها لنوع خليه معينه لعزل الكسور النووية والخلوية ، واجراء التدرج المنظفات في البداية. وينبغي ان تكون مجموعه من 1:20 إلى 1:60 (اي 2.5 μL إلى 0.8 μL من المنظفات إلى 50 μL من العازلة ناقص التوتر) كافيه.
ملاحظه: إذا تم تعديل وحده التخزين من المخزن المؤقت الوتر في الخطوة 3.4 ، تاكد من الحفاظ علي نسبه المنظفات المناسبة. - تحقق من تحلل الخلية من خلال مراقبه الخلايا باستخدام مجهر التباين المرحلة قبل وبعد أضافه المنظفات. تظهر الخلايا الكاملة أكبر مع نواه داكنه كثيفه. سيظهر السيتوبلاسما كهالة ساطعه حول النواة.
ملاحظه: كما يتم تاكيد التحلل المناسب باستخدام البقع الغربية لتحليل بروتينات محدده داخل الكسور التي تم توليدها من تدرج المنظفات.
- لتحديد التركيز الأمثل من المنظفات لاستخدامها لنوع خليه معينه لعزل الكسور النووية والخلوية ، واجراء التدرج المنظفات في البداية. وينبغي ان تكون مجموعه من 1:20 إلى 1:60 (اي 2.5 μL إلى 0.8 μL من المنظفات إلى 50 μL من العازلة ناقص التوتر) كافيه.
- مره واحده lysed ، الطرد المركزي العينات في 14,000 x g ل 30 s في 4 درجه مئوية.
- نقل بعناية ماده طافي إلى ما قبل المبردة ، المسمي أنبوب الطارد المجهري. ويمكن تخزين هذا الكسر السيتوبلازمي في-80 درجه مئوية حتى المطلوب لمزيد من التحليل. يحتوي ال [بيليه] متبقي الكسر نوويه (خطوه 3.5).
ملاحظه: تجنب دورات التجميد/الذوبان المتكررة للعينات.
- أضافه 0.8-2.5 μL (1:20 إلى 1:60) من المنظفات في كل عينه ودوامه علي اعلي اعداد ل 10 ثانيه.
- اعداد الكسور النووية: أعاده تعليق كل بيليه النووية في 50 μL من المخزن المؤقت تحلل كامله (الخطوة 3-2) عن طريق التنضيد صعودا وهبوطا.
ملاحظه: يمكن تعديل حجم المخزن المؤقت تحلل كامله تجريبيا وفقا لرقم الخلية البداية.- أضف 2.5 μL من المنظفات لأذابه البروتينات المرتبطة بالغشاء النووي والدوامة علي اعلي اعداد ل 10 ليالي. احتضان العينات علي الجليد لمده 30 دقيقه.
- دوامه علي اعلي اعداد ل 30 ثانيه ، ثم الطرد المركزي العينات في 14,000 x g لمده 20 دقيقه في 4 درجه مئوية.
- انقل العملاق إلى أنبوب الطارد المجهري المسمي قبل المبرد. ويمكن تخزين هذا الكسر النووي في-80 درجه مئوية حتى المطلوب لمزيد من التحليل.
ملاحظه: تجنب دورات التجميد/الذوبان المتكررة للعينات.
- اعداد الخلايا الكاملة (WCL) من خلايا CLL
ملاحظه: التحضير من الكاملة خليه مقتطف يستطيع كنت وفيت [آت سم تيم] التحضير من الكسور نوويه (خطوه 3.5).- أعاده التعليق الكريات استخراج الخلية بأكملها في 100 μL من المخزن المؤقت تحلل كامله (أعدت في الخطوة 2) عن طريق التعبئة صعودا وهبوطا ، ثم أضافه 5 μL من المنظفات لضمان تحلل الخلية كامله. احتضان العينات علي الجليد لمده 30 دقيقه.
- دوامه علي اعلي اعداد ل 30 ثانيه ، ثم الطرد المركزي العينات في 14,000 x g لمده 20 دقيقه في 4 درجه مئوية.
- انقل العملاق إلى أنبوب الطارد المجهري المبرد مسبقا. ويمكن تخزين هذه الخلية كله محلله في-80 درجه مئوية حتى المطلوبة لمزيد من التحليل.
ملاحظه: تجنب دورات التجميد/الذوبان المتكررة للعينات.
4. التحليل النهائي لكسور الخلايا الفرعية
ملاحظه: في هذا البروتوكول ، تم اجراء تحليل لكسور الخلايا المتولدة من قبل الغربية التنقيط باستخدام البروتوكولات القياسية ، وتحميل أرقام الخلايا متساوية/حاره (ما يعادل ~ 10 ميكروغرام من البروتين) لكسور النووية والسيتوبلازمية.
- التحديد الكمي للاتجار بالبروتين بين الكسور النووية والجزيئات السيتوبلازمية: اجراء تحليل كمي الغربية لطخه من خلال كميه من شده الاشاره ، أو قياس الكثافة باستخدام المتاحة بحريه البرمجيات تحليل وصمه عار الغربية.
- استيراد الصور: يجب استيراد الصور لطخه الغربية التي تم إنشاؤها من الصكوك النامية المختلفة كملفات JPG ، PNG أو TIFF. من المستحسن ملف RAW عمق 16 بت. لاستيراد صوره ، انقر فوق أيقونه البرنامج ومرر مؤشر الماوس فوق الاستيراد. ثم انقر فوق صور الجهات الخارجية. حدد ملف الصورة ثم انقر فوق فتح.
- عرض الصورة: في الشريط صوره ، انقر فوق الزر اختيار في مجموعه العرض . سيتم فتح مربع الحوار " ضبط العرض " لتمكين المزيد من التعديلات إذا لزم الأمر. تنفيذ تحسينات اضافيه بما في ذلك السطوع أو التباين باستخدام أشرطه التمرير القابلة للتعديل علي علامة التبويب Luts الصورة . استخدم علامة التبويب المنحنيات لاجراء تعديلات أدق.
- تحليل البيانات (إلغاء تحديد القناة): انقر علي شريط التحليل. لتحليل قناه واحده فقط ، قم بإلغاء تحديد القناة (الاقنيه) التي لم يتم تحليلها. انقر علي الصورة المصغرة للقناه "عدم إظهار القناة" في LUTs Image ، تاركا القناة المطلوبة فقط معروضه. قد تتطلب الصور التي تم استيرادها كملفات JPG أو PNG أو TIFF إلغاء انتخاب قنوات RGB متعددة غير مرغوب فيها.
-
أضافه الاشكال: لقياس شده الاشاره ، انقر فوق أضافه مستطيل لأضافه مستطيل إلى الصورة. انقر فوق مركز الميزة (علي سبيل المثال ، شريط البروتين) لوضع مستطيل حوله. بدلا من ذلك ، لرسم شكل يدويا ، اختر رسم مستطيل. بعد أضافه كافة الاشكال المطلوبة ، انقر فوق تحديد لإرجاع المؤشر إلى أداه التحديد.
ملاحظه: أضافه اشكال متعددة بترتيب منطقي ، حيث يتم فرز البيانات حسب رقم المعرف الذي تم إنشاؤه بشكل تسلسلي. -
الطرح الخلفي: لطرح ضجيج الخلفية ، انقر فوق الزر الأول في المجموعة الخلفية وحدد متوسط من القائمة المنسدلة. قم بتعيين عرض الحدود إلى 3 في حوار الخلفية وحدد الشرائح التي سيتم استخدامها لحساب الخلفية. عند اختيار الشرائح التي سيتم استخدامها ، حدد الشرائح التي تمثل خلفيه الصورة بشكل أفضل.
ملاحظه: الضوضاء الخلفية يمكن ان تؤثر علي التحديد الكمي للاشاره ، لذلك يجب ان تطرح لحساب الاشاره بدقه من الاشكال الفائدة. -
تقليم اشاره وتقليم الخلفية-اختياري: قد تظهر الملفات التي تم استيرادها بتنسيقات JPG أو PNG أو TIFF تشبع البكسل: المناطق البارزة/الساطعة داخل نطاق البروتين. تقليم اشاره وتقليم الخلفية (bkgnd) يزيل بكسل المشبعة من التحليل. لعرض هذه القيم ، أضف اشاره trim وتقليم Bkgnd إلى جدول بالنقر علي زر الاعمده إلى يمين طريقه عرض الجدول.
ملاحظه: قد يؤدي تشبع البكسل إلى كميه غير موثوق بها. يمكن أزاله البيكسلات المشبعة فقط إذا تم تشبع اقل من 5% من البيكسلات داخل الشكل.
-
أضافه الاشكال: لقياس شده الاشاره ، انقر فوق أضافه مستطيل لأضافه مستطيل إلى الصورة. انقر فوق مركز الميزة (علي سبيل المثال ، شريط البروتين) لوضع مستطيل حوله. بدلا من ذلك ، لرسم شكل يدويا ، اختر رسم مستطيل. بعد أضافه كافة الاشكال المطلوبة ، انقر فوق تحديد لإرجاع المؤشر إلى أداه التحديد.
- تصدير البيانات: انقر فوق علامة التبويب اشكال اعلي الجدول. بالنسبة لقياس الكثافة ، فان القيم الموجودة في عمود الاشاره مطلوبه. الاشاره هي مجموع قيم كثافة البكسل (الإجمالي) للشكل ناقص منتج Bkgnd والمنطقة. انقر فوق الزر تقرير. انقر فوق حفظ باسم أو تشغيل جدول بيانات.
الاشاره = المجموع-(منطقه Bkgnd x)
ملاحظه: توفر علامة التبويب الاشكال جدولا للقيم الكمية بما في ذلك الاشاره والمجموع والمساحة و Bkgrnd. - الكمية التعبير البروتين: ضمن جدول البيانات المحفوظة ، حساب التعبير تطبيع من البروتين الفائدة لكل حاره أو متغير عن طريق تقسيم الاشاره التي تم الحصول عليها للبروتين من الفائدة من قبل اشاره لفرقه التحكم في تحميل البروتين المقابلة.
ملاحظه: ولا يمكن مقارنه المقارنات بين مقادير البروتين الطبيعي الصالح عبر الكسور النووية والجزيئات السيتوبلازمية بشكل مباشر بسبب ضوابط التحميل المختلفة المستخدمة لتمييز الكسور النووية والجزيئات الخلوية. ومع ذلك ، فان المقارنات داخل الكسور الفردية ، مثل المعالجة التالية للمخدرات ، ملائمة. - صوره التصدير للنشر أو العرض التقديمي: انقر فوق علامة التبويب الصور التي تم العثور عليها فوق الجدول ثم انقر فوق الصورة التي سيتم تصديرها. إذا كنت تستخدم الصورة لعرض شرائح أو تنسيقات رقميه أخرى ، فانقر علي أيقونه البرنامج ، ومرر مؤشر الماوس فوق التصدير وانقر علي الصورة للوسائط الرقمية. احفظ الصورة كملف JPG أو PNG أو TIFF ، كما هو مطلوب.
النتائج
عند التخطيط للتجارب علي خلايا CLL الاوليه ، إذا كانت الاختبارات تتطلب عددا كبيرا من الخلايا (> 50 × 106 خلايا) ، هناك تفضيل لاستخدام خلايا cll المعزولة حديثا ، بدلا من الخلايا التي تتطلب الذوبان ، ولكن هذا ليس دائما الممكن. وهذا لان عمليه تجميد/ذوبان يمكن ان يؤدي إلى وفاه ما يصل إلى 50 ٪ من خلايا CLL ، علي الرغم من ان هذا هو عينه تابعه. إثراء خلايا CLL مع WCC > 40 × 106/مل باستخدام كثافة طرد كما هو موضح هنا (الخطوات 1.3 – 1.5) تمكن من الانتعاش خليه عاليه مع نقاء عاليه (≥ 95 ٪) خلايا CLL الاساسيه. في العينة المعروضة ، و WCC = 177 x 106/ml: من عينه الدم 30 مل تم انتشال 5 × 109 خلايا ، والذي يمثل محصول الخلية من 94 ٪ من مجموع الخلايا. تحليل هذه العينة عن طريق تدفق الخلوي كشفت نقاء خلايا CLL من > 95% كما هو مبين من قبل التعبير السطحي المزدوج للعلامات خليه CLL CD19 و CD5 بعد النابضة علي FSC/SSC ، الخلايا المفردة التي كانت DAPI السلبية (خلايا قابله للحياة) (الشكل 1).
تم تنفيذ الأمثل لاجراء تجزئه سوبسيلولار باستخدام مجموعه من نسب المنظفات (1:20 إلى 1:60) اثناء اعداد الجزء السيتوبلازمي (الخطوة 3.4). وبعد ذلك ، أعدت الكسور النووية والاتحادات الذرية (الخطوات 3.5 و 3.6 علي التوالي). وأجريت المناعة علي الكسور الناتجة من خط الخلية CLL MEC1 (الشكل 2ا) وخلايا cll الاوليه (الشكل 2ب). تم سبر البقع لعلامات الكسر لامين (النووية ؛ 74/63 ده كده) و β-توبين (سيتوبلازمي ؛ 55 ده كده) لتاكيد التجزئة الناجحة للخلايا. وتشير التجزئة إلى ان مستوي المنظفات الأمثل للخلايا MEC1 هو التخفيف 1:60 (الشكل 2ا) ، مقارنه مع التخفيف 1:30 يجري الأمثل للخلايا cll الابتدائية (الشكل 2ب) ، كما هو مبين من إثراء البروتين النووي وعدم وجود البروتين السيتوبلازمي في الكسور والعكسصحيح. وتمثل WCLs البروتين الكلي وتعمل كعنصر تحكم إيجابي للأجسام المضادة المستخدمة لتحقيق الكسور الخلوية. من المهم اختيار البروتينات المناسبة كعلامات كسر: الشكل 2ج يظهر المناعية من الكسور النووية/الخلوية التي أعدت من MEC1 الخلايا التي RNA الثانية (Rpb1 Ctd; 250 دهت) واللاميين A/c وكانت بقع من علامات الكسور النووية ، في حين تم استخدام β-الأنابيب و γ (50 ده) كعلامات سيتوبلازمية. ومن الواضح ان γ الأنابيب المخصب في السيتوبلاسما ولكن التعبير هو واضح في النواة ، كما هو مبين سابقا9.
بمجرد ان يتم تحسين الظروف التجريبية ، يمكن اجراء تجربه. في الامثله المعروضة ، تم تحديد التعريب تحت الخلوية من FOXO1 في الكسور النووية والخلوية علي تحفيز الخلايا مع مستقبلات مستضد الخلية B (BCR) في وجود أو عدم وجود مثبطات mTORC1/2 المزدوجة AZD8055 ، في خلايا MEC1 ( الشكل 3(ا) والخلايا الاوليه cll (الشكل 3ب)5،10. وفي كلا المثالين ، تم تحقيق جيل من الكسور النووية العالية التخصيب والجزيئات السيتوبلازمية علي النحو المبين في التعبير الحصري تقريبا للامين في الكسر النووي والأنابيب β في الكسور الخلوية. في كلا النوعين من الخلايا ، تم تخفيض التعبير FOXO1 في السيتوبلاسما بعد العلاج مع AZD8055 بالمقارنة مع الشركة ، يرافقه زيادة في FOXO1 التعبير في المقصورة النووية ، مما يدل علي نقل البروتين (الشكل 3). ولأزاله الذاتية لتفسير البيانات ، تم تحديد كميه المناعة الفردية من خمس عينات CLL الاوليه داخل الكسور الخلوية (الخطوة 4 ؛ الشكل 4ا) ، باستخدام البروتينات النووية أو الخلوية ذات الصلة كضوابط تحميل داخلية لكل عينه ، ومن ثم تطبيع كل جزء إلى السيطرة غير المحفزة (الولايات الامريكيه) لا مراقبه المخدرات ، كما هو مبين. يظهر الرسم البياني الناتج اتجاات حركه FOXO1 بين الكسور النووية والجزيئات السيتوبلازمية ، مع AZD8055 الحد من مستويات التعبير FOXO1 في السيتوبلاسما ، مع زيادة التعبير في الوقت نفسه في النواة. وعلاوة علي ذلك ، فان الارتفاع في التعبير FOXO1 السيتوبلازمي واضح عند الربط المتقاطع BCR.
| انبوب | اسم الأنبوب | الخلايا/الخرز | Antigen | فلوروفوري |
| 1 | غير ملوثين | الخلايا | Na | Na |
| 2 | واحد وصمه عار | الخرز | CD5 | FITC |
| 3 | واحد وصمه عار | الخرز | CD19 | PE-Cy7 |
| 4 | واحد وصمه عار | الخرز | CD23 | Apc |
| 5 | واحد وصمه عار | الخرز | CD45 | APC-Cy7 |
| 6 | واحد وصمه عار | الخلايا | صلاحيه | DAPI |
| 7 | CLL وصمه عار | الخلايا | CD5, CD19, CD23, CD45 & الصلاحية | FITC ، PE-Cy7 ، APC ، APC-Cy7 & DAPI |
الجدول 1: الجدول الذي يبين المجموعة المثالية من أنابيب العينات اللازمة لقياس التدفق الخلوي للخلايا CLL. ويجب ان تشمل كل تجربه جميع الضوابط المناسبة للتحليل الدقيق للنتائج التي تم الحصول عليها.
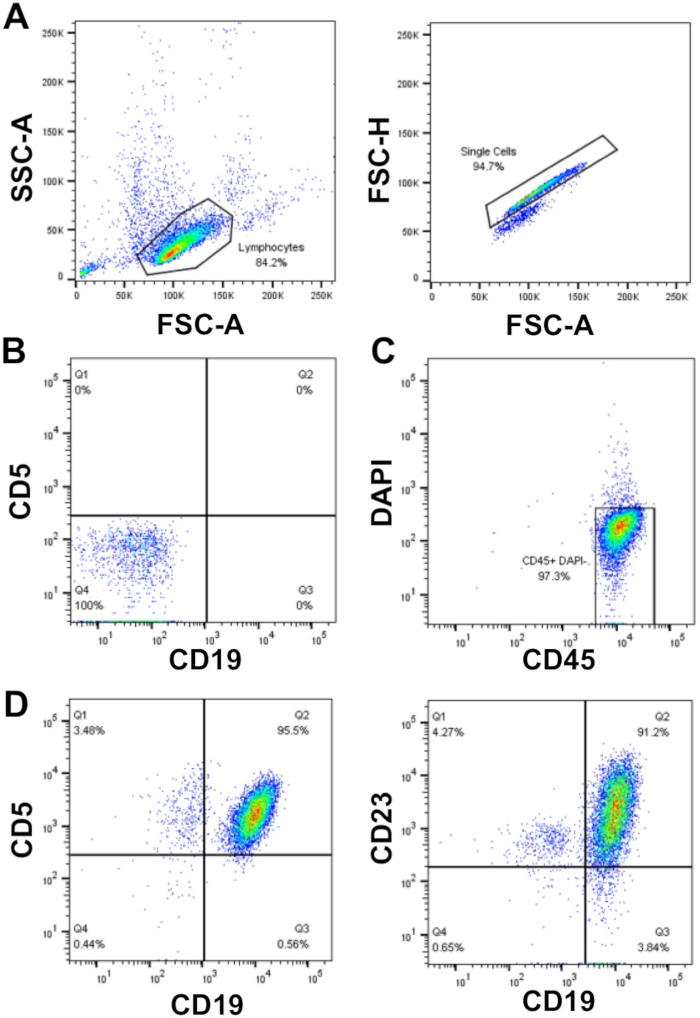
الشكل 1: رسم بياني لتحليل التدفق الخلوي لمرضي CLL المخصبين. وكانت الخلايا أحاديه النواة المخصبة من الدم المحيطي من المريض CLL الفردية بوابات باستخدام FSC-A مقابل SSC-a ، والمشككين ثم استبعدت باستخدام Fsc-a مقابل Fsc-H (a). واستخدمت الخلايا غير الملونة (أنبوب 1) وضوابط التعويض (أنابيب 2-6) لاعداد مقياس التدفق الخلوي للكشف عن الخلايا والتعويض بين القناات الفلورية ، التالي ضمان ان الإشارات مضان تم الكشف عنها بشكل صحيح. (ب) مثال علي التلطيخ السلبي (الخلايا غير الملونة ؛ الأنبوب 1) في CD19 و CD5 القناات الفلورية. تم بوابات حيه (DAPI سلبي) و CD45 الخلايا الموجبة (C) ونسبهCD19 +CD5 + (95.5 ٪) وCD19 +CD23 + (91.2%) تم تحديد الخلايا داخل DAPI-CD45 + السكان (د). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 2: تحسين التجزئة النووية/الخلوية. وقد أعدت الكسور الخلوية والنووية ، والخلايا الكاملة (WCL) ، من كريات الخلية (10-20 × 106 خلايا) من خط الخلية Cll (A) MEC1 أو (ب) خلايا cll الاوليه المخصب من الدم المحيطي من المرضي كما هو موضح في الخطوة الثالثة تم تنفيذ الأمثل من التجزئة تحت الخلوية باستخدام مجموعه من نسب المنظفات (1:20 إلى 1:60) عند اعداد الجزء السيتوبلازمي (كما هو موضح في الخطوة 3.4). وكانت العينات الناتجة المناعية وسبرت مع المضادة للامين A/C (النووية) ومكافحه β-الأجسام المضادة (سيتوبلازمي) لتاكيد تجزئه الخلية الناجحة إلى جانب WCL. وتظهر علامات الوزن الجزيئي علي يسار لطخه (M). * يشير إلى ظروف المنظفات الأمثل لتحلل الخلية. (ج) السمية المناعية للكسور النووية والسيتوبلازمية من خلايا MEC1 مع ظروف السيطرة أو العلاج بالمخدرات (8055) في وجود غياب التحفيز (+ أو-bcr المتقاطعة علي التوالي). تم سبر البقع مع المضادة لRbp1 CTD (استنساخ 4H8; الاعتراف الحمض الريبي النيبالي الثاني الوحدة الفرعية B1), المضادة للامين A/C, مكافحه β-الأنابيب أو المضادة لγ-أنابيب (استنساخ GTU-88) الأجسام المضادة, لتحديد الكسور تحت الخلوية. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
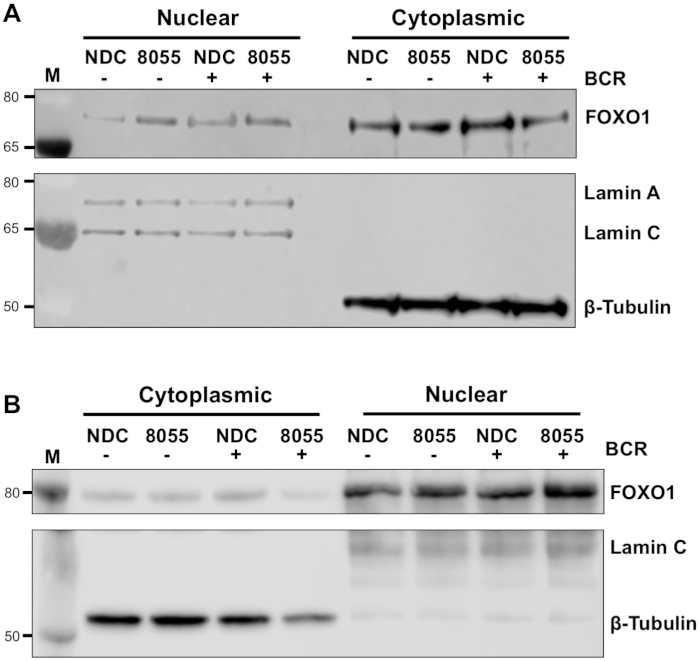
الشكل 3: التجزئة شبه الخلوية يوضح الإغلاق الFOXO1 بين النواة والسيتوتوبلاسما في CLL. (ا) خلايا MEC-1 و (ب) خلايا cll الاوليه عولجت مسبقا لمده 30 دقيقه مع 100 nM AZD8055 (8055) أو تركت دون علاج (التابعة) كما هو مبين ومن ثم تم ligated bcr لمده 1 ساعة أو ترك الولايات الامريكيه. ثم تم اعداد الكسور النووية والسيتوبلازمية والمناعية. بعد تاكيد التجزئة عن طريق السبر مع المضادة للامين A/C (النووية) ومكافحه β-الأجسام المضادة (سيتوبلازمي) ، تم تقييم تاثير كل من العلاج المخدرات وربط BCR علي FOXO1 التعبير البروتين ، وذلك باستخدام الأجسام المضادة لFOXO1. M يشير إلى علامة الوزن الجزيئي. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
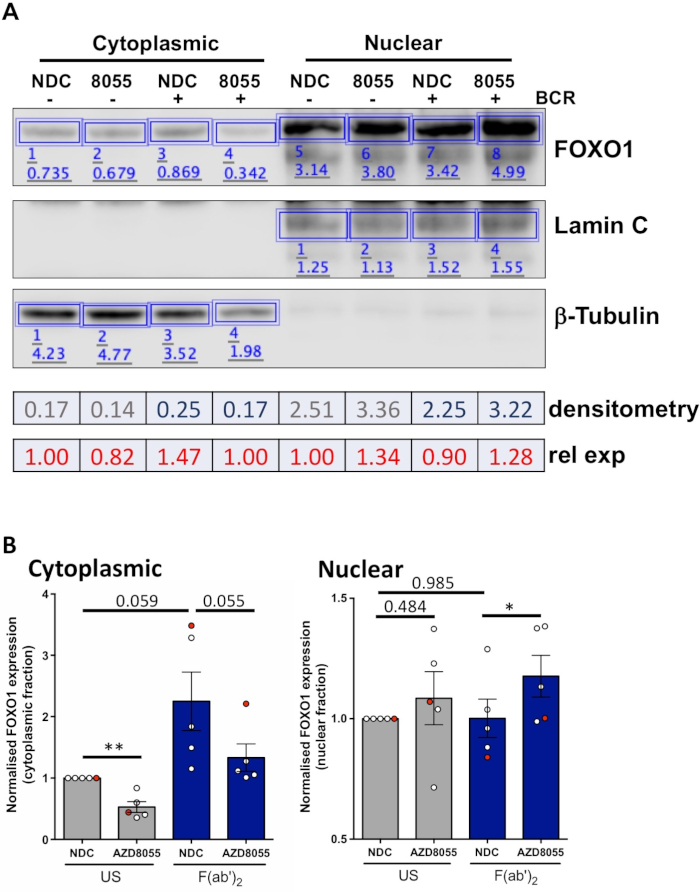
الشكل 4: مثال عملي للتحليل الكمي للطخه الغربية (قياس الكثافة). (ا) تم اجراء قياس الكثافة باستخدام برامجيات تحليل الوصمات الغربية المتاحة علي الإنترنت. لفتره وجيزة ، داخل شريط التحليل ، تم رسم المستطيلات حول عصابات البروتين في الصورة لحساب كثافة الاشاره. يصور هو قياس الكثافة من صوره لطخه الغربية تمثيليه من عينه المريض CLL التي خضعت لتفتيت الخلوية/النووية. وتتميز الكسور الخلوية والنووية بالتعبير عن علامات السيتوبلازمي (β-توبين) والنووية (Lamin A/C). يمكن حساب التعبير الذي تم تطبيعه لFOXO1 لحاله معينه عن طريق قسمه الاشاره التي تم الحصول عليها ل FOXO1 بواسطة الاشاره المقابلة ل β-توبين أو Lamin A/C ، اعتمادا علي الكسر الذي يتم تحليله. النسبية FOXO1 التعبير (بالنسبة للسيطرة علي المركبات الولايات الامريكيه) ، يمكن حسابها عن طريق تقسيم تطبيع FOXO1 التعبير عن شرط معين من قبل التعبير FOXO1 تطبيع من السيطرة علي المركبات الامريكيه من كسر الخلوية معينه. (ب) الرسم البياني الذي يظهر مستويات التعبير FOXO1 في الكسور الخلوية (اليسرى) أو النووية (اليمني) التي تم تطبيعها مع السيطرة الامريكيه-التابعة لكل جزء من أجزاء الخلية. النقطة الحمراء علي الرسم البياني هو مثال العمل المعروض. تظهر هذه البيانات متوسط التغير في التعبير FOXO1 بالمقارنة مع الولايات الامريكيه-الشركة العامة التي تم تحديد قيم P من قبل ثنائي الذيل الطلاب الاقران اختبار t . n = 5 عينات المريض CLL الفردية. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
Discussion
ويوفر البروتوكول الموصوف طريقه سريعة وفعاله لتوليد الكسور النووية والسيتوبلازمية من خلايا CLL الاوليه ، والكمية اللاحقة من الاتجار بالبروتين بين الكسور النووية والجزيئات الخلوية عند تحفيز الخلايا والعلاج بالمخدرات. وتبين البيانات المقدمة القدرة علي الكشف عن الاتجار بالبروتينات المحددة ، علي سبيل المثال ، FOXO1 ، بين الكسور النووية والجزيئات السيتوبلازمية ، عند المعالجة بمثبط ثنائي mTOR AZD8055 في وجود/غياب التقاطع BCR من خلال F ( ab ')2 التحفيز جزء (الشكل 3 والشكل 4). اقتران هذه التجارب مع القياس الكمي من البقع الغربية من عينات المريض CLL الفردية ، وتمكن التحليلات الموضوعية للبيانات المتولدة ويوضح متانة الفحص الموصوفة لتحديد التغيرات العالمية في توطين البروتين في خلايا CLL معزولة عن أفواج المرضي (الشكل 4). ومن الواضح من البيانات ان متوسط خمس عينات من المرضي في الكسور السيتوبلازمية وصلت بالقرب من الاهميه. النظر إلى التغاير السريري لمرضي CLL11، فان هذه التحاليل عاده ما يتم اجراؤها علي المجموعات الأكبر من المرضي ، و/أو تركز علي مجموعات فرعيه نذير محدده للمرضي للحصول علي فهم اوفي للاستجابة الخلوية من cll خلايا لعلاجات المخدرات المحددة.
البيانات المقدمة تثبت اهميه اختيار علامات البروتين التي تعيش حصرا في الكسور الخلوية أو النووية ، كما سيتم تاكيد نقاء تجزئه من قبل هذه العلامات. تم اختيار β-الأنابيب لتاكيد الكسر سيتوبلازمي ، ولامين A/C كعلامة النووية. البروتينات الاضافيه التي يشيع استخدامها هي الفجوة و α-الأنابيب لتحديد الجزء السيتوبلازمي أو Brg1 (SMARCA4) ، tfiid والحمض النووي الريبي الثاني لنقاء الكسر الذري4،5. ومع ذلك ، يجب توخي الحذر عند اختيار البروتينات التي يتم تخصيبها بشكل كبير في كسور معينه ، وليست موجودة في كلا الكسور (علي سبيل المثال ، γ) (الشكل 2ج)9. وفي الواقع ، فانه في حين تعتبر البروتينات السيتوبلازمية والمثبطة للخلايا الخلوية بشكل عام قادره علي التوطين في النواة12،13، فانها تسلط الضوء علي اهميه اختيار علامة كسر لا تنتقل عند التحفيز أو العلاج تطبيقها علي الخلايا. علاوة علي ذلك ، من المهم التاكد من ان علامة البروتين المختارة يتم التعبير عنها في خليه الاهتمام عن طريق تشغيل WCL إلى جانب التجزئة تحت الخلوي.
وفي التجربة التمثيلية المبينة ، استخدم نفس العدد من خلايا CLL لكل حاله (التحفيز/العلاج بالعقاقير) ، وبعد ذلك أعدت عينات التجزئة علي الفور. تحميل 10 ميكروغرام من البروتين المجزا/حاره يوفر المواد الكافية للكشف عن البروتينات من الفائدة. ونظرا لان هذه العينات خضعت فقط لعلاج المخدرات علي المدى القصير والتحفيز (حتى 4 ساعات) ، فقد افترض ان مستوي البروتين سيبقي كما هو في كل عينه ، ولم يتم اجراء فحص البروتين. ومع ذلك ، إذا تم تمديد العلاجات الخلوية (18-72 h) ، فان مستوي موت الخلايا أو الانتشار في الخلايا قد يغير بشكل كبير من نوعيه وكميه البروتين المستخرج ، ويعتمد علي تحفيز الدواء/الخلية المطبق ، التالي تغيير مستويات البروتين في المعالجة /العينات المحفزة. في هذه الحالات لعلاج المخدرات علي المدى الطويل ، فانه من المستحسن لتنفيذ الكمية البروتين باستخدام المقايسة برادفورد أو ما يعادلها ، قبل التنقيط الغربية لضمان يتم تشغيل نفس الكمية من البروتين في كل حاره من المناعة. وجود المنظفات قد تتداخل مع اختبارات البروتين المحددة14، ويمكن تقليل هذا التداخل عن طريق تمييع عينات البروتين جزء الخلية. الاضافه إلى ذلك ، استخدم المخزن المؤقت تحلل كامله كالفارغة ، باستخدام نفس التخفيف كما هو الحال في العينات التي يتم اختبارها.
لتقديم الادله الداعمة للنتائج الموصوفة هنا ، يمكن اجراء تجارب موازيه باستخدام المجهر الفلوري لتحليل موقع FOXO1 داخل خلايا CLL لتمكين تصور هذه النتائج5. وعلاوة علي ذلك ، يمكن أيضا استخدام الكسور الخلوية التي تم إنشاؤها لاختبارات نشاط الانزيم أو تحليل البروتينات في التحاليل اللاحقة.
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
ويود المؤلفون ان يشكروا الدكتورة ناتاشا مالك علي مراجعتها النقدية لهذه المخطوطة. تم تمويل هذه الدراسة من قبل منحه المشروع الدموي منحت إلى AMM (18003). وقامت مؤسسه حوات بتمويل مرافق التحليل الخاصة بهذه المراكز. تم تمويل MWM من قبل دكتوراه في الدراسة من أصدقاء بول O'Gorman مركز أبحاث سرطان الدم, وقد تم تمويل JC من قبل مركز أبحاث اللوكيميا أصدقاء بول O'Gorman وتم تمويل JH من قبل منحه المشروع الدموي (18003).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge Tubes | Griener Bio one | 616201 | |
| 3 mL Pasteur Pipettes | Griener Bio one | 612398 | |
| 12 mm x 75 mm FACS Tubes | Elkay | 2052-004 | |
| 15 mL Tube | Griener Bio one | 188271 | |
| 50 mL Tube | Griener Bio one | 227261 | |
| anti-CD5 FITC antibody | BD Biosciences | 555352 | phenotypic surface marker |
| anti-CD19 PE Cy7 antibody | BD Biosciences | 557835 | phenotypic surface marker |
| anti-CD23 APC antibody | BD Biosciences | 558690 | phenotypic surface marker |
| anti-CD45 APC Cy7 antibody | BD Biosciences | 557833 | phenotypic surface marker |
| anti-β-Tubulin antibody | Cell Signaling | 2146 | cytoplasmic marker |
| anti-γ-Tubulin Mouse antibody (clone GTU-88) | Sigma-Aldrich | T5326 | |
| anti-FoxO1 (C29H4) Rabbit antibody | Cell Signaling | 2880 | |
| anti-Lamin A/C antibody | Cell Signaling | 2032 | nuclear marker |
| anti-mouse IgG, HRP-linked Antibody | Cell Signaling | 7076 | Secondary antibody |
| anti-rabbit IgG, HRP-linked Antibody | Cell Signaling | 7074 | Secondary antibody |
| anti-Rpb1 CTD antibody (clone 4H8) | Cell Signaling | 2629 | nuclear marker |
| BDFACS Canto II | BD Biosciences | By Request | Flow Cytometer |
| DAPI Solution | BD Biosciences | 564907 | live/dead discriminator |
| DMSO | Sigma | D2650 | |
| EDTA | Sigma | EDS | |
| Fetal Bovine Serum | Thermofisher | 10500064 | |
| GraphPad Prism 6 | GraphPad Software | Software | |
| Histopaque1077 density gradient media | Sigma | H8889 | |
| HyperPAGE 10 - 190 kDa protein marker | Bioline | BIO-33066 | Molecular weight marker |
| Image Studio Lite (version 5.2.5) | LI-COR | www.licor.com | Software |
| Labnet VX100 | Fisher Scientific | Vortex | |
| Nucelar Extract Kit | Active Motif | 40010 | |
| OneComp eBeads | Thermofisher | 01-111-42 | |
| Trypan Blue Solution | Thermofisher | 15250061 | |
| PageRuler Plus Prestained Protein Ladder | Thermo Fisher Scientific | 26619 | Molecular weight marker |
| PBS Tablets | Fisher Scientific | BR0014G | |
| RosetteSep Human B Cell Enrichment Cocktail | Stem Cell Technologies | 15064 | |
| Sigma 3-16P | SciQuip | Centrifuge | |
| Sigma 1-15PK | SciQuip | Centrifuge |
References
- Kau, T. R., Way, J. C., Silver, P. A. Nuclear transport and cancer: from mechanism to intervention. Nature Reviews Cancer. 4, 106-117 (2004).
- Turner, J. G., Dawson, J., Sullivan, D. M. Nuclear export of proteins and drug resistance in cancer. Biochemical Pharmacology. 83, 1021-1032 (2012).
- Nakamura, N., et al. Forkhead transcription factors are critical effectors of cell death and cell cycle arrest downstream of PTEN. Molecular and Cellular Biology. 20, 8969-8982 (2000).
- Calnan, D. R., Brunet, A. The FoxO code. Oncogene. 27, 2276-2288 (2008).
- Cosimo, E., et al. AKT/mTORC2 inhibition activates FOXO1 function in CLL cells reducing B cell receptor-mediated survival. Clinical Cancer Research. 25, 1574-1587 (2019).
- Mahipal, A., Malafa, M. Importins and exportins as therapeutic targets in cancer. Pharmacology & Therapeutics. 164, 135-143 (2016).
- Hing, Z. A., et al. Next-generation XPO1 inhibitor shows improved efficacy and in vivo tolerability in hematological malignancies. Leukemia. 30, 2364-2372 (2016).
- Lapalombella, R., et al. Selective inhibitors of nuclear export show that CRM1/XPO1 is a target in chronic lymphocytic leukemia. Blood. 120, 4621-4634 (2012).
- Hořejší, B., et al. Nuclear γ-tubulin associates with nucleoli and interacts with tumor suppressor protein C53. Journal of Cellular Physiology. 227, 367-382 (2012).
- McCaig, A. M., Cosimo, E., Leach, M. T., Michie, A. M. Dasatinib inhibits B cell receptor signalling in chronic lymphocytic leukaemia but novel combination approaches are required to overcome additional pro-survival microenvironmental signals. British Journal of Haematology. 153, 199-211 (2011).
- Fischer, K., Hallek, M. Optimizing frontline therapy of CLL based on clinical and biological factors. Hematology. American Society of Hematology. Education Program. 2017, 338-345 (2017).
- Butera, G., et al. Regulation of autophagy by nuclear GAPDH and its aggregates in cancer and neurodegenerative disorders. International Journal of Molecular Sciences. 20, 2062 (2019).
- Virtanen, J. A., Vartiainen, M. K. Diverse functions for different forms of nuclear actin. Current Opinion in Cell Biology. 46, 33-38 (2017).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178, 263-268 (1989).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved