Method Article
Субклеточная фракция первичных клеток хронического лимфоцитарного лейкоза для мониторинга торговли ядерным/цитоплазмическим ибелением
В этой статье
Резюме
Этот протокол позволяет оптимизировать и последующее эффективное производство ядерных и цитоплазмозных фракций из первичных клеток хронического лимфоцитарного лейкоза. Эти образцы используются для определения локализации белка, а также изменений в торговле белками, которые происходят между ядерными и цитоплазматическими отсеками при стимуляции клеток и лечении наркоманией.
Аннотация
Ядерный экспорт макромолекулов часто дерегулирован в раковых клетках. Белки супрессора опухоли, такие как p53, могут быть неактивны из-за аномарной клеточной локализации, нарушающей их механизм действия. Выживанию клеток хронического лимфоцитарного лейкоза (ХЛЛ), среди других раковых клеток, способствует дерегулирование ядерного к цитоплазматического челнока, по крайней мере частично за счет дерегулирования транспортного рецептора XPO1 и составной активации PI3K-опосредованного сигнальных путей. Важно понимать роль отдельных белков в контексте их внутриклеточного расположения, чтобы получить более глубокое понимание роли таких белков в патобиологии болезни. Кроме того, выявление процессов, лежащих в основе стимуляции клеток, и механизма действия конкретных фармакологических ингибиторов в контексте субклеточного оборота белка, обеспечит более полное понимание механизма Действий. Описанный здесь протокол позволяет проводить оптимизацию и последующее эффективное производство ядерных и цитоплазмозных фракций из первичных клеток хронического лимфоцитарного лейкоза. Эти фракции могут быть использованы для определения изменений в торговле белками между ядерными и цитоплазматическими фракциями при стимуляции клеток и лечении наркомании. Данные могут быть количественно и представлены параллельно с иммунофлуоресцентными изображениями, обеспечивая тем самым надежные и поддающиеся количественной оценке данные.
Введение
Транспортировка макромолекулы между ядром и цитоплазмой уже давно создана, чтобы играть ключевую роль в нормальной клеточной функции и часто дерегулированы в раковых клетках1,2. Такое дерегулирование может быть результатом переэкспрессии/мутации белков, контролирующих ядерный экспорт. Один из таких белков Exportin-1 (XPO1), является транспортным рецептором, который экспортирует сигнал ядерного экспорта (NES)-содержащий белки в цитоплазму из ядра2. XPO1-грузы включают p53, члены семьи FOXO и IB, способствуя их инактивации, подавляя их механизм действия1,2,3. Дальнейшая мизанализация белка может произойти, когда микроэкологические сигналы посягают на раковые клетки, что приводит к активации внутриклеточных сигнальных путей, таких как фосфатидиил-инозитол-3-киназа (PI3K)/Акт пути, в результате чего инактивация членов семьи FOXO и последующий экспорт из ядра4,5. Такая мизанализация белков супрессоров опухолей была вовлечена в прогрессирование ряда гематологических и твердых опухолей1,2,6.
Развитие малых молекулных ингибиторов для клинического применения в гематологических злокачественных новообразованиях (острый миелоидный лейкоз (AML)/CLL), которые связываются и избирательно подавляют функцию XPO1, подчеркивает важность разработки соответствующих методов для решения влияние фармакологических агентов на челночные белки между ядерными и цитоплазматическими отсеками6,7,8. Методы визуализации значительно позволили идентифицировать белки в субклеточных отсеках при внешней стимуляции лекарственного лечения, однако важность надежных и поддерживающих параллельных методов имеет решающее значение для надежного информировать научную аудиторию о достоверности результата.
Отдых лимфоцитов и злокачественных клеток CLL-B, изолированных из образцов крови пациента представляют собой проблему в поколении ядерных и цитоплазмических фракций из-за высокого ядерного: цитоплазматическое соотношение. Оптимизация экспериментальных условий для получения надежных и надежных экспериментальных данных, конечно, имеет решающее значение для планирования будущих экспериментальных программ. Описанный здесь метод позволяет количественно очислить белки в ядерных и цитоплазмических фракциях и определяет, как на эти белки может повлиять клеточная стимуляция и/или медикаментозное лечение.
протокол
Использование первичных образцов от пациентов CLL, описанных здесь, было одобрено Службой этики Исследований Запада Шотландии, ГСЗ Большого Глазго и Клайда (Великобритания), и вся работа была проведена в соответствии с утвержденными руководящими принципами.
1. Изоляция клеток ХЛЛ от образцов крови пациента
-
Образцы периферийной крови у ранее согласованных пациентов СЛЛ поступают из клиники в трубках для сбора крови ЭДТА в сопровождении количества белых клеток (WCC). Очистка периферической крови CLL образцов в соответствии с WCC. Для WCC злт; 40 х 106 ячеек/мл, перейдите к шагу 1.1.1; для WCC 40 x 106 ячеек/мл, приступай к шагу 1.1.2.
- Налейте содержимое всех трубок крови EDTA в 50 мл конической центрифуги трубки и добавить 50 зл человека B коктейль для обогащения клеток на 1 мл крови. Инкубировать при комнатной температуре (RT) в течение 20 мин. Приступить к шагу 1.1.2.
- Разбавить образец в соотношении 1:1 с буфером для мытья RT CLL (фосфат-буферный салин (PBS), 0,5% Фетальная сыворотка крупного рогатого скота (FBS) и 2 мМ EDTA).
- Аликвот RT плотность градиента средств массовой информации в соответствующих размерах конической центрифуги трубки для образца (10 мл в 50 мл трубки для 30 мл образца или 4 мл в 15 мл трубки для 10 мл образца).
- Тщательно слой образца на верхней части плотности градиента средств массовой информации и центрифуги на 400 х г в течение 30 минут на RT.
ПРИМЕЧАНИЕ: Убедитесь, что центрифуга находится на RT до того, как образцы помещаются в центрифугу, так как изменение температуры приведет к плохому обогащению моноядерных ячеек, и выключите тормоз на центрифуге, так как внезапное торможение может нарушить жидкий интерфейс. - Аккуратно соберите белый слой моноядерных элементов, которые собирают на стыке градиентных носителей плотности и буфера для мытья CLL, в свежую коническую центрифугу мощностью 50 мл с помощью пластиковой пипетки Pasteur.
- Добавьте 40 мл буфера для мытья CLL в изолированный монослой для мытья клеток и центрифуги при 300 х г в течение 10 минут на РТ.
- Отбросьте супернатант, отостановите гранулы, щелкнув в нижней части трубки, а затем повторите шаг стирки, описанный в шаге 1.5.
- Откажитесь от супернатанта, отостановите гранулы, описанные в шаге 1.6, затем приостановите гранулы в определенном объеме буфера для мытья CLL (до 40 мл, в зависимости от размера клеточного гранулы).
- Подсчитайте клетки с помощью трипан синий и гемоцитометр. Затем приступайте к потоку цитометрии, чтобы проверить чистоту клеток ХЛЛ.
ПРИМЕЧАНИЕ: На этом этапе клетки ХЛЛ могут быть культивированы в концентрации 10 х 106 клеток/мл в носителях, которые будут использоваться в экспериментах, и/или криоконсервированы в 10% диметилсулькоксида (DMSO)/FBS для будущей работы в концентрациях до 100 х 106 клеток/флая.
2. Поток цитометрии клеток ХЛЛ
- Этикетка 12 мм х 75 мм круглые нижней произронные трубки полистирола, как описано в таблице 1.
- В трубках 2 - 5, положить одну каплю компенсации бусы и хранить на льду. Добавьте 1 qL соответствующего антитела (анти-CD5, CD19, CD23 или CD45, как указано в таблице 1) к трубам 2 - 5, и инкубируйте на льду в течение 20 минут, защищенного от света, поместив фольгу на ведро со льдом.
ПРИМЕЧАНИЕ: Эти трубки служат в качестве компенсационного контроля для настройки шаблона цитометрии потока. -
Положите до 1 х 106 CLL клеток в трубки 1, 6 и 7, добавить 2 мл буфера FACS (PBS 2% FBS) к каждой трубке и центрифуги на 300 х г в течение 5 минут на RT, чтобы мыть клетки. Откажитесь от супернатанта и храните трубки, содержащие клеточные гранулы на льду.
- Resuspend клеточных гранул и добавить соответствующее сочетание антител к клеткам в трубке 7, как указано в таблице 1, в окончательном объеме 100 Зл с буфером FACS. Антитела используются в соответствующей концентрации в соответствии с руководящими принципами производителя.
- Приостановите действие клеточных гранул в трубках 2 и 6 в 100 л буфера FACS.
- Инкубировать клетки на льду, наряду с окрашенными бусинами в трубках 2 - 5, защищенных от света в течение 20 мин.
- После инкубации добавьте 2 мл буфера FACS во все трубки и центрифугу при 300 х г в течение 5 мин на РТ для мытья клеток. Откажитесь от супернатанта и отбросите бисовые/клеточные гранулы, нежно щелкая трубками.
- Приостанавливать трубки 1 - 5 в 100 л буфера FACS и поместите на лед до готовности к анализу на цитометр потока.
- Разбавить раствор DAPI до 0,05-0,2 мкг/мл в буфере FACS непосредственно перед использованием. Оптимальная концентрация может варьироваться, и титрование рекомендуется.
- Приостановите трубки 6 и 7 со 100 зл и сажет раствором DAPI и инкубировать трубки на льду в течение как минимум 5 мин, чтобы позволить клеткам испачкать.
ПРИМЕЧАНИЕ: Дальнейшая стирка не требуется, так как DAPI должен присутствовать в буфере, чтобы мертвые ячейки оставались помеченными. После добавления DAPI клетки должны быть проанализированы на цитометре потока в пределах 4 ч. - Анализировать клетки с помощью цитометра потока.
3. Подготовка субклеточных фракций из клеток ХЛЛ
ПРИМЕЧАНИЕ: При планировании экспериментальной настройки, включают в себя колодец нестимулированных / необработанных клеток, из которых весь экстракт клетки могут быть получены.
- Выполните желаемую стимуляцию и/или медикаментозное лечение клеточной линии MEC1 CLL или изолированными первичными клетками ХЛЛ с использованием 10 - 20 х 106 клеток/условия. Клетки будут затем использоваться для субклеточной фракционации (шаги 3,4 и 3,5) или для генерации экстракта цельной клетки (шаг 3.6).
- Подготовка растворов/труб: Подготовьте все растворы/буферы только в день фракционирования, до сбора клеток. Храните растворы на льду до тех пор, пока не потребуется и использовать в течение 4 ч подготовки.
- Раствор ингибитора PBS/фосфатазы: Подготовьте ингибиторы фосфатазы в PBS путем разбавления ингибиторов фосфатазы 1:20 в 1x PBS (т.е. 0,5 мл ингибиторов фосфатазы в 9,5 мл 1x PBS).
ПРИМЕЧАНИЕ: Убедитесь, что ингибиторы фосфатазы не осаждались. Если осадок присутствует, нагрейте до 50 градусов по Цельсию в течение 10 мин. - Гипотонический буфер: Подготовка 1x гипотонический буфер, сделав 1:10 разбавления 10x гипотонический буфер в дистиллированной воде (т.е., 50 л 10x гипотонический буфер в 450 л dH2O).
- 10 мМ дитиотрейтол (DTT): Подготовка 10 мМ DTT, сделав 1:100 разбавления 1М DTT с дистиллированной водой (т.е., 10 л 1 М DTT в 990 л dH2O).
ПРИМЕЧАНИЕ: DTT очень лабильный поэтому подготовить это свежее каждый раз. Избегайте повторных циклов замораживания/оттепели. - Полный буфер лиза: Определите, сколько буфера требуется для каждого эксперимента. Каждый образец требует 50 qL полного буфера лиза, поэтому добавьте 5 qL 10 mM DTT (шаг 3.2.3) к 44.5 qL буфера lysis и после этого добавьте 0.5 qL коктейля ингибитора протеазы. Эта сумма может быть уменьшена в зависимости от количества образцов в эксперименте.
- Этикетка четыре набора 1,5 мл микрофуговых труб для каждой стимуляции и / или медикаментозного лечения для свежестимулируемых клеток (шаг 3.3), свежегенерированных цитоплазмических фракций (шаг 3.4.3), свежесгенератых ядерных фракций (шаг 3.5.3), и всей клетки лисаты (шаг 3.6.3). Предварительно охладить эти микрофуги трубки на льду до тех пор, пока требуется.
- Раствор ингибитора PBS/фосфатазы: Подготовьте ингибиторы фосфатазы в PBS путем разбавления ингибиторов фосфатазы 1:20 в 1x PBS (т.е. 0,5 мл ингибиторов фосфатазы в 9,5 мл 1x PBS).
- Перенесите клетки в индивидуально помеченные микрофуговых трубки 1,5 мл и гранулы центрифугипригана при 200 х г в течение 5 мин при 4 градусах Цельсия. Удалить супернатант и повторного захвата клеток в 1 мл ледяных ингибиторов PBS/фосфатазы (шаг 3.2.1). Пелле клетки центрифугации при 200 х г в течение 5 мин при 4 градусах Цельсия. Удалите супернатант и держите клеточные гранулы на льду.
- Препарат цитоплазмических фракций: Аккуратно приостановите работу клеточных гранул, которые будут использоваться для субклеточной фракционации в 50 Зл 1x гипотонического буфера (шаг 3.2.2). Инкубировать клетки на льду в течение 15 минут, чтобы клетки набухают.
ПРИМЕЧАНИЕ: Объем используемого гипотонического буфера может быть увеличен эмпирически в зависимости от числа клеток.- Добавьте в каждый образец 0,8 - 2,5 л (1:20- до 1:60) моющего средства и вихря на самом высоком уровне для 10 с.
- Для определения оптимальной концентрации моющего средства для использования для определенного типа клеток для изоляции ядерных и цитоплазмических фракций, выполните градиент моющего средства на начальном этапе. Диапазон от 1:20 до 1:60 (т.е. от 2,5 до 0,8 л моющего средства в 50 л гипотонического буфера) должен быть адекватным.
ПРИМЕЧАНИЕ: Если объем гипотонического буфера в шаге 3.4 корректируется, убедитесь, что соответствующее соотношение моющих средств сохраняется. - Проверить лиза клетки, наблюдая клетки с помощью фазового контрастного микроскопа до и после добавления моющего средства. Целые клетки кажутся больше с плотным, темным ядром. Цитоплазма будет выглядеть как яркий ореол вокруг ядра.
ПРИМЕЧАНИЕ: Соответствующий лисис также подтверждается с помощью западного промотирования для анализа конкретных белков в лисизированных фракциях, генерируемых из градиента моющего средства.
- Для определения оптимальной концентрации моющего средства для использования для определенного типа клеток для изоляции ядерных и цитоплазмических фракций, выполните градиент моющего средства на начальном этапе. Диапазон от 1:20 до 1:60 (т.е. от 2,5 до 0,8 л моющего средства в 50 л гипотонического буфера) должен быть адекватным.
- После того, как лисича, центрифуга образцов на 14000 х г на 30 с при 4 градусах Цельсия.
- Тщательно перенесите супернатант в предварительно охлажденный, помеченный микрофугтрубкой. Эта цитоплазмическая фракция может храниться при -80 градусах Цельсия до тех пор, пока не потребуется для дальнейшего анализа. Оставшийся гранулы содержат ядерную фракцию (шаг 3.5).
ПРИМЕЧАНИЕ: Избегайте повторных циклов замораживания/оттепели образцов.
- Добавьте в каждый образец 0,8 - 2,5 л (1:20- до 1:60) моющего средства и вихря на самом высоком уровне для 10 с.
- Подготовка ядерных фракций: Приготовь каждую ядерную гранулу в 50 qL полного буфера лисиса (шаг 3.2.4) путем пайпетирования вверх и вниз.
ПРИМЕЧАНИЕ: Объем полного буфера лиза может быть скорректирован эмпирически в зависимости от исходного числа ячейки.- Добавьте 2,5 л моющего средства для растворительизации белков, связанных с ядерной мембраной, и вихря на самом высоком уровне для 10 с. Инкубировать образцы на льду в течение 30 мин.
- Вихрь на самом высоком уровне для 30 с, затем центрифуга образцов на 14000 х г в течение 20 минут при 4 c.
- Перенесите супернатант в предварительно охлажденный, помеченный микрофуговной трубкой. Эта ядерная фракция может храниться при -80 градусах Цельсия до тех пор, пока не потребуется для дальнейшего анализа.
ПРИМЕЧАНИЕ: Избегайте повторных циклов замораживания/оттепели образцов.
- Приготовление цельных клеточных лисатов (WCL) из клеток CLL
ПРИМЕЧАНИЕ: Подготовка всего клеточного экстракта может осуществляться одновременно с подготовкой ядерных фракций (шаг 3.5).- Resuspend весь экстракт клетки гранулы в 100 л полного буфера лиза (подготовлен в шаге 3.2.4) путем pipetting вверх и вниз, а затем добавить 5 зл моющего средства для обеспечения полного лиза клетки. Инкубировать образцы на льду в течение 30 мин.
- Вихрь на самом высоком уровне для 30 с, затем центрифуга образцов на 14000 х г в течение 20 минут при 4 c.
- Перенесите супернатант в предварительно охлажденный микрофугую трубку. Весь этот клеточный лизат может храниться при -80 градусов по Цельсию до тех пор, пока не потребуется для дальнейшего анализа.
ПРИМЕЧАНИЕ: Избегайте повторных циклов замораживания/оттепели образцов.
4. Анализ субклеточных фракций ниже по течению
ПРИМЕЧАНИЕ: В этом протоколе анализ генерируемых клеточных фракций проводился западными промотированием с помощью стандартных протоколов, загружая равные номера клеток/полосу (эквивалент 10 мкг белка) на ядерные и цитоплазматические фракции.
- Количественная оценка оборота белка между ядерными и цитоплазмическими фракциями: Выполняйте количественный анализ западной подевой с помощью количественной оценки интенсивности сигнала, или денситометрии, используя свободно доступное программное обеспечение для анализа посылок Запада.
- Импорт изображений: Западные изображения помот, генерируемые из различных развивающихся инструментов, должны импортироваться в виде файлов JPG, PNG или TIFF. Рекомендуется 16-битный файл RAW глубины. Чтобы импортировать изображение, щелкните значок программного обеспечения и нависнете над импортом. Затем нажмите на изображения сторонних групп. Выберите файл изображения и нажмите Open.
- Отображение изображения: В ленте изображения нажмите на кнопку «Выбрать» в группе Display. Диалог Настройки дисплея откроется для включения дальнейших корректировок в случае необходимости. Реализация дополнительных улучшений, включая яркость или контрастность, используя регулируемые ползунки на вкладке Image LUTs. Используйте вкладку Кривые для более тонкой корректировки.
- Анализ данных (отбор каналов): Нажмите ленту Анализа. Для анализа только одного канала, отменить канал (ы) не анализируется. Нажмите на эскиз канала Don't Show Channel в image LUTs, оставляя отображатьтолько только нужный канал. Изображения, импортируемые в виде файлов JPG, PNG или TIFF, могут потребовать отмены нескольких нежелательных каналов RGB.
-
Добавление фигур: Чтобы количественно определить интенсивность сигнала, щелкните Добавить rectangle, чтобы добавить прямоугольник к изображению. Нажмите на центр функции (например, белковая полоса), чтобы разместить прямоугольник вокруг него. Кроме того, чтобы вручную нарисовать фигуру, выберите Draw Rectangle. После добавления всех желаемых форм нажмите Select, чтобы вернуть курсор в инструмент выбора.
ПРИМЕЧАНИЕ: Добавьте несколько фигур в логическом порядке, так как данные сортируются по идентификационному номеру, который генерируется последовательно. -
Фоновое вычитание: Чтобы вычесть фоновый шум, нажмите первую кнопку в фоновой группе и выберите Median из выпадающего меню. Установите ширину границы до 3 в фоновом диалоге и выберите сегменты, которые будут использоваться для расчета фона. При выборе сегментов, которые следует использовать, выберите сегменты, которые лучше всего представляют фон изображения.
ПРИМЕЧАНИЕ: Фоновый шум может повлиять на количествение сигнала, поэтому его необходимо вычесть, чтобы точно рассчитать сигнал из интересных форм. -
Обрезка сигнала и обрезки фона - OPTIONAL: Файлы, импортируемые в форматах JPG, PNG или TIFF, могут проявлять насыщенность пикселей: выделенные/яркие области в белковой полосе. Обрезка сигнала и обрезки фона (Bkgnd) удаляет насыщенные пиксели из анализа. Чтобы просмотреть эти значения, добавьте Trim Signal и Trim Bkgnd в таблицу, нажав на кнопку Колонки справа от представления таблицы.
ПРИМЕЧАНИЕ: Насыщенность пикселей может привести к ненадежной количественной оценке. Насыщенные пиксели могут быть удалены только в том случае, если насыщено менее 5% пикселей в форме.
-
Добавление фигур: Чтобы количественно определить интенсивность сигнала, щелкните Добавить rectangle, чтобы добавить прямоугольник к изображению. Нажмите на центр функции (например, белковая полоса), чтобы разместить прямоугольник вокруг него. Кроме того, чтобы вручную нарисовать фигуру, выберите Draw Rectangle. После добавления всех желаемых форм нажмите Select, чтобы вернуть курсор в инструмент выбора.
- Данные об экспорте: Нажмите на вкладку Формы над таблицей. Для денситометрии требуются значения в столбце Сигнала. Сигнал — это сумма значений интенсивности пикселей (Всего) для формы минус продукт Bkgnd и Области. Нажмите кнопку «Отчет». Нажмите Сохранить Как или запустить таблицу.
Сигнал - Всего - (Bkgnd x Площадь)
ПРИМЕЧАНИЕ: Вкладка форм содержит таблицу количественных значений, включая Signal, Total, Area и Bkgrnd. - Количественная экспрессия белка: В сохраненной таблице, вычислите нормализованное выражение протеина интереса для каждой майны или переменной путем делить полученный Сигнал для протеина интереса Сигналом для соответствуя полосы управления нагрузки протеина.
ПРИМЕЧАНИЕ: Сравнения между количеством нормализованного белка, представляющих интерес, через ядерные и цитоплазматические фракции не могут быть непосредственно сопоставлены из-за различных погрузочных механизмов, используемых для различения ядерных и цитоплазматических фракций. Однако сопоставления в отдельных фракциях, например после лечения наркотиками, являются уместными. - Экспортное изображение для публикации или презентации: Нажмите на вкладку «Изображения», найденную над таблицей, а затем нажмите на изображение, на норежевство. При использовании изображения для слайд-презентации или других цифровых форматов нажмите значок программного обеспечения, нависните над экспортом и нажмите на изображение для цифровых медиа. При необходимости сохраните изображение в виде файла JPG, PNG или TIFF.
Результаты
При планировании экспериментов на первичных клетках ХЛЛ, если анализы требуют большого количества клеток (Nogt;50 x 106 клеток), есть предпочтение использовать свежеизолированные клетки ХЛЛ, а не криоконсервированные клетки, которые требуют оттаивания, однако это не всегда Возможно. Это потому, что процесс замораживания / оттепели может привести к гибели до 50% клеток CLL, хотя это образец зависит. Обогащение клеток ХЛЛ с помощью WCC х 10х10 6/мл с использованием центрифугации плотности, как описано здесь (шаги 1.3 - 1.5) обеспечивает высокое восстановление клеток с высокой чистотой (95%) первичных клеток ХЛЛ. В показанной выборке, WCC 177 x 10 6/мл: из 30 мл крови образца 5 х 109 клеток были восстановлены, что представляет собой выход клеток 94% от общего числа клеток. Анализ этого образца по течению цитометрии показал чистоту клеток CLL в размере 95%, как показано на двойное выражение поверхности маркеров клеток CLL CD19 и CD5 после gating на FSC / SSC, одиночные клетки, которые были DAPI отрицательные (жизнеспособные клетки) (Рисунок 1).
Оптимизация субклеточной фракции проводилась с использованием ряда моющих средств (1:20 к 1:60) при подготовке цитоплазмической фракции (шаг 3,4). После этого были подготовлены ядерные фракции и ВКЛ (шаги 3,5 и 3,6 соответственно). Иммуноблоты были выполнены на результирующих фракциях клеточной линии CLL MEC1(рисунок 2A)и первичных клетках CLL(рисунок 2B). Помарки были исследованы на фракционные маркеры Lamin A/C (ядерный; 74/63 kDa) и к-тубулин (цитоплазматический; 55 kDa) для подтверждения успешной фракционирования клеток. Фракция указывает на то, что оптимальным уровнем моющего средства для клеток MEC1 является разбавление 1:60(рисунок 2А),по сравнению с 1:30 разбавления, оптимальным для первичных клеток ХЛЛ(рисунок 2В),о чем свидетельствует обогащение ядерного белка и отсутствие цитоплазмического белка в фракциях инаоборот. WCLs представляют общий белок и выступают в качестве положительного контроля для антител, используемых для зондирования субклеточных фракций. Важно выбрать подходящие белки в качестве фракционных маркеров: на рисунке 2C показаны иммуноблоты ядерных/цитоплазмических фракций, подготовленных из клеток MEC1, в которых РНК-полимераза II (Rpb1 CTD; 250 kDa) и Lamin A/C были смыты в качестве маркеров ядерные фракции, в то время как З-тубулин и З-тубулин (50 кДа) использовались в качестве цитоплазмических маркеров. Ясно, что К-тубулин обогащается в цитоплазме, однако выражение проявляется в ядре, как показано ранее9.
Как только экспериментальные условия оптимизированы, эксперимент может быть выполнен. В приведенных примерах субклеточная локализация FOXO1 в ядерных и цитоплазмических фракциях была определена при стимуляции клеток с рецептором антигена В-клеток (BCR) при наличии или отсутствии двойного ингибитора mTORC1/2, в клетках MEC1 ( Рисунок 3А) и первичные клетки ХЛЛ(рисунок 3B)5,10. В обоих примерах было достигнуто поколение высокообогащенных ядерных и цитоплазмических фракций, о чем свидетельствует почти исключительное выражение ламина в ядерной фракции и к-тубулина в цитоплазматических фракциях. В обоих типах клеток, экспрессия FOXO1 была уменьшена в цитоплазме после лечения с A'D8055 по сравнению с NDC, сопровождается увеличением экспрессии FOXO1 в ядерном отсеке, демонстрируя тем самым транслокацию белка (Рисунок 3). Для устранения субъективности интерпретации данных отдельные иммуноблоты из пяти первичных образцов ХЛЛ были количественно определены в субклеточных фракциях (шаг 4; Рисунок 4A), используя соответствующие ядерные или цитоплазмемые белки в качестве внутреннего контроля нагрузки для каждого образца, а затем нормализации каждой фракции в нестимулированных (США) нет контроля над наркотиками (NDC) контроля, как указано. Полученный график показывает тенденции движения FOXO1 между ядерными и цитоплазматическими фракциями, при этом АЗД8055 снижает уровни экспрессии FOXO1 в цитоплазме при одновременном увеличении экспрессии в ядре. Кроме того, высота цитоплазмического выражения FOXO1 проявляется при перекрестных перекрестных ссылках BCR.
| Трубки | Название трубки | Клетки/бусы | Антигена | Флюрофор |
| 1 | Неокрашенные | Клетки | Na | Na |
| 2 | Одноместное пятно | Бусины | CD5 | FITC |
| 3 | Одноместное пятно | Бусины | CD19 | PE-Cy7 |
| 4 | Одноместное пятно | Бусины | CD23 | Apc |
| 5 | Одноместное пятно | Бусины | CD45 | APC-Cy7 |
| 6 | Одноместное пятно | Клетки | Жизнеспособность | ДАПИ |
| 7 | CLL Пятно | Клетки | CD5, CD19, CD23, CD45 и жизнеспособность | FITC, PE-Cy7, APC, APC-Cy7 и DAPI |
Таблица 1: Таблица, показывающая идеальный набор пробных трубок, необходимых для цитометрии потока клеток CLL. Каждый эксперимент должен включать в себя все соответствующие элементы управления для точного анализа полученных результатов.
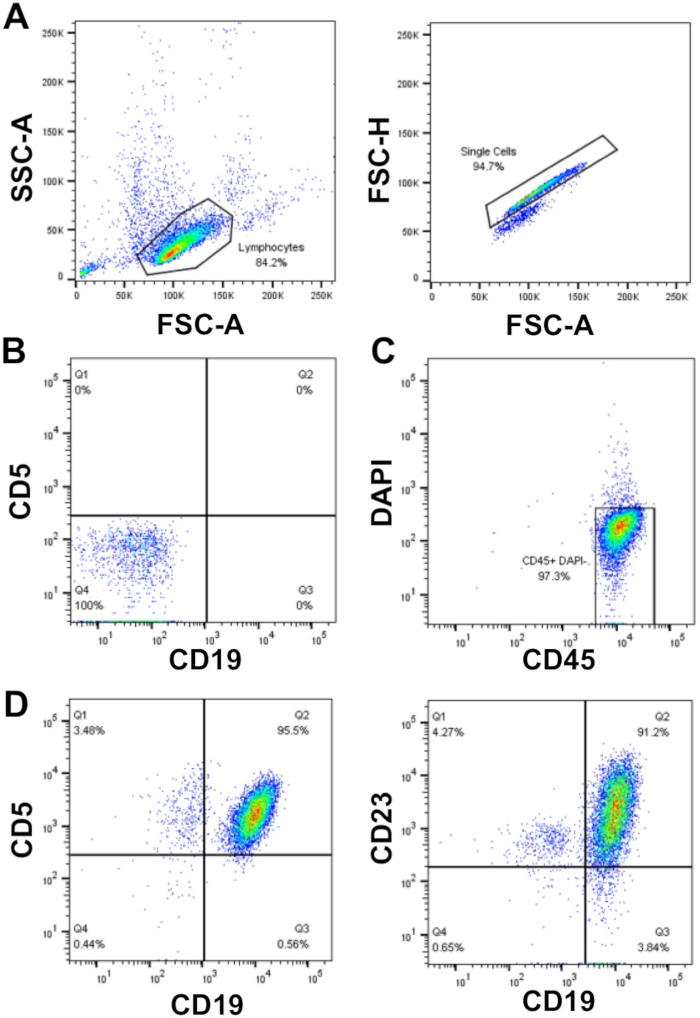
Рисунок 1: Представитель потока цитометрии анализа участка обогащенных пациентов CLL. Моноядерные-CLL клетки обогащены из периферической крови отдельных пациентов CLL были закрыты с помощью FSC-A против SSC-A, и дублеты были затем исключены с помощью FSC-A против FSC-H (A). Неокрашенные клетки (трубка 1) и компенсационный контроль (трубы 2-6) были использованы для настройки цитометра потока для обнаружения клеток и компенсации между флуоресцентными каналами, обеспечивая тем самым правильное обнаружение сигналов флуоресценции. (B) Пример отрицательного окрашивания (неокрашенные клетки; трубка 1) в каналах флуоресценции CD19 и CD5. Live (DAPI отрицательный) и CD45 положительные клетки были закрыты(C) и доля CD19CD5(95,5%) и CD19иCD23 (91,2%) клетки в DAPI-CD45- популяция была определена(D). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Оптимизация ядерной/цитоплазмической фракционации. Цитоплазмические и ядерные фракции, а также целые клеточные лисаты (WCL), были подготовлены из клеточных гранул (10 - 20 х 106 клеток) клеточной линии CLL (A) MEC1 или (B) первичные клетки CLL, обогащенные из периферической крови пациентов, как описано в Шаг 3. Оптимизация субклеточной фракции проводилась с использованием ряда коэффициентов моющих средств (1:20 к 1:60) при подготовке цитоплазмической фракции (как описано в шаге 3.4). Полученные образцы были иммуноблесированы и исследованы анти-ламином A/C (ядерным) и анти-я-тубулином (цитоплазмическим) антителами для подтверждения успешной фракционации клеток наряду с WCL. Молекулярные маркеры веса показаны слева от помарка(M). - указывает оптимальные условия моющего средства для клеточного лиза. (C) Иммуноблот ядерных и цитоплазмических фракций из клеток MEC1 с условиями контроля (NDC) или медикаментозного лечения (8055) при наличии отсутствия стимуляции (я) или - BCR перекрестные соответственно). Помарки были исследованы с антителами антител антител антител против Rbp1 CTD (клон 4H8; распознавание РНК-полимераза II субъединицы B1), анти-ламина A/C, анти-я-тубулина или анти--тубулина (клон GTU-88) антител. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
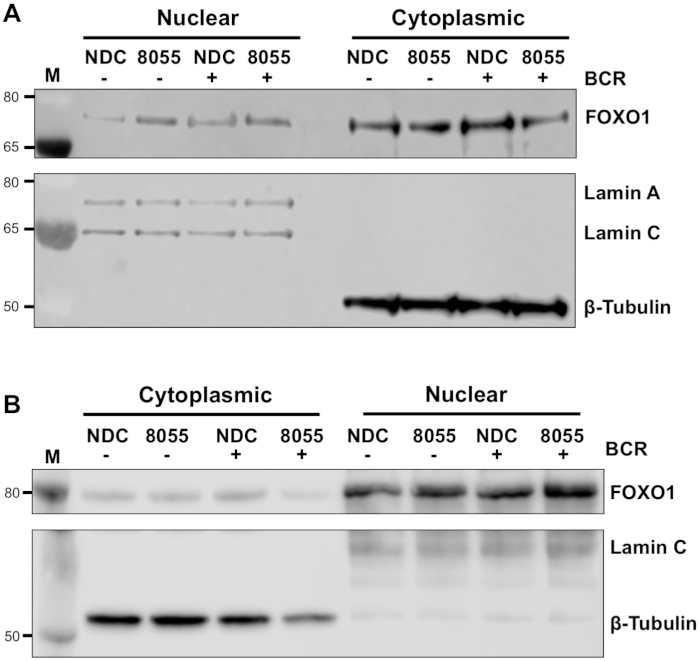
Рисунок 3: Субклеточная фракционация демонстрирует челночный foxO1 между ядром и цитоплазмой в CLL. (A) MEC-1 клетки и (B) первичные клетки CLL были предварительно обработаны в течение 30 мин с 100 нм AD8055 (8055) или не обработанные (NDC), как указано, а затем BCR был ligated в течение 1 ч или покинул США. Затем были подготовлены ядерные и цитоплазматные фракции, которые были ослаблены иммунитетом. После подтверждения фракционирования путем зондирования с анти-ламина A / C (ядерный) и анти-я-тубулин (цитоплазматические) антитела, влияние как медикаментозного лечения и перевязки BCR была оценена на ЭКСПРЕССии белка FOXO1, используя анти-FOXO1 антитела. M указывает на молекулярный маркер веса. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
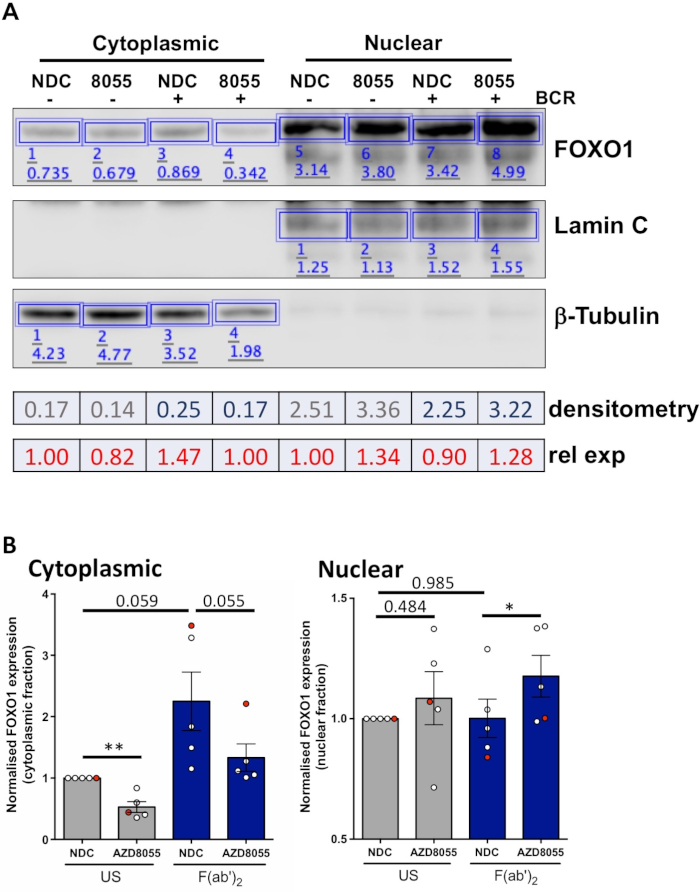
Рисунок 4: Работал пример количественного анализа западной подьек (денситометрия). (A) Денситометрия была выполнена с использованием западного программного обеспечения анализа помот доступны в Интернете. Короче говоря, в рамках ленты Анализа, прямоугольники были нарисованы вокруг белковых полос на изображении для расчета интенсивности сигнала. Изображена денситометрия репрезентативного западного изображения помоты образца пациента CLL, который прошел цитоплазматическое/ядерное фракционирование. Цитоплазмические и ядерные фракции отличаются выражением цитоплазмических (я-тубулин) и ядерных (lamin A/C) маркеров. Нормализованное выражение FOXO1 для данного состояния можно вычислить путем деления сигнала, полученного для FOXO1 соответствующим сигналом для Q-Tubulin или Lamin A/C, в зависимости от анализируемой фракции. Относительное выражение FOXO1 (относительно управления транспортным средством США), может быть рассчитано путем деления нормализованного выражения FOXO1 данного состояния нормализованным выражением FOXO1 управления транспортным средством США данной клеточной фракции. (B) График, показывающий уровни экспрессии FOXO1 в цитоплазмическом (левом) или ядерных (правых) фракциях, нормализованных до контроля МЕЖДУ США и НДК в каждой клеточной фракции. Красная точка на графике является показанной примером работы. Эти данные показывают, что среднее изменение складки в выражении FOXO1 по сравнению с американо-NDC и SEM. P значения были определены двуххвостый Студенты в паре т тест. n 5 отдельных образцов пациентов CLL. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Описанный протокол обеспечивает быстрый и эффективный метод генерации ядерных и цитоплазмических фракций из первичных клеток ХЛЛ, а также последующую количественную оценку торговли белками между ядерными и цитоплазмическими фракциями при стимуляции клеток и медикаментозное лечение. Представленные данные демонстрируют способность обнаруживать торговлю конкретными белками, например, FOXO1, между ядерными и цитоплазматическими фракциями, при лечении двойным ингибитором mTOR A'D8055 при наличии/отсутствии перекрестных связок BCR через F( ab')2 фрагмента стимуляции(Рисунок 3 и Рисунок 4). Сочетание этих экспериментов с количественной оценкой западных пятен из отдельных образцов пациентов CLL, позволяет объективно анализировать генерируемые данные и демонстрирует надежность анализа, описанного для количественной оценки глобальных изменений в локализации белка в Клетки CLL, изолированные от когорты пациентов(рисунок 4). Из данных ясно, что в среднем пять образцов пациентов в цитоплазматических фракциях достигли почти значимого значения. Учитывая клиническую неоднородность пациентов СЛл11, эти анализы обычно проводятся на больших когорт пациента, и / или сосредоточены на конкретных прогностического подгрупп пациентов, чтобы получить более полное понимание клеточной реакции CLL клеток к конкретным лекарственным препаратам.
Представленные данные свидетельствуют о важности выбора белковых маркеров, которые находятся исключительно в цитоплазмических или ядерных фракциях, так как чистота фракции будет подтверждена этими маркерами. К-тубулин был выбран для подтверждения цитоплазмической фракции, а Lamin A/C в качестве ядерного маркера. Дополнительные белки обычно используются GAPDH и к-тубулин для выявления цитоплазмической фракции или Brg1 (SMARCA4), TFIID и РНК Полимераза II для ядерной чистоты фракции4,5. Тем не менее, необходимо проявлять осторожность при выборе белков, которые высоко обогащены в определенных фракциях, и не присутствуют в обеих фракциях (например, З-тубулин) (Рисунок 2C)9. Действительно, GAPDH и актин в то время как обычно считается цитоплазматических белков может локализовать в ядро12,13, подчеркнув важность выбора фракции маркер, который не перемещается, когда стимуляция или лечение применяется к клеткам. Кроме того, важно подтвердить, что выбранный маркер белка выражается в клетке интереса, запуская WCL наряду с субклеточными фракционированиями.
В репрезентативном эксперименте показано, что одинаковое количество клеток ХЛЛ было использовано для каждого состояния (стимуляция / медикаментозное лечение), и после этого образцы фракционирования были подготовлены немедленно. Загрузка 10 мкг фракционированного белка/полосы обеспечивает достаточный материал для обнаружения интересующих белков. Поскольку эти образцы только прошли краткосрочную медикаментозную обработку и стимуляцию (до 4 ч), предполагалось, что уровень белка останется неизменным в каждом образце, и анализ белка не был выполнен. Однако, если клеточная обработка расширена (18 - 72 h), уровень гибели клеток или пролиферации в клетках может значительно изменить качество и количество извлеченного белка, зависимого от применяемой препаратом/клеточной стимуляцией, тем самым изменяя уровень белка в обработанном /стимулированные образцы. В этих случаях для более долгосрочного лечения наркотиков, желательно проводить протеиновые количественное использование Брэдфорд анализ или эквивалент, до западного blotting обеспечить одинаковое количество белка работает в каждой полосе иммуноблота. Присутствие моющих средств может помешать конкретным белковым анализам14,эта интерференция может быть уменьшена путем разбавления образцов белка фракции клеток. Кроме того, используйте полный буфер лисиса в качестве пробела, используя то же разбавление, что и в тестируемых образцах.
Для обеспечения подтверждающих доказательств выводы, описанные здесь, параллельные эксперименты могут быть выполнены с использованием флуоресценции микроскопии для анализа местоположения FOXO1 в клетках CLL, чтобы визуализация этих выводов5. Кроме того, порожденные субклеточные фракции также могут быть использованы для анализа активности ферментов или анализа протеомики в дальнейших анализах вниз по течению.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить доктора Наташу Малик за критический отзыв рукописи. Это исследование финансировалось за счет гранта проекта Bloodwise, предоставленного AMM (18003). Аналитические центры FACS финансировались Фондом Ховата. MWM финансировался аспирантом от друзей Пола О'Гормана Лейкемии исследовательский центр, JC финансировался друзья Пол О'Горман лейкемии научно-исследовательский центр и JH финансируется за счет гранта проекта Bloodwise (18003).
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge Tubes | Griener Bio one | 616201 | |
| 3 mL Pasteur Pipettes | Griener Bio one | 612398 | |
| 12 mm x 75 mm FACS Tubes | Elkay | 2052-004 | |
| 15 mL Tube | Griener Bio one | 188271 | |
| 50 mL Tube | Griener Bio one | 227261 | |
| anti-CD5 FITC antibody | BD Biosciences | 555352 | phenotypic surface marker |
| anti-CD19 PE Cy7 antibody | BD Biosciences | 557835 | phenotypic surface marker |
| anti-CD23 APC antibody | BD Biosciences | 558690 | phenotypic surface marker |
| anti-CD45 APC Cy7 antibody | BD Biosciences | 557833 | phenotypic surface marker |
| anti-β-Tubulin antibody | Cell Signaling | 2146 | cytoplasmic marker |
| anti-γ-Tubulin Mouse antibody (clone GTU-88) | Sigma-Aldrich | T5326 | |
| anti-FoxO1 (C29H4) Rabbit antibody | Cell Signaling | 2880 | |
| anti-Lamin A/C antibody | Cell Signaling | 2032 | nuclear marker |
| anti-mouse IgG, HRP-linked Antibody | Cell Signaling | 7076 | Secondary antibody |
| anti-rabbit IgG, HRP-linked Antibody | Cell Signaling | 7074 | Secondary antibody |
| anti-Rpb1 CTD antibody (clone 4H8) | Cell Signaling | 2629 | nuclear marker |
| BDFACS Canto II | BD Biosciences | By Request | Flow Cytometer |
| DAPI Solution | BD Biosciences | 564907 | live/dead discriminator |
| DMSO | Sigma | D2650 | |
| EDTA | Sigma | EDS | |
| Fetal Bovine Serum | Thermofisher | 10500064 | |
| GraphPad Prism 6 | GraphPad Software | Software | |
| Histopaque1077 density gradient media | Sigma | H8889 | |
| HyperPAGE 10 - 190 kDa protein marker | Bioline | BIO-33066 | Molecular weight marker |
| Image Studio Lite (version 5.2.5) | LI-COR | www.licor.com | Software |
| Labnet VX100 | Fisher Scientific | Vortex | |
| Nucelar Extract Kit | Active Motif | 40010 | |
| OneComp eBeads | Thermofisher | 01-111-42 | |
| Trypan Blue Solution | Thermofisher | 15250061 | |
| PageRuler Plus Prestained Protein Ladder | Thermo Fisher Scientific | 26619 | Molecular weight marker |
| PBS Tablets | Fisher Scientific | BR0014G | |
| RosetteSep Human B Cell Enrichment Cocktail | Stem Cell Technologies | 15064 | |
| Sigma 3-16P | SciQuip | Centrifuge | |
| Sigma 1-15PK | SciQuip | Centrifuge |
Ссылки
- Kau, T. R., Way, J. C., Silver, P. A. Nuclear transport and cancer: from mechanism to intervention. Nature Reviews Cancer. 4, 106-117 (2004).
- Turner, J. G., Dawson, J., Sullivan, D. M. Nuclear export of proteins and drug resistance in cancer. Biochemical Pharmacology. 83, 1021-1032 (2012).
- Nakamura, N., et al. Forkhead transcription factors are critical effectors of cell death and cell cycle arrest downstream of PTEN. Molecular and Cellular Biology. 20, 8969-8982 (2000).
- Calnan, D. R., Brunet, A. The FoxO code. Oncogene. 27, 2276-2288 (2008).
- Cosimo, E., et al. AKT/mTORC2 inhibition activates FOXO1 function in CLL cells reducing B cell receptor-mediated survival. Clinical Cancer Research. 25, 1574-1587 (2019).
- Mahipal, A., Malafa, M. Importins and exportins as therapeutic targets in cancer. Pharmacology & Therapeutics. 164, 135-143 (2016).
- Hing, Z. A., et al. Next-generation XPO1 inhibitor shows improved efficacy and in vivo tolerability in hematological malignancies. Leukemia. 30, 2364-2372 (2016).
- Lapalombella, R., et al. Selective inhibitors of nuclear export show that CRM1/XPO1 is a target in chronic lymphocytic leukemia. Blood. 120, 4621-4634 (2012).
- Hořejší, B., et al. Nuclear γ-tubulin associates with nucleoli and interacts with tumor suppressor protein C53. Journal of Cellular Physiology. 227, 367-382 (2012).
- McCaig, A. M., Cosimo, E., Leach, M. T., Michie, A. M. Dasatinib inhibits B cell receptor signalling in chronic lymphocytic leukaemia but novel combination approaches are required to overcome additional pro-survival microenvironmental signals. British Journal of Haematology. 153, 199-211 (2011).
- Fischer, K., Hallek, M. Optimizing frontline therapy of CLL based on clinical and biological factors. Hematology. American Society of Hematology. Education Program. 2017, 338-345 (2017).
- Butera, G., et al. Regulation of autophagy by nuclear GAPDH and its aggregates in cancer and neurodegenerative disorders. International Journal of Molecular Sciences. 20, 2062 (2019).
- Virtanen, J. A., Vartiainen, M. K. Diverse functions for different forms of nuclear actin. Current Opinion in Cell Biology. 46, 33-38 (2017).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178, 263-268 (1989).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены