Method Article
原发性慢性淋巴细胞白血病细胞的细胞次细胞分段监测核/细胞质蛋白贩运
摘要
该协议能够优化和随后有效地从原发性慢性淋巴细胞白血病细胞中生成核质和细胞质部分。这些样本用于确定蛋白质定位以及细胞刺激和药物治疗后核质室和细胞质室之间的蛋白质贩运变化。
摘要
大分子的核出口在癌细胞中经常被解除管制。肿瘤抑制蛋白,如p53,由于细胞定位异常,破坏其作用机制,可以变得不活动。慢性淋巴细胞白血病(CLL)细胞(CLL)细胞的生存,以及其他癌细胞,通过放松对细胞质的管制,至少部分通过放松对转移受体XPO1的管制和组织活化PI3K 介导信令通路。了解单个蛋白质在其细胞内位置中的作用至关重要,以便更深入地了解这些蛋白质在疾病病理生物学中的作用。此外,在亚细胞蛋白贩运的背景下,确定细胞刺激的基础过程和特定药理抑制剂的作用机制,将使人们更全面地了解行动。此处描述的方案能够优化并随后有效地从原发性慢性淋巴细胞白血病细胞中生成核质和细胞质部分。这些分数可用于确定细胞刺激和药物治疗时核质和细胞质馏分之间的蛋白质贩运变化。数据可以量化,并与免疫荧光图像并行呈现,从而提供可靠和可量化的数据。
引言
核和细胞质之间的大分子的传递早已确立为在正常细胞功能中起着关键作用,并且经常在癌细胞1、2中解除调节。这种放松管制可能是由于控制核出口的蛋白质的过度表达/突变造成的。其中一种蛋白质出口-1(XPO1),是一种运输受体,从细胞核2向细胞质出口>200核出口信号(NES)中含有蛋白质。XPO1货运包括第53页,FOXO家庭成员和IB,通过抑制其行动机制1,2,3,促进其灭活。当微环境信号冲击癌细胞时,可能发生进一步的蛋白质错位,导致细胞内信号通路(如磷脂酰-肌醇-3-激酶(PI3K)/Akt通路激活,导致FOXO家庭成员的失活,随后从核心4,5出口。这种肿瘤抑制蛋白的错位与一些血液和实体肿瘤1、2、6的进展有关。
开发用于血液恶性肿瘤临床使用的小分子抑制剂(急性骨髓性白血病(AML)/CLL),它与XPO1功能结合并选择性地抑制,强调开发适当技术解决药理剂对核质和细胞质室6、7、8之间蛋白质穿梭的影响。成像技术已经显著地推进了在药物治疗的外部刺激下识别亚细胞腔中的蛋白质,然而,强健和支撑性平行技术的重要性对于可靠告知科学观众结果的有效性。
从患者血液样本中分离出的休息淋巴细胞和恶性CLL-B细胞,由于高核质比,在核和细胞质分数的生成方面是一个挑战。优化实验条件以生成可靠可靠的实验数据,对于规划未来的实验方案当然至关重要。此处描述的方法能够定量核质和细胞质馏分中的蛋白质,并确定这些蛋白质如何受到细胞刺激和/或药物治疗的影响。
研究方案
此处描述的 CLL 患者主要样本的使用已获得苏格兰西部研究伦理服务部、NHS 大格拉斯哥和克莱德 (英国)的批准,所有工作均按照批准的准则进行。
1. 从患者血液样本中分离CLL细胞
-
以前同意的CLL患者的外周血样本从EDTA采血管的诊所接收,并伴有白细胞计数(WCC)。根据WCC纯化外周血CLL样本。对于 WCC < 40 x 106单元格/mL,继续执行步骤 1.1.1;对于 WCC = 40 x 106单元/mL,请继续执行步骤 1.1.2。
- 将所有EDTA血管的含量倒入50mL锥形离心管中,每1mL血液加入50μL人B细胞浓缩鸡尾酒。在室温 (RT) 下孵育 20 分钟。继续执行步骤 1.1.2。
- 使用 RT CLL 洗涤缓冲液(磷酸盐缓冲盐碱 (PBS)、0.5% 胎儿牛血清 (FBS) 和 2 mM EDTA)以 1:1 的比例稀释样品。
- 将Lquote RT密度梯度介质放入适合样品的圆锥形离心管中(10 mL成50 mL管,用于30 mL样品,或将4 mL插入15 mL管,用于10 mL样品)。
- 在RT处,小心地将样品分层在密度梯度介质和离心机顶部,在400 x g下进行30分钟。
注:在将样品放入离心机之前,确保离心机处于RT位置,因为温度变化将导致单核电池富集不良,并关闭离心机的制动器,因为突然制动会干扰液体界面。 - 使用塑料巴斯德移液器,在密度梯度介质和 CLL 洗涤缓冲液的界面处轻轻收获收集在密度梯度介质和 CLL 洗涤缓冲液界面处的白层单核细胞,并放入新的 50 mL 圆锥形离心管中。
- 在隔离的单层中加入40 mL的CLL洗涤缓冲液,在RT下以300 x g清洗细胞和离心机10分钟。
- 丢弃上清液,通过轻拂管底部重新悬浮颗粒,然后重复步骤 1.5 中描述的洗涤步骤。
- 丢弃上清液,重新悬浮步骤 1.6 中所述的颗粒,然后将颗粒重新悬浮在设定的 CLL 洗涤缓冲液中(最高 40 mL,具体取决于细胞颗粒的大小)。
- 使用锥蓝色锥体和血细胞计对细胞进行计数。然后继续流动细胞测量,以检查CLL细胞的纯度。
注:在此阶段,CLL细胞可在实验中使用的介质中培养浓度为10 x 106细胞/mL,和/或冷冻在10%二甲基硫酸盐(DMSO)/FBS中冷冻,以高达100 x 106细胞/瓶的浓度进行未来工作。
2. CLL细胞的流细胞测定
- 标签 12 毫米 x 75 毫米圆形底聚苯乙烯管,如表 1所述。
- 在管2+5中,放置一滴补偿珠子,并储存在冰上。将1μL的合适抗体(如表1所示的抗CD5、CD19、CD23或CD45)加入管2~5,在冰上孵育20分钟,通过在冰桶上放置锡箔,防止光线照射。
注:这些管用作设置流式细胞测定模板的补偿控制。 -
将多达1 x 106 CLL细胞放入管1、6和7中,向每根管中加入2 mL的FACS缓冲液(PBS = 2%FBS),并在RT处以300 x g离心5分钟清洗细胞。丢弃上清液,将含有细胞颗粒的管子储存在冰上。
- 按照表1的指示,在100μL的最终体积中,用FACS缓冲液将抗体重新悬浮到管7中的细胞中,加入适当的抗体组合。根据制造商指南,抗体以适当的浓度使用。
- 在100μL的FACS缓冲液中重新悬浮管2和6中的细胞颗粒。
- 在冰上孵育细胞,在管2和5中染色的珠子旁边孵育,20分钟免受光线照射。
- 孵育后,在所有管中加入2 mL的FACS缓冲液,并在RT处以300 x g离心5分钟清洗细胞。丢弃上清液,通过轻轻轻拂管重新悬浮珠子/细胞颗粒。
- 重新悬浮1- 5合100 μL的FACS缓冲液,并放置在冰上,直到准备好对流量细胞仪进行分析。
- 在使用前将DAPI溶液稀释至FACS缓冲液中的0.05-0.2微克/mL。最佳浓度可能会有所不同,建议滴定。
- 用100μL稀释的DAPI溶液重新悬浮管6和7,在冰上孵育管至少5分钟,使细胞染色。
注:无需进一步清洗,因为 DAPI 必须存在于缓冲液中,以便死细胞保持标签。加入DAPI后,必须在4小时内对流式细胞仪上的细胞进行分析。 - 使用流式细胞计分析细胞。
3. CLL细胞的亚细胞分数制备
注:在规划实验设置时,包括一口未经刺激/未经处理的细胞井,从中可以生成整个细胞提取物。
- 使用 10 × 20 x 106细胞/条件对 MEC1 CLL 细胞系或分离的初级 CLL 细胞执行所需的刺激和/或药物治疗。然后,细胞将用于亚细胞分馏(步骤 3.4 和 3.5)或生成整个细胞提取物(步骤 3.6)。
- 溶液/管的制备:在分馏当天,在细胞收获之前,新鲜地准备所有溶液/缓冲液。将溶液储存在冰上,直到需要,并在4小时内使用。
- PBS/磷酸酶抑制剂溶液:通过在1x PBS中稀释磷酸酶抑制剂1:20(即1x PBS的9.5 mL中0.5 maatas酶抑制剂)在PBS中制备磷酸酶抑制剂。
注:确保磷酸酶抑制剂没有沉淀。如果存在沉淀物,则加热至 50°C 10 分钟。 - 下度缓冲液:通过在蒸馏水中稀释10倍的次吨位缓冲液(即50μL的10倍低度缓冲液,将450 μL的dH2O)稀释1:10,制备1x次低度缓冲液。
- 10 mM 二硫二硫醇 (DTT): 使用蒸馏水(即,在 990 μL 的 dH2O) 中,对 1M DTT 进行 1:100 稀释,从而制备 10 mM DTT。
注:DTT 是高度实验室,所以准备这个新鲜每次。避免重复的冻结/解冻循环。 - 完全莱沙缓冲:确定每个实验需要多少缓冲区。每个样品需要50μL的完整解酶缓冲液,因此将5μL的10 mM DTT(步骤3.2.3)添加到44.5μL的解液缓冲液中,然后加入0.5μL蛋白酶抑制剂鸡尾酒。此数量可以根据实验中的样本数进行扩展。
- 为新刺激细胞(步骤3.3)、新生成的细胞质分数(步骤3.4.3)、新生成的核分数(步骤3.5.3)和整个细胞进行每次刺激和/或药物治疗,标记四组1.5 mL微fuge管利萨(步骤 3.6.3)。预先冷却这些微熔管在冰上,直到需要。
- PBS/磷酸酶抑制剂溶液:通过在1x PBS中稀释磷酸酶抑制剂1:20(即1x PBS的9.5 mL中0.5 maatas酶抑制剂)在PBS中制备磷酸酶抑制剂。
- 在4°C下,在200 x g下离心5分钟,将细胞转移到单独标记的1.5 mL微熔管和颗粒中。去除上清液,在1mL的冰冷的PBS/磷酸酶抑制剂中重新悬浮细胞(步骤3.2.1)。在4°C下,在200 x g下通过离心将细胞进行5分钟的离心。去除上清液,并将细胞颗粒留在冰上。
- 细胞质馏分的制备:轻轻重新悬浮细胞颗粒,用于在50 μL的1x低氧缓冲液(步骤3.2.2)下细胞分馏。在冰上孵育细胞15分钟,使细胞膨胀。
注:根据细胞数,使用的低通缓冲液的体积可以根据经验增加。- 在每个样品中加入 0.8 - 2.5 μL(1:20 至 1:60)的洗涤剂,并在 10 s 的最高设置上加入涡流。
- 要确定用于特定细胞类型以分离核和细胞质馏物的洗涤剂的最佳浓度,请首先执行洗涤剂梯度。1:20 至 1:60(即 2.5 μL 至 0.8 μL 的洗涤剂到 50 μL 的假缓冲液)应足够。
注:如果步骤 3.4 中的低氧缓冲液的体积得到调整,请确保保持适当的洗涤剂比。 - 在添加洗涤剂之前和之后,使用相对比显微镜观察细胞,以验证细胞分部。整个细胞看起来更大,有一个密集的,黑暗的细胞核。细胞质在细胞核周围会以明亮的光晕出现。
注:通过使用西方印迹分析洗涤剂梯度产生的分馏分内的特定蛋白质,进一步证实了适当的莱沙。
- 要确定用于特定细胞类型以分离核和细胞质馏物的洗涤剂的最佳浓度,请首先执行洗涤剂梯度。1:20 至 1:60(即 2.5 μL 至 0.8 μL 的洗涤剂到 50 μL 的假缓冲液)应足够。
- 一旦分离,在14,000 x g的样品在4°C下将样品离心30s。
- 小心地将上清液转移到预冷却、贴有标签的微熔管中。这种细胞质分数可以储存在-80°C,直到需要进一步分析。剩余的颗粒包含核分数(步骤3.5)。
注:避免样品的重复冻结/解冻周期。
- 在每个样品中加入 0.8 - 2.5 μL(1:20 至 1:60)的洗涤剂,并在 10 s 的最高设置上加入涡流。
- 核馏的制备:通过上下移液,将每个核颗粒重新悬浮在50μL的完整赖沙缓冲液(步骤3.2.4)中。
注:完全莱沙缓冲液的体积可根据起始单元数进行经验调整。- 加入2.5μL的洗涤剂,使与核膜和涡旋相关的蛋白质溶解在最高设置10秒上。在冰上孵育样品30分钟。
- 涡旋在最高设置下30秒,然后在4°C下以14,000 x g离心样品20分钟。
- 将上清液转移到预冷却、贴有标签的微熔管中。此核馏分可储存在-80°C,直到需要进一步分析。
注:避免样品的重复冻结/解冻周期。
- 从CLL细胞制备全细胞乳酸(WCL)
注:整细胞提取物的制备可以与核馏分的制备同时进行(步骤3.5)。- 通过上下移液,将整个细胞提取物颗粒重新悬浮在100μL的完整赖沙缓冲液中(在步骤3.2.4中制备),然后加入5μL的洗涤剂,以确保完整的细胞赖沙。在冰上孵育样品30分钟。
- 涡旋在最高设置下30秒,然后在4°C下以14,000 x g离心样品20分钟。
- 将上清液转移到预冷却的微熔管中。整个细胞莱沙可以储存在-80°C,直到需要进一步分析。
注:避免样品的重复冻结/解冻周期。
4. 亚细胞分数的下游分析
注:在此协议中,通过西方印迹使用标准协议对生成的细胞分数进行分析,为核和细胞质分数加载相等的细胞数/通道(相当于±10 μg的蛋白质)。
- 核质和细胞质分数之间的蛋白质贩运的定量:通过信号强度的定量分析,或使用免费提供的西方斑点分析软件进行密度测定,以执行定量的西方污点分析。
- 导入图像:从不同的开发仪器生成的西方污点图像必须作为 JPG、PNG 或 TIFF 文件导入。建议使用 16 位深度 RAW 文件。要导入图像,请单击软件图标并将鼠标悬停在"导入"上。然后单击第三方图像。选择图像文件,然后单击"打开"。
- 显示图像:在"图像"功能区中,单击"显示"组中的"选择"按钮。"调整显示"对话框将打开以启用进一步调整(如有必要)。使用"图像 LUTs"选项卡上的可调滑块实现其他增强功能,包括亮度或对比度。
- 数据分析(通道取消选择):单击"分析"功能区。要仅分析一个通道,请取消选择未分析的通道。单击"图像 LUT"中的频道的"不显示频道缩略图",仅显示所需的频道。作为 JPG、PNG 或 TIFF 文件导入的图像可能需要取消选择多个不需要的 RGB 通道。
-
添加形状:要量化信号强度,请单击"添加矩形"以向图像添加矩形。单击要素的中心(例如,蛋白质带)以在要素周围放置一个矩形。或者,要手动绘制形状,请选择"绘制矩形"。添加所有所需形状后,单击"选择"将光标返回到选择工具。
注:按逻辑顺序添加多个形状,因为数据按按顺序生成的 ID 号排序。 -
背景减法:要减去背景噪音,请单击"背景"组中的第一个按钮,然后从下拉菜单中选择"中位数"。在"背景"对话框中将边框宽度设置为 3,并选择要用于背景计算的段。选择要使用的线段时,请选择最能表示图像背景的线段。
注:背景噪声会影响信号量化,因此必须减去它才能从感兴趣的形状中准确计算信号。 -
修剪信号和修剪背景 - 可选:以 JPG、PNG 或 TIFF 格式导入的文件可能会显示像素饱和度:蛋白质波段内的高亮区域。修剪信号和修剪背景(Bkgnd) 从分析中删除饱和像素。要查看这些值,请单击表视图右侧的"列"按钮,将修剪信号和修剪 Bkgnd添加到表中。
注:像素饱和可能导致不可靠的量化。仅当形状内小于 5% 的像素饱和时,才能删除饱和像素。
-
添加形状:要量化信号强度,请单击"添加矩形"以向图像添加矩形。单击要素的中心(例如,蛋白质带)以在要素周围放置一个矩形。或者,要手动绘制形状,请选择"绘制矩形"。添加所有所需形状后,单击"选择"将光标返回到选择工具。
- 导出数据:单击表格上方的"形状"选项卡。对于密度计,需要"信号"列中的值。信号是形状减去 Bkgnd 和"区域"的积的像素强度值 (Total) 的总和。单击"报告"按钮。单击"另存为"或"启动电子表格"。
信号 = 总计 = (Bkgnd x 面积)
注:"形状"选项卡提供一个数量值表,包括信号、总计、面积和 Bkgrnd。 - 量化蛋白质表达:在保存的电子表格中,通过将感兴趣的蛋白质获得的信号除以相应蛋白质载荷控制带的信号来计算每个通道或变量的感兴趣蛋白质的规范化表达式。
注:由于用于区分核质和细胞质馏分的不同载荷控制,因此不能直接比较核质和细胞质馏分之间感兴趣的标准化蛋白的量。然而,在个别分数内的比较,例如药物治疗之后,是适当的。 - 导出图像以进行发布或演示:单击表上方的"图像"选项卡,然后单击要导出的图像。如果将图像用于幻灯片演示或其他数字格式,请单击软件图标,将鼠标悬停在"导出"上,然后单击"数字媒体的图像"。根据需要将图像另存为 JPG、PNG 或 TIFF 文件。
结果
在规划初级 CLL 细胞的实验时,如果检测需要大量细胞(>50 x 106细胞),则首选使用新分离的 CLL 细胞,而不是需要解冻的冷冻细胞,但并不总是可能。这是因为冻结/解冻过程可能导致高达 50% 的 CLL 细胞死亡,尽管这与样本相关。使用此处所述的密度离心(步骤 1.3 = 1.5)浓缩 WCC >40 x 106/mL 的 CLL 电池可实现高纯度回收(± 95%)初级 CLL 细胞。在所示的样本中,从30 mL血样5 x 109细胞中回收了WCC = 177 x 106/mL,即细胞产量占总细胞的94%。通过流式细胞测定法对样品进行分析后发现,CLL细胞的纯度为>95%,如CLL细胞标记CD19和CD5在FSC/SSC上浇注后的双重表面表达所示,即DAPI阴性(活细胞)的单细胞(图1)。
在制备细胞质分数(步骤3.4)期间,使用一系列洗涤剂比(1:20至1:60)优化亚细胞分馏程序。此后,编写了核分数和CPL(步骤分别为3.5和3.6)。对CLL细胞系MEC1(图2A)和初级CLL细胞(图2B)的产生部分进行免疫博数。对印迹进行了探查,以寻找分数标记拉明A/C(核;74/63 kDa)和β-图布林(细胞质;55 kDa),以确认成功的细胞分馏。分馏表明MEC1细胞的最佳洗涤剂水平为1:60稀释(图2A),而1:30稀释是初级CLL细胞的最佳稀释(图2B),如富集所示。核蛋白和缺乏细胞质蛋白的成分,反之亦然。WcL表示总蛋白,并作为用于探测亚细胞分数的抗体的阳性控制。选择合适的蛋白质作为分数标记很重要:图2C显示了从MEC1细胞制备的核/细胞质分数的免疫血位,其中RNA聚合酶II(Rpb1 CTD;250 kDa)和拉明A/C被作为标记物。核馏分,而β-图布林和β-图布林(50 kDa)被用作细胞质标记。很显然,β-图布林在细胞质中富集,然而表达在细胞核中很明显,如前9所示。
一旦实验条件得到优化,就可以进行实验。在所展示的示例中,FOXO1在核和细胞质馏分中的亚细胞定位是在MEC1细胞中是否存在双mTORC1/2抑制剂AZD8055(在MEC1细胞中,在存在或不存在双mTORC1/2抑制剂AZD8055)的情况下,用B细胞抗原受体(BCR)刺激细胞时确定的。图3A)和主CLL单元(图3B)5、10。在这两个例子中,高富核和细胞质分数的产生都实现了,如在核馏分中几乎独占的拉明表达和细胞质馏分中的β-图布林表达。在两种细胞类型中,FOXO1表达在AZD8055治疗后与NDC相比,在细胞质中减少,核腔中FOXO1表达增加,从而显示蛋白质易位(图3)。为了消除数据解释的主观性,从五个初级CLL样本中分别对单个免疫泡在亚细胞分数内进行了量化(步骤4;图4A,使用各自的核质蛋白或细胞质蛋白作为每个样品的内部载荷控制,然后将每个分数归化为无刺激(美国)无药物管制(NDC)控制,如所示。由此产生的图显示了FOXO1在核体和细胞质分数之间的运动趋势,AZD8055降低了细胞质中FOXO1表达的水平,同时增加了细胞核的表达。此外,在BCR交联上,细胞质FOXO1表达的升高是明显的。
| 管 | 管名称 | 细胞/珠子 | 抗原 | 荧光 |
| 1 | 未染色 | 细胞 | 那 | 那 |
| 2 | 单染色 | 珠 | CD5 | FITC |
| 3 | 单染色 | 珠 | CD19 | PE-Cy7 |
| 4 | 单染色 | 珠 | CD23 | Apc |
| 5 | 单染色 | 珠 | CD45 | APC-Cy7 |
| 6 | 单染色 | 细胞 | 可行性 | 达皮 |
| 7 | CLL 染色 | 细胞 | CD5、CD19、CD23、CD45 和生存能力 | FITC、PE-Cy7、APC、APC-Cy7 和 DAPI |
表1:表显示了CLL细胞流动细胞测定所需的理想样本管集。每个实验必须包括所有适当的控制,以便准确分析获得的结果。
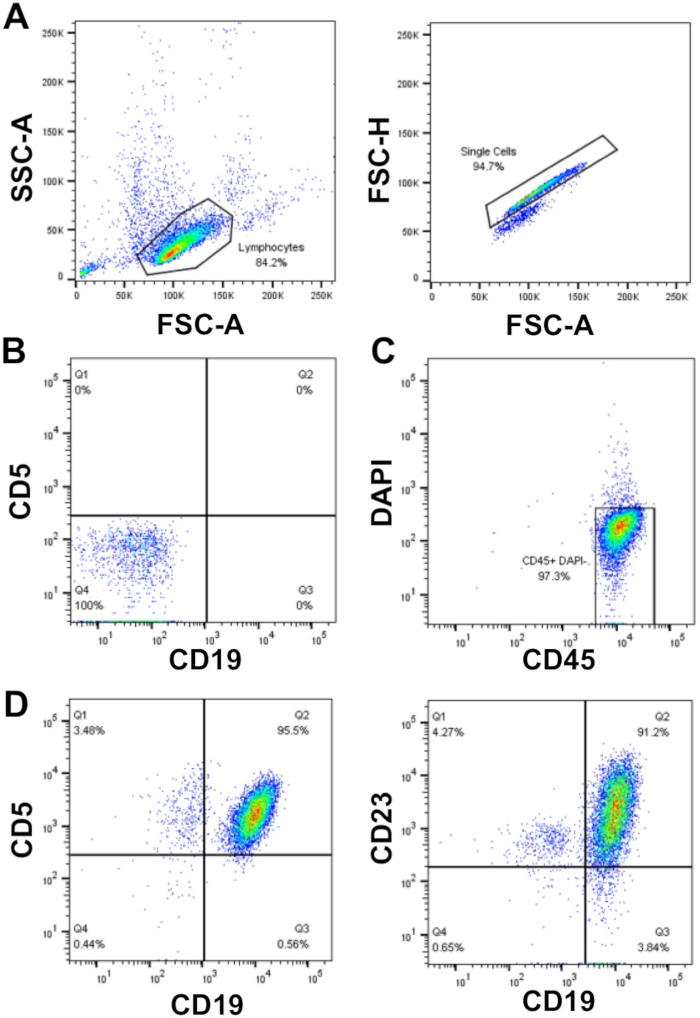
图1:富集CLL患者的代表性流细胞测定分析图。从单个CLL患者的外周血中富集的单核CLL细胞使用FSC-A vs.SSC-A进行封闭,然后使用FSC-A vs.FSC-H(A )排除双核细胞。 无染色细胞(管1)和补偿控制(管2-6)用于设置流细胞计,以检测细胞和荧光通道之间的补偿,从而确保正确检测荧光信号。(B) CD19和CD5荧光通道中负染色(未染色细胞;管1)的例子。活 (DAPI 阴性) 和 CD45 阳性细胞被封闭 (C) 和 CD19+CD5+ (95.5%) 的比例和 CD19+CD23= (91.2%)在DAPI-CD45+总体确定 (D) 内的细胞。请点击此处查看此图的较大版本。

图2:核/细胞质分馏优化。细胞质和核馏分,以及整个细胞乳酸(WCL),由CLL细胞系(A)MEC1或(B)原生CLL细胞的细胞颗粒(10×20×106细胞)制备,如步骤 3.在制备细胞质分数时,使用一系列洗涤剂比(1:20 到 1:60)对亚细胞分馏进行优化(如步骤 3.4 中所述)。由此产生的样本用抗拉明A/C(核)和抗β-图布林(细胞质)抗体进行免疫浸杀和探查,以确认与WCL一起成功的细胞分馏。分子量标记显示在斑点 (M) 的左侧。• 指示细胞莱沙的最佳洗涤剂条件。(C) 在无刺激的情况下(*或+BCR交联)来自具有控制条件(NDC)或药物治疗(8055)的MEC1细胞的核和细胞质分的免疫球体。用抗Rbp1 CTD(克隆4H8;识别RNA聚合酶II亚单位B1)、抗拉明A/C、抗β-图布林或抗β-图布林(克隆GTU-88)抗体进行探底,以识别亚细胞分数。请点击此处查看此图的较大版本。
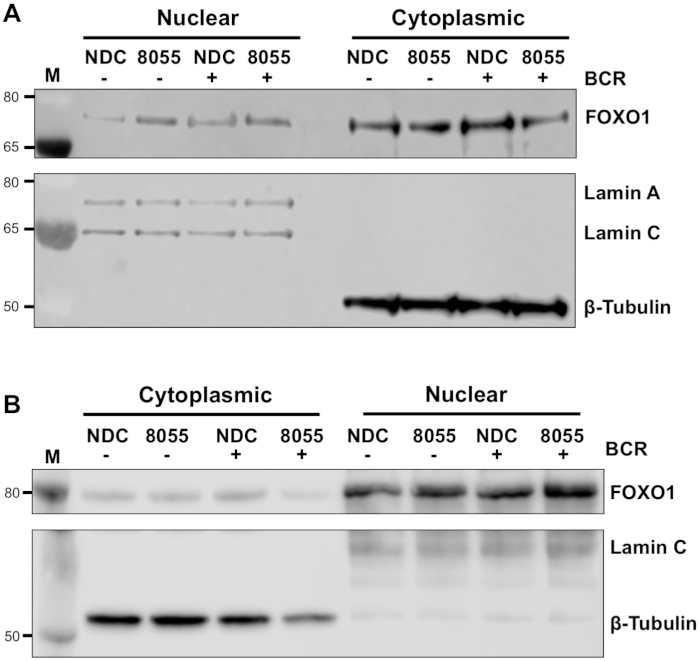
图3:亚细胞分馏表明FOXO1在CLL细胞核和细胞质之间穿梭。(A) MEC-1细胞和 (B) 初级 CLL 细胞用 100 nM AZD8055 (8055) 预处理 30 分钟,或未按照指示进行未经处理 (NDC), 然后 BCR 被连带 1 小时或离开美国。然后制备核质和细胞质部分并进行免疫免疫。在通过探测抗拉明A/C(核)和抗β-图布林(细胞质)抗体确认分馏后,使用抗FOXO1抗体对FOXO1蛋白表达进行药物治疗和BCR结扎的效果。M表示分子量标记。请点击此处查看此图的较大版本。
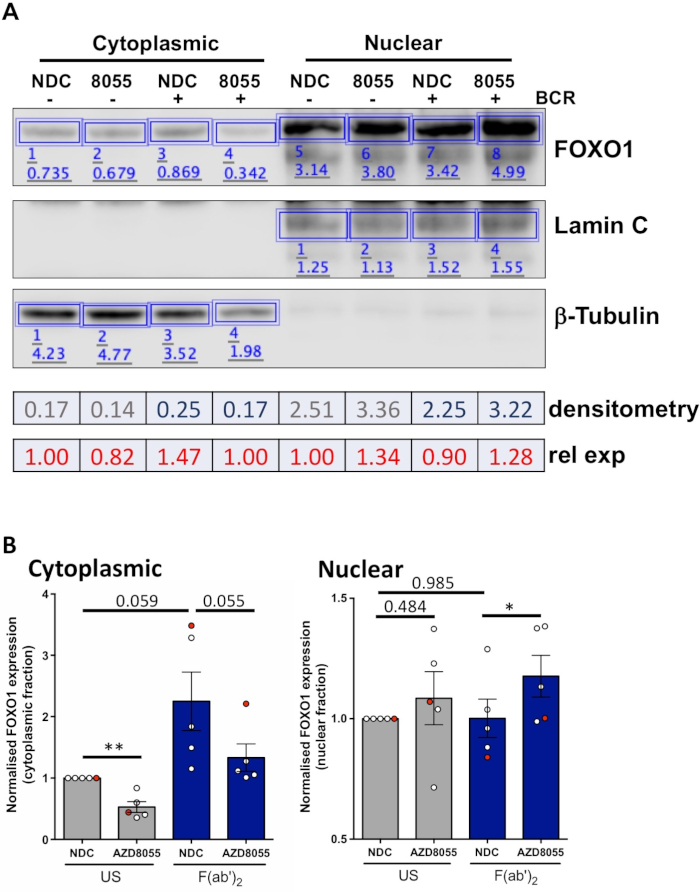
图4:定量西方污点分析(密度测定)的一个工作示例。(A) 测量是使用在线提供的西方斑点分析软件进行的.简单地说,在分析功能区内,围绕图像中的蛋白质带绘制矩形以计算信号强度。所描绘的是经过细胞质/核分馏的CLL患者样本的代表性西方斑点图像的密度测定。细胞质和核馏分由细胞质(β-图布林)和核(拉明A/C)标记的表达区分。FOXO1在给定条件下的标准化表达可以通过将FOXO1获得的信号除以β-图布林或拉明A/C的相应信号来计算,具体取决于所分析的分数。相对 FOXO1 表达式(相对于美国车辆控制)可以通过将给定条件的规范化 FOXO1 表达式除以给定蜂窝分数的美国车辆控制的规范化 FOXO1 表达式来计算。(B) 显示细胞质(左)或核(右)分数中的FOXO1表达水平的图形,每个细胞分数内均归于美国-NDC控制。图表上的红点是所示的工作示例。此数据显示 FOXO1 表达式中与美国 NDC = SEM 相比的平均折叠变化。 n = 5个单独的CLL患者样本。请点击此处查看此图的较大版本。
讨论
所述协议为从原质CLL细胞生成核质和细胞质分数,以及随后在细胞刺激时核质和细胞质分数之间的蛋白质贩运定量提供了一种快速而有效的方法和药物治疗。所提供的数据表明,在存在/不存在BCR交叉链接通过F(F) 的情况下,使用双mTOR抑制剂AZD8055进行治疗时,能够检测特定蛋白质(例如FOXO1)在核和细胞质馏分之间的贩运。ab')2片段刺激 (图 3和图4)。将这些实验与从单个 CLL 患者样本中量化的西方造血位相结合,能够对生成的数据进行客观分析,并演示所描述的测定的鲁棒性,以量化蛋白质定位的全球变化。从患者群群分离出的CLL细胞(图4)。从数据中可以明显看出,细胞质分数中平均有5个患者样本达到接近意义。鉴于CLL患者11的临床异质性,这些分析通常将在较大的患者群组进行,和/或侧重于患者的特定预后子组,以更全面地了解CLL的细胞反应细胞到特定的药物治疗。
所提供的数据表明,选择完全存在于细胞质或核馏分中的蛋白质标记物非常重要,因为这些标记将确认分馏的纯度。β-图布林被选作细胞质分数确认,拉明A/C作为核标记。常用的其他蛋白质是GAPDH和β-图布林,用于识别细胞质分数或Brg1(SMARCA4)、TFIID和RNA聚合酶II,用于核馏纯度4,5。然而,在选择特定分数中高度富集的蛋白质时,必须小心谨慎,而两个馏分中不存在的蛋白质(例如,β-图布林)(图2C)9。事实上,GAPDH和actin,而一般认为是细胞质蛋白可以本地化到细胞核12,13,强调选择分数标记的重要性,当刺激或治疗是应用于单元格。此外,通过运行WCL与亚细胞分馏一起,确认所选蛋白质标记在感兴趣的细胞中表达也是很重要的。
在显示的代表性实验中,每种情况(刺激/药物治疗)都使用相同数量的CLL细胞,然后立即制备分馏样本。加载 10 μg 的分馏蛋白/通道为检测感兴趣的蛋白质提供了足够的材料。由于这些样品只进行短期药物治疗和刺激(长达4小时),假定每个样本中的蛋白质水平保持不变,并且未进行蛋白质检测。然而,如果细胞治疗延长(18-72小时),细胞死亡或细胞增殖水平可能会显著改变提取的蛋白质的质量和数量,这取决于药物/细胞刺激应用,从而改变治疗中的蛋白质水平/刺激样品。在这些长期药物治疗中,建议在西方印迹之前使用布拉德福德测定或等效进行蛋白质定量,以确保在免疫液的每个通道运行相同量的蛋白质。洗涤剂的存在可能会干扰特定的蛋白质测定14,这种干扰可以通过稀释细胞分量蛋白样品来减少。此外,使用完整的莱沙缓冲液作为空白,使用与被测试样品相同的稀释。
为了为本文所述的发现提供支持证据,可以使用荧光显微镜进行平行实验,以分析FOXO1在CLL细胞中的位置,使这些发现可视化5。此外,产生的亚细胞分数也可用于酶活性测定或蛋白质组学分析,用于进一步的下游分析。
披露声明
作者没有什么可透露的。
致谢
作者要感谢娜塔莎·马利克博士对手稿的批判性审查。这项研究由授予AMM(18003)的"血智项目"项目赠款资助。外地资产管制系统分析设施由豪特基金会供资。MWM由保罗·奥戈曼白血病研究中心之友的博士生资助,JC由保罗·奥戈曼白血病研究中心之友资助,JH由血缘项目赠款资助(18003年)。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge Tubes | Griener Bio one | 616201 | |
| 3 mL Pasteur Pipettes | Griener Bio one | 612398 | |
| 12 mm x 75 mm FACS Tubes | Elkay | 2052-004 | |
| 15 mL Tube | Griener Bio one | 188271 | |
| 50 mL Tube | Griener Bio one | 227261 | |
| anti-CD5 FITC antibody | BD Biosciences | 555352 | phenotypic surface marker |
| anti-CD19 PE Cy7 antibody | BD Biosciences | 557835 | phenotypic surface marker |
| anti-CD23 APC antibody | BD Biosciences | 558690 | phenotypic surface marker |
| anti-CD45 APC Cy7 antibody | BD Biosciences | 557833 | phenotypic surface marker |
| anti-β-Tubulin antibody | Cell Signaling | 2146 | cytoplasmic marker |
| anti-γ-Tubulin Mouse antibody (clone GTU-88) | Sigma-Aldrich | T5326 | |
| anti-FoxO1 (C29H4) Rabbit antibody | Cell Signaling | 2880 | |
| anti-Lamin A/C antibody | Cell Signaling | 2032 | nuclear marker |
| anti-mouse IgG, HRP-linked Antibody | Cell Signaling | 7076 | Secondary antibody |
| anti-rabbit IgG, HRP-linked Antibody | Cell Signaling | 7074 | Secondary antibody |
| anti-Rpb1 CTD antibody (clone 4H8) | Cell Signaling | 2629 | nuclear marker |
| BDFACS Canto II | BD Biosciences | By Request | Flow Cytometer |
| DAPI Solution | BD Biosciences | 564907 | live/dead discriminator |
| DMSO | Sigma | D2650 | |
| EDTA | Sigma | EDS | |
| Fetal Bovine Serum | Thermofisher | 10500064 | |
| GraphPad Prism 6 | GraphPad Software | Software | |
| Histopaque1077 density gradient media | Sigma | H8889 | |
| HyperPAGE 10 - 190 kDa protein marker | Bioline | BIO-33066 | Molecular weight marker |
| Image Studio Lite (version 5.2.5) | LI-COR | www.licor.com | Software |
| Labnet VX100 | Fisher Scientific | Vortex | |
| Nucelar Extract Kit | Active Motif | 40010 | |
| OneComp eBeads | Thermofisher | 01-111-42 | |
| Trypan Blue Solution | Thermofisher | 15250061 | |
| PageRuler Plus Prestained Protein Ladder | Thermo Fisher Scientific | 26619 | Molecular weight marker |
| PBS Tablets | Fisher Scientific | BR0014G | |
| RosetteSep Human B Cell Enrichment Cocktail | Stem Cell Technologies | 15064 | |
| Sigma 3-16P | SciQuip | Centrifuge | |
| Sigma 1-15PK | SciQuip | Centrifuge |
参考文献
- Kau, T. R., Way, J. C., Silver, P. A. Nuclear transport and cancer: from mechanism to intervention. Nature Reviews Cancer. 4, 106-117 (2004).
- Turner, J. G., Dawson, J., Sullivan, D. M. Nuclear export of proteins and drug resistance in cancer. Biochemical Pharmacology. 83, 1021-1032 (2012).
- Nakamura, N., et al. Forkhead transcription factors are critical effectors of cell death and cell cycle arrest downstream of PTEN. Molecular and Cellular Biology. 20, 8969-8982 (2000).
- Calnan, D. R., Brunet, A. The FoxO code. Oncogene. 27, 2276-2288 (2008).
- Cosimo, E., et al. AKT/mTORC2 inhibition activates FOXO1 function in CLL cells reducing B cell receptor-mediated survival. Clinical Cancer Research. 25, 1574-1587 (2019).
- Mahipal, A., Malafa, M. Importins and exportins as therapeutic targets in cancer. Pharmacology & Therapeutics. 164, 135-143 (2016).
- Hing, Z. A., et al. Next-generation XPO1 inhibitor shows improved efficacy and in vivo tolerability in hematological malignancies. Leukemia. 30, 2364-2372 (2016).
- Lapalombella, R., et al. Selective inhibitors of nuclear export show that CRM1/XPO1 is a target in chronic lymphocytic leukemia. Blood. 120, 4621-4634 (2012).
- Hořejší, B., et al. Nuclear γ-tubulin associates with nucleoli and interacts with tumor suppressor protein C53. Journal of Cellular Physiology. 227, 367-382 (2012).
- McCaig, A. M., Cosimo, E., Leach, M. T., Michie, A. M. Dasatinib inhibits B cell receptor signalling in chronic lymphocytic leukaemia but novel combination approaches are required to overcome additional pro-survival microenvironmental signals. British Journal of Haematology. 153, 199-211 (2011).
- Fischer, K., Hallek, M. Optimizing frontline therapy of CLL based on clinical and biological factors. Hematology. American Society of Hematology. Education Program. 2017, 338-345 (2017).
- Butera, G., et al. Regulation of autophagy by nuclear GAPDH and its aggregates in cancer and neurodegenerative disorders. International Journal of Molecular Sciences. 20, 2062 (2019).
- Virtanen, J. A., Vartiainen, M. K. Diverse functions for different forms of nuclear actin. Current Opinion in Cell Biology. 46, 33-38 (2017).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178, 263-268 (1989).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。