Method Article
核/細胞質タンパク質の密売を監視する原発性慢性リンパ球性白血病細胞の細胞分画
要約
このプロトコルは、原発性慢性リンパ球性白血病細胞からの核および細胞質画分の最適化およびその後の効率的な生成を可能にする。これらのサンプルは、タンパク質の局在化と、細胞刺激および薬物治療時に核と細胞質区画の間で起こるタンパク質の密売の変化を決定するために使用されます。
要約
高分子の核輸出は、がん細胞でしばしば規制解除される。p53のような腫瘍抑制タンパク質は、その作用機序を破壊する異常な細胞局在化のために非アクティブにすることができる。慢性リンパ球性白血病(CLL)細胞の生存は、他の癌細胞の中でも、細胞質シャトルへの核の自由化によって支援され、少なくとも部分的には輸送受容体XPO1の規制緩和および構成的活性化を通じてPI3K媒介シグナリング経路。疾患の病態生物学におけるそのようなタンパク質の役割をより深く理解するためには、細胞内位置の文脈における個々のタンパク質の役割を理解することが不可欠である。さらに、細胞刺激の根には、細胞内タンパク質の密売の文脈において、細胞刺激および特定の薬理学的阻害剤の作用機序の下にあるプロセスを同定することは、そのメカニズムのより包括的な理解を提供する。アクション。ここで説明するプロトコルは、原発性慢性リンパ球性白血病細胞からの核および細胞質画分の最適化およびその後の効率的な生成を可能にする。これらの画分は、細胞刺激および薬物治療における核と細胞質画分の間のタンパク質取引の変化を決定するために使用することができる。データは、免疫蛍光画像と並行して定量化および提示できるため、堅牢で定量化可能なデータを提供できます。
概要
核と細胞質の間の高分子の輸送は、長い間、正常な細胞機能において重要な役割を果たすことが確立されており、癌細胞1、2でしばしば調節解除される。このような規制緩和は、核輸出を制御するタンパク質の過剰発現/突然変異に起因する可能性があります。そのようなタンパク質Exportin-1(XPO1)の1つは、核2から細胞質に>200核輸出シグナル(NES)含有タンパク質を輸出する輸送受容体である。XPO1貨物は、p53、FOXO家族およびIBを含み、作用1、2、3のそれらのメカニズムを阻害することによってそれらの不活性化に寄与する。さらにタンパク質の誤局性は、微小環境シグナルが癌細胞に影響を与える場合に起こり得る、ホスファチジル-イノシトール-3-キナーゼ(PI3K)/Akt経路などの細胞内シグナル伝達経路の活性化につながり、FOXOファミリーメンバーの不活性化と核4、5からのその後のエクスポート。このような腫瘍抑制タンパク質の誤局化は、多数の血液学的および固形腫瘍1,2,6の進行に関与している。
XPO1機能に結合し選択的に阻害する血液性悪性悪性腫瘍(急性骨髄性白血病(AML)/CLL)における臨床用低分子阻害性阻害薬の開発は、核と細胞質のコンパートメント間のタンパク質のシャトルに対する薬理学的薬剤の影響6,7,8.イメージング技術は、薬物治療の外部刺激時に細胞内のタンパク質の同定を有意に可能にするが、堅牢で支持的な並列技術の重要性は、確実に重要である。結果の妥当性を科学的な聴衆に知らせる。
患者の血液サンプルから単離された安静リンパ球および悪性CLL-B細胞は、高い核による核および細胞質画分の生成における課題を表す:細胞質比。堅牢で信頼性の高い実験データを生成するための実験条件の最適化は、将来の実験プログラムを計画するためにはもちろん重要です。ここで説明する方法は、核および細胞質画分におけるタンパク質の定量を可能にし、これらのタンパク質が細胞刺激および/または薬物治療によってどのように影響を受けるかを決定する。
プロトコル
ここに記載されているCLL患者からの一次サンプルの使用は、スコットランド研究倫理サービス、NHSグレーターグラスゴーとクライド(英国)の西部によって承認されており、すべての作業は承認されたガイドラインに従って行われました。
1. 患者の血液サンプルからのCLL細胞の単離
-
以前に同意されたCLL患者からの末梢血サンプルは、白血球数(WCC)を伴うEDTA採血管の診療所から受け取られます。WCCに従って末梢血CLLサンプルを浄化する。WCC < 40 x 106セル/mL の場合は、ステップ 1.1.1 に進みます。WCC ≥ 40 x 106セル/mL の場合は、ステップ 1.1.2 に進みます。
- すべてのEDTA血液管の内容物を50 mLの円錐遠心分離管に注ぎ、血液1mL当たり50μLのヒトB細胞濃縮カクテルを加えます。室温(RT)で20分間インキュベートし、ステップ1.1.2に進みます。
- RT CLL洗浄バッファー(リン酸緩衝サリン(PBS)、0.5%胎児ウシ血清(FBS)および2 mM EDTA)で1:1の割合でサンプルを希釈します。
- Aliquot RT密度勾配媒体をサンプル用の適切なサイズの円錐遠心管に(サンプルの30 mLまたはサンプルの15 mL用の15 mLチューブに4mLの50 mLチューブに10 mL)。
- サンプルを密度勾配媒体の上に慎重に重ね、遠心分離機をRTで30分間400 x gにします。
注:温度の変化が単核細胞の濃縮不良をもたらすので、サンプルが遠心分離機に置かれる前に遠心分離機がRTであることを確認し、突然のブレーキが液体界面を乱す可能性があるので、遠心分離機のブレーキをオフにします。 - 密度勾配媒体とCLL洗浄バッファーの界面で収集する単核細胞の白層を、プラスチックパスツールピペットを使用して新鮮な50 mL円錐遠心管に穏やかに収穫します。
- 単離された単層に40 mLのCLL洗浄バッファーを加え、細胞と遠心分離機をRTで10分間300xgで洗浄します。
- 上清を廃棄し、チューブの底部をフリックしてペレットを再懸濁し、ステップ1.5に記載の洗浄工程を繰り返す。
- 上清を廃棄し、ステップ1.6に記載の通りペレットを再懸濁し、次いでCLL洗浄バッファーのセットボリュームでペレットを再懸濁する(セルペレットのサイズに応じて最大40mL)。
- トリパンブルーと血球計を使用して細胞を数えます。次に、CLL細胞の純度を確認するために細胞メトリーを流す。
注:この段階では、CLL細胞を実験に使用する培地中の10 x 106細胞/mLの濃度で培養することができ、および/または10%ジメチルスルホキシド(DMSO)/FBSで凍結保存し、最大100 x 106細胞/バイアルの濃度で将来の作業を行うことができます。
2. CLL細胞のフローサイトメトリー
- 表 1 に記載されているように、12 mm x 75 mm 丸い底付きポリスチレンチューブにラベルを付けます。
- チューブ2-5で、補償ビーズを1滴入れ、氷の上に保存します。適切な抗体の1 μL(表1に示すように、抗CD5、CD19、CD23またはCD45)をチューブ2~5に加え、氷上で20分間インキュベートし、氷のバケツの上に錫箔を置いて光から保護する。
注:これらのチューブは、フローサイトメトリーテンプレートを設定するための補正コントロールとして機能します。 -
チューブ1、6、7に最大1 x 106 CLL細胞を入れ、各チューブに2 mLのFACSバッファー(PBS + 2%FBS)を加え、RTで5分間300xgの遠心分離機を加えて細胞を洗浄する。 上清を捨て、細胞ペレットを含むチューブを氷の上に保管します。
- 細胞ペレットを再定積し、表1に示すようにチューブ7内の細胞に抗体の適切な組み合わせを追加し、FACSバッファーを用いて100μLの最終容積にする。抗体は、製造元のガイドラインに従って適切な濃度で使用されます。
- FACSバッファーの100 μLでチューブ2および6の細胞ペレットを再ステーペンドします。
- 氷の上の細胞をインキュベートし、チューブ2~5の染色ビーズと一緒に、20分間光から保護します。
- インキュベーションの後、すべてのチューブと遠心分離機に2 mLのFACSバッファーをRTで5分間加え、細胞を洗浄します。上清を捨て、チューブをそっとフリックしてビーズ/セルペレットを再懸濁します。
- FACSバッファーの100 μLでチューブ1~5を再サスペンドし、フローサイトメーターで分析する準備ができるまで氷の上に置きます。
- DAPI 溶液を使用直前に FACS バッファーで 0.05~0.2 μg/mL に希釈します。最適な濃度は変化する場合があり、滴定をお勧めします。
- 希釈DAPI溶液の100 μLでチューブ6と7を再中断し、細胞が汚れるように、氷の上にチューブを少なくとも5分間インキュベートします。
注:死んだ細胞が標識されたままになるには、DAPIがバッファー内に存在する必要があるため、それ以上の洗浄は必要ありません。DAPIが追加されたら、4時間以内にフローサイトメーターで細胞を分析する必要があります。 - フローサイトメーターを使用して細胞を分析します。
3. CLL細胞からの細胞内画分の調製
注:実験セットアップを計画する際には、細胞抽出物全体を生成できる未刺激/未処理細胞のウェルを含む。
- 10 - 20 x 106細胞/条件を使用してMEC1 CLL細胞株または単離された一次CLL細胞の所望の刺激および/または薬物治療を行う。細胞は、細胞下分画(ステップ3.4&3.5)または細胞全体抽出物を生成するために使用されます(ステップ3.6)。
- ソリューション/チューブの準備:細胞が収穫される前に、分画の日に新鮮にすべての溶液/バッファーを準備します。溶液を必要な量まで氷の上に保管し、準備の4時間以内に使用してください。
- PBS/ホスファターゼ阻害剤溶液:ホスファターゼ阻害剤1:20を1x PBSで希釈することによりPBS中のホスファターゼ阻害剤を調作する(すなわち、1x PBSの9.5mLにおけるホスファターゼ阻害剤の0.5mL)。
注:ホスファターゼ阻害剤が沈殿していないことを確認します。沈殿物が存在する場合は、10分間50°Cに熱する。 - 低トニックバッファー:蒸留水中で1:10の低トニックバッファーの1:10希釈を行うことによって1x低トニックバッファーを調製します(すなわち、10倍の低トニックバッファーの50 μLをdH2Oの450 μ Lに)。
- 10 mMジチオスレイトール(DTT):蒸留水で1M DTTの1:100希釈を行って10mM DTTを調製する(すなわち、dH2Oの990 μLで1M DTTの10 μL)。
注:DTTは非常に不整性なので、毎回これを新鮮に準備してください。繰り返し凍結/解凍サイクルを避けてください。 - 完全なリシス バッファー: 各実験に必要なバッファーの量を決定します。各サンプルには50 μLの完全なリシスバッファーが必要なため、10 mM DTTの5 μL(ステップ3.2.3)を44.5 μLのリシスバッファーに加え、プロテアーゼ阻害剤カクテルの0.5 μLを追加します。この量は、実験中のサンプル数に応じてスケールアップできます。
- 新たに刺激された細胞の刺激および/または薬物治療ごとに1.5mLのマイクロフュージチューブの4セット(ステップ3.3)、新たに生成された細胞質画分(ステップ3.4.3)、新たに生成された核画分(ステップ3.5.3)、および細胞全体にラベルを付けます。(ステップ3.6.3)。必要になるまで氷の上でこれらのマイクロフュージチューブを事前に冷やします。
- PBS/ホスファターゼ阻害剤溶液:ホスファターゼ阻害剤1:20を1x PBSで希釈することによりPBS中のホスファターゼ阻害剤を調作する(すなわち、1x PBSの9.5mLにおけるホスファターゼ阻害剤の0.5mL)。
- 4°Cで5分間200 x gで遠心分離することにより、個別に標識された1.5 mLマイクロフュージチューブとペレットに細胞を移します。上清を取り出し、氷冷PBS/ホスファターゼ阻害剤の1 mLで細胞を再中断します(ステップ3.2.1)。4°Cで5分間200xgで遠心分離によって細胞をペレットする。上清を取り除き、細胞ペレットを氷の上に保ちます。
- 細胞質画分の調製:1x低トニックバッファーの50 μLの細胞分画に使用する細胞ペレットを穏やかに再中断します(ステップ3.2.2)。細胞が膨れ上がるように15分間氷の上の細胞をインキュベートします。
注:使用される低調球バッファーの体積は、細胞数に応じて経験的に増加させることができる。- 各サンプルに洗剤0.8~2.5μL(1:20~1:60)を加え、10sの最高値で渦を加えます。
- 核分画と細胞質画分を分離するために特定の細胞タイプに使用する洗剤の最適な濃度を決定するには、最初に洗剤の勾配を実行します。1:20 ~1:60 の範囲(つまり、2.5 μL ~ 0.8 μL の洗剤を 50 μL の低トニック バッファーに含む)で十分である必要があります。
注:ステップ3.4の低調圧バッファーの体積を調整する場合は、適切な洗剤比率が維持されていることを確認してください。 - 洗剤添加前後の位相コントラスト顕微鏡を用いて細胞を観察して細胞のリシスを確認します。細胞全体が、濃い暗黒の核を持つ大きく見えます。細胞質は、核の周りに明るいハローとして表示されます。
注:適切な分解は、洗剤の勾配から生成された分解分画内の特定のタンパク質を分析するためにウェスタンブロッティングを使用することによってさらに確認される。
- 核分画と細胞質画分を分離するために特定の細胞タイプに使用する洗剤の最適な濃度を決定するには、最初に洗剤の勾配を実行します。1:20 ~1:60 の範囲(つまり、2.5 μL ~ 0.8 μL の洗剤を 50 μL の低トニック バッファーに含む)で十分である必要があります。
- 一旦lyslysを行い、4°Cで30sの14,000 x gでサンプルを遠心分離します。
- 上清をあらかじめ冷やされたラベルの付いたマイクロフュージチューブに慎重に移します。この細胞質画分は、さらなる分析のために必要になるまで-80°Cで保存することができる。残りのペレットには核分数が含まれています(ステップ3.5)。
注:サンプルの繰り返し凍結/解凍サイクルを避けてください。
- 各サンプルに洗剤0.8~2.5μL(1:20~1:60)を加え、10sの最高値で渦を加えます。
- 核分画の準備:各核ペレットを上下にピペッティングして、完全な分解バッファー(ステップ3.2.4)の50 μLで再中断します。
注:完全なリシスバッファーの体積は、開始セル番号に従って経験的に調整することができる。- 2.5 μLの洗剤を加えて、核膜に関連するタンパク質を10s.10s.氷上で30分間インキュベートします。
- 30sの最も高い設定の渦は、4 °Cで20分のために14,000 x gでサンプルを遠心分離する。
- 上清を、あらかじめ冷やされたラベルの付いたマイクロフュージチューブに移します。この核画分は、さらなる分析のために必要になるまで-80°Cで保存することができます。
注:サンプルの繰り返し凍結/解凍サイクルを避けてください。
- CLL細胞からの全細胞リサテス(WCL)の調製
注:全細胞抽出物の調製は、核画分の調製と同時に行うことができる(ステップ3.5)。- 完全な分解バッファーの100 μL(ステップ3.2.4で調製)で全細胞抽出ペレットを上下にピペッティングし、5μLの洗剤を加えて完全な細胞分解を確保します。氷の上でサンプルを30分間インキュベートします。
- 30sの最も高い設定の渦は、4 °Cで20分のために14,000 x gでサンプルを遠心分離する。
- 上清を冷やしたマイクロフュージチューブに移します。この全細胞リサートは、さらなる分析のために必要になるまで-80°Cで保存することができる。
注:サンプルの繰り返し凍結/解凍サイクルを避けてください。
4. 細胞下画分の下流分析
注:このプロトコルでは、生成された細胞画分の分析は、標準プロトコルを用いてウェスタンブロッティングによって行われ、核および細胞質画分分に対して同じ細胞数/レーン(タンパク質の約10μgに相当)をロードした。
- 核分画と細胞質画分の間のタンパク質間取引の定量:信号強度の定量化、または自由に利用可能なウェスタンブロット解析ソフトウェアを使用した密度測定を通じて定量的ウェスタンブロット解析を実行します。
- 画像の読み込み:異なる開発機器から生成された西洋のブロット画像は、JPG、PNGまたはTIFFファイルとしてインポートする必要があります。16 ビットの深さの RAW ファイルをお勧めします。画像を読み込むには、ソフトウェア アイコンをクリックし、[インポート] にカーソルを合わせる。次に、[サードパーティの画像] をクリックします。イメージ ファイルを選択し、[開く]をクリックします。
- 画像の表示:イメージ リボンで、[表示]グループの[選択]ボタンをクリックします。[表示の調整]ダイアログが開き、必要に応じてさらに調整が可能になります。[イメージ LUT]タブの調整可能なスライダを使用して、明るさやコントラストなどの追加機能を実装します。
- データ分析(チャネル選択解除):解析リボンをクリックします。1 つのチャネルのみを分析するには、解析対象のチャネルの選択を解除します。イメージ LUT でチャンネルの [チャンネルを表示しない] サムネイルをクリックすると、目的のチャンネルのみが表示されます。JPG、PNG、または TIFF ファイルとしてインポートされた画像は、複数の不要な RGB チャンネルの選択を解除する必要があります。
-
図形の追加:信号強度を定量化するには、[長方形を追加]をクリックして、画像に四角形を追加します。フィーチャーの中心(タンパク質バンドなど)をクリックして、その中心に長方形を配置します。または、図形を手動で描画するには、[四角形を描画]を選択します。目的の図形をすべて追加したら、[選択]をクリックして、選択ツールにカーソルを戻します。
注:データは順番に生成される ID 番号で並べ替えられ、論理的な順序で複数の図形を追加します。 -
背景減算:バックグラウンドノイズを減らすには、[バックグラウンド]グループの最初のボタンをクリックし、ドロップダウンメニューから中央値を選択します。[バックグラウンド]ダイアログで境界線の幅を 3 に設定し、背景計算に使用するセグメントを選択します。使用するセグメントを選択するときは、イメージの背景を最もよく表すセグメントを選択します。
注:バックグラウンドノイズは信号定量に影響を与える可能性があるため、対象の形状からの信号を正確に計算するには減算する必要があります。 -
トリム信号とトリム背景 - オプション:JPG、PNG、または TIFF 形式でインポートされたファイルは、タンパク質バンド内でピクセル彩度(強調表示/明るい領域)を示す場合があります。トリム信号とトリムの背景(Bkgnd)は、解析から飽和ピクセルを削除します。これらの値を表示するには、テーブル ビューの右側にある[列]ボタンをクリックして、トリム信号とトリム Bkgndをテーブルに追加します。
注:ピクセルの飽和は、信頼性の低い定量化につながる可能性があります。飽和ピクセルは、図形内のピクセルの 5% 未満が飽和している場合にのみ削除できます。
-
図形の追加:信号強度を定量化するには、[長方形を追加]をクリックして、画像に四角形を追加します。フィーチャーの中心(タンパク質バンドなど)をクリックして、その中心に長方形を配置します。または、図形を手動で描画するには、[四角形を描画]を選択します。目的の図形をすべて追加したら、[選択]をクリックして、選択ツールにカーソルを戻します。
- データのエクスポート:テーブルの上にある [図形]タブをクリックします。密度メトリーでは、[シグナル]列の値が必要です。シグナルは、Bkgnd とエリアの積を差し引いたシェイプのピクセル強度値(合計)の合計です。[レポート] ボタンをクリックします。[名前を付けて保存]または[スプレッドシートを起動]をクリックします。
信号 = 合計 – (Bkgnd x エリア)
注:[図形] タブには、シグナル、合計、面積、Bkgrnd などの定量値のテーブルが表示されます。 - タンパク質発現の定量化:保存されたスプレッドシート内で、得られたタンパク質のシグナルを対応するタンパク質負荷制御バンドのシグナルで割ることによって、各レーンまたは変数に対する目的タンパク質の正規化発現を計算する。
注:核分画と細胞質画分を横切る正規化タンパク質の量の比較は、核分画と細胞質画分を区別するために使用される異なる負荷制御のために直接比較することはできません。しかし、個々の画分内の比較は、例えば薬物治療の後に、適切である。 - パブリケーションまたはプレゼンテーション用のイメージをエクスポートする:テーブルの上にある [画像]タブをクリックし、エクスポートするイメージをクリックします。スライド プレゼンテーションまたはその他のデジタル形式でイメージを使用する場合は、ソフトウェア アイコンをクリックし、エクスポートにカーソルを合わせると、[デジタル メディア用のイメージ]をクリックします。必要に応じて、イメージを JPG、PNG、または TIFF ファイルとして保存します。
結果
一次CLL細胞の実験を計画する際、アッセイに多数の細胞(>50 x 106細胞)が必要な場合、解凍を必要とする凍結保存細胞ではなく、新たに単離されたCLL細胞を使用する必要がありますが、これは必ずしもそうではありません。可能。これは、凍結/解凍プロセスにより、CLL細胞の最大50%が死亡する可能性があるためです。ここに記載されている密度遠心分離を用いてWCC>40 x 106/mLを用いてCLL細胞を濃縮することで、高純度(≥95%)で高い細胞回収が可能プライマリ CLL セルの。示されたサンプルでは、WCC=177 x 106/mL:30mL血液試料5x109細胞から回収し、これは全細胞の94%の細胞収率を表す。フローサイトメトリーによるこのサンプルの分析は、FSC/SSC上でゲーティングした後のCLL細胞マーカーCD19とCD5の二重表面発現によって示される>95%のCLL細胞の純度を明らかにした、DAPI陰性(生存細胞)であった単一細胞(図1)。
細胞質分画の最適化手順は、細胞質画分率の調製中に洗剤比の範囲(1:20~1:60)を用いて行った(ステップ3.4)。その後、核分画とWCLを用意した(それぞれ手順3.5と3.6)。免疫ブロットは、CLL細胞株MEC1(図2A)および一次CLL細胞(図2B)の結果の画分に対して行った。ブロットをラミンA/C(核;74/63 kDa)およびβ-チューブリン(細胞質;55kDa)の画分マーカーについてプローブし、細胞分画の成功を確認した。分画は、MEC1細胞に対する最適な洗剤レベルが1:60希釈(図2A)であり、一次CLL細胞に最適である1:30希釈(図2B)と比較して、濃縮によって示される。核タンパク質と分数の細胞質タンパク質の欠如とその逆.WCLは全タンパク質を表し、細胞下画分のプローブに使用される抗体の陽性対照として機能します。分画マーカーとして適切なタンパク質を選択することが重要である:図2Cは、RNAポリメラーゼII(Rpb1 CTD;250 kDa)およびラミンA/Cをマーカーとして消したMEC1細胞から調製された核/細胞質分画の免疫ブロットを示す。核画分は、β-チューブリンおよびγ-チューブリン(50kDa)が細胞質マーカーとして用いた。γ-チューブリンが細胞質に富むことは明らかであるが、前に示したように、核では発現が明らかである。
実験条件が最適化されると、実験を行うことができます。示された実施例では、核および細胞質画画におけるFOXO1の細胞下局在化は、MEC1細胞における二重mTORC1/2阻害剤AZD8055の有無におけるB細胞抗原受容体(BCR)を有する細胞の刺激時に決定された(図 3A)および一次 CLL セル (図 3B)5,10.いずれの実施例でも、高度に濃縮された核分画および細胞質画分の生成は、細胞質画分におけるラミンとβチューブリンのほぼ排他的発現によって示された。いずれの細胞型でも、NDCと比較してAZD8055を用いた治療後の細胞質においてFOXO1発現が減少し、核コンパートメントにおけるFOXO1発現の増加を伴い、タンパク質転位を実証した(図3)。データ解釈の主観性を取り除くために、5つの主要なCLLサンプルから個々の免疫ブロットを細胞下画分内で定量した(ステップ4;図4Aは、各試料の内部負荷制御としてそれぞれの核または細胞質タンパク質を用いて、次いで、示されているように、非刺激(米国)薬物制御(NDC)制御に各分数を正規化する。結果のグラフは、核と細胞質画の間のFOXO1運動の傾向を示し、AZD8055は細胞質におけるFOXO1発現のレベルを低下させ、同時に核内の発現を増加させる。さらに、細胞質FOXO1発現の標高はBCR架橋で明らかである。
| チューブ | チューブ名 | セル/ビーズ | 抗原 | フルオロフォア |
| 1 | 染み込みなし | 細胞 | Na | Na |
| 2 | シングルステイン | ビーズ | CD5 | Fitc |
| 3 | シングルステイン | ビーズ | CD19 | PE-サイ7 |
| 4 | シングルステイン | ビーズ | CD23 | Apc |
| 5 | シングルステイン | ビーズ | CD45 | APC-Cy7 |
| 6 | シングルステイン | 細胞 | 生存 率 | DAPI |
| 7 | CLLステイン | 細胞 | CD5、CD19、CD23、CD45、生存率 | FITC、PE-Cy7、APC、APC-Cy7&DAPI |
表1:CLL細胞のフローサイトメトリーに必要なサンプルチューブの理想的なセットを示す表。各実験には、得られた結果を正確に分析するための適切なコントロールをすべて含める必要があります。
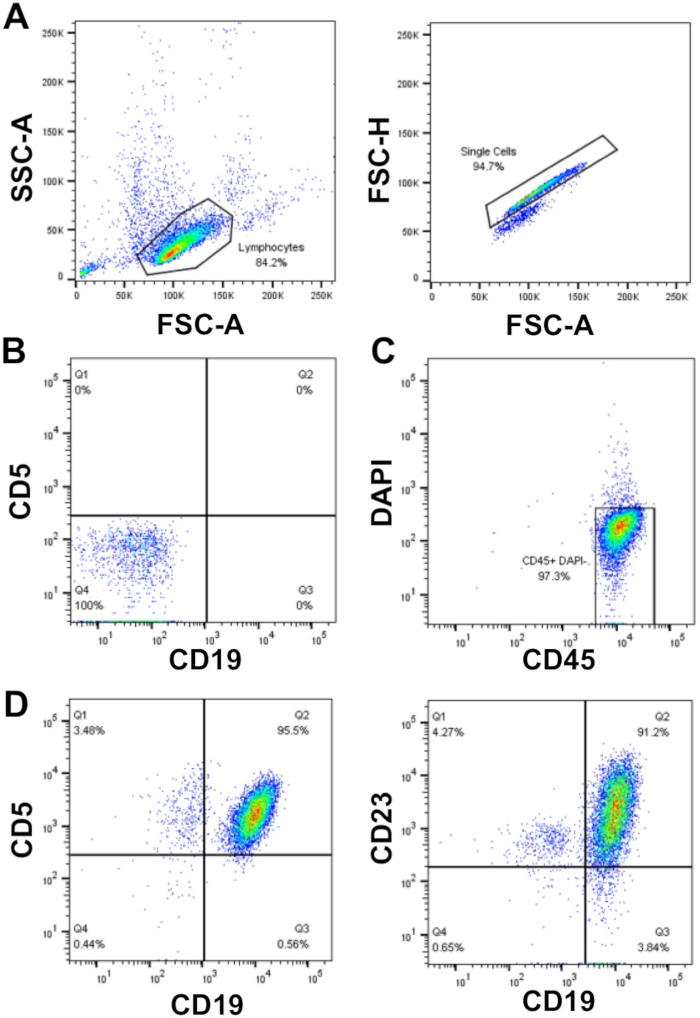
図1:濃縮CLL患者の代表的なフローサイトメトリー分析プロット。個々のCLL患者の末梢血から濃縮された単核CLL細胞をFSC-A対SSC-Aを用いてゲートし、次いでFSC-A対FSC-H(A)を用いて二重を除外した。 染色されていない細胞(チューブ1)と補償制御(チューブ2-6)を使用して、細胞を検出し、蛍光チャネル間を補正するフローサイトメーターを設定し、蛍光シグナルが正しく検出されたことを確認しました。(B)CD19およびCD5蛍光チャネルにおける陰性染色(無染色細胞;チューブ1)の一例。ライブ(DAPI陰性)およびCD45陽性細胞をゲート(C)とCD19+CD5+(95.5%)CD19+CD23+ (91.2%)DAPI内の細胞-CD45+母集団が決定された(D)。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図2:核/細胞質画分画の最適化細胞質および核画分、および全細胞凝集物(WCL)は、CLL細胞株(A)MEC1または(B)に記載されている患者の末梢血から濃縮された一次CLL細胞の細胞ペレット(10〜20x106細胞)から調製した。手順 3.細胞質画分率を調製する際の洗剤比の範囲(1:20~1:60)を用いて細胞内画分分の最適化を行った(ステップ3.4に記載)。得られたサンプルを免疫ブロロットし、抗ラミンA/C(核)および抗βチューブリン(細胞質)抗体を用いてプローブし、WCLと並んで細胞分画の成功を確認した。分子量マーカーは、ブロット(M)の左側に示されている。*細胞リシスに最適な洗剤条件を示します。(C)刺激の不在(+または-BCR架橋)の存在下で、対照条件(NDC)または薬物治療(8055)を有するMEC1細胞からの核および細胞質画分の免疫ブロト。ブロットは、抗Rbp1 CTD(クローン4H8;RNAポリメラーゼIIサブユニットB1を認識)、抗ラミンA/C、抗βチューブリンまたは抗γチューブリン(クローンGTU-88)抗体を用いてプローブし、細胞外画分を同定した。この図のより大きなバージョンを表示するには、ここをクリックしてください。
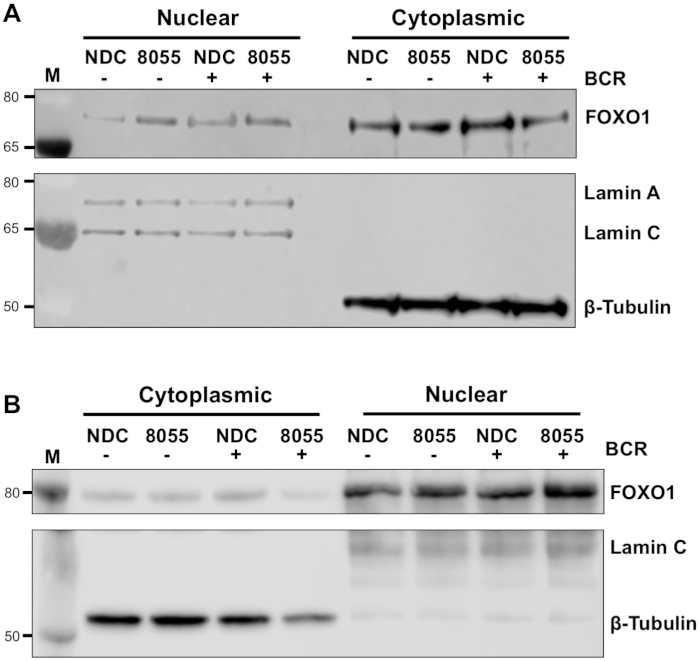
図3:細胞内分画は、CLLにおける核と細胞質間のFOXO1のシャトルを示す。(A)MEC-1細胞および(B)一次CLL細胞を100nM AZD8055(8055)で30分間前処理し、または示されているように未処理(NDC)のままにし、その後BCRを1時間または米国を残した。次に、核および細胞質画分を調製し、免疫ブロロットした。抗ラミンA/C(核)および抗βチューブリン(細胞質)抗体による分画の確認を行った後、抗FOXO1抗体を用いてFOXO1タンパク質発現に対して薬物治療とBCRライゲーションの両方の効果を評価した。Mは分子量マーカーを示す。この図のより大きなバージョンを表示するには、ここをクリックしてください。
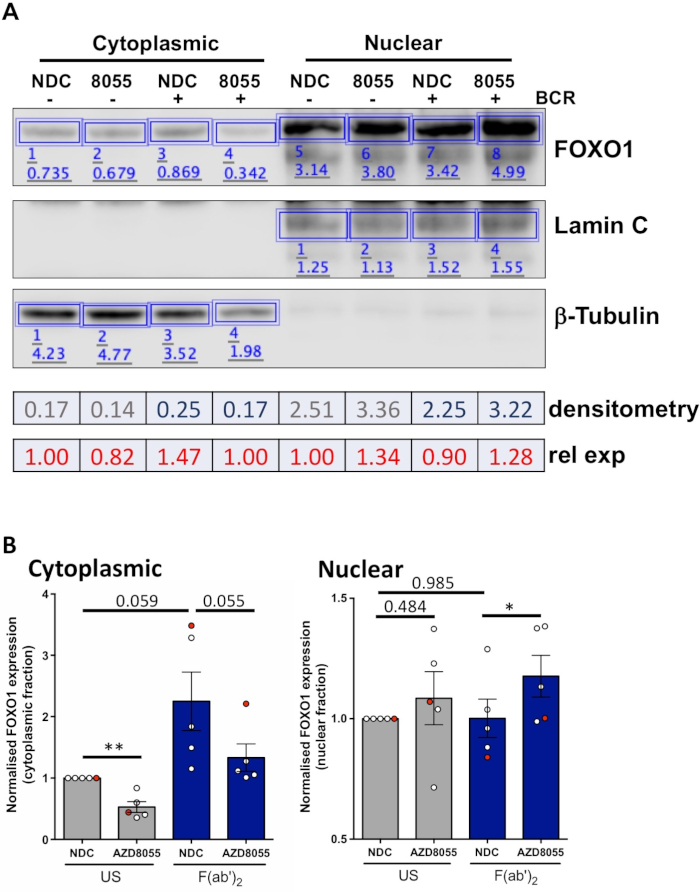
図4:定量的ウェスタンブロット分析(デンシトメトリー)の働いた例。(A)デンシトメトリーは、オンラインで入手可能なウェスタンブロット分析ソフトウェアを用いて行った。簡単に言えば、解析リボン内で、信号強度を計算するために画像内のタンパク質バンドの周りに長方形が描かれました。図示は、細胞質/核分画を受けたCLL患者サンプルの代表的なウェスタンブロット画像のデンシトメトリーである。細胞質および核画分は、細胞質(β-チューブリン)および核(ラミンA/C)マーカーの発現によって区別される。特定の条件に対するFOXO1の正規化発現は、分析される分数に応じて、FOXO1に対して得られたシグナルをβ-チューブリンまたはラミンA/Cに対する対応するシグナルで割ることによって計算することができる。相対FOXO1式(米国車両制御に対して)は、所定のセルラー画分の米国車両制御の正規化されたFOXO1式によって所定の条件の正規化されたFOXO1式を除算することによって計算することができる。(B)細胞質(左)または核(右)のFOXO1発現レベルを示すグラフは、各細胞画分内でUS-NDC制御に正規化された。グラフ上の赤い点は、示されている作業例です。このデータは、US-NDC±SEM.P値と比較したFOXO1式の平均折り目変化を、両尾学生ペアt検定によって決定した。n = 5つの個々のCLL患者サンプル。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
記載されたプロトコルは、一次CLL細胞からの核および細胞質画分の生成のための迅速かつ効率的な方法を提供し、その後の細胞刺激時の核と細胞質分画の間のタンパク質の結合の定量化そして薬物治療。提示されたデータは、Fを介したBCR架橋の有無において、二重mTOR阻害剤AZD8055を用いた治療時に、核分画と細胞質画分の間の特定のタンパク質の人身売買を検出する能力を示しています。ab')2フラグメント刺激(図3および図4)。これらの実験を個々のCLL患者サンプルからウェスタンブロットの定量化と結合することで、生成されたデータの客観的な分析を可能にし、タンパク質局在化における世界的な変化を定量化するために記載されたアッセイの堅牢性を実証する患者コホートから単離されたCLL細胞(図4)。細胞質画分の平均5つの患者サンプルがほぼ有意に達していることはデータから明らかである。CLL患者11の臨床的不均一性を考えると、これらの分析は通常、より大きな患者コホートで行われ、CLLの細胞応答のより完全な理解を得るために患者の特定の予後サブグループに焦点を当てた。特定の薬物治療に細胞。
提示されたデータは、分画の純度がこれらのマーカーによって確認されるにつれて、細胞質分画または核画分のいずれに排他的に存在するタンパク質マーカーを選択することの重要性を示す。β-チューブリンは細胞質画分確認に選ばれ、ラミンA/Cは核マーカーとして選ばれた。一般的に使用される追加のタンパク質は、細胞質画分またはBrg1(SMARCA4)、TFIIDおよびRNAポリメラーゼIIの核画分純度4、5を同定するためにGAPDHおよびα-チューブリンである。しかし、特定の画分で非常に濃縮されたタンパク質を選択する際には注意が必要であり、両方の画分(例えば、γ-tubulin)に存在しない(図2C)9。実際、GAPDHおよびアクチンは、一般的に細胞質タンパク質であると考えられているが、核12、13に局所化することができ、刺激または治療時に再配置しない分画マーカーを選択することの重要性を強調し、セルに適用されます。さらに、選択したタンパク質マーカーが細胞内画分画と共にWCLを実行することによって目的の細胞内で発現していることを確認することが重要である。
示した代表的な実験では、各条件(刺激/薬物治療)に同数のCLL細胞を用い、その後、分画試料を直ちに調製した。分画タンパク質/レーンの10 μgをロードすると、目的のタンパク質を検出するのに十分な材料が提供されます。これらのサンプルは、短期的な薬物治療と刺激(最大4時間)しか受けていないため、タンパク質レベルは各試料で同じままであり、タンパク質アッセイは行われなかった。しかし、細胞治療が延長された場合(18~72時間)、細胞内の細胞死または増殖のレベルは、適用される薬物/細胞刺激に依存して抽出されたタンパク質の質と量を著しく変化させ、治療中のタンパク質レベルを変化させる可能性がある。/刺激されたサンプル。これらの長期的な薬物治療の場合、ブラッドフォードアッセイまたは同等のタンパク質定量を用いて、ウェスタンブロッティングの前に、同じ量のタンパク質が免疫ブロットの各レーンで実行されることを確実にすることをお勧めします。洗剤の存在は、特定のタンパク質アッセイ14に干渉し得るが、この干渉は細胞分画タンパク質サンプルを希釈することによって低減することができる。さらに、完全なリシスバッファーをブランクとして使用し、試験対象のサンプルと同じ希釈を使用します。
ここで説明する知見の裏付けとなる証拠を提供するために、蛍光顕微鏡を用いて並列実験を行い、CLL細胞内のFOXO1の位置を解析し、これらの知見の可視化を可能にした5.さらに、生成された細胞下画分は、さらに下流分析における酵素活性アッセイまたはプロテオミクス分析にも使用することができる。
開示事項
著者は何も開示していない。
謝辞
著者たちは、原稿を批判的に見直してくれたナターシャ・マリク博士に感謝したいと思います。この研究は、AMM(18003)に授与されたブラッドワイズプロジェクト助成金によって資金提供されました。FACS分析施設は、ハウアット財団が資金を提供しました。MWMはポール・オゴーマン白血病研究センターのフレンズから博士課程の学生によって資金提供され、JCはポール・オゴーマン白血病研究センターのフレンズから資金提供を受け、JHはブラッドワイズプロジェクト助成金(18003)によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge Tubes | Griener Bio one | 616201 | |
| 3 mL Pasteur Pipettes | Griener Bio one | 612398 | |
| 12 mm x 75 mm FACS Tubes | Elkay | 2052-004 | |
| 15 mL Tube | Griener Bio one | 188271 | |
| 50 mL Tube | Griener Bio one | 227261 | |
| anti-CD5 FITC antibody | BD Biosciences | 555352 | phenotypic surface marker |
| anti-CD19 PE Cy7 antibody | BD Biosciences | 557835 | phenotypic surface marker |
| anti-CD23 APC antibody | BD Biosciences | 558690 | phenotypic surface marker |
| anti-CD45 APC Cy7 antibody | BD Biosciences | 557833 | phenotypic surface marker |
| anti-β-Tubulin antibody | Cell Signaling | 2146 | cytoplasmic marker |
| anti-γ-Tubulin Mouse antibody (clone GTU-88) | Sigma-Aldrich | T5326 | |
| anti-FoxO1 (C29H4) Rabbit antibody | Cell Signaling | 2880 | |
| anti-Lamin A/C antibody | Cell Signaling | 2032 | nuclear marker |
| anti-mouse IgG, HRP-linked Antibody | Cell Signaling | 7076 | Secondary antibody |
| anti-rabbit IgG, HRP-linked Antibody | Cell Signaling | 7074 | Secondary antibody |
| anti-Rpb1 CTD antibody (clone 4H8) | Cell Signaling | 2629 | nuclear marker |
| BDFACS Canto II | BD Biosciences | By Request | Flow Cytometer |
| DAPI Solution | BD Biosciences | 564907 | live/dead discriminator |
| DMSO | Sigma | D2650 | |
| EDTA | Sigma | EDS | |
| Fetal Bovine Serum | Thermofisher | 10500064 | |
| GraphPad Prism 6 | GraphPad Software | Software | |
| Histopaque1077 density gradient media | Sigma | H8889 | |
| HyperPAGE 10 - 190 kDa protein marker | Bioline | BIO-33066 | Molecular weight marker |
| Image Studio Lite (version 5.2.5) | LI-COR | www.licor.com | Software |
| Labnet VX100 | Fisher Scientific | Vortex | |
| Nucelar Extract Kit | Active Motif | 40010 | |
| OneComp eBeads | Thermofisher | 01-111-42 | |
| Trypan Blue Solution | Thermofisher | 15250061 | |
| PageRuler Plus Prestained Protein Ladder | Thermo Fisher Scientific | 26619 | Molecular weight marker |
| PBS Tablets | Fisher Scientific | BR0014G | |
| RosetteSep Human B Cell Enrichment Cocktail | Stem Cell Technologies | 15064 | |
| Sigma 3-16P | SciQuip | Centrifuge | |
| Sigma 1-15PK | SciQuip | Centrifuge |
参考文献
- Kau, T. R., Way, J. C., Silver, P. A. Nuclear transport and cancer: from mechanism to intervention. Nature Reviews Cancer. 4, 106-117 (2004).
- Turner, J. G., Dawson, J., Sullivan, D. M. Nuclear export of proteins and drug resistance in cancer. Biochemical Pharmacology. 83, 1021-1032 (2012).
- Nakamura, N., et al. Forkhead transcription factors are critical effectors of cell death and cell cycle arrest downstream of PTEN. Molecular and Cellular Biology. 20, 8969-8982 (2000).
- Calnan, D. R., Brunet, A. The FoxO code. Oncogene. 27, 2276-2288 (2008).
- Cosimo, E., et al. AKT/mTORC2 inhibition activates FOXO1 function in CLL cells reducing B cell receptor-mediated survival. Clinical Cancer Research. 25, 1574-1587 (2019).
- Mahipal, A., Malafa, M. Importins and exportins as therapeutic targets in cancer. Pharmacology & Therapeutics. 164, 135-143 (2016).
- Hing, Z. A., et al. Next-generation XPO1 inhibitor shows improved efficacy and in vivo tolerability in hematological malignancies. Leukemia. 30, 2364-2372 (2016).
- Lapalombella, R., et al. Selective inhibitors of nuclear export show that CRM1/XPO1 is a target in chronic lymphocytic leukemia. Blood. 120, 4621-4634 (2012).
- Hořejší, B., et al. Nuclear γ-tubulin associates with nucleoli and interacts with tumor suppressor protein C53. Journal of Cellular Physiology. 227, 367-382 (2012).
- McCaig, A. M., Cosimo, E., Leach, M. T., Michie, A. M. Dasatinib inhibits B cell receptor signalling in chronic lymphocytic leukaemia but novel combination approaches are required to overcome additional pro-survival microenvironmental signals. British Journal of Haematology. 153, 199-211 (2011).
- Fischer, K., Hallek, M. Optimizing frontline therapy of CLL based on clinical and biological factors. Hematology. American Society of Hematology. Education Program. 2017, 338-345 (2017).
- Butera, G., et al. Regulation of autophagy by nuclear GAPDH and its aggregates in cancer and neurodegenerative disorders. International Journal of Molecular Sciences. 20, 2062 (2019).
- Virtanen, J. A., Vartiainen, M. K. Diverse functions for different forms of nuclear actin. Current Opinion in Cell Biology. 46, 33-38 (2017).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178, 263-268 (1989).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved