Method Article
Nükleer/Sitoplazmik Protein Ticaretini İzlemek Için Primer Kronik Lenfositik Lösemi Hücrelerinin Subsellüler Fraksiyonları
Bu Makalede
Özet
Bu protokol, primer kronik lenfositik lösemi hücrelerinden nükleer ve sitoplazmik fraksiyonların optimizasyonu ve daha sonra verimli bir şekilde üretilmesini sağlar. Bu örnekler protein lokalizasyonunun yanı sıra hücre stimülasyonu ve ilaç tedavisi üzerine nükleer ve sitoplazmik bölmeler arasında gerçekleşen protein ticaretindeki değişiklikleri belirlemek için kullanılır.
Özet
Makromoleküllerin nükleer ihracatı genellikle kanser hücrelerinde deregulated olduğunu. Tümör baskılayıcı proteinler, p53 gibi, anormal hücresel lokalizasyon etki mekanizmasını bozan nedeniyle inaktif hale getirilebilir. Kronik lenfositik lösemi (KLL) hücrelerinin sağkalım, diğer kanser hücreleri arasında, sitoplazmik shuttling nükleer deregülasyon tarafından desteklenmektedir, taşıma reseptörü XPO1 ve kurucu aktivasyon deregülasyonu ile en azından kısmen PI3K aracılı sinyal yolları. Bu tür proteinlerin hastalığın patobiyolojisindeki rolünü daha iyi anlamak için bireysel proteinlerin hücre içi konumları bağlamında rolünü anlamak esastır. Ayrıca, hücre altı protein ticareti bağlamında hücre stimülasyonunun ve spesifik farmakolojik inhibitörlerin etki mekanizmasının altında yatan süreçlerin belirlenmesi, hücre altı protein ticareti bağlamında, Eylem. Burada açıklanan protokol, primer kronik lenfositik lösemi hücrelerinden nükleer ve sitoplazmik fraksiyonların optimizasyonu ve sonraki etkin üretimine olanak sağlamaktadır. Bu kesirler hücre stimülasyonu ve ilaç tedavisi üzerine nükleer ve sitoplazmik fraksiyonlar arasındaki protein ticaretindeki değişiklikleri belirlemek için kullanılabilir. Veriler, immünoresan görüntülere paralel olarak ölçülebilir ve sunulabilir, böylece sağlam ve ölçülebilir veriler sağlanabilir.
Giriş
Çekirdek ve sitoplazma arasında makromoleküllerin taşınması uzun normal hücresel fonksiyon önemli bir rol oynamak için kurulmuştur ve genellikle kanser hücrelerinde deregulated1,2. Bu tür deregülasyon, nükleer ihracatı kontrol eden proteinlerin aşırı ekspresyonundan/mutasyonundan kaynaklanabilir. Bu tür bir protein Exportin-1 (XPO1), çekirdekten sitoplazmaya >200 nükleer ihracat sinyali (NES) içeren proteinleri ihraç eden bir taşıma reseptörüdür2. XPO1-kargolar p53 içerir, FOXO aile üyeleri ve IB, eylem kendi mekanizması inhibe ederek onların inaktivasyonu katkıda1,2,3. Daha fazla protein yanlışlaştırması, mikroçevresel sinyallerin kanser hücrelerini etkisi haline getirerek fosfatidil-inositol-3-kinaz (PI3K)/Akt yolu gibi hücre içi sinyal yollarının aktivasyonuna yol açması yla ortaya çıkabilir. FOXO aile üyelerinin inaktivasyonu ve çekirdekten sonraki ihracat4,5. Tümör baskılayıcı proteinlerin bu tür yanlış lokalizasyonu hematolojik ve solid tümörlerin bir dizi ilerlemesi nde karıştığı olmuştur1,2,6.
XPO1 fonksiyonuna bağlanan ve seçici olarak inhibe eden hematolojik malignitelerde (akut miyeloid lösemi (AML)/CLL) klinik kullanım için küçük molekül inhibitörlerinin geliştirilmesi, farmakolojik ajanların nükleer ve sitoplazmik bölmeler arasındaki proteinlerin kapatılması üzerindeki etkisi6,7,8. Görüntüleme teknikleri, ilaç tedavilerinin dış uyarılması üzerine hücre altı bölmelerdeki proteinlerin tanımlanmasını önemli ölçüde mümkün kılmıştır, ancak sağlam ve destekleyici paralel tekniklerin önemi güvenilir bir sonucun geçerliliği konusunda bilimsel bir kitleye bilgi vermek.
Hasta kan örneklerinden izole edilen istirahat lenfositler ve malign KLL-B hücreleri yüksek nükleer nedeniyle nükleer ve sitoplazmik fraksiyonların oluşumunda bir sorun teşkil etmektedir: sitoplazmik oran. Sağlam ve güvenilir deneysel veriler üretmek için deneysel koşulların optimizasyonu, gelecekteki deneysel programların planlanmaları için elbette çok önemlidir. Burada açıklanan yöntem, nükleer ve sitoplazmik fraksiyonlarda proteinlerin sayısallaştırılmasını sağlar ve bu proteinlerin hücresel stimülasyon ve/veya ilaç tedavisi ile nasıl etkilenebileceğini belirler.
Protokol
Burada açıklanan CLL hastalarından alınan birincil örneklerin kullanımı West of Scotland Research Ethics Service, NHS Greater Glasgow ve Clyde (Uk) tarafından onaylanmıştır ve tüm çalışmalar onaylanan yönergelere uygun olarak yürütülmüştür.
1. Hasta Kan Örneklerinden CLL Hücrelerinin İzolasyon
-
Daha önce rıza gösterilmiş CLL hastalarından periferik kan örnekleri EDTA kan toplama tüplerinde, beyaz hücre sayımı (WCC) eşliğinde klinikten alınır. Periferik kan CLL örneklerini WCC'ye göre arındırın. WCC < 40 x 106 hücre/mL için adım 1.1.1'e geçin; WCC ≥ 40 x 106 hücre/mL için adım 1.1.2'ye geçin.
- Tüm EDTA kan tüplerinin içeriğini 50 mL konik santrifüj tüpüne dökün ve 1 mL kan başına 50 μL İnsan B Hücre Zenginleştirme Kokteyli ekleyin. 20 dk. Adım 1.1.2'ye kadar oda sıcaklığında (RT) kuluçkaya yatın.
- Örneği RT CLL yıkama tamponu (fosfat tamponlu salin (PBS), %0,5 Fetal Sığır Serumu (FBS) ve 2 mM EDTA ile 1:1 oranında seyreltin.
- Aliquot RT yoğunluk gradyan ortam, numune için uygun büyüklükte konik santrifüj tüpüne (10 mL'lik bir 50 mL tüpe 30 mL numune veya 10 mL numune için 15 mL tüpe 4 mL).
- Numuneyi yoğunluk gradyan ortamının üzerine dikkatlice katlayın ve 400 x g'de RT'de 30 dakika boyunca santrifüj edin.
NOT: Numuneler santrifüje yerleştirilmeden önce santrifüjün RT'de olduğundan emin olun, çünkü sıcaklık değişimi mononükleer hücrelerin kötü zenginleşmesine neden olacak ve ani frenleme sıvı arabirimi bozabileceğinden santrifüjün frenini kapatın. - Yoğunluk gradyan ortamının ve CLL yıkama tamponunun arabiriminde toplanan mononükleer hücrelerin beyaz tabakasını plastik pastöre pipet kullanarak yeni bir 50 mL konik santrifüj tüpe yavaşça hasat edin.
- Hücreleri yıkamak için izole monolayer cll yıkama tampon 40 mL ekleyin ve RT 10 dakika için 300 x g santrifüj.
- Supernatant atın, tüpün alt flicking tarafından pelet resuspend, sonra adım 1.5 açıklanan yıkama adımı tekrarlayın.
- Supernatant atın, adım 1.6 açıklandığı gibi pelet resuspend, sonra CLL yıkama tampon (kadar 40 mL, hücre pelet boyutuna bağlı olarak) bir dizi hacim pelet askıya.
- Trypan mavisi ve hemositometre kullanarak hücreleri say. Sonra CLL hücrelerinin saflığını kontrol etmek için sitometri akışı devam edin.
NOT: Bu aşamada CLL hücreleri deneylerde kullanılmak üzere medyada 10 x 106 hücre/mL konsantrasyonda kültürlenebilir ve/veya 100 x 106 hücre/şişeye kadar olan konsantrasyonlarda ileride çalışmak üzere %10 dimetil sülfoksit (DMSO)/FBS'de kriyopreserved yapılabilir.
2. CLL Hücrelerinin Akış Sitometrisi
- Etiket 12 mm x 75 mm yuvarlak dipli polistiren tüpler Tablo 1'deaçıklandığı gibi.
- Tüpler 2 -5, tazminat boncuk bir damla koymak ve buz üzerinde saklayın. 2- 5 numaralı tüplere uygun antikordan (anti-CD5, CD19, CD23 veya CD45) 1 μL ekleyin ve buz kovasının üzerine folyo yerleştirerek ışıktan korunarak 20 dakika boyunca buz üzerinde kuluçkaya yatırın.
NOT: Bu tüpler akış sitometri şablonu kurmak için tazminat kontrolleri olarak hizmet vermektedir. -
Tüpler 1, 6 ve 7 içine 1 x 106 CLL hücreleri kadar koyun, hücreleri yıkamak için RT 5 dakika için 300 x g 300 x g facs tampon (PBS + 2% FBS) 2 mL ekleyin. Supernatant atın ve buz üzerinde hücre pelet içeren tüpleri saklayın.
- Hücre peletlerini yeniden askıya alın ve TABLO 1'debelirtildiği gibi tüp 7'deki hücrelere uygun antikor kombinasyonunu ekleyin , FACS tamponu ile 100°L'lik son bir hacimde. Antikorlar üretici kurallarına uygun olarak uygun bir konsantrasyonda kullanılır.
- 2 ve 6 numaralı tüplerdeki hücre peletlerini 100 μL'lik FACS tamponunda yeniden askıya alın.
- 2 - 5 numaralı tüplerdeki lekeli boncukların yanı sıra, 20 dakika boyunca ışıktan korunan hücreleri buz üzerinde kuluçkaya yatırın.
- Kuluçkadan sonra, tüm tüplere 2 mL FACS tamponu ekleyin ve hücreleri yıkamak için RT'de 5 dk için 300 x g'de santrifüj ekleyin. Supernatant atın ve yavaşça tüpler flicking tarafından boncuk / hücre pelet askıya.
- Resuspend tüpleri 1 - 5 100° L FACS tampon ve akış sitometre üzerinde analiz hazır olana kadar buz üzerinde yerleştirin.
- DAPI çözeltisini kullanımdan hemen önce FACS tamponundaki 0,05-0,2 μg/mL'ye seyreltin. Optimal konsantrasyon değişebilir ve titrasyon önerilir.
- Resuspend tüpleri 6 ve 7 seyreltilmiş DAPI çözeltisi 100 μL ile ve hücrelerin leke izin vermek için en az 5 dakika buz tüpleri kuluçka.
NOT: Ölü hücrelerin etiketlenmiş kalması için arabellekte DAPI bulunması gerektiğinden, başka yıkama gerekmez. DAPI eklendikten sonra, hücreler 4 saat içinde akış sitometresi üzerinde analiz edilmelidir. - Akış sitometrekullanarak hücreleri analiz edin.
3. CLL Hücrelerinden Hücre Altı Fraksiyonlarının Hazırlanması
NOT: Deneysel kurulum planlarken, tüm hücre ekstresi oluşturulabilir hangi uyarılmamış / işlenmemiş hücrelerin bir kuyu içerir.
- MEC1 CLL hücre hattı veya izole primer CLL hücrelerinin istenilen stimülasyon ve/veya ilaç tedavisini 10 – 20 x 106 hücre/koşul kullanarak gerçekleştirin. Hücreler daha sonra hücre altı fraksiyonu (adım 3.4 & 3.5) veya tüm hücre ekstresi (adım 3.6) oluşturmak için kullanılacaktır.
- Çözeltilerin/tüplerin hazırlanması: Hücreler hasat edilmeden önce tüm çözümleri/arabellekleri kesirasyon gününde taze olarak hazırlayın. Gerekli olana kadar buz üzerinde saklayın ve hazırlık 4 saat içinde kullanın.
- PBS/fosfataz inhibitörü çözeltisi: 1x PBS'de 1:20 fosfataz inhibitörlerini seyrelterek PBS'deki fosfataz inhibitörlerini hazırlayın (yani, 0.5 mL fosfataz inhibitörleri 9.5 mL 1x PBS).
NOT: Fosfataz inhibitörlerinin çökelmediğinden emin olun. Bir çökelti varsa, 10 dakika boyunca 50 °C'ye ısıtın. - Hipotonik tampon: Distile suda 10x hipotonik tamponun 1:10 seyreltilmesini sağlayarak 1x hipotonik Tampon'u hazırlayın (yani, 50 μL 10x hipotonik Tampon 450 μ L dH2O'ya).
- 10 mM dithiothreitol (DTT): Distile su ile 1M DTT 1:100 seyreltme yaparak 10 mM DTT hazırlayın (yani, 10 μL 1 M DTT dH2O).
NOT: DTT son derece labile bu yüzden taze her zaman hazırlamak. Tekrarlanan donma/çözülme döngülerinden kaçının. - Tam lisis arabelleği: Her deneme için ne kadar arabellek gerektiğini belirleyin. Her numune 50 μL tam lysis tampon gerektirir, bu nedenle 5 μL 10 mM DTT (adım 3.2.3) ila 44.5 μL lysis tampon ekleyin ve sonra 0.5 μL proteaz inhibitörü kokteyli ekleyin. Bu miktar, deneydeki numune sayısına bağlı olarak büyütülebilir.
- Etiket her stimülasyon ve / veya ilaç tedavisi için her stimülasyon ve / veya ilaç tedavisi için dört set taze uyarılmış hücreler (adım 3.3), taze üretilen sitoplazmik fraksiyonları (adım 3.4.3), taze üretilen nükleer fraksiyonları (adım 3.5.3) ve tüm hücre lysates (adım 3.6.3). Önceden gerekli kadar buz üzerinde bu mikrofuge tüpler iper.
- PBS/fosfataz inhibitörü çözeltisi: 1x PBS'de 1:20 fosfataz inhibitörlerini seyrelterek PBS'deki fosfataz inhibitörlerini hazırlayın (yani, 0.5 mL fosfataz inhibitörleri 9.5 mL 1x PBS).
- Hücreleri tek tek etiketlenmiş 1,5 mL mikrofuge tüplere ve peletlere 200 x g'de 4 °C'de 5 dk santrifüj ederek aktarın. Supernatant çıkarın ve buz gibi PBS / fosfataz inhibitörleri 1 mL hücreleri resuspend (adım 3.2.1). 4 °C'de 5 dk için 200 x g'de santrifüj ile hücreleri pelet. Supernatant çıkarın ve buz üzerinde hücre pelet tutun.
- Sitoplazmik fraksiyonların hazırlanması: 1x hipotonik Tamponun 50 μL'sinde hücre altı fraksiyonu için kullanılacak hücre peletlerini yavaşça askıya alın (adım 3.2.2). Hücrelerin şişmesine izin vermek için 15 dakika boyunca buz üzerindeki hücreleri kuluçkaya yatırın.
NOT: Kullanılan hipotonik tampon hacmi hücre sayısına bağlı olarak ampirik olarak artırılabilir.- Her numuneye 0,8 - 2,5 μL (1:20 ila 1:60) deterjan ekleyin ve 10 s için en yüksek ayarda girdap ekleyin.
- Nükleer ve sitoplazmik fraksiyonları izole etmek için belirli bir hücre tipi için kullanılacak en uygun deterjan konsantrasyonunu belirlemek için, başlangıçta bir deterjan gradyan gerçekleştirin. 1:20-1:60 aralığı (yani, 2.5 μL ile 0.8 μL arasında 50 μL Hipotonik Tampon'a kadar) yeterli olmalıdır.
NOT: Adım 3.4'teki hipotonik tampon hacmi ayarlanırsa, uygun deterjan oranının korunun. - Deterjan ilavesinden önce ve sonra faz kontrastmikroskobu kullanarak hücreleri gözlemleyerek hücre lisisini doğrulayın. Tüm hücreler yoğun, koyu çekirdekli daha büyük görünür. Sitoplazma çekirdeğin etrafında parlak bir hale olarak görünecektir.
NOT: Deterjan degradesinden elde edilen lysed fraksiyonları içindeki spesifik proteinleri analiz etmek için Batı lekeleme kullanılarak uygun lysis daha da doğrulanır.
- Nükleer ve sitoplazmik fraksiyonları izole etmek için belirli bir hücre tipi için kullanılacak en uygun deterjan konsantrasyonunu belirlemek için, başlangıçta bir deterjan gradyan gerçekleştirin. 1:20-1:60 aralığı (yani, 2.5 μL ile 0.8 μL arasında 50 μL Hipotonik Tampon'a kadar) yeterli olmalıdır.
- Bir kez lysed, 4 °C'de 30 s için 14.000 x g numuneleri santrifüj.
- Supernatant'ı önceden soğutulmuş, etiketli mikrofuge tüpüne dikkatlice aktarın. Bu sitoplazmik fraksiyon daha fazla analiz için gerekli olana kadar -80 °C'de saklanabilir. Kalan pelet nükleer fraksiyonu içerir (adım 3.5).
NOT: Örneklerin tekrarlanan donma/çözülme döngülerinden kaçının.
- Her numuneye 0,8 - 2,5 μL (1:20 ila 1:60) deterjan ekleyin ve 10 s için en yüksek ayarda girdap ekleyin.
- Nükleer kesirlerin hazırlanması: Her nükleer peleti 50 μL'lik tam lisis tamponu (adım 3.2.4) içinde yukarı ve aşağı borular oluşturarak yeniden askıya alın.
NOT: Tam lisis tamponhacmi başlangıç hücre numarasına göre ampirik olarak ayarlanabilir.- Nükleer membran ve girdap ile ilişkili proteinleri 10 sin için en yüksek ayarda hassaslaştırmak için 2,5 μL deterjan ekleyin.
- 30 s için en yüksek ayarda girdap, sonra 4 °C'de 20 dk için 14.000 x g'de numuneleri santrifüj edin.
- Supernatant önceden soğutulmuş, etiketli mikrofuge tüp içine aktarın. Bu nükleer kesir daha fazla analiz için gerekli olana kadar -80 °C'de saklanabilir.
NOT: Örneklerin tekrarlanan donma/çözülme döngülerinden kaçının.
- CLL hücrelerinden tüm hücre lisatlarının (WCL) hazırlanması
NOT: Tüm hücre ekstresinin hazırlanması nükleer kesirlerin hazırlanmasıyla aynı anda gerçekleştirilebilir (adım 3.5).- Tüm hücre ekstresi peletleri 100 μL'lik tam lisis tamponunda (adım 3.2.4'te hazırlanır) yukarı ve aşağı borular oluşturarak yeniden askıya alın, ardından hücre lisisinin tamamını sağlamak için 5 μL deterjan ekleyin. 30 dakika buz üzerinde örnekleri kuluçka.
- 30 s için en yüksek ayarda girdap, sonra 4 °C'de 20 dk için 14.000 x g'de numuneleri santrifüj edin.
- Supernatant önceden soğutulmuş mikrofuge tüp içine aktarın. Bu hücre lisate daha fazla analiz için gerekli kadar -80 °C'de saklanabilir.
NOT: Örneklerin tekrarlanan donma/çözülme döngülerinden kaçının.
4. Hücre Altı Kesirlerin Downstream Analizi
NOT: Bu protokolde, üretilen hücre fraksiyonlarının analizi, nükleer ve sitoplazmik kesirler için eşit hücre numaraları/şerit (~10 μg proteine eşdeğer) yükleyerek, standart protokoller kullanılarak Batı lekeleme ile gerçekleştirilmiştir.
- Nükleer ve sitoplazmik fraksiyonlar arasında protein ticaretinin sayısallaştırılması: Serbestçe kullanılabilir Western blot analiz yazılımı kullanarak sinyal yoğunluğunun nicel liği veya densitometri yoluyla sayısal Western blot analizi yapın.
- Görüntü alma: Farklı gelişmekte olan araçlardan oluşturulan Western leke görüntüleri JPG, PNG veya TIFF dosyaları olarak ithal edilmelidir. 16 bit derinlikte RAW dosyası önerilir. Görüntü almak için yazılım simgesini tıklatın ve İçe Aktar'ın üzerine tıklayın. Ardından Üçüncü Taraf Resimleri'ni tıklatın. Resim dosyasını seçin ve Aç'ıtıklatın.
- Görüntünün görüntülenmesi: Resim şeridinde, Görüntü grubundaki Seç düğmesini tıklatın. Gerekirse daha fazla ayarlama sağlamak için Ekranı Ayarla iletişim kutusu açılır. Görüntü LUTs sekmesindeki ayarlanabilir kaydırıcıları kullanarak Parlaklık veya Kontrast gibi ek geliştirmeler uygulayın. Daha hassas ayarlamalar için Eğriler sekmesini kullanın.
- Veri analizi (kanal deselection): Çözümleme şeridini tıklatın. Yalnızca bir kanalı çözümlemek için, analiz edilmeden kanal(lar) seçin. Bir kanalın Görüntü LUT'larında Kanal Gösterme küçük resmini tıklatarak yalnızca istenen kanalı görüntüleyin. JPG, PNG veya TIFF dosyaları olarak alınan görüntüler, birden çok istenmeyen RGB kanalının seçilmesini gerektirebilir.
-
Şekil ekleme: Sinyal yoğunluğunu ölçmek için, görüntüye dikdörtgen eklemek için Dikdörtgen Ekle'yi tıklatın. Bir özelliğin (örneğin, bir protein bandı) merkezine tıklayarak etrafına bir dikdörtgen yerleştirin. Alternatif olarak, el ile bir şekil çizmek için Dikdörtgen Çiz'iseçin. İstenilen tüm şekilleri ekledikten sonra imleci seçim aracına döndürmek için Seç'i tıklatın.
NOT: Veriler sırayla oluşturulan bir kimlik numarasına göre sıralanırken, mantıksal sırada birden çok şekil ekleyin. -
Arka plan çıkarma: Arka plan gürültüsünü çıkarmak için Arka Plan grubundaki ilk düğmeyi tıklatın ve açılan menüden Ortanca'yı seçin. Arka Plan diyaloğunda kenarlık genişliğini 3'e ayarlayın ve arka plan hesaplamasında kullanılacak bölümleri seçin. Hangi segmentlerin kullanılacağını seçerken, görüntü arka planını en iyi temsil eden kesimleri seçin.
NOT: Arka plan gürültüsü sinyal niceliğini etkileyebilir, bu nedenle ilgi şekillerinden gelen sinyali doğru bir şekilde hesaplamak için çıkarılmalıdır. -
Kırpma Sinyali ve Kırpma Arka Planı - İstEĞE BAĞLI: JPG, PNG veya TIFF formatlarında alınan dosyalar piksel doygunluğu gösterebilir: bir protein bandı içinde vurgulanan/parlak bölgeler. Kırpma Sinyali ve Kırpma Arka Planı (Bkgnd) doymuş pikselleri çözümlemeden kaldırır. Bu değerleri görüntülemek için, tablo görünümünün sağındaki Sütunlar düğmesine tıklayarak Tabloya Kırpma Sinyali ve Kırpma Bkgnd ekleyin.
NOT: Piksel doygunluğu güvenilmez nicelemeye yol açabilir. Doymuş pikseller yalnızca bir şekil içindeki piksellerin %5'inden azı doymuşsa kaldırılabilir.
-
Şekil ekleme: Sinyal yoğunluğunu ölçmek için, görüntüye dikdörtgen eklemek için Dikdörtgen Ekle'yi tıklatın. Bir özelliğin (örneğin, bir protein bandı) merkezine tıklayarak etrafına bir dikdörtgen yerleştirin. Alternatif olarak, el ile bir şekil çizmek için Dikdörtgen Çiz'iseçin. İstenilen tüm şekilleri ekledikten sonra imleci seçim aracına döndürmek için Seç'i tıklatın.
- İhracat Verileri: Tablonun üzerindeki Şekiller sekmesini tıklatın. Densitometri için Sinyal sütunundaki değerler gereklidir. Sinyal, Bkgnd ve Alan'ın ürünü eksi bir şekil için piksel yoğunluk değerlerinin (Toplam) toplamıdır. Rapor düğmesini tıklatın. Kaydet veya Elektronik TabloYu Başlat'ıtıklatın.
Sinyal = Toplam – (Bkgnd x Area)
NOT: Şekiller sekmesi Sinyal, Toplam, Alan ve Bkgrnd gibi nicel değerlerin bir tablosunu sağlar. - Protein ekspresyonunun ölçülmesi: Kaydedilen elektronik tabloda, elde edilen ilgi proteini için elde edilen Sinyali ilgili protein yükleme kontrol bandı için Sinyal ile bölerek her şerit veya değişken için ilgi proteininin normalleştirilmiş ifadesini hesaplayın.
NOT: Nükleer ve sitoplazmik fraksiyonları ayırt etmek için kullanılan farklı yükleme kontrolleri nedeniyle nükleer ve sitoplazmik fraksiyonları arasında ilgi normalleştirilmiş protein miktarları arasındaki karşılaştırmalar doğrudan karşılaştırılamaz. Ancak, bireysel kesirler içinde karşılaştırmalar, örneğin ilaç tedavisi sonrasında, uygundur. - Yayın veya sunu için görüntüyü dışa aktarma: Tablonun üzerinde bulunan Resimler sekmesini tıklatın ve sonra dışa aktarılacak resmin üzerine tıklayın. Slayt sunusu veya diğer dijital biçimler için görüntüyü kullanıyorsanız, yazılım simgesini tıklatın, Dışa Aktarma'nın üzerine tıklayın ve Dijital Medyaiçin Resim'e tıklayın. Görüntüyü gerektiği gibi JPG, PNG veya TIFF dosyası olarak kaydedin.
Sonuçlar
Birincil CLL hücreleri üzerinde deneyler planlarken, tahliller çok sayıda hücre gerektiriyorsa (>50 x 106 hücre), erime gerektiren kriyokorunmuş hücreler yerine taze izole Edilmiş CLL hücrelerini kullanmayı tercih eder, ancak bu her zaman Mümkün. Bunun nedeni, buzun/çözülme işleminin cll hücrelerinin %50'sine kadar ölümüne yol açabilebileceği, ancak bu örneke bağımlı olmasıdır. Burada açıklandığı gibi yoğunluk santrifüjü kullanılarak WCC >40 x 106/mL olan CLL hücrelerinin zenginleşmesi (adım 1.3 – 1.5) yüksek saflıkta yüksek hücre kurtarması sağlar (%≥ 95) birincil CLL hücrelerinin. Gösterilen örnekte, WCC = 177 x 106/mL: 30 mL'lik bir kan örneğinden 5 x 109 hücre kurtarıldı, bu da toplam hücrelerin %94'ünü temsil ediyor. Akış sitometrisi ile bu örneğin analizi FSC/SSC'ye gating sonra CLL hücre belirteçleri CD19 ve CD5 çift yüzey ekspresyonu ile gösterildiği gibi >95% CLL hücrelerinin saflık ortaya, DAPI negatif olan tek hücreler (canlı hücreler)(Şekil 1).
Subsellüler fraksiyonu optimizasyonu, sitoplazmik fraksiyonun hazırlanması sırasında çeşitli deterjan oranları (1:20-1:60) kullanılarak gerçekleştirilmiştir (adım 3.4). Daha sonra nükleer kesirler ve WCL'ler hazırlandı (sırasıyla 3.5 ve 3.6. adımlar). İmmünoblots, CLL hücre hattı MEC1 (Şekil 2A) ve primer CLL hücrelerinin(Şekil 2B)ortaya çıkan fraksiyonlarına uygulandı. Lekeler başarılı hücre fraksiyonunu doğrulamak için Lamin A/C (nükleer; 74/63 kDa) ve β-tubulin (sitoplazmik; 55 kDa) kesir belirteçleri için incelendi. Fraksiyonu, MEC1 hücreleri için en uygun deterjan seviyesinin 1:60 seyreltme(Şekil 2A)olduğunu, primer CLL hücreleri için en uygun olan 1:30 seyreltme(Şekil 2B), kesirlerde nükleer protein ve sitoplazmik protein eksikliği ve tam tersi. WCL'ler toplam proteini temsil eder ve hücre altı fraksiyonlarını araştırmak için kullanılan antikorlar için pozitif bir kontrol görevi gösterir. Kesir belirteçleri olarak uygun proteinlerin seçimi önemlidir: Şekil 2C, RNA polimeraz II (Rpb1 CTD; 250 kDa) ve Lamin A/C'nin belirteçleri olarak lekelendiği MEC1 hücrelerinden hazırlanan nükleer/sitoplazmik fraksiyonların immünoblots'larını göstermektedir. β-tubulin ve γ-tubulin (50 kDa) sitoplazmik belirteçler olarak kullanılırken, nükleer fraksiyonlar. Γ-tubulin'in sitoplazmada zenginleştirilmiş olduğu açıktır ancak daha önce 9'dagösterildiği gibi, ifade çekirdeğinde belirgindir.
Deneysel koşullar optimize edildikten sonra, bir deney yapılabilir. Gösterilen örneklerde, FOXO1'in nükleer ve sitoplazmik fraksiyonlarda hücre altı lokalizasyonu, MEC1 hücrelerinde çift mTORC1/2 inhibitörü AZD8055 varlığında veya yokluğunda B hücre antijen reseptörü (BCR) ile hücrelerin uyarılması yla saptandı ( Şekil 3A) ve primer CLL hücreleri ( Şekil3B)5,10. Her iki örnekte de, yüksek oranda zenginleştirilmiş nükleer ve sitoplazmik fraksiyonların üretimi, laminin nükleer fraksiyondaki neredeyse münhasır ifadesi ve sitoplazmik fraksiyonlarda β-tubulin ile gösterildiği gibi elde edilmiştir. Her iki hücre tipinde de AZD8055 ile tedavi den sonra sitoplazmada FOXO1 ekspresyonu azalmış, nükleer bölmede FOXO1 ekspresyonunda artış eşlik ederek protein translokasyonu gösterilmiştir(Şekil 3). Veri yorumlamanın öznelliğini ortadan kaldırmak için, beş ana CLL örneğinden bireysel immünoblots hücre altı fraksiyonları içinde ölçüldü (adım 4; Şekil 4A), her örnek için iç yükleme kontrolleri olarak ilgili nükleer veya sitoplazmik proteinlerin kullanılması ve daha sonra her bir fraksiyonu uyarılmamış (ABD) hiçbir ilaç kontrolü (NDC) kontrolüne normalleştirme, belirtildiği gibi. Ortaya çıkan grafik, nükleer ve sitoplazmik fraksiyonlar arasındaki FOXO1 hareketinin eğilimlerini gösterirken, AZD8055 sitoplazmadaki FOXO1 ekspresyonunun düzeylerini azaltırken çekirdekteki ifadeyi de aynı anda artırmaktadır. Ayrıca BCR crosslinking'inde sitoplazmik FOXO1 ekspresyonunda bir yükselme belirgindir.
| Tüp | Tüp Adı | Hücreler /Boncuklar | Antijen | Florofor |
| 1 | Lekesiz | Hücre | Na | Na |
| 2 | Tek Leke | Boncuk | CD5 | FITC |
| 3 | Tek Leke | Boncuk | CD19 | PE-Cy7 |
| 4 | Tek Leke | Boncuk | CD23 | Apc |
| 5 | Tek Leke | Boncuk | CD45 | APC-Cy7 |
| 6 | Tek Leke | Hücre | Canlılık | Demir |
| 7 | CLL Lekesi | Hücre | CD5, CD19, CD23, CD45 & canlılık | FITC, PE-Cy7, APC, APC-Cy7 & DAPI |
Tablo 1: CLL hücrelerinin akış sitometrisi için gerekli olan örnek tüplerin ideal kümesini gösteren tablo. Her deneme, elde edilen sonuçların doğru analizi için tüm uygun kontrolleri içermelidir.
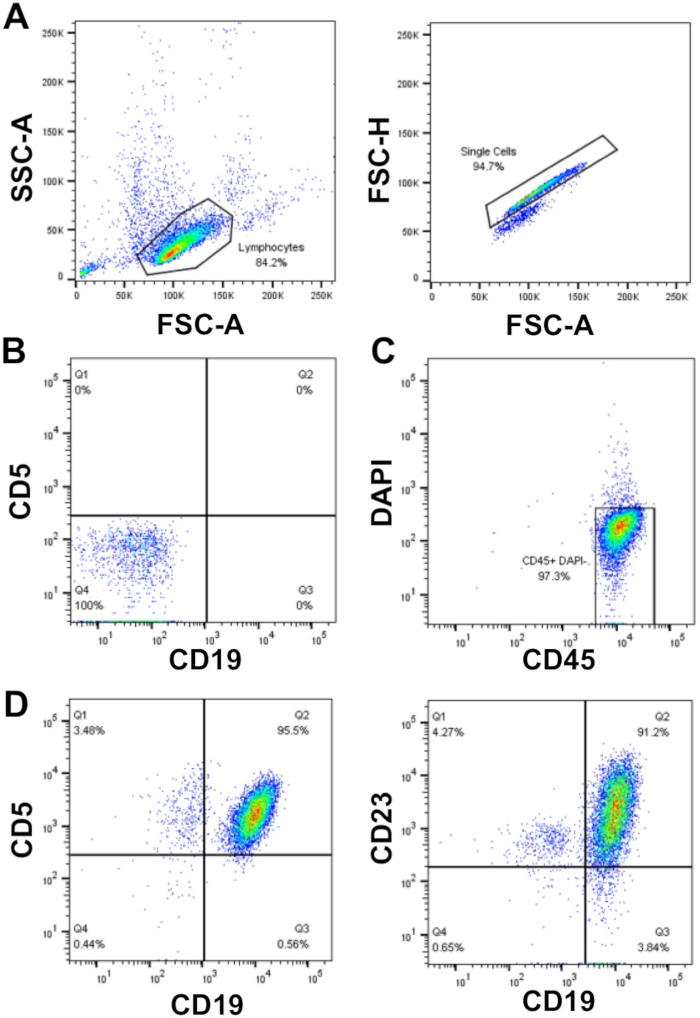
Şekil 1: Zenginleştirilmiş CLL hastalarının temsili akış sitometri analizi konusu. Tek bir CLL hastasının periferik kanından zenginleştirilmiş mononükleer-CLL hücreleri FSC-A vs SSC-A kullanılarak kaplandı ve çiftler fsc-a vs FSC-H (A)kullanılarak dışlandı. Lekesiz hücreler (tüp 1) ve kompansasyon kontrolleri (tüpler 2-6) hücreleri tespit etmek ve floresan kanalları arasında telafi etmek için akış sitometresini kurmak için kullanıldı, böylece floresan sinyallerinin doğru şekilde tespit edilmesini sağladı. (B) CD19 ve CD5 floresan kanallarında negatif boyama (lekesiz hücreler; tüp 1) örneği. Canlı (DAPI negatif) ve CD45 pozitif hücreler(C)ve CD19+CD5+ (%95,5) oranı kapılı idi ve CD19+CD23+ (%91,2) DAPI içindeki hücreler-CD45+ popülasyon(D)olarak belirlenmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Nükleer/sitoplazmik fraksiyonun optimizasyonu. Sitoplazmik ve nükleer fraksiyonlar ve tüm hücre lisatları (WCL), CLL hücre hattının hücre peletlerinden (10 – 20 x 106 hücre) (A) MEC1 veya (B)primer CLL hücrelerinden hazırlanmıştır. Adım 3. Subsellüler fraksiyonun optimizasyonu, sitoplazmik fraksiyonu hazırlanırken (adım 3.4'te açıklandığı gibi) çeşitli deterjan oranları (1:20-1:60) kullanılarak gerçekleştirilmiştir. Ortaya çıkan örnekler, WCL ile birlikte başarılı hücre fraksiyonunu doğrulamak için immünblotted ve anti-Lamin A/C (nükleer) ve anti-β-tubulin (sitoplazmik) antikorları ile incelendi. Moleküler ağırlık belirteçleri lekenin solunda gösterilir (M). * hücre lisisi için en uygun deterjan koşullarını gösterir. (C) Kontrol koşulları (NDC) veya ilaç tedavisi (8055) ile MEC1 hücrelerinden nükleer ve sitoplazmik fraksiyonların immünoblot stimülasyon yokluğu varlığında (+ veya – BCR crosslinking sırasıyla). Alt hücre fraksiyonlarını belirlemek için anti-Rbp1 CTD (klonu 4H8; RNA polimeraz II alt ünitesi B1, anti-Lamin A/C, anti-β-tubulin veya anti-γ-tubulin (klon GTU-88) antikorları ile bazaltıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
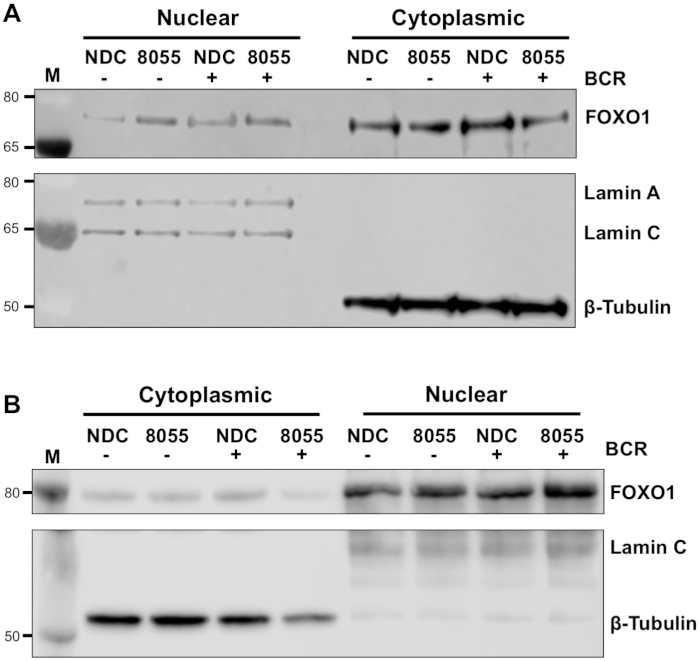
Şekil 3: Hücre altı fraksiyonu CLL'de çekirdek ve sitoplazma arasındaki FOXO1'in kapatılmasını göstermektedir. (A) MEC-1 hücreleri ve (B) primer CLL hücreleri 30 dakika boyunca 100 nM AZD8055 (8055) ile ön tedavi edildi veya belirtildiği gibi tedavi edilmemiş (NDC) bırakıldı ve daha sonra BCR 1 saat veya abd'de bırakıldı. Daha sonra nükleer ve sitoplazmik fraksiyonlar hazırlandı ve immünoblotted. Fraksiyonasyonun anti-Lamin A/C (nükleer) ve anti-β-tübulin (sitoplazmik) antikorlarla probasyon la onaylanmasının ardından, hem ilaç tedavisinin hem de BCR ligasyonunun etkisi FOXO1 protein ekspresyonunda anti-FOXO1 antikor kullanılarak değerlendirildi. M moleküler ağırlık belirteci gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
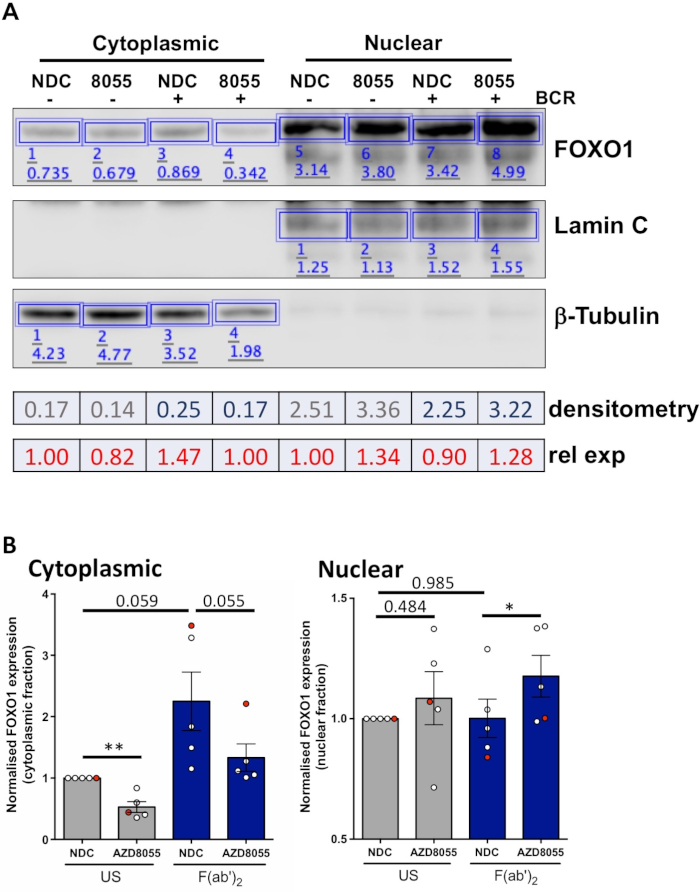
Şekil 4: Sayısal Batı leke analizinin (densitometri) bir örneği. (A) Densitometri, çevrimiçi olarak mevcut olan Western blot analiz yazılımı kullanılarak gerçekleştirildi. Kısaca, Analiz şeridi içinde, sinyal yoğunluğunu hesaplamak için görüntüdeki protein bantlarının etrafına dikdörtgenler çizildi. Sitoplazmik/nükleer fraksiyona uğramış bir CLL hasta örneğinin temsili batı leke görüntüsünün densitometrisi tasvir edilmiştir. Sitoplazmik ve nükleer fraksiyonlar sitoplazmik (β-tubulin) ve nükleer (Lamin A/C) belirteçlerinin ekspresyonu ile ayırt edilir. Belirli bir durum için FOXO1'in normalleştirilmiş ifadesi, analiz edilen kesire bağlı olarak, FOXO1 için elde edilen sinyalin β-Tubulin veya Lamin A/C için karşılık gelen sinyalle bölünmesi ile hesaplanabilir. Göreceli FOXO1 ekspresyonu (ABD araç kontrolüne göre), belirli bir koşulun normalleştirilmiş FOXO1 ekspresyonunun belirli bir hücresel fraksiyonun ABD araç kontrolünün normalleştirilmiş FOXO1 ifadesi ile bölünmesi ile hesaplanabilir. (B) Her hücresel fraksiyon içinde US-NDC kontrolüne normalleştirilen sitoplazmik (sol) veya nükleer (sağ) fraksiyonlarda FOXO1 ekspresyon düzeylerini gösteren grafik. Grafikteki kırmızı nokta gösterilen çalışma örneğidir. Bu veriler, FOXO1 ekspresyonundaki ortalama kıvrım değişimini ABD-NDC ± SEM. P değerleri iki kuyruklu öğrenciler tarafından belirlenen t testi ile göstermektedir. n = 5 ayrı CLL hasta örneği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Açıklanan protokol, birincil CLL hücrelerinden nükleer ve sitoplazmik fraksiyonların üretimi ve hücre stimülasyonu üzerine nükleer ve sitoplazmik fraksiyonlar arasında protein ticaretinin daha sonra ölçülmesi için hızlı ve etkili bir yöntem sağlar. ve uyuşturucu tedavisi. Sunulan veriler, f üzerinden çapraz BCR'nin varlığı/yokluğunda çift mTOR inhibitörü AZD8055 ile tedavi edildikten sonra, örneğin, nükleer ve sitoplazmak fraksiyonlar arasında belirli proteinlerin, örneğin FOXO1' in ticaretini tespit etme yeteneğini göstermektedir. ab')2 parça stimülasyonu (Şekil 3 ve Şekil 4). Bu deneyleri, tek tek CLL hasta örneklerinden Batılı lekelerin niceliği ile birleştirilmesi, üretilen verilerin objektif analizlerinin yapılmasını sağlar ve protein lokalizasyonundaki küresel değişimleri ölçmek için tanımlanan testin sağlamlığını gösterir. Hasta kohortlarından izole edilen KLL hücreleri (Şekil 4). Verilerden sitoplazmik fraksiyonlarda ortalama beş hasta örneğinin öneme yakın olduğu açıktır. CLL hastalarının klinik heterojenliği göz önüne alındığında11, Bu analizler normalde daha büyük hasta kohortları üzerinde yapılacak ve/veya CLL'nin hücresel yanıtını daha iyi anlamak için hastaların spesifik prognostik alt gruplarına odaklanacak belirli ilaç tedavileri için hücreleri.
Sunulan veriler, fraksiyonun saflığı bu belirteçler tarafından doğrulanacağı için, sadece sitoplazmik veya nükleer fraksiyonlarda bulunan protein belirteçlerinin seçilmesinin önemini göstermektedir. β-tubulin sitoplazmik fraksiyon onayı için, Lamin A/C ise nükleer belirteç olarak seçilmiştir. İlave proteinler yaygın olarak kullanılan GAPDH ve α-tubulin sitoplazmik fraksiyonu veya Brg1 (SMARCA4), TFIID ve RNA Polimeraz II nükleer fraksiyonsaflık4,5tanımlamak için vardır. Ancak, belirli kesirlerde yüksek oranda zenginleştirilmiş ve her iki kesirde de bulunmayan proteinler seçilirken (örneğin, γ-tubulin) dikkat edilmelidir (Şekil 2C)9. Nitekim, GAPDH ve aktin genellikle sitoplazmik proteinler olarak kabul edilirken çekirdeğine lokalize olabilir12,13, stimülasyon veya tedavi olduğunda taşınmaz bir kesir belirteci seçiminin önemini vurgulayarak hücrelere uygulanır. Ayrıca, seçilen protein belirteci subsellüler fraksiyonları yanında WCL çalıştırarak ilgi hücresinde ifade olduğunu onaylamak önemlidir.
Gösterilen temsili deneyde, her durum için aynı sayıda CLL hücresi kullanıldı (stimülasyon/ilaç tedavisi) ve daha sonra fraksiyonel örnekler hemen hazırlandı. 10 μg fraksiyone protein/şerit yüklenmesi, ilgi çeken proteinlerin tespiti için yeterli malzeme sağlar. Bu numuneler sadece kısa süreli ilaç tedavisi ve stimülasyondan (4 saate kadar) geçtiği için, her örnekte protein seviyesinin aynı kalacağı ve protein testinin yapılmadığı varsayılmıştır. Ancak, hücre tedavileri uzatılırsa (18 - 72 saat), hücrelerdeki hücre ölüm veya çoğalma düzeyi, uygulanan ilaç/hücre stimülasyonuna bağlı olarak çıkarılan proteinin kalitesini ve miktarını önemli ölçüde değiştirebilir ve böylece tedavi edilen protein düzeylerini değiştirebilir. /uyarılmış örnekler. Uzun süreli ilaç tedavileri için bu durumlarda, bir Bradford testi veya eşdeğeri kullanarak protein niceliği yürütmek için tavsiye edilir, önce Batı lekeleme protein aynı miktarda immünoblot her şeritte çalıştırılır sağlamak için. Deterjanların varlığı spesifik protein tahlilleri ile müdahale edebilir14, Bu girişim hücre fraksiyonu protein örnekleri seyreltilmesi ile azaltılabilir. Buna ek olarak, test edilen numunelerde olduğu gibi aynı seyreltme kullanarak, boş olarak tam lysis tampon kullanın.
Burada açıklanan bulgular için destekleyici kanıt sağlamak için, paralel deneyler bu bulguların görselleştirilmesini sağlamak için CLL hücreleri içinde FOXO1 konumunu analiz etmek için floresan mikroskobu kullanılarak yapılabilir5. Ayrıca, üretilen hücre altı fraksiyonları da enzim aktivitesi tahlilleri veya proteomik analizler için daha fazla downstream analizleri kullanılabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, dr. Natasha Malik'e el yazmasını eleştirel olarak gözden geçiren ler için teşekkür etmek isterler. Bu çalışma AMM'ye (18003) verilen Bloodwise proje hibesi ile finanse edilmiştir. FACS analiz tesisleri Howat Vakfı tarafından finanse edilmiştir. MWM, Paul O'Gorman Lösemi Araştırma Merkezi'nin arkadaşlarının doktora öğrencisi olarak finanse edildi, JC Paul O'Gorman Lösemi Araştırma Merkezi'nin arkadaşları tarafından finanse edildi ve JH Bloodwise proje hibesi (18003) tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge Tubes | Griener Bio one | 616201 | |
| 3 mL Pasteur Pipettes | Griener Bio one | 612398 | |
| 12 mm x 75 mm FACS Tubes | Elkay | 2052-004 | |
| 15 mL Tube | Griener Bio one | 188271 | |
| 50 mL Tube | Griener Bio one | 227261 | |
| anti-CD5 FITC antibody | BD Biosciences | 555352 | phenotypic surface marker |
| anti-CD19 PE Cy7 antibody | BD Biosciences | 557835 | phenotypic surface marker |
| anti-CD23 APC antibody | BD Biosciences | 558690 | phenotypic surface marker |
| anti-CD45 APC Cy7 antibody | BD Biosciences | 557833 | phenotypic surface marker |
| anti-β-Tubulin antibody | Cell Signaling | 2146 | cytoplasmic marker |
| anti-γ-Tubulin Mouse antibody (clone GTU-88) | Sigma-Aldrich | T5326 | |
| anti-FoxO1 (C29H4) Rabbit antibody | Cell Signaling | 2880 | |
| anti-Lamin A/C antibody | Cell Signaling | 2032 | nuclear marker |
| anti-mouse IgG, HRP-linked Antibody | Cell Signaling | 7076 | Secondary antibody |
| anti-rabbit IgG, HRP-linked Antibody | Cell Signaling | 7074 | Secondary antibody |
| anti-Rpb1 CTD antibody (clone 4H8) | Cell Signaling | 2629 | nuclear marker |
| BDFACS Canto II | BD Biosciences | By Request | Flow Cytometer |
| DAPI Solution | BD Biosciences | 564907 | live/dead discriminator |
| DMSO | Sigma | D2650 | |
| EDTA | Sigma | EDS | |
| Fetal Bovine Serum | Thermofisher | 10500064 | |
| GraphPad Prism 6 | GraphPad Software | Software | |
| Histopaque1077 density gradient media | Sigma | H8889 | |
| HyperPAGE 10 - 190 kDa protein marker | Bioline | BIO-33066 | Molecular weight marker |
| Image Studio Lite (version 5.2.5) | LI-COR | www.licor.com | Software |
| Labnet VX100 | Fisher Scientific | Vortex | |
| Nucelar Extract Kit | Active Motif | 40010 | |
| OneComp eBeads | Thermofisher | 01-111-42 | |
| Trypan Blue Solution | Thermofisher | 15250061 | |
| PageRuler Plus Prestained Protein Ladder | Thermo Fisher Scientific | 26619 | Molecular weight marker |
| PBS Tablets | Fisher Scientific | BR0014G | |
| RosetteSep Human B Cell Enrichment Cocktail | Stem Cell Technologies | 15064 | |
| Sigma 3-16P | SciQuip | Centrifuge | |
| Sigma 1-15PK | SciQuip | Centrifuge |
Referanslar
- Kau, T. R., Way, J. C., Silver, P. A. Nuclear transport and cancer: from mechanism to intervention. Nature Reviews Cancer. 4, 106-117 (2004).
- Turner, J. G., Dawson, J., Sullivan, D. M. Nuclear export of proteins and drug resistance in cancer. Biochemical Pharmacology. 83, 1021-1032 (2012).
- Nakamura, N., et al. Forkhead transcription factors are critical effectors of cell death and cell cycle arrest downstream of PTEN. Molecular and Cellular Biology. 20, 8969-8982 (2000).
- Calnan, D. R., Brunet, A. The FoxO code. Oncogene. 27, 2276-2288 (2008).
- Cosimo, E., et al. AKT/mTORC2 inhibition activates FOXO1 function in CLL cells reducing B cell receptor-mediated survival. Clinical Cancer Research. 25, 1574-1587 (2019).
- Mahipal, A., Malafa, M. Importins and exportins as therapeutic targets in cancer. Pharmacology & Therapeutics. 164, 135-143 (2016).
- Hing, Z. A., et al. Next-generation XPO1 inhibitor shows improved efficacy and in vivo tolerability in hematological malignancies. Leukemia. 30, 2364-2372 (2016).
- Lapalombella, R., et al. Selective inhibitors of nuclear export show that CRM1/XPO1 is a target in chronic lymphocytic leukemia. Blood. 120, 4621-4634 (2012).
- Hořejší, B., et al. Nuclear γ-tubulin associates with nucleoli and interacts with tumor suppressor protein C53. Journal of Cellular Physiology. 227, 367-382 (2012).
- McCaig, A. M., Cosimo, E., Leach, M. T., Michie, A. M. Dasatinib inhibits B cell receptor signalling in chronic lymphocytic leukaemia but novel combination approaches are required to overcome additional pro-survival microenvironmental signals. British Journal of Haematology. 153, 199-211 (2011).
- Fischer, K., Hallek, M. Optimizing frontline therapy of CLL based on clinical and biological factors. Hematology. American Society of Hematology. Education Program. 2017, 338-345 (2017).
- Butera, G., et al. Regulation of autophagy by nuclear GAPDH and its aggregates in cancer and neurodegenerative disorders. International Journal of Molecular Sciences. 20, 2062 (2019).
- Virtanen, J. A., Vartiainen, M. K. Diverse functions for different forms of nuclear actin. Current Opinion in Cell Biology. 46, 33-38 (2017).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178, 263-268 (1989).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır