Method Article
שבירה משנית של תאים לוקמיה לימפוציטית כרונית ראשונית לניטור גרעיני/Cytoplasmic סחר בחלבונים
In This Article
Summary
פרוטוקול זה מאפשר אופטימיזציה ולאחר מכן הדור יעיל של שברים גרעיניים ו cytoplasmic מתאי לוקמיה לימפוציטית כרונית ראשית. דגימות אלה משמשות כדי לקבוע לוקליזציה חלבונים, כמו גם שינויים בסחר בחלבונים המתרחשים בין התאים הגרעיניים cytoplasmic על גירוי התא וטיפול בסמים.
Abstract
הייצוא הגרעיני של קרו הוא לעתים קרובות התגולמת בתאים סרטניים. חלבונים מדכא הגידול, כגון p53, ניתן לעבד בלתי פעיל עקב לוקליזציה הסלולר הסוטה מפריע מנגנון הפעולה שלהם. ההישרדות של כרונית לימפוציטית לוקמיה (CLL) תאים, בין התאים הסרטניים האחרים, הוא נעזר על ידי הרגולציה של הגרעין של cytoplasmic שובל, לפחות בחלק דרך רגולציה של קולטן התחבורה XPO1 ואת ההפעלה החוקתית של PI3K-בתיווך איתות מסלולים. חיוני להבין את התפקיד של חלבונים בודדים בהקשר של מיקום תאיים שלהם כדי לקבל הבנה עמוקה יותר של התפקיד של חלבונים כגון הפתוביולוגיה של המחלה. יתר על כן, זיהוי תהליכים כי הגירוי התאים התחתון ואת מנגנון הפעולה של מעכבי תרופתי ספציפיים, בהקשר של סחר בחלבון subcellular, תספק הבנה מקיפה יותר של המנגנון של פעולה. הפרוטוקול המתואר כאן מאפשר אופטימיזציה והדור הבאים יעיל של שברים גרעיניים ו cytoplasmic מתאי לוקמיה לימפוציטית כרונית ראשית. שברים אלה יכולים לשמש כדי לקבוע שינויים בסחר בחלבונים בין שברים גרעיניים ו cytoplasmic על גירוי התא וטיפול בסמים. ניתן לכמת את הנתונים ולהציג אותם במקביל לתמונות האימונולוצילציציציאוליים, ובכך לספק נתונים חזקים ומקביליים.
Introduction
התחבורה של קרו בין הגרעין של ציטופלסמה כבר הוקמה כדי לשחק תפקיד מפתח בתפקוד הסלולר נורמלי והוא לעיתים קרובות מראש בתאים סרטניים1,2. רגולציה כגון זה יכול לנבוע ביטוי יתר/מוטציה של חלבונים השולטים ייצוא גרעיני. אחד כזה Exportin-1 חלבון (XPO1), הוא קולטן התחבורה המייצ> 200 הייצוא הגרעיני האות (NES)-המכיל חלבונים לתוך הציטופלסמה מן הגרעין2. XPO1-cargos כוללים p53, foxo בני משפחה ו-ליברות, לתרום לחוסר ההפעלה שלהם על ידי עיכוב מנגנון הפעולה שלהם1,2,3. חלבון נוסף mislocalization וקליזציה יכול להתרחש כאשר אותות הסביבה פגוע על התאים הסרטניים, המוביל להפעלה של מסלולים מסוג מעבר תאיים כגון פוספולידידיל-inositol-3-קינאז (PI3K)/akt מסלול, וכתוצאה מכך הפעלה של בני משפחה foxo והיצוא הבאים מן הגרעין4,5. שגוי כזה לוקליזציה של חלבונים מדכא הגידול היה מעורב התקדמות של מספר גידולים המטולוגיים ומוצק1,2,6.
ההתפתחות של מעכבי מולקולה קטנה לשימוש קליני ממאירות המטולוגית (לוקמיה מיאלואידית חריפה (AML)/CLL), אשר לאגד ובאופן סלקטיבי לעכב XPO1 פונקציה, מדגיש את החשיבות של פיתוח טכניקות המתאימות כדי לטפל ב ההשפעה של סוכני תרופתי על שוליים של חלבונים בין בתאי הגרעין cytoplasmic6,7,8. טכניקות הדמיה מתקדמות באופן משמעותי המאפשר זיהוי של חלבונים בתאי subcellular על גירוי חיצוני של טיפולי התרופה, עם זאת, את החשיבות של טכניקות חזקות ותומכות מקבילות היא קריטית לאמינות יידע את הקהל המדעי על תוקפו של תוצאה.
לימפוציטים נח ממאיר CLL-B תאים מבודדים מדגימות דם החולה לייצג אתגר בדור של שברים גרעיניים ו cytoplasmic בשל הגרעין הגרעיני הגבוה: היחס cytoplasmic. אופטימיזציה של התנאים הניסיוניים ליצירת נתונים ניסיוניים חזקים ואמינים הוא כמובן קריטי על מנת לתכנן תוכניות ניסיוני עתידיים. השיטה המתוארת כאן מאפשרת כימות חלבונים בשברים גרעיניים ו cytoplasmic וקובע כיצד חלבונים אלה יכולים להיות מושפעים על ידי גירוי סלולרי ו/או טיפול בסמים.
Protocol
השימוש דגימות ראשיות מהחולים CLL שתוארו כאן אושרו על ידי מערב סקוטלנד שירות אתיקה מחקר, מדינת גלזגו רבתי וקלייד (בריטניה) וכל העבודה בוצעה בהתאם הנחיות מאושרות.
1. בידוד של תאים CLL מדגימות דם החולה
-
דגימות דם היקפיים ממטופלים CLL בעבר מתקבלים מהמרפאה בצינורות איסוף דם EDTA, בליווי ספירת תאים לבנים (WCC). טהר את דגימות ה-CLL של דם היקפי לפי ה-WCC. עבור WCC < 40 x 106 תאים/mL, המשך לשלב 1.1.1; עבור WCC ≥ 40 x 106 תאים/mL, המשך לשלב 1.1.2.
- יוצקים את התוכן של כל צינורות דם EDTA לתוך שפופרת צנטריפוגה 50 mL ולהוסיף 50 μL של קוקטייל העשרה של האדם B תא ל 1 mL של דם. דגירה בטמפרטורת החדר (RT) עבור 20 דקות. המשך לשלב 1.1.2.
- לדלל את המדגם ביחס של 1:1 עם RT CLL לשטוף מאגר (פוספט באגירה סאלין (PBS), 0.5% סרום של שור עוברי (fbs) ו 2 מ"מ edta).
- הפחתת מדיה של צפיפות מעבר הצבע לתוך צינורית צנטריפוגה בגודל מתאים של המדגם (10 מ"ל לתוך צינור 50 mL במשך 30 מ ל של דגימה או 4 מ"ל לתוך שפופרת 15 מ"ל עבור 10 מ ל של דגימה).
- שכבה בקפידה את המדגם על גבי מדיה מעבר הדרגתי צפיפות וצנטריפוגה ב 400 x g עבור 30 דקות ב-RT.
הערה: ודא כי הצנטריפוגה היא ב-RT לפני הדגימות ממוקמות בצנטריפוגה כשינוי בטמפרטורה יגרום העשרה עניים של תאים מונמונומנט, ולכבות את הבלם על הצנטריפוגה, כמו בלימה פתאומית יכול לשבש את הממשק הנוזלי. - בעדינות לקצור את השכבה הלבנה של תאים מונוליתיים לאסוף בממשק של מדיה צפיפות מעבר הצבע ו CLL לשטוף מאגר, לתוך שפופרת חדש 50 mL בתוך הצינור מפלסטיק פסטר.
- הוסף 40 mL של CLL לשטוף מאגר למונאולייר מבודדים כדי לשטוף את התאים צנטריפוגה ב 300 x g עבור 10 דקות ב-RT.
- להיפטר supernatant, להשעות מחדש את הגלולה על ידי מצליף בחלק התחתון של הצינור, ואז לחזור על שלב הכביסה המתוארת בשלב 1.5.
- להיפטר supernatant, להשעות מחדש את הגלולה כמתואר בשלב 1.6, ואז להשעות את הגלולה בנפח קבוע של CLL לשטוף מאגר (עד 40 mL, בהתאם לגודל של הגלולה תא).
- תספור את התאים בעזרת טרי, כחול והמוכטומטר לאחר מכן המשך להזרים cy, לבדוק את הטוהר של תאים CLL.
הערה: בשלב זה התאים CLL יכול להיות תרבותי בריכוז של 10 x 106 תאים/mL במדיה לשמש ניסויים, ו/או cryopreserved 10% diמתיל סולפוקסיד (dmso)/fbs לעבודה בעתיד בריכוזים של עד 100 x 106 תאים/בקבוקון.
2. מיכלי זרימה של תאים CLL
- תווית 12 מ"מ x 75 מ"מ עגולה בעובי פוליסטירן מצינורות כמתואר בטבלה 1.
- בצינורות 2 – 5, לשים טיפה אחת של חרוזי פיצוי ולאחסן על הקרח. הוסף 1 μL של הנוגדן המתאים (anti-CD5, CD19, CD23 או CD45, כפי שמצוין בטבלה 1) על צינורות 2 – 5, ו-דגירה על קרח 20 דקות, מוגן מפני אור על ידי הצבת רדיד פח על דלי קרח.
הערה: צינורות אלה משמשים כבקרי פיצוי עבור הגדרת התבנית cy, הזרמת הזרימה. -
לשים עד 1 x 106 תאים CLL לתוך צינורות 1, 6 ו -7, להוסיף 2 מ ל של facs מאגר (PBS + 2% fbs) כל צינור ו צנטריפוגה ב 300 x g עבור 5 דקות ב RT כדי לשטוף את התאים. להיפטר supernatant ולאחסן את הצינורות המכילים כדורי תא על הקרח.
- השהה מחדש את כדורי התא והוסף את השילוב המתאים של נוגדנים לתאים בצינור 7 כפי שהורו בטבלה 1, בנפח הסופי של 100 μl עם מאגר facs. נוגדנים משמשים בריכוז מתאים בהתאם להנחיות היצרן.
- השהה מחדש את כדורי התא בצינורות 2 ו-6 ב-100 μL של מאגר FACS.
- מודגנת את התאים על הקרח, לצד החרוזים ויטראז בצינורות 2 – 5, מוגן מפני אור עבור 20 דקות.
- לאחר הדגירה, להוסיף 2 מ ל של מאגר FACS לכל הצינורות והצנטריפוגה ב 300 x g עבור 5 דקות ב-RT כדי לשטוף את התאים. להיפטר supernatant ולהשעות את חרוז/כדורי תא על ידי מצליף בעדינות את הצינורות.
- השעיה מחדש צינורות 1-5 ב 100 μL של מאגר FACS ומקום על הקרח עד מוכן לנתח את cytometer הזרימה.
- דלל את הפתרון DAPI כדי 0.05-0.2 μg/mL במאגר FACS מיד לפני השימוש. הריכוז האופטימלי עשוי להשתנות, והטיטור מומלץ.
- להשעות את הצינורות 6 ו 7 עם 100 μL של פתרון DAPI מדולל ו-דגירה את הצינורות על הקרח למינימום של 5 דקות כדי לאפשר לתאים כתם.
הערה: אין צורך בכביסה נוספת כמו DAPI חייב להיות נוכח במאגר כדי שתאים מתים יישארו מתויג. לאחר DAPI נוספה, התאים חייבים להיות מנותח על הזרימה cytometer בתוך 4 h. - לנתח תאים באמצעות cytometer זרימה.
3. הכנת שברים תת-סלולריים מתאים CLL
הערה: בעת תכנון הגדרת הניסוי, כולל גם תאים לא ממריצים/לא מטופלות שמהם ניתן ליצור את תמצית התא כולה.
- בצע את הגירוי הרצוי ו/או טיפול תרופתי של קו MEC1 CLL התאים או מבודדים בתאי CLL הראשי באמצעות 10 – 20 x 106 תאים/תנאי. התאים ישמשו לאחר השבר הסלולר (שלבים 3.4 & 3.5) או כדי ליצור תמצית תא שלמה (שלב 3.6).
- הכנת פתרונות/צינורות: הכינו את כל הפתרונות/המאגרים הטריים ביום השבר, לפני שהמצברים נאספים. לאחסן את הפתרונות על הקרח עד הנדרש ולהשתמש בתוך 4 h של הכנה.
- הפתרון המעכב PBS/פוספאטאז: להכין את מעכבי פוספספטאז ב-PBS על ידי דילול מעכבי פוספספטאז 1:20 ב-1x PBS (כלומר, 0.5 mL של מעכבי פוספספטאז ב 9.5 mL של 1x PBS).
הערה: ודא שמעכבי פוספספטאז. לא זירז אם יש מזרז בהווה, החום עד 50 ° c עבור 10 דקות. - היפוטוניקה מאגר: להכין מאגר היפוטוניקה 1x על ידי ביצוע דילול 1:10 של מאגר היפוטון 10x במים מזוקקים (כלומר, 50 μL של מאגר היפוטון 10x לתוך 450 μ L של dH2O).
- 10 מילימטר dithiothreitol (DTT): להכין 10 מ"מ DTT על ידי ביצוע דילול 1:100 של 1M DTT עם מים מזוקקים (כלומר, 10 μL של 1 M DTT ב 990 μL של dH2O).
הערה: Dtt הוא מאוד יציב משך כל כך להכין את זה טרי בכל פעם. הימנע מחזורי הקפאה/הפשרה חוזרים. - מאגר פירוק מלא: קבע את מידת האגירה הדרושה עבור כל ניסוי. כל מדגם דורש 50 μL של מאגר פירוק מוחלט, כך להוסיף 5 μL של 10 מ"מ DTT (שלב 3.2.3) כדי 44.5 μL של מאגר הליזה ולאחר מכן להוסיף 0.5 μL של קוקטייל פרוטאז מעכבי. ניתן לשנות סכום זה בהתאם למספר הדגימות בניסוי.
- תווית ארבע סטים של 1.5 mL microfuge צינורות עבור כל גירוי ו/או תרופה עבור תאים מגורה טרי (שלב 3.3), השברים הטריים cytoplasmic (שלב 3.4.3), שברים גרעיניים שנוצר טרי (שלב 3.5.3), ואת התא כולו lysates (שלב 3.6.3). טרום לצנן אלה צינורות microfuge על הקרח עד הצורך.
- הפתרון המעכב PBS/פוספאטאז: להכין את מעכבי פוספספטאז ב-PBS על ידי דילול מעכבי פוספספטאז 1:20 ב-1x PBS (כלומר, 0.5 mL של מעכבי פוספספטאז ב 9.5 mL של 1x PBS).
- להעביר את התאים לתוך בנפרד מתויג 1.5 mL microfuge צינורות, גלולה על ידי תפרידו ב 200 x g עבור 5 דקות ב 4 ° c. הסר את הסופרנטאנט והשהה מחדש את התאים ב-1 מ ל של מעכבי ה-PBS/פוספספטאז (שלב 3.2.1). כדור התאים על ידי צנטריפוגה ב 200 x g עבור 5 דקות ב 4 ° c. הסר את הסופרנטאנט. ושמור את כדורי התא על הקרח
- הכנת שברים cytoplasmic: השהה מחדש בעדינות את כדורי התא שישמשו עבור שבירה משנית ב-50 μL של מאגר היפוטוניקה של 1x (שלב 3.2.2). דגירה את התאים על הקרח 15 דקות כדי לאפשר לתאים להתנפח.
הערה: נפח של מאגר יפוטוניק בשימוש ניתן להגדיל באופן אמפירי בהתאם למספר הטלפון.- הוסף 0.8-2.5 μL (1:20 כדי 1:60) של אבקת כביסה לתוך כל מדגם ומערבולת על ההגדרה הגבוהה ביותר עבור 10 s.
- כדי לקבוע את הריכוז האופטימלי של חומרי ניקוי לשימוש עבור סוג תא מסוים כדי לבודד גרעיני ושברים cytoplasmic, לבצע מעבר צבע ניקוי בתחילה. טווח של 1:20 כדי 1:60 (כלומר, 2.5 μL כדי 0.8 μL של ניקוי לתוך 50 μL של מאגר היפוטוניקה) צריך להיות הולם.
הערה: אם נפח של מאגר ההיפוטוניקה בשלב 3.4 מותאם, ודא שיחס חומרי הניקוי המתאים נשמר. - בדוק את הפירוק התאים על-ידי התבוננות בתאים באמצעות מיקרוסקופ ניגודיות פאזה לפני ואחרי הוספת חומרי ניקוי. תאים שלמים נראים גדולים יותר עם גרעין צפוף ואפל. הציטופלסמה יופיעו כהילה בהירה סביב הגרעין.
הערה: הליזה המתאימה מאושרת עוד יותר על-ידי שימוש בכתמים המערביים לניתוח חלבונים ספציפיים בתוך השברים שנוצרו מצבע הניקוי.
- כדי לקבוע את הריכוז האופטימלי של חומרי ניקוי לשימוש עבור סוג תא מסוים כדי לבודד גרעיני ושברים cytoplasmic, לבצע מעבר צבע ניקוי בתחילה. טווח של 1:20 כדי 1:60 (כלומר, 2.5 μL כדי 0.8 μL של ניקוי לתוך 50 μL של מאגר היפוטוניקה) צריך להיות הולם.
- פעם אחת, צנטריפוגה את הדגימות ב 14,000 x g עבור 30 s ב 4 ° c.
- העבירו את הסופרנטנט לצינור microfuge מקורר ומתויג מראש. שבר cytoplasmic זה יכול להיות מאוחסן ב--80 ° c עד הנדרש לניתוח נוסף. הגלולה הנותרת מכילה את השבר הגרעיני (שלב 3.5).
הערה: הימנע הקפאת/הפשרה מחזורי הדגימות.
- הוסף 0.8-2.5 μL (1:20 כדי 1:60) של אבקת כביסה לתוך כל מדגם ומערבולת על ההגדרה הגבוהה ביותר עבור 10 s.
- הכנת שברים גרעיניים: השהה מחדש כל גלולה גרעינית ב 50 μL של מאגר פירוק להשלים (שלב 3.2.4) על ידי ליטוף למעלה ולמטה.
הערה: הנפח של מאגר הפירוק המלא ניתן לכוונן בהתאם למספר התא ההתחלתי.- הוסף 2.5 μL של תכשיר לניקוי חלבונים משויכים לממברנה הגרעינית ומערבולת על ההגדרה הגבוהה ביותר עבור 10 ס מ. הצבת דגימות על הקרח במשך 30 דקות.
- מערבולת על ההגדרה הגבוהה ביותר עבור 30 s, ואז לצנטריפוגה את הדגימות ב 14,000 x g עבור 20 דקות ב 4 ° c.
- העבר את הסופרנטנט לצינור microfuge מקורר מראש ומתויג. זה שבר גרעיני ניתן לאחסן ב-80 ° צ' עד הנדרש לניתוח נוסף.
הערה: הימנע הקפאת/הפשרה מחזורי הדגימות.
- הכנת ליקוטים תא שלם (WCL) מתאי CLL
הערה: הכנת תמצית התא כולו יכולה להתבצע באותו זמן כמו הכנת השברים הגרעיניים (שלב 3.5).- השהה מחדש את כדורי התמצית של התא ב-100 μL של מאגר פירוק מוחלט (מוכן בשלב 3.2.4) על-ידי pipetting למעלה ולמטה, לאחר מכן להוסיף 5 μL של חומרי ניקוי כדי להבטיח הליזה להשלים תאים. מודקון את הדגימות על הקרח במשך 30 דקות.
- מערבולת על ההגדרה הגבוהה ביותר עבור 30 s, ואז לצנטריפוגה את הדגימות ב 14,000 x g עבור 20 דקות ב 4 ° c.
- העבר את הסופרנטנט לצינור microfuge מקורר לפני הקירור. כל התאים האלה יכולים להיות מאוחסנים ב-80 ° צ' עד הנדרש לניתוח נוסף.
הערה: הימנע הקפאת/הפשרה מחזורי הדגימות.
4. ניתוח במורד הזרם של שברים תת-סלולריים
הערה: בפרוטוקול זה, ניתוח של שברים התא שנוצר התבצע על ידי בלוק המערבי באמצעות פרוטוקולים סטנדרטיים, טעינת מספרי תאים שווים/ליין (שווה ערך ל-~ 10 μg של חלבון) עבור שברים גרעיניים ו cytoplasmic.
- קוונפיקציה של סחר בחלבונים בין שברים גרעיניים ו cytoplasmic: ביצוע ניתוח כתמי מערביות כמותי באמצעות כימות עוצמת האות, או densi, try באמצעות תוכנה זמינה באופן חופשי ניתוח כתמי אבן מערבי.
- ייבוא תמונות: תמונות כתמי מערביות שנוצרו ממכשירים פיתוח שונים חייב להיות מיובא כמו JPG, PNG או קבצי TIFF. מומלץ לעשות קובץ RAW בעומק 16 סיביות. כדי לייבא תמונה, לחץ על סמל התוכנה ורחף מעל ייבוא. לאחר מכן לחץ על תמונות של צד שלישי. בחרו בקובץ התמונה ולחצו על ' פתח'.
- הצגת התמונה: ברצועת הכלים תמונה, לחץ על לחצן בחר בקבוצה תצוגה . תיבת הדו ' כוונון תצוגה ' תיפתח כדי לאפשר התאמות נוספות במידת הצורך. יישום שיפורים נוספים כולל בהירות או ניגודיות באמצעות המחוונים הניתנים לשינוי בכרטיסיה luts של התמונה . השתמש בכרטיסיה עקומות להתאמות מהירות יותר.
- ניתוח נתונים (בחירת ערוץ): לחץ על רצועת הכלים ניתוח. כדי לנתח ערוץ אחד בלבד, בטל את הסימון בערוצים שאינם מנתחים. לחצו על ' אל תציג את התמונה הממוזערת של ערוץ ' ב-LUTs Image, והוא משאיר רק את הערוץ הרצוי המוצג. תמונות שיובאו כקבצי JPG, PNG או TIFF עשויות לדרוש ביטול מבחר של ערוצי RGB בלתי רצויים מרובים.
-
הוספת צורות: לכמת עוצמת אות, לחצו על ' הוסף מלבן ' להוספת מלבן לתמונה. לחץ על המרכז של תכונה (למשל, להקת חלבון) שתמקם מלבן סביבו. לחלופין, כדי לצייר צורה באופן ידני, בחרו ' צייר מלבן'. לאחר הוספת כל הצורות הרצויות, לחץ על ' בחר ' כדי להחזיר את הסמן לכלי הבחירה.
הערה: הוסף צורות מרובות בסדר לוגי, כאשר הנתונים ממוינים לפי מספר מזהה שנוצר ברצף. -
חיסור רקע: כדי להפחית רעשי רקע, לחץ על הלחצן הראשון בקבוצת הרקע ובחר חציון מהתפריט הנפתח. הגדר את רוחב הגבול ל-3 בדו הרקע ובחר את המקטעים שישמשו עבור חישוב הרקע. בשעת בחירת מקטעים לשימוש, בחרו מקטעים המייצגים את רקע התמונה ביותר.
הערה: רעשי רקע יכולים להשפיע על כימות האות, כך שיש להחיסור כדי לחשב במדויק אות מצורות הריבית. -
קצץ את האות ואת רקע החיתוך-אופציונלי: קבצים שיובאו בתבניות JPG, PNG או TIFF עשויים להפגין רוויית פיקסלים: אזורים מודגשים/בהירים בתוך להקת חלבון. חתוך את האות ואת רקע החיתוך (bkgnd) מסיר פיקסלים רוויים מהניתוח. כדי להציג ערכים אלה, הוסף את ' חתוך אות ' וחתוך את Bkgnd לטבלה על-ידי לחיצה על לחצן העמודות מימין לתצוגת הטבלה.
הערה: רוויית פיקסלים עלולה להוביל לכימות מהימנות. ניתן להסיר פיקסלים רוויים רק אם פחות מ-5% מהפיקסלים בצורה רוויה.
-
הוספת צורות: לכמת עוצמת אות, לחצו על ' הוסף מלבן ' להוספת מלבן לתמונה. לחץ על המרכז של תכונה (למשל, להקת חלבון) שתמקם מלבן סביבו. לחלופין, כדי לצייר צורה באופן ידני, בחרו ' צייר מלבן'. לאחר הוספת כל הצורות הרצויות, לחץ על ' בחר ' כדי להחזיר את הסמן לכלי הבחירה.
- ייצוא נתונים: לחץ על הכרטיסיה צורות מעל הטבלה. עבור densi, הערכים בעמודת האות נדרשים. האות הוא הסכום של ערכי עוצמת הפיקסלים (Total) עבור צורה פחות מהמוצר של Bkgnd והאזור. לחץ על לחצן ' דוח '. לחץ על שמירה בשם או על הפעלת גיליון אלקטרוני.
אות = סך הכל – (Bkgnd x אזור)
הערה: הכרטיסיה צורות מספקת טבלה של ערכים כמותיים כולל אות, סה כ, אזור ו-Bkgrnd. - כימות ביטוי חלבון: בתוך הגיליון האלקטרוני שנשמר, חשב ביטוי מנורמל של חלבון הריבית עבור כל נתיב או משתנה על-ידי חלוקת האות המתקבלת עבור חלבון הריבית על-ידי האות עבור להקת הבקרה התואמת של החלבון התואם.
הערה: השוואות בין כמויות של חלבון מנורמל של עניין על פני שברים גרעיניים ו cytoplasmic לא יכול להיות ישירות בהשוואה בגלל שולט טעינה שונים המשמשים כדי להבדיל בין שברים גרעיניים cytoplasmic. עם זאת, השוואות בתוך שברים בודדים, למשל בעקבות טיפול תרופתי, מתאימים. - ייצוא תמונה לפרסום או למצגת: לחץ על הכרטיסיה תמונות שנמצאו מעל הטבלה ולאחר מכן לחץ על התמונה כדי להיות מיוצא. אם נעשה שימוש בתמונה עבור מצגת שקופיות או בתבניות דיגיטליות אחרות, לחץ על סמל התוכנה, רחף מעל הייצוא ולחץ על התמונה עבור מדיה דיגיטלית. שמור את התמונה כקובץ JPG, PNG או TIFF, לפי הצורך.
תוצאות
כאשר תכנון ניסויים על התאים CLL העיקרי, אם בחני דורשים מספר גדול של תאים (> 50 x 106 תאים), יש העדפה להשתמש בתאי CLL מבודדים טריים, במקום הקפאת תאים הדורשים הפשרה, אולם זה לא תמיד אפשרי. הסיבה לכך היא תהליך ההקפאה/הפשרה יכול לגרום למותם של עד 50% של התאים CLL, למרות שזה תלוי לדוגמה. העשרה של תאים CLL עם WCC > 40 x 106/mL באמצעות צפיפות צנטריפוגה כפי שמתואר כאן (שלבים 1.3 – 1.5) מאפשר שחזור תאים גבוה עם טוהר גבוה (≥ 95%) של תאים CLL הראשי. במדגם המוצג, WCC = 177 x 106/mL: החל מדגימת דם של 30 מ"ל 5 x 109 תאים התאושש, אשר מייצג את התשואה התא של 94% של תאים כולל. ניתוח של מדגם זה על-ידי הזרמת cy, מגלה טוהר של תאים CLL של > 95% כפי שמצוין על ידי הביטוי פני השטח הכפול של סמנים תא CLL CD19 ו CD5 לאחר בעלות על FSC/למעלה, תאים בודדים שהיו DAPI שלילי (תאים קיימא) (איור 1).
אופטימיזציה של הליך השבר הזעיר הסלולר נעשה באמצעות מגוון של יחסי ניקוי (1:20 כדי 1:60) במהלך הכנת שבר cytoplasmic (שלב 3.4). לאחר מכן, השברים הגרעיניים ו-WCLs היו מוכנים (שלבים 3.5 ו 3.6 בהתאמה). חיסוני בוצעו על השברים התוצאה של קו התאים CLL MEC1 (איור 2A) ותאים CLL הראשי (איור 2B). הכלים היו בדקו את סמני שבר lamin A/C (גרעיני; 74/63 kda) ו-β-טובולין (cytoplasmic; 55 kda) כדי לאשר שבירה תא מוצלחת. השבר מציין כי רמת הניקוי האופטימלי עבור תאים MEC1 הוא דילול 1:60 (איור 2a), לעומת התשובה 1:30 להיות אופטימלית עבור תאים CLL הראשי (איור 2ב), כפי שמצוין על ידי העשרה של חלבון גרעיני וחוסר חלבון cytoplasmic בשברים ולהיפך. WCLs מייצגים את החלבון הכולל ולפעול כפקד חיובי עבור נוגדנים המשמשים לחקור את שברים subcellular. חשוב לבחור חלבונים מתאימים כמו סמני שבר: איור 2C מראה החוליות החיסוני של שברים גרעיני/cytoplasmic מוכן MEC1 תאים בהם RNA פולימראז II (Rpb1 Ctd; 250 Kda) ו Lamin A/C נמחקו כסמנים של שברים גרעיניים, בעוד β-טובולין ו γ-טובולין (50 kDa) שימשו כסמנים cytoplasmic. ברור כי γ-טובולין הוא מועשר בציטופלסמה אולם ביטוי ניכר בגרעין, כפי שמוצג בעבר9.
ברגע שהתנאים הניסיוניים ממוטבים, ניתן לבצע ניסוי. בדוגמאות המוצגות, לוקליזציה subcellular של FOXO1 בשברים גרעיניים ו cytoplasmic יקרופון נקבע על גירוי של תאים עם קולטן לתאי ה-B (BCR) בנוכחות או היעדרות של AZD8055 mTORC1/2 המדכא הכפול, ב MEC1 תאים ( איור 3א) ו בתאי CLL הראשי (איור 3ב)5,10. בשתי הדוגמאות, הדור של שברים גרעיניים מועשר ביותר וcytoplasmic הושגה כפי שצוין על ידי הביטוי הבלעדי כמעט של Lamin בשבר גרעיני ו-β-טובולין בשברים cytoplasmic. בשני התאים, ביטוי FOXO1 הופחת בציטופלסמה לאחר הטיפול עם AZD8055 לעומת NDC, מלווה בגידול של FOXO1 הביטוי בתא הגרעיני, ובכך להפגין טרנסלוקציה חלבון (איור 3). כדי להסיר את הסובייקטיביות של פרשנות הנתונים, חיסוני בודדים מתוך חמש דגימות CLL הראשי היו כמותית בתוך שברים תת תאיים (שלב 4; איור 4א), באמצעות החלבונים הגרעיניים או cytoplasmic כפקדי טעינה פנימית עבור כל מדגם, ולאחר מכן לנרמל כל שבריר לבלתי מגורה (ארה ב) אין בקרת סמים (ndc) שליטה, כפי שמצוין. הגרף התוצאה מראה מגמות של תנועה FOXO1 בין שברים גרעיניים ו cytoplasmic, עם AZD8055 להקטין את רמות הביטוי FOXO1 בציטופלסמה, בעוד ביטוי הולך וגובר בגרעין. יתר על כן, העלאה בביטוי FOXO1 cytoplasmic ניכרת על BCR הקישור.
| צינור | שם שפופרת | תאים/חרוזים | אנטיגן | פלואור |
| 1 | וכתם | תאים | נה | נה |
| 2 | כתם בודד | חרוזים | CD5 | מיכל הג |
| 3 | כתם בודד | חרוזים | CD19 | PE-Cy7 |
| 4 | כתם בודד | חרוזים | CD23 | APC |
| מיכל 5 | כתם בודד | חרוזים | CD45 | APC-Cy7 |
| 6 | כתם בודד | תאים | כדאיות | דאפי |
| 7 | בתים של CLL | תאים | CD5, CD19, CD23, CD45 & כדאיות | FITC, PE-Cy7, APC, APC-Cy7 & DAPI |
טבלה 1: טבלה המציגה את הערכה האידיאלית של הצינורות לדוגמה הדרושים לזרימה cy, try של תאים CLL. כל ניסוי חייב לכלול את כל הפקדים המתאימים לניתוח מדויק של התוצאות שהתקבלו.
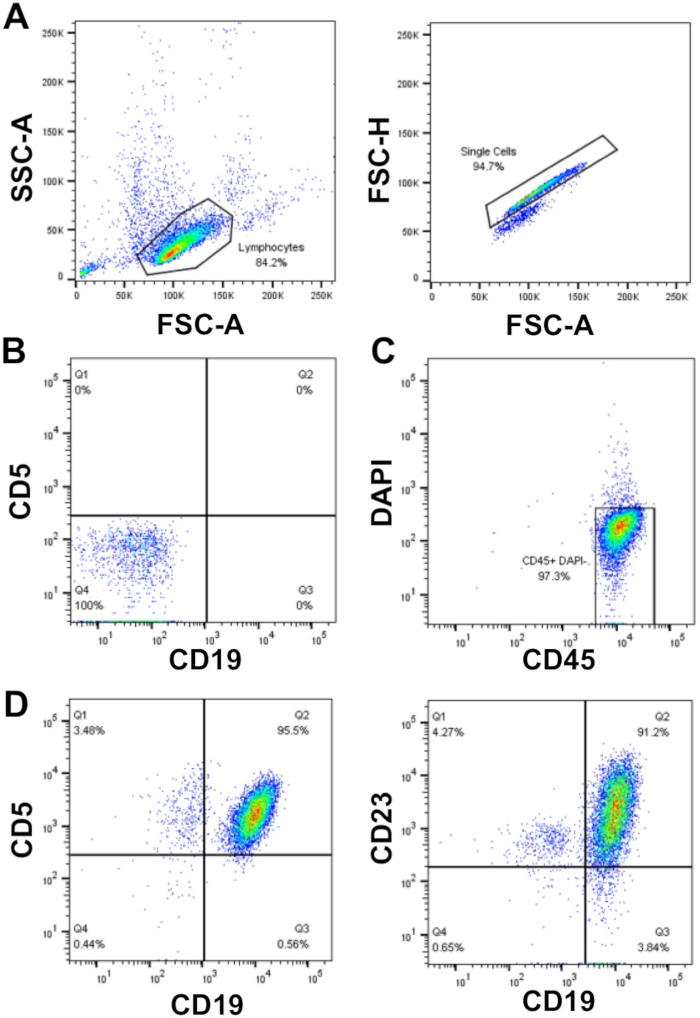
איור 1: הנציגה המייצגת cy, מחלקת ניתוח של חולי CLL מועשרים. התאים mon, ברור-CLL מועשר דם היקפי של החולה CLL בודדים היו מגודרת באמצעות FSC-A vs. מדינת ה, ו doublets נשלל אז באמצעות Fsc-a vs. fsc-H (א). תאים בלתי מוכתמים (צינור 1) ובקרות פיצוי (צינורות 2-6) שימשו כדי להגדיר את cytometer הזרימה כדי לזהות תאים ולפצות בין ערוצי פלורסנט, ובכך להבטיח כי אותות ניאון זוהו כראוי. (ב) דוגמה של כתמים שליליים (תאים לא מוכתמים; tube 1) בערוצי CD19 ו CD5 פלואורסצנטית. Live (DAPI שלילי) ו CD45 תאים חיוביים היו מגודרת (C) ואת היחס של CD19+CD5+ (95.5%) ו-CD19+CD23+ (91.2%) תאים בתוך האוכלוסיה DAPI-CD45+ נקבע (D). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: אופטימיזציה של שבירה גרעינית/cytoplasmic. Cytoplasmic ושברים גרעיניים, ואת כל lysates תא (wcl), היו מוכנים כדורי תא (10 – 20 x 106 תאים) של קו התאים cll (א) MEC1 או (ב) תאים cll הראשי מועשר דם היקפי של חולים כמתואר ב . צעד שלישי אופטימיזציה של השבר הסלולר בוצע באמצעות מגוון של יחסי ניקוי (1:20 כדי 1:60) בעת הכנת שבר cytoplasmic (כמתואר בשלב 3.4). הדגימות התוצאות היו חיסוני ובדקו עם anti-Lamin A/C (גרעיני) ו אנטי β-טובולין (cytoplasmic) נוגדנים כדי לאשר משבר תא מוצלח לצד WCL. סמני משקל מולקולרי מוצגים משמאל לאבן החשופה (M). * מציין את תנאי ניקוי החומר האופטימלי לפירוק תאים. (ג) החיסוני של שברים גרעיניים ו cytoplasmic מ MEC1 תאים עם תנאי שליטה (ndc) או טיפול בסמים (8055) בנוכחות של העדר גירוי (+ או – bcr מרובי קישור בהתאמה). Blots נחקר עם anti-Rbp1 CTD (שיבוט 4H8; הכרה RNA פולימראז II משנה B1), anti-Lamin A/C, אנטי β-טובולין או anti-γ-טובולין (שיבוט GTU-88) נוגדנים, כדי לזהות שברים תת תאיים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
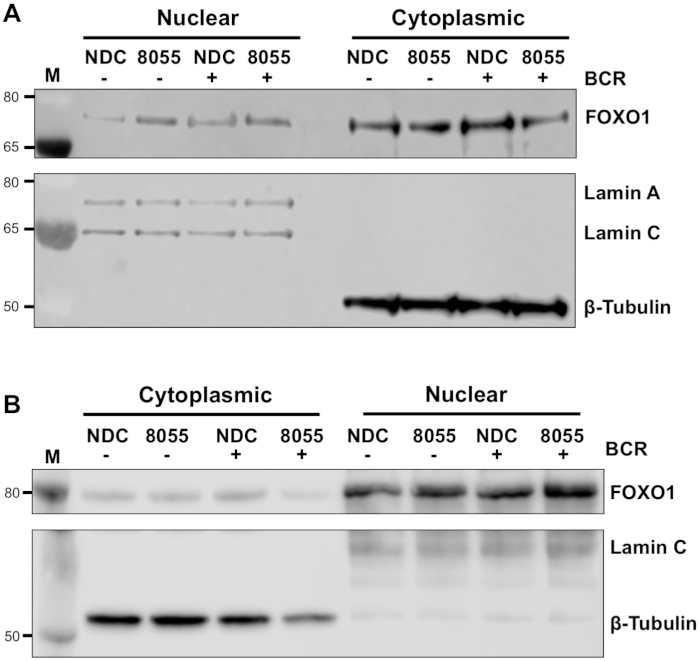
איור 3: השבר התת-סלולרי מדגים את הFOXO1 בין הגרעין והציטופלסמה ב CLL. (A) מMEC-1 תאים ו (ב) התאים CLL הראשי היו מטופלים מראש עבור 30 דקות עם 100 ננומטר AZD8055 (8055) או שמאל מטופל (ndc) כפי שצוין ולאחר מכן bcr היה לפחות 1 h או עזב אותנו. שברים גרעיניים ו cytoplasmic היו אז מוכנים והחיסונית. בעקבות אישור השבר על ידי בדיקה עם anti-Lamin A/C (גרעיני) ו anti-β-טובולין (cytoplasmic) נוגדנים, ההשפעה של שני הטיפול בסמים ו BCR ליפציה הוערך על FOXO1 חלבון ביטוי, באמצעות נוגדן אנטי FOXO1. M מציין סמן מולקולרית משקל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
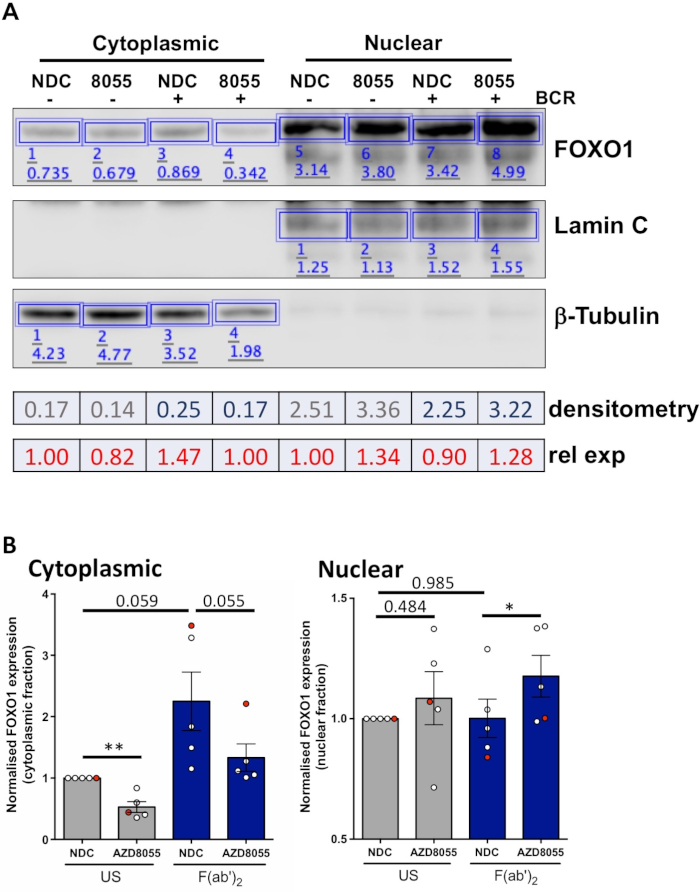
איור 4: דוגמה מעובדת של ניתוח כתמי כמותי מערבי (densi, try). (א) densi, try התבצע באמצעות תוכנת ניתוח כתמי אבן המערבי זמין באינטרנט. בקצרה, בתוך רצועת הכלים ניתוח, מלבנים צוירו סביב להקות חלבונים בתמונה כדי לחשב את עוצמת האות. מתואר הוא densi, לנסות של הנציג המערבי כתם התמונה של דגימת החולה CLL שעברו cytoplasmic/משבר גרעיני. Cytoplasmic ושברים גרעיניים נבדלים על ידי הביטוי של cytoplasmic (β-טובולין) ו גרעיני (Lamin A/C) סמנים. ניתן לחשב ביטוי מנורמל של FOXO1 עבור תנאי נתון על-ידי חלוקת האות שהושג עבור FOXO1 על-ידי האות המתאימה עבור β-טובולין או Lamin A/C, בהתאם לשבר שנותח. ביטוי יחסי FOXO1 (יחסית לבקרת רכב ארה"ב), ניתן לחישוב על-ידי חלוקת FOXO1 ביטוי מנורמל של תנאי נתון על-ידי ביטוי הFOXO1 המנורמל של בקרת הרכב האמריקאי של שבר סלולרי נתון. (ב) גרף המציג את רמות הביטוי FOXO1 ב cytoplasmic (שמאל) או גרעיני (ימין) שברים מנורמל לבקרת US-ndc בתוך כל שבר סלולרי. הנקודה האדומה בגרף היא הדוגמה העובדת המוצגת. נתונים אלה מראים את שינוי הקיפול הממוצע בביטוי FOXO1 בהשוואה לערכי ה-US-NDC ± SEM. P נקבעו על-ידי בדיקה דו-זנבית של סטודנטים. n = 5 מטופלים בודדים CLL דגימות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
הפרוטוקול המתואר מספק שיטה מהירה ויעילה עבור הדור של שברים גרעיניים ו cytoplasmic מן התאים CLL הראשי, ובעקבות הכמת של סחר בחלבונים בין שברים גרעיניים ו cytoplasmic על גירוי התא וטיפול תרופתי. הנתונים המוצגים מדגים את היכולת לזהות סחר של חלבונים ספציפיים, למשל, FOXO1, בין שברים גרעיניים ו cytoplasmic, על הטיפול עם מעכבי mTOR כפול AZD8055 בנוכחות/היעדרות של BCR המקשר דרך F ( ab ')2 גירוי ברסיס (איור 3 ואיור 4). צימוד ניסויים אלה עם כימות של הכלים המערבי מתוך דגימות בודדות החולה CLL, מאפשר ניתוח אובייקטיבי של הנתונים שנוצר ומדגים את החוסן של הנתון המתואר לכמת שינויים גלובליים לוקליזציה חלבונים ב התאים CLL מבודדים מתוך החולה כנופיית (איור 4). ברור מהנתונים כי ממוצע של חמש דגימות המטופל בשברים cytoplasmic הגיעו בקרבת משמעות. בהינתן טרוגניות קליני של מטופלים CLL11, ניתוחים אלה בדרך כלל להתבצע על כנופיית החולה גדול יותר, ו/או ממוקדת קבוצות התחזיות הספציפיות של חולים כדי לקבל הבנה מלאה יותר של התגובה התאית של CLL תאים לטיפול תרופתי מסוים.
הנתונים המוצגים מדגימים את החשיבות של בחירת סמני חלבונים השוכנים באופן בלעדי בשני החלקים הגרעיניים או בשברי הגרעין, כאשר טוהר החפירה תאושר על-ידי סמנים אלה. β-טובולין נבחרה לאישור שבר cytoplasmic, ו-Lamin A/C כסמן גרעיני. חלבונים נוספים המשמשים בדרך כלל הם שוטפת ו α-טובולין כדי לזהות את שבר cytoplasmic או Brg1 (SMARCA4), tfiid ו-RNA פולימראז II עבור טוהר שבר גרעיני4,5. עם זאת, הטיפול חייב להילקח בעת בחירת חלבונים כי הם מועשרים מאוד שברים ספציפיים, ולא להציג בשני השברים (למשל, γ-טובולין) (איור 2ג)9. אכן, הגנד ו אקטין בדרך כלל נחשב חלבונים cytoplasmic יכול להתאים לגרעין12,13, להדגיש את החשיבות של בחירת סמן שבר שאינו מיקום כאשר גירוי או טיפול הוא וחל על התאים. יתרה מזאת, חשוב לאשר שסמן החלבון שנבחר מתבטא בתא העניין על-ידי הפעלת ה-WCL לצד השבר הסלולרי.
בניסוי המייצג המוצג, השתמשו באותו מספר של תאי CLL עבור כל תנאי (טיפול בגירוי/תרופה), ולאחר מכן הכינו דגימות החפירה מיד. טעינת 10 μg של חלבון מפוצל/נתיב מספק חומר מספיק לזיהוי חלבונים של ריבית. בעוד שדוגמאות אלה עברו רק טיפול תרופתי לטווח קצר וגירוי (עד 4 שעות), ההנחה היא שרמת החלבון תישאר זהה בכל דגימה, ושיטת החלבון לא בוצעה. עם זאת, אם הטיפולים בתאים מורחבים (18-72 h), רמת המוות של תאים או התפשטות בתאים עשויים לשנות באופן משמעותי את האיכות ואת כמות החלבון שחולצו, תלוי גירוי התרופה/תא להחיל, ובכך שינוי רמות החלבון בטיפול /המרצת דגימות. במקרים אלה עבור טיפולים לטווח ארוך יותר של תרופות, מומלץ לבצע כימות חלבון באמצעות שיטת ברדפורד או שווה ערך, לפני הכתמים המערביים כדי להבטיח את אותה כמות של חלבון מופעל בכל נתיב של האבן החיסונית. הנוכחות של דטרגנטים עלול להפריע לחלבון מסוים בחני14, הפרעה זו יכולה להיות מופחתת על ידי דילול דגימות חלבון שבר של התאים. בנוסף, השתמש במאגר הפירוק המלא כריק, תוך שימוש באותו דילול כמו בדגימות שנבדקו.
כדי לספק ראיות תומכות לממצאים המתוארים כאן, ניסויים מקבילים ניתן לבצע באמצעות מיקרוסקופ הזריחה כדי לנתח את המיקום של FOXO1 בתוך תאים CLL כדי לאפשר ויזואליזציה של ממצאים אלה5. יתר על כן, שברים subcellular שנוצר יכול לשמש גם עבור הפעילות האנזים בחני או ניתוח פרוטאומניקס בניתוחי במורד הזרם.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
המחברים רוצים להודות לד ר נטשה מאליק על בדיקת כתב היד באופן ביקורתי. מחקר זה מומן על ידי מענק הפרויקט דם וייז הוענק AMM (18003). מתקני ניתוח FACS ממומנים על ידי קרן הוביב. MWM מומן על ידי רופא מומחה דוקטורט מחברים של פול אוגורמן לוקימיה מרכז המחקר, JC מומן על ידי חברים של פול או'גורמן לוקימיה מרכז מחקר JH מומן על ידי מענק הפרויקט דם וייז (18003).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge Tubes | Griener Bio one | 616201 | |
| 3 mL Pasteur Pipettes | Griener Bio one | 612398 | |
| 12 mm x 75 mm FACS Tubes | Elkay | 2052-004 | |
| 15 mL Tube | Griener Bio one | 188271 | |
| 50 mL Tube | Griener Bio one | 227261 | |
| anti-CD5 FITC antibody | BD Biosciences | 555352 | phenotypic surface marker |
| anti-CD19 PE Cy7 antibody | BD Biosciences | 557835 | phenotypic surface marker |
| anti-CD23 APC antibody | BD Biosciences | 558690 | phenotypic surface marker |
| anti-CD45 APC Cy7 antibody | BD Biosciences | 557833 | phenotypic surface marker |
| anti-β-Tubulin antibody | Cell Signaling | 2146 | cytoplasmic marker |
| anti-γ-Tubulin Mouse antibody (clone GTU-88) | Sigma-Aldrich | T5326 | |
| anti-FoxO1 (C29H4) Rabbit antibody | Cell Signaling | 2880 | |
| anti-Lamin A/C antibody | Cell Signaling | 2032 | nuclear marker |
| anti-mouse IgG, HRP-linked Antibody | Cell Signaling | 7076 | Secondary antibody |
| anti-rabbit IgG, HRP-linked Antibody | Cell Signaling | 7074 | Secondary antibody |
| anti-Rpb1 CTD antibody (clone 4H8) | Cell Signaling | 2629 | nuclear marker |
| BDFACS Canto II | BD Biosciences | By Request | Flow Cytometer |
| DAPI Solution | BD Biosciences | 564907 | live/dead discriminator |
| DMSO | Sigma | D2650 | |
| EDTA | Sigma | EDS | |
| Fetal Bovine Serum | Thermofisher | 10500064 | |
| GraphPad Prism 6 | GraphPad Software | Software | |
| Histopaque1077 density gradient media | Sigma | H8889 | |
| HyperPAGE 10 - 190 kDa protein marker | Bioline | BIO-33066 | Molecular weight marker |
| Image Studio Lite (version 5.2.5) | LI-COR | www.licor.com | Software |
| Labnet VX100 | Fisher Scientific | Vortex | |
| Nucelar Extract Kit | Active Motif | 40010 | |
| OneComp eBeads | Thermofisher | 01-111-42 | |
| Trypan Blue Solution | Thermofisher | 15250061 | |
| PageRuler Plus Prestained Protein Ladder | Thermo Fisher Scientific | 26619 | Molecular weight marker |
| PBS Tablets | Fisher Scientific | BR0014G | |
| RosetteSep Human B Cell Enrichment Cocktail | Stem Cell Technologies | 15064 | |
| Sigma 3-16P | SciQuip | Centrifuge | |
| Sigma 1-15PK | SciQuip | Centrifuge |
References
- Kau, T. R., Way, J. C., Silver, P. A. Nuclear transport and cancer: from mechanism to intervention. Nature Reviews Cancer. 4, 106-117 (2004).
- Turner, J. G., Dawson, J., Sullivan, D. M. Nuclear export of proteins and drug resistance in cancer. Biochemical Pharmacology. 83, 1021-1032 (2012).
- Nakamura, N., et al. Forkhead transcription factors are critical effectors of cell death and cell cycle arrest downstream of PTEN. Molecular and Cellular Biology. 20, 8969-8982 (2000).
- Calnan, D. R., Brunet, A. The FoxO code. Oncogene. 27, 2276-2288 (2008).
- Cosimo, E., et al. AKT/mTORC2 inhibition activates FOXO1 function in CLL cells reducing B cell receptor-mediated survival. Clinical Cancer Research. 25, 1574-1587 (2019).
- Mahipal, A., Malafa, M. Importins and exportins as therapeutic targets in cancer. Pharmacology & Therapeutics. 164, 135-143 (2016).
- Hing, Z. A., et al. Next-generation XPO1 inhibitor shows improved efficacy and in vivo tolerability in hematological malignancies. Leukemia. 30, 2364-2372 (2016).
- Lapalombella, R., et al. Selective inhibitors of nuclear export show that CRM1/XPO1 is a target in chronic lymphocytic leukemia. Blood. 120, 4621-4634 (2012).
- Hořejší, B., et al. Nuclear γ-tubulin associates with nucleoli and interacts with tumor suppressor protein C53. Journal of Cellular Physiology. 227, 367-382 (2012).
- McCaig, A. M., Cosimo, E., Leach, M. T., Michie, A. M. Dasatinib inhibits B cell receptor signalling in chronic lymphocytic leukaemia but novel combination approaches are required to overcome additional pro-survival microenvironmental signals. British Journal of Haematology. 153, 199-211 (2011).
- Fischer, K., Hallek, M. Optimizing frontline therapy of CLL based on clinical and biological factors. Hematology. American Society of Hematology. Education Program. 2017, 338-345 (2017).
- Butera, G., et al. Regulation of autophagy by nuclear GAPDH and its aggregates in cancer and neurodegenerative disorders. International Journal of Molecular Sciences. 20, 2062 (2019).
- Virtanen, J. A., Vartiainen, M. K. Diverse functions for different forms of nuclear actin. Current Opinion in Cell Biology. 46, 33-38 (2017).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178, 263-268 (1989).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved