Method Article
ثقافة الخلية علي اغشيه نيرايد السيليكون والتعويض عن البرد لل Synchrotron الاشعه السينية الفلورية نانو-تحليل
In This Article
Summary
ويرد هنا بروتوكول لثقافة الخلية علي الاغشيه نيتريد السيليكون ويغرق-تجميد قبل التصوير الشعاعي الاشعه السينية مع السنكروتروني المبردة الاشعه السينية نانوسبر. عندما يتم توفير درجه حرارة الغرفة فقط نانو التحليل ، يمكن ان تكون العينات المجمدة مزيد من التجميد المجفف. هذه هي الخطوات الحاسمة للحصول علي معلومات حول تكوين عنصري داخل الخلايا.
Abstract
ولا يعرف سوي القليل جدا عن توزيع أيونات المعادن علي المستوي دون الخلوي. ومع ذلك ، فان هذه العناصر الكيميائية لها وظائف تنظيميه أساسيه والتوازن المضطرب وتشارك في مختلف الامراض. الدولة من بين الفن السنكروتروني الاشعه السينية النانو الفلورية توفير الحساسية المطلوبة والدقة المكانية لتوضيح ثنائي الابعاد (2d) وثلاثي الابعاد (3d) توزيع وتركيز المعادن داخل الخلايا بأكملها في مستوي عضيه. وهذا يفتح مجالات علميه جديده مثيره للتحقيق في دور المعادن في الفيزيولوجيا الفسيولوجية للخلية. ويعد الاعداد الخلوي اجراء رئيسيا ومعقدا في كثير من الأحيان ، ولا سيما بالنسبة للتحليل الأساسي. علي الرغم من ان تقنيات الاشعه السينية الآن علي نطاق واسع واستخدمت أساليب الاعداد المختلفة ، والدراسات قليله جدا وقد حققت في الحفاظ علي محتوي عنصري من الخلايا في أحسن الحال ، وليس بروتوكول مفصل متدرج للتعويض عن البرد وقد تم الإفراج عن الخلايا الملتصقة للاشعه السينية النانو الفلورية حتى الآن. هذا هو وصف للبروتوكول الذي يوفر اعداد الخلوية تدريجيا لكريوفيكسيشن السريع لتمكين السنكروتروني الاشعه السينية الشعاعية التحليل نانو الخلايا في حاله رطبه المجمدة عندما تتوفر بيئة المبردة ونقل. في حاله النانو-تحليل يجب ان يؤديها في درجه حرارة الغرفة ، ويتم توفير اجراء إضافي لتجميد التجفيف الاعداد الخلوي كريوفيكسيد. وقد تم استخدام البروتوكولات المقترحة بنجاح في الاعمال السابقة ، ومؤخرا في دراسة التوزيع الثنائي الابعاد والثلاثي الابعاد لمركب فلزي في خلايا سرطان الثدي.
Introduction
المصممة حديثا السنكروتروني الاشعه السينية الفلورية (SR-xrf) النانو تحقيقات تسمح التصور للتوزيع تحت الخلوية من العناصر بطريقه كميه بالبالكامل. وعلي سبيل المثال ، تسمح هذه القدرة التحليلية بالتحقيق في امتصاص جزيئات جسيمات نانويه1 أو فلزي مثل المجمعات المستندة إلى الاوزميوم2، وتوفر نظره ثاقبه علي الامتصاص داخل الخلايا للجسيمات القائمة علي المعادن مع خصائص مضاده للسرطان قويه. كتقنية متعددة العناصر ، يوفر SR-XRF3 مع نانوسبر وسيله لقياس وتعريب اينتراسيلولارلي معظم العناصر الهامه بيولوجيا في وقت واحد ، بما في ذلك الفوسفور والكبريت والبوتاسيوم والكالسيوم والحديد والنحاس والزنك. في الواقع ، فان استخدام الاشعه السينية الصلبة يوفر عمق اختراق كبير للصورة كامله الخلايا المجمدة الرطبة في أزياء خاليه من التسمية. وعلاوة علي ذلك ، وتوفير الوصول إلى الحافة K من معظم عناصر الفائدة ، والاشعه السينية الفلورية هو متحمس أكثر كفاءه. ويسمح استخدام النهج المبردة بالحد من الضرر الإشعاعي والتحسين الأمثل للحفاظ علي هيكل الخلية والتوزيع العنصري.
ومعظم التقنيات التحليلية المتاحة التي تحل مكانيا لدراسة الفلزات في الخلايا هي تقنيات سطحيه تتطلب إنتاج أجزاء رقيقه جدا ومسطحه من الخلايا. ويشمل هذا أساسا مسح المجهر الكترون الإرسال مع تحليل الطاقة التشتت الاشعه السينية (الجذعية-EDX) ، والطاقة المصفاة المجهر الكترون الإرسال (EF-TEM) ، والنانو الثانوية الطيف الكتلة الايونيه (نانوسيمس). لا يمكن اجراء هذا الأخير علي أقسام الخلايا المجمدة والمائية بينما يمكن اجراء تحليل التبريد باستخدام المجهر الكتروني مع دقه مكانيه غير مسبوقة ولكن الحساسية العنصرية الضعيفة. وقد سمحت انبعاثات الاشعه السينية المستحثة بالجسيمات بدراسة التوزيعات العنصرية في الخلايا الكاملة. لديها ميزه كونها كميه تماما مع حساسية عنصري عادله علي مقياس ميكرون وحتى في submicron القرار4، ولكن يعاني من الاضرار الاشعاعيه وعدم وجود قدرات المبردة لدراسة الخلايا المتجمدة الرطب. كل هذه التقنيات التحليلية تكمل بعضها البعض في التصوير العنصري للخلايا ، ولكن بالنسبة لجميع التقنيات ، يعد اجراء اعداد العينات خطوه حاسمه. وينبغي الإبقاء عليه بسيطا للحد من التلوث المحتمل فضلا عن أعاده التوزيع العنصري و/أو التسرب للحصول علي نتائج ذات مغزى. كما هو موضح في المجهر الكتروني ، وسير العمل المبردة ، بما في ذلك تجميد التبريد من الخلية والكريوترانسفير إلى مرحله كرويوكانينج ، يسمح الحفاظ علي عنصري الأمثل في مستويات شبه الخلوية أقرب ما يمكن إلى الدولة الاصليه5،6،7،8،9،10. وقد تم تنفيذ هذا الفهم بنجاح في تطوير المجهرية السينية الاشعه السينية اللينة (علي سبيل المثال ، المجاهر الميدانية الكاملة والمجاهر المسح الضوئي) لإنتاج التصوير الهيكلي الشامل لكامل الخلايا المجمدة الرطب في 2D أو 3D. تم تطوير مهام سير العمل المبردة المختلفة11 لمجاهر الاشعه السينية الناعمة في Beamline 2.1 (XM-2) من مصدر الضوء المتقدم في مختبر لورانس بيركلي الوطني12، beamline U41 في حلقه تخزين الكترون Bessy الثاني (ألمانيا)13، BEAMLINE MISTRAL من مصدر الضوء البا (اسبانيا)14، وفي Beamline B24 من مصدر ضوء الماس15، من بين أمور أخرى. وقد تبين مؤخرا ان سير العمل المماثل هو الطريقة الأكثر موثوقيه للاعداد والحفظ للتحليل العنصري داخل الخلايا باستخدام الاشعه السينية المجهرية16،17.
علي الرغم من ان تقنيات النانو الاشعه السينية بدات تستخدم علي نطاق واسع لتحليل عنصري الخلوية ، وخاصه مع ظهور قدرات المبردة SR-XRF ، لم يتم نشر بروتوكول متدرج حتى الآن إلى المجتمع البحثي. هنا ، يتم توفير اجراء مفصل لاعداد كريوفيكسيد الخلايا الملتصقة المستزرعة كطبقات أحاديه علي اغشيه نيرايد السيليكون ليتم تحليلها في ظل الظروف المبردة. وتقدم أيضا خطوه التجفيف بالتجميد بعد البروتوكول في حاله وجوب اجراء تحليل الاشعه السينية في درجه حرارة الغرفة. في حين تم استخدام البروتوكول المقترح بنجاح مع خلايا سرطان الثدي الإنسان MD-MB-2312 وتم التدليل علي تجميد التجفيف من بين أمور أخرى علي الخلايا العصبية الماوس18،20،21، ويمكن توسيعها بسهوله إلى أنواع مختلفه من الإنسان أو الخلية الحيوانية.
Protocol
تمت الموافقة علي الإجراءات التجريبية من قبل لجنه الرعاية الحيوانية من شعبه علوم الحياة CEA (CETEA ، A14-006). وقد أجريت هذه الاتفاقات وفقا للتشريع الفرنسي والتوجيه الصادر عن مجلس الجماعة الاوروبيه في 24 تشرين الثاني/نوفمبر 1986 (86/609/EEC).
1. نيرايد السيليكون (Si3ن4) غشاء اعداد الدعم
ملاحظه: لان الغشاء هش وحساسة ، ودعمها (200 μm الإطار السيليكون سميكه) يجب التعامل معها بلطف ، ومثالي مع ملاقط الكربون رقيقه أو الملاقط دومونت #5 ، علي التوالي الذاتي إغلاق نصائح غرامه. استخدم هذا البروتوكول اغشيه نيرايد السيليكون مع اطار من 5 مم × 5 مم وحجم غشاء 1.5 مم × 1.5 مم. يجب اعداد الغشاء حوالي 12 ساعة قبل بدء التجربة (اي بذر الخلايا). ويمكن اعداد الاغشيه في نهاية اليوم وترك التجفيف بين عشيه وضحيها تحت الطبقة الثانية غطاء للتدفق الرقائقي بحيث تكون جاهزه للاستخدام في الصباح التالي. سمك اطار السيليكون من 200 μm هو المعيار بالنسبة لمعظم الشركات التي تبيع السيليكون نيتريد النوافذ. إذا كان المنتج المستخدم في هذا البروتوكول غير متوفر ، يمكن استخدام حجم غشاء في نطاق 0.5 − 1.5 ملم مع حجم اطار قياسي من 5 مم × 5 مم. ويفضل حجم الغشاء أكبر عندما سيتم استخدام التصوير المقطعي الاشعه السينية. TEM نوع الشبكة السيليكون نيتريد النوافذ مع حجم غشاء 0.5 مم وسمك 50 nm يمكن أيضا ان تستخدم.
- افتح الكبسولة التي تحتوي علي دعم الغشاء Si3N4 (الشكل 1). اضغط برفق علي الكبسولة من أجل تخفيف الدعم بخفه.
- عقد واحده من زوايا الإطار السيليكون باستخدام ملاقط رقيقه. يجب الحرص علي عدم لمس الغشاء Si3N4 في المركز. 200 أو 500 nm غشاء سميك يمكن ان تتلف بسهوله.
- باستخدام ملاقط رقيقه ، وضع بلطف Si3ن4 غشاء الدعم في طبق بتري الزجاج معقمه ، سطح مستو من السيليكون نيتريد النافذة التي تواجه (اي ، تجويف التي تواجه الجزء السفلي من الطبق).
- أزاله غطاء طبق بيتري وترك الاغشيه تحت ضوء الاشعه فوق البنفسجية لمده 25 − 30 دقيقه تحت مجلس الوزراء تدفق الرقائقي.
ملاحظه: يتم تعيين ضوء UVC (254 nm) عاده في 200 μW/سم2. - وضع 10 μL من بولي-L-ليسين علي الغشاء. وينبغي ان تغطي قطره Si3ن4 غشاء جيدا ويمكن ان ينتشر قليلا علي اطار السيليكون. ترك الأمر عند 37 درجه مئوية لمده 25 دقيقه في الحاضنة النسيج الثقافة القياسية في 100 ٪ الرطوبة النسبية و 95 ٪ الهواء ، 5 ٪ CO2.
ملاحظه: في هذه الحالة تم استخدام طلاء بولي-L-يسين لخلايا سرطان الثدي MDA-MB-231. اعتمادا علي نوع خط الخلية ، يمكن استخدام الطلاءات المختلفة ، وينبغي ان تكون هذه الخطوة الأمثل وفقا لذلك. - في لوحه معقمه 48 جيدا ، وملء ابار مختلفه مع 200 − 250 μL من المياه فائقه نقيه وفائقه الأثر تصفيتها من خلال فلتر معقم 0.22 μm. عاده ، يمكن استخدام كل بئر لشطف ما يصل إلى 2 − 3 اغشيه. باستخدام ملاقط غرامه ، والبيك أب دعم الغشاء في زاوية من اطار السيليكون. شطف الغشاء برفق عن طريق دمجه عموديا 10 ثانيه في ثلاثه ابار متتالية.
ملاحظه: يتم أخذ الغشاء يدعم من الحاضنة ويمكن معالجتها في درجه حرارة الغرفة ، مع درجه الحرارة والرطوبة المحددة من قبل الطبقة الثانية غطاء للتدفق الرقائقي. - وضع الدعم غشاء عموديا في بئر فارغه من لوحه معقمه 96 جيدا ، وتغطيه ذلك ، والسماح لها الجافة بين عشيه وضحيها تحت الطبقة الثانية غطاء للتدفق.
2-بذر الخلايا
- في لوحه معقمه 4 جيدا ، ووضع الاغشيه مع الجانب المسطح التي تواجه ما يصل.
- يتم الحفاظ علي الخلايا MDA-MB-231 في ثقافة أحاديه الطبقة في DMEM مع الفينول الأحمر/جلوساماكس الأول ، تستكمل مع 10 ٪ مصل الساق الجنين و 1 ٪ البنسلين والسستربتومايسين في 37 درجه مئوية في 5 ٪ CO2 الهواء ترطيب الحاضنة.
- عندما تصل الخلايا 60 − 70 ٪ كونفلوينسي أزاله وسائل الاعلام من الطبق أو قارورة.
- غسل 1x مع 10 مل من الفوسفات دولبيكو المالحة مخزنه دون Ca2 + أو Mg2 +.
- أضافه 3 مل/T75 قارورة من 0.05 ٪ التريبسين/الحل أدتا والتاكد من ان الطبقة الاحاديه بأكملها مغطاه بمحلول التريبسين.
- احتضان لمده 3 − 5 دقيقه عند 37 درجه مئوية حتى تبدا الخلايا في الفصل. يجب الحرص علي عدم الإفراط في التريسيسيزي الخلايا وعدم إجبار الخلايا علي فصل قبل الأوان.
- أضف 8 مل من DMEM مع مصل العجل الجنيني بنسبه 10% و 1% من البنسلين والسستربتومايسين أو وسائل الاعلام الكاملة واجمع الخلايا عن طريق التنضيد. سوف المصل في وسائل الاعلام تحييد التريبسين.
- تدور في 250 x g لمده 3 دقائق في درجه حرارة الغرفة. يستنشق العملاق.
- أضافه 8 مل من وسائل الاعلام الطازجة كامله إلى أنبوب 15 مل التي تحتوي علي بيليه الخلية ، وماصه pipet-x الخلايا صعودا وهبوطا حتى يتم تفريق الخلايا في تعليق خليه واحده.
- عد الخلايا باستخدام مقياس اللزوجة وتمييع إلى تركيز 5 × 106 خلايا لكل مل في وسائل الاعلام الكاملة (dmem مع الفينول الأحمر/1 ٪ من 200 mM l-الانيل-الجلوتامين ديببتيد في 0.85 ٪ محلول كلوريد الصوديوم تكمله مع 10 ٪ الجنين الساق المصل و 1 ٪ البنسلين والستربتومايسين).
- خذ 10 μL من تعليق الخلية MDA-ميغابايت-231 وإيداعه علي الغشاء. هذا يماثل إلى 50,000 خليه/10 μL ل MDA-MB-231. وينبغي ان تغطي قطره Si3ن4 غشاء جيدا ويمكن ان تنتشر قليلا علي اطار السيليكون. وينبغي الحرص علي عدم لمس الغشاء Si3N4 مع غيض من ميكروماص.
ملاحظه: اعتمادا علي نوع خط الخلية والتجارب أو القياسات ، قد تختلف كثافة الخلايا ويجب اختبارها وفقا لذلك. هنا ، تم العثور علي كثافة الخلية المقترحة لبذر الغشاء Si3N4 الأمثل للظروف التجريبية ومزيد من التحليل الدقيق-xrf نانو--231 الخلايا MDA-MB-2. - للخلايا العصبية هيبوكامبال (HN) ، وأزاله الانسجه الدماغ الحصين من اليوم الجنيني 18.5 الفئران وهضمه في 0.25 ٪ التربسين في hepes-hbss (5.3 mm kcl ، 0.44 mm KH2po4، 137.9 mm nacl ، 0.34 mm الجناح2po4، 5.56 mm الجلوكوز) في 37 درجه مئوية لمده 15 دقيقه18،19.
- باستخدام ماصه P1000 بطرف P1000 وطرف P200 ، قم باجراء التفكك الميكانيكي عن طريق رسم وتحرير محتوي المخروط مع الماصة عده مرات. خلال هذه الخطوة ، يجب الحرص علي عدم إنشاء فقاعات الهواء في الوسط ، لان فقاعات الهواء هي سامه للخلايا العصبية.
- انتظر بضع دقائق حتى يستقر المجموع في الجزء السفلي من الأنبوب.
- انقل الديدان التي تحتوي علي الخلايا المشتتة إلى أنبوب ابندورف معقم. ترك ~ 25 ميكرولتر من الثقافة المتوسطة التي تحتوي علي المجموع.
- عد الخلايا المنفصلة باستخدام مقياس الكريات الدموية. يتم طلاء الخلايا العصبية HN معزولة في تركيز من 7 × 104 خليه سم-2 علي بولي-l-ليسين (1 ملغ/مل بولي-l-يسين)-المغلفة السيليكون نيرايد الغشاء.
- فقط لاغشيه مع HN ، احتضان الخلايا العصبية في DMEM الاولي تستكمل مع 10 ٪ الجنين البقري المصل. ساعة واحده بعد الطلاء HN في dmem ، يتم تغيير المتوسطة إلى وسائل الاعلام الطلاء العصبي (200 mM l-الانيل-الجلوتامين ديببتيد في 0.85 ٪ محلول كلوريد الصوديوم ، و B27 الملحق د = 1/50 المخفف في neurobasal)18،19.
- للخلايا MDA-ميغابايت-231 ، وضع الغشاء يدعم في 37 درجه مئوية في الحاضنة (100 ٪ الرطوبة النسبية ، 95 ٪ الهواء و 5 ٪ CO2) لمده 25 دقيقه. وهذا يسمح للخلايا لتسويه والبدء في نعلق علي الركيزة. ويمكن تكييف هذا الأمر اعتمادا علي خط الخلية المستخدم.
- أضافه 1 مل من المتوسط الثقافة الكاملة المطلوبة (DMEM مع الفينول الأحمر/1 ٪ من 200 mM L-الانيل-جلوتامين ديببتيد في 0.85 ٪ محلول كلوريد الصوديوم تكمله مع 10 ٪ الجنين الساق المصل و1 ٪ البنسلين والسستربتومايسين) في كل بئر من الخلايا MDA-ميغابايت-231 عن طريق وضع غيض ماصه ضد جدار بئر من البلاستيك والإفراج عن المتوسطة ببطء شديد في حين انه يغطي الغشاء.
- وضع الغشاء العمودي ضد جدار لوحه 4 جيدا من أجل ان تاخذ بعيدا اي فقاعات الهواء المحاصرين في تجويف بئر من Si3N4 الغشاء (الشكل 2). للقيام بذلك ، واستخدام ملاقط غرامه ودفع بعيدا فقاعه بلطف جدا ، وتتحرك موازيه للإطار Si3N4 المؤخر لتجنب لمس واتلاف الغشاء.
- وضع الغشاء مره أخرى أفقيا في الجزء السفلي من البئر وترك 4 لوحه جيدا في الحاضنة للوقت المطلوب اعتمادا علي معدل النمو من خط الخلية المستخدمة. تم احتضان الخلايا MDA-ميغابايت-231 بين عشيه وضحيها.
3-العلاج أو التغير المتوسط
- أزاله المتوسطة من 4 لوحه جيدا.
- شطف مره واحده مع 1 مل من محلول تلفزيوني في 37 درجه مئوية. تخلص من الشريط التلفزيوني وأضف 1 مل من المتوسط الطازج الكامل في الوجود أو في الغياب (الضوابط) من العلاج المطلوب باستخدام طرف ماصه 1 مل ، والإفراج عن السائل ببطء شديد ضد جدار لوحه جيدا. يجب ان يتم غمر الغشاء Si3N4 ببطء دون اي إزعاج لتجنب الحركة الغشائية أو الرفع.
4. البرد--تجميد الاعداد الخلوية بواسطة يغرق--تجمد
ملاحظه: في نهاية وقت الحضانة المطلوب ، في وجود أو عدم وجود العلاج ، يجب شطف الخلايا بعناية وكريوفيكسيد. حوالي 30 دقيقه قبل البدء في شطف ولطخه اعداد الخلوية قبل يغرق-تجميد ، أول اعداد وتهدئه التلقائي اله يغرق الفريزر. كما يمكنك التلاعب كريوجينس ، والمطلوب استخدام القفازات المبردة المناسبة ، نظارات السلامة ، والاحذيه المغلقة ، ومعطف المختبر. ويجب نقل النيتروجين السائل في ديوارس المناسبة ، وينبغي ان يكون مكان العمل التهوية بما فيه الكفاية مع وجود رصد الأكسجين. ومن الناحية المثالية ، يساعد المستوي المنخفض لقياس الرطوبة من 20 − 30% علي الحد من تلوث الجليد بالمواد ، ديوارس ، والكريوجينس ، الأمر الذي يضر بالتزجيج للعينات (اي طبقه جليدية غير متبلورة). ومن الناحية المثالية ، واعتمادا علي مستوي خبره الباحث ، يمكن اعداد ما يصل إلى 10 − 12 عينه لجلسة واحده باستخدام نفس كاس الإيثان الثانوي السائل للتزجيج. بين الدورات ، ويغرق الفريزر التلقائي يتطلب 1 ح التلقائي الخبز الداخلي الاجراء. ومن الناحية المثالية ، ينبغي معالجه العينات بشروط حضانة متطابقة. ومع ذلك ، يمكن معالجه الضوابط أولا ، تليها العينات مع حاله علاج معينه.
ملاحظه: بالنسبة ليغرق-تجميد الخطوات التالية تطبيق كلا من MDA-ميغابايت-231 أو HN الخلايا.
- قم باعداد الكريوبلونجير لكريوفيكسيشن السريع للخلايا.
- قم بتشغيل التجميد التلقائي.
- ادخل المعلمات (علي سبيل المثال ، درجه الحرارة ، والرطوبة في المئة ، ووقت التنقيط إذا تم استخدام التنقيط التلقائي ، وموقف لرفع العينة إلى سطح كريوجين لتسهيل نقل إلى حاويه المبردة) مباشره من وحده التحكم والمعلمات قائمه الإعدادات. في هذه الحالة ، تم تعيين المعلمات من غرفه الرطوبة إلى 37 درجه مئوية و 80 ٪ الرطوبة.
ملاحظه: تم الحصول علي أفضل النتائج التزجيج لهذا البروتوكول والتصوير بالاشعه السينية مع دليل سريع ودقيق التنقيط. التالي ، لا يستخدم البروتوكول برنامج تسلسل التنقيط التلقائي. - نعلق غرفه المرطب ومن أجل الحفاظ علي الرطوبة أولا تعبئته باستخدام حقنه مع 60 مل من الماء المقطر المزدوج ، ومن ثم 20 مل كما دعا علي وحده التحكم يغرق التجميد التلقائي.
ملاحظه: تجنب استخدام الماء نقاء لأنه قد يضر نظام التبخير. إغلاق صمام وترك الأنابيب المرفقة علي المؤخر من المرطب. - قم بتركيب كاس الإيثان الأسود في حاملها وغطيها بالاغطيه البلاستيكية.
- ملء ديوان الغرفة الباردة مع LN2، وبذلك يصل إلى مستوي الشبكة داخل منطقه العمل.
- وضع صندوق تبريد مخصص لتخزين الاغشيه بعد كريوفيكسيشن في حاويه النقل المحتفظ بها في الموقع المخصص في منطقه العمل EM-GP القرب من حامل كاس الإيثان.
ملاحظه: ومخصصه البرد مربع هو التنمية في المنزل في ID16A beamline نانوسبر من الإشعاع السنكروتروني الأوروبي في غرونوبل. تتوفر الرسومات مع المواصفات عند الطلب (الشكل 3). ويمكن تخزينها أربعه في وقت في أنبوب مخروطي 50 mL للتخزين علي المدى الطويل في ديوار LN2. وهناك امكانيه بديله في استخدام صغيره 0.2 mL العادية PCR أنبوب الجدار رقيقه مع قبعات قبة لتخزين واحد Si3ن4 غشاء الدعم. سوف تحتاج إلى حفر ثقب ~ 2 ملم في الجزء العلوي من أنبوب الجدار باستخدام ابره حقنه ساخنه من أجل السماح LN2 لملء الأنبوب. - أملا حاويه النقل مع LN2 وغطيها بغطاء ألمنيوم المخصص. الاستمرار في ملء الغرفة الباردة مع LN2 (عاده ~ 2 L مطلوب) حفظ في 100% الشاشة ln2 مستوي عرض علي وحده التحكم. انتظر حتى يتم الوصول إلى درجه الحرارة النهائية المطلوبة.
- قم بازاله الغطاء البلاستيكي وغطي كاس الإيثان مع التسييل المتصل بزجاجه الإيثان. انتظر حتى درجه حرارة كاس الإيثان يتوازن إلى نقطه الحرارة. عند الوصول ، البدء في استخدام كريوجين الثانوية (اي ، الإيثان المسيل).
ملاحظه: كانت المطالب المستخدمة-180 درجه مئوية ، قليلا فوق نقطه انصهار الإيثان (-182.8 درجه مئوية). أنت لست بحاجه إلى الدقة في تسييل الإيثان لأنه يمكن ان يكون مصدرا لتشكيل الصقيع والتلوث من كاس الإيثان. - فتح الصمام الرئيسي زجاجه الإيثان عاليه النقاء وفتح ببطء شديد منظم الضغط حتى تحصل علي ضباب بطيء من الإيثان. حافظ علي هذا التدفق المنخفض جدا حتى يبني الإيثان السائل. ملء الكاس إلى الحافة العلوية. إغلاق منظم الضغط والصمام الرئيسي للزجاجة الإيثان. أزاله الاساله لأيكا بعناية وتركها جانبا علي دعم البوليسترين الصغيرة تحت غطاء محرك الدخان. الحفاظ علي منطقه العمل مغطاه فضفاضة مع غطاء البوليسترين الأسود المقدمة مع الجهاز لمنع تلوث الصقيع من منطقه العمل وحاويه الإيثان.
- فقط قبل التنقيط اليدوي من العينة ، وأزاله غطاء البوليسترين الأسود ومن القائمة من وحده الصحافة "غرفه السفلي" ، الذي يجمع الغرفة البيئية في اتصال مع منطقه العمل المبردة.
- استعد لتلطيخ العينة.
- اعداد العازلة كافيه لأزاله اثار الأملاح من الوسط الثقافي. لهذا البروتوكول ، تم استخدام المخزن المؤقت خلات الأمونيوم لشطف الخلايا MDA-ميغابايت-231.
ملاحظه: العازل خلات الأمونيوم مناسبه لمعظم أنواع الخلايا ، وانه لا يضيف إلى اشاره الفلورية الاشعه السينية (النظر في العناصر مع Z > 9). قد تتطلب بعض خطوط الخلايا الخاصة مثل الخلايا العصبية استخدام مخزن مؤقت مخصص. علي سبيل المثال ، للخلايا العصبية القشرية الاوليه ، حل ملحي يتكون من 1.8 حجم 0.5 M Na2hpo4 و 1.9 حجم 0.5 m الجناح2PO4 يمكن استخدام15. ومن ناحية أخرى ، فان الفوسفور أو الكلور الموجود في المخزن المؤقت سيساهم في طيف XRF. ويجب ان يوضع في الاعتبار هذا الحد من خطوط انبعاثات الاشعه السينية الزائفة اعتمادا علي عناصر الفائدة التي يتعين الكشف عنها. - اعداد محلول خلات الأمونيوم 150 mM من محلول خلات الأمونيوم نقاء والتحقق من الحموضة (7.0 – 7.3) و الاسموليه (270 – 300 mosm/kg)
ملاحظه: الاسموليه المذكورة أعلاه هو ما يعادل المالحة العازلة دولبيكو في الفوسفات (D-التلفزيونية) دون الكالسيوم والمغنيسيوم ويمكن التحقق باستخدام الصغرى-الاسموليه. - أملا العدد المطلوب من الآبار من 12 صفيحه بلاستيكية جيدا مع العازل خلات الأمونيوم.
- قطع ربع ورقه فلتر لتنقيط ، اما من ورقه فلتر رقم 1 مع ثقب بريكوت ، أو من اللكم يدويا ورقه فلتر من قطرها 55 ملم مع ثقب مركزي 15 ملم.
- إخراج العينة المطلوبة المخزنة في الحاضنة في 37 درجه مئوية في اللحظة الاخيره قبل الشطف ويغرق-تجميد الغشاء.
- فتح ملاقط باستخدام عصابه المشبك الأسود من ملقط الإفراج السريع (وعاده ما يكون الطوق دومونت لقط عاليه الدقة ملاقط الطبية) والاستيلاء علي Si3ن4 غشاء دعم من الثقافة جيدا.
ملاحظه: الاستيلاء علي منتصف اطار السيليكون ، والحفاظ علي غيض من ملاقط بالقرب من الغشاء. حرك المشبك الأسود الدائري وصولا إلى المشارب الاولي لقفل ملاقط. - تزج الدعم الغشاء Si3ن4 عموديا في محلول العازلة خلات الأمونيوم ابقي في 37 درجه مئوية ل ~ 5 s.
ملاحظه: يجب ان يظل الدعم العمودي في المخزن المؤقت. لاحظ ان حل المخزن المؤقت في كل بئر من لوحه يمكن استخدامها لمده تصل إلى ثلاثه اغشيه لنفس ظروف الحضانة. - لطخه يدويا مع ورقه فلتر لاستنزاف العازلة الزائدة من محلول الشطف الغشاء (الشكل 4) من أجل ترك طبقه رقيقه ومتجانسة من محلول خلات الأمونيوم المائية التي تغطي الخلايا.
ملاحظه: للقيام بذلك ، أولا اضغط علي المؤخر من النافذة علي ورقه فلتر لأزاله ما يقرب من كل العازلة المائية المتبقية في البئر والظهر من الغشاء. ثانيا ، لطخه الجانب الامامي ، بدءا من كلا الجانبين من ملاقط ، ثم كل جانب من الإطار (الشكل 4). لا تلمس الغشاء أبدا يمكن مراقبه فائض المخزن المؤقت المصفي مع aureole شكلت علي ورقه التصفية. - فتح باب الغرفة البيئية وتحميل بسرعة ملاقط ، والانزلاق في التعشيق ملقط ، وإغلاق الباب (الشكل 5).
- اضغطعلي "لطخه/A يغرق". سيتم بسرعة سقطت ملاقط عقد Si3ن4 غشاء في cryogen.
- قم بازاله غطاء حاويه النقل بالملقط الذي تم الإفراج عنه.
- اضغط علي "نقل". سيتم نقل الغشاء Si3N4 قليلا فوق cryogen.
- في حركه واحده سريعة ، افصل ملاقط عن طريق تحريكها من التعشيق ملقط وأماله قليلا من التعشيق لجلب مباشره إلى فتحه فارغه من صندوق التبريد في حاويه نقل مليئه LN2. حرر خاتم المشبك الأسود لتحرير الغشاء (الشكل 5).
ملاحظه: يجب دائما تغطيه حاويه النقل مع LN2. عند الحاجة لملء العبوه ، غطي كوب الإيثان بالغطاء البلاستيكي المزود بالماكينة لتجنب خلط LN2 والإيثان. - غطي حاويه النقل بغطاء واستخدم كوب البوليسترين ابيض صغير مليء ب LN2 لنقله إلى صندوق البوليستيرين المليء ب ln2.
ملاحظه: يمكن بعد ذلك تخزين صندوق التبريد أو الأنبوب الذي يحتوي علي الاغشيه في أنابيب مخروطيه الشكل 50 مل مملوءة ب LN2 ونقلها إلى تخزين طويل الأجل ln2 dewar. قبل البدء في الغطس تجميد العينة القادمة ، والإحماء جميع ملاقط الباردة ومتجمد مع مجفف الشعر أو مجفف لوحه ساخنه/كريتوولس (45 درجه مئوية) لتجنب التلوث مع بلورات الثلج.
- اعداد العازلة كافيه لأزاله اثار الأملاح من الوسط الثقافي. لهذا البروتوكول ، تم استخدام المخزن المؤقت خلات الأمونيوم لشطف الخلايا MDA-ميغابايت-231.
5. تجميد--تجفيف الخلايا يغرق--المجمدة المزروعة علي الاغشيه نيرايد السيليكون
ملاحظه: بالنسبة لتجفيف التجميد ، يتم تطبيق الخطوات التالية علي كل من MDA-ميغابايت-231 والخلايا HN. لتهدئه مجفف تجميد ، وسوف تحتاج إلى الانتظار حوالي 40 دقيقه إلى 1 ساعة.
- اعداد مجفف التجميد
- قم بتبديل الطاقة باستخدام مفتاح الروك الموجود علي اللوحة الخلفية للاداه.
- أبدا في إدخال المعلمات التالية لقائمه LCD: الجزء 1 = 2 h عند-120 درجه مئوية ؛ الجزء 2 = 2 ح المنحدر من-120 درجه مئوية إلى-80 درجه مئوية ؛ الجزء 3 = 2 ح في-80 درجه مئوية ؛ الجزء 4 = 2 ح المنحدر من-80 درجه مئوية إلى 50 درجه مئوية ؛ الجزء 5 = 2 ح في-50 درجه مئوية ؛ الجزء 6 = 6 h المنحدر من-50 درجه مئوية إلى 30 درجه مئوية.
- في نهاية اعداد المعلمة ، احفظ الإعدادات ، اغلق غطاء الغرفة واضغط علي "START".
- سوف الوحدة ضخ وصولا إلى 1.10-5 mbar. عند الوصول إلى هذا الضغط ، سيظهر سطر الأوامر للعرض "بدء التبريد الآن ، أبدا للمتابعة".
- ملء النيتروجين السائل ديوار بانتظام لتهدئه المرحلة تحت درجه الحرارة الثلاث نقطه الاعداد.
ملاحظه: يتم تعيين درجه الحرارة نقطه الثلاثي المرحلة إلى-140 درجه مئوية. قبل تحميل العينة لهذا البروتوكول ، فمن الأفضل ان ننتظر حوالي 1 h ودرجه حرارة المرحلة-160 درجه مئوية. - سوف تظهر الشاشة "اضغط علي المفتاحR" عند الاستعداد ل "تحميل العينة".
- تهدئه إلى درجه حرارة النيتروجين السائل داخل LN2 شغل البوليسترين ديوار ، وصاحب عينه نقل المقدمة من قبل المورد ، واثنين اضافيه أسطواني النحاس Si3ن4 حاملي الغشاء.
- جبل Si3ن4 غشاء حامل النحاس الأصفر علي راس صاحب نقل عينه المقدمة من قبل المورد في ديوار البوليسترين (الشكل 6ا). الحفاظ علي مستوي LN2 إلى حوالي 1 − 2 مم تحت الحافة العلوية من القطعة النحاسية الاولي.
- التقاط Si3ن4 غشاء دعم عينه من البرد مربع أو أنبوب PCR باستخدام الملقط الذاتي الإغلاق precooled في اينونوكس أو تفلون المغلفة.
- إيداع الغشاء مع الجانب عينه الخلايا التي تواجه حتى في تجويف النحاس مرقمه.
- تغطيه التجميع مع القطعة النحاسية الثانية كغطاء (الشكل 6ج).
ملاحظه: قمنا بتصميم اثنين من الاقراص النحاسية كل منها سماكه 5 ملم ، وقطرها 50 ملم ، وثقب القطر 11 ملم المركزية. القرص النحاسي الأول لديه 14 تشكيله مستطيله (8 مم × 6 مم) المواقع لاستيعاب الدعم (5 مم × 5 مم). كل فتحه لديها شقه ومصقول جيدا مع عمق 2 ملم. القرص النحاسي الثاني هو مسطح لتغطيه Si3N4 غشاء دعم النحاس وبمثابه الضميمه فخ الباردة. - Precool قضيب نقل في LN2 معباه رغوة البوليسترين مربع واستخدامها لقفل في التجمع الكامل (الشكل 6د ، ه).
- اضغط علي "ENTER" علي اللوحة الاماميه من مجفف تجميد.
- وسوف تتوقف مضخات توربو والدوارة وتطهير الغرفة مع غاز النيتروجين الجاف للسماح فتح غطاء الغرفة.
- نقل علي الفور التجمع عينه نقل مع قضيب نقل الربيع محمله في غرفه مجفف تجميد ومقطع علي النحاس LN2 المرحلة الباردة.
ملاحظه: ترك التجميع الكامل مع قضيب نقل في الغرفة. - اغلق علي الفور غطاء غرفه التجفيف بالتجميد واضغط علي "START" للمتابعة مع دوره التجميد.
- ملء خزان LN2 من مجفف تجميد يدويا كل 2 ساعة.
ملاحظه: قد يكون نظام التعبئة LN2 التلقائي متصلا بهذا الخزان. - في نهاية دوره التجفيف بالتجميد ، اضغط علي "STOP" لتنفيس الغرفة ، وقم بازاله التجميع الكامل للوصول إلى العينات المجففة بالتجميد.
النتائج
عرض مجهر الفيديو البصرية نموذجيه من الخلايا المجمدة الرطبة MDA-ميغابايت-231 التي كانت شبه مثقف علي بولي-L-يسين المغلفة Si3ن4 ويظهردعم غشاء في الشكل 7ا. تم الحصول علي الرؤية البصرية للعينه في غرفه فراغ في وضع التفكير باستخدام المجهر الفيديو مخصصه علي الإنترنت من ID16A beamline من ESRF22. في حين يتطلب الكترون أو الاشعه السينية الناعمة المجهرية طبقه الجليد تضمين الخلية لتكون رقيقه قدر الإمكان (عاده < 0.5 μm) ، والاشعه السينية الصلبة (> 10 كيلو) لديها ميزه عمق الاختراق اعلي بكثير وترسب الجرعة المنخفضة. سمك الجليد التالي يمكن ان تكون أكبر ، عاده < 10 μm بما في ذلك الخلية بحيث الجليد تضمين الخلية هو عدد قليل ميكرون في سمك. ويمكن تقدير هذا من خلال كثافة الاشعه السينية تقاس في انتقال مقارنه مع كثافة دون العينة ، مع الأخذ بعين الاعتبار امتصاص 500 nm سميكه Si3N4 غشاء. ويمكن تحقيق هذا السمك الجليدي من خلال دليل التنقيط علي النحو المبين في هذا البروتوكول. في المنطقة حلقات نيوتن ، سمك الجليد يمكن ان يكون حتى ارق (لا يقاس).
ويبين الشكل 7باء رسم الخرائط العنصرية بالاشعه السينية للخلية الرطبة المجمدة ، مع توزيع العناصر الفسيولوجية مثل البوتاسيوم (K) ، والكبريت (ق) ، والزنك (Zn). وتمثل هذه الخرائط الكتلة المساحية العنصرية (اي الكتلة المسقطة العنصرية). وفي حين ان هذه الخرائط لم يتم القيام بها في هذه الحالة ، فانه يمكن تطبيعها من خلال تصوير تباين المراحل القائم علي الانتشار بالاشعه السينية الذي يوفر تقدير العينة المتوقعة من الكتلة23. كما ذكرت من قبل العديد من الدراسات ، ويفترض ان أيون شديد التشتت في الخلايا المحفوظة في دولتهم القريبة من السكان الأصليين ان تكون متجانسة توزيعها في جميع انحاء الخلية23،24،16. وكما هو مبين في الصور العنصرية ثنائيه الابعاد بالاشعه السينية في الشكل 7ب، فان العنصر المنضم باحكام قد وزع بالتساوي داخل الخلية ، بالمثل إلى K ، ويمثل تقديرا جيدا للتشكيل الشامل الخلوي. وكان توزيع الزنك اشاره اعلي في النواة مما كانت عليه في عصارة وحددت بوضوح النواة. ويمكن الاشاره إلى ان المناطق الصغيرة المخصبة بالزنك يمكن الكشف عنها عند الاستبانة المكانية (50 نانومتر) في المنطقة النووية.
ان النانو الموجودة في الاشعه السينية أو تلك التي سيتم بناؤها لا تستوعب بالضرورة القدرات المبردة. في هذه الحالة ، فان أفضل بديل للحصول علي صور شعاعي الاشعه السينية من الخلايا في القرارات المكانية الفرعية 100 nm هو اجراء تجميد التجفيف المنصوص عليها في هذا البروتوكول بعد يغرق-تجميد الخلية. الشكل 8a يظهر نموذجي مشرق عرض المجهر الميداني من الناتجة تجميد المجفف الرئيسية الماوس هيبوكامبال الخلايا العصبية المزروعة مباشره علي الغشاء Si3N4 . في هذه الحالة ، إذا كانت مخزنه في غرفه المجففة نظيفه ، يمكن اعداد عينات 1 − 2 أسابيع مقدما وان يلاحظ مع المجهر البصري تستقيم العادية لتسجيل المناطق ذات الاهميه. وينبغي توخي الحذر لمنع التعرض للرطوبة المحيطة لأنه قد يتم الاستيلاء عليها بواسطة العينة المجففة بالتجميد وتؤدي إلى تلف تحت الاشعه السينية نانوبي. تم تطبيق هذا الاجراء بنجاح علي الخلايا الحساسة جدا (اي الخلايا العصبية) وتم الحصول علي نتائج أفضل مع أنواع أخرى أكثر قوه من الخلايا ، مثل الخلايا السرطانية. اما بالنسبة للخلايا المجمدة ، فان صور الاشعه السينية من K و S و Zn علي كامل عرض الخلية المجففة تشبه تلك المذكورة أعلاه. وهي تمثل التوزيعات العنصرية التي يمكن العثور عليها في أنواع مختلفه من الخلايا المجففة بالتجميد باستبانة مكانيه بدقه 50 − 100 نانومتر. في حين تجميد التجفيف الخلايا الكاملة هو بديل للحفاظ علي سلامه عنصري ، فمن علي حساب الحفاظ علي الكمال من الشكل الخلية16، وخاصه اغشيه الخلايا.

الشكل 1: نموذج الدعم النموذجي للاشعه السينية لتحليل النانو. دعم الغشاء Si3N4 في الكبسولة الواقية. ويمكن استخدام هذا النوع من الركيزة علي حد سواء لتحليل درجه حرارة الغرفة (يغرق تجميد اعداد الخلوية تليها درجه حرارة منخفضه وانخفاض فراغ تجميد التجفيف عمليه) أو لتحليل المبردة الاشعه السينية الفلورية. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
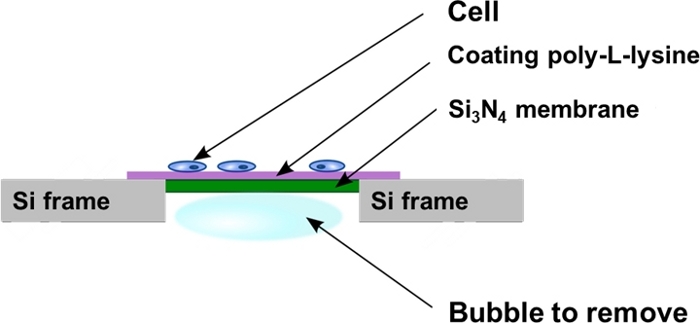
الشكل 2: عرض تخطيطي للنوافذ نيرايد السيليكون بعد بذر الخلية. يتم استزراع الخلايا مباشره علي السطح المسطح بولي-L-ليسين المغلفة لدعم الغشاء Si3N4 . في بعض الأحيان يمكن ان تكون المحاصرين فقاعات الهواء في تجويف المؤخر لدعم الغشاء Si3ن4 ويجب ازالتها كما هو موضح في البروتوكول. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 3: في المنزل وضعت 3D المطبوعة البرد مربع للتخزين علي المدى الطويل من يغرق المجمدة Si3N4 غشاء يدعم في ديوار النيتروجين السائل. (ا) صندوق التبريد المفكك مع الحاوية والاغطيه (الجزء السفلي) و (ب) صندوق التبريد المجمع مع قبعات مقفله. يمكن التلاعب القبعات مع ملاقط ، فتح أو قفل بالتناوب. تتوفر خطه مفصله للطباعة ثلاثية الابعاد عند الطلب من ESRF ID16A. وقد تم تصميم لاستيعاب شبكات السيليكون نيتريد TEM. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 4: التنقيط من الخلايا المستزرعة علي Si3N4. قبل يغرق-تجميد الخلية أحاديه الطبقة المستزرعة علي الغشاء Si3N4 يحتاج إلى شطف في محلول خلات الأمونيوم (ا) وبعناية يدويا باستخدام ورقه فلتر (ب). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 5: التلقائي يغرق تجميد الام-GP الجهاز. (ا) يغرق الفريزر التلقائي. (ب) الغرفة البيئية مع ملاقط مقفله في. (ج) كوب الإيثان المغطي بالتسييل لأيكا المتصل بزجاجه الإيثان. (د) الضميمه المبردة التي تظهر الكوب الأسود الكامل من الإيثان المسال وصندوق التبريد لمزيد من التخزين في LN2 من الاغشيه Si3N4 اللاذعة. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 6: عينه كريوترانسفير تجميع لاجراء تجميد التجفيف. (ا) المتلقي النحاس الأول ل Si3N4 الاغشيه هي التي شنت علي راس العينة حامل النقل المقدمة من قبل المورد تجميد مجفف. (ب) و (ج) تبين ان القرص النحاسي المسطح الثاني يستخدم كغطاء ويعمل كالضميمه الباردة لادراجها في الضميمه فراغ من مجفف تجميد. (د) التجميع الكامل مع قضيب النقل المحمل بالزنبرك. (ه) يجب أضافه حامل العينة الذي يحمل الاعداد الخلوي اللاذع المزروع علي غشاء Si3N4 في مجفف التجميد المبرد LN2. يتم اجراء كافة الخطوات لتركيب التجميع في LN2 في مربع الستايروفوم. للتوضيح ، تم إنتاج جميع الصور في غياب LN2. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 7: صور فلورية بالاشعه السينية لخليه رطبه مجمده باستخدام القرص الصلب للاشعه السينية النانويه. (ا) العرض النموذجي علي الإنترنت في وضع الانعكاس باستخدام مجهر الفيديو البصري المخصص ل ESRF ID16A beamline. بعد التنقيط اليدوي ، تم تحقيق سماكه الجليد الاجماليه من حوالي 5 − 10 ميكرومتر التي تسمح برؤية واضحة للخلايا الرطبة المجمدة. منطقه مع نيوتن حلق دلاله من حتى كثير ارق جليد ملحوظة. (ب) التوزيعات الخلوية بالاشعه السينية التمثيلية للعناصر الفسيولوجية البوتاسيوم (K) ، والكبريت (ق) ، والزنك (Zn). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
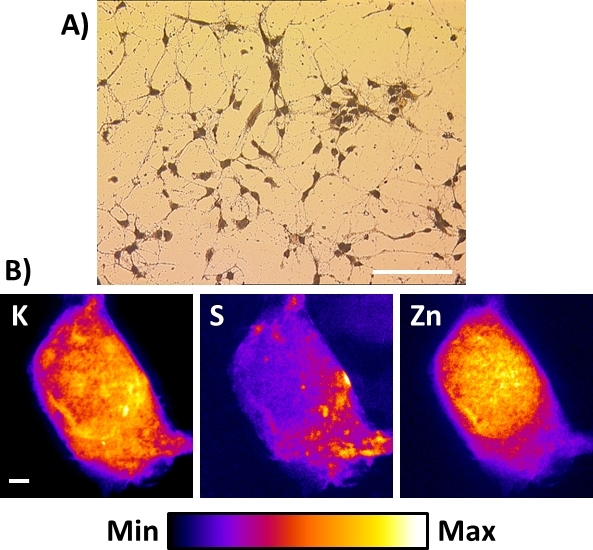
الشكل 8: صور الاشعه السينية للخلايا العصبية المجففة بالتجميد باستخدام القرص الصلب للاشعه السينية النانويه. (ا) عرض المجهر الميداني الساطع النموذجي للخلايا العصبية القشرية الاوليه الناتجة عن التجميد التي تم استزراعها مباشره علي الغشاء Si3N4 . شريط مقياس = 200 μm (ب) درجه حرارة الغرفة التمثيلية الصور الشعاعية الاشعه السينية من الخلايا العصبية هيبوكامبال المجففة واحده تظهر توزيعات العناصر الفسيولوجية البوتاسيوم (K) ، والكبريت (ق) ، والزنك (Zn). شريط مقياس = 2 μm. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.
Discussion
[برد-الكترون] مجهريه ([برد-م]) يربح ال 2017 [نوبل بريز] في كيمياء وبما ان مثل هذا التطوير يجعل ب [ج.]. [دوبوشت] علي تزجيج من ماده احيائيه ل ال [هيغ-ديكايشن] بنيه تحديد الجزيئات احيائيه في حل25. وكما ذكر دوبوشيت في محاضرته التي ألقاها بجائزه نوبل "ان معرفه كيفيه القيام بالتزجيج لقطره من الماء شيء واحد ، فان اعداد عينه بيولوجية للمراقبة البيولوجية هو آخر"25. وتعتبر الآن خطوات التعويض عن البرد التقنية القياسية للتخفيف من الضرر الناجم عن الجرعة الاشعاعيه ودراسة الخلايا القريبة من حالتها الاصليه. غير ان الاعداد لا يزال مملا. وذلك لان المجهر الكتروني ، نظرا لدقته المكانية غير المسبوقة ، حساس لأي قطعه أثريه بنيوية تحدث اثناء اعداد العينة. وتقترب الآن المجسات المتزامنة من الصعوبات المماثلة التي تنخفض إلى القرارات المكانية بحيث تصل إلى 13 نانومتر في نطاق الاشعه السينية العالية الطاقة26. من الصعب الاشعه السينية المجهر يمكن تحليل الخلايا بأكملها في حين يعاني المجهر الكترون من عمق تغلغل الفقراء من الكترونات تمكين فقط شرائح رقيقه جدا الخلية التي يمكن ملاحظتها.
أحاديه الخلايا هي رقيقه بما يكفي بحيث يغرق-تجميد في الإيثان السائل ، يتم تحقيق معدلات التبريد المطلوبة لتزجيج المياه. من الناحية النظرية ، معدلات التبريد عاليه مثل 108 ك/س ممكنة باستخدام الضغط العالي التجميد27 الذي يسمح التزجيج من العينات سميكه جدا ليغرق تجميد. يتم الوصول إلى معدل تبريد 105 ك/ثانيه ، المطلوبة للسماح بالتزجيج الكامل للعينه في الضغط المحيط28، التكرار باستخدام التلقائي يغرق-تجميد اله والمعلمات المعروضة هنا. وهذا يسمح للباحث بان يرمم العينات البيولوجية الرقيقة (< 10 ميكرومتر) مثل الطبقة الاحاديه من الخلايا12،13،14،15،29،30 بالتجميد في الإيثان السائل.
ومن التحديات الهامه مع هذا البروتوكول هو أيضا الحفاظ علي قدر الإمكان السلامة الكيميائية للمحتوي داخل الخلايا لتوفير توزيعات عنصري موثوق بها في الخلية في 2D أو 3D. كما نشرت في مكان آخر2،16،17،31، في حاله التصوير العنصري علي المستوي تحت الخلوي ، ينبغي النظر في تحليل الخلايا الرطبة المجمدة. والا ، يمكن استخدام مزيج من يغرق-تجميد وتجميد تجفيف الخلايا لتحليل درجه حرارة الغرفة. بالنسبة لهذا الأخير ، يتم أزاله الجليد غير متبلور من خلال عمليه التسامي ، في حين يتم أزاله جزيئات الماء المنضم من خلال عمليه الامتصاص. قد تكون هذه العملية بعيده عن المثالية مقارنه بالعينات الرطبة المجمدة بسبب التغير المحتمل في الاغشيه الخلوية وشكل بعض الهياكل الخلوية32. أيضا ، بالنسبة للدراسات المحددة ، قد يؤدي استخراج المياه إلى قطع أثريه معدنيه. ومع ذلك ، فقد كان ناجحا وأفضل بديل لعينات رطبه المجمدة للتصوير عنصري في المستويات الفرعية 100 nm2،16،17،18،20،33،34،35،36.
كما تم الإبلاغ عن37، ويمكن تقييم نوعيه الاستعدادات الخلوية بالتبريد من خلال نسبه K/Na البوتاسيوم إلى الصوديوم. لسوء الحظ ، فانه لا يمكن حتى الآن ان تحدد مع الصلبة الاشعه السينية نانوسبر المستخدمة هنا ، وذلك بسبب انخفاض الطاقة المنخفضة للكشف عن الانجراف السيليكون المستخدمة للكشف عن الفوتونات الاشعه السينية من العناصر (E ≥ 1.3 كيلو المغنيسيوم). في الواقع ، نسبه عاليه K/Na (> 10) التي يمكن قياسها باستخدام توف-سيمز ، epma ، أو ميكروسبر النووية pixe16،37 هو مؤشر علي سلامه المواد الكيميائية المحفوظة للخلية مقارنه بالمتوقع ك/نا من 25 في خليه حيه37. ويمكن دعم ذلك بنسبه منخفضه من Cl/K المصاحبة38. ومع ذلك ، فان التزجيج الناقص ، خاصه إذا كانت سرعه تبريد العينة منخفضه جدا ، يمكن ان تؤدي إلى تشكيل بلورات جليدية كبيره يمكن ان تتلف اغشيه الخلايا والأرغن ، التالي تغيير توزيع العناصر الكيميائية. علي الرغم من انه لا يوجد اجراء روتيني لمراقبه هذا الضرر المحتمل والتاثير علي التوزيع داخل الخلايا ، فان نسب العنصري المذكورة أعلاه وامكانيه تصوير الخلية بدقه عاليه باستخدام الاشعه السينية المتباينة أو المجهرية السينية بالاشعه السينية يمكن ان تكون أفضل الطرق لدعم الحفاظ علي سلامه المقصورات الجمع بين هذه التقنيات واستخدام المجاهر البصرية كريوكوريلاتيفي مضان المتقدمة حديثا سوف تساعد علي تقييم إلى اي مدي يحدث هذا الضرر ويؤثر علي توزيع عنصري داخل الخلايا.
وعموما ، يتم تقديم بروتوكول مفصل وشامل لاعداد عينات الخلوية لتحليل الاشعه السينية الشعاعية السنكروتروني. وهو نقطه انطلاق جيده للمجتمع البحثي ، مما يساعد علي حل القضية الصعبة لكيفيه اعداد عينات الخلوية المناسبة ل 2D و 3D التصوير العنصري في (البرد) الصلبة الاشعه السينية النانو. ويمكن دمج هذه النهج مع القدرات الضوئية البصرية والمجهرية الكترونيه للتصوير الكيميائي النسبي العميق والتصوير الهيكلي للخلايا.
Disclosures
ولا يوجد تضارب في المصالح بين أصحاب البلاغ.
Acknowledgements
أجريت التجارب علي النانو التصوير beamline ID16A في اطار مقترحات ESRF LS2430 ، LS2303 ، و LS2765.
Materials
| Name | Company | Catalog Number | Comments |
| Ammonium Acetate solution, BioUltra, for molecular biology, ~5M in H2O | SIGMA | 09691-250mL | One can prepare the required solution from high-grade ammonium acetate powder and ultrapure water, pH and osmolarity needs to be adjusted anyway. |
| B27 supplement, 50x | Life Technologies, Invitrogen | 17504-044 | for hippocampal neuron culture |
| Dulbecco’s Phosphate Buffered Saline, DPBS, ([-] CaCl2, [-] MgCl2) | GIBCO | 14190-094 | cell culture |
| DMEM with Phenol Red/Glutamax I (Medium ATCC modification) | GIBCO | 21885025 | cell culture |
| Dulbecco’s modified Eagle medium (DMEM) | Life Technologies, Invitrogen | 31966-02 | for hippocampal neuron culture |
| Dumont Tweezers #5, Straight Self-closing, 0.05x0.01mm Tips, Biology | World Precision Instrument | 501202 | |
| Emitech K750X Peltier-Cooled EM Freeze Dryer | Quorum Technology | EK3147 | |
| Ethane N45 | Air Liquid | p0505s05r0a001 | C2H6 > 99,995 % |
| Fetal Bovine Serum, Performance Plus, certified One Shot format, US origin | GIBCO | A31604-02 | cell culture |
| HBSS 10x | Life Technologies, Invitrogen | 14185-052 | for hippocampal neuron culture |
| Leica GP quick-release forceps | Leica | 16706435 | |
| MDA-MB-231 cell line, an epithelial, human adenocarcinoma breast cancer cell | ATCC | ATCC HTB-26 | cell culture |
| Neurobasal medium | Life Technologies, Invitrogen | 21103-049 | for hippocampal neuron culture |
| Nunc 4-Well Plate | Thermo Fisher | 176740 | cell culture |
| Osmo1 Single-Sample Micro-Osmometer | Advanced Instruments | Osmo1 | Alternative can be found at Fisher scientific (Wescor Inc. VAPRO® Vapor Pressure Osmometer) |
| Penicillin-Streptomycin | SIGMA | P4333 | cell culture |
| poly-L-lysine | SIGMA | P4707 | Other type of coating can be used that is dependent of the cell type to be cultured on the membrane, other adhesion factors such as fibronectin, collagen, polyornithine can be tested accordingly. Cell can be cultured directly on silicon nitride membrane, but the latter are slightly hydrophobic and adhesion factors are recommended unless the membrane are processed to be hydrophilic (glow plasma discharged). |
| Plunge freezing robot Leica EM GP main unit | Leica | 16706401 | Alternative for automated plunger are the Vitrobot Mark IV (FEI), CryoPlunge 3 (Gatan), MS-002 Rapid Immersion Freezer (EMS). Manual home-made system can be used but an environment-controlled chamber is an asset for plunge-freezing. |
| Silicon nitride membrane (Si3N4) | Silson Ltd. | SiRN-5.0(o)-200-1.5-500-NoHCl | The proposed silicon nitride membrane type is optimised for analysis at ID16A ESRF X-ray nanoprobe, The 500 nm thickness of the membrane was chosen being more robust for cellular manipulation and cryofixation detailed within this protocol. Membrane with thickness of 200 nm or below can also be used although quite fragile, and other design of silicon nitride membrane can be purchased (for example TEM compatible membrane...) from Sislon or other company such as Norcada, SPI supplies, Ted Pella, EMS, LabTech, Neyco... |
| Trypan blue solution 0.4% | GIBCO | 15250061 | cell culture |
| Trypsin-EDTA, 0.05% | GIBCO | 25300-054 | cell culture |
| Ultratrace Elemental Analysis Grade, Ultrapure Water | Fisher Chemicals | W9-1 | MilliQ water can be used but has to be tested for trace element level of contamination using for example ICP-MS analysis. |
| Whatman No. 1 filter paper with precut hole | Leica | 16706440 | Alternative filter paper may be used and must have an outer diameter of 55 mm, the Punch for filter paper system from Leica (ref.16706443) can be used. |
References
- Lewis, D. J., et al. Intracellular synchrotron nanoimaging and DNA damage/genotoxicity screening of novel lanthanide-coated nanovectors. Nanomedicine. 5 (10), 1547-1557 (2010).
- Fus, F., et al. The intracellular localization of osmocenyl-tamoxifen derivatives in hormone-independent breast cancer cells revealed by 2D and 3D nano X-ray fluorescence imaging. Angwendte Chemie. , (2019).
- Janssens, K., Adams, F., Rindby, A. Microscopic X-Ray Fluorescence Analysis. , Wiley. Chichester, UK. (2000).
- Carmona, A., et al. Uranium exposure of human dopaminergic cells results in low cytotoxicity, accumulation within sub-cytoplasmic regions, and down regulation of MAO-B. Neurotoxicology. 68, 177-188 (2018).
- Leapman, R. D., Hunt, J. A., Buchanan, R. A., Andrews, S. B. Measurement of low calcium concentrations in cryosectioned cells by parallel-EELS mapping. Ultramicroscopy. 49 (1-4), 225-234 (1993).
- Saubermann, A. J., Echlin, P., Peters, P. D., Beeuwkes, R. Application of scanning electron microscopy to X-ray analysis of frozen hydrated sections. I. Specimen handling techniques. Journal of Cell Biology. 88 (2), 257-267 (1981).
- Saubermann, A. J., Heyman, R. V. Quantitative digital X-ray imaging using frozen hydrated and frozen dried tissue sections. Journal of Microscopy. 146, Pt2 169-182 (1987).
- Wroblewski, J., Roomans, G. M. X-ray microanalysis of single and cultured cells. Scanning Electron Microscopy. , Pt 4 1875-1882 (1984).
- Wroblewski, J., Müller, R. M., Wroblewski, R., Roomans, G. M. Quantitative X-ray microanalysis of semi-thick cryosections. Histochemistry. 77 (4), 447-463 (1983).
- Zierold, K. Cryopreparation of mammalian tissue for X-ray microanalysis in STEM. Journal of Microscopy. 125, Pt2 149-156 (1982).
- Harkiolaki, M., et al. Cryo-soft X-ray tomography: Using soft X-rays to explore the ultrastructure of whole cells. Emerging Topics in Life Sciences. 2 (1), 81-92 (2018).
- McDermott, G., Le Gros, M. A., Knoechel, C. G., Uchida, M., Larabell, C. A. Soft X-ray tomography and cryogenic light microscopy: the cool combination in cellular imaging. Trends in Cell Biology. 19 (11), 587-595 (2009).
- Schneider, G., et al. Three-dimensional cellular ultrastructure resolved by X-ray microscopy. Nature Methods. 7 (12), 985-987 (2010).
- Sorrentino, A., et al. MISTRAL: a transmission soft X-ray microscopy beamline for cryo nano-tomography of biological samples and magnetic domains imaging. Journal of Synchrotron Radiation. 22 (4), 1112-1117 (2015).
- Carzaniga, R., Domart, M. C., Duke, E., Collinson, L. M. Correlative cryo-fluorescence and cryo-soft X-ray tomography of adherent cells at European synchrotrons. Methods in Cell Biology. 124, Academic Press. 151-175 (2014).
- Perrin, L., Carmona, A., Roudeau, S., Ortega, R. Evaluation of sample preparation methods for single cell quantitative elemental imaging using proton or synchrotron radiation focused beams. Journal of Analytical Atomic Spectrometry. 30 (12), 2525-2532 (2015).
- Jin, Q., et al. Preserving elemental content in adherent mammalian cells for analysis by synchrotron-based x-ray fluorescence microscopy. Journal of Microscopy. 265 (1), 81-93 (2017).
- Daoust, A., et al. Impact of manganese on primary hippocampal neurons from rodents. Hippocampus. 24 (5), 598-610 (2014).
- Daoust, A., et al. Manganese Cytotoxicity Assay on Hippocampal Neuronal Cell Culture. Bio-protocol. 5 (1), 1368(2015).
- Gibon, J., et al. The over-expression of TRPC6 channels in HEK-293 cells favours the intracellular accumulation of zinc. Biochimica et Biophysica Acta (BBA)-Biomembranes. 1808 (12), 2807-2818 (2011).
- Hasna, J., Bohic, S., Lemoine, S., Blugeon, C., Bouron, A. Zinc Uptake and Storage During the Formation of the Cerebral Cortex in Mice. Molecular Neurobiology. , 1-13 (2019).
- Villar, F., et al. Nanopositioning for the ESRF ID16A Nano-Imaging Beamline. Synchrotron Radiation News. 31 (5), 9-14 (2018).
- Kosior, E., et al. Combined use of hard X-ray phase contrast imaging and X-ray fluorescence microscopy for subcellular metal quantification. Journal of Structural Biology. 177 (2), 239-247 (2012).
- Bohic, S., et al. Synchrotron hard X-ray microprobe: fluorescence imaging of single cells. Applied Physics Letters. 78, 3544-3546 (2001).
- Dubochet, J. On the Development of Electron Cryo-Microscopy (Nobel Lecture). Angwendte Chemie. 57 (34), 10842-10846 (2018).
- Da Silva, J. C., et al. Efficient concentration of high-energy X-rays for diffraction-limited imaging resolution. Optica. 4 (5), 492-495 (2017).
- Studer, D., Humbel, B. M., Chiquet, M. Electron microscopy of high-pressure frozen samples: bridging the gap between cellular ultrastructure and atomic resolution. Histochemistry and Cell Biology. 130 (5), 877-889 (2008).
- Moor, H. Theory and pratice of high pressure freezing. Cryotechniques in Biological Electron Microscopy. Steinbrecht, R. A., Zierold, K. , Springer. 175-191 (1987).
- Gilkey, J. C., Staehelin, L. A. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. Journal of Electron Microscopy Techniques. 3 (2), 177-210 (1986).
- Ferreira, J. L., Matthews-Palmer, T. R., Beeby, M. Electron Cryo-Tomography. Cellular Imaging. , Springer, Cham. 61-94 (2018).
- Colvin, R. A., Jin, Q., Lai, B., Kiedrowski, L. Visualizing metal content and intracellular distribution in primary hippocampal neurons with synchrotron X-ray fluorescence. PLoS One. 11 (7), 0159582(2016).
- Vavpetič, P., et al. Elemental distribution and sample integrity comparison of freeze-dried and frozen-hydrated biological tissue samples with nuclear microprobe. Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms. 348, 147-151 (2015).
- Guerquin-Kern, J. L., Bordat, C. Cryo-preparation procedures for elemental imaging by sims and eftem. Handbook of Cryo-Preparation Methods for Electron Microscopy. , CRC Press. 499-536 (2008).
- Gramaccioni, C., et al. Nanoscale quantification of intracellular element concentration by X-ray fluorescence microscopy combined with X-ray phase contrast nanotomography. Applied Physics Letters. 112 (5), 053701(2018).
- Perrin, L., et al. Zinc and Copper Effects on Stability of Tubulin and Actin Networks in Dendrites and Spines of Hippocampal Neurons. ACS Chemical Neurosciences. 8 (7), 1490-1499 (2017).
- Ortega, R., et al. α-synuclein over-expression induces increased iron accumulation and redistribution in iron-exposed neurons. Molecular Neurobiology. 53 (3), 1925-1934 (2016).
- Fartmann, M., et al. Quantitative imaging of atomic and molecular species in cancer cultures with TOF-SIMS and Laser-SNMS. Applied Surface Sciences. 231 (2), 428-431 (2004).
- Pålsgård, E., Lindh, U., Roomans, G. M. Comparative study of freeze-substitution techniques for X-ray microanalysis of biological tissue. Microscopy Research and Techniques. 28 (3), 254-258 (1994).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved