Method Article
싱크로트론 X선 형광 나노 분석을 위한 실리콘 질화물 멤브레인의 세포 배양 및 저온 준비
요약
여기에 제시된 것은 싱크로트론 극저온 X선 나노프로브를 사용한 X선 형광 이미징 이전에 실리콘 질화물 멤브레인 및 플런지 동결에 대한 세포 배양 프로토콜이다. 실온 나노 분석만 이 제공되면, 동결된 시료는 더욱 동결건조될 수 있다. 이들은 세포내 원소 조성물에 대한 정보를 얻기 위한 중요한 단계이다.
초록
세포 외 수준에서 금속 이온의 분포에 대해서는 거의 알려져 없습니다. 그러나, 그 화학 요소는 필수적인 규제 기능을 가지고 있고 그들의 방해된 항상성각종 질병에 관여합니다. 최첨단 싱크로트론 X선 형광 나노프로브는 2차원(2D) 및 3차원(3D) 금속 의 분포 및 전체 세포 내부의 금속 농도를 해명하는 데 필요한 감도 및 공간 분해능을 제공합니다. 세포 수준. 이것은 세포의 생리병리학에 있는 금속의 역할에 조사의 새로운 흥미진진한 과학적인 필드를 엽니다. 세포 준비는 키와 종종 복잡 한 절차, 특히 기본 분석에 대 한. X 선 형광 기술이 지금 광범위하고 각종 준비 방법이 이용되었더라도, 아주 몇몇 연구 결과는 세포의 원소 내용의 보존을 기껏해야 조사하고, 극저온 준비를 위한 단계적으로 상세한 프로토콜이 없습니다 X선 형광 나노프로브에 대한 부착 세포는 지금까지 출시되었습니다. 이는 동결된 수화 상태에서 세포의 싱크로트론 X선 형광 나노 분석을 가능하게 하는 빠른 저온 광에 대한 단계적 세포 제제를 제공하는 프로토콜에 대한 설명이다. 나노 분석이 실온에서 수행되어야 하는 경우, 냉동 고착 부착 세포 제제를 동결 건조하기 위한 추가 적인 절차가 제공된다. 제안된 프로토콜은 유방암 세포에 있는 유기금속 화합물의 2D 및 3D 세포 내 분포를 공부하기에서, 전작에서 성공적으로 이용되었습니다.
서문
새로 설계된 싱크로트론 X선 형광(SR-XRF) 나노프로브는 완전히 정량적인 방식으로 요소의 세포외 분포를 시각화할 수 있게 합니다. 예를 들어, 이 분석 능력은 오스뮴 기반 복합체2와같은 나노 입자1 또는 유기 금속 분자의 섭취를 조사할 수 있게 하여 강력한 항암 특성을 가진 금속 기반 분자의 세포내 섭취에 대한 통찰력을 제공합니다. 다요소 기술로서 나노프로브를 사용한 SR-XRF3는 인, 황, 칼륨, 칼슘, 철, 구리 및 아연을 포함한 세포내 가장 중요한 원소를 동시에 정량화하고 국소화할 수 있는 방법을 제공합니다. 실제로, 하드 엑스레이의 사용은 라벨이없는 방식으로 전체 냉동 수화 세포를 이미지에 큰 침투 깊이를 제공합니다. 또한, 관심있는 대부분의 요소의 K-에지에 대한 액세스를 제공, X 선 형광은 가장 효율적으로 흥분된다. 극저온 접근법의 사용은 방사선 손상의 감소와 세포 구조 및 원소 분포의 보존의 최적화를 허용합니다.
세포에서 금속을 연구하기 위해 공간적으로 해결된 대부분의 분석 기법은 세포의 매우 얇고 평평한 부분의 생산이 필요한 표면 기술입니다. 이것은 주로 에너지 분산 X 선 분석 (STEM-EDX), 에너지 여과 된 전송 전자 현미경 검사법 (EF-TEM), 및 나노 스케일 이차 이온 질량 분광법 (nanoSIMS)를 가진 스캐닝 전송 전자 현미경 검사법을 포함합니다. 후자는 냉동, 수화 세포 섹션에서 수행 할 수 없으며 저온 분석은 타의 추종을 불허하는 공간 해상도를 가진 전자 현미경 검사법으로 수행 할 수 있지만 원소 감도가 좋지 않습니다. 입자 유도 엑스레이 방출 (PIXE)는 전체 세포에서 원소 분포의 연구를 허용했습니다. 미크론 스케일과 서브미크론 해상도4에서도공정한 원소 감도로 완전히 정량화되는 장점이 있지만, 방사선 손상과 냉동 수화 세포를 연구하는 극저온 능력의 부족으로 고통받고 있습니다. 이 모든 분석 기술은 세포의 원소 화상 진찰에 있는 각각을 보완합니다, 그러나 모든 기술에 대한 견본 준비 절차는 중요한 단계입니다. 의미 있는 결과를 얻기 위해 가능한 오염뿐만 아니라 원소 재분배 및/또는 누출을 제한하기 위해 단순하게 유지해야 합니다. 전자 현미경검사법에서 입증된 바와 같이, 극저온 세포의 극저온 고정화 및 저온 스캐닝 단계로의 극저온전달을 포함하는 극저온 워크플로우는, 원어민 상태5,6,7,8,9,10에가능한 한 가까운 세포 내 수준에서 최적의 원소 보존을 가능하게 한다. 이러한 이해는 2D 또는 3D로 전체 냉동 수화 세포의 초구조 이미징을 생성하기 위해 싱크로트론 저온 연약한 X 선 현미경 검사법 (예 : 전체 필드 현미경 및 스캐닝 현미경)의 개발에 성공적으로 구현되었습니다. 로렌스 버클리 국립 연구소 12, 전자 저장 링 BESSY II (독일)13,ALBA 광원 (스페인) 14의 빔 라인 MISTRAL ,14,빔 라인 B2에서 로렌스 버클리 국립 연구소12의고급 광원의 Beamline 2.1 (XM-2)에서 부드러운 X 선 현미경을 위해11을 개발하였다. 유사한 워크플로우가 최근 X선 마이크로프로브16,17을이용한 세포내 원소 분석을 위한 가장 신뢰할 수 있는 준비 및 보존 방법으로 나타났다.
X 선 나노 프로브 기술은 세포 원소 분석에 널리 사용되기 시작하지만, 특히 극저온 SR-XRF 기능의 출현과 함께, 어떤 단계적 프로토콜은 지금까지 연구 커뮤니티에 보급되지 않았습니다. 여기서, 극저온 조건하에서 분석될 실리콘 질화물 멤브레인상상에 단층으로 배양된 저온 고정 부착 세포를 제조하기 위한 상세한 절차가 제공된다. 실온에서 X선 분석을 수행해야 하는 경우에 대비하여 프로토콜 이후에 적용되는 동결 건조 단계도 제공됩니다. 제안된 프로토콜은 인간 유방암 세포MD-MB-2312와 함께 성공적으로 사용되었지만 동결건조는 마우스 뉴런18,20,21에서다른 사람들 사이에서 입증되었으며, 다양한 유형의 인간 또는 동물 세포로 용이하게 확장될 수 있다.
프로토콜
실험 절차는 CEA의 생명 과학 부서 (CETEA, A14-006)의 동물 관리위원회에 의해 승인되었습니다. 그들은 프랑스 법률과 1986년 11월 24일 (86/609/EEC)의 유럽 공동체 이사회 지침에 따라 실시되었습니다.
1. 실리콘 정염 (Si3N4)멤브레인 지원 제제
참고: 멤브레인은 깨지기 쉽고 섬세하기 때문에 지지대(200 μm 두께의 실리콘 프레임)는 얇은 카본 핀셋 또는 두몬트 핀셋 #5 스트레이트 셀프 클로징 미세 팁으로 부드럽게 처리해야 합니다. 이 프로토콜은 5mm x 5mm 프레임의 프레임과 1.5 mm x 1.5 mm의 멤브레인 크기의 실리콘 염화물 멤브레인을 사용했습니다. 멤브레인은 실험을 시작하기 전에 약 12 시간 (즉, 세포 파종)을 준비해야합니다. 멤브레인은 하루의 끝에 준비하고 다음 날 아침을 사용할 준비가 되도록 클래스 II 층류 후드에서 하룻밤 건조 방치 할 수 있습니다. 200 μm의 실리콘 프레임 두께는 실리콘 정염 창을 판매하는 대부분의 회사에서 표준입니다. 이 프로토콜에 사용된 제품을 사용할 수 없는 경우 0.5-1.5 mm 범위의 멤브레인 크기를 5mm x 5mm의 표준 프레임 크기로 사용할 수 있습니다. 엑스레이 단층 촬영이 사용될 때 더 큰 막 크기가 바람직합니다. 0.5 mm의 멤브레인 크기와 50 nm의 두께를 가진 TEM 그리드 형 질화물 창도 사용할 수 있습니다.
- Si3N4 멤브레인 지지체를 함유하는 캡슐을 엽니다(도1). 부드럽게 캡슐을 짜서 가볍게 지지체를 풀어주세요.
- 얇은 핀셋을 사용하여 실리콘 프레임의 모서리 중 하나를 잡습니다. 중앙에 있는 Si3N4 멤브레인을 만지지 않도록 주의하십시오. 200 또는 500 nm 두께의 멤브레인은 쉽게 손상 될 수 있습니다.
- 얇은 핀셋을 사용하여 Si3N4 멤브레인 지지체를 멸균 유리 페트리 접시에 부드럽게 놓고, 실리콘 일화물 창의 평평한 표면을 위로 향하게 합니다(즉, 접시의 바닥을 향한 공동).
- 페트리 접시의 뚜껑을 제거하고 라미나 흐름 캐비닛 아래에 25-30 분 동안 UV 빛 아래에 멤브레인을 둡니다.
참고: UVC 라이트(254 nm)는 일반적으로 200μW/cm2로설정됩니다. - 멤브레인에 폴리-L-리신 10 μL을 넣습니다. 드롭은 Si3N4 멤브레인을 잘 덮고 실리콘 프레임에 약간 퍼질 수 있습니다. 표준 조직 배양 인큐베이터에서 100% 상대 습도 및 95% 공기, 5%CO2에서37°C에서 25분 동안 방치한다.
참고: 이 경우 MDA-MB-231 유방암 세포에 폴리-L-리신 코팅을 사용하였다. 세포주 유형에 따라 다양한 코팅을 사용할 수 있으며 이 단계에 따라 최적화되어야 합니다. - 멸균 48 웰 플레이트에서 0.22 μm 멸균 필터를 통해 여과된 200-250 μL의 초순수 및 초미량 수로 다른 우물을 채웁니다. 일반적으로 각 웰은 최대 2−3 멤브레인을 헹구는 데 사용할 수 있습니다. 미세 핀셋을 사용하여 실리콘 프레임의 모서리에서 멤브레인 지지체를 픽업합니다. 세 개의 연속 우물에 수직으로 10s를 침수하여 멤브레인을 부드럽게 헹구십시오.
참고 : 멤브레인 지지대는 인큐베이터에서 꺼내어 클래스 II 층류 후드에 의해 정의 된 온도와 습도로 실온에서 처리 할 수 있습니다. - 멸균 된 96 웰 플레이트의 빈 우물에 수직으로 멤브레인 지지체를 넣고 덮고 Class II 층류 후드 에서 하룻밤 건조시키십시오.
2. 셀 시딩
- 멸균 4 웰 플레이트에 평평한 면이 위를 향하여 멤브레인을놓습니다.
- MDA-MB-231 세포는 페놀 레드/글루타맥스 I를 사용하여 DMEM에서 단층 배양으로 유지되며, 5%CO2 공기 가습 인큐베이터에서 37°C에서 10% 태아 송아지 혈청 및 1% 페니실린 및 스트렙토마이신을 보충하였다.
- 세포가 60-70 % 결합에 도달하면 접시 또는 플라스크에서 매체를 제거합니다.
- Ca2+ 또는 Mg2+없이 덜베코의 인산완충 식염수 10ml로 1x를 씻으십시오.
- 0.05% 트립신/EDTA 용액의 3 mL/T75 플라스크를 추가하고 전체 단층이 트립신 용액으로 덮여 있는지 확인합니다.
- 세포가 분리되기 시작할 때까지 37 °C에서 3-5 분 동안 배양하십시오. 주의를 기울여야합니다.
- 8 ml의 DMEM을 10% 태아 송아지 혈청과 1% 페니실린 및 스트렙토마이신 또는 완전한 매체로 보충하고 파이펫팅하여 세포를 수집합니다. 미디어의 혈청은 트립신을 중화시킬 것이다.
- 실온에서 3분 동안 250 x g에서 스핀다운합니다. 상급자 흡인.
- 세포 펠릿을 함유하는 15 ml 튜브에 8 ml의 신선한 완전 매체를 추가하고 세포가 단일 세포 현탁액으로 분산 될 때까지 세포를 위아래로 피펫.
- 혈뇨계를 사용하여 세포를 카운트하고 완전한 매체에서 mL 당 5 x 106 세포의 농도로 희석하십시오 (Phenol Red를 가진 DMEM / 0.85 % NaCl 용액에서 200 mM L-알라닐-L-글루타민 디펩티드의 1 %는 10 % 태아 송아지 혈럼과 1 % 페니실린 및 스테우토마이신으로 보충되었습니다).
- MDA-MB-231 세포 현탁액의 10 μL을 가지고 멤브레인에 증착하십시오. 이는 MDA-MB-231의 경우 50,000개의 셀/10 μL에 해당합니다. 드롭은 Si3N4 멤브레인을 잘 덮고 실리콘 프레임에 약간 퍼질 수 있습니다. 마이크로파이펫 의 끝으로 Si3N4 멤브레인을 만지지 않도록 주의해야 합니다.
참고: 세포주 유형과 실험 또는 측정에 따라 세포 밀도가 다를 수 있으므로 그에 따라 테스트해야 합니다. 여기서, 제안된 Si3N4 멤브레인을 파종하기 위한 제안된 세포 밀도는 MDA-MB-231 세포의 실험 조건 및 추가적인 SR-XRF 나노 분석에 최적을발견하였다. - 해마 뉴런(HN)의 경우, 해마 뇌 조직을 배아일 18.5마리로부터 제거하고 헤페스-HBSS(5.3 mM KCl, 0.44 mMKH2PO4,137.9 mM NaCl, 0.34 mM NaH2PO4,5.56 mMM 17, 5.56 mM17°C17,5.56mM)에서0.25% 트립신으로 소화한다.
- P1000 팁과 P200 팁이 있는 P1000 파이펫을 사용하여 피펫으로 콘 컨텐티를 여러 번 그리고 방출하여 기계적 해리를 수행합니다. 이 단계에서는 기포가 뉴런에 독성이 있기 때문에 배지에 기포가 생성되지 않도록 주의하십시오.
- 골재가 튜브 의 바닥에 정착 될 때까지 몇 분 기다립니다.
- 분산된 세포를 함유하는 상상체를 멸균 된 Eppendorf 튜브로 옮김. 골재를 포함하는 배양 배지의 ~25 μl을 남겨 둡니다.
- 혈세포계를 사용하여 해리 된 세포를 계산합니다. 단리HN 뉴런은 폴리-L-리신(1 mg/mL 폴리-L-리신)-코팅된 질화 실리콘 멤브레인상에 7 x 104 세포cm-2의 농도로 도금된다.
- HN을 가진 막에 대해서만, 10% 태아 소 혈청으로 보충된 첫번째 DMEM에 있는 신경세포를 배양하십시오. DMEM에서 HN을 도금한 후, 배지는 신경기저금재(200 mM L-알라닐-L-글루타민 디펩타이드 0.85% NaCl 용액, 및 B27 보충제 d= 1/50+1/50+19)로 변경된다.
- MDA-MB-231 세포의 경우, 인큐베이터에 멤브레인 지지체를 37°C(상대 습도 100%, 공기 95%,CO25%)를 25분 동안 넣습니다. 이것은 세포가 정착하고 기판에 붙이기 시작하는 것을 허용합니다. 이는 사용된 세포주에 따라 적응될 수 있다.
- 필요한 완전한 배양 배지 1 mL(페놀 레드를 가진 DMEM/200 mM L-알라닐-L-글루타민 디펩타이드의 1%를 0.85% NaCl 용액에 10% 태아로 보충 송아지 혈청 및 1% 페니실린 및 스트렙토마이신)을 MDA-MB-231 세포의 각 웰에서 플라스틱의 벽에 파이펫 팁을 잘 놓고 멤브레인을 덮는 동안 배지를 매우 천천히 방출한다.
- Si3N 4 멤브레인의 웰 캐비티에 갇힌 기포를 빼앗기 위해 4웰 플레이트의 벽에 수직으로 멤브레인을 놓습니다(도2). 이렇게 하려면 미세 핀셋을 사용하여 포어를 매우 부드럽게 밀어 내고 Si3N4 후면 프레임에 평행하게 이동하여 멤브레인을 만지거나 손상시키지 않도록 하십시오.
- 멤브레인을 웰의 바닥에 수평으로 다시 넣고 사용된 세포주의 성장 속도에 따라 필요한 시간 동안 인큐베이터에 4개의 웰 플레이트를 둡니다. MDA-MB-231 세포를 하룻밤 동안 배양하였다.
3. 치료 또는 중간 변화
- 4 웰 플레이트에서 배지를 제거합니다.
- 37°C에서 1mL의 PBS 용액으로 한 번 헹구어 내보소서. PBS를 버리고 1 mL 파이펫 팁을 사용하여 원하는 처리의 존재 또는 부재 중이거나 부재 중에도 1 mL의 완전 신선한 배지를 추가하고, 웰 플레이트의 벽에 액체를 매우 천천히 방출한다. Si3N4 멤브레인은 멤브레인 의 움직임이나 리프팅을 피하기 위해 방해없이 천천히 잠들어 있어야합니다.
4. 플런지 동결에 의한 세포 제제의 냉동 고정
참고 : 필요한 인큐베이션 시간이 끝나면 치료가 있거나 없는 상태에서 세포를 신중하게 헹구고 저온 으로 처리해야합니다. 플런지 동결 전에 셀룰러 준비를 헹구고 얼룩지기 전에 약 30 분, 먼저 자동 플런지 냉동기계를 설정하고 식힙니다. 극저온을 조작할 때 적절한 극저온 장갑, 안전 안경, 밀폐형 신발 및 실험실 코트를 사용해야 합니다. 액체 질소는 적절한 Dewars에서 수송되어야하며, 작업 장소는 산소 모니터의 존재와 함께 충분히 환기되어야한다. 이상적으로, 20-30%의 낮은 습도학 수준은 물질, Dewars 및 극저온의 얼음 오염을 제한하는 데 도움이 되며, 이는 시료의 유리화(즉, 비정질 얼음 층)에 해롭습니다. 이상적으로는 연구원의 경험 수준에 따라 단일 세션에 대해 최대 10-12개의 샘플을 유리화를 위해 동일한 이차 저온 액체 에탄 컵을 사용하여 제조할 수 있습니다. 세션 사이에 자동 플런지 냉동고에는 1시간 자동 베이크아웃 절차가 필요합니다. 이상적으로, 샘플은 동일한 배양 조건으로 처리되어야한다. 여전히, 컨트롤은 먼저 처리 될 수있다, 특정 치료 조건 샘플 뒤에.
참고: 플런지 동결의 경우 다음 단계가 MDA-MB-231 또는 HN 셀에 모두 적용됩니다.
- 세포의 신속한 저온 광속을 위해 저온 플런저를 설정합니다.
- 자동 플런지 냉동고를 켭니다.
- 콘솔 및 파라미터에서 직접 파라미터(예: 온도, 습도, 블로팅 시간, 자동 블로팅이 사용되는 경우 블로팅 시간 및 극저온 용기로의 이송을 용이하게 하기 위해 극저온 용기의 표면으로 샘플을 들어 올리기 위한 위치)를 입력합니다. 설정 메뉴. 본 사례에서, 습도 챔버의 파라미터는 37°C 및 80% 습도로 설정하였다.
참고: 신속하고 신중한 수동 블로팅을 통해 이 프로토콜 및 X선 이미징에 대해 더 나은 유리화 결과를 얻을 수 있었습니다. 따라서 프로토콜은 자동 블로팅 시퀀스 프로그램을 사용하지 않습니다. - 가습기 챔버를 부착하고 습도를 보존하기 위해 먼저 이중 증류수 60mL의 주사기를 사용하여 채운 다음 자동 플런지 냉동고 콘솔에서 요구되는 대로 20 mL를 채웁니다.
참고: 기화기 시스템이 손상될 수 있으므로 초순수를 사용하지 마십시오. 밸브를 닫고 가습기 뒷면에 부착 된 튜브를 둡니다. - 블랙 에탄 컵을 홀더에 넣고 플라스틱 캡으로 덮습니다.
- LN2로차가운 챔버의 Dewar를 채우고 작업 영역 내의 그리드 수준으로 가져 오립니다.
- EM-GP 작업 공간의 전용 위치에 보관된 이송 용기에 cryofixation 후 멤브레인을 보관하고 에탄 컵 홀더에 가까운 전용 저온 상자를 보관하십시오.
참고 : 전용 저온 상자는 그르노블에서 유럽 싱크로트론 방사선의 나노 프로브 빔 라인 ID16A에서 사내 개발이다. 사양이 있는 도면은 요청 시 사용할 수있습니다(그림 3). LN2 Dewar에서 장기 보관을 위해 50 mL 원엽 튜브에 한 번에 4개까지 저장할 수 있습니다. 대안적인 가능성은 돔 캡이 있는 작은 0.2 mL 일반 PCR 얇은 벽튜브를 사용하여 단일 Si3N4 멤브레인 지지체를 저장하는 것으로 구성됩니다. LN 2가 튜브를 채울 수 있도록 가열 된 주사기 바늘을 사용하여 벽 튜브의 상단 부분에 ~ 2mm 구멍을 뚫어야합니다. - 전사 용기를 LN2로 채우고 전용 알루미늄 뚜껑으로 덮습니다. 본체의LN 2 레벨 모니터 디스플레이를 100% 유지하면서 LN2(일반적으로 ~2L필요)로 차가운 챔버를 계속 채웁니다. 최종 필요한 온도에 도달할 때까지 기다립니다.
- 플라스틱 캡을 제거하고 에탄 병에 연결된 액액으로 에탄 컵을 덮습니다. 에탄 컵의 온도가 온도 설정점에 평형될 때까지 기다립니다. 도달하면, 이차 저온원(즉, 액화 에탄)을 사용하기 시작한다.
참고: 사용된 설정점은 -180°C였으며, 에탄 융점(-182.8°C)보다 약간 높았습니다. 에탄 컵의 서리 형성 및 오염의 원인이 될 수 있기 때문에 에탄 액화기를 미리 냉각 할 필요가 없습니다. - 고순도 에탄 병 메인 밸브를 열고 에탄의 느린 안개가 될 때까지 압력 조절기의 매우 천천히 엽니다. 액체 에탄이 쌓일 때까지 이 흐름을 매우 낮게 유지하십시오. 컵을 위쪽 가장자리로 채웁니다. 에탄 병의 압력 조절기와 메인 밸브를 닫습니다. 라이카 액화기를 조심스럽게 제거하고 연기 후드 아래에 작은 폴리스티렌 지지대 위에 놓습니다. 작업 영역과 에탄 용기의 서리 오염을 방지하기 위해 기계와 함께 제공되는 검은 색 폴리스티렌 캡으로 느슨하게 작업 영역을 덮습니다.
- 샘플의 수동 블로팅 직전에, 검은 폴리스티렌 캡을 제거하고 콘솔 프레스의 메뉴에서"낮은 챔버", 이는 극저온 작업 영역과 접촉 환경 챔버를 제공합니다.
- 샘플을 얼룩지도록 준비합니다.
- 배양 배지에서 염의 흔적을 제거하기 위해 적절한 버퍼를 준비합니다. 이 프로토콜의 경우, 암모늄 아세테이트 버퍼는 MDA-MB-231 세포를 헹구는 데 사용되었다.
참고 : 암모늄 아세테이트 버퍼는 대부분의 세포 유형에 적합하며 X 선 형광 신호에 추가되지 않습니다 (Z > 9가있는 요소를 고려). 신경 세포와 같은 몇몇 특정 세포주는 전용 완충제의 사용을 요구할 수 있다. 예를 들어, 1차 피질 뉴런의 경우, 0.5 MNa2HPO4 및 0.5 M NaH 2 PO4의 1.8 부피로 구성된 식염수용액을15로사용할 수 있다. 한편, 완충액에 함유된 인 또는 염소는 XRF 스펙트럼에 기여할 것이다. 가짜 X 선 방출 라인의 이러한 제한은 감지 할 관심 요소에 따라 염두에 두어야합니다. - 암모늄 아세테이트 초순수 용액에서 150 mM 암모늄 아세테이트 용액을 준비하고 pH (7.0-7.3) 및 삼투압 (270-300 mOsm / kg)을 확인하십시오.
참고: 위에서 언급한 삼투압은 칼슘과 마그네슘이 없는 덜베코의 인산 완충액(D-PBS)과 동일하며 미세 삼투계를 사용하여 확인할 수 있습니다. - 암모늄 아세테이트 버퍼로 12 개의 웰 플라스틱 플레이트에서 필요한 수의 우물을 채웁니다.
- 프리컷 구멍이 있는 No.1 필터 용지또는 직경 55mm의 수동으로 펀칭된 필터 용지에서 15mm 중앙 구멍이 있는 필터 용지를 블로팅하기 위해 필터 용지를 잘라냅니다.
- 멤브레인을 헹구고 플런지하기 전에 마지막 순간에 37 °C에서 인큐베이터에 저장된 필요한 샘플을 꺼낸다.
- 퀵 릴리즈 집게의 블랙 클램프 링(일반적으로 Dumont 클램핑 링 고정밀 의료 핀셋)을 사용하여 핀셋을 잠금 해제하고 배양으로부터 Si3N4 멤브레인 지지체를 잘 잡습니다.
참고: 실리콘 프레임의 중간을 잡고 핀셋 끝을 멤브레인 근처에 유지합니다. 검은 색 클램프 링을 첫 번째 줄무늬로 이동하여 핀셋을 잠급전시. - Si3N4 멤브레인 지지체를 ~5s에 대해 37°C에서 보관된 암모늄 아세테이트 완충액에 수직으로 담그다.
참고: 지원은 버퍼에서 수직으로 유지되어야 합니다. 플레이트의 각 웰의 완충액은 동일한 배양 조건에 대해 최대 3개의 멤브레인에 사용될 수 있습니다. - 필터 페이퍼와 함께 수동으로 블롯하여 세포를 덮는 암모늄 아세테이트 수성 용액의 얇고 균일한 층을 남기기 위해 멤브레인 헹구 용액으로부터 과잉 완충액을 배출한다(도4).
참고: 이렇게 하려면 먼저 창 의 뒷면을 필터 용지에 눌러 멤브레인의 우물과 뒷면에 남아 있는 거의 모든 수성 버퍼를 제거합니다. 둘째, 핀셋의 양쪽에서 시작하여 프레임의 각 면을 시작하여 전면을 블롯합니다(그림4). 멤브레인을 만지지 마십시오. 배수 된 버퍼의 과잉은 필터 종이에 형성 된 아우레올로 모니터링 할 수 있습니다. - 환경 챔버 도어를 열고 핀셋을 빠르게 장착하고 집게 인터록에 밀어 넣고 문을 닫습니다(그림 5).
- 프레스 "블롯 /A 플런지". Si3N4 멤브레인을 보유한 핀셋은 신속하게 저온으로 급락할 것이다.
- 미리 냉각된 집게로 전사 용기의 뚜껑을 제거합니다.
- "전송"을누릅니다. Si3N4 멤브레인은 극저온 위로 약간 이동됩니다.
- 하나의 빠른 움직임에서, 집안인터록에서 핀셋을 밀어 내고 인터록에서 약간 기울어LN2로채워진 전사 용기에 있는 저온 상자의 빈 슬롯으로 직접 가져온다. 멤브레인을 해제하기 위해 검은 색 클램프 링을 놓습니다(그림 5).
참고: 전송 컨테이너는 항상 LN2로덮여 있어야 합니다. 리필이 필요한 경우 LN2와 에탄을 혼합하지 않도록 기계와 함께 제공된 플라스틱 뚜껑으로 에탄 컵을 덮습니다. - 전사 용기를 뚜껑으로 덮고 LN2로 채워진 작은 흰색 폴리스티렌 컵을 사용하여 LN2로채워진 폴리스티렌 상자로 옮김을 옮김을 사용하십시오.
참고: 멤브레인을 함유하는 저온 박스 또는 튜브는 LN2로 채워진 50 mL 원엽 튜브에 저장되고 장기 보관 LN2 Dewar로 이송될 수 있습니다. 다음 시료를 동결하기 시작하기 전에 얼음 결정에 오염되지 않도록 헤어 드라이어 또는 핫 플레이트/냉동 도구 건조기(45°C)로 차갑고 서리가 내린 핀셋을 모두 데우십시오.
- 배양 배지에서 염의 흔적을 제거하기 위해 적절한 버퍼를 준비합니다. 이 프로토콜의 경우, 암모늄 아세테이트 버퍼는 MDA-MB-231 세포를 헹구는 데 사용되었다.
5. 실리콘 염화물 멤브레인에 배양 된 플런지 냉동 세포의 동결 건조
참고: 동결 건조의 경우 MDA-MB-231 및 HN 셀 모두에 다음 단계가 적용됩니다. 동결 건조기를 냉각하려면 약 40 분에서 1 시간까지 기다려야합니다.
- 냉동 건조기 설정
- 기기 의 후면 패널에 있는 로커 스위치로 전원을 켭타.
- LCD 메뉴 다음의 매개 변수 입력을 시작합니다: 세그먼트 1 = 2 시간 -120 °C에서; 세그먼트 2 = -120 °C에서 -80 °C까지 2 h 램프; 세그먼트 3 = -80 °C에서 2 시간; 세그먼트 4 = -80 °C에서 50 °C까지 2 h 램프; 세그먼트 5 = -50 °C에서 2 시간; 세그먼트 6 = -50 °C에서 30 °C까지 6 h 램프.
- 매개 변수 설정의 끝에서, 설정을 저장 챔버 뚜껑을 닫고"START"를 누릅니다.
- 이 장치는 1.10-5 mbar까지 펌프합니다. 이 압력에 도달하면 디스플레이의 명령줄에"지금 냉각 시작, 시작 "이 계속됩니다.
- 액체 질소 Dewar를 정기적으로 채우고 온도 삼중 포인트 설정 아래의 단계를 식힙니다.
참고 : 스테이지 트리플 포인트 온도는 -140 °C로 설정됩니다. 이 프로토콜에 대한 샘플을 로딩하기 전에 약 1시간 및 -160°C의 온도 단계를 기다리는 것이 가장 좋습니다. - "로드샘플"에준비가 되면 디스플레이에 "ENTER"을 누릅니다.
- LN2 충전 폴리스티렌 Dewar, 공급 업체에서 제공하는 샘플 전달 홀더 및 두 개의 추가 황동 원통형 Si3N4 멤브레인 홀더 내에서 액체 질소 온도로 냉각.
- Si3N4 멤브레인 황동 홀더를 폴리스티렌 드와르(그림6A)에서공급업체가 제공한 샘플 이송 홀더 위에 장착합니다. LN2의 레벨을 첫 번째 황동 조각의 상단 가장자리 보다 약 1-2mm 아래에 유지합니다.
- 이녹스 또는 테프론 코팅된 미리 냉각된 자가 닫는 핀셋을 사용하여 저온 상자 또는 PCR 튜브에서 Si3N4 멤브레인 샘플 지지체를 픽업합니다.
- 셀 샘플 측이 황동 홀더 번호가 매겨진 캐비티에서 위로 향하여 멤브레인을 증착합니다.
- 두 번째 황동 조각으로 어셈블리를 뚜껑으로 덮습니다(그림6C).
참고: 두께 5mm, 직경 50mm, 중앙 11mm 직경 구멍을 가진 두 개의 황동 디스크를 각각 설계했습니다. 첫 번째 황동 디스크에는 지지대(5mm x 5mm)를 수용할 수 있는 14개의 가공직사각형(8mm x 6mm) 위치가 있습니다. 각 슬롯은 2mm의 깊이로 평평하고 잘 연마되어 있습니다. 두 번째 황동 디스크는 Si3N4 멤브레인 황동 지지체를 커버하기 위해 평평하며 콜드 트랩 인클로저역할을 합니다. - LN2 충전 폴리스티렌 폼 박스의 전사 막대를 예용하고 전체 어셈블리에 고정하는 데 사용합니다(그림 6D,E).
- 동결 건조기의 전면 패널에"ENTER"을누릅니다.
- 터보 및 로터리 펌프가 멈추고 챔버가 건조 질소 가스로 제거되어 챔버뚜껑을 열 수 있습니다.
- 스프링 이드 드워드 로드로드로 시료 이송 어셈블리를 즉시 동결 건조기 챔버로 이송하고 구리 LN2 냉면에 끼워 넣습니다.
참고: 전사 로드가 있는 전체 어셈블리를 챔버에 둡니다. - 동결 건조기 챔버의 뚜껑을 즉시 닫고"START"를눌러 동결 건조 주기를 계속합니다.
- 냉동 건조기의 LN2 저장소를 2시간마다 수동으로 채웁니다.
참고: 자동 LN2 충전 시스템이 이 저장소에 연결될 수 있습니다. - 동결 건조 주기가 끝나면 "STOP"를 눌러 챔버를 배출하고 전체 어셈블리를 제거하여 동결 건조 샘플에 액세스합니다.
결과
폴리-L-리신 코팅 Si3N4 멤브레인 지지체 에 서브 배양된 동결 수화 MDA-MB-231 세포의 전형적인 광학 비디오 현미경 뷰는 도 7A에도시되어 있다. 진공 챔버 내의 시료의 광학 뷰는 ESRF22의ID16A 빔라인의 전용 온라인 비디오 현미경을 사용하여 반사 모드에서 수득하였다. 전자 또는 연약한 X선 현미경 검사법은 세포를 가능한 한 얇게 삽입하는 얼음 층(일반적으로 <0.5 μm)을 필요로 하지만, 하드 X선(>10 keV)은 훨씬 더 높은 침투 깊이와 낮은 용량의 증착이라는 장점이 있습니다. 얼음 두께는 따라서 셀을 포함하는 전형적으로 <10 μm더 클 수 있으므로 세포를 포함하는 얼음은 두께가 몇 μm입니다. 이는 500 nm 두께의 Si3N4 멤브레인의 흡수를 고려하여 시료없이 강도에 비해 전송에서 측정된 X선 강도를 통해 추정될 수 있다. 이러한 얼음 두께는 본 프로토콜에 기재된 바와 같이 수동 블로팅을 통해 달성될 수 있다. 뉴턴 링 영역에서 얼음 두께는 더 얇을 수 있습니다(측정되지 않음).
동결된 수화 세포의 X선 형광 원소 매핑은 칼륨(K), 황(S) 및 아연(Zn)과 같은 생리학적 원소의 대표적인 분포와 함께 도 7B에 도시되어 있다. 이러한 맵은 원소 아레알 질량(즉, 원소 투영 질량)을 나타냅니다. 본 사례에서 수행되지 않는 동안, 이러한 맵은 시료 투영 질량23의추정을 제공하는 X선 전파 기반 위상 대비 이미징을 통해 정규화될 수 있다. 많은 연구에 의해 보고된 바와 같이, 그들의 근거체 상태로 보존된 세포에서 고도로 확산성이 높은 K 이온은 전체 세포23,24,16에걸쳐 균질하게 분포되는 것으로 가정되었다. 도 7B의2D X선 형광 원소 이미지에 도시된 바와 같이, 단단히 결합된 요소 S는 K와 유사하게 세포 내에서 고르게 분포되었고, 세포 질량 프로파일의 양호한 추정치를 나타낸다. Zn 분포는 시토졸에서 보다 핵에서 더 높은 신호를 가졌고 명확하게 핵을 설명했다. 핵 영역의 공간 해상도(50nm)에서 작은 Zn 농축 영역을 감지할 수 있다는 점에 유의할 수 있습니다.
기존의 X선 나노프로브 또는 구축될 나노프로브가 반드시 극저온 기능을 수용할 필요는 없다. 이 경우, 서브-100 nm 공간 분해능에서 세포의 X선 형광 이미지를 얻는 가장 좋은 대안은 세포의 플런지 동결 후 이 프로토콜에 기재된 동결 건조 절차를 수행하는 것이다. 도 8A는 Si3N4 멤브레인 상에서 직접 배양된 결과동결건조 원발성 마우스 해마 뉴런의 전형적인 밝은 필드 현미경 도를 나타낸다. 이 경우, 깨끗한 건조 챔버에 저장하는 경우, 샘플은 사전에 1-2 주 제조 될 수 있으며 관심 영역의 등록을위한 일반 직립 광학 현미경으로 관찰 될 수있다. 동결 건조 된 샘플에 의해 포착 될 수 있으며 X 선 나노 빔 하에서 손상을 초래할 수 있으므로 주변 습도에 대한 노출을 방지하기 위해주의를 기울여야합니다. 이 절차는 매우 민감한 세포 (즉, 신경 세포)에 성공적으로 적용되었으며 암세포와 같은 다른 보다 강력한 유형의 세포로 더 나은 결과를 얻었습니다. 플런지 동결 된 세포에 관해서는, 전체 동결 건조 세포 디스플레이에 K, S 및 Zn의 X 선 형광 이미지는 위에서 설명한 것과 유사하다. 이들은 50-100 nm 공간 해상도에서 다양한 유형의 동결 건조 세포에서 발견되는 원소 분포를 대표한다. 동결 건조 전체 세포는 원소 무결성을 보존하는 대안이지만, 세포 형태(16)특히 세포막의 완벽한 보존을 희생한다.

그림 1: X선 형광 나노 분석을 위한 일반적인 샘플 지원. Si3N4 멤브레인은 보호 캡슐에 지지합니다. 이러한 유형의 기판은 실온 분석(저온 및 저진공 동결 건조 공정에 이어 플런지 동결 셀룰러 준비) 또는 극저온 X선 형광 분석에 모두 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
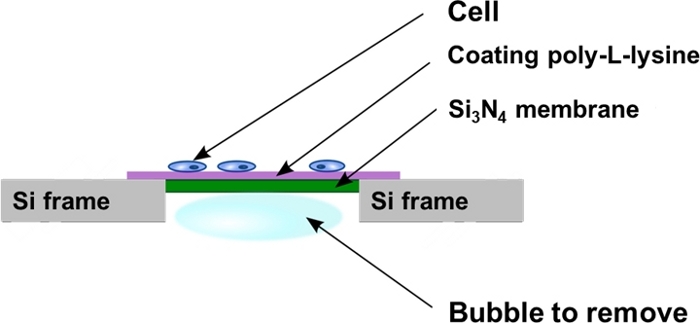
그림 2: 셀 파종 후 실리콘 종화물 윈도우의 개략적 보기. 세포는 Si3N4 멤브레인 지지체의 폴리-L-리신 코팅 된 평평한 표면에 직접 배양된다. 때때로 기포는 Si3N4 멤브레인 지지체의 후면 캐비티에 포획될 수 있으며 프로토콜에 기재된 바와 같이 제거되어야 한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 액체 질소 Dewar에서 플런지 냉동 Si3N4 멤브레인 지지체의 장기 보관을 위해 자체 개발한 3D 프린팅 저온 상자. (A)냉동 상자는 용기와 캡 (하부 부분)과(B)냉동 캡이있는 냉동 상자로 분해됩니다. 캡은 핀셋으로 조작할 수 있으며 회전에 의해 열리거나 잠글 수 있습니다. ESRF ID16A의 요청시 3D 프린팅에 대한 자세한 계획을 세우실 수 있습니다. 이 설계는 실리콘 염화물 TEM 그리드를 수용할 수 있도록 만들어졌습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 4: Si3N4에서 배양된 세포의 블로팅. Si3N4 멤브레인상에 배양된 세포 단층을 급락-동결시키기 전에 암모늄 아세테이트 용액(A)으로 헹구고 필터 페이퍼(B)를 사용하여 신중하게 수동으로 블로틴화해야 한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 자동 플런지 동결 EM-GP 기계. (A)자동 플런지 냉동고. (B)핀셋이 잠겨있는 환경 챔버(C)에탄 컵은 에탄 병에 연결된 라이카 액화로 덮여 있습니다. (D)유리화된 Si3N4 멤브레인의 LN2에 추가 저장을 위해 액화 에탄 및 저온 상자로 가득 찬 블랙 컵을 보여주는 플런지 동결 인클로저. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 동결 건조 절차를 위한 시료 저온 전달 어셈블리. (A)Si3N4 멤브레인의 첫 번째 황동 수신자는 동결 건조기 공급 업체가 제공하는 샘플 이송 홀더 위에 장착됩니다. (B)및(C)제2 플랫 브라스 디스크가 커버로 사용되고 동결 건조기의 진공 인클로저에 삽입되는 콜드 트랩 인클로저로서 작용한다는 것을 보여준다. (D)스프링 이재형 전사봉이 있는 전체 어셈블리. (e)Si3N4 멤브레인에서 성장된 유리화된 세포 전제가 운반되는 샘플 홀더는 LN2-냉각동결 건조기에 추가로 삽입되어야 한다. 어셈블리를 장착하기 위한 모든 단계는 스티로폼 상자에 LN2로 이루어집니다. 명확성을 위해 모든 이미지는 LN2가없는 상태에서 제작되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 하드 X선 나노프로브를 사용하여 냉동 수화 된 세포의 저온 X 선 형광 이미지. (A)ESRF ID16A 빔라인의 전용 광학 비디오 현미경을 사용하여 리플렉션 모드에서 일반적인 온라인 보기. 수동 블로팅 후, 약 5-10 μm의 총 얼음 두께가 달성되어 냉동 수화 된 세포를 명확하게 볼 수 있습니다. 뉴턴 링이 있는 지역은 훨씬 더 얇은 얼음을 가리키는 것이 눈에 띈다. (B)대표적인 저온-X선 형광 세포 분포의 생리적 원소 칼륨(K), 황(S), 및 아연(Zn). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
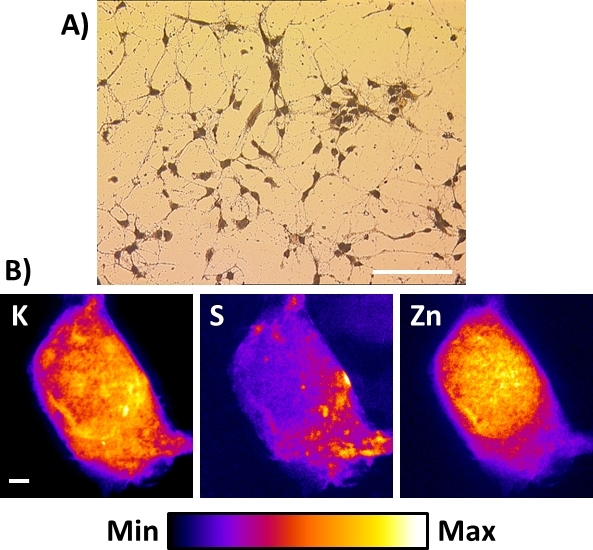
그림 8: 하드 X선 나노프로브를 사용하여 동결건조된 뉴런 세포의 X선 형광 이미지. (a)Si3N4 멤브레인상에 직접 배양된 결과동결건조 1차 피질 뉴런 세포의 전형적인 밝은 필드 현미경 보기. 스케일 바 = 200 μm(B)대표적인 실온 X선 형광 이미지는 생리학적 원소 칼륨(K), 황(S) 및 아연(Zn)의 분포를 나타내는 단일 동결 건조 해마 뉴런이다. 배율 표시줄 = 2 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
저온전자 현미경(cryo-EM)은 2017년 노벨 화학상을 수상했으며, 이에 따라 용액25에서생체분자의 고분해능 구조 판정을 위한 생물학적 물질의 유리화에 대한 J. Dubochet의 개발이 이루어졌습니다. 그의 노벨 강의에서 Dubochet에 의해보고 된 바와 같이 "물 방울을 vitrify하는 방법을 아는 것은 한 가지, 생물학적 관찰을위한 생물학적 샘플을 준비하는 것은 또 다른 것입니다"25. 냉동 준비 단계는 이제 방사선 선량 손상을 완화하고 자신의 모국에 가까운 세포를 연구하는 표준 기술로 간주됩니다. 그러나 준비는 지루한 남아 있습니다. 이것은 전자 현미경 검사법, 그것의 타의 추종을 불허하는 공간 해결책 때문에, 견본 준비 도중 생기는 어떤 초구조적인 유물든지에 민감하기 때문입니다. 싱크로트론 cryonanoprobes는 지금 고에너지 엑스레이 범위26에있는 13 nm의 낮은 공간 해상도로 내려가는 유사한 어려움에 접근하고 있습니다. 단단한 엑스레이 현미경 검사법은 전자 현미경 검사법은 아주 얇은 세포 조각을 관찰할 수 있게 하는 전자의 가난한 침투 깊이 때문에 손해를 입는 동안 전체 세포를 분석할 수 있습니다.
세포의 단층은 충분히 얇아서 액체 에탄의 급락 동결에 의해 물 유리화에 필요한 냉각 속도를 얻을 수 있습니다. 이론적으로, 108 K/s의 높은 냉각 속도는 급락 동결에 너무 두꺼운 시편의 유리화를 허용하는 고압 동결27을 사용하여 가능합니다. 주변 압력28에서시료의 완전한 유리화를 허용하는 데 필요한 105 K/s의 냉각 속도는 여기에 제시된 자동 플런지 동결 기계 및 파라미터를 사용하여 재현가능하게 도달합니다. 이것은 연구원이 액체 에탄에 있는 급락 동결에 의하여 세포의 단층12,13,14,15,29,30와 같은 얇은 생물학 견본 (<10 μm)를 vitrify할 수 있습니다.
이 프로토콜의 중요한 과제는 세포 내 의 화학적 무결성을 가능한 한 많이 보존하여 세포 내의 신뢰할 수 있는 원소 분포를 2D 또는 3D로 제공하는 것입니다. 다른 곳에서 발표 된 바와 같이2,16,17,31, 세포 내 수준에서 원소 이미징의 경우 냉동 수화 세포의 분석을 고려해야합니다. 그렇지 않으면, 셀의 플런지 동결 및 동결 건조의 조합은 실온 분석에 사용될 수있다. 후자의 경우, 비정질 얼음은 승화 과정을 통해 제거되고 결합 된 물 분자는 탈착 과정을 통해 제거됩니다. 이러한 과정은 세포막의 가능한 변경 및 일부세포구조(32)의형태로 인해 동결된 수화 샘플에 비해 이상적이지 않을 수 있다. 또한, 견본 연구의 경우, 물 추출은 금속 표본 유물로 이어질 수 있습니다. 여전히, 그것은 성공하고 하위 100 nm 수준2,16,17,18,20,33,34,35,36에서원소 이미징을위한 냉동 수화 샘플에 대한 최선의 대안이었다.
37로보고된 바와 같이, 저온 보존 된 세포 제제의 품질은 칼륨 대 나트륨 K / Na 비율을 통해 평가 될 수 있습니다. 불행히도, 요소의 X 선 형광 광자를 검출하는 데 사용되는 실리콘 드리프트 검출기의 낮은 에너지 차단으로 인해 여기에서 사용되는 하드 X 선 나노 프로브로 아직 결정될 수 없습니다 (E ≥ 1.3 keV 마그네슘). 실제로, TOF-SIMS, EPMA, 또는 핵 마이크로프로브 PIXE16을사용하여 측정할 수 있는 높은 K/Na 비율(>10)은 살아있는 셀(37)에서예상되는 K/Na(25)와 비교하여 세포의 보존된 화학적 무결성을 나타낸다. 이것은 수반되는 낮은 Cl/K 비율38에의해 지원될 수 있습니다. 여전히, 불완전한 유리화, 특히 시료 냉각 속도가 너무 낮은 경우, 세포막과 세포기관을 손상시킬 수있는 큰 얼음 결정의 형성으로 이어질 수 있습니다, 결과적으로 화학 원소의 분포를 변경. 이러한 잠재적인 손상과 세포내 분포에 미치는 영향을 모니터링하는 일상적인 절차는 없지만, 위의 원소 비율과 X선 위상 대비 또는 극저온 연약한 X선 현미경을 사용하여 고해상도로 세포를 이미지화할 수 있는 가능성은 원소 무결성의 수반되는 보존과 함께 세포내 구획의 양호한 보존을 지원하는 가장 좋은 방법이 될 수 있습니다. 이러한 기술의 조합과 새로 개발 된 극저온 형광 광학 현미경의 사용은이 손상이 발생하고 세포 내 원소 분포에 영향을 미치는 정도를 평가하는 데 도움이됩니다.
전반적으로, 싱크로트론 X선 형광 나노 분석을 위한 세포 샘플을 준비하는 상세하고 포괄적인 프로토콜이 제시된다. 그것은 연구 사회를 위한 좋은 출발점, (cryo) 하드 X 선 나노 프로브에서 2D 및 3D 원소 이미징에 대 한 적절 한 세포 샘플을 준비 하는 방법의 어려운 문제를 해결 하는 데 도움이. 이러한 접근법은 세포의 심층적인 상관 관계 화학 및 구조 이미징을 위해 광학 형광 및 전자 현미경 기능과 병합될 수 있습니다.
공개
저자는 이해관계의 충돌이 없습니다.
감사의 말
나노 이미징 빔라인 ID16A에 대한 실험은 ESRF 제안 LS2430, LS2303, 및 LS2765의 프레임에서 수행되었다.
자료
| Name | Company | Catalog Number | Comments |
| Ammonium Acetate solution, BioUltra, for molecular biology, ~5M in H2O | SIGMA | 09691-250mL | One can prepare the required solution from high-grade ammonium acetate powder and ultrapure water, pH and osmolarity needs to be adjusted anyway. |
| B27 supplement, 50x | Life Technologies, Invitrogen | 17504-044 | for hippocampal neuron culture |
| Dulbecco’s Phosphate Buffered Saline, DPBS, ([-] CaCl2, [-] MgCl2) | GIBCO | 14190-094 | cell culture |
| DMEM with Phenol Red/Glutamax I (Medium ATCC modification) | GIBCO | 21885025 | cell culture |
| Dulbecco’s modified Eagle medium (DMEM) | Life Technologies, Invitrogen | 31966-02 | for hippocampal neuron culture |
| Dumont Tweezers #5, Straight Self-closing, 0.05x0.01mm Tips, Biology | World Precision Instrument | 501202 | |
| Emitech K750X Peltier-Cooled EM Freeze Dryer | Quorum Technology | EK3147 | |
| Ethane N45 | Air Liquid | p0505s05r0a001 | C2H6 > 99,995 % |
| Fetal Bovine Serum, Performance Plus, certified One Shot format, US origin | GIBCO | A31604-02 | cell culture |
| HBSS 10x | Life Technologies, Invitrogen | 14185-052 | for hippocampal neuron culture |
| Leica GP quick-release forceps | Leica | 16706435 | |
| MDA-MB-231 cell line, an epithelial, human adenocarcinoma breast cancer cell | ATCC | ATCC HTB-26 | cell culture |
| Neurobasal medium | Life Technologies, Invitrogen | 21103-049 | for hippocampal neuron culture |
| Nunc 4-Well Plate | Thermo Fisher | 176740 | cell culture |
| Osmo1 Single-Sample Micro-Osmometer | Advanced Instruments | Osmo1 | Alternative can be found at Fisher scientific (Wescor Inc. VAPRO® Vapor Pressure Osmometer) |
| Penicillin-Streptomycin | SIGMA | P4333 | cell culture |
| poly-L-lysine | SIGMA | P4707 | Other type of coating can be used that is dependent of the cell type to be cultured on the membrane, other adhesion factors such as fibronectin, collagen, polyornithine can be tested accordingly. Cell can be cultured directly on silicon nitride membrane, but the latter are slightly hydrophobic and adhesion factors are recommended unless the membrane are processed to be hydrophilic (glow plasma discharged). |
| Plunge freezing robot Leica EM GP main unit | Leica | 16706401 | Alternative for automated plunger are the Vitrobot Mark IV (FEI), CryoPlunge 3 (Gatan), MS-002 Rapid Immersion Freezer (EMS). Manual home-made system can be used but an environment-controlled chamber is an asset for plunge-freezing. |
| Silicon nitride membrane (Si3N4) | Silson Ltd. | SiRN-5.0(o)-200-1.5-500-NoHCl | The proposed silicon nitride membrane type is optimised for analysis at ID16A ESRF X-ray nanoprobe, The 500 nm thickness of the membrane was chosen being more robust for cellular manipulation and cryofixation detailed within this protocol. Membrane with thickness of 200 nm or below can also be used although quite fragile, and other design of silicon nitride membrane can be purchased (for example TEM compatible membrane...) from Sislon or other company such as Norcada, SPI supplies, Ted Pella, EMS, LabTech, Neyco... |
| Trypan blue solution 0.4% | GIBCO | 15250061 | cell culture |
| Trypsin-EDTA, 0.05% | GIBCO | 25300-054 | cell culture |
| Ultratrace Elemental Analysis Grade, Ultrapure Water | Fisher Chemicals | W9-1 | MilliQ water can be used but has to be tested for trace element level of contamination using for example ICP-MS analysis. |
| Whatman No. 1 filter paper with precut hole | Leica | 16706440 | Alternative filter paper may be used and must have an outer diameter of 55 mm, the Punch for filter paper system from Leica (ref.16706443) can be used. |
참고문헌
- Lewis, D. J., et al. Intracellular synchrotron nanoimaging and DNA damage/genotoxicity screening of novel lanthanide-coated nanovectors. Nanomedicine. 5 (10), 1547-1557 (2010).
- Fus, F., et al. The intracellular localization of osmocenyl-tamoxifen derivatives in hormone-independent breast cancer cells revealed by 2D and 3D nano X-ray fluorescence imaging. Angwendte Chemie. , (2019).
- Janssens, K., Adams, F., Rindby, A. Microscopic X-Ray Fluorescence Analysis. , Wiley. Chichester, UK. (2000).
- Carmona, A., et al. Uranium exposure of human dopaminergic cells results in low cytotoxicity, accumulation within sub-cytoplasmic regions, and down regulation of MAO-B. Neurotoxicology. 68, 177-188 (2018).
- Leapman, R. D., Hunt, J. A., Buchanan, R. A., Andrews, S. B. Measurement of low calcium concentrations in cryosectioned cells by parallel-EELS mapping. Ultramicroscopy. 49 (1-4), 225-234 (1993).
- Saubermann, A. J., Echlin, P., Peters, P. D., Beeuwkes, R. Application of scanning electron microscopy to X-ray analysis of frozen hydrated sections. I. Specimen handling techniques. Journal of Cell Biology. 88 (2), 257-267 (1981).
- Saubermann, A. J., Heyman, R. V. Quantitative digital X-ray imaging using frozen hydrated and frozen dried tissue sections. Journal of Microscopy. 146, Pt2 169-182 (1987).
- Wroblewski, J., Roomans, G. M. X-ray microanalysis of single and cultured cells. Scanning Electron Microscopy. , Pt 4 1875-1882 (1984).
- Wroblewski, J., Müller, R. M., Wroblewski, R., Roomans, G. M. Quantitative X-ray microanalysis of semi-thick cryosections. Histochemistry. 77 (4), 447-463 (1983).
- Zierold, K. Cryopreparation of mammalian tissue for X-ray microanalysis in STEM. Journal of Microscopy. 125, Pt2 149-156 (1982).
- Harkiolaki, M., et al. Cryo-soft X-ray tomography: Using soft X-rays to explore the ultrastructure of whole cells. Emerging Topics in Life Sciences. 2 (1), 81-92 (2018).
- McDermott, G., Le Gros, M. A., Knoechel, C. G., Uchida, M., Larabell, C. A. Soft X-ray tomography and cryogenic light microscopy: the cool combination in cellular imaging. Trends in Cell Biology. 19 (11), 587-595 (2009).
- Schneider, G., et al. Three-dimensional cellular ultrastructure resolved by X-ray microscopy. Nature Methods. 7 (12), 985-987 (2010).
- Sorrentino, A., et al. MISTRAL: a transmission soft X-ray microscopy beamline for cryo nano-tomography of biological samples and magnetic domains imaging. Journal of Synchrotron Radiation. 22 (4), 1112-1117 (2015).
- Carzaniga, R., Domart, M. C., Duke, E., Collinson, L. M. Correlative cryo-fluorescence and cryo-soft X-ray tomography of adherent cells at European synchrotrons. Methods in Cell Biology. 124, Academic Press. 151-175 (2014).
- Perrin, L., Carmona, A., Roudeau, S., Ortega, R. Evaluation of sample preparation methods for single cell quantitative elemental imaging using proton or synchrotron radiation focused beams. Journal of Analytical Atomic Spectrometry. 30 (12), 2525-2532 (2015).
- Jin, Q., et al. Preserving elemental content in adherent mammalian cells for analysis by synchrotron-based x-ray fluorescence microscopy. Journal of Microscopy. 265 (1), 81-93 (2017).
- Daoust, A., et al. Impact of manganese on primary hippocampal neurons from rodents. Hippocampus. 24 (5), 598-610 (2014).
- Daoust, A., et al. Manganese Cytotoxicity Assay on Hippocampal Neuronal Cell Culture. Bio-protocol. 5 (1), 1368(2015).
- Gibon, J., et al. The over-expression of TRPC6 channels in HEK-293 cells favours the intracellular accumulation of zinc. Biochimica et Biophysica Acta (BBA)-Biomembranes. 1808 (12), 2807-2818 (2011).
- Hasna, J., Bohic, S., Lemoine, S., Blugeon, C., Bouron, A. Zinc Uptake and Storage During the Formation of the Cerebral Cortex in Mice. Molecular Neurobiology. , 1-13 (2019).
- Villar, F., et al. Nanopositioning for the ESRF ID16A Nano-Imaging Beamline. Synchrotron Radiation News. 31 (5), 9-14 (2018).
- Kosior, E., et al. Combined use of hard X-ray phase contrast imaging and X-ray fluorescence microscopy for subcellular metal quantification. Journal of Structural Biology. 177 (2), 239-247 (2012).
- Bohic, S., et al. Synchrotron hard X-ray microprobe: fluorescence imaging of single cells. Applied Physics Letters. 78, 3544-3546 (2001).
- Dubochet, J. On the Development of Electron Cryo-Microscopy (Nobel Lecture). Angwendte Chemie. 57 (34), 10842-10846 (2018).
- Da Silva, J. C., et al. Efficient concentration of high-energy X-rays for diffraction-limited imaging resolution. Optica. 4 (5), 492-495 (2017).
- Studer, D., Humbel, B. M., Chiquet, M. Electron microscopy of high-pressure frozen samples: bridging the gap between cellular ultrastructure and atomic resolution. Histochemistry and Cell Biology. 130 (5), 877-889 (2008).
- Moor, H. Theory and pratice of high pressure freezing. Cryotechniques in Biological Electron Microscopy. Steinbrecht, R. A., Zierold, K. , Springer. 175-191 (1987).
- Gilkey, J. C., Staehelin, L. A. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. Journal of Electron Microscopy Techniques. 3 (2), 177-210 (1986).
- Ferreira, J. L., Matthews-Palmer, T. R., Beeby, M. Electron Cryo-Tomography. Cellular Imaging. , Springer, Cham. 61-94 (2018).
- Colvin, R. A., Jin, Q., Lai, B., Kiedrowski, L. Visualizing metal content and intracellular distribution in primary hippocampal neurons with synchrotron X-ray fluorescence. PLoS One. 11 (7), 0159582(2016).
- Vavpetič, P., et al. Elemental distribution and sample integrity comparison of freeze-dried and frozen-hydrated biological tissue samples with nuclear microprobe. Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms. 348, 147-151 (2015).
- Guerquin-Kern, J. L., Bordat, C. Cryo-preparation procedures for elemental imaging by sims and eftem. Handbook of Cryo-Preparation Methods for Electron Microscopy. , CRC Press. 499-536 (2008).
- Gramaccioni, C., et al. Nanoscale quantification of intracellular element concentration by X-ray fluorescence microscopy combined with X-ray phase contrast nanotomography. Applied Physics Letters. 112 (5), 053701(2018).
- Perrin, L., et al. Zinc and Copper Effects on Stability of Tubulin and Actin Networks in Dendrites and Spines of Hippocampal Neurons. ACS Chemical Neurosciences. 8 (7), 1490-1499 (2017).
- Ortega, R., et al. α-synuclein over-expression induces increased iron accumulation and redistribution in iron-exposed neurons. Molecular Neurobiology. 53 (3), 1925-1934 (2016).
- Fartmann, M., et al. Quantitative imaging of atomic and molecular species in cancer cultures with TOF-SIMS and Laser-SNMS. Applied Surface Sciences. 231 (2), 428-431 (2004).
- Pålsgård, E., Lindh, U., Roomans, G. M. Comparative study of freeze-substitution techniques for X-ray microanalysis of biological tissue. Microscopy Research and Techniques. 28 (3), 254-258 (1994).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유