Method Article
Клеточная культура на силиконовых нитридных мембранах и криопрепарат для синхротронного рентгеновского флуоресценции Нано-анализа
В этой статье
Резюме
Здесь представлен протокол для клеточной культуры на кремниевых нитридных мембранах и замораживания до рентгеновской флуоресценции с синхротронным криогенным рентгеновским нанозондом. При наличии только наноанализа комнатной температуры замороженные образцы можно дополнительно высушить. Это критические шаги для получения информации о внутриклеточной элементарной композиции.
Аннотация
О распределении ионов металла на субклеточном уровне известно очень мало. Тем не менее, эти химические элементы имеют основные регулятивные функции и их нарушенный гомеостаз участвует в различных заболеваниях. Современные синхротронные рентгеновские флуоресценционные нанозонды обеспечивают необходимую чувствительность и пространственное разрешение для выяснения двумерного (2D) и трехмерного (3D) распределения и концентрации металлов внутри целых клеток в уровень органеллы. Это открывает новые захватывающие научные области исследования о роли металлов в физиопатологии клетки. Клеточная подготовка является ключевой и часто сложной процедурой, особенно для базового анализа. Хотя методы рентгеновской флуоресценции в настоящее время широко распространены и различные методы подготовки были использованы, очень немногие исследования исследовали сохранение элементарного содержания клеток в лучшем случае, и не пошаговая подробный протокол для криоподготовки Адепт клетки для рентгеновских флуоресценции нанозондов был освобожден до сих пор. Это описание протокола, который обеспечивает пошаговую клеточную подготовку к быстрой криофиксации, чтобы синхротронный рентгеновский флуоресценция нано-анализа клеток в замороженном гидратированных состоянии, когда криогенной среды и передачи доступна. В случае, если нано-анализ должен быть выполнен при комнатной температуре, предусмотрена дополнительная процедура замораживания сушки крионфиксированного адепта клеточного препарата. Предлагаемые протоколы были успешно использованы в предыдущих работах, в последнее время в изучении 2D и 3D внутриклеточного распределения органометаллического соединения в клетках рака молочной железы.
Введение
Недавно разработанные синхротронные рентгеновские флуоресценции (SR-XRF) нанозонды позволяют визуализировать субклеточное распределение элементов в полностью количественном ключе. В качестве примера, эта аналитическая возможность позволяет исследует поглощение наночастиц1 или органометаллических молекул, таких как осмий на основе комплексов2, обеспечивая понимание внутриклеточного поглощения молекул на основе металла с мощными антираковыми свойствами. Как многоэлементная техника, SR-XRF3 с нанозондом обеспечивает способ одновременной количественной оценки и локализации внутриклеточных наиболее биологически важных элементов, включая фосфор, серу, калий, кальций, железо, медь и цинк. Действительно, использование жестких рентгеновских лучей обеспечивает большую глубину проникновения для изображения целых замороженных гидратированных клеток в без этикетки моды. Кроме того, обеспечивая доступ к K-край большинства элементов, представляющих интерес, рентгеновская флуоресценция возбуждается наиболее эффективно. Использование криогенных подходов позволяет снизить радиационный ущерб и оптимизировать сохранение клеточной структуры и элементарное распределение.
Наиболее доступные пространственно решенные аналитические методы для изучения металлов в клетках являются поверхностными методами, требующими очень тонких и плоских участков клеток, которые должны быть произведены. Это в основном включает в себя сканирование передачи электронной микроскопии с энергетически-дисперсивным рентгеновским анализом (STEM-EDX), энергетической электронной микроскопией передачи (EF-TEM) и наномасштабной вторичной ионной масс-спектрометрией (nanoSIMS). Последние не могут быть выполнены на замороженных, гидратированных секциях клеток, в то время как крио-анализ может быть сделано с электронной микроскопией с непревзойденным пространственным разрешением, но плохой чувствительностью элемента. Рентгеновское излучение, вызванное частицами (PIXE), позволило изучить элементарные распределения в целых клетках. Он имеет то преимущество, что полностью количественный с справедливой чувствительности элементарной в микрон масштабе и даже в субмикрон резолюции4, но страдает от радиационного повреждения и отсутствие криогенных возможностей для изучения замороженных гидратированных клеток. Все эти аналитические методы дополняют друг друга в элементарной визуализации клеток, но для всех методов процедура подготовки образца является важным шагом. Она должна быть простой, чтобы ограничить возможное загрязнение, а также элементарное перераспределение и / или утечки для получения значимых результатов. Как показано в электронной микроскопии, криогенный рабочий процесс, включая криоиммобилизацию клетки и криотрансфер к криосканирующей стадии, позволяет оптимально еле-элементарно сохранять на субклеточных уровнях как можно ближе к родному государству5,6,7,8,9,10. Это понимание было успешно реализовано в разработке синхротронной крио-мягкой рентгеновской микроскопии (например, полное поле микроскопов и сканирующие микроскопы) для получения ультраструктурных изображений целых замороженных гидратированных клеток в 2D или 3D. Различные криогенные рабочие процессы были разработаны11 для мягких рентгеновских микроскопов на Beamline 2.1 (XM-2) из Расширенный источник света в Лоуренс Беркли Национальная лаборатория12, луч U41-XM на электронном хранении кольцо BESSY II (Германия)13, луч MISTRAL источника света ALBA (Испания)14, и на балке B24 из Алмазныйисточник. Аналогичный рабочий процесс был недавно показан как самый надежный метод подготовки и сохранения для внутриклеточного элементарного анализа с использованием рентгеновских микрозондов16,17.
Хотя методы рентгеновского нанозонда начинают широко использоваться для клеточного элементарного анализа, особенно с появлением криогенных возможностей SR-XRF, до сих пор ни один пошаговый протокол не был распространен среди научно-исследовательского сообщества. Здесь предусмотрена подробная процедура подготовки криофиксированных клеток адептов, культивируемых в качестве монослойных на кремниевых нитридных мембранах, которые будут анализироваться в криогенных условиях. После протокола следует применить шаг замораживания для сушки, если рентгеновский анализ должен быть выполнен при комнатной температуре. В то время как предлагаемый протокол был успешно использован с человеческими раковыми клетками молочной железы MD-MB-2312 и замораживание сушки было продемонстрировано среди других на нейронах мыши18,20,21, он может быть легко распространен на различные типы клеток человека или животных.
протокол
Экспериментальные процедуры были одобрены комитетом по уходу за животными Отдела наук о жизни CEA (CETEA, A14-006). Они проводились в соответствии с французским законодательством и Директивой Совета Европейского сообщества от 24 ноября 1986 года (86/609/EEC).
1. Нитрид кремния (Si3N4)препарат поддержки мембран
ПРИМЕЧАНИЕ: Потому что мембрана является хрупкой и деликатной, его поддержка (200 мкм толщиной кремниевой рамы) должна быть обработана мягко, в идеале с тонким пинцетом углерода или Dumont tweezers #5, Прямо Self-закрытие тонкой советы. В этом протоколе использовались кремниевые нитридные мембраны с рамой 5 мм х 5 мм и мембраной размером 1,5 мм х 1,5 мм. Мембрана должна быть подготовлена примерно 12 ч перед началом эксперимента (т.е. посева клеток). Membranes могут быть подготовлены в конце дня и оставили сушки на ночь под классОМ II ламинарный капот потока, чтобы они готовы использовать на следующее утро. Толщина кремниевого каркаса 200 мкм является стандартом для большинства компаний, которые продают кремниевые нитридные окна. Если продукт, используемый в этом протоколе, недоступен, мембранный размер в диапазоне 0,5-1,5 мм может быть использован со стандартным размером рамы 5 мм х 5 мм. Более крупный размер мембраны предпочтительнее при использовании рентгеновской томографии. TEM сетки типа кремниевых нитридных окон с мембраной размером 0,5 мм и толщиной 50 нм также могут быть использованы.
- Откройте капсулу, содержащую поддержку Мембраны Si3N4 (рисунок 1). Аккуратно сожмите капсулу, чтобы слегка ослабить опору.
- Держите один из углов кремниевой рамы с помощью тонких пинцетов. Будьте осторожны, чтобы не коснуться Si3N4 мембраны в центре. Мембрана толщиной 200 или 500 нм может быть легко повреждена.
- Используя тонкие пинцеты, аккуратно поместите поддержку Мембраны Si3N4 в стерильное стеклянное блюдо Петри, плоскую поверхность окна нитрида кремния вверх (т.е. полость, обращенную ко дну блюда).
- Снимите крышку чашки Петри и оставьте мембраны под ультрафиолетовым светом на 25–30 минут под ламинарным шкафом.
ПРИМЕЧАНИЕ: Свет UVC (254 нм), как правило, установлен на уровне 200 ЗВт/см2. - Положите 10 л поли-L-лизина на мембрану. Капля должна покрыть Мембрану Si3N4 хорошо и может распространяться немного по кремниевой раме. Оставьте его при 37 градусах По области на 25 мин в стандартном инкубаторе культуры тканей при 100% относительной влажности и 95% воздуха, 5% CO2.
ПРИМЕЧАНИЕ: В этом случае поли-L-лизиновое покрытие было использовано для MDA-MB-231 раковых клеток молочной железы. В зависимости от типа клеточной линии можно использовать различные покрытия, и этот шаг должен быть оптимизирован соответствующим образом. - В стерильной пластине 48 скважин заполните различные скважины 200–250 л ультра-чистой и ультра-прослежочная вода, фильтруееемых через стерильный фильтр 0,22 мкм. Как правило, каждая скважина может быть использована для промывки до 2х3 мембран. Используя тонкие пинцеты, пикап мембранной поддержки в углу его кремниевой рамы. Аккуратно промыть мембрану, погрузив ее вертикально 10 с в три последовательных колодца.
ПРИМЕЧАНИЕ: Мембранные опоры вынимаются из инкубатора и могут обрабатываться при комнатной температуре, при температуре и влажности, определяемой ламинарным капотом класса II. - Положите мембранную поддержку вертикально в пустой колодец стерильной пластины 96 хорошо, накройте его, и дайте ему высохнуть на ночь под ламинарным капотом класса II.
2. Посев ячейки посева
- В стерильной 4 хорошо пластины, место мембраны с их плоской стороной вверх.
- Клетки MDA-MB-231 поддерживаются в монослойной культуре в DMEM с фенол-красным/Glutamax I, дополнены 10% сыворотки плода и дремлют и 1% пенициллина и стрептомицина при 37 градусах По Цельсию в 5% CO2 воздуха увлажняют инкубатор.
- Когда клетки достигают 60-70% всфой, удалите носители из тарелки или колбы.
- Вымойте 1x с 10 мл фосфатного буферного сольника Dulbecco без Ca2 "или Mg2".
- Добавьте 3 мл/T75 колбу 0,05% трипсина/EDTA раствора и убедитесь, что весь монослой покрыт раствором трипсина.
- Инкубировать в течение 3-5 мин при 37 градусах Цельсия, пока клетки не начнут отсоединяться. Следует позаботиться о том, чтобы не переопрошение клеток и не заставлять клетки преждевременно отсоединяться.
- Добавьте 8 мл DMEM, дополненные 10% сыворотки плода икроножной железы и 1% пенициллина и стрептомицина или полных носителей и собирать клетки путем пипетки. Сыворотка в сми нейтрализует трипсин.
- Спин вниз на 250 х г в течение 3 мин при комнатной температуре. Аспирируй супернатанта.
- Добавьте 8 мл свежего полного носителя в 15 мл трубки, содержащей клеточные гранулы, и пайплет клетки вверх и вниз, пока клетки не рассеяются в одну суспензию клеток.
- Подсчитайте клетки с помощью гемоцитометра и разбавьте до концентрации 5 х 106 клеток на мл в полных носителях (DMEM с фенол Красный / 1% от 200 мМ L-аланил-L-глютамин дипептид в 0,85% NaCl раствор дополняется 10% сыворотки плода и 1% пениллин и streptomycin).
- Возьмите 10 зл и суспензию клетки MDA-MB-231 и отсылайте ее на мембрану. Это соответствует 50 000 ячеек/10 Л для MDA-MB-231. Капля должна покрыть мембрану Si3N4 хорошо и может распространяться немного на кремниевой раме. Следует позаботиться о том, чтобы не прикасаться к мембране Si3N4 с кончиком микропипети.
ПРИМЕЧАНИЕ: В зависимости от типа клеточной линии и экспериментов или измерений плотность клеток может варьироваться и должна быть проверена соответствующим образом. Здесь, предлагаемая плотность клеток для посева Si3N4 мембраны была признана оптимальной для экспериментальных условий и дальнейшего SR-XRF нано-анализ MDA-MB-231 клетки2. - Для гиппокампа нейронов (HN), удалить ткани мозга гиппокампа из эмбрионального дня 18,5 мышей и переварить его в 0,25% трипсин в Hepes-HBSS (5,3 мм ККЛ, 0,44 мМ KH2PO4, 137,9 мМ NaCl, 0,34 мМ2PO4, 5,56 мм глюкозы) при 37 КК за 15 мин18,19.
- Используя пипетку P1000 с наконечником P1000 и наконечником P200, выполните механическую диссоциацию, нарисовав и выпустив содержимое конуса с помощью пипетки несколько раз. Во время этого шага, будьте осторожны, чтобы не создавать пузырьки воздуха в среде, потому что пузырьки воздуха являются токсичными для нейронов.
- Подождите несколько минут, пока агрегат не осядет в нижней части трубки.
- Перенесите супернатант, содержащий рассеянные клетки, в стерильную трубку Эппендорфа. Оставьте 25 евро культурной среды, содержащей агрегат.
- Подсчитайте разобщенные клетки с помощью гемоситометра. Изолированные нейроны HN покрываются концентрацией 7 х 1010 4 клетоксм -2 на поли-L-лизина (1 мг/мл поли-L-лизина) покрытием кремниевого нитрида мембраны.
- Только для мембран с HN, инкубировать нейроны в первом DMEM дополнены 10% плода бычьей сыворотки. Один ч после покрытия HN в DMEM, среда меняется на нейробазального покрытия средств (200 мМ L-аланил-L-глютамин дипептид в 0,85% NaCl раствор, и B27 дополнение d 1/50 разбавленных в Neurobasal)18,19.
- Для клеток MDA-MB-231 поставьте мембранные опоры при 37 градусах По Цельсию в инкубаторе (100% относительная влажность, 95% воздуха и 5% CO2)на 25 мин. Это позволяет клеткам оседать и начать прикрепляться к субстрату. Это может быть адаптировано в зависимости от используемой линии ячейки.
- Добавьте 1 мл требуемой полной культуры среды (DMEM с фенол красный / 1% от 200 мМ L-аланил-L-глютамин дипептид в 0,85% NaCl раствор дополнен 10% плода сыворотки и кротких и 1% пенициллина и стрептомицина) в каждой скважине клеток MDA-MB-231, поставив кончик пипетки к стенке пластика хорошо и выпуская среду очень медленно, пока она охватывает мембрану.
- Положите мембраны вертикальной стены 4 хорошо пластины для того, чтобы забрать любые пузырьки воздуха, оказавшихся в скважине полости Si3N4 мембраны (Рисунок 2). Чтобы сделать это, используйте тонкий пинцет и оттолкнуть пузырь очень мягко, двигаясь параллельно Si3N4 задней рамы, чтобы избежать прикосновения и повреждения мембраны.
- Положите мембрану обратно горизонтально в нижней части скважины и оставить 4 хорошо пластины в инкубаторе в течение необходимого времени в зависимости от темпов роста клеточной линии используется. Клетки MDA-MB-231 были инкубированы в одночасье.
3. Лечение или среднее изменение
- Удалите среду из 4 хорошо пластины.
- Промыть один раз с 1 мл раствора PBS при 37 градусах Цельсия. Откажитесь от PBS и добавьте 1 мл разогретой полной свежей среды в присутствии или в отсутствие (контроля) желаемой обработки с помощью 1 мл пипетки наконечник, выпуская жидкость очень медленно против стенки хорошо пластины. Мембрана Si3N4 должна медленно погружаться без каких-либо нарушений, чтобы избежать движения или подъема мембраны.
4. Крио-иммобилизация клеточной подготовки путем замораживания погружения
ПРИМЕЧАНИЕ: В конце необходимого инкубационного времени, при наличии или отсутствии лечения, клетки должны быть тщательно промыты и криофиксированы. Около 30 минут, прежде чем начать промыть и пятно клеточной подготовки до погружения замораживания, первая настройка и охладить автоматический морозильник окунуться. При манипулировании криогенами требуется использование соответствующих криогенных перчаток, защитных очков, закрытой обуви и лабораторного пальто. В соответствующих деварах необходимо транспортировать жидкий азот, а рабочее место должно быть достаточно проветриваемым при наличии кислородного монитора. В идеале низкий уровень гигрометрии в 20–30% помогает ограничить ледяное загрязнение материалов, деваров и криогенов, что вредно для витрификации образцов (т.е. аморфного слоя льда). В идеале, в зависимости от уровня опыта исследователя, до 10–12 образцов для одного сеанса могут быть подготовлены с использованием той же вторичной криогенной жидкой этиловой чашки для витрификации. Между сессиями, автоматический морозильник погружения требует 1 ч автоматической выпечки из процедуры. В идеале образцы должны обрабатываться с одинаковыми условиями инкубации. Тем не менее, элементы управления могут быть обработаны в первую очередь, а затем образцы с конкретным условием лечения.
ПРИМЕЧАНИЕ: Для замораживания погружения следующие шаги применяются как к MDA-MB-231, так и к HN-клеткам.
- Настройка криоplunger для быстрого криофиксирования клеток.
- Включите автоматический морозильник погружения.
- Введите параметры (например, температура, процентная влажность, время промотирования при использовании автоматического промотирования и положение для подъема образца на поверхность криогена для облегчения переноса в криогенный контейнер) непосредственно с консоли и параметров меню настроек. В данном случае параметры камеры влажности были установлены на 37 градусов по Цельсию и 80% влажности.
ПРИМЕЧАНИЕ: Для этого протокола были получены лучшие результаты витрификации и рентгеновского излучения с быстрым и тщательным ручным просветлением. Таким образом, протокол не использует программу автоматической последовательности промотирования. - Прикрепите камеру увлажнителя и для того, чтобы сохранить влажность, сначала заполните ее шприцем с 60 мл двойной дистиллированной воды, а затем 20 мл, как это необходимо для автоматической консоли морозильной камеры погружения.
ПРИМЕЧАНИЕ: Избегайте использования ультрачистой воды, потому что это может повредить систему испарителей. Закройте клапан и оставьте трубку, прикрепленную на задней стороне увлажнителя. - Установите черную чашку этана в держатель и накройте его пластиковыми колпачками.
- Заполните Dewar холодной камеры с LN2,доведя его до уровня сетки в рабочей зоне.
- Положите специальный крио-бокс для хранения мембран после криофиксации в контейнере передачи, состоявшемся в специальном месте в рабочей зоне EM-GP и близко к держателю чашки этана.
ПРИМЕЧАНИЕ: Выделенный крио-бокс является внутренней разработкой на нанозонде луча ID16A европейского синхротронного излучения в Гренобле. Рисунки со спецификациями доступны по запросу(рисунок 3). Они могут храниться четыре в то время, в 50 мл конической трубки для длительного хранения в LN2 Dewar. Альтернативная возможность заключается в использовании небольшой 0,2 мл регулярной ПЦР тонкая настенная трубка с куполом крышки для хранения одного Si3N4 мембраны поддержки. Вам нужно будет просверлить отверстие в 2 мм в верхней части настенной трубки с помощью нагретой шприц иглы для того, чтобы LN2 для заполнения трубки. - Заполните контейнер для передачи LN2 и накройте его выделенной алюминиевой крышкой. Продолжайте заполнять холодную камеру LN2 (обычно требуется 2 л), сохраняя на 100% дисплей монитора уровня LN2 на консоли. Подождите, пока окончательная необходимая температура не будет достигнута.
- Снимите пластиковую крышку и накройте этан чашку с жидком, соединенным с этаном бутылкой. Подождите, пока температура этана чашка уравновешется до температуры установленной точки. При подогнании, начать использовать вторичный криоген (т.е. сжиженный этан).
ПРИМЕЧАНИЕ: Используемая точка была -180 градусов по Цельсию, немного выше точки плавления этана (-182,8 градусов по Цельсию). Вам не нужно предварительно охлаждать этановый сжиженный, потому что он может быть источником образования заморозков и загрязнения этилановые чашки. - Откройте высокой чистоты этана бутылка основной клапан и очень медленно открыть регулятор давления, пока вы не получите медленный туман этана. Держите этот очень низкий поток, пока жидкий этан накапливаются. Заполните чашку до верхнего края. Закройте регулятор давления и главный клапан этановой бутылки. Снимите leica сжиженный тщательно и оставить его в сторону на небольшой полистирол поддержки под дымом капот. Держите рабочую зону свободно покрыты черной крышкой полистирола, предоставленной машиной для предотвращения загрязнения замерзающей рабочей зоны и этана контейнера.
- Непосредственно перед ручным прометкой образца снимите черную погодную крышку и из меню консольного пресса«Нижняя палата»,которая приводит экологическую палату в контакт с криогенной рабочей зоной.
- Приготовьтесь смягчить образец.
- Подготовьте адекватный буфер для удаления следов солей из культуры среды. Для этого протокола буфер ацетата аммония использовался для промывки клеток MDA-MB-231.
ПРИМЕЧАНИЕ: Ацетат ацетат аммиак буфер подходит для большинства типов клеток, и это не добавляет к рентгеновского сигнала флуоресценции (учитывая элементы с No gt; 9). Некоторые конкретные линии клеток, такие как нейронные клетки могут потребовать использования выделенного буфера. Например, для первичных корковых нейронов можноиспользоватьсоленовый раствор, состоящий из 1,8 тома 0,5 М Na2HPO4 и 1,9 тома 0,5 М2PO4. С другой стороны, фосфор или хлор, содержащийся в буфере, будут способствовать развитию спектра XRF. Это ограничение ложных линий рентгеновского излучения должно быть в виду в зависимости от элементов, представляющих интерес, которые будут обнаружены. - Подготовьте раствор ацетата аммония 150 мМ из ультрачистого раствора ацетата аммония и проверьте на рН (7,0–7,3) и осмоляритность (270-300 мОзм/кг)
ПРИМЕЧАНИЕ: Вышеупомянутая осмоляритность эквивалентна фосфатной солину Dulbecco (D-PBS) без кальция и магния и может быть проверена с помощью микро-осмометра. - Заполните необходимое количество колодцев из 12 хорошо пластиковой пластины с буфером ацетата аммония.
- Вырезать четверть фильтровальной бумаги для промокать, либо из No 1 фильтровальной бумаги с предрезанным отверстием, или из ручной пробитой фильтровальной бумаги диаметром 55 мм с 15 мм центральное отверстие.
- Вынизвините необходимый образец, хранящийся в инкубаторе при температуре 37 градусов по Цельсию в последний момент перед оборкой и замораживанием мембраны.
- Разблокируйте пинцет с помощью черного зажима щипцы быстрого выпуска (как правило, Дюмон зажима кольцо высокой точности медицинских пинцета) и захватить Si3N4 мембраны поддержки от культуры хорошо.
ПРИМЕЧАНИЕ: Захватите середину кремниевой рамы, сохраняя кончик пинцета возле мембраны. Переместите черное кольцо зажима вниз к первым полосам, чтобы заблокировать пинцет. - Погрузите поддержку Мембраны Si3N4 вертикально в буферный раствор ацетата аммония, который сохраняется при 37 градусах Цельсия для 5 с.
ПРИМЕЧАНИЕ: Поддержка должна оставаться вертикальной в буфере. Обратите внимание, что буферное решение в каждой скважине пластины может быть использовано для до трех мембран для тех же условий инкубации. - Пятно вручную с фильтровальной бумагой, чтобы слить избыточный буфер из мембранного раствора для промывки(Рисунок 4) для того, чтобы оставить тонкий и однородный слой ацетата аммония aqueous раствор, покрывающий клетки.
ПРИМЕЧАНИЕ: Чтобы сделать это, сначала нажмите заднюю часть окна на фильтровальную бумагу, чтобы удалить почти все ваквого буфера, остающегося в колодце и задней части мембраны. Во-вторых, пятно передней стороне, начиная с обеих сторон пинцета, то с каждой стороны кадра(рисунок 4). Никогда не прикасайтесь к мембране. Избыток буфера осушенных можно контролировать с aureole формируется на фильтровальной бумаге. - Откройте дверь экологической камеры и быстро смонтируйте пинцет, сдвинув ее в щипцы блокировки, и закройте дверь(рисунок 5).
- Пресса "Пятно / Окунуться". Пинцет, держащий мембрану Si3N4, будет быстро погружен в криоген.
- Снимите крышку переносного контейнера с помощью предварительно охлажденных щипков.
- Пресса "Передача". Мембрана Si3N4 будет слегка перемещена выше криогена.
- В одном быстром движении, отключить пинцет, сдвинув их из щипцы блокировки и слегка наклониться из блокировки, чтобы принести непосредственно в пустой слот крио-коробки в контейнере передачи заполнены LN2. Отпустите черное кольцо зажима, чтобы освободить мембрану(рисунок 5).
ПРИМЕЧАНИЕ: Контейнер для передачи всегда должен быть покрыт LN2. Когда пополнение требуется, накройте этан чашку с пластиковой крышкой, предоставленной машиной, чтобы избежать смешивания LN2 и этана. - Обложка контейнера с крышкой и использовать небольшой белый полистирол чашку заполнены LN2, чтобы передать его в полистирол поле заполнены LN2.
ПРИМЕЧАНИЕ: Крио-коробка или трубка, содержащая мембраны, могут храниться в конических трубках мощностью 50 мл, наполненных LN2, и передаваться на долгосрочное хранение LN2 Dewar. Перед тем, как начать окунуться заморозить следующий образец, разогреть все холодные и матовые пинцеты с феном или горячей пластины / криоинструментов сушилка (45 градусов по Цельсию), чтобы избежать загрязнения кристаллами льда.
- Подготовьте адекватный буфер для удаления следов солей из культуры среды. Для этого протокола буфер ацетата аммония использовался для промывки клеток MDA-MB-231.
5. Замораживание сушки замороженных клеток, культивированных на кремниевых нитридных мембранах
ПРИМЕЧАНИЕ: При замораживании сушки следующие шаги применяются как к клеткам MDA-MB-231, так и к HN. Чтобы охладить сушилку для замораживания, вам нужно будет подождать около 40 минут до 1 ч.
- Настройка сушилки для замораживания
- Включите питание с выключателем рокера, расположенным на задней панели прибора.
- Начало ввода параметров, следующих за меню LCD: Сегмент 1 и 2 ч при -120 градусов по Цельсию; Сегмент 2 и 2 ч пандус от -120 кв-80 градусов по Цельсию; Сегмент 3 и 2 ч при -80 градусах по Цельсию; Сегмент 4 и 2 ч пандус от -80 до 50 градусов по Цельсию; Сегмент 5 и 2 ч при -50 градусах по Цельсию; Сегмент 6 и 6 ч пандус от -50 до 30 градусов по Цельсию.
- В конце настройки параметра сохраните настройки, закройте крышку камеры и нажмите "START".
- Агрегат будет прокачиваться до 1,10-5 мбар. Когда это давление будет достигнуто, командная линия дисплея покажет "Start Cooling Now, START, чтобы продолжить".
- Регулярно заполняйте жидкий азот Dewar, чтобы охладить сцену ниже температуры тройной точки настройки.
ПРИМЕЧАНИЕ: Температура тройной точки стадии установлена до -140 градусов по Цельсию. Перед загрузкой образца для этого протокола, лучше всего ждать около 1 ч и температуры стадии -160 градусов по Цельсию. - Дисплей покажет "Press ENTER" когда будет готов к "Загрузить образец".
- Охладите до температуры жидкого азота в lN2 заполнены полистирол Dewar, держатель передачи образца, предоставляемый поставщиком, и два дополнительных латунных цилиндрических Si3N4 мембраны держателей.
- Маунт Si3N4 мембраны латунной держатель на верхней части образца передачи держателя, предоставляемых поставщиком в полистирола Dewar (Рисунок 6A). Держите уровень LN2 примерно на 1-2 мм ниже верхнего края первого латунного куска.
- Возьмите Si3N4 мембраны образца поддержки из крио-коробки или ПЦР трубки с помощью предварительно охлажденных самозакрывающихся пинцетов в инокс или тефлоновые покрытием.
- Депозит мембраны с клетками образца стороны вверх в латунной держатель пронумерованы полости.
- Обложка сборки со второй латунной кусок в качестве крышки(Рисунок 6C).
ПРИМЕЧАНИЕ: Мы разработали два латунных диска, каждый из которых имеет толщину 5 мм, диаметр 50 мм и центральное отверстие диаметром 11 мм. Первый латунный диск имеет 14 машинистских прямоугольных (8 мм х 6 мм) локаций для размещения опор (5 мм x 5 мм). Каждый слот имеет плоский и отполированный колодец с глубиной 2 мм. Второй латунный диск плоский, чтобы покрыть поддержку мембраны Si3N4 и действует как холодный корпус ловушки. - Precool передачи стержня в LN2 заполнены полистирола пены окно и использовать его для блокировки в полной сборке(Рисунок 6D, E).
- Нажмите "ENTER" на передней панели замораживания сушилки.
- Турбо- и роторные насосы остановятся, а камера продуется сухим азотным газом, что позволит открыть крышку камеры.
- Немедленно перенесите сборку переноса образца с пружинно-загруженным штангой в камеру замораживания сушилки и закрепите его на медной LN2 холодной стадии.
ПРИМЕЧАНИЕ: Оставьте полную сборку с переносом стержня в камеру. - Немедленно закройте крышку камеры замораживания сушилки и нажмите "START", чтобы продолжить цикл замораживания сушки.
- Заполните резервуар LN2 замораживания сушилки вручную каждые 2 ч.
ПРИМЕЧАНИЕ: Автоматическая система заполнения LN2 может быть подключена к этому резервуару. - В конце цикла замораживания сушки, нажмите "STOP", чтобы выпустить камеру, и удалить полную сборку для доступа к лиофилизированных образцов.
Результаты
Типичный оптический видеомикроскоп зрения замороженных гидратированных MDA-MB-231 клеток, которые были суб-культуры на поли-L-лизина покрытием Si3N4 мембранной поддержки показано на рисунке 7A. Оптический вид образца в вакуумной камере был получен в режиме отражения с помощью специального онлайн-видеомикроскопа луча ID16A ESRF22. В то время как электронная или мягкая рентгеновская микроскопия требует, чтобы слой льда, встраивающий клетку, был как можно более тонким (обычно ,lt;0.5 мкм), твердые рентгеновские лучи (Зgt;10 keV) имеют преимущество гораздо более высокой глубины проникновения и более низкой дозы осаждения. Толщина льда может быть больше, как правило, lt;10 мкм, включая ячейку, так что лед встраивания ячейки в несколько мкм в толщину. Это можно оценить через измеренную интенсивность рентгеновского снимка в передаче по сравнению с интенсивностью без образца, принимая во внимание поглощение 500 нм толщиной Si3N4 мембраны. Эта толщина льда может быть достигнута с помощью ручного промотирования, как описано в настоящем протоколе. В области колец Ньютона толщина льда может быть еще тоньше (не измеряется).
Рентгеновское флуоресценцию элементарного картирования замороженных гидратированных клеток показано на рисунке 7B с репрезентативным распределением физиологических элементов, таких как калий (K), сера (S) и цинк (N). Эти карты представляют собой элементарную ареальную массу (т.е. элементарной прогнозируемой массой). Хотя в данном случае такие карты не сделаны, такие карты могут быть нормализованы с помощью рентгеновской фазовой контрастной визуализации, которая обеспечивает оценку прогнозируемой массы образца23. Как сообщалось во многих исследованиях, высоко рассеянный Ион K в клетках, сохранившихся в их почти родном государстве, как предполагалось, однородно распространен по всей ячейке23,24,16. Как показано на 2D рентгеновской флуоресценции элементарных изображений на рисунке 7B, плотно связаны элемент S равномерно распределены в ячейке, подобно K, и представляет собой хорошую оценку профиля клеточной массы. Распределение В н имело более высокий сигнал в ядре, чем в цитозоле, и четко обозначило ядро. Можно отметить, что небольшие обогащенные зоны могут быть обнаружены при пространственном разрешении (50 нм) в ядерном регионе.
Существующие рентгеновские нанозонды или те, которые будут построены, не обязательно вмещают криогенные возможности. В этом случае лучшей альтернативой для получения рентгеновских флуоресценции клеток при пространственных разрешениях суб-100 нм является выполнение процедуры замораживания, описанной в этом протоколе после замораживания клетки. Рисунок 8А показывает типичный яркий вид полевой микроскопии резонирующего лиофилизированного первичного мышигиппокампа нейронов, непосредственно культивируемого на мембране Si3N4. В этом случае, если они хранятся в чистой высохлой камере, образцы можно подготовить за 1–2 недели и наблюдать с помощью обычного вертикального оптического микроскопа для регистрации интересуемых регионов. Следует позаботиться о том, чтобы предотвратить воздействие окружающей влажности, поскольку она может быть захвачена лиофилизированным образцом и привести к повреждению под рентгеновским нанолучьем. Эта процедура была успешно применена к очень чувствительным клеткам (т.е. нейронные клетки) и даже лучшие результаты были получены с другими более надежными типами клеток, таких как раковые клетки. Что касается замороженных клеток, рентгеновские флуоресценции изображения K, S, и Зн на весь лиофилизированный дисплей клетки похожи на те, описанные выше. Они являются репрезентативными для элементарных дистрибутивов, которые можно найти в различных типах лиофилизированных ячеек с пространственным разрешением 50–100 нм. В то время как замораживание сушки целые клетки является альтернативой для сохранения элементарной целостности, это за счет идеального сохранения морфологии клеток16, особенно клеточных мембран.

Рисунок 1: Типичная поддержка образца рентгеновского флуоресценции наноанализа. Мембрана Si3N4 в защитной капсуле. Этот тип субстрата может быть использован как для анализа комнатной температуры (погружение-заморозка клеточной подготовки с последующим низкой температурой и низким вакуумным процессом замораживания сушки), так и для криогенного рентгеновского анализа флуоресценции. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
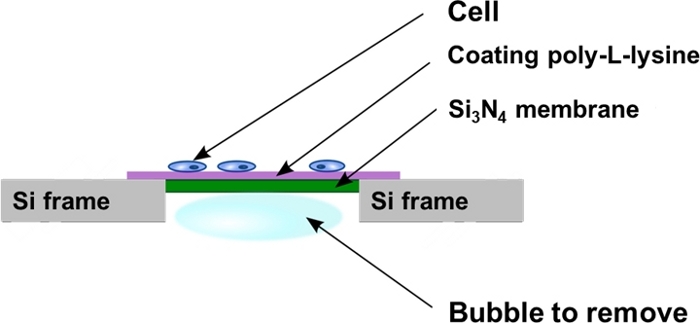
Рисунок 2: Схематический вид окон нитрида кремния после посева клеток. Клетки культивируются непосредственно на поли-L-лизина покрытием плоская поверхность Si3N4 мембраны поддержки. Иногда пузырьки воздуха могут быть пойманы в ловушку в задней полости мембранной поддержки Si3N4 и должны быть удалены, как описано в протоколе. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: В доме разработан 3D печатных крио-бокс для долгосрочного хранения окунуться замороженных Si3N4 мембраны поддерживает в жидком азоте Dewar. (A) Крио-коробка разобрана с контейнером и крышками (нижняя часть) и (B) собранная крио-коробка с locked крышками. Крышки можно манипулировать с пинцетом, открытие или блокировки путем вращения. Подробный план 3D-печати доступен по запросу ESRF ID16A. Конструкция была сделана для размещения кремниевых нитрида TEM сетки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Blotting клеток культивируется на Si3N4. Перед погружением-замораживания монослой клетки культивируется на Si3N4 мембраны необходимо промыть в раствора ацетата аммония ()и тщательно вручную смыты с помощью фильтровальной бумаги (B). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Автоматическая машина EM-GP. (A) Автоматический морозильник погружения. (B) Экологическая камера с пинцетом заблокирован дюйма (C) этан чашка покрыта Leica сжижения подключен к бутылке этана. (D) Погружение замораживания корпуса с указанием черная чашка полна сжиженного этана и крио-бокс для дальнейшего хранения в LN2 из vitrified Si3N4 мембран. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 6: Образец криотрансферной сборки для процедуры замораживания сушки. ()Первый получатель латуни для Si3N4 мембраны устанавливается на верхней части держателя передачи образца, предоставляемых поставщиком замораживания сушилки. (B)и (C) показывают, что второй плоский латунный диск используется в качестве крышки и действует как холодная ловушка корпуса, которые будут вставлены в вакуумный корпус замораживания сушилки. (D) Полная сборка с пружинно-загруженным штангой передачи. (E) Держатель образца, несущий витрифицированный клеточный препарат, выращенный на мембране Si3N4, должен быть дополнительно вставлен в lN 2-охлажденный сушилку для замораживания. Все шаги для монтажа сборки выполняются в LN2 в пенополистирола поле. Для ясности, все изображения были произведены в отсутствие LN2. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 7: Крио-рентгеновская флуоресценция изображения замороженной гидратасной клетки с помощью жесткого рентгеновского нанозонда. (A) Типичный онлайн-вид в режиме отражения с использованием специального оптического видео микроскопа луча ESRF ID16A. После ручного промотирования была достигнута общая толщина льда в размере около 5,10 мкм, что позволяет четко увидеть замороженные гидратированные клетки. Область с кольцами Ньютона, свидетельствующая о еще более тонком льду, заметна. (B) Представитель крио-рентгеновской флуоресценции клеточных распределения физиологических элементов калия (K), серы (S), и цинка (N). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
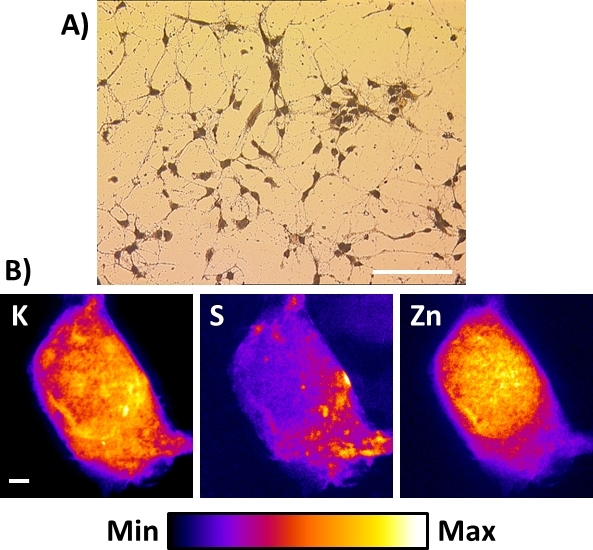
Рисунок 8: Рентгеновские флуоресценции изображения лиофилизированной нейронной клетки с использованием жесткого рентгеновского нанозонда. (A) Типичный вид яркой полевой микроскопии резонирующего лиофилизированного первичных корковых нейронных клеток, непосредственно культивированных на мембрану Si3N4. Шкала бар 200 мкм (B) Представитель комнатной температуры рентгеновской флуоресценции изображения одного лиофилизированного гиппокампа нейрон, показывающий распределение физиологических элементов калия (K), серы (S), и цинка (N). Шкала бар 2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Криоэлектронная микроскопия (крио-ЭМ) получила Нобелевскую премию по химии 2017 года и как таковую разработку, сделанную Дж.Дюбоше по витрификации биологического материала для определения структуры высокого разрешения биомолекул в растворе25. Как сообщил Дюбоше в своей Нобелевской лекции "Зная, как vitrify капли воды это одно, подготовка биологического образца для биологического наблюдения с другой"25. Криоподготовка шаги в настоящее время считается стандартным методом для смягчения повреждения дозы радиации и изучения клеток близко к их родному состоянию. Однако подготовка остается утомительной. Это потому, что электронная микроскопия, из-за его непревзойденного пространственного разрешения, чувствителен к любому ультраструктурному артефакту, который происходит во время подготовки образца. Синхротронные крионанозонды в настоящее время приближается аналогичные трудности спускаясь к пространственным разрешениям как низко как 13 нм в высокой энергии рентгеновского диапазона26. Твердая рентгеновская микроскопия может анализировать целые клетки, в то время как электронная микроскопия страдает от низкой глубины проникновения электронов, позволяя наблюдать только очень тонкие клеточные ломтики.
Монослойы клеток достаточно тонкие, так что при замораживании жидкого этана достигаются необходимые темпы охлаждения для витрификации воды. Теоретически, скорость охлаждения выше 108 К/с возможна с помощью замораживания27 высокого давления, что позволяет витрификации образцов слишком толстыми для замораживания. Скорость охлаждения 105 К/с, необходимая для обеспечения полной витрификации образца при атмосферном давлении28,достигается воспроизводимо с помощью автоматической машины замораживания погружения и представленных здесь параметров. Это позволяет исследователю vitrify тонких биологических образцов (l;10 мкм), таких как монослой клеток12,13,14,15,29,30 путем погружения замораживания в жидком этане.
Важная задача с этим протоколом также сохранить как можно больше химической целостности внутриклеточного содержания для обеспечения надежного элементарного распределения в клетке в 2D или 3D. Как опубликовано в другом месте2,16,17,31, в случае элементарной визуализации на субклеточном уровне, анализ замороженных гидратированных клеток должны быть рассмотрены. В противном случае для анализа комнатной температуры можно использовать комбинацию замораживания и замораживания клеток. Для последнего, аморфный лед удаляется через процесс сублимации, в то время как связанные молекулы воды удаляются через процесс desorpation. Этот процесс может быть далек от идеала по сравнению с замороженными гидратированными образцами из-за возможного изменения клеточных мембран и морфологии некоторых подклеточных структур32. Кроме того, для видообразований, добыча воды может привести к металлообразованию артефактов. Тем не менее, он был успешным и лучшая альтернатива замороженных гидратированных образцов для элементарной визуализации на суб-100 нмуровнях 2,16,17,18,20,33,34,35,36.
Как было сообщено37, качество криоконсервированных клеточных препаратов может быть оценено через калий к натрию K/ Na соотношение. К сожалению, он пока не может быть определен с жестким рентгеновским нанозондом, используемым здесь, из-за низкой энергии отсечения кремниевого детектора дрейфа, используемого для обнаружения рентгеновских флуоресценции фотонов элементов (E - 1.3 кеВ магния). Действительно, высокое соотношение K/Na (Nogt;10), которое может быть измерено с помощью TOF-SIMS, EPMA, или ядерного микрозонда PIXE16,37 свидетельствует о сохраненной химической целостности клетки по сравнению с ожидаемым K/Na 25 в живой клетке37. Это может быть поддержано сопутствующим низким соотношением Cl/K38. Тем не менее, несовершенная витрификация, особенно если скорость охлаждения образца слишком низка, может привести к образованию крупных кристаллов льда, которые могут повредить клеточные мембраны и органеллы, что, следовательно, изменение распределения химических элементов. Хотя нет рутинной процедуры для мониторинга этого потенциального повреждения и воздействия на внутриклеточное распределение, вышеуказанные элементарные соотношения и возможность изображения клетки с высоким разрешением с помощью рентгеновской фазы контраста или крио-мягкой рентгеновской микроскопии могут быть наилучшими подходами для поддержки хорошего сохранения внутриклеточных отсеков с сопутствующим сохранением элементарной целостности. Сочетание этих методов и использование недавно разработанных криокорных флуоресцентных оптических микроскопов поможет оценить, в какой степени это повреждение происходит и влияет на внутриклеточное элементарное распределение.
В целом представлен подробный и всеобъемлющий протокол подготовки клеточных образцов для синхротронного рентгеновского флуоресценции наноанализа. Это хорошая отправная точка для научного сообщества, помогая решить трудный вопрос о том, как подготовить соответствующие образцы клеток для 2D и 3D элементарных изображений на (крио) жестких рентгеновских нанозондов. Эти подходы могут быть объединены с оптической флуоресценцией и возможностями электронной микроскопии для углубленной коррелятивной химической и структурной визуализации клеток.
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Эксперименты на нано-изображении луча ID16A были проведены в рамках предложений ESRF LS2430, LS2303 и LS2765.
Материалы
| Name | Company | Catalog Number | Comments |
| Ammonium Acetate solution, BioUltra, for molecular biology, ~5M in H2O | SIGMA | 09691-250mL | One can prepare the required solution from high-grade ammonium acetate powder and ultrapure water, pH and osmolarity needs to be adjusted anyway. |
| B27 supplement, 50x | Life Technologies, Invitrogen | 17504-044 | for hippocampal neuron culture |
| Dulbecco’s Phosphate Buffered Saline, DPBS, ([-] CaCl2, [-] MgCl2) | GIBCO | 14190-094 | cell culture |
| DMEM with Phenol Red/Glutamax I (Medium ATCC modification) | GIBCO | 21885025 | cell culture |
| Dulbecco’s modified Eagle medium (DMEM) | Life Technologies, Invitrogen | 31966-02 | for hippocampal neuron culture |
| Dumont Tweezers #5, Straight Self-closing, 0.05x0.01mm Tips, Biology | World Precision Instrument | 501202 | |
| Emitech K750X Peltier-Cooled EM Freeze Dryer | Quorum Technology | EK3147 | |
| Ethane N45 | Air Liquid | p0505s05r0a001 | C2H6 > 99,995 % |
| Fetal Bovine Serum, Performance Plus, certified One Shot format, US origin | GIBCO | A31604-02 | cell culture |
| HBSS 10x | Life Technologies, Invitrogen | 14185-052 | for hippocampal neuron culture |
| Leica GP quick-release forceps | Leica | 16706435 | |
| MDA-MB-231 cell line, an epithelial, human adenocarcinoma breast cancer cell | ATCC | ATCC HTB-26 | cell culture |
| Neurobasal medium | Life Technologies, Invitrogen | 21103-049 | for hippocampal neuron culture |
| Nunc 4-Well Plate | Thermo Fisher | 176740 | cell culture |
| Osmo1 Single-Sample Micro-Osmometer | Advanced Instruments | Osmo1 | Alternative can be found at Fisher scientific (Wescor Inc. VAPRO® Vapor Pressure Osmometer) |
| Penicillin-Streptomycin | SIGMA | P4333 | cell culture |
| poly-L-lysine | SIGMA | P4707 | Other type of coating can be used that is dependent of the cell type to be cultured on the membrane, other adhesion factors such as fibronectin, collagen, polyornithine can be tested accordingly. Cell can be cultured directly on silicon nitride membrane, but the latter are slightly hydrophobic and adhesion factors are recommended unless the membrane are processed to be hydrophilic (glow plasma discharged). |
| Plunge freezing robot Leica EM GP main unit | Leica | 16706401 | Alternative for automated plunger are the Vitrobot Mark IV (FEI), CryoPlunge 3 (Gatan), MS-002 Rapid Immersion Freezer (EMS). Manual home-made system can be used but an environment-controlled chamber is an asset for plunge-freezing. |
| Silicon nitride membrane (Si3N4) | Silson Ltd. | SiRN-5.0(o)-200-1.5-500-NoHCl | The proposed silicon nitride membrane type is optimised for analysis at ID16A ESRF X-ray nanoprobe, The 500 nm thickness of the membrane was chosen being more robust for cellular manipulation and cryofixation detailed within this protocol. Membrane with thickness of 200 nm or below can also be used although quite fragile, and other design of silicon nitride membrane can be purchased (for example TEM compatible membrane...) from Sislon or other company such as Norcada, SPI supplies, Ted Pella, EMS, LabTech, Neyco... |
| Trypan blue solution 0.4% | GIBCO | 15250061 | cell culture |
| Trypsin-EDTA, 0.05% | GIBCO | 25300-054 | cell culture |
| Ultratrace Elemental Analysis Grade, Ultrapure Water | Fisher Chemicals | W9-1 | MilliQ water can be used but has to be tested for trace element level of contamination using for example ICP-MS analysis. |
| Whatman No. 1 filter paper with precut hole | Leica | 16706440 | Alternative filter paper may be used and must have an outer diameter of 55 mm, the Punch for filter paper system from Leica (ref.16706443) can be used. |
Ссылки
- Lewis, D. J., et al. Intracellular synchrotron nanoimaging and DNA damage/genotoxicity screening of novel lanthanide-coated nanovectors. Nanomedicine. 5 (10), 1547-1557 (2010).
- Fus, F., et al. The intracellular localization of osmocenyl-tamoxifen derivatives in hormone-independent breast cancer cells revealed by 2D and 3D nano X-ray fluorescence imaging. Angwendte Chemie. , (2019).
- Janssens, K., Adams, F., Rindby, A. Microscopic X-Ray Fluorescence Analysis. , Wiley. Chichester, UK. (2000).
- Carmona, A., et al. Uranium exposure of human dopaminergic cells results in low cytotoxicity, accumulation within sub-cytoplasmic regions, and down regulation of MAO-B. Neurotoxicology. 68, 177-188 (2018).
- Leapman, R. D., Hunt, J. A., Buchanan, R. A., Andrews, S. B. Measurement of low calcium concentrations in cryosectioned cells by parallel-EELS mapping. Ultramicroscopy. 49 (1-4), 225-234 (1993).
- Saubermann, A. J., Echlin, P., Peters, P. D., Beeuwkes, R. Application of scanning electron microscopy to X-ray analysis of frozen hydrated sections. I. Specimen handling techniques. Journal of Cell Biology. 88 (2), 257-267 (1981).
- Saubermann, A. J., Heyman, R. V. Quantitative digital X-ray imaging using frozen hydrated and frozen dried tissue sections. Journal of Microscopy. 146, Pt2 169-182 (1987).
- Wroblewski, J., Roomans, G. M. X-ray microanalysis of single and cultured cells. Scanning Electron Microscopy. , Pt 4 1875-1882 (1984).
- Wroblewski, J., Müller, R. M., Wroblewski, R., Roomans, G. M. Quantitative X-ray microanalysis of semi-thick cryosections. Histochemistry. 77 (4), 447-463 (1983).
- Zierold, K. Cryopreparation of mammalian tissue for X-ray microanalysis in STEM. Journal of Microscopy. 125, Pt2 149-156 (1982).
- Harkiolaki, M., et al. Cryo-soft X-ray tomography: Using soft X-rays to explore the ultrastructure of whole cells. Emerging Topics in Life Sciences. 2 (1), 81-92 (2018).
- McDermott, G., Le Gros, M. A., Knoechel, C. G., Uchida, M., Larabell, C. A. Soft X-ray tomography and cryogenic light microscopy: the cool combination in cellular imaging. Trends in Cell Biology. 19 (11), 587-595 (2009).
- Schneider, G., et al. Three-dimensional cellular ultrastructure resolved by X-ray microscopy. Nature Methods. 7 (12), 985-987 (2010).
- Sorrentino, A., et al. MISTRAL: a transmission soft X-ray microscopy beamline for cryo nano-tomography of biological samples and magnetic domains imaging. Journal of Synchrotron Radiation. 22 (4), 1112-1117 (2015).
- Carzaniga, R., Domart, M. C., Duke, E., Collinson, L. M. Correlative cryo-fluorescence and cryo-soft X-ray tomography of adherent cells at European synchrotrons. Methods in Cell Biology. 124, Academic Press. 151-175 (2014).
- Perrin, L., Carmona, A., Roudeau, S., Ortega, R. Evaluation of sample preparation methods for single cell quantitative elemental imaging using proton or synchrotron radiation focused beams. Journal of Analytical Atomic Spectrometry. 30 (12), 2525-2532 (2015).
- Jin, Q., et al. Preserving elemental content in adherent mammalian cells for analysis by synchrotron-based x-ray fluorescence microscopy. Journal of Microscopy. 265 (1), 81-93 (2017).
- Daoust, A., et al. Impact of manganese on primary hippocampal neurons from rodents. Hippocampus. 24 (5), 598-610 (2014).
- Daoust, A., et al. Manganese Cytotoxicity Assay on Hippocampal Neuronal Cell Culture. Bio-protocol. 5 (1), 1368(2015).
- Gibon, J., et al. The over-expression of TRPC6 channels in HEK-293 cells favours the intracellular accumulation of zinc. Biochimica et Biophysica Acta (BBA)-Biomembranes. 1808 (12), 2807-2818 (2011).
- Hasna, J., Bohic, S., Lemoine, S., Blugeon, C., Bouron, A. Zinc Uptake and Storage During the Formation of the Cerebral Cortex in Mice. Molecular Neurobiology. , 1-13 (2019).
- Villar, F., et al. Nanopositioning for the ESRF ID16A Nano-Imaging Beamline. Synchrotron Radiation News. 31 (5), 9-14 (2018).
- Kosior, E., et al. Combined use of hard X-ray phase contrast imaging and X-ray fluorescence microscopy for subcellular metal quantification. Journal of Structural Biology. 177 (2), 239-247 (2012).
- Bohic, S., et al. Synchrotron hard X-ray microprobe: fluorescence imaging of single cells. Applied Physics Letters. 78, 3544-3546 (2001).
- Dubochet, J. On the Development of Electron Cryo-Microscopy (Nobel Lecture). Angwendte Chemie. 57 (34), 10842-10846 (2018).
- Da Silva, J. C., et al. Efficient concentration of high-energy X-rays for diffraction-limited imaging resolution. Optica. 4 (5), 492-495 (2017).
- Studer, D., Humbel, B. M., Chiquet, M. Electron microscopy of high-pressure frozen samples: bridging the gap between cellular ultrastructure and atomic resolution. Histochemistry and Cell Biology. 130 (5), 877-889 (2008).
- Moor, H. Theory and pratice of high pressure freezing. Cryotechniques in Biological Electron Microscopy. Steinbrecht, R. A., Zierold, K. , Springer. 175-191 (1987).
- Gilkey, J. C., Staehelin, L. A. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. Journal of Electron Microscopy Techniques. 3 (2), 177-210 (1986).
- Ferreira, J. L., Matthews-Palmer, T. R., Beeby, M. Electron Cryo-Tomography. Cellular Imaging. , Springer, Cham. 61-94 (2018).
- Colvin, R. A., Jin, Q., Lai, B., Kiedrowski, L. Visualizing metal content and intracellular distribution in primary hippocampal neurons with synchrotron X-ray fluorescence. PLoS One. 11 (7), 0159582(2016).
- Vavpetič, P., et al. Elemental distribution and sample integrity comparison of freeze-dried and frozen-hydrated biological tissue samples with nuclear microprobe. Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms. 348, 147-151 (2015).
- Guerquin-Kern, J. L., Bordat, C. Cryo-preparation procedures for elemental imaging by sims and eftem. Handbook of Cryo-Preparation Methods for Electron Microscopy. , CRC Press. 499-536 (2008).
- Gramaccioni, C., et al. Nanoscale quantification of intracellular element concentration by X-ray fluorescence microscopy combined with X-ray phase contrast nanotomography. Applied Physics Letters. 112 (5), 053701(2018).
- Perrin, L., et al. Zinc and Copper Effects on Stability of Tubulin and Actin Networks in Dendrites and Spines of Hippocampal Neurons. ACS Chemical Neurosciences. 8 (7), 1490-1499 (2017).
- Ortega, R., et al. α-synuclein over-expression induces increased iron accumulation and redistribution in iron-exposed neurons. Molecular Neurobiology. 53 (3), 1925-1934 (2016).
- Fartmann, M., et al. Quantitative imaging of atomic and molecular species in cancer cultures with TOF-SIMS and Laser-SNMS. Applied Surface Sciences. 231 (2), 428-431 (2004).
- Pålsgård, E., Lindh, U., Roomans, G. M. Comparative study of freeze-substitution techniques for X-ray microanalysis of biological tissue. Microscopy Research and Techniques. 28 (3), 254-258 (1994).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены