Method Article
Cultivo celular en membranas de nitruro de silicio y criopreparación para nanoanálisis de fluorescencia de rayos X de sincrotrón
En este artículo
Resumen
Aquí se presenta un protocolo para el cultivo celular en membranas de nitruro de silicio y congelación por inmersión antes de la toma de imágenes de fluorescencia de rayos X con una nanosonda de rayos X criogénica de sincrotrón. Cuando sólo se proporciona nanoanálisis a temperatura ambiente, las muestras congeladas se pueden liofilizadas. Estos son pasos críticos para obtener información sobre la composición elemental intracelular.
Resumen
Se sabe muy poco sobre la distribución de iones metálicos a nivel subcelular. Sin embargo, esos elementos químicos tienen funciones reguladoras esenciales y su homeostasis perturbada está involucrada en diversas enfermedades. Las nanosondas de fluorescencia de rayos X de sincrotrón de última generación proporcionan la sensibilidad y la resolución espacial necesarias para dilucidar la distribución y concentración bidimensionales (2D) y tridimensionales (3D) de metales dentro de células enteras en la distribución y concentración bidimensionales (2D) y tridimensionales (3D) de metales dentro de células enteras en la distribución y concentración bidimensionales (2D) y tridimensionales (3D) dentro de células enteras en la distribución y concentración bidimensionales (2D) y tridimensionales (3D) de metales dentro de células enteras en la distribución y concentración bidimensional (2D) y tridimensional (3D) de metal nivel de organelo. Esto abre nuevos y emocionantes campos científicos de investigación sobre el papel de los metales en la fisiopatología de la célula. La preparación celular es un procedimiento clave y a menudo complejo, particularmente para el análisis básico. Aunque las técnicas de fluorescencia de rayos X están ahora generalizadas y se han utilizado varios métodos de preparación, muy pocos estudios han investigado la preservación del contenido elemental de las células en el mejor de los casos, y no hay un protocolo detallado escalonado para la criopreparación de hasta ahora se han liberado células adherentes para nanosondas de fluorescencia de rayos X. Esta es una descripción de un protocolo que proporciona la preparación celular escalonada para la criofixación rápida para permitir el nanoanálisis de fluorescencia de rayos X sincrotrón de células en un estado hidratado congelado cuando un entorno criogénico y la transferencia está disponible. En caso de que el nanoanálisis tenga que realizarse a temperatura ambiente, se proporciona un procedimiento adicional para el secado por congelación de la preparación celular adhesiva adherente criofija. Los protocolos propuestos se han utilizado con éxito en trabajos anteriores, más recientemente en el estudio de la distribución intracelular 2D y 3D de un compuesto organometálico en células de cáncer de mama.
Introducción
Las nanosondas de fluorescencia de rayos X de sincrotrón (SR-XRF) de nuevo diseño permiten la visualización de la distribución subcelular de los elementos de una manera totalmente cuantitativa. Como ejemplo, esta capacidad analítica permite investigar la ingesta de nanopartículas1 o moléculas organometálicas como los complejos basados en osmio2,proporcionando información sobre la ingesta intracelular de moléculas basadas en metal es con potentes propiedades anticancerígenas. Como técnica multielemento, SR-XRF3 con nanosonda proporciona simultáneamente una manera de cuantificar y localizar simultáneamente los elementos intracelularmente más importantes biológicamente, incluyendo fósforo, azufre, potasio, calcio, hierro, cobre y zinc. De hecho, el uso de rayos X duros proporciona una gran profundidad de penetración para crear imágenes de células enteras hidratadas congeladas de una manera libre de etiquetas. Además, al proporcionar acceso al borde K de la mayoría de los elementos de interés, la fluorescencia de rayos X se excita de la manera más eficiente. El uso de enfoques criogénicos permite la reducción del daño por radiación y la optimización de la preservación de la estructura celular y la distribución elemental.
La mayoría de las técnicas analíticas resueltas espacialmente disponibles para estudiar metales en células son técnicas superficiales que requieren secciones muy delgadas y planas de las células que se van a producir. Esto abarca principalmente la microscopía electrónica de transmisión de escaneo con análisis de rayos X de dispersión de energía (STEM-EDX), microscopía electrónica de transmisión filtrada por energía (EF-TEM) y espectrometría de masas ióncasecundaria a nanoescala (nanoSIMS). Esto último no se puede realizar en secciones celulares congeladas e hidratadas, mientras que el crioanálisis se puede hacer con microscopía electrónica con una resolución espacial insuperable pero poca sensibilidad elemental. La emisión de rayos X inducida por partículas (PIXE) ha permitido el estudio de distribuciones elementales en células enteras. Tiene la ventaja de ser totalmente cuantitativo con una sensibilidad elemental justa a escala de micras e incluso en la resolución submicras4,pero sufre de daño por radiación y falta de capacidades criogénicas para estudiar células hidratadas congeladas. Todas estas técnicas analíticas se complementan entre sí en la toma de imágenes elementales de las células, pero para todas las técnicas el procedimiento de preparación de la muestra es un paso crucial. Debe mantenerse simple de limitar la posible contaminación, así como la redistribución elemental y / o fugas para obtener resultados significativos. Como se demuestra en la microscopía electrónica, un flujo de trabajo criogénico, incluyendo crio-inmovilización de la célula y criotransferencia a una etapa crioescaneada, permite una preservación elemental óptima a niveles subcelulares lo más cercanos posible al estado nativo5,6,7,8,9,10. Esta comprensión se ha implementado con éxito en el desarrollo de la microscopía de rayos X crio-blando sincrotrón (por ejemplo, microscopios de campo completo y microscopios de exploración) para producir imágenes ultraestructurales de células enteras hidratadas congeladas en 2D o 3D. Varios flujos de trabajo criogénicos fueron desarrollados11 para microscopios de rayos X blandos en Beamline 2.1 (XM-2) de la Fuente de Luz Avanzada en el Laboratorio Nacional Lawrence Berkeley12, haz lensia U41-XM en el anillo de almacenamiento de electrones BESSY II (Alemania)13, haz línea MISTRAL de la fuente de luz ALBA (España)14,y en Beamline B24 de la fuente de luz Diamond15,entre otros. Recientemente se demostró que un flujo de trabajo similar era el método de preparación y conservación más fiable para el análisis elemental intracelular utilizando microsondas de rayos X16,17.
Aunque las técnicas de nanosonda de rayos X están empezando a ser ampliamente utilizadas para el análisis elemental celular, particularmente con la llegada de las capacidades criogénicas SR-XRF, no se ha difundido ningún protocolo escalonado hasta ahora a la comunidad de investigación. Aquí, se proporciona un procedimiento detallado para preparar células adherentes criofijadas cultivadas como monocapas en membranas de nitruro de silicio para ser analizadas en condiciones criogénicas. También se proporciona un paso de secado por congelación después del protocolo en caso de que el análisis de rayos X se realice a temperatura ambiente. Mientras que el protocolo propuesto se ha utilizado con éxito con las células de cáncer de mama humano MD-MB-2312 y el secado por congelación se demostró entre otros en las neuronas de ratón18,20,21, se puede extender fácilmente a varios tipos de células humanas o animales.
Protocolo
Los procedimientos experimentales fueron aprobados por el comité de cuidado animal de la División de Ciencias de la Vida de la CEA (CETEA, A14-006). Se llevaron a cabo de conformidad con la legislación francesa y la Directiva del Consejo de la Comunidad Europea de 24 de noviembre de 1986 (86/609/CEE).
1. Preparación de soporte de membrana de nitruro de silicio (Si3N4)
NOTA: Debido a que la membrana es frágil y delicada, su soporte (marco de silicio de 200 m de espesor) tiene que ser manejado suavemente, idealmente con unas pinzas finas de carbono o pinzas de dumont #5, puntas finas de autocierre rectas. Este protocolo utiliza membranas de nitruro de silicio con un marco de 5 mm x 5 mm y un tamaño de membrana de 1,5 mm x 1,5 mm. La membrana debe prepararse aproximadamente 12 h antes de iniciar el experimento (es decir, la sembración celular). Las membranas se pueden preparar al final del día y dejar secarse durante la noche bajo una campana de flujo laminar de clase II para que estén listas para usar se a la mañana siguiente. Un espesor de marco de silicio de 200 m es estándar para la mayoría de las empresas que venden ventanas de nitruro de silicio. Si el producto utilizado en este protocolo no está disponible, se puede utilizar un tamaño de membrana en el rango de 0,5 x 1,5 mm con un tamaño de bastidor estándar de 5 mm x 5 mm. El tamaño de membrana más grande se prefiere cuando se utilizará la tomografía de rayos X. También se pueden utilizar ventanas de nitruro de silicio tipo rejilla TEM con un tamaño de membrana de 0,5 mm y un espesor de 50 nm.
- Abra la cápsula que contiene el soporte de membrana Si3N4 (Figura 1). Apriete suavemente la cápsula para aflojar ligeramente el soporte.
- Sostenga una de las esquinas del marco de silicio usando las pinzas delgadas. Tenga cuidado de no tocar la membrana Si3N4 en el centro. La membrana de 200 o 500 nm de espesor puede dañarse fácilmente.
- Usando las pinzas delgadas, coloque suavemente el soporte de membrana Si3N4 en un plato Petri de vidrio estéril, superficie plana de la ventana de nitruro de silicio hacia arriba (es decir, la cavidad frente a la parte inferior del plato).
- Retire la tapa de la placa Petri y deje las membranas bajo luz UV durante 25 x 30 minutos debajo del armario de flujo laminar.
NOTA: La luz UVC (254 nm) se establece normalmente en 200 W/cm2. - Poner 10 l de poli-L-lisina en la membrana. La gota debe cubrir bien la membrana Si3N4 y puede extenderse un poco sobre el marco de silicio. Déjalo a 37oC durante 25 min en la incubadora de cultivos tisulares estándar a 100% de humedad relativa y 95% de aire, 5% CO2.
NOTA: En este caso se utilizó un recubrimiento de poli-L-lisina para las células de cáncer de mama MDA-MB-231. Dependiendo del tipo de línea celular, se pueden utilizar varios recubrimientos, y este paso debe optimizarse en consecuencia. - En una placa estéril de 48 pocillos, llene diferentes pozos con 200 x 250 ml de agua ultrapura y ultratraza filtrada a través de un filtro estéril de 0,22 m. Típicamente, cada poca puede ser utilizado para enjuagar hasta 2 x 3 membranas. Usando pinzas finas, recoja el soporte de la membrana en una esquina de su marco de silicio. Enjuague suavemente la membrana sumergiéndola verticalmente 10 s en tres pozos sucesivos.
NOTA: Los soportes de membrana se sacan de la incubadora y se pueden procesar a temperatura ambiente, con la temperatura y la humedad definidas por una campana de flujo laminar de clase II. - Coloque el soporte de membrana verticalmente en un pozo vacío de una placa estéril de 96 pozos, cúbralo y déjelo secar durante la noche bajo una campana de flujo laminar de clase II.
2. Sembrado celular
- En una placa estéril de 4 pocillos, coloque las membranas con su lado plano haciaarriba.
- Las células MDA-MB-231 se mantienen en un cultivo monocapa en DMEM con fenol rojo/Glutamax I, complementado con 10% de suero de ternera fetal y 1% de penicilina y estreptomicina a 37oC en una incubadora humidificada al aire 5% CO2.
- Cuando las células alcancen una confluencia del 60%, retire el medio del plato o del matraz.
- Lavar 1x con 10 ml de solución salina tamponada de fosfato de Dulbecco sin Ca2+ o Mg2+.
- Agregue 3 ml/T75 matraz de 0.05% de solución trypsin/EDTA y asegúrese de que toda la monocapa está cubierta con la solución de trippsina.
- Incubar durante 3 x 5 min a 37 oC hasta que las células comiencen a desprenderse. Se debe tener cuidado de no sobre-trippsinizar las células y no forzar las células a separarse prematuramente.
- Añadir 8 ml de DMEM suplementado con 10% de suero de ternera fetal y 1% penicilina y estreptomicina o medios completos y recoger las células mediante pipeteo. El suero en los medios neutralizará la trippsina.
- Gire hacia abajo a 250 x g durante 3 minutos a temperatura ambiente. Aspira al sobrenadante.
- Añadir 8 ml de medios completos frescos al tubo de 15 ml que contiene el pellet celular, y canalizar las células hacia arriba y hacia abajo hasta que las células se dispersen en una sola suspensión celular.
- Contar las células usando un hemocitómetro y diluir a una concentración de 5 x 106 células por ml en medios completos (DMEM con Fenol Rojo/1% de un dipéptido L-alanil-L-glutamina de 200 mM en solución de NaCl 0.85% complementado con 10% de suero de ternera fetal y 1% penicilina y estreptomicina).
- Tomar 10 l de la suspensión celular MDA-MB-231 y depositarla en la membrana. Esto corresponde a 50.000 celdas/10 l para MDA-MB-231. La gota debe cubrir bien la membrana Si3N4 y puede extenderse un poco en el marco de silicio. Se debe tener cuidado de no tocar la membrana Si3N4 con la punta del micropipeta.
NOTA: Dependiendo del tipo de línea celular y los experimentos o mediciones, la densidad celular puede variar y debe probarse en consecuencia. Aquí, la densidad celular propuesta para la sembración de la membrana Si3N4 se encontró óptima para las condiciones experimentales y el nanoanálisis SR-XRF de las células MDA-MB-2312. - Para las neuronas del hipocampo (HN), extraiga el tejido cerebral del hipocampo de los ratones del día embrionario 18,5 y digerirlo en 0,25% de trippsina en Hepes-HBSS (5,3 mM de KCl, 0,44 mM KH2PO4, 137,9 mM NaCl, 0,34 mM NaH2PO4, 5,56 mM de glucosa) a 37 oC durante 15 min18,19.
- Usando una pipeta P1000 con una punta P1000 y una punta P200, realice la disociación mecánica dibujando y soltando el contenido del cono con la pipeta varias veces. Durante este paso, tenga cuidado de no crear burbujas de aire en el medio, porque las burbujas de aire son tóxicas para las neuronas.
- Espere unos minutos hasta que el agregado se asiente en la parte inferior del tubo.
- Transfiera el sobrenadante que contiene las células dispersas a un tubo estéril de Eppendorf. Deje 25 l de medio de cultivo que contenga el agregado.
- Cuente las células disociadas usando un hemocitómetro. Las neuronas HN aisladas se nivelan a una concentración de 7 x 104 células cm-2 en membrana de nitruro de silicio recubierto de poli-L-lisina (1 mg/ml poli-L-lisina).
- Sólo para membranas con HN, incubar las neuronas en primer DMEM complementado con 10% de suero bovino fetal. Una h después de la platinado HN en DMEM, el medio se cambia a medio de chapado neurobasal (200 mM L-alanil-L-glutamina dipéptido en 0.85% NaCl solución, y B27 suplemento d a 1/50 diluido en Neurobasal)18,19.
- Para las células MDA-MB-231, coloque los soportes de membrana a 37 oC en la incubadora (100% de humedad relativa, 95% de aire y 5% CO2) durante 25 min. Esto permite que las células se asienten y comiencen a adherirse al sustrato. Esto puede ser adaptado dependiendo de la línea celular utilizada.
- Añadir 1 ml del medio de cultivo completo requerido (DMEM con Phenol Red/1% de un dipéptido L-alanil-L-glutamina de 200 mM en solución de NaCl al 0,85% complementado con 10% fetal suero de ternero y 1% penicilina y estreptomicina) en cada pocal de las células MDA-MB-231 poniendo la punta de la pipeta contra la pared del pozo de plástico y liberando el medio muy lentamente mientras cubre la membrana.
- Coloque la membrana vertical contra la pared de la placa de 4 pocillos para eliminar las burbujas de aire atrapadas en la cavidad del pozo de la membrana Si3N4 (Figura 2). Para ello, utilice pinzas finas y empuje la burbuja muy suavemente, moviéndose paralelamente al marco trasero si3N4 para evitar tocar y dañar la membrana.
- Vuelva a colocar la membrana horizontalmente en la parte inferior del pozo y deje la placa de 4 pocillos en la incubadora durante el tiempo requerido dependiendo de la tasa de crecimiento de la línea celular utilizada. Las células MDA-MB-231 fueron incubadas durante la noche.
3. Tratamiento o cambio medio
- Retire el medio de la placa de 4 pozos.
- Enjuagar una vez con 1 ml de solución de PBS a 37 oC. Deseche el PBS y agregue 1 ml de medio fresco completo calentado en presencia o en ausencia (controles) del tratamiento deseado utilizando una punta de pipeta de 1 ml, liberando el líquido muy lentamente contra la pared de la placa del pozo. La membrana Si3N4 debe sumergirse lentamente sin ninguna perturbación para evitar el movimiento de la membrana o el levantamiento.
4. Crio-inmovilización de la preparación celular por congelación por inmersión
NOTA: Al final del tiempo de incubación requerido, en presencia o ausencia de tratamiento, las células tienen que ser cuidadosamente enjuagadas y criofijadas. Alrededor de 30 minutos antes de comenzar a enjuagar y borrar la preparación celular antes de la congelación por inmersión, primero configure y enfríe la máquina de congelador automático. A medida que manipula criógenos, se requiere el uso de guantes criogénicos apropiados, gafas de seguridad, zapatos cerrados y un abrigo de laboratorio. El nitrógeno líquido debe transportarse en Dewars apropiados, y el lugar de trabajo debe estar suficientemente ventilado con la presencia de un monitor de oxígeno. Idealmente, un bajo nivel de higrometría de 20-30% ayuda a limitar la contaminación por hielo de los materiales, Dewars, y criógenos, que es perjudicial para la vitrificación de las muestras (es decir, una capa de hielo amorfa). Idealmente, dependiendo del nivel de experiencia del investigador, se pueden preparar hasta 10 a 12 muestras para una sola sesión utilizando la misma copa de etano líquido criogena secundario para la vitrificación. Entre sesiones, el congelador de inmersión automático requiere un procedimiento de horneado automático de 1 h. Idealmente, las muestras deben procesarse con condiciones de incubación idénticas. Aún así, los controles se pueden procesar primero, seguidos de las muestras con una condición de tratamiento particular.
NOTA: Para la congelación por inmersión, los siguientes pasos se aplican tanto a las células MDA-MB-231 como a las células HN.
- Preparar el crioplunger para la criofixación rápida de las células.
- Encienda el congelador de inmersión automático.
- Introduzca los parámetros (por ejemplo, temperatura, porcentaje de humedad, tiempo de hinchado si se utiliza la hincha automática y la posición para levantar la muestra a la superficie del criógeno para facilitar la transferencia a un recipiente criogénico) directamente desde la consola y los parámetros menú de ajustes. En el caso de autos, los parámetros de la cámara de humedad se fijaron en 37 oC y 80% de humedad.
NOTA: Se obtuvieron mejores resultados de vitrificación para este protocolo y las imágenes de rayos X con una hincha manual rápida y cuidadosa. Por lo tanto, el protocolo no utiliza un programa de secuencia de hincha automática. - Fije la cámara del humidificador y para preservar la humedad primero llénela con una jeringa con 60 ml de agua de doble destilación, y luego 20 ml como se pide en la consola automática del congelador de inmersión.
NOTA: Evite el uso de agua ultrapura porque puede dañar el sistema de vaporizador. Cierre la válvula y deje el tubo unido en la parte posterior del humidificador. - Instale la copa de etano negro en su soporte y cúbrala con las tapas de plástico.
- Llenar el Dewar de la cámara fría con LN2,llevándolo al nivel de la rejilla dentro del área de trabajo.
- Coloque una crio-caja dedicada para almacenar las membranas después de la criofixación en el recipiente de transferencia que se mantiene en el lugar dedicado en el área de trabajo de EM-GP y cerca del soporte de la copa de etano.
NOTA: La crio-caja dedicada es un desarrollo interno en la línea de haz de nanosonda ID16A de la radiación sincrotrón europea en Grenoble. Los dibujos con especificaciones están disponibles bajo petición(Figura 3). Se pueden almacenar cuatro a la vez en un tubo cónico de 50 ml para su almacenamiento a largo plazo en un LN2 Dewar. Una posibilidad alternativa consiste en utilizar un pequeño tubo de pared delgada PCR regular de 0,2 ml con tapas de domo para almacenar un solo soporte de membrana Si3N4. Usted tendrá que perforar un agujero de 2 mm en la parte superior del tubo de pared utilizando una aguja de jeringa calentada para permitir que LN2 llene el tubo. - Llene el recipiente de transferencia con LN2 y cúbralo con la tapa de aluminio dedicada. Continúe llenando la cámara de frío con LN2 (normalmente se necesitan 2 L) manteniendo al 100% la pantalla del monitor de nivel LN2 en la consola. Espere hasta que se alcance la temperatura final requerida.
- Retire la tapa de plástico y cubra la taza de etano con el licuador conectado a la botella de etano. Espere hasta que la temperatura de la copa de etano se equilibe hasta el punto de consigna de temperatura. Cuando se llegue, comience a usar el criógeno secundario (es decir, etano licuado).
NOTA: El punto de consigna utilizado fue de -180 oC, ligeramente por encima del punto de fusión de etano (-182,8 oC). No es necesario preenfriar el licuador de etano porque puede ser una fuente de formación de heladas y contaminación de la copa de etano. - Abra la válvula principal de la botella de etano de alta pureza y abra muy lentamente el regulador de presión hasta obtener una niebla lenta de etano. Mantenga este flujo muy bajo hasta que se acumule el etano líquido. Llene la taza hasta su borde superior. Cierre el regulador de presión y la válvula principal de la botella de etano. Retire el licuador Leica con cuidado y déjelo a un lado en un pequeño soporte de poliestireno debajo de la campana de humo. Mantenga el área de trabajo libremente cubierta con la tapa de poliestireno negro provista de la máquina para evitar la contaminación por heladas del área de trabajo y del recipiente de etano.
- Justo antes de la hincha manual de la muestra, retire la tapa de poliestireno negro y del menú de la prensa de la consola"Cámara inferior",que pone la cámara ambiental en contacto con el área de trabajo criogénica.
- Prepárese para borrar la muestra.
- Prepare el tampón adecuado para eliminar los restos de sales del medio de cultivo. Para este protocolo, se utilizó un tampón de acetato de amonio para enrmadrear las células MDA-MB-231.
NOTA: El tampón de acetato de amonio es adecuado para la mayoría de los tipos de células, y no se añade a la señal de fluorescencia de rayos X (considerando elementos con Z > 9). Algunas líneas celulares particulares, como las células neuronales, pueden requerir el uso de un búfer dedicado. Por ejemplo, para las neuronas corticales primarias, se puede utilizar una solución salina de 1,8 de volumen de 0,5 M Na2HPO4 y 1,9 de 0,5 M NaH2PO4 de 15. Por otro lado, el fósforo o el cloro contenidos en el tampón contribuirán al espectro XRF. Esta limitación de las líneas de emisión de rayos X no esenciales debe tenerse en cuenta en función de los elementos de interés que deban detectarse. - Preparar una solución de acetato de amonio de 150 mM a partir de solución ultrapura de acetato de amonio y comprobar si hay pH (7,0–7,3) y osmolaridad (270–300 mOsm/kg)
NOTA: La osmolaridad mencionada anteriormente es equivalente a la solución salina tampón de fosfato de Dulbecco (D-PBS) sin calcio y magnesio y se puede comprobar con un micro-osmómetro. - Rellene el número requerido de pozos de una placa de plástico de 12 pocillos con el tampón de acetato de amonio.
- Corte una cuarta parte del papel de filtro para la hincha, ya sea del papel de filtro No. 1 con un orificio precortado, o del papel de filtro perforado manualmente de un diámetro de 55 mm con un orificio central de 15 mm.
- Sacar la muestra requerida almacenada en la incubadora a 37oC en el último momento antes de encierreye y congelación por inmersión de la membrana.
- Desbloquee las pinzas con el anillo de sujeción negro de los fórceps de liberación rápida (normalmente un anillo de sujeción Dumont de pinzas médicas de alta precisión) y agarre el soporte de membrana Si3N4 del pozo de cultivo.
NOTA: Agarre el centro del marco de silicio, manteniendo la punta de las pinzas cerca de la membrana. Mueva el anillo de la abrazadera negra hacia abajo hasta las primeras rayas para bloquear las pinzas. - Sumerja el soporte de membrana Si3N4 verticalmente en la solución tampón de acetato de amonio mantenida a 37 oC durante 5 s.
NOTA: El soporte debe permanecer vertical en el búfer. Tenga en cuenta que la solución tampón en cada pocal de la placa se puede utilizar para hasta tres membranas para las mismas condiciones de incubación. - Blot manualmente con papel de filtro para drenar el exceso de tampón de la solución de enjuanado de membrana(Figura 4) con el fin de dejar una capa delgada y homogénea de solución acuosa de acetato de amonio que cubra las células.
NOTA: Para ello, primero presione la parte posterior de la ventana sobre el papel del filtro para eliminar casi todo el tampón acuoso que queda en el pozo y la parte posterior de la membrana. En segundo lugar, blot el lado frontal, a partir de ambos lados de las pinzas, a continuación, cada lado del marco(Figura 4). Nunca toque la membrana. El exceso de tampón drenado se puede controlar con la aureola formada en el papel de filtro. - Abra la puerta de la cámara ambiental y monte rápidamente las pinzas, deslizándola en el enclavamiento de fórceps y cierre la puerta(Figura 5).
- Pulse "Blot/A plunge". Las pinzas que sostienen la membrana Si3N4 se sumergirán rápidamente en el criógeno.
- Retire la tapa del recipiente de transferencia con fórceps preenfriados.
- Pulse "Transferir". La membrana Si3N4 se moverá ligeramente por encima del criógeno.
- En un solo movimiento rápido, desconecte las pinzas deslizándolas fuera del enclavamiento de los fórceps y ligeramente inclinarse fuera del enclavamiento para llevar directamente a una ranura vacía de la crio-caja en el recipiente de transferencia lleno de LN2. Suelte el anillo de sujeción negro para liberar la membrana(Figura 5).
NOTA: El contenedor de transferencia siempre debe estar cubierto con LN2. Cuando se requiera una recarga, cubra la taza de etano con la tapa de plástico provista con la máquina para evitar mezclar LN2 y etano. - Cubra el recipiente de transferencia con una tapa y utilice una pequeña taza de poliestireno blanco llena de LN2 para transferirlo a una caja de poliestireno llena de LN2.
NOTA: La crio-caja o tubo que contiene las membranas puede almacenarse en tubos cónicos de 50 ml llenos de LN2 y transferirse a un almacenamiento a largo plazo LN2 Dewar. Antes de empezar a sumergirse, congele la siguiente muestra, caliente todas las pinzas frías y esmeriladas con un secador de pelo o un secador de placa caliente/crioherramientas (45 oC) para evitar la contaminación con cristales de hielo.
- Prepare el tampón adecuado para eliminar los restos de sales del medio de cultivo. Para este protocolo, se utilizó un tampón de acetato de amonio para enrmadrear las células MDA-MB-231.
5. Secado por congelación de células congeladas cultivadas en membranas de nitruro de silicio
NOTA: Para el secado por congelación, los siguientes pasos se aplican a las células MDA-MB-231 y HN. Para enfriar el secador de congelación, tendrá que esperar alrededor de 40 minutos a 1 h.
- Configurar el secador de congelación
- Encienda la unidad con el interruptor basculante situado en el panel posterior del instrumento.
- Empiece a introducir los parámetros siguiendo el menú LCD: Segmento 1 a 2 h a -120 oC; Segmento de rampa de 2 a 2 h de -120 oC a -80 oC; Segmento 3 a 2 h a -80 oC; Segmento rampa de 4 a 2 h de -80 oC a 50 oC; Segmento de 5 a 2 h a -50 oC; Segmento rampa de 6 a 6 h de -50 oC a 30 oC.
- Al final de la configuración del parámetro, guarde los ajustes, cierre la tapa de la cámara y pulse "START".
- La unidad bombeará hasta 1.10-5 mbar. Cuando se alcanza esta presión, la línea de comandos de la pantalla mostrará"Iniciar enfriamiento ahora, COMENZAR para continuar".
- Llene el nitrógeno líquido Dewar regularmente para enfriar el escenario por debajo del ajuste del triple punto de temperatura.
NOTA: La temperatura del triple punto de la etapa se establece en -140 oC. Antes de cargar la muestra para este protocolo, lo mejor es esperar aproximadamente 1 h y una etapa de temperatura de -160 oC. - La pantalla mostrará"Pulse ENTER"cuando esté listo para"Cargar muestra".
- Enfriar a temperatura de nitrógeno líquido dentro de un LN2 lleno de poliestireno Dewar, el soporte de transferencia de muestra proporcionado por el proveedor, y los dos soportes de membrana cilíndricos de latón adicionales Si3N4.
- Monte el soporte de latón de membrana Si3N4 enlaparte del soporte de transferencia de muestra proporcionado por el proveedor en el poliestireno Dewar(Figura 6A). Mantenga el nivel de LN2 a aproximadamente 1 x 2 mm por debajo del borde superior de la primera pieza de latón.
- Recoja un soporte de muestra de membrana Si3N4 de la crio-caja o del tubo PCR utilizando pinzas auto-cierre preenfriadas en inox o recubierta sin teflón.
- Deposite la membrana con el lado de la muestra de las células hacia arriba en la cavidad numerada del soporte de latón.
- Cubra el conjunto con la segunda pieza de latón como tapa(Figura 6C).
NOTA: Diseñamos dos discos de latón cada uno con un espesor de 5 mm, un diámetro de 50 mm y un orificio central de 11 mm de diámetro. El primer disco de latón tiene 14 ubicaciones rectangulares mecanizadas (8 mm x 6 mm) para acomodar soportes (5 mm x 5 mm). Cada ranura tiene un pozo plano y pulido con una profundidad de 2 mm. El segundo disco de latón es plano para cubrir el soporte de latón de membrana Si3N4 y actúa como una carcasa de trampa fría. - Enfriar previamente la varilla de transferencia en la caja de espuma de poliestireno rellenaL2 y utilizarla para bloquear el conjunto completo(Figura 6D,E).
- Pulse "ENTER" en el panel frontal de la secadora congelada.
- Las bombas turbo y rotativas se detendrán y la cámara purgada con gas nitrógeno seco para permitir la apertura de la tapa de la cámara.
- Transfiera inmediatamente el conjunto de transferencia de muestra con la varilla de transferencia con resorte a la cámara del secador de congelación y abórrelo en la etapa fría de cobre LN2.
NOTA: Deje el conjunto completo con la varilla de transferencia en la cámara. - Cierre inmediatamente la tapa de la cámara de congelación y pulse "START" para continuar con el ciclo de secado por congelación.
- Llene el depósito LN2 del secador de congelación manualmente cada 2 h.
NOTA: Se puede conectar un sistema de llenado automático LN2 a este depósito. - Al final del ciclo de secado por congelación, pulse"STOP"para ventilar la cámara y retire el conjunto completo para acceder a las muestras liofilizadas.
Resultados
En la Figura 7Ase muestra una vista típica del microscopio de vídeo óptico de células MDA-MB-231 hidratadas congeladas que fueron subcultivadas en un soporte de membrana Si3N4 recubierto de poli-L-lisina. La vista óptica de la muestra en la cámara de vacío se obtuvo en modo de reflexión utilizando el microscopio de vídeo en línea dedicado de la línea de haz ID16A de la ESRF22. Mientras que la microscopía de rayos X blanda o electrónica requiere que la capa de hielo que incrusta la célula sea lo más delgada posible (normalmente <0,5 m), los rayos X duros (>10 keV) tienen la ventaja de una profundidad de penetración mucho mayor y una deposición de dosis más baja. Por lo tanto, el espesor del hielo puede ser más grande, normalmente <10 m incluyendo la célula para que el hielo que incrusta la célula sea de unos pocos m de espesor. Esto se puede estimar a través de la intensidad de rayos X medida en la transmisión en comparación con la intensidad sin la muestra, teniendo en cuenta la absorción de la membrana de 500 nm de espesor Si3N4. Este espesor de hielo se puede lograr a través de la hincha manual como se describe en el protocolo actual. En la región de los anillos de Newton, el espesor del hielo puede ser aún más delgado (no medido).
El mapeo elemental de fluorescencia de rayos X de la célula hidratada congelada se muestra en la Figura 7B con las distribuciones representativas de elementos fisiológicos como potasio (K), azufre (S) y zinc (Zn). Estos mapas representan la masa areal elemental (es decir, la masa proyectada elemental). Aunque no se hace en el presente caso, dichos mapas pueden normalizarse mediante imágenes de contraste de fase basadas en la propagación de rayos X que proporcionan la estimación de la masa proyectada de la muestra23. Como se informó en muchos estudios, se supone que el ion K altamente difusible en células conservadas en su estado casi nativo se distribuyó homogéneamente a lo largo de toda la celda23,24,16. Como se muestra en las imágenes elementales de fluorescencia de rayos X 2D en la Figura 7B, el elemento firmemente unido S se distribuyó uniformemente dentro de la célula, de forma similar a K, y representa una buena estimación del perfil de masa celular. La distribución Zn tenía una señal más alta en el núcleo que en el citosol y delineó claramente el núcleo. Cabe señalar que las pequeñas regiones enriquecidas con Zn se pueden detectar en la resolución espacial (50 nm) en la región nuclear.
Las nanosondas de rayos X existentes o las que se van a construir no se adaptan necesariamente a las capacidades criogénicas. En este caso, la mejor alternativa para obtener imágenes de fluorescencia de rayos X de células a resoluciones espaciales inferiores a 100 nm es realizar un procedimiento de secado por congelación descrito en este protocolo después de la congelación por inmersión de la célula. La Figura 8A muestra una vista típica de la microscopía de campo brillante de las neuronas del hipocampo primario salinadas con liofilidad resultantes cultivadas directamente en la membrana Si3N4. En este caso, si se almacenan en una cámara limpia desecada, las muestras se pueden preparar con 1 a 2 semanas de antelación y se observan con un microscopio óptico vertical ordinario para el registro de las regiones de interés. Se debe tener cuidado para evitar la exposición a la humedad ambiental, ya que puede ser capturada por la muestra liofilizada y provocar daños bajo el nanohaz de rayos X. Este procedimiento se aplicó con éxito a células muy sensibles (es decir, células neuronales) e incluso mejores resultados se obtuvieron con otros tipos más robustos de células, como las células cancerosas. En cuanto a las células congeladas, las imágenes de fluorescencia de rayos X de K, S y Zn en toda la pantalla de células liofilizadas son similares a las descritas anteriormente. Son representativos de las distribuciones elementales que se encuentran en varios tipos de células liofilizadas a una resolución espacial de 50 a 100 nm. Mientras que el secado por congelación de células enteras es una alternativa para preservar la integridad elemental, es a expensas de una preservación perfecta de la morfología celular16,particularmente las membranas celulares.

Figura 1: Soporte típico de la muestra para el nanoanálisis de fluorescencia de rayos X. Un soporte de membrana Si3N4 en su cápsula protectora. Este tipo de sustrato se puede utilizar tanto para el análisis de la temperatura ambiente (preparación celular de congelación de inmersión seguida de baja temperatura y proceso de secado por congelación al vacío bajo) o para el análisis de fluorescencia criogénica de rayos X. Haga clic aquí para ver una versión más grande de esta figura.
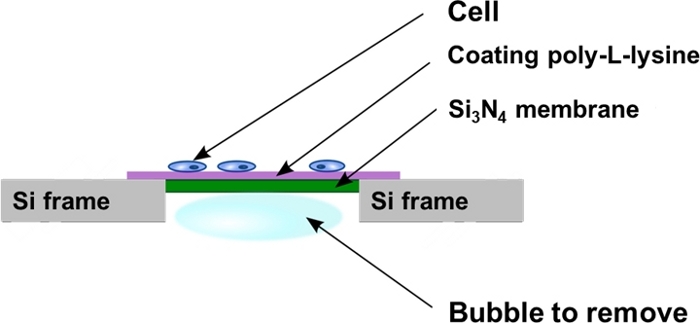
Figura 2: Vista esquemática de las ventanas de nitruro de silicio después de la sembración celular. Las células se cultivan directamente sobre la superficie plana recubierta de poli-L-lisina del soporte de membrana Si3N4. A veces las burbujas de aire pueden quedar atrapadas en la cavidad posterior del soporte de membrana Si3N4 y tienen que ser removidas como se describe en el protocolo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: La criocaja impresa en 3D desarrollada internamente para el almacenamiento a largo plazo de soportes de membrana Si3N4 congelados por inmersión en nitrógeno líquido Dewar. (A) Cryo-box desmontado con el recipiente y las tapas (parte inferior) y (B) la crio-caja montada con tapas bloqueadas. Las tapas se pueden manipular con las pinzas, abriendo o bloqueando por rotación. Un plan detallado para la impresión 3D está disponible a petición de ESRF ID16A. El diseño se ha realizado para acomodar rejillas TEM de nitruro de silicio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Manchadeo de células cultivadas en Si3N4. Antes de congelar la célula monocapa cultivada en una membrana Si3N4 debe enjuagarse en solución de acetato de amonio (A) y se borró cuidadosamente manualmente con papel de filtro (B). Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Máquina automática EM-GP de congelación por inmersión. (A) El congelador de inmersión automático. (B) Cámara ambiental con las pinzas fijadas. (C) La copa de etano cubierta con el licuador Leica conectado a una botella de etano. (D) El gabinete de congelación por inmersión que muestra la copa negra llena de etano licuado y la crio-caja para su posterior almacenamiento en LN2 de las membranas Vitrificadas Si3N4. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Conjunto de criotransferencia de muestra para procedimiento de secado por congelación. (A) El primer recipiente de latón para membranas Si3N4 está montado encima del soporte de transferencia de muestra proporcionado por el proveedor de secadores de congelación. (B) y (C) muestran que el segundo disco de latón plano se utiliza como cubierta y actúa como una carcasa de trampa fría que se insertará en la carcasa de vacío del secador de congelación. (D) El conjunto completo con la varilla de transferencia con resorte. (E) El portamuestras que lleve la preparación celular vitrificada cultivada en la membrana Si3N4 debe insertarse en el secador de congelación refrigerado LN2. Todos los pasos para montar el montaje se realizan en LN2 en una caja de espuma de poliestireno. Para mayor claridad, todas las imágenes se produjeron en ausencia de LN2. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Imágenes de fluorescencia de rayos X crio-X de una célula hidratada congelada utilizando nanosonda de rayos X duros. (A) Vista en línea típica en modo de reflexión utilizando el microscopio de vídeo óptico dedicado de la línea de haz ESRF ID16A. Después de la hincha manual, se logró un espesor total de hielo de aproximadamente 5 x 10 m que permite una visión clara de las células hidratadas congeladas. Una región con anillos Newton indicativos de hielo aún mucho más delgado es notable. (B) Distribuciones celulares representativas de la fluorescencia crio-X-rayo de los elementos fisiológicos potasio (K), azufre (S) y zinc (Zn). Haga clic aquí para ver una versión más grande de esta figura.
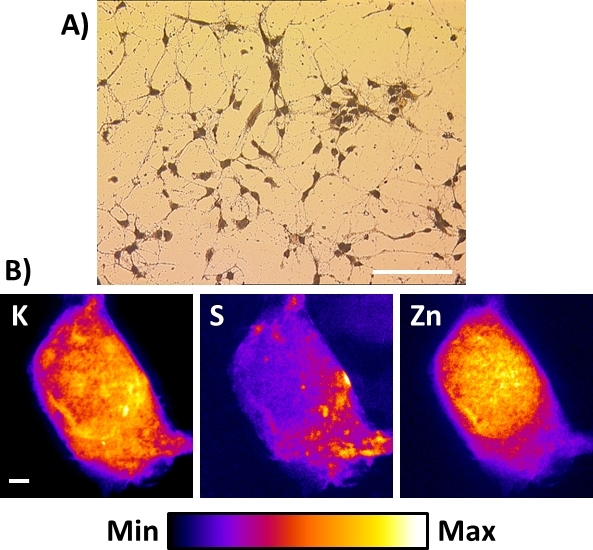
Figura 8: Imágenes de fluorescencia de rayos X de una célula neuronal liofilizada utilizando nanosonda de rayos X duros. (A) Vista típica de la microscopía de campo brillante de las células neuronales corticales primarias liofilizadas resultantes cultivadas directamente en la membrana Si3N4. Barra de escala a 200 m(B) Imágenes representativas de la fluorescencia de rayos X a temperatura ambiente de una sola neurona hipocampal liofilizada que muestra las distribuciones de los elementos fisiológicos de potasio (K), azufre (S) y zinc (Zn). Barra de escala de 2 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
La microscopía crioelectrónica (crio-EM) ganó el Premio Nobel de Química 2017 y como tal el desarrollo realizado por J. Dubochet sobre la vitrificación de material biológico para la determinación de la estructura de alta resolución de biomoléculas en la solución25. Como informó Dubochet en su conferencia del Nobel "Saber cómo vitrificar una gota de agua es una cosa, preparar una muestra biológica para la observación biológica es otra"25. Los pasos de criopreparación ahora se consideran la técnica estándar para mitigar el daño de la dosis de radiación y estudiar las células cerca de su estado nativo. Sin embargo, la preparación sigue siendo tediosa. Esto se debe a que la microscopía electrónica, debido a su resolución espacial insuperable, es sensible a cualquier artefacto ultraestructural que se produce durante la preparación de la muestra. Los crionanos de sincrotrón se están acercando ahora a dificultades similares que bajan a resoluciones espaciales tan bajas como 13 nm en el rango de rayos X de alta energía26. La microscopía de rayos X dura puede analizar células enteras, mientras que la microscopía electrónica sufre de la poca profundidad de penetración de los electrones, lo que permite observar solo rebanadas de células muy delgadas.
Las monocapas de células son lo suficientemente delgadas como para que al congelarse por inmersión en el etano líquido, se alcancen las tasas de enfriamiento necesarias para la vitrificación del agua. En teoría, las tasas de enfriamiento tan altas como 108 K/s son posibles utilizando la congelación de alta presión27 que permite la vitrificación de muestras demasiado gruesas para la congelación por inmersión. Una velocidad de enfriamiento de 105 K/s, necesaria para permitir la vitrificación completa de la muestra a presión ambiente28,se alcanza reproduciblemente utilizando la máquina de congelación automática y los parámetros presentados aquí. Esto permite a un investigador vitrificar muestras biológicas delgadas (<10 m) como una monocapa de células12,13,14,15,29,30 por congelación por inmersión en etano líquido.
Un desafío importante con este protocolo es también preservar en la medida de lo posible la integridad química del contenido intracelular para proporcionar distribuciones elementales confiables dentro de la célula en 2D o 3D. Como se publicó en otros lugares2,16,17,31, en el caso de la toma de imágenes elementales a nivel subcelular, se debe considerar el análisis de las células hidratadas congeladas. De lo contrario, la combinación de congelación por inmersión y secado por congelación de células se puede utilizar para el análisis de la temperatura ambiente. Para este último, el hielo amorfo se elimina a través del proceso de sublimación, mientras que las moléculas de agua enlazadas se eliminan a través del proceso de desorción. Este proceso puede estar lejos de ser ideal en comparación con las muestras hidratadas congeladas debido a la posible alteración de las membranas celulares y la morfología de algunas estructuras subcelulares32. Además, para estudios de especiación, la extracción de agua puede conducir a artefactos de especiación de metal. Aún así, ha tenido éxito y la mejor alternativa a las muestrashidratadas congeladas para imágenes elementales en niveles sub-100 nm2,16,17,18,20,33,34,35,36.
Como se ha informado37, la calidad de las preparaciones celulares crioconservadas se puede evaluar a través de la relación potasio-sodio K / Na. Desafortunadamente, todavía no se puede determinar con la nanosonda de rayos X dura utilizada aquí, debido al corte de baja energía del detector de deriva de silicio utilizado para detectar los fotones de fluorescencia de rayos X de los elementos (E 1.3 keV magnesio). De hecho, una alta relación K/Na (>10) que se puede medir utilizando TOF-SIMS, EPMA o microsonda nuclear PIXE16,37 es indicativo de la integridad química preservada de la célula en comparación con el K/Na esperado de 25 en una celda viva37. Esto puede ser apoyado por una relación cl/K baja concomitante38. Sin embargo, la vitrificación imperfecta, especialmente si la velocidad de enfriamiento de la muestra es demasiado baja, puede conducir a la formación de grandes cristales de hielo que pueden dañar las membranas celulares y los orgánulos, alterando en consecuencia la distribución de elementos químicos. Aunque no existe un procedimiento rutinario para monitorear este daño potencial e impacto en la distribución intracelular, las proporciones elementales anteriores y la posibilidad de tomar imágenes de la célula a alta resolución utilizando contraste de fase de rayos X o microscopía de rayos X crioblanda pueden ser los mejores enfoques para apoyar una buena preservación de los compartimentos intracelulares con preservación concomitante de la integridad elemental. La combinación de estas técnicas y el uso de microscopios ópticos de fluorescencia criocorrelativa recientemente desarrollados ayudarán a evaluar en qué medida se produce este daño y afecta a la distribución elemental intracelular.
En general, se presenta un protocolo detallado y completo para preparar muestras celulares para el nanoanálisis de fluorescencia de rayos X de sincrotrón. Es un buen punto de partida para la comunidad de investigación, ayudando a resolver el difícil problema de cómo preparar muestras celulares apropiadas para imágenes elementales 2D y 3D en nanosondas de rayos X duros (crio). Estos enfoques se pueden combinar con capacidades de fluorescencia óptica y microscopía electrónica para imágenes químicas y estructurales correlativas en profundidad de las células.
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Los experimentos en la línea de haz de nanoimagen ID16A se realizaron en el marco de las propuestas de ESRF LS2430, LS2303 y LS2765.
Materiales
| Name | Company | Catalog Number | Comments |
| Ammonium Acetate solution, BioUltra, for molecular biology, ~5M in H2O | SIGMA | 09691-250mL | One can prepare the required solution from high-grade ammonium acetate powder and ultrapure water, pH and osmolarity needs to be adjusted anyway. |
| B27 supplement, 50x | Life Technologies, Invitrogen | 17504-044 | for hippocampal neuron culture |
| Dulbecco’s Phosphate Buffered Saline, DPBS, ([-] CaCl2, [-] MgCl2) | GIBCO | 14190-094 | cell culture |
| DMEM with Phenol Red/Glutamax I (Medium ATCC modification) | GIBCO | 21885025 | cell culture |
| Dulbecco’s modified Eagle medium (DMEM) | Life Technologies, Invitrogen | 31966-02 | for hippocampal neuron culture |
| Dumont Tweezers #5, Straight Self-closing, 0.05x0.01mm Tips, Biology | World Precision Instrument | 501202 | |
| Emitech K750X Peltier-Cooled EM Freeze Dryer | Quorum Technology | EK3147 | |
| Ethane N45 | Air Liquid | p0505s05r0a001 | C2H6 > 99,995 % |
| Fetal Bovine Serum, Performance Plus, certified One Shot format, US origin | GIBCO | A31604-02 | cell culture |
| HBSS 10x | Life Technologies, Invitrogen | 14185-052 | for hippocampal neuron culture |
| Leica GP quick-release forceps | Leica | 16706435 | |
| MDA-MB-231 cell line, an epithelial, human adenocarcinoma breast cancer cell | ATCC | ATCC HTB-26 | cell culture |
| Neurobasal medium | Life Technologies, Invitrogen | 21103-049 | for hippocampal neuron culture |
| Nunc 4-Well Plate | Thermo Fisher | 176740 | cell culture |
| Osmo1 Single-Sample Micro-Osmometer | Advanced Instruments | Osmo1 | Alternative can be found at Fisher scientific (Wescor Inc. VAPRO® Vapor Pressure Osmometer) |
| Penicillin-Streptomycin | SIGMA | P4333 | cell culture |
| poly-L-lysine | SIGMA | P4707 | Other type of coating can be used that is dependent of the cell type to be cultured on the membrane, other adhesion factors such as fibronectin, collagen, polyornithine can be tested accordingly. Cell can be cultured directly on silicon nitride membrane, but the latter are slightly hydrophobic and adhesion factors are recommended unless the membrane are processed to be hydrophilic (glow plasma discharged). |
| Plunge freezing robot Leica EM GP main unit | Leica | 16706401 | Alternative for automated plunger are the Vitrobot Mark IV (FEI), CryoPlunge 3 (Gatan), MS-002 Rapid Immersion Freezer (EMS). Manual home-made system can be used but an environment-controlled chamber is an asset for plunge-freezing. |
| Silicon nitride membrane (Si3N4) | Silson Ltd. | SiRN-5.0(o)-200-1.5-500-NoHCl | The proposed silicon nitride membrane type is optimised for analysis at ID16A ESRF X-ray nanoprobe, The 500 nm thickness of the membrane was chosen being more robust for cellular manipulation and cryofixation detailed within this protocol. Membrane with thickness of 200 nm or below can also be used although quite fragile, and other design of silicon nitride membrane can be purchased (for example TEM compatible membrane...) from Sislon or other company such as Norcada, SPI supplies, Ted Pella, EMS, LabTech, Neyco... |
| Trypan blue solution 0.4% | GIBCO | 15250061 | cell culture |
| Trypsin-EDTA, 0.05% | GIBCO | 25300-054 | cell culture |
| Ultratrace Elemental Analysis Grade, Ultrapure Water | Fisher Chemicals | W9-1 | MilliQ water can be used but has to be tested for trace element level of contamination using for example ICP-MS analysis. |
| Whatman No. 1 filter paper with precut hole | Leica | 16706440 | Alternative filter paper may be used and must have an outer diameter of 55 mm, the Punch for filter paper system from Leica (ref.16706443) can be used. |
Referencias
- Lewis, D. J., et al. Intracellular synchrotron nanoimaging and DNA damage/genotoxicity screening of novel lanthanide-coated nanovectors. Nanomedicine. 5 (10), 1547-1557 (2010).
- Fus, F., et al. The intracellular localization of osmocenyl-tamoxifen derivatives in hormone-independent breast cancer cells revealed by 2D and 3D nano X-ray fluorescence imaging. Angwendte Chemie. , (2019).
- Janssens, K., Adams, F., Rindby, A. Microscopic X-Ray Fluorescence Analysis. , Wiley. Chichester, UK. (2000).
- Carmona, A., et al. Uranium exposure of human dopaminergic cells results in low cytotoxicity, accumulation within sub-cytoplasmic regions, and down regulation of MAO-B. Neurotoxicology. 68, 177-188 (2018).
- Leapman, R. D., Hunt, J. A., Buchanan, R. A., Andrews, S. B. Measurement of low calcium concentrations in cryosectioned cells by parallel-EELS mapping. Ultramicroscopy. 49 (1-4), 225-234 (1993).
- Saubermann, A. J., Echlin, P., Peters, P. D., Beeuwkes, R. Application of scanning electron microscopy to X-ray analysis of frozen hydrated sections. I. Specimen handling techniques. Journal of Cell Biology. 88 (2), 257-267 (1981).
- Saubermann, A. J., Heyman, R. V. Quantitative digital X-ray imaging using frozen hydrated and frozen dried tissue sections. Journal of Microscopy. 146, Pt2 169-182 (1987).
- Wroblewski, J., Roomans, G. M. X-ray microanalysis of single and cultured cells. Scanning Electron Microscopy. , Pt 4 1875-1882 (1984).
- Wroblewski, J., Müller, R. M., Wroblewski, R., Roomans, G. M. Quantitative X-ray microanalysis of semi-thick cryosections. Histochemistry. 77 (4), 447-463 (1983).
- Zierold, K. Cryopreparation of mammalian tissue for X-ray microanalysis in STEM. Journal of Microscopy. 125, Pt2 149-156 (1982).
- Harkiolaki, M., et al. Cryo-soft X-ray tomography: Using soft X-rays to explore the ultrastructure of whole cells. Emerging Topics in Life Sciences. 2 (1), 81-92 (2018).
- McDermott, G., Le Gros, M. A., Knoechel, C. G., Uchida, M., Larabell, C. A. Soft X-ray tomography and cryogenic light microscopy: the cool combination in cellular imaging. Trends in Cell Biology. 19 (11), 587-595 (2009).
- Schneider, G., et al. Three-dimensional cellular ultrastructure resolved by X-ray microscopy. Nature Methods. 7 (12), 985-987 (2010).
- Sorrentino, A., et al. MISTRAL: a transmission soft X-ray microscopy beamline for cryo nano-tomography of biological samples and magnetic domains imaging. Journal of Synchrotron Radiation. 22 (4), 1112-1117 (2015).
- Carzaniga, R., Domart, M. C., Duke, E., Collinson, L. M. Correlative cryo-fluorescence and cryo-soft X-ray tomography of adherent cells at European synchrotrons. Methods in Cell Biology. 124, Academic Press. 151-175 (2014).
- Perrin, L., Carmona, A., Roudeau, S., Ortega, R. Evaluation of sample preparation methods for single cell quantitative elemental imaging using proton or synchrotron radiation focused beams. Journal of Analytical Atomic Spectrometry. 30 (12), 2525-2532 (2015).
- Jin, Q., et al. Preserving elemental content in adherent mammalian cells for analysis by synchrotron-based x-ray fluorescence microscopy. Journal of Microscopy. 265 (1), 81-93 (2017).
- Daoust, A., et al. Impact of manganese on primary hippocampal neurons from rodents. Hippocampus. 24 (5), 598-610 (2014).
- Daoust, A., et al. Manganese Cytotoxicity Assay on Hippocampal Neuronal Cell Culture. Bio-protocol. 5 (1), 1368(2015).
- Gibon, J., et al. The over-expression of TRPC6 channels in HEK-293 cells favours the intracellular accumulation of zinc. Biochimica et Biophysica Acta (BBA)-Biomembranes. 1808 (12), 2807-2818 (2011).
- Hasna, J., Bohic, S., Lemoine, S., Blugeon, C., Bouron, A. Zinc Uptake and Storage During the Formation of the Cerebral Cortex in Mice. Molecular Neurobiology. , 1-13 (2019).
- Villar, F., et al. Nanopositioning for the ESRF ID16A Nano-Imaging Beamline. Synchrotron Radiation News. 31 (5), 9-14 (2018).
- Kosior, E., et al. Combined use of hard X-ray phase contrast imaging and X-ray fluorescence microscopy for subcellular metal quantification. Journal of Structural Biology. 177 (2), 239-247 (2012).
- Bohic, S., et al. Synchrotron hard X-ray microprobe: fluorescence imaging of single cells. Applied Physics Letters. 78, 3544-3546 (2001).
- Dubochet, J. On the Development of Electron Cryo-Microscopy (Nobel Lecture). Angwendte Chemie. 57 (34), 10842-10846 (2018).
- Da Silva, J. C., et al. Efficient concentration of high-energy X-rays for diffraction-limited imaging resolution. Optica. 4 (5), 492-495 (2017).
- Studer, D., Humbel, B. M., Chiquet, M. Electron microscopy of high-pressure frozen samples: bridging the gap between cellular ultrastructure and atomic resolution. Histochemistry and Cell Biology. 130 (5), 877-889 (2008).
- Moor, H. Theory and pratice of high pressure freezing. Cryotechniques in Biological Electron Microscopy. Steinbrecht, R. A., Zierold, K. , Springer. 175-191 (1987).
- Gilkey, J. C., Staehelin, L. A. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. Journal of Electron Microscopy Techniques. 3 (2), 177-210 (1986).
- Ferreira, J. L., Matthews-Palmer, T. R., Beeby, M. Electron Cryo-Tomography. Cellular Imaging. , Springer, Cham. 61-94 (2018).
- Colvin, R. A., Jin, Q., Lai, B., Kiedrowski, L. Visualizing metal content and intracellular distribution in primary hippocampal neurons with synchrotron X-ray fluorescence. PLoS One. 11 (7), 0159582(2016).
- Vavpetič, P., et al. Elemental distribution and sample integrity comparison of freeze-dried and frozen-hydrated biological tissue samples with nuclear microprobe. Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms. 348, 147-151 (2015).
- Guerquin-Kern, J. L., Bordat, C. Cryo-preparation procedures for elemental imaging by sims and eftem. Handbook of Cryo-Preparation Methods for Electron Microscopy. , CRC Press. 499-536 (2008).
- Gramaccioni, C., et al. Nanoscale quantification of intracellular element concentration by X-ray fluorescence microscopy combined with X-ray phase contrast nanotomography. Applied Physics Letters. 112 (5), 053701(2018).
- Perrin, L., et al. Zinc and Copper Effects on Stability of Tubulin and Actin Networks in Dendrites and Spines of Hippocampal Neurons. ACS Chemical Neurosciences. 8 (7), 1490-1499 (2017).
- Ortega, R., et al. α-synuclein over-expression induces increased iron accumulation and redistribution in iron-exposed neurons. Molecular Neurobiology. 53 (3), 1925-1934 (2016).
- Fartmann, M., et al. Quantitative imaging of atomic and molecular species in cancer cultures with TOF-SIMS and Laser-SNMS. Applied Surface Sciences. 231 (2), 428-431 (2004).
- Pålsgård, E., Lindh, U., Roomans, G. M. Comparative study of freeze-substitution techniques for X-ray microanalysis of biological tissue. Microscopy Research and Techniques. 28 (3), 254-258 (1994).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados