Method Article
תרבות התא על ממברנות הסיליקון נידהר וקריופיקציה עבור סינכרוטרון X-ray פלואורסצנטית ננו-ניתוח
In This Article
Summary
מוצג כאן הוא פרוטוקול עבור תרבות התא על ממברנות הסיליקון ניטריד ו-לקפוא לפני לפני הדמיה רנטגן קרני הקרינה עם סינכרוטרון nanoprobe רנטגן הקריוגני. כאשר רק טמפרטורת החדר בניתוח ננו מסופק, הדגימות הקפואות יכול להיות נוסף מיובש להקפיא. אלה הם צעדים קריטיים כדי לקבל מידע על הרכב היסודות תאיים.
Abstract
מעט מאוד ידוע על חלוקת יוני מתכת ברמה התת תאית. עם זאת, אלמנטים כימיים אלה יש פונקציות רגולטוריות חיוני הומאוסטזיס מופרע שלהם מעורב במחלות שונות. סינכרוטרון רנטגן של המדינה הארט nanoprobes לספק את הרגישות הנדרשת ואת הרזולוציה המרחבית כדי להבהיר את דו מימדי (2d) ו תלת מימדי (3d) הפצה וריכוז של מתכות בתוך תאים שלמים ב רמה ארגונית. זה פותח שדות מדעיים חדשים ומרגשים של חקירה על התפקיד של מתכות בphysiopathology של התא. ההכנה התאית היא מפתח ולעתים קרובות הליך מורכב, במיוחד לניתוח בסיסי. למרות שיטות הקרינה של X-ray נפוצים כעת, שיטות הכנה שונות שימשו, מחקרים מעטים מאוד חקרו את שימור התוכן הבסיסי של תאים בצורה הטובה ביותר, ולא פרוטוקול מפורט החורג של הקריופיקציה של תאים מחסיד עבור nanoprobes רנטגן הקרינה שוחרר עד כה. זהו תיאור של פרוטוקול המספק את ההכנה התאית החורגות עבור הקפאה מהירה כדי לאפשר סינכרוטרון X-ray פלואורסצנטית ננו ניתוח של תאים במצב רטוב קפוא כאשר סביבה קריוגניים והעברה זמין. במקרה ננו ניתוח צריך להתבצע בטמפרטורת החדר, הליך נוסף עבור הקפאת לייבש את ההכנה התאית קריוקבוע מסופק. הפרוטוקולים המוצעים השתמשו בהצלחה בעבודות קודמות, לאחרונה במחקר 2D ו-3D התפלגות תאיים של מתחם אורגנומתכתית בתאי סרטן השד.
Introduction
החדש תוכנן סינכרוטרון רנטגן X-ray (SR-XRF) nanoprobes אפשר ויזואליזציה של התפלגות subcellular של אלמנטים בצורה כמותית מלאה. כדוגמה, יכולת אנליטית זו מאפשרת חקירה של ספיגת חלקיקים1 או אורגנומתכתית מולקולות כגון osmium מבוססי מתחמי2, מתן תובנה לספיגת תאיים של מולקולות מבוססות מתכת עם תכונות נוגדות סרטן חזקים. כטכניקה multielement, SR-XRF3 עם nanoprobe מספק דרך בו לכמת ולוקליזציה intracellularly האלמנטים החשובים ביותר ביולוגית, כולל זרחן, גופרית, אשלגן, סידן, ברזל, נחושת, אבץ. אכן, השימוש בקרני רנטגן קשים מספק עומק חדירה גדול לתמונה כולה מוקפא תאים בצורה ללא תווית. יתר על כן, מתן גישה K-edge של רוב האלמנטים של העניין, הזריחה רנטגן מתרגש ביותר ביעילות. השימוש בגישות קריוגני מאפשר הפחתת נזק לקרינה ואופטימיזציה של שימור מבנה התא והפצה אלמנטלים.
מרבית הטכניקות האנליטיות הזמינות ביותר לחקר מתכות בתאים הן טכניקות משטח הדורשות חלקים דקים מאוד ושטוחים של תאים להיות מיוצרים. זה כולל בעיקר סריקת הילוכים אלקטרון מיקרוסקופ עם אנרגיה-מפזרים רנטגן ניתוח (גזע-EDX), אנרגיה מסוננים שידור אלקטרון מיקרוסקופ אלקטרוני (EF-TEM), ו-בקנה מידה ננו המוני יון משני ספקטרומטריה (nanoSIMS). האחרון לא יכול להתבצע על קפוא, מקטעים תאים בתוך ההקפאה ניתן לעשות עם המיקרוסקופיה אלקטרונית עם רזולוציה מרחבית מתחרות אך רגישות היסודות העניים. פליטת החלקיקים המושרה רנטגן (PIXE) אפשרה לחקר הפצות היסודות בתאים שלמים. יש לו את היתרון של להיות כמותיים לחלוטין עם רגישות היסודות הוגן בסולם מיקרון ואפילו ברזולוציה יקרונים יקרון4, אבל סובל מנזקי קרינה וחוסר יכולות קריוגניים לחקור תאים קפואים. כל הטכניקות האנליטיות האלה משלימים אחד את השני בהדמיה היסודות של תאים, אבל לכל הטכניקות הליך ההכנה לדוגמה הוא צעד מכריע. זה צריך להישמר פשוט כדי להגביל את הזיהום האפשרי, כמו גם היסודות להפצה משמעותית ו/או דליפה כדי להשיג תוצאות משמעותיות. כפי שמתואר במיקרוסקופיה אלקטרונית, זרימת עבודה קריוגניים, כולל ההקפאה של התא ו קריוטרנספר לשלב הקריוסריקה, מאפשר שימור היסודות אופטימלית ברמות subcellular קרוב ככל האפשר למדינה מקורית5,6,7,8,9,10. הבנה זו יושמה בהצלחה לתוך הפיתוח של סינכרוטרון-מיקרוסקופ רנטגן רך-ray (למשל, מיקרוסקופים שדה מלא סריקת מיקרוסקופים) כדי לייצר הדמיה ultraקונסטרוקטיבי של תאים קפואים להתייבש כולו ב-2D או 3D. זרימות עבודה קריוגניים שונות פותחו11 עבור רנטגן רך מיקרוסקופים ב Beamline 2.1 (XM-2) של מקור אור מתקדם במעבדה הלאומית של לורנס ברקלי12, beamline U41-XM בטבעת האחסון אלקטרון Bessy השני (גרמניה)13, beamline מיסטרל של מקור האור אלבה (ספרד)14, ו Beamline B24 של מקור אור יהלום15, בין היתר. זרימת עבודה דומה הוצגה לאחרונה להיות שיטת ההכנה והשימור האמינה ביותר עבור ניתוח היסודות תאיים באמצעות רנטגן מיקרורגשים16,17.
למרות nanoprobe רנטגן טכניקות מתחילות להיות בשימוש נרחב לניתוח היסודות הסלולר, במיוחד עם הופעתו של הקריוגניים SR-XRF יכולות, פרוטוקול חורג לא הופץ עד כה לקהילת המחקר. כאן, הליך מפורט מסופק כדי להכין את התאים האלה קריוקבוע שאינם מתורבתים כמו monolayers על ממברנות סיליקון ניטריד להיות מנותח בתנאים קריוגניים. במקרה של ניתוח רנטגן יש לבצע את הצעד לייבוש ההקפאה לאחר הפרוטוקול, במידה והבדיקה מבוצעת גם בטמפרטורת החדר. בעוד הפרוטוקול המוצע בשימוש בהצלחה עם תאים סרטן השד האנושי MD-MB-2312 ו-ההקפאה ייבוש הפגינו בין אחרים על נוירונים בעכבר18,20,21, זה יכול להיות מורחב בקלות סוגים שונים של תאים אנושיים או בעלי חיים.
Protocol
הליכים ניסיוניים אושרו על ידי ועדת הטיפול בבעלי חיים של החטיבה למדעי החיים של הצ (CETEA, A14-006). הם נערכו בהתאם לחקיקה הצרפתית ולהוראת מועצת הקהילה האירופית של 24 בנובמבר 1986 (86/609/EEC).
1. סיליקון נידהר (Si3N4) הכנה לתמיכה ממברנה
הערה: בגלל הקרום הוא שברירי ועדין, התמיכה שלה (200 יקרומטר עבה מסגרת סיליקון) צריך להיות מטופל בעדינות, באופן אידיאלי עם מלקחיים פחמן דק או דומונט מלקחיים #5, ישר עצמית סגירה עצות קנס. פרוטוקול זה השתמשו סיליקון ממברנות ניטריד עם מסגרת של 5 מ"מ x 5 מ"מ וגודל קרום של 1.5 mm x 1.5 מ"מ. הקרום צריך להיות מוכן בערך 12 h לפני תחילת הניסוי (כלומר, זריעת תאים). ניתן להכין ממברנות בסוף היום ולהתייבש במשך הלילה מתחת לכיתה ב' לכיוון כיסוי הזרימה, כך שהם יהיו מוכנים לשימוש למחרת בבוקר. עובי מסגרת סיליקון של 200 יקרומטר הוא סטנדרטי עבור רוב החברות שמוכרות חלונות הסיליקון ניטריד. אם המוצר המשמש בפרוטוקול זה אינו זמין, ניתן להשתמש בגודל ממברנה בטווח של 0.5-1.5 מ"מ עם גודל מסגרת סטנדרטי של 5 מ"מ x 5 מ"מ. גודל הממברנה הגדול יותר מועדף כאשר נעשה שימוש בטומוגרפיה של קרני רנטגן. ברשת TEM סוג סיליקון ניטריד חלונות עם גודל קרום של 0.5 מ"מ ועובי של 50 ננומטר יכול לשמש גם.
- פתח את הקפסולה המכילה את התמיכה ממברנות Si3N4 (איור 1). לחץ בעדינות על הקפסולה כדי לשחרר בקלות את התמיכה.
- החזק את אחת הפינות של מסגרת הסיליקון באמצעות מלקחיים דקים. להיזהר לא לגעת Si3N4 ממברנה במרכז. 200 או 500 ממברנה עבה ננומטר ניתן לפגוע בקלות.
- באמצעות מלקחיים דקים, בעדינות למקם את Si3N4 ממברנה התמיכה צלחת פטרי מזכוכית סטרילית, משטח שטוח של החלון הסיליקון הנידהר פונה כלפי מעלה (כלומר, החלל הפונה לתחתית המנה).
- הסר את המכסה של צלחת פטרי והשאר את הקרומים תחת אור UV במשך 25-30 דקות מתחת לארון הזרימה המבינארי.
הערה: הנורית UVC (254 nm) מוגדרת בדרך כלל ב-200 μW/cm2. - שים 10 μL של פולי-L-ליזין על הקרום. הירידה צריכה לכסות את Si3N4 היטב ממברנה והוא יכול להתפשט קצת מעל מסגרת סיליקון. השאירו אותו ב 37 ° c עבור 25 דקות בחממה רגילה לתרבות רקמות ב 100% לחות יחסית ו 95% אוויר, 5% CO2.
הערה: במקרה זה ציפוי פולי-אל-ליזין שימש לתאי סרטן החזה מד-ה231. בהתאם לסוג קו התא, ניתן להשתמש בציפויים שונים, והשלב הזה צריך להיות מיטבי בהתאם. - ב 48 סטרילי צלחת הבאר, למלא בארות שונות עם 200-250 μl של אולטרה טהור ואולטרה מעקב מים מסוננים באמצעות מסנן סטרילי משנת 0.22 יקרומטר. בדרך כלל, ניתן להשתמש בכל טוב כדי לשטוף עד 2-3 ממברנות. באמצעות מלקחיים עדינים, לאסוף את התמיכה הממברנה בפינה של מסגרת הסיליקון שלה. לשטוף את הקרום בעדינות על ידי תת מיזוג אותו אנכית 10 s בשלוש בארות רצופות.
הערה: התמיכה בקרום נלקח מתוך החממה וניתן לעבד אותה בטמפרטורת החדר, עם הטמפרטורה והלחות המוגדרת על-ידי מחלקה 2 של כיסוי זרימה למינארי. - לשים את התמיכה הממברנה אנכית בבאר ריקה של צלחת 96 ומלא סטרילי, לכסות אותו, ולתת לו להתייבש בלילה תחת Class II לאורך כיפה הזרימה.
2. זריעת תאים
- בצלחת 4 היטב סטרילית, הניחו את הקרומים עם הצד השטוח שלהם פונה כלפי מעלה.
- מד א-MB-231 תאים נשמרים בתרבות דופלקס ב dmem עם פנול אדום/גלוטמקס I, שיושלם עם 10% סרום עגל עוברי ו 1% פניצילין ו סטרפטומיצין ב 37 ° צ' ב 5% CO2 האוויר מחולל החממה.
- כאשר התאים מגיעים ל-60 ש-70% שליטה מסירה את המדיה ממנה או מבקבוקון.
- לשטוף 1 x עם 10 מ ל של מלוחים של Dulbecco הפוספט באגירה ללא Ca2 + או Mg2 +.
- הוסף 3 מ"ל/T75 בקבוקון של 0.05% טריפסין/EDTA פתרון ולהבטיח כי המונאולייר כולו מכוסה בתמיסה טריפסין.
- המשך 3-5 דקות ב 37 ° צ' עד שהתאים מתחילים להתנתק. הטיפול צריך להילקח לא יותר-טריסינטזציה של התאים ולא לאלץ את התאים להתנתק בטרם עת.
- הוסף 8 מ ל של DMEM בתוספת עם 10% סרום העוברי העובר ו 1% פניצילין ו סטרפטומיצין או מדיה מלאה לאסוף את התאים על ידי ליטוף. הנסיוב בתקשורת ינטרל. את הטריפסין
- ספין למטה ב 250 x g עבור 3 דקות בטמפרטורת החדר. . ומכה את הסופרנטאנט
- הוסף 8 מ ל של מדיה מלאה טרי אל הצינור 15 מ"ל המכיל את הגלולה התא, ו ללטף את התאים למעלה ולמטה עד התאים הם התפזרו לתוך תא אחד ההשעיה.
- לספור את התאים באמצעות הומוציטוטומטר ולדלל את הריכוז של 5 x 106 תאים לכל mL במדיה מלאה (Dmem עם פנול אדום/1% של 200 מ"מ L-alanyl-l-גלוטמין dipeptide ב 0.85% הפתרון בתוספת עם 10% סרום עגל עוברי ו 1% פניצילין ו סטרפטומיצין).
- לקחת 10 μL של מד א-MB-231 תא הבולם והפקדה אותו על קרום. זה מתאים 50,000 תאים/10 μL עבור מד א-MB-231. הירידה צריכה לכסות את Si3N4 היטב ממברנה והוא יכול להתפשט קצת על מסגרת סיליקון. הטיפול צריך להילקח לא לגעת Si3N4 ממברנה עם קצה של המיקרופיפטה.
הערה: בהתאם לסוג קו התאים והניסויים או המידות, צפיפות התא עשויה להשתנות ולהיבדק בהתאם. כאן, צפיפות התא המוצע עבור זריעת Si3N4 ממברנה נמצאה אופטימלית עבור התנאים ניסיוני ו-SR-xrf NANO-ניתוח של מד א-MB-231 תאים2. - עבור נוירונים היפוקמאל (ח נ), להסיר את רקמת המוח ההיפוקמפוס מן היום העובריים 18.5 עכברים ולעכל את זה ב 0.25% טריפסין ב hepes-hbss (5.3 מ"מ kcl, 0.44 mm KH2הפו4, 137.9 מ"מ הנאל, 0.34 מילימטר ב2po4,5.56 מילימטרגלוקוז) ב 37 ° c
- באמצעות P1000 מP1000 וטיפ P200, לבצע את הדיסוציאציה המכנית על ידי ציור ושחרור התוכן חרוט עם הפיפטה מספר פעמים. במהלך שלב זה, להיזהר לא ליצור בועות אוויר במדיום, כי בועות האוויר רעילים לנוירונים.
- המתן מספר דקות עד שהצבירה מצטברת בתחתית השפופרת.
- העבר את הסופרנטנט המכיל את התאים המפוזרים לצינור אפנדורף סטרילי. השאר ~ 25 μl של התרבות הבינונית המכילה את הצבירה.
- ספירת התאים שאינם מתאיהם באמצעות הטציטומטר. מבודדים הנוירונים HN מצופים בריכוז של 7 x 104 תאים ס"מ-2 על פולי-l-ליזין (1 מ"ג/mL פולי-l-ליזין)-מצופה ממברנה הסיליקון ניטריד.
- רק עבור ממברנות עם ח נ, מודדת את הנוירונים ב Dמאמ הראשון שיושלם עם 10% סרום בפרה עוברית. אחד h לאחר ציפוי HN ב dmem, המדיום משתנה מדיה ציפוי נוירובסיס (200 mM L-alanyl-l-גלוטמין dipeptide ב 0.85% הפתרון הנאקל, ו B27 תוסף d = 1/50 מדולל נוירובסיס)18,19.
- עבור התאים מד א-MB-231, לשים את הקרום תומך ב 37 ° צ' בחממה (100% לחות יחסית, 95% air ו 5% CO2) עבור 25 דקות. הדבר מאפשר לתאים להתיישב ולהתחיל לצרף למצע. הדבר עשוי להיות מותאם בהתאם לקו התא המשמש.
- להוסיף 1 מ ל של בינונית התרבות המלאה הנדרשת (DMEM עם פנול אדום/1% של 200 mM L-alanyl-L-גלוטמין dipeptide ב 0.85% הפתרון בתוספת עם 10% העגל העוברי סרום ו 1% פניצילין ו סטרפטומיצין) בכל טוב של מד א-MB-231 תאים על ידי הצבת את העצה הפיפטה נגד קיר של פלסטיק היטב ושחרור המדיום לאט מאוד בזמן שהוא מכסה את הקרום.
- לשים את הממברנה אנכית על הקיר של 4 צלחת הבאר כדי לקחת משם כל בועות אוויר לכוד בחלל הבאר של Si3N4 ממברנה (איור 2). כדי לעשות זאת, להשתמש בפינצטה עדין לדחוף את הבועה בעדינות רבה, נע במקביל Si3N4 מסגרת האחורי כדי למנוע נגיעה ונזק קרום.
- לשים את הממברנה בחזרה אופקית בתחתית הבאר ולהשאיר את הצלחת 4 הבאר בחממה לזמן הנדרש בהתאם לקצב הצמיחה של קו התא בשימוש. התאים מד א-ב-231 מודלו לילה.
3. טיפול או שינוי בינוני
- הסר את המדיום מ 4 צלחת הבאר.
- לשטוף פעם אחת עם 1 mL של פתרון PBS ב 37 ° c. התעלם מערוץ ה-PBS והוסף 1 מ ל של המדיום הרענן והמלא בנוכחות או בהעדר (פקדים) של הטיפול הרצוי באמצעות טיפ של 1 מ ל, שחרור הנוזל מאוד לאט נגד הקיר של צלחת הבאר. את Si3N4 ממברנה צריך להיות שקוע באיטיות ללא כל הפרעות כדי למנוע תנועה ממברנה או להרים.
4. הכנה להקפאה של ההכנה התאית בהקפאה
הערה: בתום זמן הדגירה הנדרש, בנוכחות או בהעדר הטיפול, יש לשטוף בזהירות את התאים ולתקן את ההקפאה. בסביבות 30 דקות לפני התחלת לשטוף ולמחוק את ההכנה התאית לפני הקפאה-לקפוא, הגדרת הראשון וקריר במורד מכונת המקפיא האוטומטית לצלול. כאשר אתה מתפעל קריוגנים, השימוש בכפפות קריוגניים מתאימים, משקפי בטיחות, נעליים סגורות, ומעיל מעבדה נדרשים. חנקן נוזלי חייב להיות מועבר בתוך Dewars מתאים, ואת מקום העבודה צריך להיות מאוורר מספיק עם נוכחות של צג חמצן. באופן אידיאלי, רמת היגרומטריה נמוכה של 20-30% מסייעת להגביל את זיהום הקרח של חומרים, Dewars, ו קריוגנים, כי הוא מזיק לויטריפיקציה של דגימות (כלומר, שכבת קרח אמורפיות). באופן אידיאלי, בהתאם לרמת הניסיון של החוקר, עד 10-12 לאחד דגימות עבור הפעלה אחת ניתן להכין באמצעות משנה אותו הגביע הנוזלי משני הקריוגן עבור ויטריפיקציה. בין הפעלות, המקפיא לצלול אוטומטי דורש 1 h לאפות הליך החוצה. באופן אידיאלי, יש לעבד דגימות בתנאי דגירה זהים. עדיין, ניתן לעבד פקדים תחילה, ואחריהם הדגימות בתנאי טיפול מסוים.
הערה: עבור הקפאה-מקפיא הצעדים הבאים חלים הן על התאים מד א-MB-231 או בתאי HN.
- הגדר את הקריוקרינגר. לקריוקיבעון מהיר של תאים
- . תדליק את מקפיא הצלילה האוטומטי
- הזן את הפרמטרים (למשל, טמפרטורה, אחוז לחות, הזמן לחסום אם בלוק אוטומטי משמש, ומיקום להרים את המדגם על פני השטח של הקריוגן כדי להקל על העברה מכולה קריוגניים) ישירות מהמסוף והפרמטרים תפריט ' הגדרות '. במקרה הנוכחי, הפרמטרים של תא הלחות הוגדרו כ-37 ° c ו-80% לחות.
הערה: טוב יותר ויטריפיקציה תוצאות התקבלו עבור פרוטוקול זה ו-X-ray הדמיה מהירה וזהירה ידנית. לפיכך, הפרוטוקול אינו משתמש בתוכנית רצף אוטומטית. - חברו את חדר מכשיר האדים ובכדי לשמר את הלחות הראשונה למלא אותו באמצעות מזרק עם 60 mL של מים כפולים מזוקקים, ולאחר מכן 20 mL כפי שנקרא במסוף המקפיא האוטומטי לצלול.
הערה: הימנע משימוש במים אלקטרופורזה כי זה עלול לגרום נזק מערכת אידוי. סגור את השסתום ולהשאיר את האבובים מוצמד על הישבן של מכשיר האדים. - התקינו את הספל השחור למחזיק בה וכיסו אותו בעזרת כובעי הפלסטיק.
- למלא את Dewar של החדר הקר עם LN2, להביא אותו לרמה של הרשת בתוך אזור העבודה.
- שים את המיכל הייעודי כדי לאחסן את הקרומים לאחר קריוקיבעון במיכל העברת שנערך במיקום הייעודי באזור העבודה EM-GP וקרוב מחזיק הגביע אתאן.
הערה: המנה הייעודית היא התפתחות בבית ב-nanoprobe beamline ID16A של קרינת הסינכרוטרון האירופית בגרנובל. ציורים עם מפרטים זמינים לפי בקשה (איור 3). הם יכולים להיות מאוחסנים ארבעה בכל פעם בצינור 50 mL לטווח ארוך אחסון LN2 Dewar. אפשרות חלופית מורכב באמצעות קטן 0.2 mL הקיר הקבוע PCR דק עם כובעי כיפה לאחסן אחד Si3N4 ממברנה תמיכה. יהיה עליך לקדוח ~ 2 מ"מ חור בחלק העליון של צינור הקיר באמצעות מחט מזרק מחומם כדי לאפשר LN2 למלא את הצינור. - מלאו את המכולה עם LN2 וכיסו אותו במכסה האלומיניום הייעודי. המשך למלא את החדר הקר עם LN2 (בדרך כלל ~ 2 יש צורך) שמירה על 100% צג LN2 ברמה במסוף. המתן עד להגעת הטמפרטורה הנדרשת הסופית.
- הסירו את כובע הפלסטיק וכסו את הגביע האטיאן עם הliquefier המחוברים לבקבוק אתיאן. המתן עד שטמפרטורת הספל. תהיה מעורפלת לטמפרטורת הטמפרטורה בעת ההגעה, התחל להשתמש בקריוגן המשני (כלומר, ethane).
הערה: ה-setpoint ששימש היה-180 ° c, מעט מעל נקודת התכה של אתאן (-182.8 ° c). אתה לא צריך לצנן את אתאן liquefier כי זה יכול להיות מקור של היווצרות פרוסט וזיהום של הגביע אתאן. - פתח את בקבוק הטוהר הגבוה אתאן שסתום הראשי מאוד לאט לפתוח את וסת הלחץ עד שאתה מקבל ערפל איטי של אתאן. החזק את הזרימה הנמוכה עד שהאתאן הנוזלי בונה. ממלאים את הספל לקצהו העליון. סגור את וסת הלחץ ואת השסתום הראשי של בקבוק אתאן. הסר את הלייקה liquefier בזהירות והשאר אותה בצד על גבי פוליסטירן מוקצף מתחת למכסה המנוע. לשמור על שטח העבודה מכוסה באופן רופף עם כובע פוליסטירן שחור סיפק עם המכונה כדי למנוע זיהום פרוסט של אזור העבודה ואת המיכל אתאן.
- רק לפני לחיצה ידנית של המדגם, להסיר את הפקק פוליסטירן שחור ומהתפריט של קונסולת לחיצה "התחתון החדר", אשר מביא את החדר הסביבתי במגע עם שטח העבודה הקריוגני.
- . היכונו למחוק את הדגימה
- הכן את החוצץ המתאים להסרת עקבות מלחים ממדיום התרבותי. עבור פרוטוקול זה, מאגר אצטט אמוניום שימש לשטיפה התאים מד א-MB-231.
הערה: מאגר אצטט אמוניום מתאים לרוב סוגי התאים, והוא אינו מוסיף לאות הזריחה ברנטגן (בהתחשב באלמנטים עם Z > 9). מספר קווי תאים מסוימים, כגון תאים עצביים, עשויים לדרוש שימוש במאגר ייעודי. למשל, עבור נוירונים בקליפת המין העיקרית, פתרון מלוחים המורכב 1.8 נפח של 0.5 M Na2hpo4 ו 1.9 נפח של 0.5 m נה2פו4 ניתן להשתמש15. לעומת זאת, זרחן או כלור הכלולים במאגר יתרום לספקטרום XRF. מגבלה זו של שורות פליטת רנטגן מזויף יש לזכור בהתאם לאלמנטים של עניין להתגלות. - הכנת 150 mM אמוניום אצטט הפתרון מ אמוניום אצטט באלקטרופורזה הפתרון ולבדוק pH (7.0-7.3) ו (270 – 300 mosm/ק"ג)
הערה: האוסמלאידים שהוזכרו לעיל הוא שווה ערך לתמיסת פוספט של Dulbecco (D-PBS) ללא סידן ומגנזיום וניתן לבדוק אותה באמצעות מיקרו-אוסממטר. - למלא את המספר הדרוש של בארות מ 12 צלחת פלסטיק היטב עם מאגר אצטט אמוניום.
- גזור רבע מסנן נייר לחיתוך, או מנייר מסנן מס ' 1 עם חור שנחתך מראש, או מנייר סינון ידני של קוטר 55 מ"מ עם חור מרכזי בגודל 15 מ"מ.
- קחו את המדגם הנדרש המאוחסן בחממה ב 37 ° c ברגע האחרון לפני שטיפה לצלול-מקפיא את הקרום.
- לפתוח את הפינצטה באמצעות הטבעת השחורה שחור של מלקחיים לשחרר מהיר (בדרך כלל הטבעת דומונט להדק את מלקחיים רפואי בדיוק גבוהה) ולתפוס את Si3N4 ממברנה תמיכה מהתרבות היטב.
הערה: תפוס את באמצע מסגרת הסיליקון, שמירה על קצה הפינצטה ליד הקרום. הזז את התפס השחור למטה אל הפסים הראשונים כדי לנעול את הפינצטה. - לטבול את Si3N4 ממברנה תמיכה אנכית בפתרון מאגר אצטט אמוניום שמרו ב 37 ° c עבור ~ 5 s.
הערה: על התמיכה להישאר אנכית במאגר. שימו לב כי פתרון המאגר בכל באר של הצלחת יכול לשמש עד שלושה ממברנות לאותו תנאי דגירה. - למחוק באופן ידני עם נייר סינון כדי לנקז את המאגר העודף מתוך הפתרון שטיפה הממברנה (איור 4) כדי להשאיר שכבה דקה והומוגנית של הפתרון אמוניום אצטט מימית המכסה את התאים.
הערה: כדי לעשות זאת, תחילה לחץ על הישבן של החלון על נייר המסנן כדי להסיר כמעט את כל המאגר מימית נשאר בבאר ובגב הקרום. שנית, למחוק את הצד הקדמי, החל משני צידי הפינצטה, ולאחר מכן כל צד של המסגרת (איור 4). . לעולם אל תיגע בקרום עודף של מאגר סחוט יכול להיות מנוטר עם האוראולה הנוצרת על נייר סינון. - פתח את דלת חדר הסביבה ובמהירות לטעון את הפינצטה, החלקה אותו לתוך הלקחיים משתלבים, ולסגור את הדלת (איור 5).
- לחץ על "כריכה חשופה". הפינצטה מחזיק את Si3N4 ממברנה יהיה במהירות צלל לתוך הקריוגן.
- הסר את המכסה של מיכל ההעברה עם מלקחיים מקורר.
- לחץ על "העברה". Si3N4 ממברנה יהיה מעט מעלה מעל הקריוגן.
- בתנועה מהירה אחת, לנתק את הפינצטה על ידי הזזת אותם מתוך מלקחיים משתלבים ולהטות מעט מתוך משתלבים להביא ישירות לתוך חריץ ריק של תיבת ההקפאה במיכל העברת מלא עם LN2. שחררו את טבעת המלחציים השחורה כדי לשחרר את הקרום (איור 5).
הערה: על מיכל ההעברה להיות תמיד מכוסה ב-LN2. כאשר נדרש מילוי מלא, לכסות את הגביע אתאן עם מכסה פלסטיק שסופקו עם המכונה כדי למנוע ערבוב LN2 ו-אתאן. - כסו את מיכל ההעברה במכסה והשתמשו בספל פוליסטירן לבן קטן שמולא ב-LN2 כדי להעבירו לקופסת פוליסטירן מלאה ב-ln2.
הערה: לאחר מכן ניתן לאחסן את המיכל או הצינור המכיל את הקרומים ב-50 mL ממולא ב-LN2 והועברו לאחסון לטווח ארוך ב-2 dewar. לפני שמתחילים להקפיא את הדגימה הבאה, לחמם את כל מלקחיים קר ומזוגג עם מייבש שיער או צלחת חם/קריוכלי מייבש (45 ° c) כדי למנוע זיהום עם גבישי קרח.
- הכן את החוצץ המתאים להסרת עקבות מלחים ממדיום התרבותי. עבור פרוטוקול זה, מאגר אצטט אמוניום שימש לשטיפה התאים מד א-MB-231.
5. הקפאת ייבוש של תאים קפואים לצלול על ממברנות סיליקון הנירכוב
הערה: לצורך ייבוש הקפאה, השלבים הבאים חלים על תאי מד א-231 ו-HN. כדי לצנן את מייבש ההקפאה, יהיה עליך להמתין בסביבות 40 דקות עד 1 h.
- הגדרת מייבש ההקפאה
- הפעל את החשמל עם מתג הנדנדה הממוקם בלוח האחורי של המכשיר.
- התחל להזין את הפרמטרים הבאים בתפריט LCD: קטע 1 = 2 h ב-120 ° c; פלח 2 = 2 הרמפה מ-120 ° צ' עד-80 ° צ'; קטע 3 = 2 ח' ב-80 ° c; פלח 4 = 2 מעלות השיפוע מ-80 ° c עד 50 ° c; פלח 5 = 2 ב-50 ° c; קטע 6 = 6 שיפוע מ50 ° c עד 30 ° c.
- בתום הגדרת הפרמטרים, שמור את ההגדרות, סגור את המכסה הקאמרי ולחץ על 'כוכבT'.
- היחידה תהיה לשאוב עד 1.10-5 mbar. כאשר מגיעים ללחץ זה, שורת הפקודה של התצוגה תציג את "התחל לקרר עכשיו, התחל להמשיך".
- למלא את החנקן נוזלי Dewar באופן סדיר כדי לצנן את הבמה מתחת לטמפרטורה הגדרת נקודה משולשת.
הערה: טמפרטורת השלב המשולש מוגדרת ל-140 ° c. לפני טעינת המדגם עבור פרוטוקול זה, מומלץ להמתין 1 h ובשלב הטמפרטורה של-160 ° c. - הצג יציג "הקש ENTER" כאשר מוכן "לטעון מדגם".
- לצנן את הטמפרטורה חנקן נוזלי בתוך LN2 ממולא פוליסטירן dewar, מחזיק העברת המדגם סיפק הספק, ואת שני פליז נוסף גלילי Si3N4 מחזיקי ממברנה.
- הר את Si3N4 מחזיק פליז ממברנה על גבי מחזיק העברה לדוגמה סיפק הספק בקלקר dewar (איור 6א). שמור את הרמה של LN2 כדי כ 1-2 מ"מ מתחת לקצה העליון של פיסת פליז הראשון.
- תרימי את Si3N4 ממברנה לדוגמה תמיכה מתוך תיבת הקירור או הצינורית PCR באמצעות מלקחיים לסגירה עצמית מראש inox או טפלון מצופה.
- הפקדה את הקרום עם התאים לדוגמה בצד כלפי מעלה בחלל הנחושת ממוספרים.
- כסו את ההרכבה בכלי הפליז השני כמכסה (איור 6ג).
הערה: עיצבנו שני דיסקי פליז כל אחד בעל עובי של 5 מ"מ, קוטר של 50 מ"מ, וחור קוטר 11 מ"מ מרכזי. הראשון בדיסק יש 14 מלבני מכונת (8 מ"מ x 6 מ"מ) מיקומים כדי להתאים את התמיכה (5 מ"מ x 5 מ"מ). כל חריץ יש שטוח ומלוטש היטב עם עומק של 2 מ"מ. דיסק הפליז השני הוא שטוח לכסות את התמיכה פליז3N4 ממברנה משמש מארז מלכודת קרה. - לצנן את מוט העברת בקופסת קצף ממולא בתוך2 ולהשתמש בו כדי לנעול את ההרכבה המלאה (איור 6D, E).
- לחץ על "ENTER" בלוח הקדמי של מייבש ההקפאה.
- משאבות טורבו ורוטרי יפסיקו והחדר מטוהר עם גז חנקן יבש כדי לאפשר פתיחת מכסה החדר.
- מיד להעביר את ההרכבה לדוגמה הרכבה עם מוט העברה טעון קפיץ לתוך תא מייבש ההקפאה ולהצמיד אותו על הנחושת LN2 בשלב קר.
הערה: השאר את ההרכבה המלאה עם מוט ההעברה לתוך התא. - סגור מיד את המכסה של תא מייבש ההקפאה ולחץ "כוכבT" כדי להמשיך עם מחזור ייבוש ההקפאה.
- מלא את מאגר ה-LN2 של מייבש ההקפאה ידנית כל 2 h.
הערה: מערכת מילוי אוטומטית של LN2 עשויה להיות מחוברת למאגר זה. - בסוף מחזור ההקפאה, לחץ על "STOP" כדי לפרוק את החדר ולהסיר את ההרכבה המלאה כדי לגשת לדגימות ההקפאה.
תוצאות
טיפוסי מיקרוסקופ וידאו אופטי תצוגה של קפוא הרטוב מד א-MB-231 תאים שהיו תת-תרבותית על פולי-L-ליזין מצופה Si3N4 ממברנה מוצג באיור 7א. התצוגה האופטית של המדגם בחדר ואקום הושגה במצב השתקפות באמצעות מיקרוסקופ וידאו ייעודי מקוון של ID16A beamline של ESRF22. בעוד אלקטרון או מיקרוסקופ רנטגן רך דורש את שכבת הקרח להטביע את התא כדי להיות דק ככל האפשר (בדרך כלל < 0.5 μm), רנטגן קשיח (> 10 קוו) יש את היתרון של עומק חדירה הרבה יותר גבוה ומינון נמוך תצהיר. עובי הקרח יכול אפוא להיות גדול יותר, בדרך כלל < 10 יקרומטר כולל התא כך הקרח הטבעה התא הוא מספר יקרומטר עובי. זה יכול להיות מוערך באמצעות עוצמת רנטגן נמדד הילוכים בהשוואה לעוצמה ללא המדגם, לוקח בחשבון את ספיגת 500 ננומטר עבה Si3N4 ממברנה. עובי קרח זה ניתן להשיג באמצעות כתמים ידניים כפי שמתואר בפרוטוקול הנוכחי. באזור הטבעות של ניוטון, עובי הקרח יכול להיות אפילו דק יותר (לא נמדד).
צילום רנטגן מיפוי היסודות של התא הרטוב מוקפא מוצג באיור 7ב עם הפצות הנציג של אלמנטים פיזיולוגיים כגון אשלגן (K), גופרית (ים), ו אבץ (zn). מפות אלה מייצגים את המסה אריאל היסודות (כלומר, מסה מוקרן היסודות). בעוד לא נעשה במקרה הנוכחי, מפות כאלה ניתן לנרמל באמצעות X-ray המבוססת על הפצת הדמיה בשלב התמונה המספקת את הערכה של המדגם מוקרן23. כפי שדווחו על-ידי מחקרים רבים, ההנחה הקשה ביותר בתאים שנשתמרו במצבם הכמעט-טבעי היתה מופצת באופן הומוגנטי בכל התא23,24,16. כפי שמוצג ב-2D רנטגן תמונות היסודות באיור 7B, הרכיב המאוגד בחוזקה הופץ באופן שווה בתוך התא, בדומה ל-K, ומייצג אומדן טוב של פרופיל מסת הסלולר. התפלגות Zn היה אות גבוה יותר בגרעין מאשר בציטוזול והתווה בבירור את הגרעין. ניתן לציין כי מאזורים קטנים Zn מועשר ניתן להבחין ברזולוציה המרחבית (50 nm) באזור הגרעיני.
הרנטגן הקיים nanoprobes או אלה להיבנות לא בהכרח להכיל יכולות קריוגניים. במקרה זה, החלופה הטובה ביותר כדי לקבל רנטגן תמונות זריחה של תאים ב-sub-100 ננומטר החלטות מרחבית היא לבצע הקפאת ייבוש הליך המתואר בפרוטוקול זה לאחר לצלול-הקפאת התא. איור 8A מראה תצוגה טיפוסית מיקרוסקופ שדה בהיר של תוצאה הקפאת מיובשים העכבר הראשי היפוקמאל ההיפוקומאל באופן ישיר תרבותי על Si3N4 ממברנה. במקרה זה, אם מאוחסן בחדר נקי ומיובש, ניתן להכין את הדגימות 1 עד 2 שבועות מראש ולצפות במיקרוסקופ אופטי אנכי רגיל לרישום אזורי עניין. יש לנקוט כדי למנוע חשיפה ללחות הסביבה כפי שהוא עשוי להילכד על ידי הקפאת מדגם מיובש ולהוביל לנזק מתחת ל-X nanobeam. הליך זה הוחל בהצלחה על תאים רגישים מאוד (כלומר, תאים עצביים) ואף תוצאות טובות יותר הושגו עם סוגים אחרים חזקים יותר של תאים, כגון תאים סרטניים. באשר התאים קפואים לצלול, רנטגן תמונות הזריחה של K, S, ו Zn על המסך כולו הקפאת התאים דומים לאלה שתוארו לעיל. הם מייצגים את ההפצות האלמנטלים להימצא בסוגים שונים של תאים מיובשים הקפאה ב-50-100 ננומטר ברזולוציה מרחבית nm. בעוד הקפאת-ייבוש תאים שלמים היא חלופה כדי לשמר את היושר הבסיסי, זה על חשבון של שימור מושלם של מורפולוגיה התא16, במיוחד תאי ממברנות.

איור 1: תמיכה לדוגמה טיפוסית לננו-אנליזת קרינה ברנטגן. A Si3N4 ממברנה תמיכה הקפסולה המגן שלה. סוג זה של מצע ניתן להשתמש הן עבור ניתוח טמפרטורת החדר (לצלול להקפיא הכנה הסלולר ואחריו טמפרטורה נמוכה הקפאת ואקום ייבוש תהליך) או לניתוח הקפאה רנטגן הקריוגני. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
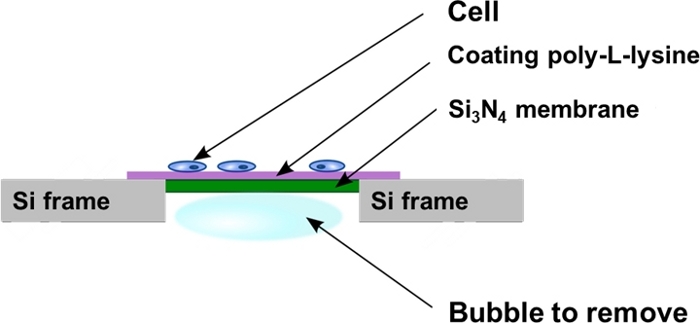
איור 2: השקפה סכמטית של מערכת הסיליקון מרכיבה לאחר זריעת תאים. התאים הם מתורבתים ישירות על משטח שטוח פולי L-ליזין של Si3N4 ממברנה תמיכה. לפעמים בועות אוויר יכול להיות לכוד בחלל האחורי של התמיכה ממברנה3N4 ו צריך להיות מוסר כפי שמתואר בפרוטוקול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: In-house פיתח תלת-ממד הדפסה מודפס-box לאחסון לטווח ארוך של לצלול קפוא Si3N4 ממברנה תומך חנקן נוזלי dewar. (א) הקפאה מפורק עם המיכל והאותיות (החלק התחתון) ו-(ב) תיבת ההקפאה התאספו עם אותיות נעולות. ניתן לתמרן את הכיפות עם הפינצטה, הפתיחה או הנעילה בסיבוב. תוכנית מפורטת עבור הדפסה תלת-ממדית זמינה על פי בקשה מ-ESRF ID16A. העיצוב נעשה כדי להתאים סיליקון ניטריד TEM רשתות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: בלוק של תאים המתורבים על Si3N4. לפני לצלול-להקפיא את התא מונאולייר תרבותי על ממברנות Si3N4 צריך להיות שוטפים בתמיסה אמוניום אצטט (א) ובזהירות ידנית מחק באמצעות נייר סינון (ב). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: מכונת EM-GP הקפאה אוטומטית. (א) מקפיא הצלילה האוטומטי. (ב) חדר האיכות הסביבתי עם הפינצטה הנעולה ב. (ג) גביע אתאן מכוסה בliquefier לייקה המחובר לבקבוק אתיאן. (ד) מארז ההקפאה המראה את הספל השחור המלא במלין ובקופסת ההקפאה לאחסון נוסף ב-LN2 של הממברנותהארבע -שלושN 4. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 6: מכלול לדוגמה הרכבה להקפאה הליך ייבוש. (א) הנמען פליז הראשון עבור Si3N4 ממברנות מותקן על גבי בעל העברת המדגם המסופק על ידי ספק מייבש ההקפאה. (ב) ו-(ג) מראים כי הדיסק השטוח השני משמש ככיסוי ופועל כמארז מלכודת קרה שיוכנס למארז הוואקום של מייבש ההקפאה. (ד) ההרכבה המלאה עם מוט ההעברה הטעון באביב. (ה) מחזיק המדגם הנושא את ההכנה התאית המוגבהת גדל על הקרום Si3N4 חייב להיות נוסף במייבש בהקפאה2-מקורר. כל השלבים לטעינת ההרכבה נעשים ב-LN2 בתיבת קלקר. לבהירות, כל התמונות הופקו בהיעדר LN2. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 7: ההקפאה-X-ray תמונות הקרינה של תא מוקפא קפוא באמצעות רנטגן קשיח nanoprobe. (א) תצוגה מקוונת טיפוסית במצב השתקפות באמצעות מיקרוסקופ וידאו אופטי ייעודי של ESRF ID16A beamline. לאחר בלוק ידני, עובי הקרח הכולל של כ 5 עד 10 יקרומטר הושג המאפשר תצוגה ברורה של התאים הקפואים קפוא. אזור עם טבעות ניוטון מעיד על קרח רזה אפילו הרבה יותר מורגש. (ב) נציג הקפאה-X-ray הפצות הסלולר של אלמנטים פיזיולוגיים אשלגן (K), גופרית (ים), ו אבץ (zn). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
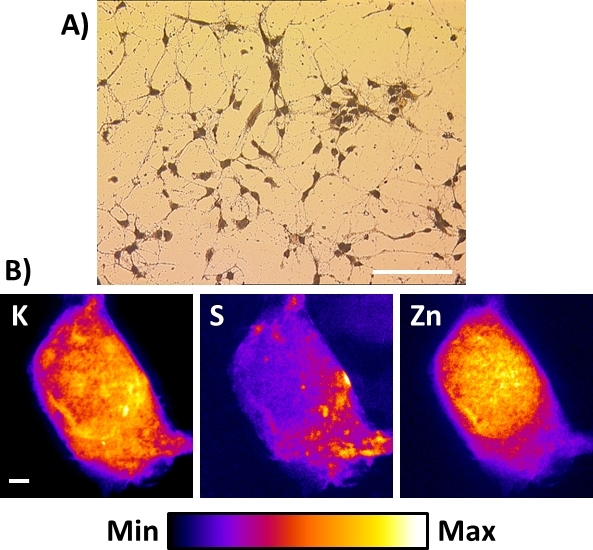
איור 8: x-ray תמונות הזריחה של תא עצבי הקפאה מיובשים באמצעות רנטגן קשיח nanoprobe. (א) השקפה טיפוסית מיקרוסקופ שדה בהיר של כתוצאה הקפאת מיובשים תאים עצביים הראשי מתורבת ישירות על Si3N4 ממברנה. סרגל בקנה מידה = 200 יקרומטר (ב) מייצג טמפרטורה בחדר הנציג X-ray הקרינה הפלואורסצנטית של תא היפוקמאל מיובשים בודד מראה את הפצות של אלמנטים פיזיולוגיים אשלגן (K), גופרית (ים), ו אבץ (zn). סרגל בקנה מידה = 2 μm. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
מיקרוסקופ ההקפאה-אלקטרונים זכה בפרס נובל 2017 בכימיה וככזה הפיתוח של J. Dubochet על ויטריפיקציה של חומר ביולוגי לקביעת המבנה ברזולוציה גבוהה של biomolecules בפתרון25. כפי שדווח על-ידי Dubochet בהרצאה הנובל שלו "לדעת כיצד לחזק את ה-droplet של מים הוא דבר אחד, הכנת דוגמה ביולוגית להתבוננות ביולוגית היא עוד"25. הקפאה צעדים נחשבים כעת את הטכניקה הסטנדרטית כדי לרכך את הנזק למינון קרינה ותאי הלימוד קרוב מדינה מקורית שלהם. ההכנה נותרת מייגעת, עם זאת. הסיבה לכך היא מיקרוסקופ אלקטרוני, בשל הרזולוציה המרחבית מתחרות שלה, הוא רגיש לכל חפץ אולטרה מבנית המתרחשת במהלך ההכנה לדוגמה. סינכרוטרון cryonanoprobes הם כעת מתקרבים קשיים דומים יורדים לרזולוציות מרחבית נמוך כמו 13 ננומטר באנרגיה גבוהה רנטגן טווח26. מיקרוסקופ רנטגן קשיח יכול לנתח תאים שלמים בעוד המיקרוסקופיה אלקטרונית סובלת מעומק החדירה המסכן של אלקטרונים המאפשרים רק פרוסות תא דקות מאוד כדי להיות שנצפו.
מונאולאיירס של תאים הם דקים מספיק כך על ידי הקפאת לצלול ב ethane נוזלי, את שיעורי הצינון הנדרש עבור המים ויטריפיקציה מושגת. בתאוריה, שיעורי צינון גבוה כמו 108 K/s אפשריים באמצעות הלחץ הגבוה בהקפאה27 המאפשר ויטריפיקציה של דגימות עבה מדי לקפוא לצלול. שיעור קירור של 105 K/s, נדרש כדי לאפשר ויטריפיקציה מלא של המדגם בלחץ הסביבתי28, הוא הגיע לידי באמצעות מכונת ההקפאה האוטומטית לצלול ופרמטרים הציג כאן. הדבר מאפשר לחוקר לזייף דגימות ביולוגיות דקות (< 10 μm) כגון מונאולייר של תאים12,13,14,15,29,30 על ידי הקפאת לצלול באתאן הנוזלי.
אתגר חשוב עם פרוטוקול זה הוא גם לשמר ככל האפשר את השלמות הכימית של התוכן תאיים כדי לספק הפצות היסודות אמין בתוך התא 2D או 3D. כפי שפורסם במקום אחר2,16,17,31, במקרה של הדמיה היסודות ברמה subcellular, ניתוח של תאים קפואים מוקפאים צריך להיחשב. אחרת, ניתן להשתמש בשילוב של הקפאת לצלול וייבוש של תאים לניתוח טמפרטורת החדר. עבור האחרון, הקרח אמורפיות מוסר באמצעות תהליך סובלימציה, בעוד מולקולות המים מאוגד מוסרים באמצעות תהליך של desorption. תהליך זה עשוי להיות רחוק מאידיאל בהשוואה לדוגמיות שהוקפאו בשל השינוי האפשרי של הקרומים הסלולאריים והמבנה של כמה מבני subcellular32. כמו כן, ללימודי היווצרות המינים, הפקת המים עלולה להוביל לחפצי מין מתכתיים. עדיין, זה היה מוצלח ואת החלופה הטובה ביותר כדי קפוא דגימות בהתייבשות עבור הדמיה היסודות ב-sub-100 ננומטר רמות2,16,17,18,20,33,34,35,36.
כפי שדווחו37, האיכות של קריואופרסטית הסלולר ההכנות ניתן להעריך באמצעות אשלגן ל-נתרן היחס K/Na. למרבה הצער, זה עדיין לא יכול להיות נחוש עם רנטגן קשה nanoprobe משמש כאן, בשל האנרגיה הנמוכה לגזור של גלאי הסחף סיליקון השתמשו כדי לזהות את הפוטונים הזריחה של הרנטגן של האלמנטים (E ≥ 1.3 מגנזיום הקוו). אכן, יחס k/Na גבוה (> 10) כי ניתן למדוד באמצעות תוף-סימס, epma, או מיקרודיקה גרעינית pixe16,37 מעיד על שלמות כימית שנשמר של התא לעומת הצפוי K/Na של 25 בתא חי37. הדבר יכול להיות נתמך על ידי היחס הנמוך Cl/K38. עדיין, הויטריפיקציה לא מושלמים, במיוחד אם מהירות הצינון המדגם נמוכה מדי, עלולה להוביל להיווצרות גבישי קרח גדולים שעלולים להזיק לקרומים של תאים ולאורגלים, ובכך לשנות את התפלגות היסודות הכימיים. למרות שאין הליך שגרתי כדי לנטר את הנזק הפוטנציאלי וההשפעה על התפלגות תאיים, היחס הבסיסי לעיל ואת האפשרות לדמות את התא ברזולוציה גבוהה באמצעות x-ray בשלב הניגודיות או ההקפאה רך רנטגן מיקרוסקופ יכול להיות הגישות הטובות ביותר לתמוך שימור טוב של תאים תאיים עם שימור במקביל של ה השילוב של טכניקות אלה והשימוש של מיקרוסקופים אופטי החדש שפותחו מיקרוסקופ אופטיים יסייע להעריך מה במידה נזק זה מתרחש ומשפיע על התפלגות תאיים היסודות.
באופן כללי, פרוטוקול מפורט ומקיף להכנת דגימות סלולריות עבור סינכרוטרון X-ray פלואורסצנטית ננו מוצג. זוהי נקודת התחלה טובה לקהילת המחקר, עוזר לפתור את הסוגיה קשה של איך להכין דגימות תאים המתאים עבור 2D ו 3D הדמיה היסודות ב (ההקפאה) קשה רנטגן nanoprobes. ניתן למזג גישות אלה בעזרת קרינה אופטית ומיקרוסקופית אלקטרונים בעזרת יכולות מיקרוסקופ מעמיק והדמיה מבנית של תאים.
Disclosures
למחברים אין ניגודי אינטרסים.
Acknowledgements
הניסויים על הננו-הדמיה beamline ID16A בוצעו במסגרת של הצעות ESRF LS2430, LS2303, ו LS2765.
Materials
| Name | Company | Catalog Number | Comments |
| Ammonium Acetate solution, BioUltra, for molecular biology, ~5M in H2O | SIGMA | 09691-250mL | One can prepare the required solution from high-grade ammonium acetate powder and ultrapure water, pH and osmolarity needs to be adjusted anyway. |
| B27 supplement, 50x | Life Technologies, Invitrogen | 17504-044 | for hippocampal neuron culture |
| Dulbecco’s Phosphate Buffered Saline, DPBS, ([-] CaCl2, [-] MgCl2) | GIBCO | 14190-094 | cell culture |
| DMEM with Phenol Red/Glutamax I (Medium ATCC modification) | GIBCO | 21885025 | cell culture |
| Dulbecco’s modified Eagle medium (DMEM) | Life Technologies, Invitrogen | 31966-02 | for hippocampal neuron culture |
| Dumont Tweezers #5, Straight Self-closing, 0.05x0.01mm Tips, Biology | World Precision Instrument | 501202 | |
| Emitech K750X Peltier-Cooled EM Freeze Dryer | Quorum Technology | EK3147 | |
| Ethane N45 | Air Liquid | p0505s05r0a001 | C2H6 > 99,995 % |
| Fetal Bovine Serum, Performance Plus, certified One Shot format, US origin | GIBCO | A31604-02 | cell culture |
| HBSS 10x | Life Technologies, Invitrogen | 14185-052 | for hippocampal neuron culture |
| Leica GP quick-release forceps | Leica | 16706435 | |
| MDA-MB-231 cell line, an epithelial, human adenocarcinoma breast cancer cell | ATCC | ATCC HTB-26 | cell culture |
| Neurobasal medium | Life Technologies, Invitrogen | 21103-049 | for hippocampal neuron culture |
| Nunc 4-Well Plate | Thermo Fisher | 176740 | cell culture |
| Osmo1 Single-Sample Micro-Osmometer | Advanced Instruments | Osmo1 | Alternative can be found at Fisher scientific (Wescor Inc. VAPRO® Vapor Pressure Osmometer) |
| Penicillin-Streptomycin | SIGMA | P4333 | cell culture |
| poly-L-lysine | SIGMA | P4707 | Other type of coating can be used that is dependent of the cell type to be cultured on the membrane, other adhesion factors such as fibronectin, collagen, polyornithine can be tested accordingly. Cell can be cultured directly on silicon nitride membrane, but the latter are slightly hydrophobic and adhesion factors are recommended unless the membrane are processed to be hydrophilic (glow plasma discharged). |
| Plunge freezing robot Leica EM GP main unit | Leica | 16706401 | Alternative for automated plunger are the Vitrobot Mark IV (FEI), CryoPlunge 3 (Gatan), MS-002 Rapid Immersion Freezer (EMS). Manual home-made system can be used but an environment-controlled chamber is an asset for plunge-freezing. |
| Silicon nitride membrane (Si3N4) | Silson Ltd. | SiRN-5.0(o)-200-1.5-500-NoHCl | The proposed silicon nitride membrane type is optimised for analysis at ID16A ESRF X-ray nanoprobe, The 500 nm thickness of the membrane was chosen being more robust for cellular manipulation and cryofixation detailed within this protocol. Membrane with thickness of 200 nm or below can also be used although quite fragile, and other design of silicon nitride membrane can be purchased (for example TEM compatible membrane...) from Sislon or other company such as Norcada, SPI supplies, Ted Pella, EMS, LabTech, Neyco... |
| Trypan blue solution 0.4% | GIBCO | 15250061 | cell culture |
| Trypsin-EDTA, 0.05% | GIBCO | 25300-054 | cell culture |
| Ultratrace Elemental Analysis Grade, Ultrapure Water | Fisher Chemicals | W9-1 | MilliQ water can be used but has to be tested for trace element level of contamination using for example ICP-MS analysis. |
| Whatman No. 1 filter paper with precut hole | Leica | 16706440 | Alternative filter paper may be used and must have an outer diameter of 55 mm, the Punch for filter paper system from Leica (ref.16706443) can be used. |
References
- Lewis, D. J., et al. Intracellular synchrotron nanoimaging and DNA damage/genotoxicity screening of novel lanthanide-coated nanovectors. Nanomedicine. 5 (10), 1547-1557 (2010).
- Fus, F., et al. The intracellular localization of osmocenyl-tamoxifen derivatives in hormone-independent breast cancer cells revealed by 2D and 3D nano X-ray fluorescence imaging. Angwendte Chemie. , (2019).
- Janssens, K., Adams, F., Rindby, A. Microscopic X-Ray Fluorescence Analysis. , Wiley. Chichester, UK. (2000).
- Carmona, A., et al. Uranium exposure of human dopaminergic cells results in low cytotoxicity, accumulation within sub-cytoplasmic regions, and down regulation of MAO-B. Neurotoxicology. 68, 177-188 (2018).
- Leapman, R. D., Hunt, J. A., Buchanan, R. A., Andrews, S. B. Measurement of low calcium concentrations in cryosectioned cells by parallel-EELS mapping. Ultramicroscopy. 49 (1-4), 225-234 (1993).
- Saubermann, A. J., Echlin, P., Peters, P. D., Beeuwkes, R. Application of scanning electron microscopy to X-ray analysis of frozen hydrated sections. I. Specimen handling techniques. Journal of Cell Biology. 88 (2), 257-267 (1981).
- Saubermann, A. J., Heyman, R. V. Quantitative digital X-ray imaging using frozen hydrated and frozen dried tissue sections. Journal of Microscopy. 146, Pt2 169-182 (1987).
- Wroblewski, J., Roomans, G. M. X-ray microanalysis of single and cultured cells. Scanning Electron Microscopy. , Pt 4 1875-1882 (1984).
- Wroblewski, J., Müller, R. M., Wroblewski, R., Roomans, G. M. Quantitative X-ray microanalysis of semi-thick cryosections. Histochemistry. 77 (4), 447-463 (1983).
- Zierold, K. Cryopreparation of mammalian tissue for X-ray microanalysis in STEM. Journal of Microscopy. 125, Pt2 149-156 (1982).
- Harkiolaki, M., et al. Cryo-soft X-ray tomography: Using soft X-rays to explore the ultrastructure of whole cells. Emerging Topics in Life Sciences. 2 (1), 81-92 (2018).
- McDermott, G., Le Gros, M. A., Knoechel, C. G., Uchida, M., Larabell, C. A. Soft X-ray tomography and cryogenic light microscopy: the cool combination in cellular imaging. Trends in Cell Biology. 19 (11), 587-595 (2009).
- Schneider, G., et al. Three-dimensional cellular ultrastructure resolved by X-ray microscopy. Nature Methods. 7 (12), 985-987 (2010).
- Sorrentino, A., et al. MISTRAL: a transmission soft X-ray microscopy beamline for cryo nano-tomography of biological samples and magnetic domains imaging. Journal of Synchrotron Radiation. 22 (4), 1112-1117 (2015).
- Carzaniga, R., Domart, M. C., Duke, E., Collinson, L. M. Correlative cryo-fluorescence and cryo-soft X-ray tomography of adherent cells at European synchrotrons. Methods in Cell Biology. 124, Academic Press. 151-175 (2014).
- Perrin, L., Carmona, A., Roudeau, S., Ortega, R. Evaluation of sample preparation methods for single cell quantitative elemental imaging using proton or synchrotron radiation focused beams. Journal of Analytical Atomic Spectrometry. 30 (12), 2525-2532 (2015).
- Jin, Q., et al. Preserving elemental content in adherent mammalian cells for analysis by synchrotron-based x-ray fluorescence microscopy. Journal of Microscopy. 265 (1), 81-93 (2017).
- Daoust, A., et al. Impact of manganese on primary hippocampal neurons from rodents. Hippocampus. 24 (5), 598-610 (2014).
- Daoust, A., et al. Manganese Cytotoxicity Assay on Hippocampal Neuronal Cell Culture. Bio-protocol. 5 (1), 1368(2015).
- Gibon, J., et al. The over-expression of TRPC6 channels in HEK-293 cells favours the intracellular accumulation of zinc. Biochimica et Biophysica Acta (BBA)-Biomembranes. 1808 (12), 2807-2818 (2011).
- Hasna, J., Bohic, S., Lemoine, S., Blugeon, C., Bouron, A. Zinc Uptake and Storage During the Formation of the Cerebral Cortex in Mice. Molecular Neurobiology. , 1-13 (2019).
- Villar, F., et al. Nanopositioning for the ESRF ID16A Nano-Imaging Beamline. Synchrotron Radiation News. 31 (5), 9-14 (2018).
- Kosior, E., et al. Combined use of hard X-ray phase contrast imaging and X-ray fluorescence microscopy for subcellular metal quantification. Journal of Structural Biology. 177 (2), 239-247 (2012).
- Bohic, S., et al. Synchrotron hard X-ray microprobe: fluorescence imaging of single cells. Applied Physics Letters. 78, 3544-3546 (2001).
- Dubochet, J. On the Development of Electron Cryo-Microscopy (Nobel Lecture). Angwendte Chemie. 57 (34), 10842-10846 (2018).
- Da Silva, J. C., et al. Efficient concentration of high-energy X-rays for diffraction-limited imaging resolution. Optica. 4 (5), 492-495 (2017).
- Studer, D., Humbel, B. M., Chiquet, M. Electron microscopy of high-pressure frozen samples: bridging the gap between cellular ultrastructure and atomic resolution. Histochemistry and Cell Biology. 130 (5), 877-889 (2008).
- Moor, H. Theory and pratice of high pressure freezing. Cryotechniques in Biological Electron Microscopy. Steinbrecht, R. A., Zierold, K. , Springer. 175-191 (1987).
- Gilkey, J. C., Staehelin, L. A. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. Journal of Electron Microscopy Techniques. 3 (2), 177-210 (1986).
- Ferreira, J. L., Matthews-Palmer, T. R., Beeby, M. Electron Cryo-Tomography. Cellular Imaging. , Springer, Cham. 61-94 (2018).
- Colvin, R. A., Jin, Q., Lai, B., Kiedrowski, L. Visualizing metal content and intracellular distribution in primary hippocampal neurons with synchrotron X-ray fluorescence. PLoS One. 11 (7), 0159582(2016).
- Vavpetič, P., et al. Elemental distribution and sample integrity comparison of freeze-dried and frozen-hydrated biological tissue samples with nuclear microprobe. Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms. 348, 147-151 (2015).
- Guerquin-Kern, J. L., Bordat, C. Cryo-preparation procedures for elemental imaging by sims and eftem. Handbook of Cryo-Preparation Methods for Electron Microscopy. , CRC Press. 499-536 (2008).
- Gramaccioni, C., et al. Nanoscale quantification of intracellular element concentration by X-ray fluorescence microscopy combined with X-ray phase contrast nanotomography. Applied Physics Letters. 112 (5), 053701(2018).
- Perrin, L., et al. Zinc and Copper Effects on Stability of Tubulin and Actin Networks in Dendrites and Spines of Hippocampal Neurons. ACS Chemical Neurosciences. 8 (7), 1490-1499 (2017).
- Ortega, R., et al. α-synuclein over-expression induces increased iron accumulation and redistribution in iron-exposed neurons. Molecular Neurobiology. 53 (3), 1925-1934 (2016).
- Fartmann, M., et al. Quantitative imaging of atomic and molecular species in cancer cultures with TOF-SIMS and Laser-SNMS. Applied Surface Sciences. 231 (2), 428-431 (2004).
- Pålsgård, E., Lindh, U., Roomans, G. M. Comparative study of freeze-substitution techniques for X-ray microanalysis of biological tissue. Microscopy Research and Techniques. 28 (3), 254-258 (1994).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved