Method Article
التقييم الكهروميكانيكي لنشاط القلب المعمول وراثياً
In This Article
Summary
نقدم بروتوكولا لتقييم الآثار الكهروميكانيكية لتنشيط GtACR1 في خلايا القلب الأرانب. نحن نقدم معلومات مفصلة عن عزل الخلايا، وزراعة وانتقال الأدينوفيروسات، وعن التجارب الوظيفية مع التصحيح المشبك وتقنيات ألياف الكربون.
Abstract
على مدى العقدين الماضيين ، تم إنشاء أدوات البومقراجينية كوسيلة فعالة لتعديل نشاط محدد من نوع الخلية في الأنسجة المنفعلة ، بما في ذلك القلب. في حين أن Channelrhodopsin-2 (ChR2) هو أداة شائعة لإزالة الاستقطاب من الأغشية المحتملة في cardiomyocytes (CM) ، مما قد يثير إمكانات العمل (AP) ، فقد أداة فعالة لإسكات موثوق ة من نشاط CM. وقد اقترح استخدام قناة الأنيون rhodopsins (ACR) للتثبيط optogenetic. هنا، ونحن وصف بروتوكول لتقييم آثار تفعيل ACR GtACR1 الطبيعية من Guillardia theta في المثقف أرنب CM. القراءة الأولية هي التسجيلات الكهربية الفيزيولوجية التصحيح المشبك والتتبع البصري لتقلصات CM، وكلاهما يؤديها في حين تطبيق أنماط مختلفة من التحفيز الضوئي. ويشمل البروتوكول عزل CM من قلب الأرانب ، والبذر وزراعة الخلايا لمدة تصل إلى 4 أيام ، وإعادة الأنابيب عبر ترميز الخلايا الداينوفية لقناة كلوريد ذات بوابات الضوء ، وإعداد المشبك المشبك والضلابات الكربونية ، وجمع البيانات وتحليلها. باستخدام تقنية التصحيح المشبك في تكوين الخلية الكاملة يسمح لأحد لتسجيل التيارات تنشيط الضوء (في وضع الجهد المشبك، V-المشبك) وAP (وضع المشبك الحالي، I-المشبك) في الوقت الحقيقي. بالإضافة إلى تجارب المشبك المشبك، ونحن إجراء قياسات انقباض للتقييم الوظيفي لنشاط CM دون إزعاج الوسط داخل الخلايا. للقيام بذلك، يتم تحميل الخلايا ميكانيكيا باستخدام ألياف الكربون ويتم تسجيل الانقباضات عن طريق تتبع التغيرات في طول ساركومري ومسافة ألياف الكربون. ويشمل تحليل البيانات تقييم مدة AP من تسجيلات المشبك I، والتيارات الذروة من تسجيلات المشبك V وحساب القوة من قياسات ألياف الكربون. يمكن تطبيق البروتوكول الموصوف على اختبار الآثار البيوفيزيائية لمختلف المؤثرات النمائية على نشاط CM ، وهو شرط أساسي لتطوير فهم ميكانيكي للتجارب البولوجية في أنسجة القلب والقلوب بأكملها.
Introduction
تم تسجيل التيارات الضوئية بوساطة ChR لأول مرة في عين الطحالب الخضراء وحيدة الخلية1،2. بعد وقت قصير من الاستنساخ الجيني والتعبير غير المغاير من Chlamydomonas reinhardtii ChR1 و ChR2 ، تم استخدام ChR كأدوات لتغيير الغشاء المحتمل في البويضات زينوبوس وخلايا الثدييات عن طريق الضوء3،4. التقريب غير انتقائية ChR depolarize غشاء الخلايا مع إمكانية غشاء يستريح التي هي سلبية لاحتمال عكس ChR. وبالتالي يمكن استخدامها لاستخلاص AP في الخلايا مثير، بما في ذلك الخلايا العصبية وCM، مما يسمح سرعة البصرية5،6.
مكملة لChR الميشن، البروتون ضوء يحركها، كلوريد ومضخات الصوديوم7،8،9 وقد استخدمت لمنع النشاط العصبي10،11،12. ومع ذلك ، فإن هذه الأخيرة لها قيود ، تتطلب كثافة ضوء عالية وإضاءة مستدامة ، حيث يتم نقل أيون واحد لكل فوتون ممتص. في عام 2014 ، وصفت دراستان مستقلتان أجراهما Wietek وآخرون وBerndt وآخرون تحويل ChR الذي يجري التيشن إلى ACR عبر طفرات في مسام القناة13،14. بعد عام واحد، تم اكتشاف ACR الطبيعية في الكريبتفيت Guillardia theta (GtACR)15. كما أظهرت ACR المهندسة التوصيل الملص المتبقية ، تم استبدالها بـ ACR الطبيعي ، الذي يتميز بالتوصيل الكبير أحادي القناة وحساسية الضوء العالية15. تم استخدام GtACR لإسكات النشاط العصبي عن طريق استقطاب إمكانات الغشاء نحو إمكانية عكس كلوريد16،17. Govorunova وآخرون تطبيق GtACR1 على الطور المستزرع البطني CM وأظهرت كفاءة التثبيط الضوئي في مستويات كثافة الضوء المنخفض التي لم تكن كافية لتنشيط أدوات تثبيط المتاحة سابقا، مثل مضخة البروتون قوس18. مجموعتنا ذكرت مؤخرا أن GtACR1 بوساطة التثبيط الضوئي لCM يستند إلى نزع الاستقطاب وأنه يمكن أيضا أن تستخدم GtACR1، وبالتالي، لسرعة بصرية من CM19.
هنا ، نقدم بروتوكولًا لدراسة الآثار الكهروفيزيولوجية والميكانيكية للتنشيط الضوئي GtACR1 على CM البطيني للأرنب المستزرع. نحن أول وصف عزل الخلية، وزراعة ونقل. يتم قياس الآثار الكهربية باستخدام التسجيلات المشبك المشبك الخلايا الكاملة. يتم تقييم التيارات بوساطة الضوء في جهد غشاء معين في وضع المشبك V. يتم قياس الديناميات المحتملة للغشاء أثناء سرعة CM كهربائيًا أو بصريًا (وضع I-المشبك). يتم اختبار تثبيط بصري من AP أثار كهربائيا باستخدام تطبيق ضوء مستمر. يتم قياس الآثار الميكانيكية باستخدام ألياف الكربون في تركيبة مع التصوير القائم على تتبع طول ساركومري. للقيام بذلك، يتم تحميل الخلايا القابلة للسرعة بصريا ً من خلال ربط اثنين من ألياف الكربون بغشاء البلازما بالقرب من نهايات الخلية المقابلة. يتم تسجيل تغييرات طول ساركومري أثناء سرعة بصرية أو كهربائية. وأخيرا، يتم قياس التثبيط الضوئي أثناء التحفيز الميداني الكهربائي للخلايا، ويتم تحليل القوى المولدة.
يتضمن البروتوكول الخطوات التالية الموضحة في المخطط الانسيابي في الشكل 1:تخدير الأرانب العميق ، حقن جرعة زائدة من الثيوبينتال ، استئصال القلب ، Langendorff-perfusion وهضم الأنسجة ، التفكك الميكانيكي للأنسجة لإطلاق الخلايا ، التحليل المجهري لغلة CM ، زراعة CM ، تحويل القناة مع نوع الأدينوفيروس 5 ، تليها التجارب الحاضنة والوظيفية.

الشكل 1: مخطط انسيابي للبروتوكول المستخدم للحصول على CM قابل للحركة كهربائياً وبصرياً. يتم استئصال القلوب من الأرانب 9-10 أسابيع من العمر، ويتم هضم أنسجة القلب في حين يجري مرحبة باستخدام إعداد Langendorff. يتم تحرير الخلايا عن طريق التحريض الميكانيكي. يتم احتساب العائد CM تحت المجهر. يتم استزراع CM ، وتنتقل مع نوع الأدينوفيروس 5 ويتم إجراء التجارب الوظيفية 48-72 ساعة بعد النقل. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
وأجريت جميع تجارب الأرانب وفقا للمبادئ التوجيهية الواردة في التوجيه 2010/63/EU الصادر عن البرلمان الأوروبي بشأن حماية الحيوانات المستخدمة للأغراض العلمية ووافقت عليها السلطات المحلية في بادن فورتمبرغ (Regierungspräsidi Freiburg, X-16/10R, ألمانيا).
1- حلول لعزل الخلايا
- إعداد الحلول لعزل الخلية بالماء من المتطلبات التالية(الجدول 1)ووفقا للتراكيب الأيونية المدرجة في الجدول 2.
ملاحظة: يتم إضافة CaCl2 و MgCl2 من حلول الأسهم 1 M.
| الاحتياجات من المياه | |
| الموصلية [μS/cm] عند 25 درجة مئوية | 0.055 |
| بايروجين [الاتحاد الأوروبي/مل] | < 0.001 |
| الجسيمات (حجم > 0.22 ميكرومتر) [1/mL] | ≤ 1 |
| إجمالي الكربون العضوي [ppb] | < 5 |
| الكائنات الحية الدقيقة [CFU/mL] | ≤ 1 |
| RNase [نانوغرام/مل] | < 0.01 |
| DNase [نانوغرام/مل] | < 4 |
الجدول 1: الاحتياجات من المياه.
| محلول سفيزي وكحلي مُلسي (1) | انخفاض الكالسيوم، وارتفاع حل البوتاسيوم (2) | محلول الإنزيم (3) | حل الحظر | |
| NaCl [mM] | 137 | 137 | 137 | 137 |
| KCl [mM] | 4 | 14 | 14 | 14 |
| HEPES [mM] | 10 | 10 | 10 | 10 |
| الكرياتين [mM] | 10 | 10 | 10 | 10 |
| تورين [mM] | 20 | 20 | 20 | 20 |
| الجلوكوز [mM] | 10 | 10 | 10 | 10 |
| MgCl2 [mM] | 1 | 1 | 1 | 1 |
| أدينوسين [mM] | 5 | 5 | 5 | 5 |
| L-كارنيتين [mM] | 2 | 2 | 2 | 2 |
| CaCl2 [mM] | 1 | - | 0.1 | 0.1 |
| نا-هيبارين [IU/L] | 5000 | - | - | - |
| EGTA [mM] | - | 0.096 | ||
| الكولاجين من النوع 2، 315 U/mg [g/L] | - | - | 0.6 | - |
| بروتياز الرابع عشر [ز/لتر] | - | - | 0.03 | - |
| بوملين مصل الألبومين [٪] | - | - | - | 0.5 |
| أوسومولاتي [mOsmol/L] | 325 ± 5 | 345 ± 5 | 345 ± 5 | 345 ± 5 |
الجدول 2: حلول لعزل CM.
- ضبط جميع الحلول لدرجة الحموضة 7.4 في 37 درجة مئوية والتحقق من osmolarity.
ملاحظة: حل الإنزيمات (الكولاجين من النوع 2 والبروتياز الرابع عشر) مباشرة قبل استئصال القلب. الأوكسجين جميع الحلول قبل الاستخدام.
2. إعداد إعداد Langendorff-perfusion
ملاحظة: الإعداد المستخدم مصنوع حسب الطلب. كما هو مبين في الشكل 2، يتكون الإعداد من ثلاثة خزانات المياه السترة (1-3) ، واحد دوامة مكافحة تدفق المبادل الحراري (4) ووعاء التروية المياه سترة (5).

الشكل 2 : Langendorff - التروية الإعداد الأمثل لعزل خلية الأرانب. (1-3) خزانات المياه السترة مع (1) محلول ملحي فسيولوجي، (2) انخفاض الكالسيوم، وارتفاع محلول البوتاسيوم و (3) محلول القلب المحتوي على إنزيم. (4) دوامة مكافحة تدفق مبادل حراري و (5) المياه سترة جمع الخزان. تدفق المياه السترة النظام هو المبادل الحراري الحلزوني (درجة حرارة الحلول التي تترك قنية الترويفية في نهاية المبادل الحراري يجب أن تكون ثابتة عند 37 درجة مئوية) ، تليها سفينة التروية والخزانات الثلاثة. جميع الحلول هي المؤكسج (خط متقطع). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- قم بتشغيل مضخة حمام الماء لتعميم المياه عند 38 درجة مئوية في نظام التبادل الحراري وتسخين جميع الحلول إلى 37 درجة مئوية.
ملاحظة: يجب التحكم في درجة الحرارة في التدفق إلى الخارج (4) وثابتة عند 37 درجة مئوية. - ملء الخزانات الثلاثة مع الحل المعني وغسل كل سطر (أسود) مع الحل المقابل. ملء الخط الرئيسي (الأزرق) في نهاية دون فقاعات الهواء باستخدام الحل (1).
ملاحظة: الأوكسجين الحلول قبل (10 دقيقة) وأثناء الاستخدام. ملء الخط من الخزان (3) إلى الصنبور مع انخفاض الكالسيوم، وارتفاع البوتاسيوم الحل. - إعداد خياطة لربط القلب حول الأورطان في قنية.
3- عزل الخلايا
- إعداد المحاقن التالية.
- للتخدير/ التخدير: اخلط 0.5 مل/كغ وزن الجسم الإسكيتامين هيدروكلوريد (25 ملغم/مل) و0.2 مل/كغ وزن الجسم xylazine هيدروكلوريد (2%).
- ملء اثنين من المحاقن مع 12 مل من حل NaCl (0.9٪).
- إعداد 6 مل من 12.5 ملغ / مل نا ثيوبينتال, حل في 0.9% محلول NaCl.
- ملء 0.2 مل من هيدروكلوريد الإسكيتامين (25 ملغ / مل) في حقنة.
- تمييع 0.2 مل من نا-هيبارين (5000 وحدة دولية/مل) في 1 مل من محلول NaCl 0.9٪ (تركيز نهاية 1000 وحدة دولية / مل).
- الأرانب السّيدات/تخدير (9-10 أسابيع، أرنب أبيض نيوزيلندي، أنثى أو ذكر، ~ 2 كجم) عن طريق الحقن العضلي لهيدروكلوريد الإسكيتامين وهيدروكلوريد إكسلازين (الخطوة 3.1.1).
ملاحظة: تحتاج الأرانب إلى 10 دقيقة على الأقل ليتم تهوّنها بالكامل؛ المدة الدقيقة يعتمد على وزن الجسم. تأكيد التخدير مع فقدان رد الفعل الصحيح. - اُزل الصدر والأذنين حيث توجد الأوردة.
- أدخل قنية مرنة في وين الأذن، وأصلحها بالشريط وامسحها بحل NaCl بنسبة 0.9%.
- حقن 1 مل من محلول Na-heparin عن طريق الوريد وتدفق مع 0.9٪ محلول NaCl.
- حقن 0.2 مل من هيدروكلوريد الإسكيتامين, تدفق مرة أخرى مع 0.9% محلول NaCl وحقن Na-thiopental حتى انقطاع النفس.
ملاحظة: يجب أن لا يستجيب الأرنب إلى انعكاس سحب الدواسة. - فتح الصدر في الجانب الأيسر وإزالة التامور.
- بدء الموقت عندما يتم استئصال القلب وغسل القلب مرتين في محلول مالفيفسي.
ملاحظة: استخدم المقص مع نصائح مستديرة لمنع تلف عرضي لأنسجة القلب. - Cannulate الأورطا في حمام مع محلول مالفيفسي والحفاظ على جميع الأنسجة في الحل. التبديل على نظام Langendorff-perfusion (محلول سفيسي للمحلول المالح (1)، سرعة 24 مل/دقيقة).
- نقل القلب إلى الإعداد Langendorff-التروية، وربط الأورطان إلى فوهة perfusate، وربط بإحكام القلب مع خياطة حول الأورطا إلى قنية (< 1 دقيقة).
ملاحظة: ما قبل ملء قنية مع محلول المالحة الفسيولوجية، وضمان عدم دخول فقاعات الهواء قنية أثناء النقل من موقع cannulation إلى الإعداد Langendorff، وربط فقاعة خالية. - يُبرّر القلب حتى يتم غسل كل الدم (2-3 دقيقة).
- التبديل إلى انخفاض الكالسيوم، وارتفاع حل البوتاسيوم (2). Perfuse لمدة 2 دقيقة أخرى بعد توقف القلب عن النبض والتحول إلى محلول الإنزيم.
- بدء تدوير محلول الإنزيم، بعد 2 دقيقة من بداية الهضم، مرة أخرى إلى الخزان. تقليل السرعة إلى 16 مل / دقيقة بعد 5 دقيقة من الهضم.
- عندما يظهر النسيج لينة (40-50 دقيقة من الهضم)، وقطع القلب قبالة قنية وفصل البطين الأيسر.
- إطلاق الخلايا عن طريق التفكك الميكانيكي (بلطف سحب بعيدا عن الأنسجة مع ماصة وملقط غرامة لعقد الأنسجة) في حل حجب.
- تصفية تعليق الخلية من خلال شبكة (حجم المسام من 1 ملم2)والطرد المركزي لمدة 2 دقيقة في 22 × ز (تسارع الجاذبية).
- إزالة supernatant التي تحتوي على غير myocytes وإعادة تعليق CM في حل حظر.
4. زراعة CM
ملاحظة: تنفيذ الخطوات التالية تحت ظروف معقمة.
- تمييع لامينين (من Engelbreth-Holm-سرب murine sarcoma غشاء الطابق السفلي، 1 ملغ/مل) 1:10 في الفوسفات المعقم المالحة العازلة (دونCa+ 2 +/Mg2+)إلى تركيز نهائي من 100 ميكروغرام/مل.
- إعداد الوسط الثقافي في M199-Medium مع المكملات الغذائية كما هو مبين في الجدول 3.
| وسط ثقافة الخلية في M199-متوسطة | |
| الكرياتين [mM] | 5 |
| L-كارنيتين هيدروكلوريد [mM] | 2 |
| تورين [mM] | 5 |
| نا بيروفات [mM] | 1 |
| الأنسولين (البنكرياس البقري) [U/L] | 0.25 |
| سيتوسين-α-D-arabinofuranoside [mM] | 0.01 |
| جنتاليسين [ملغم/مل] | 0.05 |
الجدول 3: وسط ثقافة الخلية.
- محلول الفلتر المعقم (0.22 ميكرومتر) وإضافة 5٪ مصل الأبقار الجنينية.
- لتجارب المشبك التصحيح التغطيات الأوتوكلاف ø 16 ملم، سمك رقم 0، معطف لهم مع 100 ميكروغرام / مل لامين ين مباشرة قبل التعبد.
- لتجارب ألياف الكربون، معطف سطح طبق بيتري مع بولي (2-هيدروكسيثيل ميثاكريلات) (بولي-هيما، 0.12 غرام/مل في 95:5 EtOH:H20) والسماح لها ترسيخ.
ملاحظة: الخلايا لا 'عصا' لبولي هيما المغلفة بيتري الأطباق; هذا أمر بالغ الأهمية لانكماشهم أقل الاحتكاك في دراسات ميكانيكا الخلايا. - بعد إعادة تعليق CM قد استقر (~ 10-15 دقيقة)، وإزالة supernatant، ومن ثم إعادة تعليق CM في وسط الثقافة.
- عد CM مع غرفة نيوباور والبذور في كثافة مستهدفة من 17500 خلية / مل إما على القسائم المغلفة لامين ينفي أو في بولي هيما المغلفة بيتري الأطباق.
- الخلايا المحتضنة في 37 درجة مئوية، 5٪ CO2 لمدة 3-4 ساعات. تبادل المتوسطة (37 درجة مئوية) من الخلايا المبذر coverslip.
- إضافة الأدينوفيروس (نوع 5) الترميز لGtACR1-eGFP في تعدد العدوى (MOI) من 75 والبدء في التجارب الوظيفية بعد 48 ساعة.
ملاحظة: بعد نقل إبقاء الخلايا في الظلام. استخدم الإضاءة الحمراء عند العمل مع البروتينات الزرقاء أو الخضراء التي يتم تنشيطها ضوئيًا. ويستخدم نظام إيصال الأدينوفيالفيروسي المتاح تجارياً (انظر جدول المواد)لاستنساخ الجينات التي تقوم بترميز GtACR1-eGFP في متجه الغدالفيروسي. إدراج الفائدة ، وهنا GtACR1 - eGFP ، هو تضخيم PCR ومن ثم جنبا إلى جنب مع ناقلات الغدية بما في ذلك مروجيه CMV في تفاعل الاستنساخ في الانصهار. يستخدم مروج CMV (الفيروس المضخم للخلايا البشرية) عادة لدفع التعبير المفرط للجينات المتحولة في خلايا الثدييات. eGFP هو بروتين الفلورسنت الأخضر المعزز المستمدة من فيكتوريا Aequorea مع حد أقصى الإثارة من 488 نانومتر والحد الأقصى للانبعاثات في 507 نانومتر. تم إنتاج فيروس أدينو (من النوع 5) خارجيًا في شاريتيه-يونيفرسيتماديزين برلين، معهد فور فارماكولوجي، برلين، البروفيسور الدكتور مايكل شوب.
تنبيه: يتم تصنيف الاختزال الأدينوفيلي على أنه عمل على مستوى السلامة BSL-2، وتدابير السلامة المناسبة مطلوبة قانونيًا.
5- التجارب الوظيفية
ملاحظة: يتم إجراء التسجيلات باستخدام مجهر الفلورسة المقلوب. قم بتصفية ضوء الإرسال بواسطة فلتر أحمر تمرير ة النطاق (630/20 نانومتر) في المكثف لتجنب التنشيط المشترك لـ GtACR1.
-
إعداد التصحيح المشبك
- استخدم مكبر للصوت مع محول تماثلي إلى رقمي. استخدام برنامج الحصول على البيانات لتسجيل البيانات الحالية والجهد (انظر جدول المواد).
ملاحظة: يتم رقمنة البيانات المسجلة بسرعة 10 كيلو هرتز وتصفيتها عند 5 كيلو هرتز.
- استخدم مكبر للصوت مع محول تماثلي إلى رقمي. استخدام برنامج الحصول على البيانات لتسجيل البيانات الحالية والجهد (انظر جدول المواد).
-
إعداد ألياف الكربون
- استخدم الكاميرا للكشف عن موضع ألياف الكربون وطول الساركومر عن طريق تتبع التغيرات في التباين البصري (تظهر ألياف الكربون كهياكل أغمق ، متراكبة على نمط الخلية المتربسية). يظهر تمثيل تخطيطي للإعداد في الشكل 3.
ملاحظة: يتم حساب طول ساركومري في الوقت الحقيقي باستخدام تحويل فورييه سريع (FFT) من طيف الطاقة لنمط التطفّر.
- استخدم الكاميرا للكشف عن موضع ألياف الكربون وطول الساركومر عن طريق تتبع التغيرات في التباين البصري (تظهر ألياف الكربون كهياكل أغمق ، متراكبة على نمط الخلية المتربسية). يظهر تمثيل تخطيطي للإعداد في الشكل 3.

الشكل 3: مخطط يصور الإعداد التجريبي لقياسات ألياف الكربون. (الرسم ليس على نطاق واسع). يتم إرفاق اثنين من ألياف الكربون على خلية ويتم التحكم في موقفهم من قبل موضع بيزو. يتم استخدام البيسر لتحفيز المجال الكهربائي. وتقترن المصابيح متعددة الألوان في منفذ epifluorescence من المجهر المقلوب لإضاءة الخلايا في الطائرة الكائن. يتم التحكم في قوة LED عبر صندوق تحكم مخصص ، والذي يتلقى نبضات رقمية عبر الإخراج الرقمي للمحول الرقمي التماثلي (DAC). يتصل DAC عبر الإخراج التماثلي مع واجهة نظام الفلورسينس. يتم توصيل كاميرا بالأبيض والأسود (774 بكسل في 245 خط) للتصوير الخلوي بالكمبيوتر لتتبع طول ساركومر والانحناء من ألياف الكربون. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- إضاءة موقوتة
- توفير الضوء للمجهر الفلوري وتنشيط قنوات الأيون ذات البوابة الخفيفة عبر صندوق تحكم LED خارجي مصمم خصيصًا ، يتألف من ثلاثة مصابيح LED من لون مختلف (460 نانومتر ، 525 نانومتر ، 640 نانومتر ، انظر جدول المواد).
- تعديل رمز وحدة التحكم الدقيقة وواجهة المستخدم الرسومية (GUI) لمربع التحكم للسماح بالتحكم في LED عبر نبضات Time to Live (TTL) الخارجية ، التي تم إنشاؤها في بروتوكولات برامج الحصول على البيانات (انظر جدول المواد). نقل نبضات TTL إلى مربع التحكم LED عبر المحول الرقمي التماثلي.
- محرك الأقراص واختيار عدد من البقول عبر واجهة المستخدم الرسومية. عند تلقي الأمر من واجهة المستخدم الرسومية المتحكم الدقيقة يبدأ عملية على نواة جديدة. في هذه العملية سيتم فحص إدخال TTL بالإضافة إلى مجموعة تبديل التحكم من واجهة المستخدم الرسومية بشكل مستمر.
- عندما يكون إدخال TTL موجبًا، يقوم المتحكم بتشغيل LED ثم يستأنف التحقق من إدخال TTL. بمجرد عودة إشارة TTL إلى الصفر، يقوم المتحكم ببإيقاف تشغيل LED ويقلل من عدد النبضات التي يتركها واحد. إذا كان مفتاح التحكم في أي وقت غير صحيح أو عدد النبضات صفر، يتوقف المتحكم الدقيق عن هذه العملية حتى يتم تلقي أمر جديد من واجهة المستخدم الرسومية.
- الزوجين مباشرة المصابيح في الجزء الخلفي من المجهر.
- تحديد شدة الضوء في مستوى الكائن
- قياس المنطقة المضيئة مع ميكرومتر المرحلة (التكبير الهدف 40x، A = 0.8 ملم2).
- استخدام عداد الطاقة البصرية (انظر جدول المواد).
- حدد إعدادات التجارب: الطول الموجي للإثارة (525 نانومتر) ، التكبير الموضوعي (40x) ، مرشح الإثارة (530/20 نانومتر) أو المرآة ، واقرأ قوة الضوء [W] في مختلف الفولتية LED- input.
- احسب شدة الضوء [W/mm2]عن طريق قسمة قوة الضوء [W] على المنطقة المضيئة [مم2](هنا: 0.8 مم2).
ملاحظة: قياس قوة الضوء الفعلية مع البروتوكولات ذات الصلة في الخطوة 5.6 للتحقق مما إذا كانت فترات نبض الضوء القصير من الوصول إلى 10 مللي ثانية والمدد الطويلة تحمل القيمة المحددة(الشكل التكميلي 1).
- التحضير لتجارب المشبك الترقيعي
- إعداد الحلول الخارجية والداخلية التالية(الجدول 4؛ لمتطلبات المياه انظر الجدول 1).
- ضبط osmolarity مع الجلوكوز إلى 300 ± 5 mOsmol / L. Aliquot الحل الداخلي وتخزينها في -20 درجة مئوية.
ملاحظة: الاحتفاظ بالحل الداخلي على الجليد ليوم التسجيل. حافظ على الحل الخارجي في درجة حرارة الغرفة. وتستند حلول التصحيح المشبك وصفها هنا على الحلول المستخدمة سابقا وCl- تم تغيير التركيز إلى مستويات أقل وأكثر فسيولوجية7. لتوصيف انتقائية الأيون للرائد الأوبتوري جيني المعني ، نقترح تغيير تركيزات الأيونات الرئيسية (على سبيل المثال ، Cl-، Na+، K+، H+) في الحلول خارج وداخل الخلايا19. - خلع القطب تسجيل من حامل ماصة وإزالة طبقة كلوريد الفضة من السلك الفضي مع الصنفرة غرامة جدا.
ملاحظة: قم بهذه الخطوة في بداية كل يوم قياس. - قم بتوصيل السلك بالقطب الإيجابي لبطارية 1.5 فولت واغمر في محلول 3 M KCl لطلاء كلوريد الفضة لمدة 10 دقيقة.
ملاحظة: يتم توصيل القطب السلبي إلى سلك فضي مرجعي مغمور في حل 3 M KCl. - إعداد غرفة القياس: وضع الشحوم السيليكون على إطار غرفة القياس ووضع غطاء (قطرها: 50 ملم، سمك رقم 0) على الجزء العلوي من الإطار أن الغرفة مختومة.
- وضع مرجع الفضة / الفضة كلوريد بيليه القطب في الحمام وتوصيله مع مرحلة الرأس.
- سحب 1.7 - 2.5 MΟ ماصة التصحيح من الشعيرات الزجاجية الجير الصودا (القطر الخارجي: 1.55 ملم، القطر الداخلي: 1.15 ملم) مع سحب ميكروبيب (انظر جدول المواد).
- بدء تشغيل برنامج الحصول على البيانات وضبط اختبار الغشاء (نبض 10 mV لمدة 15 مللي ثانية، خط الأساس 0 mV).
| حل حمام خارجي | حل ماصة داخلي | |
| NaCl [mM] | 140 | - |
| KCl [mM] | 5.4 | 11 |
| CaCl2 [mM] | 1 | - |
| MgCl2 [mM] | 2 | 2 |
| الجلوكوز [mM] | 10 | - |
| HEPES [mM] | 10 | 10 |
| K-أسبارتات [mM] | - | 119 |
| Mg-ATP [mM] | - | 3 |
| EGTA [mM] | - | 10 |
| الرقم الهيدروجيني | 7.4 (NaOH) | 7.2 (كوه) |
| Osmolarity (ضبط مع الجلوكوز) [mOsmol / L] | 300 ± 5 | 300 ± 5 |
الجدول 4: حلول المشبك الترقيعي.
- بروتوكولات لقياسات المشبك الترقيعي
- سجل بروتوكول التنشيط الضوئي في وضع V-المشبك في احتمال عقد من -74 mV. استخدام نبضات ضوئية من 300 مللي ثانية.
ملاحظة: نقترح إجراء تسجيلات V-المشبك بالقرب من إمكانية غشاء يستريح من CM المستزرعة (المنشأة في I-المشبك؛ في أيدينا بين -79 mV و-77 mV على حد سواء لcm المنقولة وغير المنقولة19). الخلايا المعزولة حديثا تظهر متوسط غشاء يستريح المحتملة من -79 mV(الشكل التكميلي 2،جميع القيم بعد التصحيح لالسائل ة تقاطع المحتملة). - سجل AP في وضع I-المشبك في 0 pA.
- للسرعة الكهربائية، وحقن النبضات الحالية من 10 مللي ثانية (منحدر من 0 pA إلى القيمة المحددة في غضون 10 مللي ثانية)، 0.25 هرتز والعثور على عتبة للحصول على AP. سجل AP عن طريق الحقن الحالية من 50٪ أكثر من عتبة.
- لسرعة البصرية استخدام نبضات الضوء من 10 مللي ثانية، 0.25 هرتز في الحد الأدنى من شدة الضوء للحصول على AP موثوق بها.
- تسجيل التثبيط الضوئي في وضع I-المشبك في 0 pA. استثارة AP كما هو موضح في الخطوة 5.6.2.1 وتطبيق الضوء المستمر لمدة 64 ث في 4 mW/mm2 بعد 15 تشغيل كهربائيا AP.
ملاحظة: الشكل 6F يظهر بروتوكول التثبيط الضوئي حيث يتم تطبيق حقن الحالية أعلى ضوء مستمر. ابتداء من 1.5 مرة عتبة (هنا: 0.7 nA) تم زيادة التيار حقن في خطوات من 0.1 nA (المستوى النهائي: 2.2 nA). في جميع السعة الحالية اختبارها، وتثبيط تطبيق ضوء مستمر توليد AP.- كتجربة تحكم، توقف التحفيز الكهربائي لمدة 64 s دون تطبيق خفيف.
- سجل بروتوكول التنشيط الضوئي في وضع V-المشبك في احتمال عقد من -74 mV. استخدام نبضات ضوئية من 300 مللي ثانية.
- تجارب المشبك التصحيح
ملاحظة: تنفيذ التجارب التالية في الظلام (يمكن استخدام الضوء الأحمر للأدوات تنشيط الضوء الأزرق/الأخضر).- ضع غطاء مع الخلايا في غرفة القياس مع حل خارجي وحدد CM الفلورية.
ملاحظة: يمكن الكشف عن الخلايا الإيجابية من eGFP باستخدام LED أزرق (460 نانومتر) بالاقتران مع مرشح إثارة تمرير الفرقة (450 نانومتر - 490 نانومتر) ومرآة ديكلويك 510 نانومتر ومرشح انبعاث طويل التمرير 515 نانومتر. إذا تم استخدام علامات الفلورسنت الأخرى، استخدم مجموعات فلتر LED ومضان ية مناظرة. إذا تم تحقيق كفاءة نقل عالية (في أيدينا > 99٪ مع الـ GtACR1 adenovirus)، فلا حاجة للتحقق من تفلور eGFP قبل التجارب الوظيفية؛ هذا يتجنب المحتملة GtACR1 التنشيط المسبق. - ملء ماصة التصحيح مع الحل الداخلي. تأكد من عدم وجود فقاعات هواء في الطرف.
- إرفاق ماصة إلى حامل ماصة، وإدراج الفضة كلوريد تسجيل الأسلاك الفضية المغلفة في الحل الداخلي.
- بعد الوصول إلى التكوين المرفق بالخلية، قم بالتبديل إلى وضع الخلية الكاملة في برنامج الحصول على البيانات مع إمكانية الاحتفاظ بـ -74 mV. تمزق الغشاء عن طريق تطبيق بلطف الضغط السلبي للوصول إلى تكوين الخلية الكاملة. ويدل على ذلك الزيادة الفورية في الزيادة المقاسة.
- تشغيل البروتوكولات الموضحة في القسم 5.6.
- ضع غطاء مع الخلايا في غرفة القياس مع حل خارجي وحدد CM الفلورية.
- تقنية ألياف الكربون
- إنتاج ألياف الكربون.
- استخدام الشعيرات الدموية الزجاجية مع المعلمات التالية: القطر الخارجي: 2.0 ملم، القطر الداخلي: 1.16 ملم، الطول: 100 ملم (انظر جدول المواد). باستخدام السُحب الميكروبيبيت، اسحب الشعيرات الزجاجية إلى ماصين من نفس الطول (إجمالي طول التفتق ~ 11 مم، الشكل 5)إلى قطر داخلي نهائي يبلغ ~ 30 ميكرومتر.
ملاحظة: الإعدادات المستخدمة للسحب الأول والثاني هي 85.2٪ (نسبة إلى الحد الأقصى لإخراج السلّحب) و 49.0٪، على التوالي (ستعتمد على السُلّف ونوع وعمر الخيط). - ثني ماصات تصل إلى 45 درجة مع صياغة صغيرة عصامي باستخدام إعدادات 12 V، 24 A (انظر الشكل 4 للحصول على تفاصيل الإعداد الانحناء ماصة ماصة).
- محاذاة الشعيرات الدموية (2) على الخط الأحمر في دائرة التوجه (5)، والحفاظ على تحديد المواقع من الشعرية ثابت حتى طول جزء الانحناء هو نفسه دائما بعد مركز دائرة التوجه (دائرة نصف قطرها من 4.5 ملم).
- ثني الشعيرات الدموية تصل إلى 45 درجة (الخط الأخضر) عن طريق دفع أسفل غيض من الشعيرات الدموية مع بندر (3) وصياغة عن طريق تسخين خيوط (4) حتى يلتقط الشعيرات الدموية زاوية 45 درجة حتى بعد إزالة بندر.
- تناسب ألياف الكربون (المقدمة من البروفيسور جان إيف لو Guennec) في غيض من غرامة من الشعيرات الدموية الزجاجية تحت المجهر ستيريو. استخدام ملقط غرامة مع أنابيب لينة في نهاية لزيادة قبضة وتقليل خطر إتلاف الألياف.
ملاحظة: تتميز هذه الألياف بهياكل دقيقة ، مما يزيد من سطح الاتصال بين الألياف والخلايا ، وبالتالي تحسين الالتصاق20. - قطع ألياف الكربون على طول 2 ملم واستخدام الغراء السوبر (سيانواكريلات) لإصلاح الألياف إلى القسم الأمامي من الشعيرات الدموية.
ملاحظة: كلما طالت الألياف، كلما انحنت عند تطبيق نفس القوة.
- استخدام الشعيرات الدموية الزجاجية مع المعلمات التالية: القطر الخارجي: 2.0 ملم، القطر الداخلي: 1.16 ملم، الطول: 100 ملم (انظر جدول المواد). باستخدام السُحب الميكروبيبيت، اسحب الشعيرات الزجاجية إلى ماصين من نفس الطول (إجمالي طول التفتق ~ 11 مم، الشكل 5)إلى قطر داخلي نهائي يبلغ ~ 30 ميكرومتر.
- معايرة ألياف الكربون.
- معايرة ألياف الكربون باستخدام محول قوة مع حساسية من 0.05 mN / V ونطاق قوة من 0 - 0.5 mN (انظر جدول المواد).
ملاحظة: هذا الإعداد مصنوع حسب الطلب من أجل قياس الضغط بدلاً من "سحب". - إرفاق الشعيرات الدموية مع ألياف الكربون إلى حامل التي يتم التحكم فيها من قبل micromanipulator ومحرك بيزو.
- ضع طرف الألياف في اتصال مع مستشعر القوة ، ولكن دون إنتاج أي قوة وحرك محرك بيزو بخطوات 10 ميكرومتر (حركة إجمالية تبلغ 60 ميكرومتر) نحو المستشعر واقرأ الجهد المقاس(E)في فولت.
ملاحظة: تأكد من الاتصال محول القوة من قبل غيض جدا من نهاية حرة من ألياف الكربون. - كرر هذه القياسات ثلاث مرات.
- استخدام الفورمولا 1 لحساب القوة لكل موقف بيزو(ΟА
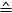 الفرق من الجهد قياس بين الخطوات الحركية بيزو):
الفرق من الجهد قياس بين الخطوات الحركية بيزو):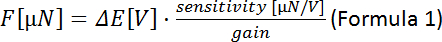
ملاحظة: تعتمد حساسية محول القوة على نموذج المحول (هنا: 0.05 mN/V = 50 μN/V). يمكن تعيين المكسب في وحدة التحكم. - رسم القوة [μN] ضد موقف بيزو. الميل يتوافق مع صلابة الألياف [μN/μm].
- معايرة ألياف الكربون باستخدام محول قوة مع حساسية من 0.05 mN / V ونطاق قوة من 0 - 0.5 mN (انظر جدول المواد).
- قوة قياسية للتعاقد مع CM.
ملاحظة: إجراء التجارب التالية في الظلام (يمكن استخدام الضوء الأحمر للأدوات الزرقاء / الخضراء تنشيط الضوء).- معطف سطح غرفة القياس مع بولي هيما. ملء غرفة القياس مع حل حمام خارجي ووضع بضع قطرات من تعليق الخلية المستزرعة في الغرفة (الخطوة 4.9).
- إرفاق الشعيرات الدموية مع ألياف الكربون إلى micromanipulator المرحلة. حدد GtACR1-التعبير عن CM عن طريق التحقق من القدرة على الحث على الانقباضات عن طريق تطبيق نبضات الضوء الأخضر القصيرة. محاذاة ألياف الكربون أفقيا تقريبا إلى سطح غرفة القياس.
- خفض الألياف الأولى على سطح الخلية. إرفاق الألياف الثانية بالتوازي مع الألياف الأولى في الطرف الآخر من CM. المحاذاة المثالية شبه متعامدة إلى محور الخلية.
ملاحظة: قم بتوصيل الألياف عن طريق دفع الخلية برفق إلى السطح السفلي. الإفراج عن الضغط قبل إرفاق الألياف الثانية. لا تمتد الخلية عن طريق إرفاق الألياف الثانية. - بعد أن يتم إرفاق كل من الألياف على الخلية، ورفع الألياف، وبالتالي فإن الخلية ليس لديها اتصال إلى سطح الغرفة بعد الآن وقادرة على التعاقد دون أي احتكاك.
- التركيز على sarcomeres في برنامج الحصول على البيانات (انظر جدول المواد)وتعيين مسار مسار sarcomere نافذة(الشكل 7A I (3)بين الألياف.
ملاحظة: ينتج طيف الطاقة FFT(الشكل 7A I (2)) يظهر بشكل مثالي ذروة حادة واحدة، تمثل متوسط طول sarcomere. - تتبع الألياف الانحناء باستخدام وحدة الكشف عن الحافة. تعيين مناطق الكشف مع النافذة الحمراء والخضراء وتحديد عتبة (خط أفقي أحمر وأخضر) عند المشتقة الأولى من أثر شدة الضوء(الشكل 7A III).
- ابدأ في تسريع سرعة الخلية بصريًا بسرعة 0.25 هرتز (إذا أمكن، حاول معدلات سرعة أسرع) وتتبع طول ساركومري وثني الألياف.
ملاحظة: يتم التحكم في موقف حامل الألياف، مشغل LED ونبضات التحفيز الكهربائي عبر برنامج الحصول على البيانات (انظر جدول المواد). - بعد تسجيل ما لا يقل عن 15 تقلصات أثاربصريا، حقل تحفيز الخلية كهربائيا (انظر جدول المواد). العثور على عتبة لاثارة الانقباضات وسجل من خلال تطبيق 1.5 مرات من الجهد عتبة.
- لبروتوكول تثبيط، وتطبيق المحفزات الكهربائية لاثارة تقلصات ومن ثم فضح لضوء مستمر من 64 ق (في شدة الضوء المختلفة).
- إنتاج ألياف الكربون.

الشكل 4: إعداد الانحناء ماصة ماصة. (1) يتم استخدام micromanipulator على الجانب الأيسر للسيطرة على موقف الشعيرات الدموية ، ويستخدم micromanipulator الثاني على اليمين لثنيه. (2) الشعيرات الدموية. (3) بندر. (4) ميكروفورج. (5) دائرة التوجيه. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: ماصة مع ألياف الكربون. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
6 - تحليل البيانات
-
تسجيلات المشبك التصحيح
ملاحظة: تصحيح كافة الفولتية المسجلة والأوامر لإمكانات تقاطع السائل بعد التجربة. تحديد إمكانات تقاطع السائل في برنامج الحصول على البيانات باستخدام آلة حاسبة أداة تقاطع المحتملة (لحلول التصحيح المشبك المذكورة في الجدول 4: 14.4 mV في 21 درجة مئوية). طرح السائل تقاطع المحتملة من الجهد المسجلة / الأمر.- لتسجيلات I-المشبك AP، تحقق من سرعة الكهربائية مقابل سرعة البصرية. حساب مدة AP (APD) في 20 و 90٪ إعادة الاستقطاب مع سيناريو مكتوب خصيصا(المواد التكميلية). تحديد إمكانية الغشاء يستريح وسعة AP.
ملاحظة: تحديد APD كما هو موضح في وانغ K. وآخرون21 البرنامج النصي لتحميل ملفات .abf يمكن الوصول إليها بشكل عام عبر الرابط التالي: https://de.mathworks.com/matlabcentral/fileexchange/22114-fcollman-abfload. متوسط قيم APD لما لا يقل عن 6 AP. - لتنشيط ضوئي V-المشبك، تحقق إذا كان خط الأساس في 0 pA. إذا لم يتم ضبط خط الأساس إلى صفر. تحليل التيار المسجل الذي أثارته نبضات ضوئية 300 مللي ثانية عند -74 مللي فولت. نقل البيانات إلى برامج تحليل البيانات وتحديد ذروة ومتوسط التيار الثابتة.
- لتسجيلات I-المشبك AP، تحقق من سرعة الكهربائية مقابل سرعة البصرية. حساب مدة AP (APD) في 20 و 90٪ إعادة الاستقطاب مع سيناريو مكتوب خصيصا(المواد التكميلية). تحديد إمكانية الغشاء يستريح وسعة AP.
-
تجارب ألياف الكربون
- تسجيلات الانكماش أثناء السرعة البصرية: تحميل البيانات المسجلة في برنامج الحصول على البيانات وقراءة خط الأساس وأقصى حد للانحناء ألياف الكربون والتغيرات طول ساركومري.
ملاحظة: متوسط القيم لـ 10 تقلصات تسجيل مستقر. - قياس عرض الخلية وحساب المنطقة المقطعية للخلية على افتراض مقطع عرضي بيضاوي الشكل(الشكل 7B II).
ملاحظة: صيغة لمنطقة القطع الناقص هي A = οοοοοοοb (الفورمولا 2) حيث a هي المسافة من المركز إلى الرأس و b هي المسافة من المركز إلى الرأس المشترك. في حالتنا هذا يعني = (عرض الخلية) / 2 و ب = (سمك الخلية) / 2. وفقا لنيشيمورا وآخرون22 يمكن تقدير سمك CM ليكون ثلث عرض الخلية بحيث A = ο· (1/2)·عرض· (1/2)·سمك = · (1/4)·عرض· (1/3)·العرض = ο· (1/12)·عرض2. - حساب القوة الانقباضية النهائية (F):
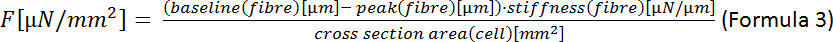
- حساب تشوه الخلية الانقباضي النهائي (ESD):
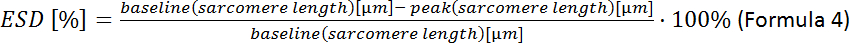
ملاحظة: يمكن تحليل المزيد من المعلمات التعاقد: يستريح طول ساركومري، والوقت إلى الذروة، والوقت إلى الاسترخاء 90٪، وتقصير sarcomere كسور، والسرعة القصوى للانكماش والاسترخاء (انظر دليل اقتناء البرمجيات).
- تسجيلات الانكماش أثناء السرعة البصرية: تحميل البيانات المسجلة في برنامج الحصول على البيانات وقراءة خط الأساس وأقصى حد للانحناء ألياف الكربون والتغيرات طول ساركومري.
النتائج
تم التعبير عن GtACR1-eGFP في الأرانب المثقفة CM(الشكل 6 إدراج) وتم قياس التيارات الضوئية مع تقنية التصحيح المشبك. يُظهر التنشيط الضوئي لـ GtACR1 تيارات موجهة إلى الداخل عند -74 mV. في الشكل 6ذروة التيار(IP)في 4 mW/mm2 هو 245 pA. تم تشغيل AP إما كهربائيًا(الشكل 6B)أو بصريًا(الشكل 6C)مع الحقن الحالية 1.5 أضعاف العتبة ، أو نبضات ضوئية قصيرة من 10 مللي ثانية ، على التوالي. تحليل قيم APD ، ويسير بخطى كهربائية CM تظهر APD 20 من 0.24 ± 0.08 ث وAPD 90 من 0.75 ± 0.17 s ، في حين أن الوتيرة البصرية CM تظهر APD 20 من 0.31 ± 0.08 ق وAPD 90 من 0.81 ± 0.19 ق (SE، n = 5، N = 2، في هنا قدم مثال APD 20الكهربائية = 0.17 ق؛ APD 20البصرية = 0.27 s وAPD 90الكهربائية = 0.61 s; APD 90البصرية = 0.68 s; الشكل 6د). يسير بخطى بصرية CM تظهر أبطأ AP بداية(الشكل 6D). تم تثبيط تنشيط CM على الإضاءة المستدامة (ل64 ث، 4 mW/mm2)عن طريق استقطاب إمكانات الغشاء نحو إمكانية عكس كلوريد، هنا -58 mV(الشكل 6E). حقن الحالية أعلى من 1.5 مرات عتبة لا تثير جيل AP(الشكل 6F). تم تحديد قوات الذروة المتولدة من الانحناء من ألياف الكربون(الشكل 7B، C، E). ولدت CM 232 μN/mm2 على سرعة كهربائية(الشكل 7B)و 261 μN/mm2 بعد سرعة بصرية(الشكل 7C). البقول ذات الضوء الأخضر المطولة تمنع الانقباضات(الشكل 7E). بعد تثبيط البصرية ل64 ق، وتقلصات تكرار توليد قوة انكماش أقل، وقيم قوة استرداد نحو خط الأساس بعد ~ 10 تقلصات (سرعة في 0.25 هرتز، الشكل 7D)تمشيا مع فقدان الكالسيوم الانبساطي من CM الأرنب.
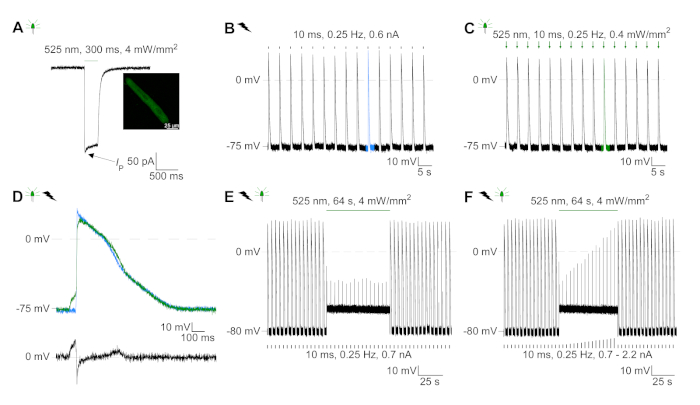
الشكل 6: تسجيلات المشبك المشبك التمثيلي لـ ELECTRIC and بصريا ً / CM المثبطة. (أ)التمثيل الضوئي في -74 mV باستخدام نبض ة خفيفة من 300 مللي ثانية، 4 mW/mm2. يشير IP إلى ذروة التيار. يعرض الإدراج خلية موجبة GtACR1-eGFP. (B)ممثل AP تسجيل في 0 pA باستخدام منحدر الحالي من 10 مللي ثانية، 0.6 nA لتسريع كهربائيا CM.(C)ممثل AP تسجيل في 0 pA باستخدام نبضات خفيفة من 10 مللي ثانية، 0.4 mW/mm2. (D)أعلى الرسم البياني يظهر تراكب AP10 من كهربائيا (الأزرق) وبصريا (الأخضر) تنشيط CM. AP كانت محاذاة من قبل الحد الأقصى للتغيير في الأغشية المحتملة (dV / dt ماكس). الرسم البياني السفلي يظهر الفرق في إمكانية الغشاء بين بصريا وكهربائيا AP أثار(Eالبصرية-Eالكهربائية). (E)تم تثبيط AP أثار كهربائيا تحت ضوء مستمر من 64 ث، 4 mW/mm2. (F)AP يتم تثبيطها عن طريق الحقن الحالية أعلى من 1.5 مرات عتبة (من 0.7 nA في خطوات من 0.1 nA إلى 2.2 nA) تحت ضوء مستمر. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
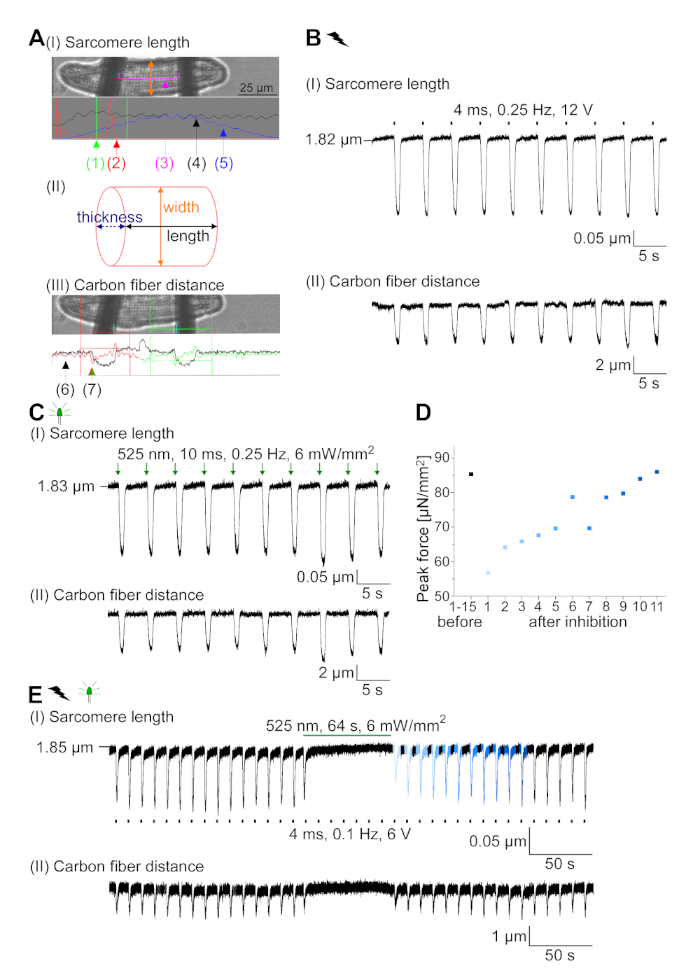
الشكل 7: بيانات تمثيلية من تسجيلات ألياف الكربون لـ CM /مثبطة ضوئيًا وكهربائيًا. (أ)عرض في برنامج الحصول على البيانات. صورة (I) يظهر CM قياس مع نافذة لحساب طول sarcomere. يتم وضع علامة على عرض الخلية باللون البرتقالي. (1) نطاق الترددات ذات الصلة. (2) يظهر طيف الطاقة FFT تردد تباعد الساركوميري على الخلية. يتم حساب متوسط طول الساركومري من تردد الذروة. (3) ساركومري طول نافذة تتبع. (4) تتبع كثافة. (5) تتبع كثافة مضروبة في نافذة هامينغ هو تتبع كثافة نافذة. يُظهر المخطط (II) المقطع العرضي البيضاوي للخلية. عرض باللون البرتقالي وسمك باللون الأزرق المتقطع. الصورة (III) يظهر موقف ألياف الكربون مع صناديق الكشف المعنية، إلى اليسار باللون الأحمر واليمين باللون الأخضر. (6) تتبع كثافة. (7) المشتقة الأولى من أثر الكثافة (انظر دليل برامج الحصول على البيانات). (ب)أثر تمثيلي للانقباضات التي تم الحصول عليها كهربائيًا. لوحة (I) يظهر طول sarcomere تقصير، لوحة (II) المسافة بين ألياف الكربون اثنين. (C)أثر تمثيلي للانقباضات التي تم الحصول عليها بصريًا (525 نانومتر ، 0.25 هرتز ، 10 مللي ثانية ، 6 مواط / مم2). لوحة (I) يظهر طول sarcomere تقصير، لوحة (II) المسافة بين ألياف الكربون اثنين. (D)ولدت قوة الذروة من الانكماش 1 إلى 11 بعد وقفة الناجمة عن تثبيط جيل AP. (E)أثر تمثيلي للتثبيط البصري للانقباضات تحت الإضاءة المستمرة (525 نانومتر ، 64 ث ، 6 mW / mm2). لوحة (I) يظهر طول sarcomere تقصير، لوحة (II) طول بين ألياف الكربون اثنين. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
| أ | منطقه |
| Acr | أنيون channelrhodopsin |
| Ap | إمكانية العمل |
| Apd | مدة الإجراء المحتملة |
| CFU | وحدة تشكيل مستعمرة |
| Chr | تشانيلرودوبسين |
| سم | عضلة القلب |
| eGFP | تعزيز البروتين الفلورسنت الأخضر |
| Esd | نهاية تشوه الخلايا الانقباضي |
| الاتحاد الاوربي | وحدات الإندوتوكسين |
| و | القوه |
| FFT | تحويل فورييه سريع |
| GtACR | Guillardia التا anion channelrhodopsin |
| واجهه المستخدم الرسوميه | واجهة مستخدم رسومية |
| I-المشبك | الحالية المشبك |
| وحدة دولية | الوحدات الدولية |
| موي | تعدد العدوى |
| بولي هيما | بولي (2-هيدروكسيثيل ميثاكريلات) |
| V-المشبك | الجهد المشبك |
الجدول 5: قائمة الاختصارات.

الشكل التكميلي 1: قياسات شدة الضوء مع مقياس الطاقة البصري. (أ)قياس نبضات ضوئية 10 مللي ثانية عند 4 مللي واط/مم2. (ب)قياس الإضاءة المستمرة من 64 ث في 4 mW/mm2. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
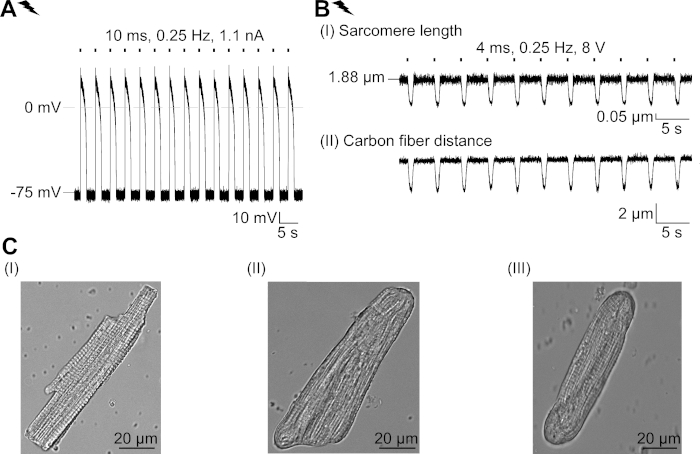
الشكل التكميلي 2: خصائص CM المعزولة حديثا والتكيف الهيكلي في الثقافة. (A)تسجيل AP لسم معزول حديثًا (APD 20 من 1.11 ± 0.34 s ، APD 90 من 1.96 ± 0.32 s ، n = 7 ، N = 2). متوسط إمكانية غشاء الراحة من -79.3 ± 0.8 mV (ن = 7، N = 2). (B)تسجيل ألياف الكربون لCM معزول حديثًا يسير بوتيرة كهربائية. متوسط قوة الذروة من 205 ± 78 μN/mm2 (n = 7، N = 2). (ج)صور محورية لسم معزول حديثًا (I)؛ غير المنقولة (الثاني) ونقل (III) CM بعد 48 ساعة في الثقافة. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
المواد التكميلية: MatLab النصي لتحديد APD ويستريح غشاء المحتملة. الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
في حين أن الأدوات الراجعة الجينية تمكن من تعديل الفيزيولوجيا الكهربية للخلايا المنفعلة بطريقة غير غازية ، فإنها تحتاج إلى توصيف شامل في أنواع الخلايا المختلفة (على سبيل المثال ، CM) للسماح للمرء باختيار أفضل أداة متاحة لتصميم تجريبي محدد. تقنية المشبك الترقيع يُعِد طريقة قياسية لتقييم الفيزيولوجيا الكهربائية الخلوية. في تكوين الخلية الكاملة ، فإنه يسمح للمرء لتسجيل التيارات تنشيط الصورة عبر غشاء البلازما أو التغيرات الزمنية في الجهد غشاء بعد تحفيز الضوء / تثبيط. يؤثر التلاعب البُقِبي للإثارة الكهربائية أيضًا على تقلصات CM. نحن نستخدم تتبع sarcomere وقياسات القوة بمساعدة ألياف الكربون لتحديد آثار الاستجواب البصري على النشاط الميكانيكي للخلايا الأوكيسية.
نحن نصف بروتوكول لتوصيف الآثار الأساسية لقناة كلوريد مسور ة الضوء، GtACR1، في CM. كنظام نموذجي ، اخترنا أرنب CM ، حيث أن خصائصها الكهروفيزيولوجية (على سبيل المثال ، شكل AP وفترة الانكسار) تشبه تلك التي لوحظت في CM البشري بشكل أوثق من القوارض CM. وعلاوة على ذلك، يمكن استزراع الأرانب CM لعدة أيام، وهي فترة كافية لإيصال الأدينوفير والتعبير عن GtACR1-eGFP. وتجدر الإشارة إلى أن CM المعزول يغير خصائصه الهيكلية في الثقافة مع مرور الوقت ، بما في ذلك تقريب نهايات الخلايا والفقدان التدريجي للتمزق ، ونظام T-tubular وcaveolae23،24. وتمشيا مع هذا، تم الإبلاغ عن التعديلات الوظيفية في CM المستزرعة: نزع الاستقطاب من الأغشية يستريح المحتملة، وإطالة أمد AP والتغيرات في التعامل مع كاليفورنيا2+ الخلوية. لمراجعة التعديلات الخلوية في الثقافة، يرجى الاطلاع على لوش وآخرون25. الشكل التكميلي 2 يظهر AP المثالية وقياسات الانكماش من CM معزولة حديثا للمقارنة مع تلك التي لوحظت في CM المستزرعة(الشكل 6، الشكل 7)باستخدام البروتوكول المقدم هنا.
تتيح تسجيلات المشبك المشبك للخلايا الكاملة قياسات مباشرة لخصائص التيار الضوئي (على سبيل المثال، السعة والحركية) والتغيرات الناجمة عن الضوء في خصائص الغشاء المحتملة أو AP بدقة زمنية عالية. ومع ذلك ، فإن هذه التسجيلات لها العديد من القيود: أولاً ، يتم استبدال السيتوسول بمحلول ماصة في تسجيلات الخلية الكاملة ، وهو مفيد للتحكم في التدرجات الكهروكيميائية الأيونية ، ولكن له عيب جوهري في غسل العضيات الخلوية والبروتينات والمركبات الأخرى ، مما قد يؤثر على الاستجابات الكهربائية الخلوية. ثانياً، من الصعب تقييم الآثار الجانبية مثل تنشيط قنوات أيون إضافية ناتجة عن نزع الاستقطاب غير الطويل من الناحية الفسيولوجية (على سبيل المثال، بطء الوقت في الثوابت للقنوات الأيونية ذات البوابات الخفيفة) لأن طريقتنا تسمح فقط للمرء باكتشاف التغيرات في APD، ولكن ليس لإجراء قياسات مباشرة للتركيزات الأيونية في مقصورات الخلايا ذات الصلة بالكهرباء والفيزيولوجيا. ويمكن القيام بذلك باستخدام مؤشرات الفلورسنت (مثل أجهزة استشعار Ca2+) أو أقطاب كهربائية انتقائية أيونية. قد يتضمن التوصيف مزيدًا من التُرتّب اتّهات شدة الضوء، وتحديد الاعتماد على درجة الحموضة، والحركية الضوئية في الإمكانات الغشائية المختلفة، وحركية الاستعادة أثناء التحفيز الضوئي المتكرر.
وعلى النقيض من تسجيلات المشبك الترقيعي، تمكّن قياسات القوة أحادية الخلية من تحليل الانقباضات الخلوية للأوسيدات السليمة دون التأثير على وسطها داخل الخلايا. يمكن تقييم الآثار الثانوية على تركيزات الأيون (على سبيل المثال، Ca2+) بشكل غير مباشر من خلال تحديد سعة القوة المولدة ودينامياتها (على سبيل المثال، السرعة القصوى للانكماش والاسترخاء؛ هنا لم يتم تحليلها). وتتسم قياسات القوة باستخدام تقنية ألياف الكربون بميزة على الخلايا المتعاقدة بحرية لأنها توفر معلومات مباشرة عن القوى السلبية والنشطة في الخلايا المحملة مسبقاً (أي في ظروف أكثر تشابهاً مع الوضع في الموقع أو في بيئات الجسم الحي). التحميل المسبق الميكانيكية مهم بشكل خاص عند تحليل القدرة الخلوية، كما تمتد يؤثر على قوة الإنتاج والاسترخاء26،27.
تسمح الأساليب البُقائية بالتلاعب الدقيق السّقاني لإمكانات الغشاء الخلوي، سواء في الأنسجة القلبية الواحدة أو الأنسجة القلبية السليمة. تقليديا، تم استخدام ChR2، وهي قناة مجسة ذات بوابات خفيفة غير انتقائية، لتجريد الأغشية المحتملة من الاستقطاب، في حين تم استخدام مضخات البروتون و/ أو كلوريد التي تحركها الضوء لفرط الاستقطاب الغشائي. تتطلب كلتا المجموعتين من المستخدمين البوجينيين مستويات تعبير عالية ، حيث يتميز ChR2 بالتوصيل المنخفض في جوهره من قناة واحدة28 والمضخات ذات النواة الخفيفة تنقل إلى أقصى حد أيون واحد لكل فوتون ممتص. وعلاوة على ذلك، قد يؤدي التنشيط المطول لـ ChR2 في CM إلى حمل زائد Na+ و/أو Ca2+ ، وقد تغير المضخات التي تحركها الضوء عبر sarcolemmal H+ أو Cl- التدرجات29،30. في البحث عن أدوات بديلة للسيطرة optogenetic من نشاط CM، اختبرنا مؤخرا قناة أنيون الطبيعية rhodopsin GtACR1، تتميز بالتوصيل ية قناة واحدة متفوقة وحساسية أعلى للضوء مقارنة مع chR التيشن مثل ChR2. وجدنا أن تنشيط GtACR1 depolarizes CM ويمكن استخدامها للسرعة البصرية وتثبيط، اعتمادا على توقيت نبض الضوء والمدة. قد تكون ميزة إضافية لاستخدام ACR بدلاً من chR الميشن احتمال عكس أكثر سلبية من Cl- بالمقارنة مع Na+، والحد من التيارات الأيونية التي تم إدخالها اصطناعيًا. كما أظهرنا سابقا، قد يؤدي السرعة البصرية مع GtACR1 إلى إطالة AP نتيجة للمكون البطيء لإغلاق قناة GtACR1، والتي يمكن التغلب عليها باستخدام أسرع GtACR1 المسوخ19. ومع ذلك ، AP إطالة هو أقل وضوحا بكثير عند استخدام أقل ، وأكثر فسيولوجية داخل الخلايا Cl-- التركيز (انظر الشكل 6). وعلاوة على ذلك، فإن تثبيط GtACR1 بوساطة الإضاءة المطولة يؤدي إلى نزع الاستقطاب في الغشاء العميق، والذي يمكن أن ينشط مرة أخرى تدفق Na+ و Ca2+ الثانوي، وبالتالي تغيير نشاط القنوات المبوبة بالجهد. في قياساتنا ، نجد أن معلمات AP والانكماش تتعافى إلى خط الأساس في غضون 40 s بعد تثبيط خفيف لمدة دقيقة واحدة (انظر Kopton et al. 2018 ، الشكل 6، الشكل 7). ضوء بوابات K+ قنوات توفر بديلا قويا لإسكات CM دون التأثير على غشاء الراحة CM المحتملة31.
في المستقبل نود أن نقارن كميا أدوات مختلفة optogenetic لقدرتها على منع النشاط القلبي. لتحقيق هذه الغاية، ونحن اختبار مجموعة متنوعة من القنوات أيون الخفيفة البوابة بما في ذلك ACR، ChR2 والأحمر تحول ChR المتغيرات32،فضلا عن المنشطات فرط الاستقطاب مثل هالورودوبسين أو ضوء بوابة adenylyl cyclase bPAC في تركيبة مع قناة البوتاسيوم SthK (PAC-K)31.
ويمكن استخدام البروتوكول هنا المقدمة لتوصيف متعمق للخصائص الكهروميكانيكية من CM. هو يطبّب أساسا أيضا إلى [كمّيل فرومّيّة سّوبتم,زوووووووووووووووووووووووووووووووووووووووووووووووووووووو التحفيز البصري يسمح للمرء أن وتيرة CM في ترددات مختلفة، ويمكن اختبار الأحمال المسبقة المختلفة أثناء تجارب انكماش ألياف الكربون. ومن التجارب المثيرة للاهتمام استخدام الإضاءة منخفضة الكثافة لإزالة الاستقطاب دون العتبة ، لمحاكاة الزيادة التدريجية في إمكانية الغشاء الاستراحة ، كما يمكن ملاحظتهأثناء تطور إعادة عرض الأنسجة القلبية أثناء تطور المرض. وأخيراً، يمكن الجمع بين القياسات الوظيفية مع التصوير Ca2+ لمزيد من البصيرة في اقتران الإثارة والانكماش، أو مع التدخلات الدوائية لتقييم آثار الأدوية المختلفة على نشاط CM.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نشكر ستيفاني بيريز فيليز على المساعدة التقنية الممتازة، الدكتور جوناس Wietek (جامعة هومبولت، برلين، ألمانيا) لتوفير pUC57-GtACR1 plasmid، البروفيسور الدكتور مايكل شوب (شاريتيه - Universitätsmedizin برلين، معهد für Pharmakologie، برلين) لإنتاج الفيروس الأدينو ية والدكتور أناستازيا خوخلوفا (جامعة الأورال الاتحادية) لتبادل خبراتها لتحسين عزل الخلايا وإعادة تصميم تم تمويل المشروع من قبل مؤسسة البحوث الألمانية (SPP1926: SCHN 1486/1-1; زمالة إيمي-نوثر: SCHN1486/2-1) ومنحة ERC المتقدمة CardioNECT.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment - Cell isolation/Culturing/Transduction | |||
| Adeno-X Adenoviral System 3 CMV | TaKaRa, Clontech Laboratories, Inc., Mountain View, California, USA | ||
| Aortic cannula | Radnoti | 4.8 OD x 3.6 ID x 8-9 L mm | |
| Coverslips ø 16 mm, Thickness No. 0 | VWR International GmbH, Leuven, Belgium | 631-0151 | Borosilicate Glass |
| Griffin Silk, Black, 2 m Length, Size 3, 0.5 mm | Samuel Findings, London, UK | TSGBL3 | |
| Incubator | New Brunswick, Eppendorf, Schönenbuch, Switzerland | Galaxy 170S | |
| Langendorff-perfusion set-up | Zitt-Thoma Laborbedarf Glasbläserei, Freiburg, Germany | Custom-made | |
| Langendorff-pump | Ismatec, Labortechnik-Analytik, Glattbrugg-Zürich, Switzerland | ISM444 | |
| Mesh: Nylon Monodur filter cloth | Cadisch Precision Meshes Ltd | 800 µm holes, 1 m wide | |
| Neubauer chamber | VWR International GmbH, Leuven, Belgium | 717806 | |
| Rabbit, New Zealand White | Charles River | Strain Code: 052 | |
| Scissors | Aesculap AG, Tuttlingen, Germany | BC774R | Bauchdeckenschere ger. 18cm |
| Sterile filter, 0.22 µm | Merck, Darmstadt, Germany | SLGP033RB | |
| Equipment - Patch-clamp | |||
| Amplfier | AxonInstruments, Union City, CA, United States | Axopatch 200B | |
| Coverslip ø 50 mm, Thickness No. 1 | VWR International GmbH, Leuven, Belgium | 631-0178 | Borosilicate Glass |
| Digitizer Axon Digidata | Molecular Devices, San José, CA, United States | 1550A | |
| Filter (530/20) | Leica Microsystems, Wetzlar, Germany | 11513878 | BZ:00 |
| Filter (630/20) | Chroma Technology, Bellows Falls, Vermont, United States | 227155 | |
| Headstage | AxonInstruments, Union City, CA, United States | CV203BU | |
| Interface | Scientifica, Uckfield, UK | 1U Rack, 352036 | |
| LED 525 nm | Luminus Devices, Sunnyvale, CA, United States | PT-120-G | |
| LED control software | Essel Research and Development, Toronto, Canada | ||
| LED control system | custom-made | ||
| Micropipette Puller | Narishige Co., Tokyo, Japan | PP-830 | |
| Microscope inverted | Leica Microsystems, Wetzlar, Germany | DMI4000B | |
| Motorised Micromanipulator | Scientifica, Uckfield, UK | PatchStar | |
| Optical power meter | Thorlabs, Newton, NJ, United States | PM100D | |
| Silicone Grease | RS Components, Corby, UK | 494-124 | |
| Silver wire | A-M Systems, Sequim, WA, United States | 787500 | Silver, Bare 0.015'', Coated 0.0190'', Length 25 Feet |
| Soda lime glass capillaries | Vitrex Medical A/S, Vasekaer, Denmark | 160213 BRIS, ISO12772 | 1.55 OD x 1.15 ID x 75 L mm |
| Software Axon pClamp | Molecular Devices, San José, CA, United States | Version 10.5 | |
| Software MatLab2017 | The MathWorks, Inc. | ||
| Stage micrometer | Graticules Optics LTD, Tonbridge, UK | 1 mm | |
| Equipment - Carbon fiber | |||
| Carbon fibers | provided from Prof. Jean-Yves Le Guennec | BZ:00 | |
| Digitizer Axon Digidata | Molecular Devices, Sunnyvale, CA, United States | 1550B | |
| Filter (530/20) | Leica Microsystems, Wetzlar, Germany | 11513878 | |
| Filter (630/20) | Chroma Technology, Bellows Falls, Vermont, United States | 227155 | |
| Fluorescence System Interface | IonOptix, Milton, MA United States | FSI-800 | 2.0 OD x 1.16 ID x 100 L mm |
| Force Transducer System | Aurora Scientific Inc., Ontario, Canada | 406A | |
| Glass capillaries for force measurements | Harvard Apparatus, Holliston, Massachusetts, United States | GC200F-10 | |
| Interface National Instruments | National Instruments, Budapest, Hungary | BNC-2110 | |
| LED 525 nm | Luminus Devices, Sunnyvale, CA, United States | PT-120-G | |
| LED control box | Essel Research and Development, Toronto, Canada | ||
| LED control system | custom-made | ||
| Microcontroller | Parallax Inc., Rocklin, California, United States | Propeller | |
| Micropipette Puller | Narishige Co., Tokyo, Japan | PC-10 | |
| Microscope inverted | Leica Microsystems, Wetzlar, Germany | DMI4000B | |
| MyoCam-S camera | IonOptix, Dublin, Ireland | ||
| MyoCam-S camera Power | IonOptix, Milton, MA, United States | MCS-100 | |
| MyoPacer Field Stimulator | IonOptix Cooperation, Milton, MA, United States | MYP100 | |
| Piezo Motor | Physik Instrumente (PI) GmbH & Co. KG, Karlsruhe, Germany | E-501.00 | |
| Silicone Grease | RS Components, Corby, UK | 494-124 | |
| Software Axon pClamp | Molecular Devices, San José, CA, United States | Version 10.5 | |
| Software IonWizard | IonOptix, Dublin, Ireland | Version 6.6.10.125 | |
| Software MatLab2017 | The MathWorks, Inc. | ||
| Stage micrometer | Graticules Optics LTD, Tonbridge, UK | 1 mm | |
| Chemicals | |||
| Adenosine | Sigma-Aldrich, St. Louis, Missouri, United States | A9251-100G | |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, Missouri, United States | A7030-50G | |
| CaCl2 | Honeywell Fluka, Muskegon, MI, USA | 21114-1L | |
| L-Carnitine hydrochloride | Sigma-Aldrich, St. Louis, Missouri, United States | C9500-25G | |
| Collagenase type 2, 315 U/mg | Worthington, Lakewood, NJ, USA | LS004177 | |
| Creatine | Sigma-Aldrich, St. Louis, Missouri, United States | C0780-50G | |
| Cytosine-β-D-arabinofuranoside | Sigma-Aldrich, St. Louis, Missouri, United States | C1768-100MG | |
| EGTA | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 3054.3 | |
| Esketamine hydrochloride, Ketanest S 25 mg/mL | Pfizer Pharma PFE GmbH, Berlin, Germany | PZN-07829486 | |
| Fetal Bovine Serum | Sigma-Aldrich, St. Louis, Missouri, United States | F9665 | |
| Gentamycin 50 mg/mL | Gibco, Life Technologies, Waltham, MA, USA | 15750-037 | |
| Glucose | Sigma-Aldrich, St. Louis, Missouri, United States | G7021-1KG | |
| Heparin-Sodium, 5,000 IU/mL | Braun Melsungen AG, Melsungen, Germany | PZN-03029843 | |
| HEPES | Sigma-Aldrich, St. Louis, Missouri, United States | H3375-1KG | |
| Insulin (bovine pancreas) | Sigma-Aldrich, St. Louis, Missouri, United States | I6634-50MG | |
| K-aspartate | Sigma-Aldrich, St. Louis, Missouri, United States | A6558-25G | |
| KCl | VWR International GmbH, Leuven, Belgium | 26764.260 | 1 mg/mL |
| KOH | Honeywell Fluka, Muskegon, MI, USA | 35113-1L | |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma-Aldrich, St. Louis, Missouri, United States | L2020-1MG | |
| M199-Medium | Sigma-Aldirch, St. Louis, Missouri, United States | M4530 | |
| Mg-ATP | Sigma-Aldrich, St. Louis, Missouri, United States | A9187-1G | |
| MgCl2 | Sigma-Aldrich, St. Louis, Missouri, United States | 63069-500ML | |
| NaCl | Fisher Scientific, Loughborough, Leics., UK | 10428420 | |
| NaCl-Solution 0.9%, Isotone Kochsalz-Lösung 0.9% | Braun Melsungen AG, Melsungen, Germany | 3200950 | |
| NaOH | AppliChem GmbH, Darmstadt, Germany | A6579 | without Ca2+/Mg2+ |
| Na-pyruvat | Sigma-Aldrich, St. Louis, Missouri, United States | P2256-100MG | |
| Phosphate Buffered Saline | Sigma-Aldrich, St. Louis, Missouri, United States | D1408-500ML | |
| Poly(2-hydroxyethyl methacrylate) | Sigma, Poole, UK | 192066 | |
| Protease XIV from Streptomyces griseus | Sigma-Aldrich, St. Louis, Missouri, United States | P5147-1G | |
| Taurine | Sigma-Aldrich, St. Louis, Missouri, United States | T0625-500G | |
| Thiopental Inresa 0.5 g | Inresa Arzneimittel GmbH, Freiburg, Germany | PZN-11852249 | |
| Xylazine hydrochloride, Rompun 2% | Bayer Vital GmbH, Leverkusen, Germany | PZN-01320422 |
References
- Harz, H., Hegemann, P. Rhodopsin-regulated calcium currents in Chlamydomonas. Nature. 351, 489-491 (1991).
- Litvin, F. F., Sineshchekov, O. A., Sineshchekov, V. A. Photoreceptor electric potential in the phototaxis of the alga Haematococcus pluvialis. Nature. 271, 476-478 (1978).
- Nagel, G., et al. Channelrhodopsin-1: A Light-Gated Proton Channel in Green Algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
- Lozier, R. H., Bogomolni, R. A., Stoeckenius, W. Bacteriorhodopsin: a light-driven proton pump in Halobacterium Halobium. Biophysical journal. 15 (9), 955-962 (1975).
- Schobert, B., Lanyi, J. K. Halorhodopsin is a light-driven chloride pump. Journal of Biological Chemistry. 257 (17), 10306-10313 (1982).
- Inoue, K., et al. A light-driven sodium ion pump in marine bacteria. Nature Communications. 4, 1678 (2013).
- Han, X., et al. A High-Light Sensitivity Optical Neural Silencer: Development and Application to Optogenetic Control of Non-Human Primate Cortex. Frontiers in Systems Neuroscience. 5, 18 (2011).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Grimm, C., Silapetere, A., Vogt, A., Bernal Sierra, Y. A., Hegemann, P. Electrical properties, substrate specificity and optogenetic potential of the engineered light-driven sodium pump eKR2. Scientific Reports. 8, 9316 (2018).
- Wietek, J., et al. Conversion of channelrhodopsin into a light-gated chloride channel. Science. 344 (6182), 409-412 (2014).
- Berndt, A. Structure-Guided Transformation. Science. 344 (6182), 420-424 (2014).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Mohamed, G. A., et al. Optical inhibition of larval zebrafish behaviour with anion channelrhodopsins. BMC Biology. 15 (1), 103 (2017).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic Neuronal Silencing in Drosophila during Visual Processing. Scientific Reports. 7, 13823 (2017).
- Govorunova, E. G., Cunha, S. R., Sineshchekov, O. A., Spudich, J. L. Anion channelrhodopsins for inhibitory cardiac optogenetics. Scientific Reports. 6, 33530 (2016).
- Kopton, R. A., et al. Cardiac Electrophysiological Effects of Light-Activated Chloride Channels. Frontiers in Physiology. 9, 1806 (2018).
- Peyronnet, R., et al. Load-dependent effects of apelin on murine cardiomyocytes. Progress in Biophysics and Molecular Biology. 130, 333-343 (2017).
- Wang, K., et al. Cardiac tissue slices: preparation, handling, and successful optical mapping. American Journal of Physiology-Heart and Circulatory Physiology. 308 (9), 1112-1125 (2015).
- Nishimura, S., et al. Single cell mechanics of rat cardiomyocytes under isometric, unloaded, and physiologically loaded conditions. American Journal of Physiology-Heart and Circulatory Physiology. 287 (1), 196-202 (2004).
- Mitcheson, J. S., Hancox, J. C., Levi, A. J. Action potentials, ion channel currents and transverse tubule density in adult rabbit ventricular myocytes maintained for 6 days in cell culture. Pflugers Archiv European Journal of Physiology. 43 (6), 814-827 (1996).
- Burton, R. A. B., et al. Caveolae in Rabbit Ventricular Myocytes: Distribution and Dynamic Diminution after Cell Isolation. Biophysical Journal. 113 (5), 1047-1059 (2017).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in cardiomyocyte isolation, culture, and gene transfer. Journal of Molecular and Cellular Cardiology. 51 (3), 288-298 (2011).
- Janssen, P. M., Hunter, W. C. Force, not sarcomere length, correlates with prolongation of isosarcometric contraction. The American Journal of Physiology. 269 (2), 676-685 (1995).
- Monasky, M. M., Varian, K. D., Davis, J. P., Janssen, P. M. L. Dissociation of force decline from calcium decline by preload in isolated rabbit myocardium. Pflugers Archiv European Journal of Physiology. 456 (2), 267-276 (2008).
- Kleinlogel, S., et al. Ultra light-sensitive and fast neuronal activation with the Ca 2+-permeable channelrhodopsin CatCh. Nature Neuroscience. 14 (4), 513-518 (2011).
- Schneider-Warme, F., Ravens, U. Using light to fight atrial fibrillation. Cardiovascular Research. 114 (5), 635-637 (2018).
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature. 463 (7277), 98-102 (2010).
- Bernal Sierra, Y. A., et al. Potassium channel-based optogenetic silencing. Nature Communications. 9 (1), 4611 (2018).
- Oda, K., et al. Crystal structure of the red light-activated channelrhodopsin Chrimson. Nature Communications. 9 (1), 3949 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved