Method Article
광유전학적으로 변조된 심근세포 활동의 전기기계적 평가
요약
우리는 토끼 심근 세포에서 GtACR1 활성화의 전기 기계적 효과를 평가하기위한 프로토콜을 제시한다. 당사는 세포 격리, 배양 및 아데노바이러스 전이, 패치 클램프 및 탄소 섬유 기술로 기능적 실험에 대한 자세한 정보를 제공합니다.
초록
지난 2 년간, 광유전학 공구는 심혼을 포함하여 흥분한 조직에 있는 세포 모형 특정 활동을 조절하는 강력한 수단으로 설치되었습니다. Channelrhodopsin-2 (ChR2)는 심근 세포 (CM)에서 막 전위를 탈분극하는 일반적인 도구이지만, 잠재적으로 행동 전위 (AP)를 유도하는 것은 CM 활동의 신뢰할 수있는 침묵에 대한 효과적인 도구가 누락되었습니다. 그것은 광과 성 억제에 대 한 항이온 채널로도 프 린스를 사용 하 여 제안 되었습니다 (ACR) 여기서, 우리는 배양된 토끼 CM에서 길라르디아 세타로부터 자연 ACR GtACR1을 활성화시키는 효과를 평가하는 프로토콜을 설명한다. 이 프로토콜에는 토끼 심장으로부터의 CM 분리, 최대 4일 동안 세포의 파종 및 배양, 광문이 있는 염화물 채널에 대한 아데노바이러스 코딩을 통한 전달, 패치 클램프 및 탄소 섬유 설정의 준비, 데이터 수집 및 분석이 포함됩니다. 전체 셀 구성에서 패치 클램프 기술을 사용하면 광 활성화 전류(전압 클램프 모드, V-클램프) 및 AP(전류 클램프 모드, I-클램프)를 실시간으로 기록할 수 있습니다. 패치 클램프 실험 외에도, 우리는 세포 내 밀리외를 방해하지 않고 CM 활성의 기능적 평가를 위한 수축성 측정을 수행합니다. 이를 위해, 세포는 탄소 섬유를 사용하여 기계적으로 미리 로드되고 수축은 sarcomere 길이와 탄소 섬유 거리의 변화를 추적하여 기록됩니다. 데이터 분석에는 I-클램프 기록의 AP 지속 시간 평가, V-클램프 기록의 피크 전류 및 탄소 섬유 측정의 힘 계산이 포함됩니다. 기재된 프로토콜은 CM 활성에 대한 다른 광유전학 액추에이터의 생물물리학적 효과의 시험에 적용될 수 있으며, 이는 심장 조직 및 전체 심장에서 광유전학적 실험에 대한 기계적 이해의 개발을 위한 전제 조건이다.
서문
ChR 매개 광전류는 단세포 녹조류1,2의안구에 처음 기록되었다. 클라미도모나스 라인하르티ChR1 및 ChR2의 유전자 복제 및 이종 발현 직후, ChR은 제노푸스 난모세포 및 포유류 세포의 막 전위를 빛3,4에의해 변화시키는 도구로 사용되었다. 양이온 비선택적 ChR은 ChR의 반전 전위에 부정적인 휴식 막 전위를 가진 세포의 막을 탈분극화한다. 그(것)들은 이렇게 광학 간격5,6를허용하는 뉴런 및 CM를 포함하여 흥분성 세포에 있는 AP를 이끌어 내는 것을 이용될 수 있습니다.
양이온 ChR, 광구동 양성자, 염화물 및 나트륨 펌프7,8,9에 대한 상보체는 신경 활성을 억제하는 데 사용되어왔다 10,11,12. 그러나, 후자는 하나의 이온이 흡수 된 광자 당 수송으로, 높은 빛 강도와 지속적인 조명을 필요로 한계가있다. 2014년, Wietek 외 및 Berndt et al.에 의한 2개의 독립적인 연구에서는 채널 기공13,14의돌연변이를 통해 양이온 전도 ChR을 ACR로 의전환을 기술하였다. 1 년 후, 자연 ACR은 암호 기야르디아 세타 (GtACR)15에서발견되었다. 엔지니어링 된 ACR은 잔류 양이온 전도도를 보였듯이, 그들은 큰 단일 채널 전도도 및 높은 빛 감도15를특징으로하는 천연 ACR로 대체되었습니다. GtACR은 염화물16,17의반전 전위를 향해 막 전위를 편광시킴으로써 뉴런 활성을 침묵시키는 데 사용되었다. 고보루노바 등은 배양된 랫트 심실 CM에 GtACR1을 적용하고 양성자 펌프아치(Arch) 18과같은 이전에 이용 가능한 억제 도구를 활성화하기에 충분하지 않은 저조도 수준에서 효율적인 광 억제를 보였다. 우리 그룹은 최근 CM의 GtACR1 매개 광 억제가 탈분극을 기반으로하고 GtACR1도 CM19의광학 적 진도에 사용될 수 있다고보고했다.
여기에서, 우리는 배양된 토끼 심실 CM에 대한 GtACR1 광활성화의 전기생리학적 및 기계적 효과를 연구하기 위한 프로토콜을 제시한다. 우리는 먼저 세포 격리, 배양 및 변환을 설명합니다. 전기 생리학적 효과는 전체 셀 패치 클램프 기록을 사용하여 측정됩니다. 주어진 멤브레인 전압에서 광 매개 전류는 V 클램프 모드에서 평가됩니다. 멤브레인 전위 역학은 전기적 또는 광학적으로 진도CM(I-클램프 모드)를 측정하는 동안 측정됩니다. 전기적으로 트리거된 AP의 광학 적 억제는 지속적인 광 응용 프로그램을 사용하여 테스트됩니다. 기계적 효과는 탄소 섬유를 사용하여 sarcomere 길이의 이미징 기반 추적과 함께 측정됩니다. 이를 위해 광학 적으로 보운세포는 반대쪽 세포 끝 근처의 플라즈마 멤브레인에 두 개의 탄소 섬유를 부착하여 기계적으로 미리 로드됩니다. Sarcomere 길이 변화는 광학 또는 전기 적 간격 동안 기록됩니다. 마지막으로, 광억제는 세포의 전기장 자극 중에 측정되고, 생성된 힘이 분석된다.
이 프로토콜은 도 1의순서도에 나타난 다음 단계를 포함합니다: 토끼 깊은 마취, 티오펜탈 과다 복용 주입, 심장 절제, Langendorff-관류 및 조직 소화, 세포를 방출하는 조직의 기계적 해리, CM 수율의 현미경 분석, CM의 배양, 아데노바이러스 유형 5의 배율, 인큐베이션 및 기능 실험.

그림 1: 전기 및 광학 적 보속 CM을 얻기 위해 사용되는 프로토콜의 순서도. 하트는 9-10 주 된 토끼에서 절제되고, 심장 조직은 랑엔도르프 설정을 사용하여 관영되는 동안 소화됩니다. 세포는 기계적 교반에 의해 방출됩니다. CM 수율은 현미경으로 계산됩니다. CM은 배양되고, 아데노바이러스 타입 5로 트랜스듀렉션되고, 기능적 실험은 48-72시간 후 트랜스덕션을 수행한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
모든 토끼 실험은 과학적 목적으로 사용되는 동물의 보호에 대한 유럽 의회의 지침 2010/63/EU에 명시된 지침에 따라 수행되었으며 바덴 뷔르템베르크지방 당국의 승인을 받았습니다(Regierungspräsidium Freiburg, X-16/10R, 독일).
1. 세포 분리를 위한 솔루션
- 하기 요건(표 1)의 물로 셀 절연용 용액을준비하고(표 1)및 표 2에열거된 이온 조성물에 따라.
참고 : CaCl2 및 MgCl2는 1 M 재고 솔루션에서 추가됩니다.
| 물 요구 사항 | |
| 25°C에서의 전도도[μS/cm] | 0.055 |
| 파이로겐 [EU/mL] | < 0.001 |
| 입자 (크기 > 0.22 μm) [1/mL] | ≤ 1 |
| 총 유기 탄소 [ppb] | < 5 |
| 미생물 [CFU/mL] | ≤ 1 |
| RNase [ng/mL] | < 0.01 |
| DNase [ng/mL] | LT; 4 |
표 1: 물 요구 사항.
| 생리식염수 용액 (1) | 저칼슘, 고칼륨 용액 (2) | 효소 용액 (3) | 차단 솔루션 | |
| 나클 [mM] | 137 | 137 | 137 | 137 |
| KCl [mM] | 4 | 14 | 14 | 14 |
| 헤페스 [mM] | 10 | 10 | 10 | 10 |
| 크레아틴 [mM] | 10 | 10 | 10 | 10 |
| 타우린 [mM] | 20 | 20 | 20 | 20 |
| 포도당 [mM] | 10 | 10 | 10 | 10 |
| MgCl2 [mM] | 1 | 1 | 1 | 1 |
| 아데노신 [mM] | 5 | 5 | 5 | 5 |
| L-카르니틴 [mM] | 2 | 2 | 2 | 2 |
| CaCl2 [mM] | 1 | - | 0.1 | 0.1 |
| 나헤파린 [IU/L] | 5000 | - | - | - |
| EGTA [mM] | - | 0.096 | ||
| 콜라게나아제 타입 2, 315 U/mg [g/L] | - | - | 0.6 | - |
| 프로테아제 XIV [g/L] | - | - | 0.03 | - |
| 소 세럼 알부민 [%] | - | - | - | 0.5 |
| 삼투압 [모스몰/L] | 325 ± 5 | 345 ± 5 | 345 ± 5 | 345 ± 5 |
표 2: CM 격리를 위한 솔루션입니다.
- 모든 솔루션을 37°C에서 pH 7.4로 조정하고 삼투압을 확인합니다.
참고: 심장 절삭 직전에 효소(콜라게나제 타입 2 및 프로테아제 XIV)를 직접 녹입니다. 사용하기 전에 모든 용액을 산소화하십시오.
2. 랑엔도르프 관류 설정 준비
참고: 사용된 설정은 사용자 지정설정입니다. 도 2에도시된 바와 같이, 설정은 3개의 물 자켓 처리된 저수지(1-3), 나선형 역유동 열교환기 1개(4) 및 물자켓 관류 용기(5)로 구성된다.

그림 2: 토끼 세포 격리에 최적화된 랑엔도르프 관류 설정. (1-3) (1) 생리식염수 용액, (2) 낮은 칼슘, 높은 칼륨 용액 및 (3) 효소 함유 심전염용액을 함유한 물 자켓 처리체. (4) 나선형 카운터 플로우 열 교환기 및 (5) 물 재킷 수집 탱크. 물 재킷 시스템의 유입은 나선형 열교환기 (열교환기의 끝에 관류 캐뉼라를 떠나는 용액의 온도는 37 °C에서 일정해야 함), 이어서 관류 용기 및 3 개의 저장소가 뒤따릅니다. 모든 용액은 산소화(파선)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 열교환 시스템에서 38 °C에서 물을 순환하고 모든 용액을 37 °C로 예열하기 위해 수조 펌프를 켭니다.
참고: (4)의 유출 온도는 37°C에서 제어되고 일정해야 합니다. - 3개의 저장소를 각각의 용액으로 채우고 각 라인(검은색)을 해당 용액으로 세척합니다. 용액(1)을 사용하여 기포 없이 끝에 있는 주(파란색) 선을 채웁니다.
참고: 사용 전(10분) 및 사용 중에 용액을 산소공급하십시오. 낮은 칼슘, 높은 칼륨 용액으로 저수지 (3)에서 탭까지 라인을 채웁니다. - 캐뉼라에서 대장 주위의 심장을 묶기 위해 봉합사를 준비하십시오.
3. 세포 격리
- 다음 주사기를 준비합니다.
- 용 분과/마취의 경우: 0.5 mL/kg 체중 에스케타민 염산염(25 mg/mL)과 0.2 mL/kg 체중 자일라진 염산염(2%)을 섞으세요.
- NaCl 용액 12 mL (0.9 %)으로 두 개의 주사기를 채웁니다.
- 0.9% NaCl 용액에 용해된 12.5 mg/mL 나티오펜탈 6 mL를 준비합니다.
- 주사기에 에스케타민 염산염 0.2 mL (25 mg / mL)을 채웁니다.
- 0.9% NaCl 용액의 1 mL에서 나 헤파린 (5,000 IU / mL)의 0.2 mL을 희석하십시오 (최종 농도 1,000 IU / mL).
- 체테테/마취 토끼 (9-10 주, 뉴질랜드 흰 토끼, 여성 또는 남성, ~2 kg) 에스케타민 염산염 및 자일라진 염산염의 근육 주사를 통해 (단계 3.1.1).
참고 : 토끼는 완전히 마취되기 위해 적어도 10 분이 필요합니다. 정확한 기간은 체중에 따라 다릅니다. 오른쪽 반사의 손실로 마취를 확인합니다. - 정맥이 있는 가슴과 귀를 면도하십시오.
- 유연한 캐뉼라를 귀 정맥에 삽입하고 테이프로 고정하고 0.9 % NaCl 용액으로 씻어 내보하십시오.
- Na-헤파린 용액 1 mL을 정맥 내 로 주입하고 0.9 % NaCl 용액으로 씻어 내소하십시오.
- 에스케타민 염산염 0.2 mL를 주입하고 0.9 % NaCl 용액으로 다시 씻어 내고 무호흡증이 될 때까지 Na-thiopental을 주입하십시오.
참고 : 토끼는 페달 철수 반사에 응답하지 않아야합니다. - 왼쪽 가슴을 열고 심낭을 제거합니다.
- 심장이 절제될 때 타이머를 시작하고 생리식염수 용액으로 심장을 두 번 씻으하십시오.
참고: 심장 조직의 우발적 인 손상을 방지하기 위해 둥근 팁이있는 가위를 사용하십시오. - 생리식염수 용액으로 욕조에서 대인을 수조절하고 모든 조직을 용액에 보관하십시오. 랑엔도르프 관류 시스템(생리식염수 용액(1), 속도 24 mL/min)을 켭니다.
- Langendorff-관류 설정에 마음을 전송, 대류를 침투 노즐에 연결하고, 단단히 캐뉼라에 대공 주위 봉합사와 마음을 묶어 (< 1 분).
참고 : 생리 식염수 용액으로 캐뉼라를 미리 채우고 캐뉼기에서 랑엔도르프 설정으로 운송하는 동안 기포가 캐뉼라에 들어가지 않도록하고 거품이없는 곳에 연결하십시오. - 모든 혈액이 씻겨 나갈 때까지 심장을 정성하십시오 (2-3 분).
- 저칼슘, 고칼륨 용액(2)으로 전환하십시오. 심장이 박동을 멈추고 효소 용액으로 전환한 후 2 분 더 퍼퓨즈하십시오.
- 소화 시작 후 2 분 후에 효소 용액을 다시 저수지로 재순환하십시오. 소화 5분 후 속도를 16 mL/min으로 줄이면 됩니다.
- 조직이 부드러워지면 (소화 40-50 분), 캐뉼라에서 심장을 잘라 내고 좌심실을 분리하십시오.
- 기계적 해리에 의해 세포를 방출 (부드럽게 피펫과 조직을 보유하는 미세 집게로 조직을 떨어져 당겨) 차단 용액.
- 메쉬(1mm2의기공 크기)와 원심분리기를 22 x g(중력 가속도)에서 2분 동안 걸러내다.
- 비 근세포가 함유된 상구체를 제거하고 차단 용액에서 CM을 다시 일시 중단합니다.
4. CM의 배양
참고: 멸균 조건에서 다음 단계를 수행합니다.
- 희석 라미닌 (엥겔브레스 - 홈 - 홈 - 스웜 뮤린 육종 지하 막에서, 1 mg / mL) 1:10 멸균 인산염 완충 식염수 (Ca2 +/ Mg2 +제외) 100 μg / mL의 최종 농도.
- 표 3에나타낸 바와 같이 보충제와 함께 M199-Medium에서 배양 배지를 준비한다.
| M199-배지에서 세포 배양 배지 | |
| 크레아틴 [mM] | 5 |
| L-카르니틴 염산염 [mM] | 2 |
| 타우린 [mM] | 5 |
| 나 피루바트 [mM] | 1 |
| 인슐린 (소 췌장) [U/L] | 0.25 |
| 시토신 β-D-아라비노푸라노사이드 [mM] | 0.01 |
| 겐타마이신 [mg/mL] | 0.05 |
표 3: 세포 배양 배지.
- 멸균 필터 용액 (0.22 μm)을 넣고 5 % 태아 소 세럼을 추가하십시오.
- 패치 클램프 실험의 경우 오토클레이브 커버슬립 16mm, 두께 No. 0, 배양 전에 100 μg/mL 라미닌으로 직접 코팅합니다.
- 탄소 섬유 실험의 경우, 폴리 (2-하이드록세틸 메타 크릴레이트)(폴리 HEMA, 0.12 g/mL 95:5 EtOH:H20)로 페트리 접시 표면을 코팅하고 고형화시.
참고 : 세포는 폴리 HEMA 코팅 페트리 접시에 '스틱'하지 않습니다; 이것은 세포 역학 연구 결과에 있는 그들의 마찰 없는 수축을 위해 중요합니다. - CM이 다시 정지된 후(~10-15분), 상체를 제거한 다음 배양 배지에서 CM을 다시 정지시낸다.
- Neubauer 챔버로 CM을 계산하고 라미닌 코팅 커버슬립 또는 폴리 HEMA 코팅 페트리 접시에 17,500 셀 / mL의 목표 밀도로 종자를 계산합니다.
- 37°C에서 세포를 배양하고, 5%CO2를 3-4시간 동안 배양한다. 커버슬립 시드 세포의 배지(37°C)를 교환합니다.
- 75의 감염 (MOI)의 복합성에서 GtACR1-eGFP에 대한 아데노 바이러스 (유형 5) 코딩을 추가하고 48 시간 후에 기능적 실험을 시작합니다.
참고 : 변환 후 어둠 속에서 세포를 유지합니다. 청색 또는 녹색 광 활성화 단백질로 작업할 때는 적색 조명을 사용하십시오. 시판되는 아데노바이러스 전달 시스템(재료 표참조)은 GtACR1-eGFP를 아데노바이러스 벡터내로 코딩하는 유전자를 복제하는 데 사용된다. 관심의 삽입, 여기 GtACR1-eGFP는, PCR 증폭및 인퓨전 클로닝 반응에서 CMV 프로모터를 포함하는 아데노바이러스 벡터와 결합된다. CMV(인간 사이토메갈로바이러스) 프로모터는 포유류 세포에서 형질전환의 과발현을 유도하는 데 일반적으로 사용된다. eGFP는 Aequorea 빅토리아에서 추출한 강화된 녹색 형광 단백질로 최대 488 nm, 방출 최대 507 nm입니다. 아데노바이러스(유형 5)는 샤리테 대학교, 베를린, 베를린, 마이클 슈프 교수, 베를린 주 부사조에서 외부적으로 생산되었다.
주의: 아데노바이러스 전이는 BSL-2 안전 수준 작업으로 분류되며, 적절한 안전 조치가 법적으로 요구됩니다.
5. 기능 실험
참고 : 기록은 반전 형광 현미경을 사용하여 수행됩니다. GtACR1의 동시 활성화를 방지하기 위해 콘덴서의 빨간색 밴드 패스 필터(630/20 nm)로 투과광을 필터링합니다.
-
패치 클램프 설정
- 아날로그-디지털 컨버터와 함께 앰프를 사용합니다. 데이터 수집 소프트웨어를 사용하여 전류 및 전압 데이터를 기록합니다(재료 표참조).
참고: 기록된 데이터는 10kHz에서 디지털화되고 5kHz에서 필터링됩니다.
- 아날로그-디지털 컨버터와 함께 앰프를 사용합니다. 데이터 수집 소프트웨어를 사용하여 전류 및 전압 데이터를 기록합니다(재료 표참조).
-
탄소 섬유 설정
- 카메라를 사용하여 광학 대비의 변화를 추적하여 탄소 섬유 위치와 사르코머 길이를 감지합니다(탄소 섬유는 줄무늬 셀 패턴에 중첩된 어두운 구조로 표시). 설정의 개략적 표현은 그림 3에나와 있습니다.
참고: Sarcomere 길이는 줄무늬 패턴의 전력 스펙트럼의 빠른 푸리에 변환(FFT)을 사용하여 실시간으로 계산됩니다.
- 카메라를 사용하여 광학 대비의 변화를 추적하여 탄소 섬유 위치와 사르코머 길이를 감지합니다(탄소 섬유는 줄무늬 셀 패턴에 중첩된 어두운 구조로 표시). 설정의 개략적 표현은 그림 3에나와 있습니다.

그림 3: 탄소 섬유 측정을 위한 실험 설정을 묘사하는 체계. (드로잉의 배율이 없습니다.) 두 개의 탄소 섬유가 세포에 부착되고 그 위치는 압전 포지셔너에 의해 제어됩니다. 페이서는 전기장 자극에 사용된다. 다색 LED는 물체 평면에서 세포의 조명을 위해 반전된 현미경의 에피플루오레전 포트내로 결합된다. LED 전원은 디지털 아날로그 컨버터(DAC)의 디지털 출력을 통해 디지털 펄스를 수신하는 전용 제어 박스를 통해 제어됩니다. DAC는 형광 시스템 인터페이스와 아날로그 출력을 통해 통신합니다. 셀룰러 이미징을 위한 흑백 카메라(774픽셀 x 245라인)가 컴퓨터에 연결되어 sarcomere 길이와 탄소 섬유 굽힘을 추적합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 시간 제 조명
- 서로 다른 색상의 3개의 LED(460 nm, 525 nm, 640nm, 재료 표참조)로 구성된 외부 맞춤형 LED 제어 상자를 통해 형광 현미경 검사법 및 광이온 채널의 활성화를 위한 빛을 제공합니다.
- 데이터 수집 소프트웨어 프로토콜에서 생성된 TTL(Time to Live) 펄스를 통해 LED를 제어할 수 있도록 제어 상자의 마이크로 컨트롤러 및 그래픽 사용자 인터페이스(GUI) 코드를 수정합니다(재료 표참조). 디지털 아날로그 컨버터를 통해 TTL 펄스를 LED 제어 박스로 전송합니다.
- LED를 구동하고 GUI를 통해 펄스 수를 선택합니다. GUI에서 명령을 받으면 마이크로 컨트롤러가 새 코어에서 프로세스를 시작합니다. 이 과정에서 TTL 입력과 GUI에서 설정된 제어 스위치가 지속적으로 확인됩니다.
- TTL 입력이 양수이면 마이크로 컨트롤러가 LED를 켜고 TTL 입력 확인을 다시 시작합니다. TTL 신호가 0으로 돌아오면 마이크로 컨트롤러가 LED를 끄고 남은 펄스 수를 하나씩 줄입니다. 어느 시점에서든 제어 스위치가 거짓이거나 펄스 수가 0이면 마이크로 컨트롤러는 GUI에서 새 명령을 받을 때까지 이 프로세스를 중지합니다.
- 직접 현미경의 백포트에 LED를 결합.
- 오브젝트 평면의 광도 측정
- 스테이지 마이크로미터(대물 배율 40배, A = 0.8mm 2)로 조명영역을측정합니다.
- 광학 전력 계측기(재료 표 참조)를사용합니다.
- 여기 파장(525nm), 객관적배율(40x), 여기 필터(530/20nm) 또는 미러와 같은 실험 설정을 정의하고 다양한 LED 입력 전압에서 광전력[W]를 판독합니다.
- 광력 [W]를 조명 영역 [mm 2](여기: 0.8mm2)로나누어 광강도를 계산합니다.
참고: 5.6단계에서 각 프로토콜을 사용하여 실제 광전력을 측정하여 10ms 도달 및 긴 지속 시간의 짧은 광 펄스 지속 시간이 설정된 값을 유지하는지 확인합니다(보충도 1).
- 패치 클램프 실험 준비
- 다음 외부 및 내부솔루션을 준비합니다(물 요구 사항은 표 1참조).
- 포도당으로 삼투압을 300±5 mOsmol/L. Aliquot 내부 용액으로 조정하고 -20°C에서 보관합니다.
참고: 녹화 당일에는 내부 용액을 얼음 위에 두십시오. 외부 용액을 실온에서 유지하십시오. 여기서 설명된 패치 클램프 용액은 이전에 사용된 용액및Cl-농도가 더 낮고, 더 생리학적 수준7로변경되었다. 각각의 광유전학 액추에이터의 이온 선택성의 특성화를 위해, 우리는 세포외 및 세포내용액(19)에서주요 이온(예를 들어, Cl-, Na+ ,K++ , H+)의농도를 변화시키는 것이 좋습니다. - 파이펫 홀더에서 기록 전극을 벗고 매우 미세한 사포로 실버 와이어에서 은염화물 층을 제거하십시오.
참고: 각 측정 일의 시작 부분에서 이 단계를 수행합니다. - 와이어를 1.5V 배터리의 양극에 연결하고 10분 동안 은 염화물 코팅을 위해 3M KCl 용액에 담그면 됩니다.
참고: 음극은 3M KCl 용액에 침지된 기준 실버 와이어에 연결됩니다. - 측정 챔버 준비 : 측정 챔버의 프레임에 실리콘 그리스를 넣고 챔버가 밀봉 된 프레임의 상단에 커버 슬립 (직경 : 50mm, 두께 번호 0)을 놓습니다.
- 욕조에 참조 실버 / 염화물 펠릿 전극을 넣고 헤드 스테이지와 연결합니다.
- 소다 라임 유리 모세 혈관 (외부 직경 : 1.55mm, 내경 : 1.15mm)에서 마이크로 파이펫 풀러 (재료 표참조)에서 1.7 - 2.5 MΩ 패치 파이펫을 당깁니다.
- 데이터 수집 소프트웨어를 시작하고 멤브레인 테스트(펄스 10 mV, 15 ms, 기준선 0 mV)를 조정합니다.
| 외부 목욕 용액 | 내부 파이펫 솔루션 | |
| 나클 [mM] | 140 | - |
| KCl [mM] | 5.4 | 11 |
| CaCl2 [mM] | 1 | - |
| MgCl2 [mM] | 2 | 2 |
| 포도당 [mM] | 10 | - |
| 헤페스 [mM] | 10 | 10 |
| K-아스파르타테 [mM] | - | 119 |
| Mg-ATP [mM] | - | 3 |
| EGTA [mM] | - | 10 |
| Ph | 7.4 (NaOH) | 7.2 (KOH) |
| 삼투압 (포도당으로 조정) [모솔/L] | 300 ± 5 | 300 ± 5 |
표 4: 패치 클램프 솔루션.
- 패치 클램프 측정을 위한 프로토콜
- -74 mV의 유지 전위에서 V 클램프 모드에서 광 활성화 프로토콜을 기록합니다. 300 ms의 광 펄스를 사용합니다.
참고 : 우리는 배양 CM의 휴식 멤브레인 전위에 가까운 V 클램프 기록을 수행하는 것이 좋습니다 (I-클램프에 설립; -79 mV와 -77 mV 사이의 우리의 손에 모두 변환 및 비 변환 CM19). 갓 단리된 세포는 -79 mV의 평균 휴식 막 전위를나타낸다(보충 도 2,액체 접합 전위 보정 후 모든 값). - 0 pA에서 I-클램프 모드에서 AP를 기록합니다.
- 전기 적 진도의 경우, 10 ms의 전류 펄스를 주입 (0 pA에서 설정 된 값에 램프 10 ms), 0.25 Hz. AP를 유도 하는 임계값을 찾을.
- 광학 속도 의 경우 신뢰할 수있는 AP를 유도하기 위해 최소 광 강도에서 10 ms, 0.25 Hz의 광 펄스를 사용합니다.
- 0 pA에서 I-클램프 모드에서 광 억제를 기록합니다. 5.6.2.1 단계에서 설명한 대로 AP를 유도하고 15개의 전기적으로 트리거된 AP 후 4mW/mm2에서 64초동안 지속된 빛을 적용합니다.
참고: 그림 6F는 지속적인 빛 동안 더 높은 전류 주사가 적용되는 광 억제 프로토콜을 보여줍니다. 임계값의 1.5배(여기: 0.7 nA)부터 시작하여 주입된 전류는 0.1 nA의 단계에서 증가하였다(최종 수준: 2.2 nA). 모든 테스트 된 전류 진폭에서, 지속적인 광 응용 프로그램은 AP 생성을 억제.- 제어 실험으로, 가벼운 응용 프로그램없이 64 s에 대한 전기 자극을 일시 중지합니다.
- -74 mV의 유지 전위에서 V 클램프 모드에서 광 활성화 프로토콜을 기록합니다. 300 ms의 광 펄스를 사용합니다.
- 패치 클램프 실험
참고: 어두운 환경에서 다음 실험을 수행합니다(파란색/녹색 광 활성화 도구에 빨간색 표시등을 사용할 수 있음).- 외부 용액이 있는 측정 챔버에 셀이 있는 커버슬립을 놓고 형광CM을 선택합니다.
참고: eGFP 양성 세포는 밴드 패스 여기 필터(450 nm - 490 nm), 510 nm 이색 거울 및 515 nm 롱 패스 방출 필터와 함께 파란색 LED(460 nm)를 사용하여 검출할 수 있습니다. 다른 형광 태그를 사용하는 경우 해당 LED 및 형광 필터 세트를 사용하십시오. 높은 감전 효율이 달성되면 (GtACR1 아데노바이러스로 손 >99%), 기능 적 실험 전에 eGFP 형광을 확인할 필요가 없습니다. 이렇게 하면 잠재적인 GtACR1 사전 활성화를 방지할 수 있습니다. - 패치 파이펫을 내부 용액으로 채웁니다. 팁에 기포가 없는지 확인합니다.
- 파이펫 홀더에 파이펫을 부착하고 내부 용액에 기록 은염화물 코팅 실버 와이어를 삽입합니다.
- 셀 연결 구성에 도달한 후 -74 mV의 보유 잠재력을 가진 데이터 수집 소프트웨어의 전체 셀 모드로 전환합니다. 전체 세포 구성에 액세스하기 위해 음압을 부드럽게 가하여 멤브레인을 파열시킵니다. 이는 측정된 정전 용량의 즉각적인 증가로 표시됩니다.
- 섹션 5.6에 설명된 프로토콜을 실행합니다.
- 외부 용액이 있는 측정 챔버에 셀이 있는 커버슬립을 놓고 형광CM을 선택합니다.
- 탄소 섬유 기술
- 탄소 섬유를 생산합니다.
- 외부 직경: 2.0 mm, 내경: 1.16 mm, 길이: 100mm (재료 표참조)와 같은 매개 변수와 함께 유리 모세 혈관을 사용합니다. 마이크로파이펫 풀러를 사용하여 유리 모세관을 동일한 길이의 두 개의 파이펫으로 당깁니다(총 테이퍼 길이 ~11 mm, 그림 5)을최종 내경 ~30 μm로 당깁니다.
참고: 첫 번째 및 두 번째 풀에 사용되는 설정은 각각 85.2%(풀러의 최대 출력에 비례) 및 49.0%입니다(필라멘트의 풀러, 유형 및 나이에 따라 다릅니다). - 12V, 24A의 설정을 사용하여 자체 제작 마이크로 단조로 파이펫을 최대 45°까지 구부립니다(피펫 굽힘 설정에 대한 자세한 내용은 그림 4 참조).
- 모세관(2)을 방향 원(5)의 빨간색 선에 정렬하고, 구부리기 부분의 길이가 방향 원의 중심(반경 4.5mm)의 중심 이후에 항상 동일하므로 모세관의 위치를 일정하게 유지합니다.
- 벤더(3)로 모세관의 끝을 아래로 밀어 모세관을 최대 45°(녹색 선)까지 구부리고 필라멘트(4)를 가열하여 위조하여 모세관이 벤더를 제거한 후에도 45° 각도를 포착합니다.
- 탄소 섬유(장 이브 르 구엔 교수가 제공)를 스테레오 현미경으로 유리 모세관의 미세한 끝에 맞춥니다. 끝에 부드러운 튜브가 있는 미세 한 집게를 사용하여 그립을 높이고 섬유를 손상시킬 위험을 줄입니다.
참고 : 이러한 섬유는 섬유와 세포 사이의 접촉 면을 증가시켜접착력 (20)을향상시키는 미세 구조가 특징입니다. - 탄소 섬유를 2mm 길이로 자르고 슈퍼 접착제 (시아노 아크릴레이트)를 사용하여 섬유를 모세관의 전면에 고정시다.
참고: 섬유가 길수록 동일한 힘을 가하면 더 많이 구부러지어집니다.
- 외부 직경: 2.0 mm, 내경: 1.16 mm, 길이: 100mm (재료 표참조)와 같은 매개 변수와 함께 유리 모세 혈관을 사용합니다. 마이크로파이펫 풀러를 사용하여 유리 모세관을 동일한 길이의 두 개의 파이펫으로 당깁니다(총 테이퍼 길이 ~11 mm, 그림 5)을최종 내경 ~30 μm로 당깁니다.
- 탄소 섬유를 교정합니다.
- 0.05 mN/V의 감도와 0-0.5 mN의 힘 범위의 힘 변환기를 사용하여 탄소 섬유를 교정합니다(재료 표참조).
참고: 이 설정은 "끌어오기" 대신 압축을 측정하기 위해 맞춤 제작되었습니다. - 모세관을 탄소 섬유로 마이크로 매니퓰레이터와 압전 모터에 의해 제어되는 홀더에 부착합니다.
- 힘 센서와 접촉하여 섬유의 팁을 배치하지만, 어떤 힘을 생성하지 않고 10 μm (총 이동 60 μm)의 단계로 압전 모터를 이동하여 센서를 향해 측정 된 전압(E)을볼트로 판독한다.
참고: 탄소 섬유의 자유 단부 끝에 힘 변환기가 닿는지 확인합니다. - 이러한 측정을 세 번 반복합니다.
- 수식 1을 사용하여 각 압전 위치(압전 모터 단계 간의 측정된 전압의ΔΔ
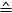 차이)에 대한 힘을 계산합니다.
차이)에 대한 힘을 계산합니다.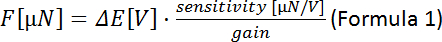
참고: 힘 변환기의 감도는 트랜스듀서 모델에 따라 달라집니다(여기: 0.05 mN/V = 50 μN/V). 게인은 컨트롤러에서 설정할 수 있습니다. - 압전 위치에 대해 힘 [μN]을 플로팅합니다. 경사는 섬유 강성 [μN/μm]에 해당합니다.
- 0.05 mN/V의 감도와 0-0.5 mN의 힘 범위의 힘 변환기를 사용하여 탄소 섬유를 교정합니다(재료 표참조).
- CM 계약의 기록 힘.
참고: 어두운 환경에서 다음 실험을 수행합니다(파란색/녹색 광 활성화 도구에 빨간색 표시등을 사용할 수 있음).- 폴리 HEMA로 측정 챔버의 표면을 코팅합니다. 측정 챔버를 외부 목욕 용액으로 채우고 배양 된 세포 현탁액을 챔버에 몇 방울 떨어 뜨립니다 (단계 4.9).
- 탄소 섬유로 모세 혈관을 무대 미세 조작기에 부착하십시오. 짧은 녹색 광 펄스를 적용하여 수축을 유도하는 능력을 확인하여 GtACR1 발현 CM을 선택합니다. 탄소 섬유를 측정 챔버 의 표면에 거의 수평으로 정렬합니다.
- 첫 번째 섬유를 세포 표면으로 낮춥습니다. 두 번째 섬유를 CM의 다른 쪽 끝에 있는 첫 번째 섬유에 평행하게 부착합니다. 이상적인 정렬은 셀 축에 거의 수직입니다.
참고: 셀을 바닥 면에 부드럽게 밀어 섬유를 부착합니다. 두 번째 섬유를 부착하기 전에 압력을 풀어 놓습니다. 두 번째 섬유를 부착하여 셀을 늘이지 마십시오. - 두 섬유가 셀에 부착 된 후 섬유를 들어 올리면 세포가 더 이상 챔버 표면에 접촉하지 않고 마찰없이 수축 할 수 있습니다.
- 데이터 수집 소프트웨어(재료 표참조)에 sarcomeres를 집중하고 섬유 사이에 sarcomere 길이 추적 창(그림7A I(3))을설정합니다.
참고: 생성된 FFT 전력스펙트럼(그림 7AI (2))은이상적으로 하나의 날카로운 피크를 나타내며, 이는 평균 sarcomere 길이를 나타낸다. - 모서리 감지 모듈을 사용하여 섬유 굽힘을 추적합니다. 적색 및 녹색 창으로 검출 영역을 설정하고 광강도 추적의 첫 번째 미분에서 임계값(빨간색 및 녹색 수평 선)을 정의합니다(그림7A III).
- 0.25Hz에서 광학적으로 셀의 속도를 맞추기 시작하고(가능한 경우 더 빠른 속도) sarcomere 길이와 섬유 굽힘을 추적합니다.
참고: 파이버 홀더 위치, LED 트리거 및 전기 자극 펄스는 데이터 수집 소프트웨어를 통해 제어됩니다(재료 표참조). - 적어도 15개의 광학유도 수축을 기록한 후, 전지를 전기적으로 자극한다(재료 표참조). 임계값 전압의 1.5배를 적용하여 수축을 유도하고 기록할 임계값을 찾습니다.
- 억제 프로토콜의 경우 전기 자극을 적용하여 수축을 유도한 다음 64초의 지속적인 빛에 노출합니다(다양한 광 강도).
- 탄소 섬유를 생산합니다.

그림 4: 파이펫 굽힘 설정. (1) 왼쪽의 마이크로 조작기는 모세관의 위치를 제어하는 데 사용되며, 오른쪽에있는 두 번째 마이크로 조작기는 구부리는 데 사용됩니다. (2) 모세관. (3) 벤더. (4) 마이크로 포지. (5) 오리엔테이션 원. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 탄소 섬유가 있는 파이펫. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 데이터 분석
-
패치 클램프 레코딩
참고: 실험 후 액체 접합 전위전위가 기록된 모든 전압및 명령 전압을 수정합니다. 공구 접합 전위 계산기를 사용하여 데이터 수집 소프트웨어에서 액체 접합 전위를 결정합니다(표 4에명시된 패치 클램프 솔루션의 경우 21°C에서 14.4mV). 기록된/명령 전압에서 액체 접합 전위를 뺍니다.- I-클램프 AP 레코딩의 경우 전기 속도와 광학 간격을 확인합니다. 사용자 지정스크립트(보충 자료)를사용하여 AP 지속 시간(APD)을 20% 및 90% 재분분극으로 계산합니다. 휴식 멤브레인 전위 및 AP 진폭을 결정합니다.
참고 : Wang K. 외21에 설명 된 대로 APD를 결정하십시오 .abf 파일을로드하는 스크립트는 일반적으로 다음 링크를 통해 액세스 할 수 있습니다 : https://de.mathworks.com/matlabcentral/fileexchange/22114-fcollman-abfload. 6AP 이상에 대한 평균 APD 값입니다. - V-클램프 광활성화의 경우 기준선이 0pA에 있는지 확인합니다. 기준선을 0으로 조정하지 않는 경우. -74 mV에서 300 ms 광 펄스에 의해 트리거 된 기록 된 전류를 분석합니다. 데이터를 데이터 분석 소프트웨어로 전송하고 피크 및 평균 고정 전류를 결정합니다.
- I-클램프 AP 레코딩의 경우 전기 속도와 광학 간격을 확인합니다. 사용자 지정스크립트(보충 자료)를사용하여 AP 지속 시간(APD)을 20% 및 90% 재분분극으로 계산합니다. 휴식 멤브레인 전위 및 AP 진폭을 결정합니다.
-
탄소 섬유 실험
- 광학 속도 동안 수축 기록: 데이터 수집 소프트웨어에서 기록된 데이터를 로드하고 탄소 섬유 굽힘과 sarcomere 길이 변경의 기준선과 최대값을 판독합니다.
참고: 안정적인 레코딩의 수축 10개에 대한 평균 값입니다. - 셀 폭을 측정하고 타원형 단면을 가정하는 셀의 단면적을 계산합니다(그림7B II).
주: 타원 영역에 대한 수식은 A = π·a·b(수식 2)이며 여기서 a는 중심에서 정점까지의 거리이고 b는 중심에서 공동 정점까지의 거리입니다. 이 경우 이것은 = (셀의 폭)/2 및 b =(셀의 두께)/2를 의미합니다. 니시무라 외22에 따르면 CM의 두께는 세포 폭의 1/3으로 추정될 수 있으므로 A = π· (1/2)·폭· (1/2)·두께 = π· (1/4)·폭· (1/3)·폭 = π· (1/12)·너비2. - 종단 수축기 힘 (F)를 계산합니다.
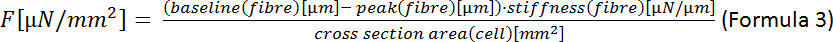
- 종단 수축기 세포 변형 (ESD)을 계산합니다.
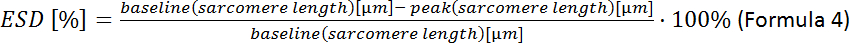
참고 : 추가 수축 매개 변수를 분석 할 수 있습니다 : 휴식 sarcomere 길이, 피크 시간, 90 % 이완 시간, 분수 sarcomere 단축, 수축 및 이완의 최대 속도 (소프트웨어 수집 매뉴얼 참조).
- 광학 속도 동안 수축 기록: 데이터 수집 소프트웨어에서 기록된 데이터를 로드하고 탄소 섬유 굽힘과 sarcomere 길이 변경의 기준선과 최대값을 판독합니다.
결과
GtACR1-eGFP는 배양된 토끼CM(도 6 인서트)에서 발현되었고, 광전류는 패치 클램프 기술로 측정하였다. GtACR1의 광활성화는 -74 mV에서 큰 내부 방향 전류를 보여줍니다. 도 6에서피크 전류(IP)는4 mW /mm2에서 245 pA입니다. AP는 전류 주사가 임계값의 1.5배, 또는 10 ms의 짧은 탈편극광 펄스를 가진(도 6B)또는 광학적으로(도6C)각각 트리거되었다. APD 값을 분석하면, 전기적으로 진행된 CM은 0.24±0.08 s의 APD 20과 0.75±0.17s의 APD 90을 나타내고, 광학적으로 진행된 CM은 APD 20의 0.31±0.08 s 및 APD 90의 0.81±0.19 s(SE, n= 5, N=2) 여기서 제시된 예에서 APD 20전기 = 0.17s; APD 20광학 = 0.27 s 및 APD 90전기 = 0.61 s; APD 90광학 = 0.68 s; 그림 6D). 광학적으로 진행되는 CM은 느린 AP 발병을보여준다(도 6D). CM 활성화는 염화물의 반전 전위를 향한 멤브레인 전위를 편광시킴으로써 지속적인 조명(64s, 4 mW/mm2)에 의해 억제되었고, 여기서 -58 mV(도 6E). 임계치의 1.5배 이상인 전류 주사는 AP 생성을 유도하지않는다(도 6F). 생성된 피크 힘은 탄소 섬유 굽힘으로부터 결정되었다(도7B, C, E). CM은 전기 적 진도에 따라 232 μN/mm2를 생성했습니다(그림 7B)및 광학 적 간격(그림 7C)에따라 261 μN /mm2. 연장된 녹색 광 펄스는 수축을 억제합니다(그림 7E). 64s에 대한 광학 억제에 이어, 재발 수축은 더 낮은 수축력을 생성하고, 힘 값은 토끼 CM에서 확장기 칼슘 손실에 따라 ~ 10 수축 후 기준선으로 회복 (0.25 Hz에서 속도, 그림 7D).
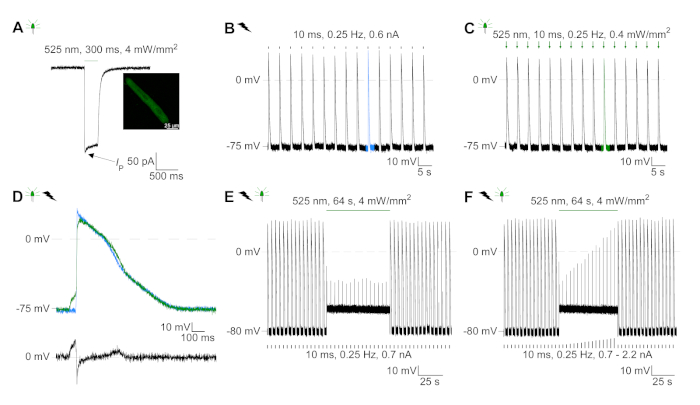
그림 6: 전기 및 광학 적 진행/억제 CM의 대표적인 패치 클램프 기록. (A)300 ms, 4 mW/mm2의광 펄스를 사용 하 여 -74 mV에서 대표적인 광 전류. IP는 피크 전류를 나타낸다. 인서트는 GtACR1-eGFP 양성 세포를 나타낸다. (B)대표 AP 레코딩은 10 ms의 전류 램프를 사용하여 0.6 nA의 전류 램프를 사용하여 CM을 전기적으로 페이스를 유지합니다.(C)대표 AP 기록은 10 ms, 0.4 mW/mm2의 광 펄스를 사용하여 0 pA에서 기록한다. (D)상단 그래프는 전기적으로(blue) 및 광학적으로 활성화된 CM. AP의10번째 AP의 오버레이를 나타내고 AP는 멤브레인 전위(dV/dt max)의 최대 변화에 의해 정렬되었다. 하단 그래프는 광학적으로 트리거된AP(E광학-E전기)의멤브레인 전위 차이를 나타낸다. (e)전기적으로 트리거된 AP는 64s, 4 mW/mm2의지속적인 빛 하에서 억제되었다. (F)AP는 지속된 빛 하에서 임계치(0.7 nA에서 0.7 nA에서 2.2 nA단계)보다 높은 전류 주사에 의해 억제된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
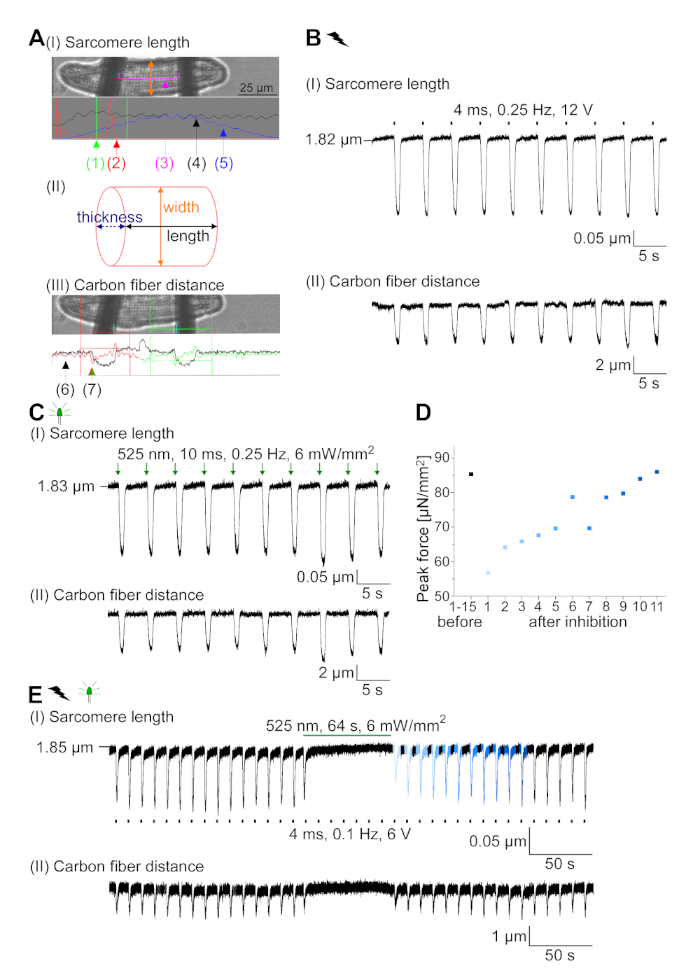
그림 7: 광학 및 전기적 진행/억제 된 CM의 탄소 섬유 기록의 대표 데이터. (A)데이터 수집 소프트웨어에 표시합니다. 이미지(I)는 사르카망 길이를 계산하기 위한 창과 함께 측정된 CM을 나타낸다. 셀 너비는 주황색으로 표시됩니다. (1) 관련 주파수의 범위. (2) FFT 파워 스펙트럼은 세포 상에서 의 자폐 간격의 주파수를 나타낸다. 평균 sarcomere 길이는 피크 주파수에서 계산됩니다. (3) 사오레 길이 추적 창. (4) 강도 추적. (5) 강도 추적에 해밍 창이 곱한 강도 추적은 창이 있는 강도 추적입니다. 계획(II)은 셀의 타원형 단면을 나타낸다. 주황색 너비와 두께가 파선 파란색입니다. 이미지(III)는 각각의 검출 박스와 함께 탄소 섬유의 위치를 나타내고, 녹색으로 적색 및 우측으로 좌측을 나타낸다. (6) 강도 추적. (7) 강도 추적의 첫 번째 미분 (데이터 수집 소프트웨어 설명서 참조). (B)전기적으로 유도된 수축의 대표적인 흔적. 패널(I)은 사르카망 길이 단축, 패널(II) 두 탄소 섬유 사이의 거리를 나타낸다. (C)광학 유도 수축의 대표적인 흔적 (525 nm, 0.25 Hz, 10 ms, 6 mW / mm2). 패널(I)은 사르카망 길이 단축, 패널(II) 두 탄소 섬유 사이의 거리를 나타낸다. (D)AP 발생의 억제에 의한 일시 정지 후 수축 1 에서 11까지 피크 힘이 발생하였다. (E)지속적인 조명하에서 수축의 광학 억제의 대표적인 흔적 (525 nm, 64 s, 6mW / mm2). 패널(I)은 두 탄소 섬유 사이의 길이 단축, 패널(II) 길이를 나타내고 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| A. | 영역 |
| Acr | 아니온 채널로독신 |
| Ap | 작업 잠재력 |
| Apd | 작업 잠재적 인 기간 |
| Cfu | 콜로니 형성 유닛 |
| Chr | 채널로독신 |
| Cm | 심근세포 |
| eGFP | 향상된 녹색 형광 단백질 |
| Esd | 끝 수축기 세포 변형 |
| Eu | 내독소 단위 |
| F | 강제로 |
| Fft | 빠른 푸리에 변환 |
| GtACR | 기야르디아 세타 음이온 채널로호도프신 |
| Gui | 그래픽 사용자 인터페이스 |
| I 클램프 | 전류 클램프 |
| Iu | 국제 단위 |
| 모이 | 감염의 복합성 |
| 폴리 헤마 | 폴리 (2-하이드록시틸 메타크릴레이트) |
| V 클램프 | 전압 클램프 |
표 5: 약어 목록입니다.

추가 그림 1: 광학 전력 계측기의 광강도 측정. (A)4 mW/mm2에서10 ms 빛 펄스의 측정. (B)4 mW /mm2에서64 s의 지속적인 조명의 측정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
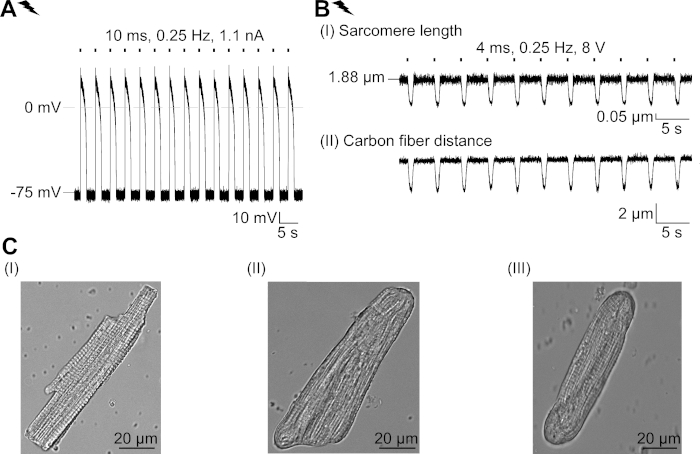
보충 그림 2: 갓 분리된 CM의 특성 및 배양에서의 구조적 적응. (a)새로 단리된 CM의 AP 기록(APD 20 의 1.11±0.34 s, APD 90 의 1.96±0.32 s, n=7, N=2). -79.3 ±0.8 mV의 평균 휴식 막 전위 (n= 7, N = 2). (b)전기적으로 단리된 CM. 평균 피크 력 205±78 μN/mm2(n=7, N=2)의 탄소 섬유 기록. (C)갓 단리된 CM(I)의 공초점 이미지; 48시간 후에 트랜스듀스(II) 및 트랜스듀시(III) CM을 배양한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 자료: APD 및 휴식 멤브레인 전위를 결정하는 MatLab 스크립트. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
광유전학 적 도구는 비 침습적 인 방식으로 흥분 성 세포 전기 생리학의 변조를 가능하게하는 반면, 그들은 특정 실험 설계에 가장 적합한 도구를 선택할 수 있도록 다른 세포 유형 (예 : CM)에서 철저한 특성화가 필요합니다. 패치 클램프 기술은 세포 전기 생리학을 평가하기위한 표준 방법입니다. 전체 세포 구성에서, 그것은 하나의 광 자극 / 억제 다음 플라즈마 멤브레인 또는 멤브레인 전압의 시간 적 변화를 통해 사진 활성화 전류를 기록 할 수 있습니다. 전기 여기의 광유전학 조작은 또한 CM 수축에 영향을 미칩니다. 당사는 sarcomere 추적 및 탄소 섬유 보조 힘 측정을 사용하여 광 심문이 근세포의 기계적 활동에 미치는 영향을 정량화합니다.
우리는 CM에서 빛 문이 염화물 채널, GtACR1의 기본 효과를 특성화하는 프로토콜을 설명합니다. 모델 시스템으로서, 우리는 그들의 전기 생리학적 특성 (예를 들어, AP 모양 및 내화 기간)이 설치류 CM보다 인간 CM에서 더 밀접하게 관찰 된 것과 유사하기 때문에 토끼 CM을 선택했습니다. 더욱이, 토끼 CM은 며칠 동안 배양될 수 있고, 충분히 오래 아데노바이러스 전달 및 GtACR1-eGFP의 발현을 위해 배양될 수 있다. 특히, 단리CM은 세포 종말의 반올림 및 교차 줄무늬의 점진적 손실을 포함하여, 배양에서 그들의 구조적 특성을 변화시키고, T-관 계통 및 카베올라23,24. 이에 따라, 기능적 변화는 배양 된 CM에서보고되었습니다 : 휴식 막 전위, AP의 연장 및 셀룰러 Ca2 + 취급의 변화. 문화에서 세포 적응의 검토를 위해, 참조 하시기 바랍니다 Louch등. 25. 보충 도 2는 본원에서 관찰된 CM(도 6, 도 7)에서 관찰된 것과 비교하기 위해 새롭게 단리된 CM의 예시AP 및 수축 측정을나타낸다(도 6, 도 7)는여기에 제시된 프로토콜을 이용하여.
전체 셀 패치 클램프 레코딩을 사용하면 광전류 특성(예: 진폭 및 역학)과 높은 시간적 해상도에서 멤브레인 전위 또는 AP 특성의 빛 유발 변화를 직접 측정할 수 있습니다. 그러나, 이러한 기록은 몇 가지 한계가 있다: 첫째, 시토솔은 이온 전기 화학 그라데이션을 제어하는 것이 유리하지만, 세포 소기관, 단백질 및 기타 화합물을 세척하는 본질적인 단점을 가지고, 따라서 잠재적으로 세포 전기 반응에 영향을 미치는 전체 세포 기록에서 파이펫 용액으로 대체된다. 둘째, 비생리학적으로 긴 탈분극(예: 빛 문이 있는 이온 채널의 느린 시간 상수)으로 인한 추가 이온 채널의 활성화와 같은 부작용은 APD의 변화를 감지할 수 있지만 전기 생리학적으로 관련된 세포 구획에서 이온 농도의 직접 측정을 수행하지 않기 때문에 평가하기가 어렵습니다. 이는 형광 표시기(예:Ca2+ 센서) 또는 이온 선택전극으로 수행할 수 있습니다. 추가 특성화는 광강도 적정, pH 의존성의 결정, 상이한 막 전위에서의 광전류 역학, 반복적인 광 자극 동안의 회복 역학을 포함할 수 있다.
패치 클램프 기록과는 달리, 단세포 힘 측정은 세포 내 밀리에 영향을 미치지 않고 손상되지 않은 근세포의 세포 수축을 분석할 수 있게 합니다. 이온 농도에 대한 이차 효과(예:Ca2+)는생성된 힘 진폭 및 역학(예: 수축 및 이완의 최대 속도; 여기서 는 분석되지 않음)을 결정하여 간접적으로 평가될 수 있습니다. 탄소 섬유 기술을 사용한 힘 측정은 사전 로드된 셀의 수동 및 활성 힘에 대한 직접적인 정보를 제공하기 때문에 자유롭게 수축하는 세포에 비해 장점이 있습니다(즉, 내부 또는 생체 내 설정과 더 유사한 조건에서). 기계적 사전 로드는 세포 수축성을 분석 할 때 특히 중요합니다, 스트레치 힘 생산 및 이완에 영향을 미치는26,27.
광유전학적 접근법은 단일 CM 및 손상되지 않은 심장 조직 모두에서 세포막 전위를 일시적으로 정밀하게 조작할 수 있게 합니다. 고전적으로, ChR2, 빛 게이트 양이온 비 선택적 채널, 멤브레인 전위탈화에 사용 되었습니다., 반면 빛 구동 양성자 및 염화물 펌프 막 과분극에 대 한 사용 되었다. ChR2는 본질적으로 낮은 단일 채널 전도도28및 광 구동 펌프가 흡수된 광자당 1개의 이온을 최대로 운반하는 특징이기 때문에 광유전학 액추에이터의 두 그룹 모두 높은 발현 수준을 요구합니다. 더욱이, CM에서 ChR2의 장기간 활성화는 Na+ 및/또는Ca2+ 과부하로 이어질 수 있으며, 경구동 펌프는 트랜스-사콜렘H+ 또는 Cl-그라데이션 29,30을변경할 수 있다. CM 활동의 광유전학적 제어를 위한 대체 도구를 찾기 위해, 우리는 최근 ChR2와 같은 양이온 ChR에 비해 우수한 단일 채널 전도도와 높은 광 감도를 특징으로 하는 천연 음이온 채널러호독신 GtACR1을 테스트했습니다. 우리는 GtACR1 활성화가 CM을 탈분극하고 광 펄스 타이밍 및 기간에 따라 광학 속도 및 억제에 사용될 수 있음을 발견했습니다. 양이온 ChR 대신 ACR을 사용하는 또 다른 장점은 Cl의 더 부정적인 반전 전위일 수있습니다-Na+에 비해 인위적으로 도입된 이온 전류를 감소시킵니다. 우리가 이전에 보여 준 바와 같이, GtACR1와 광학 속도는 빠른 GtACR1 돌연변이를 사용하여 극복 할 수있는 GtACR1 채널 폐쇄의 느린 구성 요소의 결과로 AP 연장으로 이어질 수있습니다 19. 그러나, AP 연장은 더 낮고, 더 생리학적인 세포내Cl-농도를 사용할 때 훨씬 덜 두드러진다(도 6참조). 더욱이, GtACR1-중재된 억제는 장기간 조명에 의한 억제를 초래하여 심도 있는 막 탈분극을 초래하며, 이는 다시 이차 Na+ 및Ca2+ 유입을 활성화시켜 전압 게이트 채널의 활성을 변화시킬 수 있다. 우리의 측정에서, 우리는 AP 및 수축 파라미터가 1 분 동안 빛 유도 된 억제 후 40 초 이내에 기준선으로 회복된다는 것을 발견했습니다 (Kopton et al. 2018, 그림 6, 그림 7참조). 라이트 게이트 K+ 채널은 CM 안정 멤브레인 전위31에영향을 주지 않고 CM을 침묵시키는 강력한 대안을 제공합니다.
미래에 우리는 심장 활동을 억제하는 그들의 잠재력에 대한 다른 광유전학 적 도구를 정량적으로 비교하고 싶습니다. 이를 위해, 우리는 ACR, ChR2 및 적색 이동 ChR변이체(32)를포함하는 다양한 광 게이트 이온 채널뿐만 아니라 할로호돕신 또는 발압 식 아데닐릴 사이클라제 bPAC와 같은 과극화 액추에이터를 칼륨 채널 SthK(PAC-K)(PAC-K)와 조합하여 시험한다.
여기서 제시된 프로토콜은 CM의 전기기계적 특성의 심층적 특성화에 사용될 수 있다. 그것은 주로 다른 종에서 CM에 적용, 그리고 CM병에 걸린 심근에서 분리. 광 자극을 통해 서로 다른 주파수에서 CM 속도를 조절할 수 있으며 탄소 섬유 수축 실험 중에 다양한 프리로드를 테스트할 수 있습니다. 흥미로운 실험은 질병 진행 동안 심장 조직 리모델링의 발달 중에 관찰 될 수있는 바와 같이, 휴식 막 전위점진적 증가를 모방하기 위해, 하위 임계 값 탈분극에 대한 낮은 강도 조명을 사용하는 것입니다. 마지막으로, 기능적 측정은 Ca2+ 이미징과 결합하여 여기 수축 커플링에 대한 추가 통찰력을 제공하거나 약리학적 개입으로 CM 활동에 미치는 영향을 평가할 수 있습니다.
공개
저자는 공개 할 것이 없다.
감사의 말
우리는 우수한 기술 지원에 대한 스테파니 페레즈 펠리즈 감사합니다, 박사 요나스 비텍 (훔볼트 대학, 독일 베를린) pUC57-GtACR1 플라스미드를 제공하기 위한 pUC57-GtACR1 플라스미드, 마이클 슈프 박사(샤리테-유니버시티메디진 베를린, 베를린 인스티투트 파마콜로지, 베를린) 아데노바이러스 생산을 위한 교수, 아나스타샤 코클로바 박사(우랄 연방대학)는 세포 분리를 개선하기 위해 자신의 전문지식을 공유하기 위해 아데노바이러스 생산과 아나스타샤 코클로바(Ural Federal 대학)를 공유하기 위한 전문지식을 공유하기 위한 아데노바이러스 생산및 아나스타샤 코클로바(Ural Federal 대학)를 위한 전문 지식을 공유하기 위한 교수 마이클 슈프(Charité-Universitätsmedizin Berlin, Institut für Pharmakologie, 베를린)를 제공하기 위한 전문 지식을 공유하기 위한 아데노바이러스 생산및 아나스타샤 코클로바(Ural Federal University University)를 제공하기 위한 전문 지식을 공유하고, 아데노바이러스 생산을 위한 교수 마이클 슈프(Charité-Universitätsmedizin Berlin, Instituttsmedizin, Berlin, Berlin) 이 프로젝트는 독일 연구 재단 (SPP1926: SCHN 1486/1-1)에 의해 지원되었다; 에미 노에테르 펠로우십: SCHN1486/2-1) 및 ERC 어드밴스드 그랜트 카디오넥트.
자료
| Name | Company | Catalog Number | Comments |
| Equipment - Cell isolation/Culturing/Transduction | |||
| Adeno-X Adenoviral System 3 CMV | TaKaRa, Clontech Laboratories, Inc., Mountain View, California, USA | ||
| Aortic cannula | Radnoti | 4.8 OD x 3.6 ID x 8-9 L mm | |
| Coverslips ø 16 mm, Thickness No. 0 | VWR International GmbH, Leuven, Belgium | 631-0151 | Borosilicate Glass |
| Griffin Silk, Black, 2 m Length, Size 3, 0.5 mm | Samuel Findings, London, UK | TSGBL3 | |
| Incubator | New Brunswick, Eppendorf, Schönenbuch, Switzerland | Galaxy 170S | |
| Langendorff-perfusion set-up | Zitt-Thoma Laborbedarf Glasbläserei, Freiburg, Germany | Custom-made | |
| Langendorff-pump | Ismatec, Labortechnik-Analytik, Glattbrugg-Zürich, Switzerland | ISM444 | |
| Mesh: Nylon Monodur filter cloth | Cadisch Precision Meshes Ltd | 800 µm holes, 1 m wide | |
| Neubauer chamber | VWR International GmbH, Leuven, Belgium | 717806 | |
| Rabbit, New Zealand White | Charles River | Strain Code: 052 | |
| Scissors | Aesculap AG, Tuttlingen, Germany | BC774R | Bauchdeckenschere ger. 18cm |
| Sterile filter, 0.22 µm | Merck, Darmstadt, Germany | SLGP033RB | |
| Equipment - Patch-clamp | |||
| Amplfier | AxonInstruments, Union City, CA, United States | Axopatch 200B | |
| Coverslip ø 50 mm, Thickness No. 1 | VWR International GmbH, Leuven, Belgium | 631-0178 | Borosilicate Glass |
| Digitizer Axon Digidata | Molecular Devices, San José, CA, United States | 1550A | |
| Filter (530/20) | Leica Microsystems, Wetzlar, Germany | 11513878 | BZ:00 |
| Filter (630/20) | Chroma Technology, Bellows Falls, Vermont, United States | 227155 | |
| Headstage | AxonInstruments, Union City, CA, United States | CV203BU | |
| Interface | Scientifica, Uckfield, UK | 1U Rack, 352036 | |
| LED 525 nm | Luminus Devices, Sunnyvale, CA, United States | PT-120-G | |
| LED control software | Essel Research and Development, Toronto, Canada | ||
| LED control system | custom-made | ||
| Micropipette Puller | Narishige Co., Tokyo, Japan | PP-830 | |
| Microscope inverted | Leica Microsystems, Wetzlar, Germany | DMI4000B | |
| Motorised Micromanipulator | Scientifica, Uckfield, UK | PatchStar | |
| Optical power meter | Thorlabs, Newton, NJ, United States | PM100D | |
| Silicone Grease | RS Components, Corby, UK | 494-124 | |
| Silver wire | A-M Systems, Sequim, WA, United States | 787500 | Silver, Bare 0.015'', Coated 0.0190'', Length 25 Feet |
| Soda lime glass capillaries | Vitrex Medical A/S, Vasekaer, Denmark | 160213 BRIS, ISO12772 | 1.55 OD x 1.15 ID x 75 L mm |
| Software Axon pClamp | Molecular Devices, San José, CA, United States | Version 10.5 | |
| Software MatLab2017 | The MathWorks, Inc. | ||
| Stage micrometer | Graticules Optics LTD, Tonbridge, UK | 1 mm | |
| Equipment - Carbon fiber | |||
| Carbon fibers | provided from Prof. Jean-Yves Le Guennec | BZ:00 | |
| Digitizer Axon Digidata | Molecular Devices, Sunnyvale, CA, United States | 1550B | |
| Filter (530/20) | Leica Microsystems, Wetzlar, Germany | 11513878 | |
| Filter (630/20) | Chroma Technology, Bellows Falls, Vermont, United States | 227155 | |
| Fluorescence System Interface | IonOptix, Milton, MA United States | FSI-800 | 2.0 OD x 1.16 ID x 100 L mm |
| Force Transducer System | Aurora Scientific Inc., Ontario, Canada | 406A | |
| Glass capillaries for force measurements | Harvard Apparatus, Holliston, Massachusetts, United States | GC200F-10 | |
| Interface National Instruments | National Instruments, Budapest, Hungary | BNC-2110 | |
| LED 525 nm | Luminus Devices, Sunnyvale, CA, United States | PT-120-G | |
| LED control box | Essel Research and Development, Toronto, Canada | ||
| LED control system | custom-made | ||
| Microcontroller | Parallax Inc., Rocklin, California, United States | Propeller | |
| Micropipette Puller | Narishige Co., Tokyo, Japan | PC-10 | |
| Microscope inverted | Leica Microsystems, Wetzlar, Germany | DMI4000B | |
| MyoCam-S camera | IonOptix, Dublin, Ireland | ||
| MyoCam-S camera Power | IonOptix, Milton, MA, United States | MCS-100 | |
| MyoPacer Field Stimulator | IonOptix Cooperation, Milton, MA, United States | MYP100 | |
| Piezo Motor | Physik Instrumente (PI) GmbH & Co. KG, Karlsruhe, Germany | E-501.00 | |
| Silicone Grease | RS Components, Corby, UK | 494-124 | |
| Software Axon pClamp | Molecular Devices, San José, CA, United States | Version 10.5 | |
| Software IonWizard | IonOptix, Dublin, Ireland | Version 6.6.10.125 | |
| Software MatLab2017 | The MathWorks, Inc. | ||
| Stage micrometer | Graticules Optics LTD, Tonbridge, UK | 1 mm | |
| Chemicals | |||
| Adenosine | Sigma-Aldrich, St. Louis, Missouri, United States | A9251-100G | |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, Missouri, United States | A7030-50G | |
| CaCl2 | Honeywell Fluka, Muskegon, MI, USA | 21114-1L | |
| L-Carnitine hydrochloride | Sigma-Aldrich, St. Louis, Missouri, United States | C9500-25G | |
| Collagenase type 2, 315 U/mg | Worthington, Lakewood, NJ, USA | LS004177 | |
| Creatine | Sigma-Aldrich, St. Louis, Missouri, United States | C0780-50G | |
| Cytosine-β-D-arabinofuranoside | Sigma-Aldrich, St. Louis, Missouri, United States | C1768-100MG | |
| EGTA | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 3054.3 | |
| Esketamine hydrochloride, Ketanest S 25 mg/mL | Pfizer Pharma PFE GmbH, Berlin, Germany | PZN-07829486 | |
| Fetal Bovine Serum | Sigma-Aldrich, St. Louis, Missouri, United States | F9665 | |
| Gentamycin 50 mg/mL | Gibco, Life Technologies, Waltham, MA, USA | 15750-037 | |
| Glucose | Sigma-Aldrich, St. Louis, Missouri, United States | G7021-1KG | |
| Heparin-Sodium, 5,000 IU/mL | Braun Melsungen AG, Melsungen, Germany | PZN-03029843 | |
| HEPES | Sigma-Aldrich, St. Louis, Missouri, United States | H3375-1KG | |
| Insulin (bovine pancreas) | Sigma-Aldrich, St. Louis, Missouri, United States | I6634-50MG | |
| K-aspartate | Sigma-Aldrich, St. Louis, Missouri, United States | A6558-25G | |
| KCl | VWR International GmbH, Leuven, Belgium | 26764.260 | 1 mg/mL |
| KOH | Honeywell Fluka, Muskegon, MI, USA | 35113-1L | |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma-Aldrich, St. Louis, Missouri, United States | L2020-1MG | |
| M199-Medium | Sigma-Aldirch, St. Louis, Missouri, United States | M4530 | |
| Mg-ATP | Sigma-Aldrich, St. Louis, Missouri, United States | A9187-1G | |
| MgCl2 | Sigma-Aldrich, St. Louis, Missouri, United States | 63069-500ML | |
| NaCl | Fisher Scientific, Loughborough, Leics., UK | 10428420 | |
| NaCl-Solution 0.9%, Isotone Kochsalz-Lösung 0.9% | Braun Melsungen AG, Melsungen, Germany | 3200950 | |
| NaOH | AppliChem GmbH, Darmstadt, Germany | A6579 | without Ca2+/Mg2+ |
| Na-pyruvat | Sigma-Aldrich, St. Louis, Missouri, United States | P2256-100MG | |
| Phosphate Buffered Saline | Sigma-Aldrich, St. Louis, Missouri, United States | D1408-500ML | |
| Poly(2-hydroxyethyl methacrylate) | Sigma, Poole, UK | 192066 | |
| Protease XIV from Streptomyces griseus | Sigma-Aldrich, St. Louis, Missouri, United States | P5147-1G | |
| Taurine | Sigma-Aldrich, St. Louis, Missouri, United States | T0625-500G | |
| Thiopental Inresa 0.5 g | Inresa Arzneimittel GmbH, Freiburg, Germany | PZN-11852249 | |
| Xylazine hydrochloride, Rompun 2% | Bayer Vital GmbH, Leverkusen, Germany | PZN-01320422 |
참고문헌
- Harz, H., Hegemann, P. Rhodopsin-regulated calcium currents in Chlamydomonas. Nature. 351, 489-491 (1991).
- Litvin, F. F., Sineshchekov, O. A., Sineshchekov, V. A. Photoreceptor electric potential in the phototaxis of the alga Haematococcus pluvialis. Nature. 271, 476-478 (1978).
- Nagel, G., et al. Channelrhodopsin-1: A Light-Gated Proton Channel in Green Algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
- Lozier, R. H., Bogomolni, R. A., Stoeckenius, W. Bacteriorhodopsin: a light-driven proton pump in Halobacterium Halobium. Biophysical journal. 15 (9), 955-962 (1975).
- Schobert, B., Lanyi, J. K. Halorhodopsin is a light-driven chloride pump. Journal of Biological Chemistry. 257 (17), 10306-10313 (1982).
- Inoue, K., et al. A light-driven sodium ion pump in marine bacteria. Nature Communications. 4, 1678 (2013).
- Han, X., et al. A High-Light Sensitivity Optical Neural Silencer: Development and Application to Optogenetic Control of Non-Human Primate Cortex. Frontiers in Systems Neuroscience. 5, 18 (2011).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Grimm, C., Silapetere, A., Vogt, A., Bernal Sierra, Y. A., Hegemann, P. Electrical properties, substrate specificity and optogenetic potential of the engineered light-driven sodium pump eKR2. Scientific Reports. 8, 9316 (2018).
- Wietek, J., et al. Conversion of channelrhodopsin into a light-gated chloride channel. Science. 344 (6182), 409-412 (2014).
- Berndt, A. Structure-Guided Transformation. Science. 344 (6182), 420-424 (2014).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Mohamed, G. A., et al. Optical inhibition of larval zebrafish behaviour with anion channelrhodopsins. BMC Biology. 15 (1), 103 (2017).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic Neuronal Silencing in Drosophila during Visual Processing. Scientific Reports. 7, 13823 (2017).
- Govorunova, E. G., Cunha, S. R., Sineshchekov, O. A., Spudich, J. L. Anion channelrhodopsins for inhibitory cardiac optogenetics. Scientific Reports. 6, 33530 (2016).
- Kopton, R. A., et al. Cardiac Electrophysiological Effects of Light-Activated Chloride Channels. Frontiers in Physiology. 9, 1806 (2018).
- Peyronnet, R., et al. Load-dependent effects of apelin on murine cardiomyocytes. Progress in Biophysics and Molecular Biology. 130, 333-343 (2017).
- Wang, K., et al. Cardiac tissue slices: preparation, handling, and successful optical mapping. American Journal of Physiology-Heart and Circulatory Physiology. 308 (9), 1112-1125 (2015).
- Nishimura, S., et al. Single cell mechanics of rat cardiomyocytes under isometric, unloaded, and physiologically loaded conditions. American Journal of Physiology-Heart and Circulatory Physiology. 287 (1), 196-202 (2004).
- Mitcheson, J. S., Hancox, J. C., Levi, A. J. Action potentials, ion channel currents and transverse tubule density in adult rabbit ventricular myocytes maintained for 6 days in cell culture. Pflugers Archiv European Journal of Physiology. 43 (6), 814-827 (1996).
- Burton, R. A. B., et al. Caveolae in Rabbit Ventricular Myocytes: Distribution and Dynamic Diminution after Cell Isolation. Biophysical Journal. 113 (5), 1047-1059 (2017).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in cardiomyocyte isolation, culture, and gene transfer. Journal of Molecular and Cellular Cardiology. 51 (3), 288-298 (2011).
- Janssen, P. M., Hunter, W. C. Force, not sarcomere length, correlates with prolongation of isosarcometric contraction. The American Journal of Physiology. 269 (2), 676-685 (1995).
- Monasky, M. M., Varian, K. D., Davis, J. P., Janssen, P. M. L. Dissociation of force decline from calcium decline by preload in isolated rabbit myocardium. Pflugers Archiv European Journal of Physiology. 456 (2), 267-276 (2008).
- Kleinlogel, S., et al. Ultra light-sensitive and fast neuronal activation with the Ca 2+-permeable channelrhodopsin CatCh. Nature Neuroscience. 14 (4), 513-518 (2011).
- Schneider-Warme, F., Ravens, U. Using light to fight atrial fibrillation. Cardiovascular Research. 114 (5), 635-637 (2018).
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature. 463 (7277), 98-102 (2010).
- Bernal Sierra, Y. A., et al. Potassium channel-based optogenetic silencing. Nature Communications. 9 (1), 4611 (2018).
- Oda, K., et al. Crystal structure of the red light-activated channelrhodopsin Chrimson. Nature Communications. 9 (1), 3949 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유