Method Article
Avaliação eletromecânica da atividade cardiomiocito optogeneticamente modulada
Neste Artigo
Resumo
Apresentamos um protocolo para avaliar os efeitos eletromecânicos da ativação do GtACR1 em cardiomiócitos de coelho. Fornecemos informações detalhadas sobre isolamento celular, cultivo e transdução adenoviral, e sobre experimentos funcionais com as técnicas de patch-clamp e fibra de carbono.
Resumo
Nas últimas duas décadas, ferramentas optogenéticas foram estabelecidas como meios potentes para modular atividades específicas do tipo celular em tecidos excitáveis, incluindo o coração. Enquanto channelrhodopsin-2 (ChR2) é uma ferramenta comum para despolarizar o potencial de membrana em cardiomiócitos (CM), potencialmente provocando potenciais de ação (AP), uma ferramenta eficaz para silenciar a atividade de CM tem sido faltando. Foi sugerido o uso de anion channelrhodopsins (ACR) para inibição optogenética. Aqui, descrevemos um protocolo para avaliar os efeitos da ativação do ACR GtACR1 natural de Guillardia theta em cm. Leituras primárias são gravações eletrofisiológicas de grampos de remendo e rastreamento óptico de contrações de CM, ambas realizadas ao aplicar diferentes padrões de estimulação da luz. O protocolo inclui isolamento cm do coração de coelho, semeadura e cultivo das células por até 4 dias, transdução via codificação de adenovírus para o canal de cloreto com tampa de luz, preparação de fixação de patch-clamp e fibra de carbono, coleta e análise de dados. O uso da técnica de retaque na configuração de células inteiras permite gravar correntes ativadas pela luz (no modo de grampo de tensão, v-clamp) e AP (modo de grampo de corrente, I-clamp) em tempo real. Além dos experimentos de patch-clamp, realizamos medições de contratilidade para avaliação funcional da atividade cm sem perturbar o meio intracelular. Para isso, as células são mecanicamente pré-carregadas usando fibras de carbono e contrações são registradas por alterações no comprimento do sarcomere e distância de fibra de carbono. A análise dos dados inclui a avaliação da duração do AP a partir de gravações de grampo sinuoso, correntes de pico de gravações de v-clamp e cálculo de força a partir de medidas de fibra de carbono. O protocolo descrito pode ser aplicado ao teste de efeitos biofísicos de diferentes atuadores optogenéticos na atividade cm, um pré-requisito para o desenvolvimento de uma compreensão mecanicista de experimentos optogenéticos em tecido cardíaco e corações inteiros.
Introdução
As fotocorrentes mediadas pelo ChR foram registradas pela primeira vez no olho das algas verdes unicelulares1,2. Logo após a clonagem genética e expressão heteróloga de Chlamydomonas reinhardtii ChR1 e ChR2, chR foram usados como ferramentas para alterar o potencial de membrana em oócitos xenopus e células mamíferas pela luz3,4. A Cção não-seletiva chR despolariza a membrana das células com um potencial de membrana de repouso que é negativo para o potencial de reversão da RCh. Assim, podem ser usados para provocar AP em células excitáveis, incluindo neurônios e CM, permitindo o ritmo óptico5,6.
Complementares ao cárter ChR, próton leve, cloreto e bombas de sódio7,8,9 foram usados para inibir a atividade neuronal10,11,12. No entanto, estes últimos possuem limitações, exigindo altas intensidades de luz e iluminação sustentada, uma vez que um íon é transportado por fóton absorvido. Em 2014, dois estudos independentes de Wietek et al. e Berndt et al. descreveram a conversão de CS rc condutorde cáção em ACR através de mutações no poro do canal13,14. Um ano depois, a ACR natural foi descoberta no criptofite Guillardia theta (GtACR)15. Como a ACR projetada mostrou condutância residual, elas foram substituídas por ACR natural, caracterizada por uma grande condutância de canal único e alta sensibilidade à luz15. O GTACR foi utilizado para silenciar a atividade neuronal polarizando o potencial de membrana para o potencial de reversão do cloreto16,17. Govorunova et al. aplicaram GtACR1 a CM ventricular de ratos cultivados e mostraram fotoinibição eficiente a baixos níveis de intensidade de luz que não eram suficientes para ativar ferramentas de inibição previamente disponíveis, como a bomba de prótons Arch18. Nosso grupo informou recentemente que a fotoinibição mediada por GTACR1 de CM é baseada na despolarização e que o GtACR1 também pode ser usado, portanto, para o ritmo óptico de CM19.
Aqui, apresentamos um protocolo para estudar os efeitos eletrofisiológicos e mecânicos da fotoativação gtacr1 em cm ventricular de coelho cultivado. Descrevemos primeiro o isolamento celular, a cultura e a transdução. Os efeitos eletrofisiológicos são medidos usando gravações de grampode remendo de células inteiras. As correntes mediadas pela luz em uma determinada tensão de membrana são avaliadas no modo v-clamp. A dinâmica do potencial da membrana é medida enquanto eletricamente ou opticamente aceleram CM (modo I-clamp). A inibição óptica do AP acionado eletricamente é testada usando a aplicação de luz sustentada. Os efeitos mecânicos são medidos usando fibras de carbono em combinação com o rastreamento baseado em imagens do comprimento do sarcomere. Para isso, as células opticamente paceable são mecanicamente pré-carregadas, anexando duas fibras de carbono à membrana plasmática perto de extremidades celulares opostas. Alterações de comprimento de sarcomere são registradas durante o ritmo óptico ou elétrico. Finalmente, a fotoinibição é medida durante a estimulação do campo elétrico das células, e as forças geradas são analisadas.
O protocolo inclui as seguintes etapas indicadas no fluxograma na Figura 1:anestesia profunda do coelho, injeção de overdose de tiropental, excisão cardíaca, langendorff-perfusão e digestão tecidual, dissociação mecânica do tecido para liberação de células, análise microscópica de rendimento de CM, cultivo de CM, transdução com adenovírus tipo 5, seguido de incubação e experimentos funcionais.

Figura 1: Fluxograma do protocolo utilizado para obter CM eletricamente e opticamente paceable. Os corações são extirparados de coelhos de 9 a 10 semanas de idade, e o tecido cardíaco é digerido enquanto é perfundido usando uma configuração Langendorff. As células são liberadas por agitação mecânica. O rendimento cm é contado um microscópio. Cm são cultivados, transduzidos com adenovírus tipo 5 e experimentos funcionais são realizados 48-72 horas após a transdução. Clique aqui para ver uma versão maior desta figura.
Protocolo
Todos os experimentos com coelhos foram realizados de acordo com as diretrizes estabelecidas na Diretiva 2010/63/UE do Parlamento Europeu sobre a proteção de animais usados para fins científicos e aprovados pelas autoridades locais em Baden-Württemberg (Regierungspräsidium Freiburg, X-16/10R, Alemanha).
1. Soluções para isolamento celular
- Preparar as soluções para o isolamento celular com água dos seguintes requisitos (Tabela 1) e de acordo com as composições iônicas listadas na Tabela 2.
NOTA: CaCl2 e MgCl2 são adicionados a partir de soluções de estoque de 1 M.
| Requisitos hídricos | |
| Condutividade [μS/cm] a 25 °C | 0.055 |
| Pirógeno [EU/mL] | < 0.001 |
| Partícula (tamanho > 0,22 μm) [1/mL] | ≤ 1 |
| Carbono orgânico total [ppb] | < 5 |
| Microrganismos [UFC/mL] | ≤ 1 |
| RNase [ng/mL] | < 0.01 |
| DNase [ng/mL] | < 4 |
Tabela 1: Requisitos hídricos.
| Solução salina fisiológica (1) | Baixo cálcio, solução de potássio alto (2) | Solução enzimática (3) | Solução de bloqueio | |
| NaCl [mM] | 137 | 137 | 137 | 137 |
| KCl [mM] | 4 | 14 | 14 | 14 |
| HEPES [mM] | 10 | 10 | 10 | 10 |
| Creatina [mM] | 10 | 10 | 10 | 10 |
| Taurina [mM] | 20 | 20 | 20 | 20 |
| Glicose [mM] | 10 | 10 | 10 | 10 |
| MgCl2 [mM] | 1 | 1 | 1 | 1 |
| Adenosina [mM] | 5 | 5 | 5 | 5 |
| L-Carnitina [mM] | 2 | 2 | 2 | 2 |
| CaCl2 [mM] | 1 | - | 0.1 | 0.1 |
| Na-Heparin [UI/L] | 5000 | - | - | - |
| EGTA [mM] | - | 0.096 | ||
| Colagem tipo 2, 315 U/mg [g/L] | - | - | 0.6 | - |
| Protease XIV [g/L] | - | - | 0.03 | - |
| Albumina de soro bovino [%] | - | - | - | 0.5 |
| Osmolaridade [mOsmol/L] | 325 ± 5 | 345 ± 5 | 345 ± 5 | 345 ± 5 |
Tabela 2: Soluções para isolamento cm.
- Ajuste todas as soluções para pH 7.4 a 37 °C e verifique a osmolaridade.
NOTA: Dissolva as enzimas (Collagenase tipo 2 e Protease XIV) diretamente antes da excisão cardíaca. Oxigene todas as soluções antes de usar.
2. Preparação da configuração langendorff-perfusão
NOTA: A configuração usada é feita medida. Como descrito na Figura 2,a configuração consiste em três reservatórios revestidos de água (1-3), um trocador de calor de contrafluxo em espiral (4) e um vaso de perfusão revestido de água (5).

Figura 2: Configuração de perfusão de Langendorff otimizada para o isolamento das células de coelho. (1-3) Reservatórios reprodutores de água com (1) solução salina fisiológica, (2) baixo cálcio, solução de potássio elevado e (3) solução cardioplégica contendo enzimas. (4) Trocador de calor de contrafluxo em espiral e (5) tanque de coleta com tampa de água. O fluxo do sistema revestido de água é o trocador de calor em espiral (a temperatura das soluções que saem da cânula de perfusão no final do trocador de calor deve ser constante a 37 °C), seguida pelo vaso de perfusão e os três reservatórios. Todas as soluções são oxigenadas (linha tracejada). Clique aqui para ver uma versão maior desta figura.
- Ligue a bomba do banho de água para circular água a 38 °C no sistema de troca de calor e pré-aqueça todas as soluções a 37 °C.
NOTA: A temperatura no fluxo de saída de (4) deve ser controlada e constante a 37 °C. - Encha os três reservatórios com a respectiva solução e lave cada linha (preta) com a solução correspondente. Encha a linha principal (azul) no final sem bolhas de ar usando solução (1).
NOTA: Oxigene as soluções antes (10 min) e durante o uso. Encha a linha do reservatório (3) até a torneira com baixo cálcio, solução de potássio alto. - Prepare uma sutura para amarrar o coração ao redor da aorta na cânula.
3. Isolamento celular
- Prepare as seguintes seringas.
- Para sedação/anestesia: Misture 0,5 mL/kg de cloridrato de esquetamina de peso corporal (25 mg/mL) e 0,2 mL/kg de cloridrato de xilazina de peso corporal (2%).
- Encha duas seringas com 12 mL de solução NaCl (0,9%).
- Preparar 6 mL de 12,5 mg/mL Na-thiopental, dissolvido em solução NaCl de 0,9%.
- Encha 0,2 mL de cloridrato de esquetamina (25 mg/mL) em uma seringa.
- Diluir 0,2 mL de Na-heparina (5.000 UI/mL) em 1 mL de solução NaCl de 0,9% (concentração final 1.000 UI/mL).
- Coelhos sedados/anestesiantes (9-10 semanas, coelho branco da Nova Zelândia, fêmea ou macho, ~2 kg) através de injeção intramuscular de cloridrato de esquetamina e cloridrato de xilazina (passo 3.1.1).
NOTA: Os coelhos precisam de pelo menos 10 min para serem totalmente anestesiados; a duração exata depende do seu peso corporal. Confirme a anestesia com a perda do reflexo de redireita. - Raspe o peito e as orelhas onde as veias estão localizadas.
- Insira uma cânula flexível na veia do ouvido, fixe-a com fita e lave-a com uma solução NaCl de 0,9%.
- Injete 1 mL da solução de Na-heparina por via intravenosa e lave-se com solução NaCl de 0,9%.
- Injete 0,2 mL de cloridrato de esquetamina, lave novamente com solução nacl de 0,9% e injete Na-thiopental até apnéia.
NOTA: O Coelho não deve responder ao reflexo de retirada do pedal. - Abra o peito do lado esquerdo e remova o pericárdio.
- Inicie o temporizador quando o coração for extizado e lave o coração duas vezes em solução fisiológica sorofia.
NOTA: Use uma tesoura com pontas redondas para evitar danos acidentais ao tecido cardíaco. - Cannulate a aorta em um banho com solução salina fisiológica e mantenha todo o tecido em solução. Ligar o sistema langendorff-perfusão (solução salina fisiológica (1), velocidade 24 mL/min).
- Transfira o coração para a configuração de perfusão de Langendorff, conecte a aorta ao bocal perfusato e amarre firmemente o coração com a sutura ao redor da aorta à cânula (< 1 min).
NOTA: Pré-encha a cânula com solução salina fisiológica, certifique-se de que nenhuma bolha de ar entre na cânula durante o transporte do local de cânula para a configuração langendorff, conecte-se sem bolhas. - Perfuja o coração até que todo o sangue seja lavado (2-3 min).
- Mudar para baixo cálcio, solução de potássio alto (2). Perfuse por mais 2 min depois que o coração parou de bater e mudar para solução enzimática.
- Comece a circular a solução enzimática, após 2 min desde o início da digestão, de volta ao reservatório. Diminua a velocidade para 16 mL/min após 5 min de digestão.
- Quando o tecido parecer macio (40-50 min de digestão), corte o coração da cânula e separe o ventrículo esquerdo.
- Solte as células por dissociação mecânica (separar suavemente o tecido com uma pipeta e um fórceps finopara segurar o tecido) na solução de bloqueio.
- Filtrar a suspensão celular através de uma malha (tamanho dos poros de 1 mm2) e centrífuga por 2 min a 22 x g (aceleração gravitacional).
- Remova o sobrenadante contendo não miócitos e suspenda novamente cm na solução de bloqueio.
4. Cultivo de CM
NOTA: Realize as seguintes etapas em condições estéreis.
- Diluir a laminina (da membrana do porão de sarcoma de murina Engelbreth-Holm-Swarm, 1 mg/mL) 1:10 em solução salina tamponada de fosfato estéril (sem Ca2+/Mg2+) para uma concentração final de 100 μg/mL.
- Preparar o meio de cultura em M199-Medium com os suplementos indicados na Tabela 3.
| Meio de cultura celular em M199-Medium | |
| Creatina [mM] | 5 |
| Cloridrato de L-carnitina [mM] | 2 |
| Taurina [mM] | 5 |
| Na-Pyruvat [mM] | 1 |
| Insulina (pâncreas bovino) [U/L] | 0.25 |
| Citosina-β-D-arabinofuranoside [mM] | 0.01 |
| Gentamicina [mg/mL] | 0.05 |
Tabela 3: Meio de cultura celular.
- Solução de filtro estéril (0,22 μm) e adicionar 5% de soro bovino fetal.
- Para experimentos de retalhos, tampas autoclave sucursais ø 16 mm, espessura nº 0, cubra-os com lamina de 100 μg/mL diretamente antes de cultivar.
- Para experimentos com fibra de carbono, cubra a superfície da placa de Petri com poli(2-hidroxitil metocrilato) (poli-HEMA, 0,12 g/mL em 95:5 EtOH:H20) e deixe solidificar.
NOTA: As células não 'grudam' em placas de Petri revestidas de poli-HEMA; isso é crucial para sua contração sem atrito em estudos de mecânica celular. - Após a re-suspensão cm ter resolvido (~10-15 min), remova o sobrenadante e, em seguida, suspenda novamente CM no meio de cultura.
- Conte CM com uma câmara de Neubauer e sementes a uma densidade alvo de 17.500 células/mL, seja em tampas revestidas de lamin a lamin ou em placas de Petri revestidas de poli-HEMA.
- Incubar células a 37 °C, 5% CO2 por 3-4 horas. Troque o meio (37 °C) de células semeadas de deslizamento de cobertura.
- Adicione acodificação de adenovírus (tipo 5) para GtACR1-eGFP em uma multiplicidade de infecção (MOI) de 75 e inicie experimentos funcionais após 48 horas.
NOTA: Após a transdução, mantenha as células no escuro. Use iluminação vermelha ao trabalhar com proteínas azuis ou verdes ativadas pela luz. Um sistema de entrega adenoviral comercialmente disponível (ver Tabela de Materiais) é usado para clonar os genes que codificam gtacr1-eGFP no vetor adenoviral. A inserção de interesse, aqui GtACR1-eGFP, é amplificada pcr e, em seguida, combinada com um vetor adenoviral incluindo um promotor CMV em uma reação de clonagem IN-Fusion. O promotor cmv (citomegalovírus humano) é comumente usado para conduzir a superexpressão de transgenes em células de mamíferos. eGFP é uma proteína fluorescente verde aprimorada derivada de Aequorea victoria com um máximo de excitação de 488 nm e um máximo de emissão em 507 nm. O Adenovírus (tipo 5) foi produzido externamente em Charité-Universitätsmedizin Berlin, Institut für Pharmakologie, Berlin, Prof. Dr. Michael Schupp.
ATENÇÃO: A transdução adenoviral é categorizada como trabalho de nível de segurança BSL-2, e as medidas de segurança apropriadas são legalmente necessárias.
5. Experimentos funcionais
NOTA: As gravações são realizadas usando um microscópio de fluorescência invertido. Filtrar a luz de transmissão por um filtro de banda-pass vermelho (630/20 nm) no condensador para evitar a co-ativação de GtACR1.
-
Configuração do patch-clamp
- Use um amplificador em combinação com um conversor analógico para digital. Use um software de aquisição de dados para registrar dados de corrente e tensão (ver Tabela de Materiais).
NOTA: Os dados gravados são digitalizados a 10 kHz e filtrados a 5 kHz.
- Use um amplificador em combinação com um conversor analógico para digital. Use um software de aquisição de dados para registrar dados de corrente e tensão (ver Tabela de Materiais).
-
Configuração de fibra de carbono
- Use uma câmera para detectar a posição da fibra de carbono e o comprimento do sarcomere rastreando mudanças no contraste óptico (as fibras de carbono aparecem como estruturas mais escuras, sobrepostas ao padrão celular estriado). Uma representação esquemmática da configuração é mostrada na Figura 3.
NOTA: O comprimento de sarcomere é calculado em tempo real usando uma rápida transformada fourier (FFT) do espectro de energia do padrão de estria.
- Use uma câmera para detectar a posição da fibra de carbono e o comprimento do sarcomere rastreando mudanças no contraste óptico (as fibras de carbono aparecem como estruturas mais escuras, sobrepostas ao padrão celular estriado). Uma representação esquemmática da configuração é mostrada na Figura 3.

Figura 3: Esquema que retrata a configuração experimental para medições de fibra de carbono. (O desenho não está em escala). Duas fibras de carbono são anexadas em uma célula e sua posição é controlada por um posicionador piezo. O pacer é usado para estimulação de campo elétrico. LeDs multicoloridos são acoplados na porta de epifluorescência do microscópio invertido para iluminação de células no plano do objeto. A energia LED é controlada através de uma caixa de controle dedicada, que recebe pulsos digitais através da saída digital do digital-analogue-converter (DAC). O DAC se comunica através da saída analógica com a interface do sistema de fluorescência. Uma câmera em preto e branco (774 pixels por 245 linhas) para imagens celulares é conectada ao computador para rastrear o comprimento do sarcomere e a dobra de fibra de carbono. Clique aqui para ver uma versão maior desta figura.
- Iluminação temporizado
- Fornecer luz para microscopia de fluorescência e ativação de canais de íons com tampa de luz através de uma caixa de controle LED personalizada externa, composta por três LEDs de cores diferentes (460 nm, 525 nm, 640 nm, ver Tabela de Materiais).
- Modifique o código de interface do usuário microcontrolador e gráfico (GUI) para a caixa de controle para permitir o controle do LED através de pulsos de Tempo de Vida externo (TTL), gerados em protocolos de software de aquisição de dados (ver Tabela de Materiais). Transmita pulsos TTL para a caixa de controle LED através do conversor digital-analógico.
- Dirija o LED e escolha o número de pulsos através da GUI. Ao receber o comando da GUI, o microcontrolador inicia um processo em um novo núcleo. Nesse processo, a entrada TTL, bem como um conjunto de interruptor de controle da GUI serão continuamente verificados.
- Quando a entrada TTL é positiva, o microcontrolador liga o LED e, em seguida, retoma a verificação da entrada TTL. Uma vez que o sinal TTL retorna a zero, o microcontrolador desliga o LED e reduz o número de pulsos deixados por um. Se em algum momento o interruptor de controle for falso ou o número de pulsos for zero, o microcontrolador interrompe esse processo até que um novo comando seja recebido da GUI.
- Acople diretamente os LEDs no backport do microscópio.
- Determinação da intensidade da luz no plano do objeto
- Medir a área iluminada com um micrômetro de estágio (ampliação objetiva 40x, A = 0,8 mm2).
- Use um medidor de potência óptico (ver Tabela de Materiais).
- Defina as configurações para os experimentos: comprimento de onda de excitação (525 nm), ampliação objetiva (40x), filtro de excitação (530/20 nm) ou espelho, e leia a energia de luz [W] em várias tensões de entrada led.
- Calcule a intensidade da luz [W/mm2] dividindo a potência da luz [W] pela área iluminada [mm2] (aqui: 0,8 mm2).
NOTA: Meça a potência real da luz com os respectivos protocolos na etapa 5.6 para verificar se durações curtas de pulso de luz de 10 ms alcance e durações longas mantêm o valor definido(Figura Suplementar 1).
- Preparação para experimentos de patch-clamp
- Prepare as seguintes soluções externas e internas (Tabela 4; para os requisitos hídricos ver Tabela 1).
- Ajuste a osmolaridade com glicose a 300 ± 5 mOsmol/L. Aliite a solução interna e armazene a -20 °C.
NOTA: Mantenha a solução interna no gelo durante o dia da gravação. Mantenha a solução externa em temperatura ambiente. As soluções aqui descritas de patch-clamp foram baseadas em soluções previamente utilizadas e a Cl- a concentração foi alterada para níveis mais baixos e fisiológicos7. Para caracterização da seletividade de íons do respectivo atuador optogenético, sugere-se variar as concentrações de íons maiores (por exemplo, Cl-, Na+, K+, H+) nas soluções extra e intracelulares19. - Retire o eletrodo de gravação do suporte da pipeta e remova a camada de cloreto de prata do fio de prata com lixa muito fina.
NOTA: Faça esta etapa no início de cada dia de medição. - Conecte o fio ao pólo positivo de uma bateria de 1,5 V e mergulhe na solução de 3 M KCl para revestimento de cloreto de prata por 10 min.
NOTA: O pólo negativo está conectado a um fio prateado de referência imerso na solução de 3 M KCl. - Prepare a câmara de medição: coloque graxa de silicone na estrutura da câmara de medição e coloque uma travessa (diâmetro: 50 mm, espessura nº 0) na parte superior da estrutura que a câmara está selada.
- Coloque um eletrodo de pelota de prata/prata-cloreto de referência no banho e conecte-o com o estágio da cabeça.
- Puxar 1,7 - 2,5 MΩ de cantas de vidro de cal de soda (diâmetro externo: 1,55 mm, diâmetro interno: 1,15 mm) com um puxador de micropipeta (ver Tabela de Materiais).
- Iniciar software de aquisição de dados e ajustar o teste de membrana (pulso 10 mV para 15 ms, linha de base 0 mV).
| Solução de banho externo | Solução de pipeta interna | |
| NaCl [mM] | 140 | - |
| KCl [mM] | 5.4 | 11 |
| CaCl2 [mM] | 1 | - |
| MgCl2 [mM] | 2 | 2 |
| Glicose [mM] | 10 | - |
| HEPES [mM] | 10 | 10 |
| K-Aspartate [mM] | - | 119 |
| MG-ATP [mM] | - | 3 |
| EGTA [mM] | - | 10 |
| Ph | 7.4 (NaOH) | 7.2 (KOH) |
| Osmolaridade (ajuste com glicose) [mOsmol/L] | 300 ± 5 | 300 ± 5 |
Tabela 4: Soluções de grampo de remendo.
- Protocolos para medições de patch-clamp
- Gravar o protocolo de fotoativação no modo v-clamp em um potencial de retenção de -74 mV. Use pulsos de luz de 300 ms.
NOTA: Sugerimos a realização de gravações de grampo sémio perto do potencial de membrana de repouso do CM cultivado (estabelecido em i-clamp; em nossas mãos entre -79 mV e -77 mV tanto para CM transduzidos e não transduzidos19). As células recém-isoladas apresentam um potencial médio de membrana de repouso de -79 mV(Figura Suplementar 2, todos os valores após correção do potencial de junção líquida). - Gravar AP no modo I-clamp a 0 pA.
- Para o ritmo elétrico, injete pulsos de corrente de 10 ms (rampa de 0 pA para o valor definido dentro de 10 ms), 0,25 Hz e encontre o limiar para obter AP. Registre AP por injeções atuais de 50% mais do que o limite.
- Para o ritmo óptico use pulsos de luz de 10 ms, 0,25 Hz na intensidade mínima de luz para obter AP confiável.
- Gravar fotoinibição no modo I-clamp em 0 pA. Provocar AP conforme descrito na etapa 5.6.2.1 e aplicar luz sustentada para 64 s a 4 mW/mm2 após 15 AP acionados eletricamente.
NOTA: A Figura 6F mostra um protocolo de fotoinibição onde durante a luz sustentada são aplicadas injeções de corrente mais altas. A partir de 1,5 vezes o limiar (aqui: 0,7 nA) a corrente injetada foi aumentada em etapas de 0,1 nA (nível final: 2,2 nA). Em todas as amplitudes de corrente testadas, a aplicação de luz sustentada inibiu a geração de AP.- Como experimento de controle, pausa a estimulação elétrica para 64 s sem aplicação de luz.
- Gravar o protocolo de fotoativação no modo v-clamp em um potencial de retenção de -74 mV. Use pulsos de luz de 300 ms.
- Experimentos com patch-clamp
NOTA: Realize os seguintes experimentos no escuro (a luz vermelha pode ser usada para ferramentas ativadas por luz azul/verde).- Coloque o deslizamento de cobertura com as células na câmara de medição com solução externa e selecione cm fluorescentes.
NOTA: as células eGFP positivas podem ser detectadas usando um LED azul (460 nm) em combinação com um filtro de excitação band-pass (450 nm - 490 nm), um espelho dicórico de 510 nm e um filtro de emissão de 515 nm de longa duração. Se forem utilizadas outras etiquetas fluorescentes, utilize conjuntos correspondentes de filtros de LED e fluorescência. Se uma alta eficiência de transdução for alcançada (em nossas mãos >99% com o adenovírus GtACR1), não há necessidade de verificar a fluorescência eGFP antes dos experimentos funcionais; isso evita uma possível pré-ativação do GtACR1. - Encha a pipeta de remendo com solução interna. Certifique-se de que não há bolhas de ar na ponta.
- Fixar a pipeta ao suporte da pipeta, inserindo o fio prateado revestido de prata de gravação na solução interna.
- Depois de atingir a configuração anexada à célula, mude para o modo de célula inteira no software de aquisição de dados com um potencial de retenção de -74 mV. Romper a membrana aplicando suavemente pressão negativa para acessar a configuração de células inteiras. Isso é indicado por um aumento imediato da capacitância medida.
- Execute os protocolos descritos na seção 5.6.
- Coloque o deslizamento de cobertura com as células na câmara de medição com solução externa e selecione cm fluorescentes.
- Técnica de fibra de carbono
- Produza fibras de carbono.
- Utilize capilares de vidro com os seguintes parâmetros: diâmetro externo: 2,0 mm, diâmetro interno: 1,16 mm, comprimento: 100 mm (ver Tabela de Materiais). Usando um puxador de micropipeette, puxe o capilar de vidro em duas pipetas do mesmo comprimento (comprimento total de fita ~11 mm, Figura 5) para um diâmetro interno final de ~30 μm.
NOTA: As configurações utilizadas para a primeira e segunda puxadas são 85,2% (proporção da saída máxima do puxador) e 49,0%, respectivamente (dependerá do puxador, tipo e idade do filamento). - Dobre as pipetas até 45° com uma micro forja auto-feita usando as configurações de 12 V, 24 A (consulte a Figura 4 para obter detalhes da configuração de dobra da pipeta).
- Alinhe o capilar (2) na linha vermelha no círculo de orientação (5), mantenha o posicionamento da constante capilar para que o comprimento da peça de dobra seja sempre o mesmo após o centro do círculo de orientação (raio de 4,5 mm).
- Dobre o capilar até 45° (linha verde) empurrando para baixo a ponta do capilar com a dobra (3) e forje aquecendo o filamento (4) até que a capilarcaptura o ângulo de 45° mesmo após a dobra ser removida.
- Coloque as fibras de carbono (fornecidas pelo Prof. Jean-Yves Le Guennec) na ponta fina do capilar de vidro um microscópio estéreo. Use pinças finas com tubos macios no final para aumentar a aderência e diminuir o risco de danificar as fibras.
NOTA: Essas fibras são caracterizadas por microestruturas, que aumentam a superfície de contato entre fibras e células, melhorando assim a adesão20. - Corte as fibras de carbono em um comprimento de 2 mm e use super cola (cianoacrilato) para fixar a fibra na parte frontal do capilar.
NOTA: Quanto mais tempo as fibras estiverem, mais elas se dobram na aplicação da mesma força.
- Utilize capilares de vidro com os seguintes parâmetros: diâmetro externo: 2,0 mm, diâmetro interno: 1,16 mm, comprimento: 100 mm (ver Tabela de Materiais). Usando um puxador de micropipeette, puxe o capilar de vidro em duas pipetas do mesmo comprimento (comprimento total de fita ~11 mm, Figura 5) para um diâmetro interno final de ~30 μm.
- Calibrar fibras de carbono.
- Calibrar as fibras de carbono usando um transdutor de força com uma sensibilidade de 0,05 mN/V e uma faixa de força de 0 - 0,5 mN (ver Tabela de Materiais).
NOTA: Esta configuração é feita medida para medir a compressão em vez de puxar. - Conecte o capilar com a fibra de carbono a um suporte que é controlado por um micromanipulador e um motor piezo.
- Coloque a ponta da fibra em contato com o sensor de força, mas sem produzir qualquer força e mova o motor piezo em passos de 10 μm (movimento total de 60 μm) em direção ao sensor e leia a tensão medida(E)em Volt.
NOTA: Certifique-se de que o transdutor de força seja contatado pela ponta da extremidade livre da fibra de carbono. - Repita essas medidas três vezes.
- Use a Fórmula 1 para calcular a força para cada posição piezo (ΔΕ
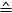 diferença de tensão medida entre os passos do motor piezo):
diferença de tensão medida entre os passos do motor piezo):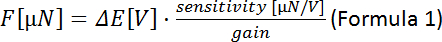
NOTA: A sensibilidade do transdutor de força depende do modelo do transdutor (aqui: 0,05 mN/V = 50 μN/V). O ganho pode ser definido no controlador. - Plote a força [μN] contra a posição piezo. A inclinação corresponde à rigidez da fibra [μN/μm].
- Calibrar as fibras de carbono usando um transdutor de força com uma sensibilidade de 0,05 mN/V e uma faixa de força de 0 - 0,5 mN (ver Tabela de Materiais).
- Força recorde de contratação de CM.
NOTA: Realize os seguintes experimentos no escuro (a luz vermelha pode ser usada para ferramentas ativadas por luz azul/verde).- Cubra a superfície da câmara de medição com poli-HEMA. Encha a câmara de medição com solução de banho externa e coloque algumas gotas da suspensão celular cultivada na câmara (passo 4.9).
- Conecte capilares com fibras de carbono ao micromanipulador de estágio. Selecione CM expressor de GtACR1 verificando a capacidade de induzir contrações por meio da aplicação de pulsos curtos de luz verde. Alinhe as fibras de carbono quase horizontalmente à superfície da câmara de medição.
- Abaixe a primeira fibra na superfície celular. Fixar a segunda fibra paralela à primeira fibra na outra extremidade do CM. O alinhamento ideal é quase perpendicular ao eixo celular.
NOTA: Conecte a fibra empurrando suavemente a célula para a superfície inferior. Solte a pressão antes de fixar a segunda fibra. Não estique a célula prendendo a segunda fibra. - Depois que ambas as fibras são fixadas na célula, levante as fibras, de modo que a célula não tem mais contato com a superfície da câmara e é capaz de contrair sem qualquer atrito.
- Concentre os sarcomeres no software de aquisição de dados (ver Tabela de Materiais) e defina a janela de rastreamento do comprimento do sarcomere(Figura 7A I(3)) entre as fibras.
NOTA: O espectro de energia FFT resultante(Figura 7A I (2)) mostra idealmente um pico acentuado, representando o comprimento médio do sarcomere. - Dobre a fibra usando o módulo de detecção de bordas. Defina as áreas de detecção com a janela vermelha e verde e defina um limiar (linha horizontal vermelha e verde) no primeiro derivado do traço de intensidade da luz(Figura 7A III).
- Comece a acelerar opticamente a célula a 0,25 Hz (se possível, tente taxas de ritmo mais rápidas) e acompanhe o comprimento do sarcomere e a dobra de fibra.
NOTA: A posição do suporte de fibra, o gatilho LED e os pulsos de estimulação elétrica são controlados através do software de aquisição de dados (ver Tabela de Materiais). - Depois de registrar pelo menos 15 contrações ópticas, estimular o campo estimule a célula eletricamente (ver Tabela de Materiais). Encontre o limiar para provocar contrações e registre aplicando 1,5 vezes a tensão limiar.
- Para o protocolo de inibição, aplique estímulos elétricos para provocar contrações e, em seguida, exponha-se à luz sustentada de 64 s (em várias intensidades de luz).
- Produza fibras de carbono.

Figura 4: Configuração de dobra de pipeta. (1) O micromanipulador do lado esquerdo é usado para controlar a posição do capilar, e um segundo micromanipulador à direita é usado para dobrá-lo. (2) Capilar. (3) Bender. (4) Microforge. (5) Círculo de orientação. Clique aqui para ver uma versão maior desta figura.

Figura 5: Pipeta com fibra de carbono. Clique aqui para ver uma versão maior desta figura.
6. Análise de dados
-
Gravações de grampo de remendo
NOTA: Corrija todas as tensões gravadas e de comando para o potencial de junção líquida após o experimento. Determine o potencial de junção líquida no software de aquisição de dados usando a calculadora potencial de junção da ferramenta (para as soluções de patch-clamp indicadas na Tabela 4: 14,4 mV a 21 °C). Subtraia o potencial de junção líquida da tensão gravada/de comando.- Para gravações AP de grampo i, verifique o ritmo elétrico versus o ritmo óptico. Calcule a duração do AP (APD) em 20 e 90% de repolarização com um script personalizado(Material Suplementar). Determine o potencial da membrana de repouso e a amplitude AP.
NOTA: Determine o APD conforme descrito em Wang K. et al.21 O script para carregar arquivos .abf é geralmente acessível através do seguinte link: https://de.mathworks.com/matlabcentral/fileexchange/22114-fcollman-abfload. Valores médios de APD para pelo menos 6 AP. - Para a fotoativação do grampo V, verifique se a linha de base está em 0 pA. Se não ajustar a linha de base a zero. Analisar a corrente registrada desencadeada por pulsos de luz de 300 ms a -74 mV. Transfira os dados para o software de análise de dados e determine o pico e a corrente estacionária média.
- Para gravações AP de grampo i, verifique o ritmo elétrico versus o ritmo óptico. Calcule a duração do AP (APD) em 20 e 90% de repolarização com um script personalizado(Material Suplementar). Determine o potencial da membrana de repouso e a amplitude AP.
-
Experimentos com fibra de carbono
- Gravações de contração durante o ritmo óptico: Carregue os dados registrados no software de aquisição de dados e leia a linha de base e a máxima da dobra da fibra de carbono e as alterações do comprimento do sarcomere.
NOTA: Valores médios para 10 contrações de um registro estável. - Meça a largura da célula e calcule a área transversal da célula assumindo uma seção transversal elíptica(Figura 7B II).
NOTA: A fórmula para a área de uma elipse é A = π·a·b (Fórmula 2) onde a é a distância do centro para o vértice e b é a distância do centro até o covértice. No nosso caso, isso significa a = (largura da célula)/2 e b = (espessura da célula)/2. De acordo com Nishimura et al.22, a espessura do CM pode ser estimada em um terço da largura da célula para que A = π· (1/2)·largura· (1/2)·espessura = π· (1/4)·largura· (1/3)·largura = π· (1/12)·largura2. - Calcular a força sistólica final (F):
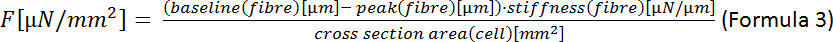
- Calcular a deformação celular sistólica final (ESD):
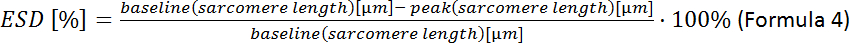
NOTA: Outros parâmetros contratuais podem ser analisados: comprimento de sarcomere de repouso, tempo para pico, tempo até 90% de relaxamento, encurtamento fracionado de sarcomere, velocidade máxima de contração e relaxamento (ver manual de aquisição de software).
- Gravações de contração durante o ritmo óptico: Carregue os dados registrados no software de aquisição de dados e leia a linha de base e a máxima da dobra da fibra de carbono e as alterações do comprimento do sarcomere.
Resultados
GtACR1-eGFP foi expresso em cm coelho cultivado ( inserçãoda Figura 6) e as fotocorrentes foram medidas com a técnica patch-clamp. A fotoativação de GtACR1 mostra grandes correntes direcionadas para dentro a -74 mV. Na Figura 6Uma corrente de pico(IP)a 4 mW/mm2 é de 245 pA. AP foram acionados eletricamente(Figura 6B) ou opticamente (Figura 6C) com injeções atuais 1,5 vezes o limiar, ou pulsos de luz despolarizador curtos de 10 ms, respectivamente. Analisando os valores de APD, cm eletricamente acelerados mostram um APD 20 de 0,24 ± 0,08 s e um APD 90 de 0,75 ± 0,17 s, que cm com ritmo óptico apresentam APD 20 de 0,31 ± 0,08 s e APD 90 de 0,81 ± 0,19 s (SE, n = 5, N = 2, no aqui apresentado exemplo APD 20elétrico = 0,17 s; APD 20óptico = 0,27 s e APD 90elétrica = 0,61 s; APD 90óptica = 0,68 s; Figura 6D). Cm opticamente acelerado mostrar um início de AP mais lento(Figura 6D). A ativação do CM foi inibida após a iluminação sustentada (para 64 s, 4 mW/mm2) por polarização do potencial de membrana em direção ao potencial de reversão do cloreto, aqui -58 mV(Figura 6E). Injeções de corrente mais altas do que 1,5 vezes o limiar não provocam geração DE AP(Figura 6F). As forças de pico geradas foram determinadas a partir da dobra da fibra de carbono (Figura 7B,C,E). O CM gerou 232 μN/mm2 após o ritmo elétrico(Figura 7B)e 261 μN/mm2 seguindo o ritmo óptico(Figura 7C). Pulsos de luz verde prolongados inibem contrações(Figura 7E). Após a inibição óptica para 64 s, as contrações recorrentes geram uma força contraífica menor, e os valores de força recuperam-se para a linha de base após ~10 contrações (ritmo a 0,25 Hz, Figura 7D) de acordo com a perda de cálcio diastólica do coelho CM.
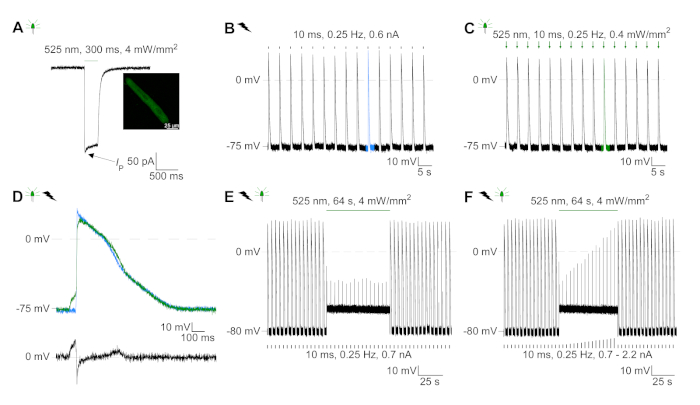
Figura 6: Representação de gravações de fixação de remendo de CM eletricamente e opticamente aceleradas/inibidas. (A) Fotocorrente representativa a -74 mV usando um pulso leve de 300 ms, 4 mW/mm2. IP indica a corrente de pico. A inserção mostra uma célula positiva GtACR1-eGFP. (B) Registro ap representativo a 0 pA utilizando uma rampa de corrente de 10 ms, 0,6 nA para acelerar eletricamente o CM. (C) Registro de AP representativo a 0 pA usando pulsos de luz de 10 ms, 0,4 mW/mm2. (D) Gráfico superior mostra a sobreposição do10º AP de CM ativado eletricamente (azul) e opticamente (verde). O gráfico inferior mostra a diferença do potencial de membrana entre AP óptica e eletricamente acionada (Eóptica-Eelétrica). (E) Ap acionado eletricamente foram inibidos luz sustentada de 64 s, 4 mW/mm2. (F) AP são inibidos por injeções de corrente mais altas do que 1,5 vezes o limiar (de 0,7 nA em etapas de 0,1 nA a 2,2 nA) luz sustentada. Clique aqui para ver uma versão maior desta figura.
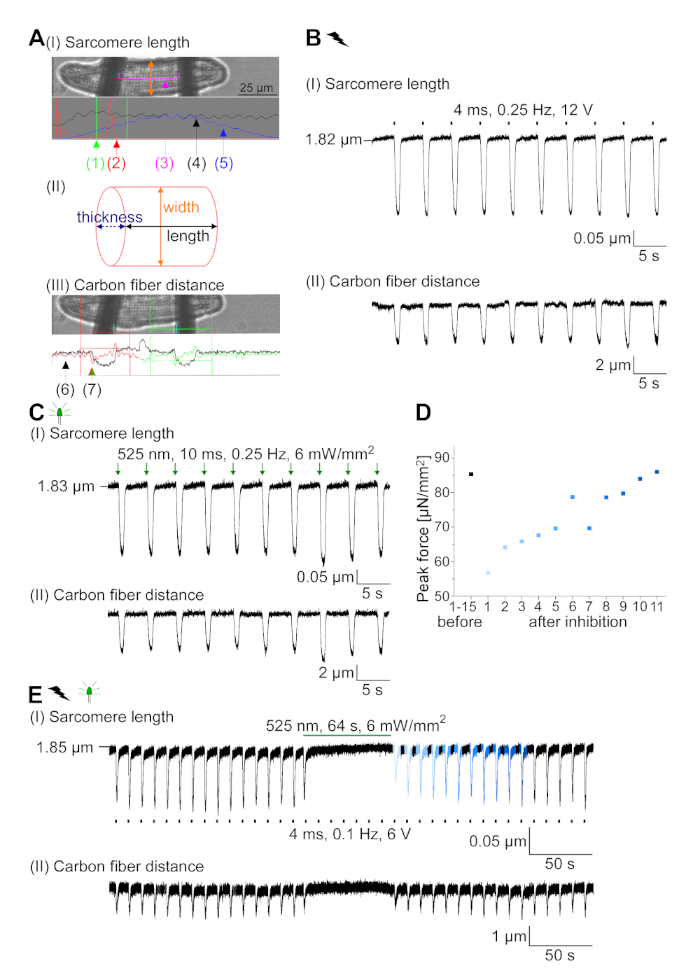
Figura 7: Dados representativos de gravações de fibra de carbono de CM ópticos e eletricamente acelerados/inibidos. (A) Exibir no software de aquisição de dados. A imagem (I) mostra o CM medido com a janela para calcular o comprimento do sarcomere. A largura da célula é rotulada em laranja. (1) Faixa de freqüências relevantes. (2) O espectro de energia FFT mostra a freqüência do espaçamento de sarcomere na célula. O comprimento médio do sarcomere é calculado a partir da frequência de pico. (3) Janela de rastreamento de comprimento sarcomere. (4) Traço de intensidade. (5) O traço de intensidade multiplicado por uma janela hamming é o traço de intensidade janela. O esquema (II) mostra a seção transversal elíptica da célula. Largura em laranja e espessura em azul tracejada. A imagem (III) mostra a posição das fibras de carbono com as respectivas caixas de detecção, deixadas em vermelho e direita em verde. (6) Traço de intensidade. (7) Primeiro derivado de rastreamento de intensidade (ver manual de software de aquisição de dados). (B) Traço representativo de contrações eletricamente provocadas. O painel (I) mostra o encurtamento do comprimento do sarcomere, painel (II) a distância entre as duas fibras de carbono. (C) Traço representativo de contrações ópticas (525 nm, 0,25 Hz, 10 ms, 6 mW/mm2). O painel (I) mostra o encurtamento do comprimento do sarcomere, painel (II) a distância entre as duas fibras de carbono. (D) Gerou força máxima de contração de 1 a 11 após uma pausa causada pela inibição da geração de AP. (E) Traço representativo da inibição óptica das contrações iluminação sustentada (525 nm, 64 s, 6 mW/mm2). O painel (I) mostra o encurtamento do comprimento do sarcomere, painel (II) o comprimento entre as duas fibras de carbono. Clique aqui para ver uma versão maior desta figura.
| Um | Área |
| Acr | anion channelrhodopsin |
| Ap | potencial de ação |
| APD | duração potencial de ação |
| Ufc | unidade de formação de colônia |
| Chr | channelrhodopsin |
| Cm | cardiomiócito |
| eGFP | proteína fluorescente verde aprimorada |
| Esd | fim da deformação celular sistólica |
| Ue | unidades de endotoxina |
| F | Força |
| Fft | rápida transformada Fourier |
| GtACR | Guillardia theta anion channelrhodopsin |
| Gui | interface gráfica do usuário |
| I-clamp | corrente-grampo |
| Ui | unidades internacionais |
| Moi | multiplicidade de infecção |
| poli-HEMA | poli (2-hidroxitil metocrilato) |
| Grampo em V | tensão-grampo |
Tabela 5: Lista de abreviaturas.

Figura suplementar 1: Medições de intensidade de luz com medidor óptico de potência. (A) Medição de pulsos de luz de 10 ms a 4 mW/mm2. (B) Medição da iluminação sustentada de 64 s a 4 mW/mm2. Clique aqui para ver uma versão maior desta figura.
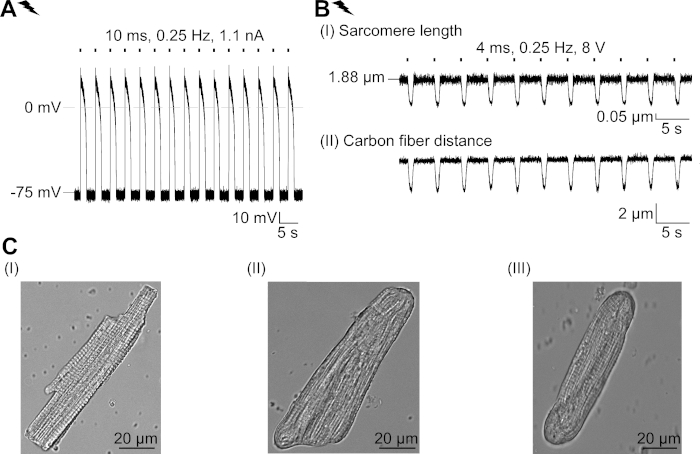
Figura suplementar 2: Propriedades de CM recém-isoladas e sua adaptação estrutural na cultura. (A) Registro ap de cm recém-isolado (APD 20 de 1,11 ± 0,34 s, APD 90 de 1,96 ± 0,32 s, n = 7, N = 2). Potencial médio de membrana de repouso de -79,3 ± 0,8 mV (n = 7, N = 2). (B) Registro de fibra de carbono de um CM recém-isolado eletricamente. Força média de pico de 205 ± 78 μN/mm2 (n = 7, N = 2). (C) Imagens confocais de um CM recém-isolado (I); CM não transduzidos (II) e transduzidos (III) após 48 horas de cultura. Clique aqui para ver uma versão maior desta figura.
Material suplementar: Script MatLab para determinar o potencial de APD e membrana de repouso. Clique aqui para baixar este arquivo.
Discussão
Considerando que as ferramentas optogenéticas permitem a modulação da eletrofisiologia celular excitável de forma não invasiva, elas precisam de caracterização completa em diferentes tipos de células (por exemplo, CM) para permitir que se escolha a melhor ferramenta disponível para um projeto experimental específico. A técnica de retalho-grampo é um método padrão para avaliar a eletrofisiologia celular. Na configuração de células inteiras, permite registrar correntes fotoativadas através da membrana plasmática ou mudanças temporais na tensão da membrana após estimulação/inibição da luz. A manipulação optogenética da excitação elétrica também afeta as contrações de CM. Usamos rastreamento de sarcomere e medidas de força assistida por fibra de carbono para quantificar os efeitos do interrogatório óptico sobre a atividade mecânica dos miócitos.
Descrevemos um protocolo para caracterizar os efeitos básicos de um canal de cloreto com tampa de luz, GtACR1, em CM. Como sistema modelo, escolhemos o CM do coelho, pois suas características eletrofisiológicas (por exemplo, forma AP e período refratário) se assemelham às observadas em CM humano mais de perto do que o CM de roedor. Além disso, o rabbit CM pode ser cultivado por vários dias, tempo suficiente para a entrega adenoviral e expressão de GtACR1-eGFP. Notavelmente, cm isolados alteram suas propriedades estruturais na cultura ao longo do tempo, incluindo arredondamento de terminações celulares e perda gradual de estrias cruzadas, sistema T-tubular e caveolae23,24. Em consonância com isso, alterações funcionais têm sido relatadas em CM cultivado: despolarização do potencial da membrana de repouso, prolongamento do AP e alterações no manuseio celular ca2+. Para revisão das adaptações celulares na cultura, consulte Louch et al.25. A Figura Suplementar 2 apresenta medidas de AP exemplares e contração de CM recém-isolados para comparação com as observadas em CM cultivados (Figura 6, Figura 7) utilizando o protocolo aqui apresentado.
As gravações de grampode remendo de células inteiras permitem medições diretas de propriedades fotocorrentes (por exemplo, amplitudes e cinéticas) e alterações induzidas pela luz no potencial da membrana ou características AP em alta resolução temporal. No entanto, tais gravações têm várias limitações: Em primeiro lugar, o citosol é substituído pela solução de pipeta em gravações de células inteiras, o que é vantajoso para controlar gradientes eletroquímicos iônicos, mas tem a desvantagem intrínseca de organelas celulares, proteínas e outros compostos, afetando potencialmente as respostas elétricas celulares. Em segundo lugar, efeitos colaterais como a ativação de canais de íons adicionais resultantes de despolarização não fisiologicamente longa (por exemplo, constantes de tempo lento de canais de íons fechados pela luz) são difíceis de avaliar, pois nosso método só permite detectar alterações na APD, mas não realizar medições diretas de concentrações iônicas em compartimentos celulares eletrofisiologicamente relevantes. Isso poderia ser feito com indicadores fluorescentes (por exemplo, sensores Ca2+) ou eletrodos seletivos de íons. Outra caracterização pode incluir titulações de intensidade de luz, determinação da dependência de pH, cinética fotocorrente em diferentes potenciais de membrana e cinética de recuperação durante a estimulação repetitiva da luz.
Em contraste com as gravações de patch-clamp, as medidas de força unicelular permitem a análise de contrações celulares de miócitos intactos sem afetar seu meio intracelular. Os efeitos secundários sobre as concentrações de íons (por exemplo, Ca2+) podem ser avaliados indiretamente por determinação da amplitude e dinâmica da força gerada (por exemplo, velocidade máxima de contração e relaxamento; aqui não analisados). As medidas de força com a técnica de fibra de carbono têm uma vantagem sobre a contração livre de células, pois fornecem informações diretas sobre forças passivas e ativas em células pré-carregadas (ou seja, em condições mais semelhantes às configurações in situ ou in vivo). A pré-carga mecânica é especialmente importante ao analisar a contratilidade celular, pois o estiramento afeta a produção de força e o relaxamento26,27.
Abordagens optogenéticas permitem a manipulação espacialmente precisa do potencial da membrana celular, tanto em CM único quanto em tecido cardíaco intacto. Classicamente, chR2, um canal não-seletivo de cácio de tampa siníope leve, tem sido usado para despolarização do potencial de membrana, enquanto bombas de próton e/ou cloreto leves foram usadas para hiperpolarização da membrana. Ambos os grupos de atuadores optogenéticos requerem altos níveis de expressão, uma vez que o ChR2 é caracterizado por uma condutância de canal único intrinsecamente baixa28 e bombas movidas à luz transportam um íon por fóton absorvido. Além disso, a ativação prolongada de ChR2 em CM pode levar à sobrecarga Na+ e/ou Ca2+, e as bombas acionadas por luz podem alterar o H+ ou Cl trans-sarcolemmal ou Cl- gradientes29,30. Em busca de ferramentas alternativas para o controle optogenético da atividade cm, testamos recentemente o anion channelrhodopsin GtACR1, caracterizado por uma condução de canal único superior e maior sensibilidade à luz em comparação com a CupiC Como ChR2. Descobrimos que a ativação gtacr1 despolariza cm e pode ser usado para ritmo óptico e inibição, dependendo do tempo e duração do pulso da luz. Uma vantagem adicional do uso de ACR em vez de cation ChR pode ser o potencial de reversão mais negativo de Cl- em comparação com Na+, reduzindo as correntes de íons introduzidas artificialmente. Como mostramos anteriormente, o ritmo óptico com gtACR1 pode levar à prorrogação do AP como resultado do componente lento do fechamento do canal GtACR1, que poderia ser superado usando mutantes GtACR1 mais rápidos19. No entanto, o prolongamento de AP é muito menos pronunciado ao usar uma cl intracelular mais baixa e mais fisiológica- concentração (ver Figura 6). Além disso, a inibição mediada pelo GtACR1 por iluminação prolongada resulta em profunda despolarização da membrana, que novamente poderia ativar o fluxo secundário Na+ e Ca2+, alterando assim a atividade dos canais com tensão. Em nossas medições, descobrimos que os parâmetros de AP e contração se recuperam para a linha de base dentro de 40 s após uma inibição induzida pela luz por 1 min (ver Kopton et al. 2018, Figura 6, Figura 7). Os canais K+ com tampa leve oferecem uma alternativa potente para silenciar cm sem afetar o potencial de membrana de repouso CM31.
No futuro, gostaríamos de comparar quantitativamente diferentes ferramentas optogenéticas para seu potencial para inibir a atividade cardíaca. Para isso, testamos uma variedade de canais de íons com cobertura luminosa, incluindo as variantes ACR, ChR2 e ChR de mudança vermelha32,bem como atuadores hiperpolarizadores como a halorhodopsina ou a luz fechada adenylyl cyclase bPAC em combinação com o canal de potássio SthK (PAC-K)31.
O protocolo aqui apresentado pode ser utilizado para caracterização aprofundada das propriedades eletromecânicas de CM. É aplicável principalmente também ao CM de outras espécies, e ao CM isolado do miocárdio doente. A estimulação óptica permite que se apace CM em diferentes frequências, e diferentes pré-cargas podem ser testadas durante experimentos de contração de fibra de carbono. Um experimento interessante seria usar iluminação de baixa intensidade para despolarização sublimiar, para imitar o aumento gradual do potencial da membrana de repouso, como pode ser observado durante o desenvolvimento da remodelação do tecido cardíaco durante a progressão da doença. Finalmente, as medições funcionais poderiam ser combinadas com imagens Ca2+ para maior estocada no acoplamento de excitação-contração, ou com intervenções farmacológicas para avaliar os efeitos de diferentes fármacos na atividade de CM.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Agradecemos a Stefanie Perez-Feliz pela excelente assistência técnica, Dr. Jonas Wietek (Humboldt-University, Berlim, Alemanha) por fornecer o plasmid pUC57-GtACR1, Prof. Dr. Michael Schupp (Charité- Universitätsmedizin Berlin, Institut für Pharmakologie, Berlin) para a produção de adenovírus e Dr. Anastasia Khokhlova (Ural Federal University) por compartilhar sua experiência para melhorar o protocolo de isolamento celular e redesenhar a configuração de dobra de pipeta. O projeto foi financiado pela Fundação Alemã de Pesquisa (SPP1926: SCHN 1486/1-1; Bolsa Emmy-Noether: SCHN1486/2-1) e o ERC Advanced Grant CardioNECT.
Materiais
| Name | Company | Catalog Number | Comments |
| Equipment - Cell isolation/Culturing/Transduction | |||
| Adeno-X Adenoviral System 3 CMV | TaKaRa, Clontech Laboratories, Inc., Mountain View, California, USA | ||
| Aortic cannula | Radnoti | 4.8 OD x 3.6 ID x 8-9 L mm | |
| Coverslips ø 16 mm, Thickness No. 0 | VWR International GmbH, Leuven, Belgium | 631-0151 | Borosilicate Glass |
| Griffin Silk, Black, 2 m Length, Size 3, 0.5 mm | Samuel Findings, London, UK | TSGBL3 | |
| Incubator | New Brunswick, Eppendorf, Schönenbuch, Switzerland | Galaxy 170S | |
| Langendorff-perfusion set-up | Zitt-Thoma Laborbedarf Glasbläserei, Freiburg, Germany | Custom-made | |
| Langendorff-pump | Ismatec, Labortechnik-Analytik, Glattbrugg-Zürich, Switzerland | ISM444 | |
| Mesh: Nylon Monodur filter cloth | Cadisch Precision Meshes Ltd | 800 µm holes, 1 m wide | |
| Neubauer chamber | VWR International GmbH, Leuven, Belgium | 717806 | |
| Rabbit, New Zealand White | Charles River | Strain Code: 052 | |
| Scissors | Aesculap AG, Tuttlingen, Germany | BC774R | Bauchdeckenschere ger. 18cm |
| Sterile filter, 0.22 µm | Merck, Darmstadt, Germany | SLGP033RB | |
| Equipment - Patch-clamp | |||
| Amplfier | AxonInstruments, Union City, CA, United States | Axopatch 200B | |
| Coverslip ø 50 mm, Thickness No. 1 | VWR International GmbH, Leuven, Belgium | 631-0178 | Borosilicate Glass |
| Digitizer Axon Digidata | Molecular Devices, San José, CA, United States | 1550A | |
| Filter (530/20) | Leica Microsystems, Wetzlar, Germany | 11513878 | BZ:00 |
| Filter (630/20) | Chroma Technology, Bellows Falls, Vermont, United States | 227155 | |
| Headstage | AxonInstruments, Union City, CA, United States | CV203BU | |
| Interface | Scientifica, Uckfield, UK | 1U Rack, 352036 | |
| LED 525 nm | Luminus Devices, Sunnyvale, CA, United States | PT-120-G | |
| LED control software | Essel Research and Development, Toronto, Canada | ||
| LED control system | custom-made | ||
| Micropipette Puller | Narishige Co., Tokyo, Japan | PP-830 | |
| Microscope inverted | Leica Microsystems, Wetzlar, Germany | DMI4000B | |
| Motorised Micromanipulator | Scientifica, Uckfield, UK | PatchStar | |
| Optical power meter | Thorlabs, Newton, NJ, United States | PM100D | |
| Silicone Grease | RS Components, Corby, UK | 494-124 | |
| Silver wire | A-M Systems, Sequim, WA, United States | 787500 | Silver, Bare 0.015'', Coated 0.0190'', Length 25 Feet |
| Soda lime glass capillaries | Vitrex Medical A/S, Vasekaer, Denmark | 160213 BRIS, ISO12772 | 1.55 OD x 1.15 ID x 75 L mm |
| Software Axon pClamp | Molecular Devices, San José, CA, United States | Version 10.5 | |
| Software MatLab2017 | The MathWorks, Inc. | ||
| Stage micrometer | Graticules Optics LTD, Tonbridge, UK | 1 mm | |
| Equipment - Carbon fiber | |||
| Carbon fibers | provided from Prof. Jean-Yves Le Guennec | BZ:00 | |
| Digitizer Axon Digidata | Molecular Devices, Sunnyvale, CA, United States | 1550B | |
| Filter (530/20) | Leica Microsystems, Wetzlar, Germany | 11513878 | |
| Filter (630/20) | Chroma Technology, Bellows Falls, Vermont, United States | 227155 | |
| Fluorescence System Interface | IonOptix, Milton, MA United States | FSI-800 | 2.0 OD x 1.16 ID x 100 L mm |
| Force Transducer System | Aurora Scientific Inc., Ontario, Canada | 406A | |
| Glass capillaries for force measurements | Harvard Apparatus, Holliston, Massachusetts, United States | GC200F-10 | |
| Interface National Instruments | National Instruments, Budapest, Hungary | BNC-2110 | |
| LED 525 nm | Luminus Devices, Sunnyvale, CA, United States | PT-120-G | |
| LED control box | Essel Research and Development, Toronto, Canada | ||
| LED control system | custom-made | ||
| Microcontroller | Parallax Inc., Rocklin, California, United States | Propeller | |
| Micropipette Puller | Narishige Co., Tokyo, Japan | PC-10 | |
| Microscope inverted | Leica Microsystems, Wetzlar, Germany | DMI4000B | |
| MyoCam-S camera | IonOptix, Dublin, Ireland | ||
| MyoCam-S camera Power | IonOptix, Milton, MA, United States | MCS-100 | |
| MyoPacer Field Stimulator | IonOptix Cooperation, Milton, MA, United States | MYP100 | |
| Piezo Motor | Physik Instrumente (PI) GmbH & Co. KG, Karlsruhe, Germany | E-501.00 | |
| Silicone Grease | RS Components, Corby, UK | 494-124 | |
| Software Axon pClamp | Molecular Devices, San José, CA, United States | Version 10.5 | |
| Software IonWizard | IonOptix, Dublin, Ireland | Version 6.6.10.125 | |
| Software MatLab2017 | The MathWorks, Inc. | ||
| Stage micrometer | Graticules Optics LTD, Tonbridge, UK | 1 mm | |
| Chemicals | |||
| Adenosine | Sigma-Aldrich, St. Louis, Missouri, United States | A9251-100G | |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, Missouri, United States | A7030-50G | |
| CaCl2 | Honeywell Fluka, Muskegon, MI, USA | 21114-1L | |
| L-Carnitine hydrochloride | Sigma-Aldrich, St. Louis, Missouri, United States | C9500-25G | |
| Collagenase type 2, 315 U/mg | Worthington, Lakewood, NJ, USA | LS004177 | |
| Creatine | Sigma-Aldrich, St. Louis, Missouri, United States | C0780-50G | |
| Cytosine-β-D-arabinofuranoside | Sigma-Aldrich, St. Louis, Missouri, United States | C1768-100MG | |
| EGTA | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 3054.3 | |
| Esketamine hydrochloride, Ketanest S 25 mg/mL | Pfizer Pharma PFE GmbH, Berlin, Germany | PZN-07829486 | |
| Fetal Bovine Serum | Sigma-Aldrich, St. Louis, Missouri, United States | F9665 | |
| Gentamycin 50 mg/mL | Gibco, Life Technologies, Waltham, MA, USA | 15750-037 | |
| Glucose | Sigma-Aldrich, St. Louis, Missouri, United States | G7021-1KG | |
| Heparin-Sodium, 5,000 IU/mL | Braun Melsungen AG, Melsungen, Germany | PZN-03029843 | |
| HEPES | Sigma-Aldrich, St. Louis, Missouri, United States | H3375-1KG | |
| Insulin (bovine pancreas) | Sigma-Aldrich, St. Louis, Missouri, United States | I6634-50MG | |
| K-aspartate | Sigma-Aldrich, St. Louis, Missouri, United States | A6558-25G | |
| KCl | VWR International GmbH, Leuven, Belgium | 26764.260 | 1 mg/mL |
| KOH | Honeywell Fluka, Muskegon, MI, USA | 35113-1L | |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma-Aldrich, St. Louis, Missouri, United States | L2020-1MG | |
| M199-Medium | Sigma-Aldirch, St. Louis, Missouri, United States | M4530 | |
| Mg-ATP | Sigma-Aldrich, St. Louis, Missouri, United States | A9187-1G | |
| MgCl2 | Sigma-Aldrich, St. Louis, Missouri, United States | 63069-500ML | |
| NaCl | Fisher Scientific, Loughborough, Leics., UK | 10428420 | |
| NaCl-Solution 0.9%, Isotone Kochsalz-Lösung 0.9% | Braun Melsungen AG, Melsungen, Germany | 3200950 | |
| NaOH | AppliChem GmbH, Darmstadt, Germany | A6579 | without Ca2+/Mg2+ |
| Na-pyruvat | Sigma-Aldrich, St. Louis, Missouri, United States | P2256-100MG | |
| Phosphate Buffered Saline | Sigma-Aldrich, St. Louis, Missouri, United States | D1408-500ML | |
| Poly(2-hydroxyethyl methacrylate) | Sigma, Poole, UK | 192066 | |
| Protease XIV from Streptomyces griseus | Sigma-Aldrich, St. Louis, Missouri, United States | P5147-1G | |
| Taurine | Sigma-Aldrich, St. Louis, Missouri, United States | T0625-500G | |
| Thiopental Inresa 0.5 g | Inresa Arzneimittel GmbH, Freiburg, Germany | PZN-11852249 | |
| Xylazine hydrochloride, Rompun 2% | Bayer Vital GmbH, Leverkusen, Germany | PZN-01320422 |
Referências
- Harz, H., Hegemann, P. Rhodopsin-regulated calcium currents in Chlamydomonas. Nature. 351, 489-491 (1991).
- Litvin, F. F., Sineshchekov, O. A., Sineshchekov, V. A. Photoreceptor electric potential in the phototaxis of the alga Haematococcus pluvialis. Nature. 271, 476-478 (1978).
- Nagel, G., et al. Channelrhodopsin-1: A Light-Gated Proton Channel in Green Algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
- Lozier, R. H., Bogomolni, R. A., Stoeckenius, W. Bacteriorhodopsin: a light-driven proton pump in Halobacterium Halobium. Biophysical journal. 15 (9), 955-962 (1975).
- Schobert, B., Lanyi, J. K. Halorhodopsin is a light-driven chloride pump. Journal of Biological Chemistry. 257 (17), 10306-10313 (1982).
- Inoue, K., et al. A light-driven sodium ion pump in marine bacteria. Nature Communications. 4, 1678 (2013).
- Han, X., et al. A High-Light Sensitivity Optical Neural Silencer: Development and Application to Optogenetic Control of Non-Human Primate Cortex. Frontiers in Systems Neuroscience. 5, 18 (2011).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Grimm, C., Silapetere, A., Vogt, A., Bernal Sierra, Y. A., Hegemann, P. Electrical properties, substrate specificity and optogenetic potential of the engineered light-driven sodium pump eKR2. Scientific Reports. 8, 9316 (2018).
- Wietek, J., et al. Conversion of channelrhodopsin into a light-gated chloride channel. Science. 344 (6182), 409-412 (2014).
- Berndt, A. Structure-Guided Transformation. Science. 344 (6182), 420-424 (2014).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Mohamed, G. A., et al. Optical inhibition of larval zebrafish behaviour with anion channelrhodopsins. BMC Biology. 15 (1), 103 (2017).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic Neuronal Silencing in Drosophila during Visual Processing. Scientific Reports. 7, 13823 (2017).
- Govorunova, E. G., Cunha, S. R., Sineshchekov, O. A., Spudich, J. L. Anion channelrhodopsins for inhibitory cardiac optogenetics. Scientific Reports. 6, 33530 (2016).
- Kopton, R. A., et al. Cardiac Electrophysiological Effects of Light-Activated Chloride Channels. Frontiers in Physiology. 9, 1806 (2018).
- Peyronnet, R., et al. Load-dependent effects of apelin on murine cardiomyocytes. Progress in Biophysics and Molecular Biology. 130, 333-343 (2017).
- Wang, K., et al. Cardiac tissue slices: preparation, handling, and successful optical mapping. American Journal of Physiology-Heart and Circulatory Physiology. 308 (9), 1112-1125 (2015).
- Nishimura, S., et al. Single cell mechanics of rat cardiomyocytes under isometric, unloaded, and physiologically loaded conditions. American Journal of Physiology-Heart and Circulatory Physiology. 287 (1), 196-202 (2004).
- Mitcheson, J. S., Hancox, J. C., Levi, A. J. Action potentials, ion channel currents and transverse tubule density in adult rabbit ventricular myocytes maintained for 6 days in cell culture. Pflugers Archiv European Journal of Physiology. 43 (6), 814-827 (1996).
- Burton, R. A. B., et al. Caveolae in Rabbit Ventricular Myocytes: Distribution and Dynamic Diminution after Cell Isolation. Biophysical Journal. 113 (5), 1047-1059 (2017).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in cardiomyocyte isolation, culture, and gene transfer. Journal of Molecular and Cellular Cardiology. 51 (3), 288-298 (2011).
- Janssen, P. M., Hunter, W. C. Force, not sarcomere length, correlates with prolongation of isosarcometric contraction. The American Journal of Physiology. 269 (2), 676-685 (1995).
- Monasky, M. M., Varian, K. D., Davis, J. P., Janssen, P. M. L. Dissociation of force decline from calcium decline by preload in isolated rabbit myocardium. Pflugers Archiv European Journal of Physiology. 456 (2), 267-276 (2008).
- Kleinlogel, S., et al. Ultra light-sensitive and fast neuronal activation with the Ca 2+-permeable channelrhodopsin CatCh. Nature Neuroscience. 14 (4), 513-518 (2011).
- Schneider-Warme, F., Ravens, U. Using light to fight atrial fibrillation. Cardiovascular Research. 114 (5), 635-637 (2018).
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature. 463 (7277), 98-102 (2010).
- Bernal Sierra, Y. A., et al. Potassium channel-based optogenetic silencing. Nature Communications. 9 (1), 4611 (2018).
- Oda, K., et al. Crystal structure of the red light-activated channelrhodopsin Chrimson. Nature Communications. 9 (1), 3949 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados