Method Article
הערכה אלקטרו-מגנטית של אלקטרואופטיקה פעילות מודולציט
In This Article
Summary
אנו מציגים פרוטוקול להערכת ההשפעות האלקטרו-מאלקטרומכניים של הפעלת GtACR1 בקרדיוציטים בארנבים. אנו מספקים מידע מפורט על בידוד התא, culturing ו אדנונגיפי התמרה, ועל ניסויים פונקציונליים עם מלחציים טלאי וסיבי פחמן.
Abstract
במהלך שני העשורים האחרונים, כלים אלקטרואופטיקה הוקמו כאמצעי חזק כדי לווסת את סוג התא פעילות ספציפית ברקמות להתרגש, כולל הלב. בעוד המתקשר-2 (ChR2) הוא כלי נפוץ כדי לבצע הקטפולאת הפוטנציאל הממברנה בקרדיומיקוציטים (CM), פוטנציאל לעורר פוטנציאל פעולה (AP), כלי יעיל עבור השתקה אמין של פעילות CM חסר. זה כבר הציע להשתמש אניון מתקשרים (acr) עבור מעכבות אלקטרואופטיקה. כאן, אנו מתארים פרוטוקול כדי להעריך את ההשפעות של הפעלת ACR GtACR1 טבעי מ גילארדיה תטא ב הארנב התרבותי ס מ. הקריאות הראשיות הן אלקטרופיסיולוגית תיקון הקלטות ומעקב אופטי של התכווצויות ס"מ, שניהם ביצעו תוך החלת דפוסים שונים של גירוי באור. הפרוטוקול כולל בידוד ס מ לב ארנב, זריעה ו culturing של התאים עד 4 ימים, התמרה באמצעות קידוד אדנווירוס עבור ערוץ כלוריד אור מגודרת, הכנת מלחציים טלאי הגדרות סיבי פחמן, איסוף נתונים וניתוח. שימוש בטכניקת טלאי-מהדק בתצורת תא שלם מאפשר אחד להקליט זרמים המופעל באור (במצב מהדק מתח, V-קלאמפ) ו-AP (הנוכחי מלחציים מצב, אני-קלאמפ) בזמן אמת. בנוסף לניסויי תיקון-מלחציים, אנו מבצעים מדידות והערכה פונקציונלית להערכת פעילות של CM מבלי להפריע לסביבה התאיים. כדי לעשות זאת, תאים מכנית טעון מרחוק באמצעות סיבי פחמן הצירים נרשמים על ידי מעקב אחר שינויים באורך סרקומר ומרחק סיבי פחמן. ניתוח נתונים כולל הערכה של משך AP מ-I-קלאמפ הקלטות, זרמי השיא מ-V-קלאמפ הקלטות וחישוב כוח מדידות סיבי פחמן. הפרוטוקול המתואר ניתן להחיל על בדיקות של השפעות ביופיזיקלי של מפעילים אלקטרואופטיקה שונים על פעילות CM, תנאי מוקדם לפיתוח הבנה מכניסטית של ניסויים אלקטרואופטיקה ברקמת הלב ולבבות שלמים.
Introduction
ChR-תיווך פוטוזרמים הוקלטו לראשונה בעין אצות ירוקות חד-תאיים1,2. זמן קצר לאחר שיבוט גנטי וביטוי הטרוולוגי של Chlamydomonas ריינהרט ChR1 ו ChR2, ChR שימשו ככלים לשנות את פוטנציאל הממברנה ב-xenopus oocytes ו התאים המיונקים על ידי אור3,4. קטיון לא סלקטיבי ChR מקרטת את קרום התאים עם פוטנציאל ממברנה מנוחה שלילי לפוטנציאל ההיפוך של ChR. הם יכולים ובכך לשמש כדי לעורר AP בתאים להתרגש, כולל נוירונים ו-CM, המאפשר התנועה האופטית5,6.
המשלים לקטיון, פרוטון מונחה אור, כלוריד ונתרן7,8,9 שימשו כדי לעכב פעילות עצבית10,11,12. עם זאת, לאלה יש מגבלות, הדורשות עוצמות אור גבוהות ותאורה מתמשכת, כיון אחד מועבר לכל פוטון נספג. ב-2014, שני מחקרים עצמאיים על ידי "וויטק ואח '" ו-berndt et al. תיאר את ההמרה של ביצוע הקטיון באמצעות מוטציות בנקבובית ערוץ13,14. שנה מאוחר יותר, התגלו ACR טבעי בקריפטהיטה גילארדיה תטה (gtacr)15. כפי מהונדסים ACR הראה היקף מוליכות שיורית, הם הוחלפו על ידי ACR טבעי, המאופיין על ידי מוליכות גדולה של ערוץ יחיד ורגישות גבוהה באור15. Gtacr נהגו להשתיק את הפעילות העצבית על ידי הקטפה את פוטנציאל הממברנה כלפי פוטנציאל היפוך של16,17. Govorunova ואח ' להחיל GtACR1 על מתורבת המוח העצמי עכברוש והראה פוטועכבות יעיל ברמות נמוכות של עוצמת אור כי לא היו מספיקים כדי להפעיל כלים מעכבות זמין בעבר, כגון משאבת פרוטון Arch18. הקבוצה שלנו דיווחה לאחרונה כי פוטואינהיביציה בתיווך של ס מ מבוסס על depolarization וכי GtACR1 יכול לשמש גם, לכן, עבור צעדים אופטיים של CM19.
כאן, אנו מציגים פרוטוקול ללמוד אלקטרופיזיולוגיה ואפקטים מכניים של GtACR1 photoactivation פעלה על הארנב מתורבת CM. אנו מתארים תחילה בידוד תאים, מקולף והתמרה. ההשפעות האלקטפיזיולוגיות נמדדות באמצעות הקלטות שלמות של תאים מהדק. זרמים בתיווך אור במתח ממברנה נתון מוערך במצב V-קלאמפ. הדינמיקה הפוטנציאלית של הממברנה נמדדת בעוד התנועה החשמלית או התנועה האופטית (I-קלאמפ mode). עיכוב אופטי של AP מופעל חשמלית נבדק באמצעות יישום אור מתמשך. השפעות מכניות נמדדות באמצעות סיבי פחמן בשילוב עם מעקב מבוסס הדמיה של אורך סרקומר. כדי לעשות זאת, תאים הניתנים לחיבור מכני הם מכנית מתחת למסך על ידי הצמדת שני סיבי פחמן לקרום פלזמה ליד מסתיים התא הנגדי. שינויים באורך sarcomere נרשמים במהלך הצעדים האופטיים או החשמליים. לבסוף, הפוטועכבות נמדד במהלך גירוי שדה חשמלי של התאים, וכוחות שנוצרו מנותח.
הפרוטוקול כולל את השלבים הבאים המוצגים בתרשים הזרימה באיור 1: הרדמה עמוקה הארנב, הזרקת מנת יתר של הראש, כריתה של הלב, לאנגדורף-פרזיה ועיכול רקמות, דיסוציאציה מכנית של הרקמה לשחרר תאים, ניתוח מיקרוסקופי של תשואה cm, culturing של ס מ, התמרה עם סוג אדנווירוס 5, ו

איור 1: תרשים זרימה של הפרוטוקול המשמש להשגת ס מ מבחינה חשמלית ואופטית. הלבבות מועכלים מארנבים 9-10 שבועות, ורקמות לב מתעכלים בזמן השימוש בכיוונון לאנגדורף. התאים משתחררים מעצבנות מכנית. התשואה CM נחשבת תחת מיקרוסקופ. ס מ הם מתורבתים, התמרה עם סוג אדנווירוס 5 וניסויים פונקציונליים מתבצעים 48-72 שעות לאחר התמרה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
כל ניסויי הארנבים בוצעו על פי ההנחיות שצוינו בהנחיה 2010/63/האיחוד האירופי של הפרלמנט האירופי על הגנה על בעלי חיים המשמשים למטרות מדעיות ואושרו על-ידי הרשויות המקומיות בבאדן-וירטמברג (רגראמונגטרהסיטסידיה פרייבורג, X-16/10R, גרמניה).
1. פתרונות לבידוד תאים
- הכינו את הפתרונות לבידוד התא עם מים מהדרישות הבאות (שולחן 1) ובהתאם לקומפוזיציות יונית המפורטות בטבלה 2.
הערה: CaCl2 ו-MgCl2 נוספים מפתרונות מניות של 1 M.
| דרישות מים | |
| מוליכות [μS/cm] ב -25 ° c | 0.055 |
| הפרעה (האיחוד האירופי/mL) | < 0.001 |
| חלקיק (גודל > 0.22 μm) [1/mL] | ≤ 1 |
| סה כ פחמן אורגני [ppb] | < 5 |
| מיקרואורגניזמים [CFU/mL] | ≤ 1 |
| בסדר. | < 0.01 |
| בסדר. | < 4 |
טבלה 1: דרישות מים.
| תמיסת מלח פיסיולוגית (1) | סידן נמוך, תמיסת אשלגן גבוהה (2) | תמיסת אנזים (3) | חסימת פתרון | |
| ! אני לא מבין | 137 | 137 | 137 | 137 |
| כיצד לעשות זאת? | 4 | 14 | 14 | 14 |
| הכלב הגרמני | 10 | 10 | 10 | 10 |
| קראטין [mM] | 10 | 10 | 10 | 10 |
| טאורין (מילימטר) | 20 | 20 | 20 | 20 |
| גלוקוז [mM] | 10 | 10 | 10 | 10 |
| הוראות מסוימות של MgCl2 | 1 | 1 | 1 | 1 |
| אדנוזין [mM] | מיכל 5 | מיכל 5 | מיכל 5 | מיכל 5 |
| אל-קריטין [ממ '] | 2 | 2 | 2 | 2 |
| CaCl2 [mM] | 1 | - | 0.1 | 0.1 |
| Na-הפארין [IU/L] | 5000 | - | - | - |
| EGTA [mM] | - | 0.096 | ||
| קולגן סוג 2, 315 U/mg [g/L] | - | - | 0.6 | - |
| פרוטאז הארבעה עשר [g/L] | - | - | 0.03 | - |
| נסיוב של שור | - | - | - | 0.5 |
| [מוסמוק/ל'] | 325 ± 5 | 345 ± 5 | 345 ± 5 | 345 ± 5 |
שולחן 2: פתרונות לבידוד בCM.
- כוונן את כל הפתרונות ל-pH 7.4 ב-37 ° צ' ובדוק האוסמלכי.
הערה: מפזר את האנזימים (הקולגן מסוג 2 ו פרוטאז הארבעה עשר) ישירות לפני כריתה של הלב. . חמצן לכל הפתרונות לפני השימוש
2. הכנת התוכנית לנגדורף-פרזיה
הערה: ההתקנה הנמצאת בשימוש מותאמת אישית. כפי שמתואר באיור 2, ההתקנה כוללת שלושה מאגרי מים מורכבים (1-3), אחד ספירלה מונה זרימה מחליף חום (4) ו המים כיסה כלי קיבול (5).

איור 2: לנגדורף-התקנה פרפיוז אופטימיזציה לבידוד תאי ארנב. (1-3) מאגרי מים עם מאגרים (1) מלוחים לתמיסת מלח, (2) סידן נמוך, תמיסת אשלגן גבוהה ו-(3) אנזימים המכילים פתרון קרדיולוגי. (4) ספירלה מחליף מחליפי חום ו (5) מים כיסה מיכל איסוף. הזרימה הרציפה של מערכת המים היא מחליף חום ספירלי (טמפרטורת הפתרונות העוזבת את צינורית הפרפיוז בסוף מחליף החום צריכה להיות קבועה ב-37 ° c), ולאחריה כלי הפרפיוז ושלושת המאגרים. כל הפתרונות מחמצן (קו מקווקו). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- הפעל את המשאבה של אמבטיית המים כדי להזרים מים ב-38 ° c במערכת החלפת החום ומחממים את כל הפתרונות ל-37 ° c.
הערה: הטמפרטורה ביצוא (4) חייבת להיות מבוקרת וקבועה ב 37 ° c. - למלא את שלושת המאגרים עם הפתרון המתאים ולשטוף כל שורה (שחור) עם הפתרון המתאים. ממלאים את הקו הראשי (כחול) בסוף ללא בועות אוויר באמצעות פתרון (1).
הערה: חמצן הפתרונות לפני (10 דקות) ובמהלך השימוש. מלאו את הקו ממאגר (3) לברז עם סידן נמוך, הפתרון אשלגן גבוה. - הכינו תפר כדי לקשור את הלב. סביב העורקים בצינורית
3. בידוד תאים
- הכן את הזרקים הבאים.
- להרדמה/הרדמה: Mix 0.5 mL/ק"ג משקל גוף esketamine הידרוכלוריד (25 מ"ג/mL) ו 0.2 mL/ק"ג משקל הגוף xylazine הידרוכללוריד (2%).
- ממלאים שני מזרקים עם 12 מ ל של פתרון הנאל (0.9%).
- הכינו 6 מ ל של 12.5 mg/mL Na-תיאופלנטל, מומס 0.9% הפתרון.
- מילוי 0.2 mL של esketamine הידרוכלוריד (25 מ"ג/mL) במזרק.
- לדלל 0.2 mL של Na-הפארין (5,000 IU/mL) ב 1 מ ל של 0.9% הפתרון (הריכוז הסופי 1,000 IU/mL).
- הרדים הרגעה/ארנבים (9-10 שבועות, ארנב לבן ניו-זילנד, נקבה או זכר, ~ 2 ק"ג) באמצעות הזרקה תוך שרירית של אסקטמין הידרוכלוריד ו קסילטין הידרוכללוריד (שלב 3.1.1).
הערה: ארנבים צריכים לפחות 10 דקות כדי לרדימים במלואה; משך מדויק תלוי במשקל גופם. תאשר את ההרדמה. עם אובדן רפלקס הצתה - לגלח את החזה ואת האוזניים שבו ממוקמים הורידים.
- הכנס צינורית גמישה לווריד האוזן, תקן אותה בקלטת ורוקן אותו עם הפתרון 0.9%.
- הכנס 1 מ ל של נה-הפארין פתרון באופן פנימי ושולי עם 0.9% פתרון.
- הכנס 0.2 mL של esketamine הידרוכלוריד, הריקון שוב עם 0.9% הפתרון הנאקל והכנס Na-thiopental עד דום נשימה.
הערה: ארנב לא צריך להגיב לרפלקס נסיגה הדוושה. - פתח את החזה בצד שמאל והסר את קרום הלב.
- הפעל את טיימר כאשר הלב הוא מגורש ולשטוף את הלב פעמיים בתמיסה מלוחים פיסיולוגיים.
הערה: השתמש במספריים עם עצות עגולות כדי למנוע נזק מקרי לרקמת לב. - עם תמיסת מלח פיסיולוגית. ושומרת את כל הרקמות בתמיסה הפעל את מערכת הלנגדורף-פרפיוז (תמיסת מלח פיסיולוגית (1), מהירות 24 mL/min).
- העבר את הלב אל הכיוונון של לאנגדורף-פרזיה, חבר את העורקים אל הזרבובית המושבת, וקשור בחוזקה את הלב עם תפר סביב העורקים אל הצינורית (< 1 דקות).
הערה: ממלאים את הצינורית בתמיסה הפיסיולוגית, ודאו שאין בועות אוויר שיכנסו לצינורית במהלך ההובלה מאתר הצינורית לתוכנית לאנגדורף, התחברו ללא בועה. - מבשם הלב עד שכל הדם נשטף (2-3 דקות).
- מעבר לסידן נמוך, תמיסת אשלגן גבוהה (2). מבשם 2 דקות לאחר שהלב הפסיק לפעום ולעבור לפתרון האנזים.
- התחל לדקלם את פתרון האנזים, לאחר 2 דקות מתחילת העיכול, בחזרה למאגר. הקטנת מהירות של 16 מ ל/דקה לאחר 5 דקות של עיכול.
- כאשר הרקמה מופיעה רכה (40-50 דקות של עיכול), חותכים את הלב מהצינורית ומפרידים את החדר השמאלי.
- שחרור תאים על ידי דיסוציאציה מכנית (בעדינות מושך את הרקמה עם פיפטה ומלקחיים קנס להחזיק את הרקמה) בפתרון חסימה.
- לסנן את ההשעיה התא דרך רשת (גודל הנקבוביות של 1 מ"מ2) ו צנטריפוגה עבור 2 דקות ב 22 x g (האצת כבידה).
- הסר את הסופרנטנט המכיל את מניעת הריריות והשהה מחדש את ה-CM בפתרון חסימה.
4. שתיים מתוך ס מ
הערה: בצע את השלבים הבאים תחת תנאים סטריליים.
- לדלל את המילין (מ אנגלברב-הולם-נחיל מרתף סרקומה של מורלין, 1 מ"ג/mL) 1:10 בשנת מלוחים סטרילי באגירה (ללא Ca2 +/mg2 +) לריכוז הסופי של 100 μg/mL.
- הכנת מדיום התרבות ב M199-Medium עם תוספי כמצוין בטבלה 3.
| בינונית תרבותית של תאים בM199-בינונית | |
| קראטין [mM] | מיכל 5 |
| ל-קרניטין הידרוכללוריד [ממ מ] | 2 |
| טאורין (מילימטר) | מיכל 5 |
| נה-פירוע [ממ מ] | 1 |
| אינסולין (לבלב שור) [U/L] | 0.25 |
| ציטוסין-β-D-arabinofuranoside [mM] | 0.01 |
| גנאמיצין [mg/mL] | 0.05 |
שולחן 3: תרבית תאים בינונית.
- מסנן סטרילי פתרון (0.22 μm) ולהוסיף 5% סרום עוברי העובר.
- עבור ניסויים תיקון-קלאמפ שמיכות של מהדק 16 מ"מ, עובי No. 0, מעיל אותם עם 100 μg/mL למינציה ישירות לפני culturing.
- עבור ניסויים סיבי פחמן, מעיל משטח צלחת פטרי עם פולי (2-הידרוקסיל מתיונין) (פולי HEMA, 0.12 g/mL ב 95:5 אטוח: H20) ולתת לו לגבש.
הערה: התאים אינם ' נדבקים ' לפולי-HEMA מצופים מנות פטרי; זה חיוני עבור התכווצות החיכוך שלהם פחות במחקרים מכניקת התא. - לאחר השעיה מחדש CM התיישבו (~ 10-15 דקות), להסיר את הסופרנטאנט, ולאחר מכן להשעות מחדש את CM במדיום התרבות.
- ספירת ס מ עם תא וזרע של נויבאואר בצפיפות היעד של 17,500 תאים/mL על למינציה בכיסויים מצופה או בפולי-HEMA מצופה מנות פטרי.
- התאים הדגירה ב 37 ° צ', 5% CO2 עבור 3-4 שעות. להחליף את המדיום (37 ° צ') של תאים הזרע כיסוי.
- הוסף אדנווירוס (סוג 5) קידוד עבור GtACR1-eGFP בריבוי של זיהום (מוי) של 75 ולהתחיל ניסויים פונקציונליים לאחר 48 שעות.
הערה: לאחר שהתמרה שומרת את התאים בחשכה. השתמשו בתאורה אדומה כשעובדים עם חלבונים בצבע כחול או ירוק. מערכת המסירה מסחרית אדנונגיפית (ראה טבלת חומרים) משמש כדי לשכפל את הגנים קידוד GtACR1-egfp לתוך וקטור אדנונגיפי. הוספת עניין, כאן GtACR1-eGFP, הוא PCR מוגבר ולאחר מכן בשילוב עם וקטור אדנונגיפי כולל מקדם CMV בתגובת שיבוט IN-Fusion. היזם CMV (cytomegalovirus ירוס) האדם משמש בדרך כלל כדי לנהוג ביטוי יתר של טרנסגנים בתאי היונקים. eGFP הוא חלבון פלורסנט ירוק משופר נגזר Aequorea ויקטוריה עם עירור מקסימום של 488 ננומטר ו פליטה מקסימום ב 507 nm. אדנווירוס (סוג 5) הופק באופן חיצוני ב-Charité, אוניברסיטת ברלין, מכון הספורט פארמקולוגיה, ברלין, פרופ ' מיכאל שכטר.
התראה: התמרה ויראלית מסווגת כעבודה ברמת בטיחות של BSL-2, ואמצעי בטיחות מתאימים נדרשים באופן חוקי.
5. ניסויים פונקציונליים
הערה: הקלטות מתבצעות באמצעות מיקרוסקופ פלואורסצנטית הפוך. לסנן את אור השידור על ידי מסנן פס אדום להעביר (630/20 nm) העבה כדי למנוע הפעלה משותפת של GtACR1.
-
התקנת קלאמפ
- השתמש במגבר בשילוב עם ממיר אנלוגי לדיגיטלי. השתמש בתוכנת רכישת נתונים כדי להקליט נתונים נוכחיים וממתח (ראה טבלת חומרים).
הערה: הנתונים המוקלטת מוקלטים ב-10 kHz ומסוננים ב-5 kHz.
- השתמש במגבר בשילוב עם ממיר אנלוגי לדיגיטלי. השתמש בתוכנת רכישת נתונים כדי להקליט נתונים נוכחיים וממתח (ראה טבלת חומרים).
-
התקנת סיבי פחמן
- השתמש במצלמה כדי לזהות את מיקום סיבי פחמן ואורך סרקומר על ידי מעקב אחר שינויים בניגוד אופטי (סיבי פחמן להופיע כמו מבנים כהים, המצופים על דפוס התא תילומי). ייצוג סכמטי של הכיוונון מוצג באיור 3.
הערה: אורך Sarcomere מחושב בזמן אמת באמצעות התמרת פורייה מהירה (FFT) של ספקטרום הכוח של תבנית הסטריציה.
- השתמש במצלמה כדי לזהות את מיקום סיבי פחמן ואורך סרקומר על ידי מעקב אחר שינויים בניגוד אופטי (סיבי פחמן להופיע כמו מבנים כהים, המצופים על דפוס התא תילומי). ייצוג סכמטי של הכיוונון מוצג באיור 3.

איור 3: הערכה המתארת את ההתקנה הניסיונית עבור מדידות סיבי פחמן. (הציור אינו בקנה מידה). שני סיבי פחמן מחוברים בתא ומיקומם נשלט על ידי פוזיצו פיאזו. קוצב משמש גירוי שדה חשמלי. נוריות מרובות צבעים מצמידים לתוך הנמל האפילנטית של המיקרוסקופ הפוך לתאורה של תאים במישור האובייקט. כוח LED נשלט באמצעות תיבת בקרה ייעודי, אשר מקבל פולסים דיגיטליים דרך הפלט הדיגיטלי של דיגיטלי אנלוגי-ממיר (DAC). DAC מתקשר באמצעות פלט אנלוגי עם ממשק מערכת פלואורסצנטית. מצלמה שחור-לבן (774 פיקסלים על-ידי 245 שורות) עבור הדמיה תאית מחובר למחשב לעקוב סרקומר אורך וכיפוף סיבי פחמן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- תאורה מתוזמנת
- לספק אור למיקרוסקופיה פלואורסצנטית והפעלה של ערוצי יונים מגודרת באור באמצעות מותאם אישית בנוי בתיבת הבקרה LED, המורכב שלושה נוריות בצבע שונה (460 nm, 525 nm, 640 nm, ראה לוח חומרים).
- שנה את קוד המיקרו-בקר וממשק המשתמש הגרפי (GUI) עבור תיבת הבקרה כדי לאפשר שליטה ב-LED באמצעות הפולסים בזמן החיצוני לשידור חי (TTL), שנוצרו בפרוטוקולי תוכנה לרכישת נתונים (ראה טבלת חומרים). שידור פעימות TTL לתיבת בקרת LED באמצעות דיגיטלי אנלוגי-ממיר.
- כונן LED ולבחור את מספר פולסים באמצעות GUI. עם קבלת הפקודה מתוך GUI המיקרו בקר מתחיל תהליך על ליבה חדשה. בתהליך זה, קלט TTL, כמו גם מתג הבקרה שהוגדר מ-GUI ייבדק ברציפות.
- כאשר הקלט TTL חיובי, המיקרו-בקר מפעיל את ה-LED ולאחר מכן מתחדש בדיקת קלט TTL. לאחר שאות TTL חוזר לאפס, המיקרו-בקר מכבה את ה-LED ומפחית את מספר הפולסים שנותרו באחד. אם בשלב כלשהו בורר הבקרה שקרי או שמספר הפולסים הוא אפס, המיקרו-בקר יעצור תהליך זה עד שתקבל פקודה חדשה מ-GUI.
- ישר כמה נוריות לתוך היציאה האחורית של המיקרוסקופ.
- קביעת עוצמת האור במישור האובייקטים
- למדוד את האזור מואר עם מיקרומטר שלב (הגדלה אובייקטיבית 40x, A = 0.8 mm2).
- השתמש במד כוח אופטי (ראה טבלת חומרים).
- הגדר את ההגדרות עבור הניסויים: העירור אורך הגל (525 nm), הגדלה אובייקטיבית (40x), מסנן עירור (530/20 nm) או שיקוף, ולקרוא את כוח האור [W] בתוך מתח שונים LED-קלט.
- חישוב עוצמת האור [W/mm2] על ידי חלוקת כוח האור [w] על ידי שטח מואר [mm2] (כאן: 0.8 mm2).
הערה: למדוד את כוח האור בפועל עם הפרוטוקולים המתאימים בשלב 5.6 כדי לבדוק אם הדופק קצר משכים של 10 ms להגיע ומשכים ארוכים להחזיק את ערך set (משלים איור 1).
- הכנה לניסויים במדבקות מלחציים
- הכן את הפתרונות החיצוניים והפנימיים הבאים (טבלה 4; לקבלת דרישות מים, ראה טבלה 1).
- כוונן את האוסמלעם גלוקוז ל 300 ± 5 mOsmol/L. Aliquot הפתרון הפנימי וחנות ב-20 ° c.
הערה: שמור את הפתרון הפנימי על הקרח ליום ההקלטה. השאר את הפתרון החיצוני בטמפרטורת החדר. להלן תיאר פתרונות מלחציים התיקון היו מבוססים על פתרונות ששימשו קודם לכןהריכוז Cl השתנה לנמוך יותר, רמות פיזיולוגיות יותר7. לאפיון יון סלקטיביות של מפעיל אלקטרואופטיקה בהתאמה, אנו ממליצים לשנות את ריכוזי היונים הגדולים (למשל, קלרנית-, Na+, K+, H+) בפתרונות הנוספים-ו תאיים19. - הסר את אלקטרודה ההקלטה ממחזיק הצינורות ולהסיר את שכבת כלוריד כסף מחוט הכסף עם נייר זכוכית יפה מאוד.
הערה: בצע שלב זה בתחילת כל יום מדידה. - לחבר את החוט אל הקוטב החיובי של סוללת 1.5 V ולטבול 3 M KCl הפתרון עבור ציפוי כסף כלוריד עבור 10 דקות.
הערה: הקוטב השלילי מקושר לחוט כסף התייחסות שקוע בתמיסה 3 M KCl. - הכן את תא המדידה: שים משחה סיליקון על המסגרת של תא מדידה והמקום coverslip (קוטר: 50 מ"מ, עובי מס ' 0) על החלק העליון של המסגרת שהתא אטום.
- שים התייחסות כסופה/כסף כלוריד האלקטרודה באמבטיה ולחבר אותו עם הבמה הראש.
- משוך 1.7-2.5 MΩ לתיקון בקבוקים מתוך סודה ליים נימים זכוכית (בקוטר החיצוני: 1.55 מ"מ, קוטר פנימי: 1.15 מ"מ) עם פולר מיקרופיפטה (ראה טבלת חומרים).
- הפעל תוכנה לרכישת נתונים וכוונן את מבחן הממברנה (הדופק 10 mV עבור 15 אלפיות הבסיסית 0 mV).
| פתרון אמבטיה חיצוני | תמיסת פיפטה פנימית | |
| ! אני לא מבין | 140 | - |
| כיצד לעשות זאת? | 5.4 | 11 |
| CaCl2 [mM] | 1 | - |
| הוראות מסוימות של MgCl2 | 2 | 2 |
| גלוקוז [mM] | 10 | - |
| הכלב הגרמני | 10 | 10 |
| קיי-אספרטט (ממ י) | - | 119 |
| Mg-ATP [mM] | - | 3 |
| EGTA [mM] | - | 10 |
| pH | 7.4 הכול | 7.2 (קו) |
| מאשר (להתאים עם גלוקוז) [mOsmol/L] | 300 ± 5 | 300 ± 5 |
שולחן 4: תיקון-מהדק פתרונות.
- פרוטוקולים עבור מדידות של מהדק תיקון
- הקלטת פרוטוקול photoactivation פעלת במצב V-קלאמפ בפוטנציאל מחזיק-74 mV. השתמש פולסים באור של 300 ms.
הערה: אנו מציעים ביצוע הקלטות V-קלאמפ קרוב לפוטנציאל הממברנה מנוחה של ס מ תרבותי (הוקמה בתוך I-קלאמפ; בידינו בין-79 mV ו-77 mV הן עבור התמרה ומלא התמרה CM19). תאים טריים מבודדים להראות ממוצע פוטנציאל ממברנה מנוחה של-79 mV (איור משלים 2, כל הערכים לאחר תיקון של פוטנציאל הצומת נוזל). - הקלט את נקודת הגישה במצב I-קלאמפ ב-0 pA.
- עבור התנועה החשמלית, הכנס את הפולסים הנוכחיים של 10 אלפיות הזאת (השיפוע מ -0 לערך הקבוע בתוך 10 אלפיות השלמה), 0.25 הרץ ולמצוא את הסף כדי לעורר AP. Record AP על-ידי זריקות נוכחיות של 50% יותר מהסף.
- עבור הצעדים האופטיים להשתמש פולסים אור של 10 ms, 0.25 Hz בעוצמת אור מינימלית כדי לעורר האמין AP.
- הקלטת מעבר תמונה ב-I-מצב קלאמפ ב-0 pA. לעורר AP כפי שמתואר בשלב 5.6.2.1 ולהחיל אור מתמשך עבור 64 s ב 4 mW/mm2 אחרי 15 מופעל החשמל AP.
הערה: איור 6F מציג פרוטוקול פוטועיכוב שבו מוחלים באור מתמשך הזריקות הנוכחיות גבוהות יותר. החל מ 1.5 פעמים את הסף (כאן: 0.7 nA) הזרם הוזרק הוגדלה בשלבים של 0.1 nA (הרמה הסופית: 2.2 nA). בכלל ההגברה הנוכחית, יישום אור מתמשך מעכבות הדור AP.- כניסוי בקרה, השהה גירוי חשמלי עבור 64 s ללא יישום אור.
- הקלטת פרוטוקול photoactivation פעלת במצב V-קלאמפ בפוטנציאל מחזיק-74 mV. השתמש פולסים באור של 300 ms.
- ניסויים מלחציים
הערה: בצע את הניסויים הבאים בחושך (ניתן להשתמש באור אדום לכלים כחול/ירוק המופעל באור).- מניחים שמיכות עם תאים בתוך חדר מדידה עם פתרון חיצוני ולבחור ס"מ פלורסנט.
הערה: התאים eGFP-חיוביים ניתן לזהות באמצעות LED כחול (460 nm) בשילוב עם מסנן עירור הלהקה (450 nm-490 nm), 510 מראה דיקרואיק ננומטר לעבור ו-a 515 מעבר ארוך לעבור מסנן פליטת. אם נעשה שימוש בתגי פלורסנט אחרים, השתמש בערכות מסנני LED וזריחה מתאימות. אם יעילות התמרה גבוהה מושגת (בידינו > 99% עם GtACR1 אדנווירוס), אין צורך לבדוק את הזריחה eGFP לפני ניסויים פונקציונליים; פעולה זו מונעת הפעלה מראש פוטנציאלית GtACR1. - למלא את הצנרת טלאי עם פתרון פנימי. ודא שאין בועות אוויר בקצה.
- חברו את הפיפטה למחזיק הפיפטה, החדרת חוט כסף מצופה כסף-כלוריד בתמיסה הפנימית.
- לאחר שהגיע לתצורה המצורפת לתא, עבור למצב תא שלם בתוכנת רכישת הנתונים עם פוטנציאל מחזיק-74 mV. מריחת בעדינות לחץ שלילי כדי. לגשת לתצורת תא כולו זה מצוין על ידי עלייה מיידית של הקיבוליות נמדד.
- הפעל את הפרוטוקולים המתוארים בסעיף 5.6.
- מניחים שמיכות עם תאים בתוך חדר מדידה עם פתרון חיצוני ולבחור ס"מ פלורסנט.
- סיבי פחמן
- לייצר סיבי פחמן.
- השתמש נימים זכוכית עם הפרמטרים הבאים: קוטר חיצוני: 2.0 מ"מ, קוטר פנימי: 1.16 מ"מ, אורך: 100 מ"מ (ראה טבלת חומרים). באמצעות פולר מיקרופיפטה, משוך את נימי הזכוכית לשני פיפטות באורך זהה (אורך להתחדד כולל ~ 11 מ"מ, איור 5) לקוטר הפנימי הסופי של ~ 30 μm.
הערה: הגדרות המשמשות את המשיכה הראשונה והשניה הן 85.2% (פרופורציה לפלט המקסימלי של הפולר) ו-49.0%, בהתאמה (יהיה תלוי הפולר, הסוג והגיל של החוט). - לכופף את הפיפטות עד 45 ° עם מיקרו מתוצרת עצמית באמצעות הגדרות של 12 V, 24 A (ראה איור 4 לפרטים של הכיוונון הכיפוף של הצנרת).
- ליישר את נימי (2) על הקו האדום במעגל כיוון (5), לשמור על מיקום קבוע נימי כך אורך החלק העיקול הוא תמיד זהה לאחר מרכז מעגל כיוון (רדיוס של 4.5 מ"מ).
- לכופף את הנימים עד 45 ° (הקו הירוק) על ידי דוחף את קצה הקפילר עם בנדר (3) ו לזייף על ידי חימום-up את החוט (4) עד נימי לוכדת את זווית 45 מעלות גם לאחר בנדר מוסר.
- התאימו את סיבי הפחמן (המסופקים מפרופסור ז'אן-איב לה גואנnec) לקצה היפה של נימי הזכוכית שמתחת למיקרוסקופ סטריאו. השתמש מלקחיים עדינים עם אבובים רכים בסוף להגדיל את האחיזה ולהקטין את הסיכון של פגיעה בסיבים.
הערה: סיבים אלה מאופיינים על ידי מבני מיקרו, המגבירים את משטח המגע בין סיבים ותאים, ובכך לשפר את הדבקה20. - חותכים את סיבי הפחמן באורך של 2 מ"מ ולהשתמש סופר דבק (ציאנואקריל) כדי לתקן את הסיבים לחלק הקדמי של נימי.
הערה: ככל שהסיבים ארוכים יותר, כך הם מכופפים יותר את היישום של אותו כוח.
- השתמש נימים זכוכית עם הפרמטרים הבאים: קוטר חיצוני: 2.0 מ"מ, קוטר פנימי: 1.16 מ"מ, אורך: 100 מ"מ (ראה טבלת חומרים). באמצעות פולר מיקרופיפטה, משוך את נימי הזכוכית לשני פיפטות באורך זהה (אורך להתחדד כולל ~ 11 מ"מ, איור 5) לקוטר הפנימי הסופי של ~ 30 μm.
- כיול סיבי פחמן.
- כיול את סיבי הפחמן בעזרת מתמר כוח עם רגישות של 0.05 mN/V וטווח כוח של 0-0.5 mN (ראה לוח חומרים).
הערה: הגדרה זו מותאמת אישית כדי למדוד את הדחיסה במקום "למשוך". - חברו את הקפילר עם סיבי הפחמן למחזיק הנשלט על ידי מיקרומניפולציה ומנוע פיזו.
- מניחים את קצה הסיבים במגע עם חיישן הכוח, אבל בלי לייצר כל כוח ולהעביר את המנוע piezo בשלבים של 10 יקרומטר (התנועה הכוללת של 60 יקרומטר) לכיוון החיישן ולקרוא את המתח נמדד (E) בוולט.
הערה: ודא כי מתמר הכוח נוצר על ידי הקצה של הקצה החופשי של סיבי הפחמן. - . חזור על המדידות האלה שלוש פעמים
- השתמש בנוסחה 1 כדי לחשב את הכוח עבור כל מיקום piezo (ΔΕ
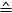 ההפרש של מתח נמדד בין הצעדים המוטוריים piezo):
ההפרש של מתח נמדד בין הצעדים המוטוריים piezo):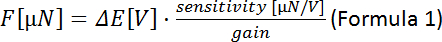
הערה: רגישות מתמר הכוח תלויה במודל של התמר (כאן: 0.05 mN/V = 50 μN/V). ניתן להגדיר את הרווח בבקר. - להתוות את הכוח [μN] נגד העמדה piezo. השיפוע מתאים לקשיות הסיבים [μN/μm].
- כיול את סיבי הפחמן בעזרת מתמר כוח עם רגישות של 0.05 mN/V וטווח כוח של 0-0.5 mN (ראה לוח חומרים).
- כוח השיא של מתקשרת ס מ.
הערה: בצע את הניסויים הבאים בחושך (ניתן להשתמש באור אדום לכלים כחול/ירוק המופעל באור).- העילו את פני השטח של חדר המדידה עם פולי-HEMA. מלאו את חדר המדידה בתמיסה חיצונית והניחו כמה טיפות מההשעיה התרבותית של התאים בחדר (שלב 4.9).
- הצמד נימים עם סיבי פחמן למיקרומניפולציה בשלב. בחר GtACR1-ביטוי ס מ על ידי בדיקת היכולת לגרום התכווצויות על ידי יישום של פולסים קצרים אור ירוק. יישר את סיבי הפחמן הסמוכים-אופקית אל פני השטח של תא המדידה.
- הנמך את הסיב הראשון על משטח התא. הצמד את הסיב השני במקביל לסיב הראשון בקצה השני של CM. היישור האידיאלי הוא קרוב לניצב לציר התא.
הערה: חבר את הסיבים על ידי דחיפת התאים בעדינות למשטח התחתון. שחררו את הלחץ לפני חיבור הסיב השני. אל תמתח את התא על-ידי הצמדת הסיב השני. - לאחר ששני הסיבים מחוברים לתא, מרימים את הסיבים, כך שלצינוק אין קשר למשטח החדר יותר והוא מסוגל להתכווץ ללא כל חיכוך.
- למקד את הסארקומרים בתוכנה לרכישת נתונים (ראה טבלת חומרים) ולהגדיר את אורך sarcomeres מעקב חלון (איור 7A I (3)) בין הסיבים.
הערה: כתוצאה מFFT ספקטרום הכוח (איור 7A I (2)) מראה באופן אידיאלי שיא חד אחד, המייצג את אורך סרקומר הממוצע. - מעקב אחר כיפוף סיבים באמצעות מודול זיהוי קצוות. הגדר את אזורי הזיהוי עם החלון האדום והירוק והגדר סף (קו אופקי אדום וירוק) בנגזרת הראשונה של מעקב עוצמת האור (איור 7a III).
- להתחיל לקצב באופן אופטית תא ב 0.25 הרץ (אם אפשר, לנסות שיעורי התנועה מהר יותר) ולעקוב סרקומר אורך וכיפוף סיבים.
הערה: מיקום בעל סיבים, ההדק והפולסים של גירוי חשמלי נשלטים באמצעות תוכנת רכישת הנתונים (ראה טבלת חומרים). - לאחר הקלטת לפחות 15 התכווצויות מעוררות באופן מסיבי, לעורר את התא חשמלית (ראה טבלת חומרים). מצא את הסף כדי לעורר התכווצויות ולהקליט על ידי החלת 1.5 פעמים של מתח הסף.
- עבור פרוטוקול עיכוב, להחיל גירויים חשמליים כדי לעורר התכווצויות ולאחר מכן לחשוף לאור המתמשכת של 64 s (בעוצמות אור שונים).
- לייצר סיבי פחמן.

איור 4: כיפוף הצנרת. (1) המיקרומניפולציה בצד שמאל משמש לשליטה במיקום הקפילר, ומיקרומניפולציה שנייה מימין משמש לעיקול. (2) נימי. (3) בנדר. (4) מיקרופורג '. (5) מעגל אוריינטציה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: פיפטה עם סיבי פחמן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
6. ניתוח נתונים
-
הקלטות קלאמפ
הערה: תקן את כל המתח המוקלט והפיקודי עבור פוטנציאל הצומת הנוזלי לאחר הניסוי. קביעת פוטנציאל ההסתעפויות הנוזלי בתוכנת רכישת הנתונים באמצעות מחשבון פוטנציאלי של צומת כלי (עבור הפתרונות האמור מהדק תיקון בטבלה 4: 14.4 mV ב 21 ° c). הפחת את פוטנציאל הצומת הנוזלי ממתח ההקלטה/הפקודה.- להקלטות של I-קלאמפ, בדוק צעדים חשמליים לעומת צעדים אופטיים. חישוב משך AP (apd) ב-20 ו-90% רה-פולריזציה עם סקריפט כתוב מותאם אישית (חומר משלים). קביעת פוטנציאל ממברנה מנוחה ומשרעת AP.
הערה: לקבוע את ה-APD כפי שמתואר ב-וואנג ק. ואח '21 קובץ ה-script כדי לטעון קבצי. abf נגיש בדרך כלל באמצעות הקישור הבא: https://de.mathworks.com/matlabcentral/fileexchange/22114-fcollman-abfload. ערכי APD ממוצעים עבור לפחות 6 AP. - עבור V-קלאמפ הפעלה, בדוק אם הבסיס הוא 0 pA. אם לא תתאים את קו הבסיס לאפס. לנתח את הנוכחי המוקלט המופעל על ידי 300 ms פולסים אור ב-74 mV. העבר את הנתונים לתוכנת ניתוח נתונים וקבע את השיא והזרם הנייח הממוצע.
- להקלטות של I-קלאמפ, בדוק צעדים חשמליים לעומת צעדים אופטיים. חישוב משך AP (apd) ב-20 ו-90% רה-פולריזציה עם סקריפט כתוב מותאם אישית (חומר משלים). קביעת פוטנציאל ממברנה מנוחה ומשרעת AP.
-
ניסויים בסיבי פחמן
- הקלטות התכווצות במהלך מצעדים אופטיים: לטעון את הנתונים המוקלט בתוכנה לרכישת נתונים ולקרוא את התוכנית הבסיסית מקסימה של סיבי פחמן כיפוף ושינויי אורך סרקומר.
הערה: ערכי ממוצע עבור 10 התכווצויות של הקלטה יציבה. - מדדו את רוחב התא ומחשבים את האזור החוצה-חתך של התא בהנחה מחתך אליפטי (איור 7B II).
הערה: הנוסחה עבור אזור אליפסה היא = π · a · b (נוסחה 2) שבה הוא המרחק מהמרכז לקודקוד ו-b הוא המרחק מהמרכז לקודקוד המשותף. במקרה שלנו זה אומר = (רוחב של התא)/2 ו-b = (עובי של התא)/2. לדברי נימורה ואח '22 עובי של ס"מ ניתן להעריך להיות שליש רוחב התא כך A = π · (1/2) · רוחב · (1/2) · עובי = π · (1/4) · רוחב · (1/3) · רוחב = π · (1/12) · רוחב2. - חישוב הכוח הסיסטולי הקצה (F):
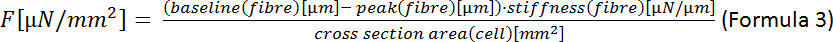
- חישוב הדפורמציה של התא הסיסטולי לקצה (ESD):
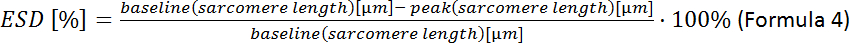
הערה: פרמטרים נוספים ניתן לנתח: במנוחה אורך סרקומר, זמן לשיא, זמן 90% הרפיה, קצר סרקומר קיצור, מהירות מקסימלית של התכווצות והרפיה (ראה המדריך רכישת תוכנה).
- הקלטות התכווצות במהלך מצעדים אופטיים: לטעון את הנתונים המוקלט בתוכנה לרכישת נתונים ולקרוא את התוכנית הבסיסית מקסימה של סיבי פחמן כיפוף ושינויי אורך סרקומר.
תוצאות
GtACR1-eGFP באה לידי ביטוי בשנת התרבות התרבותית CM (איור 6 הכנס) ו הפוטוזרמים נמדדו עם טכניקת טלאי מהדק. הפעלת photoactivation מראה זרמים גדולים מכוונים פנימה-74 mV. באיור 6הזרם שיא (IP) ב 4 mW/mm2 הוא 245 pA. AP הופעלות או חשמלית (איור 6ב) או אופטית (איור 6ג) עם זריקות הנוכחי 1.5 פעמים את הסף, או קצר הקיטוב פולסים אור של 10 ms, בהתאמה. ניתוח ערכי APD, CM חשמלית מראה את ה-APD 20 של 0.24 ± 0.08 s ו-APD 90 של 0.75 ± 0.17 s, ואילו CM בקצב מהיר מראה APD 20 של 0.31 ± 0.08 s ו-APD 90 של 0.81 ± 0.19 s (SE, n = 5, N = 2, בדוגמה המוצגת כאן APD 20חשמל = 0.17 APD 20אופטי = 0.27 s ו apd 90חשמל = 0.61 s; APD 90אופטי = 0.68 s; איור 6ד). CM בקצב optically מראה התפרצות AP איטית יותר (איור 6D). הפעלה ס מ היתה מעוכבים על תאורה מתמשכת (עבור 64 s, 4 mW/mm2) על ידי הקיטוב פוטנציאל הממברנה כלפי פוטנציאל היפוך של כלוריד, כאן-58 MV (איור 6E). זריקות הנוכחי גבוהה יותר 1.5 פעמים הסף לא לעורר את הדור AP (איור 6F). כוחות שיא שנוצר נקבעו מפני סיבי פחמן (איור 7B, C, E). CM שנוצר 232 μN/mm2 על הצעדים החשמליים (איור 7ב) ו 261 μn/mm2 הבאים התנועה האופטית (איור 7ג). פולסים באור ירוק ממושך מעכבים התכווצויות (איור 7E). בעקבות עיכוב אופטי עבור 64 s, התכווצויות מחדש ליצור כוח התכווצות נמוכה יותר, ואת ערכי כוח להתאושש לקראת בסיס אחרי ~ 10 התכווצויות (הליכה ב 0.25 הרץ, איור 7ד) בשמירה על אובדן סידן דיאסטולי מ ארנבת ס.
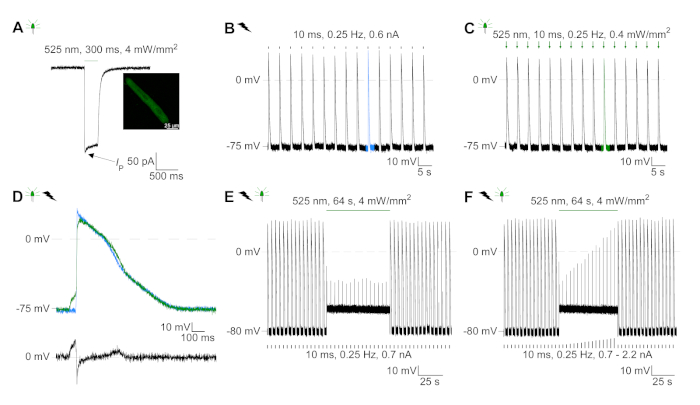
איור 6: טלאי הנציג-הקלטות קלאמפ של הקלטה חשמלית ומעכבות בקצב מבחינה אופטית (א) תמונה ייצוגית ב-74 mV באמצעות פולס קל של 300 ms, 4 mW/mm2. IP מציין את השיא הנוכחי. ההוספה מציגה תא GtACR1-eGFP חיובי. (ב) הקלטת ap הנציג ב-0 pa באמצעות הרמפה הנוכחית של 10 ms, 0.6 nA לקצב החשמלית של CM. (C) נציג AP ב-0 pA באמצעות פולסים באור של 10 ms, 0.4 mW/mm2. (ד) התרשים העליון מציג את כיסויהנקודת של ה -10 של הגישה החשמלית (כחול) והמופעל באופן אופטית (ירוק) ב-CM. AP היושרים על-ידי השינוי המירבי בפוטנציאל הממברנה (dV/dt max). הגרף התחתון מראה את ההבדל של פוטנציאל הממברנה בין AP ו חשמלית המופעל מופעל (eאופטי-eחשמלי). (ה) מופעל בחשמל AP מעוכבים תחת אור מתמשך של 64 s, 4 mW/mm2. (ו) AP מעוכבים על ידי זריקות הנוכחי גבוה יותר 1.5 פעמים הסף (מ 0.7 na בשלבים של 0.1 na כדי 2.2 na) תחת אור מתמשך. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
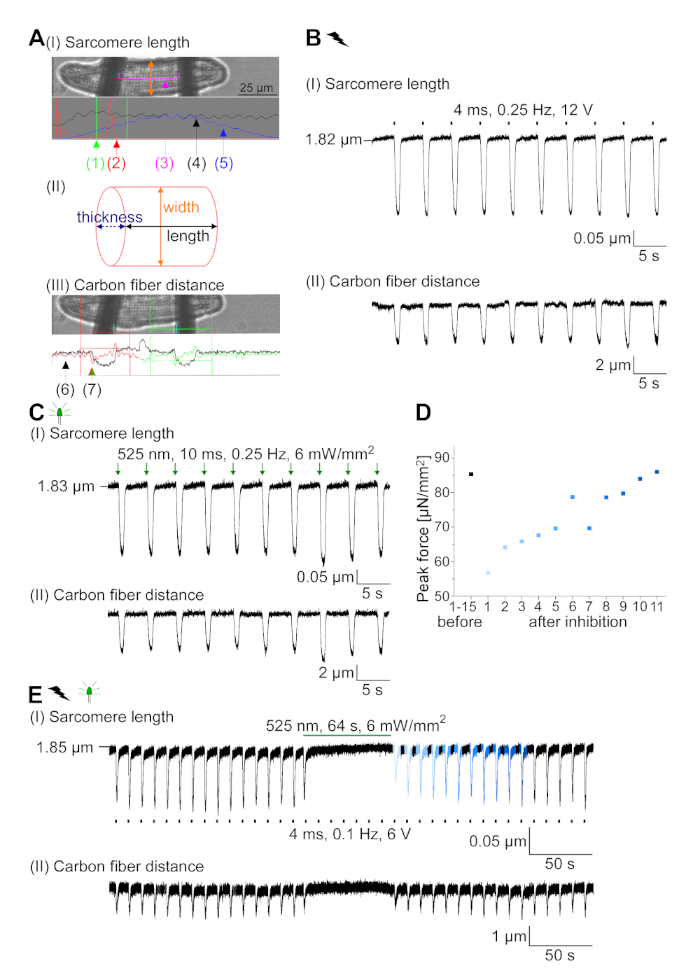
איור 7: נתונים מייצגים מתוך הקלטות סיבי פחמן של ס"מ ובקצב חשמלית/מעוכבים. (א) מוצג בתוכנת רכישת הנתונים. תמונה (I) מציג את CM נמדד עם החלון לחישוב אורך סרקומר. רוחב התא מתויג בכתום. (1) טווח תדרים רלוונטיים. (2) קשת כוח FFT מראה את התדירות של המרווח סרקומר בתא. אורך סרקומר הממוצע מחושב מתדר שיא. (3) חלון מעקב אורך sarcomere. (4) מעקב בעוצמה. (5) מעקב האינטנסיביות המוכפל בחלון המינג הוא סימן האינטנסיביות של החלונות. ערכה (II) מציגה את החתך האליפטי של התא. רוחב בכתום ועובי בכחול מקווקו. תמונה (III) מראה את המיקום של סיבי פחמן עם תיבות זיהוי בהתאמה, שמאל באדום וימין בירוק. (6) מעקב בעוצמה. (7) הנגזרת הראשונה של מעקב האינטנסיביות (ראה תוכנת רכישת נתונים ידנית). (ב) סימן מייצג של התכווצויות חשמלית מעוררת. פאנל (I) מראה את קיצור האורך סרקומר, פאנל (II) את המרחק בין שתי סיבי פחמן. (ג) הסימן המייצג של התכווצויות הוטיות בצורה אופטית (525 nm, 0.25 Hz, 10 ms, 6 mW/mm2). פאנל (I) מראה את קיצור האורך סרקומר, פאנל (II) את המרחק בין שתי סיבי פחמן. (ד) שנוצר כוח שיא מכיווץ 1 עד 11 לאחר השהיה הנגרמת על ידי עיכוב של יצירת AP. (ה) מעקב מייצג של עיכוב אופטי של התכווצויות תחת תאורה מתמשכת (525 nm, 64 s, 6 mW/mm2). פאנל (I) מראה את קיצור האורך סרקומר, פאנל (II) אורך בין שתי סיבי פחמן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| קצת | אזור |
| ACR | בעלי מתקשר |
| AP | פוטנציאל פעולה |
| APD | משך זמן פוטנציאלי לפעולה |
| CFU | יחידה להקמת מושבה |
| ChR | מתקשרים |
| ס מ | החייאה |
| מיכל מיכל | חלבון פלורסנט ירוק משופר |
| ESD | הקצה דפורמציה תא סיסטולי |
| איחוד האירופי | יחידות אנדוטוקסין |
| F | כוח |
| FFT | התמרת פורייה מהירה |
| מיכל שגיא | גילרדיה תטא אניעל מתעל דוסין |
| GUI | ממשק משתמש גרפי |
| I-קלאמפ | מלחציים נוכחיים |
| IU | יחידות בינלאומיות |
| MOI | ריבוי של זיהום |
| פולי-HEMA | פולי (2-הידרוקסיל מתיאקריל) |
| מהדק V | מהדק מתח |
שולחן 5: רשימת קיצורים.

משלים איור 1: מדידות אינטנסיביות אור עם מד כוח אופטי. (A) מדידה של 10 ms פולסים באור ב 4 mW/mm2. (ב) מדידה של תאורה מתמשכת של 64 s ב-4 mW/mm2. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
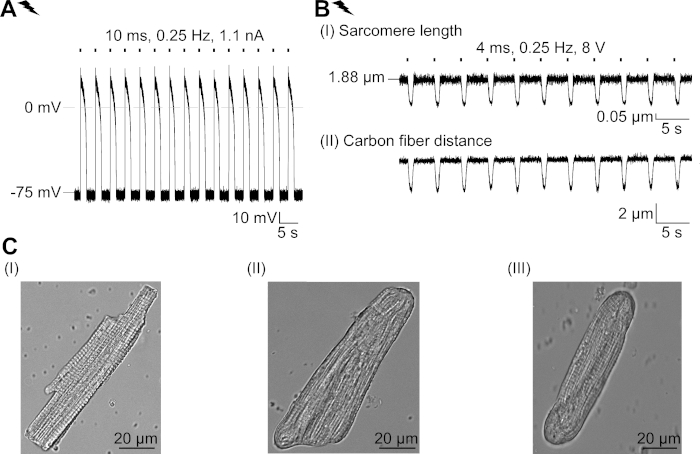
איור משלים 2: מאפיינים של ס"מ מבודדים טריים והסתגלות מבנית שלהם בתרבות. (א) הקלטת AP של ס"מ מבודדים טריים (apd 20 של 1.11 ± 0.34 s, apd 90 של 1.96 ± 0.32 s, n = 7, n = 2). מתכוון לנוח ממברנה פוטנציאל של-79.3 ± 0.8 mV (n = 7, N = 2). (ב) פחמן סיב הקלטה של ס מ מבודדת טרי בקצב מבודד. ממוצע כוח שיא של 205 ± 78 μn/mm2 (N = 7, n = 2). (ג) תמונות מיקוד של ס מ מבודד טרי (I); (II) והתמרה (III) CM לאחר 48 שעות בתרבות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
חומר משלים: MatLab סקריפט כדי לקבוע APD ומנוחה פוטנציאל הממברנה. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
בעוד כלים אלקטרואופטיקה לאפשר אפנון של אלקטרופיזיולוגיה התא להתרגש באופן לא פולשני, הם זקוקים לאפיון יסודי בסוגים שונים של תאים (g., CM) כדי לאפשר לאחד לבחור את הכלי הזמין הטוב ביותר עבור עיצוב ניסיוני ספציפי. טכניקת התיקון-מהדק היא שיטה סטנדרטית להערכת מכשירים אלקטרופיזיולוגיה סלולריים. בתצורת התא כולו, היא מאפשרת להקליט זרמים המופעל באמצעות תמונה על פני קרום הפלזמה או שינויי הזמן במתח ממברנה בעקבות גירוי באור/עכבות. מניפולציה אלקטרואופטיקה של עירור חשמל משפיע גם על התכווצויות ס מ. אנו משתמשים במעקב סרקומר ומדידות פחמן בעזרת סיבים לכמת את ההשפעות של החקירה האופטית על הפעילות המכנית של מיציטים.
אנו מתארים פרוטוקול כדי לאפיין את ההשפעות הבסיסיות של ערוץ כלוריד מגודר באור, GtACR1, ב-CM. כמו מערכת מודל, אנחנו בחרה הארנב ס מ, כמו מאפיינים אלקטרופיסיולוגיים שלהם (למשל, צורת AP ותקופה עקשן) דומה לאלה שנצפו ב-CM האנושית יותר קרוב מאשר ס מ מכרסם. יתר על כן, ארנב ס מ יכול להיות תרבותי במשך כמה ימים, מספיק זמן עבור משלוח אדנונגיפי וביטוי של GtACR1-eGFP. בעיקר, מבודד ס"מ לשנות את התכונות המבבניות שלהם בתרבות לאורך זמן, כולל עיגול של סופים תאים ואובדן הדרגתי של הצלב, T-הכרישים מערכת ו בורקולאה23,24. בשורה עם זה, שינויים פונקציונליים דווחו בתרבות CM: depolarization של פוטנציאל הממברנה נח, הארכה של AP ושינויים סלולרי Ca2 + טיפול. לסקירה של עיבודים סלולריים בתרבות, נא לראות Louch ואח '25. משלים איור 2 מציג AP למופת והתכווצות מדידות של ס"מ מבודדים טריים להשוואה עם אלה שנצפו בשנת התרבות (איור 6, איור 7) באמצעות הפרוטוקול המוצג כאן.
הקלטות מצמד התאים המלא מאפשרים מדידות ישירות של מאפייני פוטונוכחיים (לדוגמה, הגברה וקינטיקה) ושינויים בעלי האור בתכונות של ממברנה או מאפייני AP ברזולוציה גבוהה. עם זאת, הקלטות כאלה יש מספר מגבלות: ראשית, ציטוסול מוחלף על ידי פתרון פיפטה בהקלטות שלמות, אשר יתרון לשלוט מעברי האלקטרו-מדרגתיים יוניים, אבל יש את החיסרון הפנימי של שטיפת כביסה הסלולר אורגלים, חלבונים ותרכובות אחרות, ובכך פוטנציאל להשפיע על תגובות חשמל סלולריים. שנית, תופעות לוואי כמו הפעלה של ערוצי יון נוספים הנובע depolarization ארוכה מבחינה פיזיולוגית (למשל, קבועים בזמן איטי של ערוצי יונים מגודרת) קשה להעריך כמו השיטה שלנו רק מאפשר אחד כדי לזהות שינויים APD, אבל לא לנהל מדידות ישירה של ריכוזי יונית בתאי התא הרלוונטיים אלקטרופיזיולוגית. זה יכול להיעשות עם אינדיקטורים פלורסנט (למשל, Ca2 + חיישנים) או יון בררני אלקטרודות. אפיון נוסף עשוי לכלול בעוצמת האור החדירות, קביעת תלות של pH, קינטיקה פוטושוטפת בפוטנציאל ממברנה שונים, וקינטיקה שחזור במהלך גירוי אור חוזר.
בניגוד הקלטות תיקון-קלאמפ, מדידות כוח תא בודד לאפשר ניתוח של התכווצויות הסלולר של מיציטים שלמים מבלי להשפיע על הסביבה תאיים שלהם. השפעות משניות על ריכוזי יונים (למשל, Ca2 +) יכול להיות מוערך בעקיפין על ידי קביעת כוח שנוצר משרעת דינמיקה (g., מהירות מקסימלית של התכווצות והרפיה; כאן לא מנותח). מדידות כוח עם הטכניקה סיבי פחמן יש יתרון על תאים באופן חופשי מתקשרת כפי שהם מספקים מידע ישיר על כוחות פסיבי ופעיל בתאים שנטענו מראש (כלומר, בתנאים דומים יותר באתרו או vivo הגדרות). טעינה מכנית חשובה במיוחד כאשר מנתחים את הסלולר, כמו המתיחה משפיע על ייצור כוח והרפיה26,27.
גישות אלקטרואופטיקה מאפשרות מניפולציה מדויקת באופן מדויק של הפוטנציאל של הממברנה התאית, הן ב-CM אחת והן ברקמות לב שלמות. באופן קלאסי, ChR2, ערוץ הקטיון שאינו סלקטיבי, שימש לדפולריזציה של פוטנציאל הממברנה, בעוד משאבות פרוטונים ו/או כלוריד מונחות אור שימשו להיפולריזציה ממברנה. שתי הקבוצות של מפעילים אלקטרואופטיקה דורשים רמות ביטויים גבוהים, כמו ChR2 מאופיין על ידי מוליכות נמוכה מיסודה הערוץ יחיד28 ומשאבות אור הובלה מקסימאלית יון אחד לכל פוטון נספג. יתר על כן, הפעלה ממושכת של ChR2 ס"מ עשוי להוביל Na+ ו/או Ca2 + עומס יתר, ומשאבות אור מונחה יכול לשנות טרנס-sar, H+ או Cl- מעבריצבע29,30. בחיפוש אחר כלים חלופיים לבקרת האלקטרואופטיקה בפעילות CM, בדקנו לאחרונה את מתעל הGtACR1 הטבעי, המאופיין ביחס מהיר של מוליכות-ערוץ יחיד ורגישות גבוהה יותר בהשוואה לקטיון כגון ChR2. מצאנו כי הפעלה GtACR1 הדפולזים ס מ והוא יכול לשמש עבור צעדים אופטיים עיכוב, בהתאם הדופק האור תזמון ומשך. יתרון נוסף של שימוש ב-ACR במקום הקטיון יכול להיות האפשרות היפוך שלילי יותר של קלרנית- לעומת Na+, הפחתת זרמי יונים שהוצגו באופן מלאכותי. כפי שראינו בעבר, התנועה האופטית עם GtACR1 עשוי להוביל לתקשורת AP כתוצאה מרכיב איטי של סגירת ערוץ GtACR1, אשר ניתן להתגבר על ידי שימוש מהר יותר GtACR1 מוטציות19. עם זאת, נקודת הגישה AP הוא הרבה פחות מבוטא בעת שימוש נמוך יותר, מיותר לשימוש פיזיולוגי תאיים (ראה איור 6). יתר על כן, עיכוב GtACR1-תיווך על ידי תוצאות תאורה ממושכת depolarization ממברנה עמוקה, אשר שוב יכול להפעיל משנית Na+ ו-Ca2 + זרם, ובכך לשנות את הפעילות של ערוצים מגודרת מתח. במדידות שלנו, אנו מוצאים כי AP ופרמטרים התכווצות להתאושש בסיסית בתוך 40 s לאחר עיכוב אור המושרה עבור 1 דקות (ראה Kopton ואח ' 2018, איור 6, איור 7). K+ ערוצים מגודרת מציעים חלופה חזקה עבור השתקה ס מ בלי להשפיע על הממברנה ס מ המנוחה פוטנציאל31.
בעתיד אנו רוצים להשוות בין כלים אלקטרואופטיקה שונים עבור הפוטנציאל שלהם לעכב פעילות לב. לשם כך, אנו בודקים מגוון של ערוצי יונים מגודרת, כולל ACR, ChR2 ו-red-העביר משתנים32, כמו גם היתר מפעילים כגון halorhodopsin או האור מגודרת adenylyl Cyclase bpac בשילוב עם ערוץ אשלגן SthK (PAC-K)31.
הפרוטוקול המוצג כאן יכול לשמש לאפיון מעמיק של המאפיינים האלקטרומכניים של CM. היא ישימה בעיקר גם ס מ ממינים אחרים, ו-CM מבודדים משריר הלב החולה. גירוי אופטי מאפשר אחד לקצב ס"מ בתדרים שונים, יטען שונים ניתן לבדוק במהלך ניסויים התכווצות סיבי פחמן. ניסוי מעניין יהיה להשתמש תאורה בעוצמה נמוכה לדפולריזציה subpol, כדי לחקות את העלייה הדרגתית בפוטנציאל קרום מנוחה, כפי שניתן לצפות במהלך התפתחות של שיפוץ רקמות לב במהלך התקדמות המחלה. לבסוף, מדידות תפקודית יכול להיות משולב עם Ca2 + הדמיה לתובנה נוספת לתוך התכווצות עירור צימוד, או עם התערבויות תרופתי כדי להעריך את ההשפעות של תרופות שונות על פעילות CM.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
אנו מודים לסטפני פרז-פלאיז לקבלת סיוע טכני מעולה, ד ר ג'ונאס וויטק (הומבולדט-אוניברסיטת ברלין, גרמניה) למתן pUC57-GtACR1 פלסמיד, פרופ ' ד ר מיכאל שכטר (Charité-אוניברסיטת ברלין, מכון הספורט פארמקולוגיה, ברלין) עבור הייצור אדנווירוס וד ר אנסטסיה Khokhlova (אוראל האוניברסיטה הפדרלית) על שיתוף המומחיות שלה כדי לשפר את פרוטוקול בידוד התא כדי לעצב מחדש את הכיוונון הכיפוף צינורות. הפרויקט מומן על ידי קרן המחקר הגרמני (SPP1926: SCHN 1486/1-1; מלגת אמי-נתר: SCHN1486/2-1) ו-ERC גרנט מתקדם המענק.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment - Cell isolation/Culturing/Transduction | |||
| Adeno-X Adenoviral System 3 CMV | TaKaRa, Clontech Laboratories, Inc., Mountain View, California, USA | ||
| Aortic cannula | Radnoti | 4.8 OD x 3.6 ID x 8-9 L mm | |
| Coverslips ø 16 mm, Thickness No. 0 | VWR International GmbH, Leuven, Belgium | 631-0151 | Borosilicate Glass |
| Griffin Silk, Black, 2 m Length, Size 3, 0.5 mm | Samuel Findings, London, UK | TSGBL3 | |
| Incubator | New Brunswick, Eppendorf, Schönenbuch, Switzerland | Galaxy 170S | |
| Langendorff-perfusion set-up | Zitt-Thoma Laborbedarf Glasbläserei, Freiburg, Germany | Custom-made | |
| Langendorff-pump | Ismatec, Labortechnik-Analytik, Glattbrugg-Zürich, Switzerland | ISM444 | |
| Mesh: Nylon Monodur filter cloth | Cadisch Precision Meshes Ltd | 800 µm holes, 1 m wide | |
| Neubauer chamber | VWR International GmbH, Leuven, Belgium | 717806 | |
| Rabbit, New Zealand White | Charles River | Strain Code: 052 | |
| Scissors | Aesculap AG, Tuttlingen, Germany | BC774R | Bauchdeckenschere ger. 18cm |
| Sterile filter, 0.22 µm | Merck, Darmstadt, Germany | SLGP033RB | |
| Equipment - Patch-clamp | |||
| Amplfier | AxonInstruments, Union City, CA, United States | Axopatch 200B | |
| Coverslip ø 50 mm, Thickness No. 1 | VWR International GmbH, Leuven, Belgium | 631-0178 | Borosilicate Glass |
| Digitizer Axon Digidata | Molecular Devices, San José, CA, United States | 1550A | |
| Filter (530/20) | Leica Microsystems, Wetzlar, Germany | 11513878 | BZ:00 |
| Filter (630/20) | Chroma Technology, Bellows Falls, Vermont, United States | 227155 | |
| Headstage | AxonInstruments, Union City, CA, United States | CV203BU | |
| Interface | Scientifica, Uckfield, UK | 1U Rack, 352036 | |
| LED 525 nm | Luminus Devices, Sunnyvale, CA, United States | PT-120-G | |
| LED control software | Essel Research and Development, Toronto, Canada | ||
| LED control system | custom-made | ||
| Micropipette Puller | Narishige Co., Tokyo, Japan | PP-830 | |
| Microscope inverted | Leica Microsystems, Wetzlar, Germany | DMI4000B | |
| Motorised Micromanipulator | Scientifica, Uckfield, UK | PatchStar | |
| Optical power meter | Thorlabs, Newton, NJ, United States | PM100D | |
| Silicone Grease | RS Components, Corby, UK | 494-124 | |
| Silver wire | A-M Systems, Sequim, WA, United States | 787500 | Silver, Bare 0.015'', Coated 0.0190'', Length 25 Feet |
| Soda lime glass capillaries | Vitrex Medical A/S, Vasekaer, Denmark | 160213 BRIS, ISO12772 | 1.55 OD x 1.15 ID x 75 L mm |
| Software Axon pClamp | Molecular Devices, San José, CA, United States | Version 10.5 | |
| Software MatLab2017 | The MathWorks, Inc. | ||
| Stage micrometer | Graticules Optics LTD, Tonbridge, UK | 1 mm | |
| Equipment - Carbon fiber | |||
| Carbon fibers | provided from Prof. Jean-Yves Le Guennec | BZ:00 | |
| Digitizer Axon Digidata | Molecular Devices, Sunnyvale, CA, United States | 1550B | |
| Filter (530/20) | Leica Microsystems, Wetzlar, Germany | 11513878 | |
| Filter (630/20) | Chroma Technology, Bellows Falls, Vermont, United States | 227155 | |
| Fluorescence System Interface | IonOptix, Milton, MA United States | FSI-800 | 2.0 OD x 1.16 ID x 100 L mm |
| Force Transducer System | Aurora Scientific Inc., Ontario, Canada | 406A | |
| Glass capillaries for force measurements | Harvard Apparatus, Holliston, Massachusetts, United States | GC200F-10 | |
| Interface National Instruments | National Instruments, Budapest, Hungary | BNC-2110 | |
| LED 525 nm | Luminus Devices, Sunnyvale, CA, United States | PT-120-G | |
| LED control box | Essel Research and Development, Toronto, Canada | ||
| LED control system | custom-made | ||
| Microcontroller | Parallax Inc., Rocklin, California, United States | Propeller | |
| Micropipette Puller | Narishige Co., Tokyo, Japan | PC-10 | |
| Microscope inverted | Leica Microsystems, Wetzlar, Germany | DMI4000B | |
| MyoCam-S camera | IonOptix, Dublin, Ireland | ||
| MyoCam-S camera Power | IonOptix, Milton, MA, United States | MCS-100 | |
| MyoPacer Field Stimulator | IonOptix Cooperation, Milton, MA, United States | MYP100 | |
| Piezo Motor | Physik Instrumente (PI) GmbH & Co. KG, Karlsruhe, Germany | E-501.00 | |
| Silicone Grease | RS Components, Corby, UK | 494-124 | |
| Software Axon pClamp | Molecular Devices, San José, CA, United States | Version 10.5 | |
| Software IonWizard | IonOptix, Dublin, Ireland | Version 6.6.10.125 | |
| Software MatLab2017 | The MathWorks, Inc. | ||
| Stage micrometer | Graticules Optics LTD, Tonbridge, UK | 1 mm | |
| Chemicals | |||
| Adenosine | Sigma-Aldrich, St. Louis, Missouri, United States | A9251-100G | |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, Missouri, United States | A7030-50G | |
| CaCl2 | Honeywell Fluka, Muskegon, MI, USA | 21114-1L | |
| L-Carnitine hydrochloride | Sigma-Aldrich, St. Louis, Missouri, United States | C9500-25G | |
| Collagenase type 2, 315 U/mg | Worthington, Lakewood, NJ, USA | LS004177 | |
| Creatine | Sigma-Aldrich, St. Louis, Missouri, United States | C0780-50G | |
| Cytosine-β-D-arabinofuranoside | Sigma-Aldrich, St. Louis, Missouri, United States | C1768-100MG | |
| EGTA | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 3054.3 | |
| Esketamine hydrochloride, Ketanest S 25 mg/mL | Pfizer Pharma PFE GmbH, Berlin, Germany | PZN-07829486 | |
| Fetal Bovine Serum | Sigma-Aldrich, St. Louis, Missouri, United States | F9665 | |
| Gentamycin 50 mg/mL | Gibco, Life Technologies, Waltham, MA, USA | 15750-037 | |
| Glucose | Sigma-Aldrich, St. Louis, Missouri, United States | G7021-1KG | |
| Heparin-Sodium, 5,000 IU/mL | Braun Melsungen AG, Melsungen, Germany | PZN-03029843 | |
| HEPES | Sigma-Aldrich, St. Louis, Missouri, United States | H3375-1KG | |
| Insulin (bovine pancreas) | Sigma-Aldrich, St. Louis, Missouri, United States | I6634-50MG | |
| K-aspartate | Sigma-Aldrich, St. Louis, Missouri, United States | A6558-25G | |
| KCl | VWR International GmbH, Leuven, Belgium | 26764.260 | 1 mg/mL |
| KOH | Honeywell Fluka, Muskegon, MI, USA | 35113-1L | |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma-Aldrich, St. Louis, Missouri, United States | L2020-1MG | |
| M199-Medium | Sigma-Aldirch, St. Louis, Missouri, United States | M4530 | |
| Mg-ATP | Sigma-Aldrich, St. Louis, Missouri, United States | A9187-1G | |
| MgCl2 | Sigma-Aldrich, St. Louis, Missouri, United States | 63069-500ML | |
| NaCl | Fisher Scientific, Loughborough, Leics., UK | 10428420 | |
| NaCl-Solution 0.9%, Isotone Kochsalz-Lösung 0.9% | Braun Melsungen AG, Melsungen, Germany | 3200950 | |
| NaOH | AppliChem GmbH, Darmstadt, Germany | A6579 | without Ca2+/Mg2+ |
| Na-pyruvat | Sigma-Aldrich, St. Louis, Missouri, United States | P2256-100MG | |
| Phosphate Buffered Saline | Sigma-Aldrich, St. Louis, Missouri, United States | D1408-500ML | |
| Poly(2-hydroxyethyl methacrylate) | Sigma, Poole, UK | 192066 | |
| Protease XIV from Streptomyces griseus | Sigma-Aldrich, St. Louis, Missouri, United States | P5147-1G | |
| Taurine | Sigma-Aldrich, St. Louis, Missouri, United States | T0625-500G | |
| Thiopental Inresa 0.5 g | Inresa Arzneimittel GmbH, Freiburg, Germany | PZN-11852249 | |
| Xylazine hydrochloride, Rompun 2% | Bayer Vital GmbH, Leverkusen, Germany | PZN-01320422 |
References
- Harz, H., Hegemann, P. Rhodopsin-regulated calcium currents in Chlamydomonas. Nature. 351, 489-491 (1991).
- Litvin, F. F., Sineshchekov, O. A., Sineshchekov, V. A. Photoreceptor electric potential in the phototaxis of the alga Haematococcus pluvialis. Nature. 271, 476-478 (1978).
- Nagel, G., et al. Channelrhodopsin-1: A Light-Gated Proton Channel in Green Algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
- Lozier, R. H., Bogomolni, R. A., Stoeckenius, W. Bacteriorhodopsin: a light-driven proton pump in Halobacterium Halobium. Biophysical journal. 15 (9), 955-962 (1975).
- Schobert, B., Lanyi, J. K. Halorhodopsin is a light-driven chloride pump. Journal of Biological Chemistry. 257 (17), 10306-10313 (1982).
- Inoue, K., et al. A light-driven sodium ion pump in marine bacteria. Nature Communications. 4, 1678 (2013).
- Han, X., et al. A High-Light Sensitivity Optical Neural Silencer: Development and Application to Optogenetic Control of Non-Human Primate Cortex. Frontiers in Systems Neuroscience. 5, 18 (2011).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Grimm, C., Silapetere, A., Vogt, A., Bernal Sierra, Y. A., Hegemann, P. Electrical properties, substrate specificity and optogenetic potential of the engineered light-driven sodium pump eKR2. Scientific Reports. 8, 9316 (2018).
- Wietek, J., et al. Conversion of channelrhodopsin into a light-gated chloride channel. Science. 344 (6182), 409-412 (2014).
- Berndt, A. Structure-Guided Transformation. Science. 344 (6182), 420-424 (2014).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Mohamed, G. A., et al. Optical inhibition of larval zebrafish behaviour with anion channelrhodopsins. BMC Biology. 15 (1), 103 (2017).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic Neuronal Silencing in Drosophila during Visual Processing. Scientific Reports. 7, 13823 (2017).
- Govorunova, E. G., Cunha, S. R., Sineshchekov, O. A., Spudich, J. L. Anion channelrhodopsins for inhibitory cardiac optogenetics. Scientific Reports. 6, 33530 (2016).
- Kopton, R. A., et al. Cardiac Electrophysiological Effects of Light-Activated Chloride Channels. Frontiers in Physiology. 9, 1806 (2018).
- Peyronnet, R., et al. Load-dependent effects of apelin on murine cardiomyocytes. Progress in Biophysics and Molecular Biology. 130, 333-343 (2017).
- Wang, K., et al. Cardiac tissue slices: preparation, handling, and successful optical mapping. American Journal of Physiology-Heart and Circulatory Physiology. 308 (9), 1112-1125 (2015).
- Nishimura, S., et al. Single cell mechanics of rat cardiomyocytes under isometric, unloaded, and physiologically loaded conditions. American Journal of Physiology-Heart and Circulatory Physiology. 287 (1), 196-202 (2004).
- Mitcheson, J. S., Hancox, J. C., Levi, A. J. Action potentials, ion channel currents and transverse tubule density in adult rabbit ventricular myocytes maintained for 6 days in cell culture. Pflugers Archiv European Journal of Physiology. 43 (6), 814-827 (1996).
- Burton, R. A. B., et al. Caveolae in Rabbit Ventricular Myocytes: Distribution and Dynamic Diminution after Cell Isolation. Biophysical Journal. 113 (5), 1047-1059 (2017).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in cardiomyocyte isolation, culture, and gene transfer. Journal of Molecular and Cellular Cardiology. 51 (3), 288-298 (2011).
- Janssen, P. M., Hunter, W. C. Force, not sarcomere length, correlates with prolongation of isosarcometric contraction. The American Journal of Physiology. 269 (2), 676-685 (1995).
- Monasky, M. M., Varian, K. D., Davis, J. P., Janssen, P. M. L. Dissociation of force decline from calcium decline by preload in isolated rabbit myocardium. Pflugers Archiv European Journal of Physiology. 456 (2), 267-276 (2008).
- Kleinlogel, S., et al. Ultra light-sensitive and fast neuronal activation with the Ca 2+-permeable channelrhodopsin CatCh. Nature Neuroscience. 14 (4), 513-518 (2011).
- Schneider-Warme, F., Ravens, U. Using light to fight atrial fibrillation. Cardiovascular Research. 114 (5), 635-637 (2018).
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature. 463 (7277), 98-102 (2010).
- Bernal Sierra, Y. A., et al. Potassium channel-based optogenetic silencing. Nature Communications. 9 (1), 4611 (2018).
- Oda, K., et al. Crystal structure of the red light-activated channelrhodopsin Chrimson. Nature Communications. 9 (1), 3949 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved