Method Article
Évaluation électromécanique de l’activité cardiomyocyte modulée d’optogenetically
Dans cet article
Résumé
Nous présentons un protocole pour évaluer les effets électromécaniques de l’activation de GtACR1 dans les cardiomyocytes de lapin. Nous fournissons des informations détaillées sur l’isolement cellulaire, la culture et la transduction adénoviraire, et sur des expériences fonctionnelles avec les techniques de correction-pince et de fibre de carbone.
Résumé
Au cours des deux dernières décennies, des outils optogénétiques ont été établis comme des moyens puissants pour moduler l’activité spécifique de type cellulaire dans les tissus excitables, y compris le cœur. Alors que Channelrhodopsin-2 (ChR2) est un outil commun pour dépolariser le potentiel de membrane dans les cardiomyocytes (CM), potentiellement obtenir des potentiels d’action (AP), un outil efficace pour le silence fiable de l’activité CM a été manquant. Il a été suggéré d’utiliser des canalrhodopsins d’anion (ACR) pour l’inhibition optogénétique. Ici, nous décrivons un protocole pour évaluer les effets de l’activation de l’ACR GtACR1 naturel de Guillardia theta dans le lapin cultivé CM. Les lectures primaires sont des enregistrements électrophysiologiques de correction-pince et le suivi optique des contractions de CM, tous deux exécutés tout en appliquant différents modèles de stimulation lumineuse. Le protocole comprend l’isolement CM du cœur du lapin, l’ensemencement et la culture des cellules pendant un bon jusqu’à 4 jours, la transduction par le codage de l’adénovirus pour le canal de chlorure de lumière, la préparation de corrections de pinces et de fibres de carbone, la collecte et l’analyse de données. L’utilisation de la technique de pince de correction dans la configuration des cellules entières permet d’enregistrer les courants activés par la lumière (en mode tension-clamp, V-clamp) et AP (mode de pince actuelle, I-clamp) en temps réel. En plus des expériences de correction-pince, nous effectuons des mesures de contractilité pour l’évaluation fonctionnelle de l’activité de CM sans perturber le milieu intracellulaire. Pour ce faire, les cellules sont mécaniquement préchargées à l’aide de fibres de carbone et les contractions sont enregistrées en suivant les changements dans la longueur du sarcome et la distance de fibre de carbone. L’analyse des données comprend l’évaluation de la durée de l’AP à partir des enregistrements I-clamp, les courants de pointe des enregistrements de V-clamp et le calcul de la force à partir de mesures de fibre de carbone. Le protocole décrit peut être appliqué à l’essai des effets biophysiques de différents actionneurs optogénétiques sur l’activité de CM, une condition préalable pour le développement d’une compréhension mécaniste des expériences optogénétiques dans le tissu cardiaque et les coeurs entiers.
Introduction
Des photocurrents à médiation ChR ont d’abord été enregistrés dans la tache oculaire des algues vertes unicellulaires1,2. Peu de temps après le clonage génétique et l’expression hétérogène de Chlamydomonas reinhardtii ChR1 et ChR2, ChR ont été utilisés comme outils pour modifier le potentiel de membrane dans les oocytes Xenopus et les cellules de mammifères par la lumière3,4. La Cation non sélective ChR dépolarise la membrane des cellules avec un potentiel de membrane de repos qui est négatif au potentiel d’inversion de ChR. Ils peuvent ainsi être utilisés pour obtenir AP dans les cellules excitables, y compris les neurones et CM, permettant le rythme optique5,6.
Complémentaire à la cation ChR, proton léger, chlorure et pompes à sodium7,8,9 ont été utilisés pour inhiber l’activité neuronale10,11,12. Cependant, ces derniers ont des limitations, nécessitant des intensités de lumière élevée et un éclairage soutenu, car un ion est transporté par photon absorbé. En 2014, deux études indépendantes menées par Wietek et coll. et Berndt et coll. ont décrit la conversion de ChR en ACR par le biais de mutations dans le canal pore13,14. Un an plus tard, ACR naturel ont été découverts dans le cryptophyte Guillardia theta (GtACR)15. Comme l’ACR conçu a montré la conductance résiduelle de cation, ils ont été remplacés par ACR naturel, caractérisé par une grande conductance à canal unique et une sensibilité élevée de lumière15. GtACR ont été utilisés pour réduire au silence l’activité neuronale en polarisant le potentiel de membrane vers le potentiel d’inversion du chlorure16,17. Govorunova et coll. ont appliqué GtACR1 à la CM ventriculaire de rat cultivée et ont montré la photoinhibition efficace à de faibles niveaux d’intensité lumineuse qui n’étaient pas suffisants pour activer des outils d’inhibition précédemment disponibles, tels que la pompe de proton Arch18. Notre groupe a récemment signalé que la photoinhibition de CM à médiation GtACR1 est basée sur la dépolarisation et que GtACR1 peut également être utilisé, par conséquent, pour le rythme optique de CM19.
Ici, nous présentons un protocole pour étudier les effets électrophysiologiques et mécaniques de la photoactivation GtACR1 sur le lapin cultivé ventriculaire CM. Nous décrivons d’abord l’isolement cellulaire, la culture et la transduction. Les effets électrophysiologiques sont mesurés à l’aide d’enregistrements de pinces à cellules entières. Les courants à médiation légère à une tension membrane donnée sont évalués en mode V-clamp. La dynamique du potentiel de membrane est mesurée tandis que le CM de rythme électrique ou optique (mode I-clamp). L’inhibition optique de l’AP déclenchée électriquement est testée à l’aide d’une application de lumière soutenue. Les effets mécaniques sont mesurés à l’aide de fibres de carbone en combinaison avec le suivi à base d’imagerie de la longueur du sarcome. Pour ce faire, les cellules optiquement rythmées sont mécaniquement préchargées en attachant deux fibres de carbone à la membrane plasmatique près des extrémités opposées des cellules. Les changements de longueur du sarcomère sont enregistrés lors du rythme optique ou électrique. Enfin, la photoinhibition est mesurée lors de la stimulation électrique du champ des cellules, et les forces générées sont analysées.
Le protocole comprend les étapes suivantes indiquées dans le flowchart de la figure 1: anesthésie profonde du lapin, injection de surdosage thiopental, excision cardiaque, langendorff-perfusion et digestion des tissus, dissociation mécanique du tissu pour libérer les cellules, analyse microscopique du rendement cm, culte du CM, transduction avec adénovirus de type 5, suivie d’incubation et d’expériences fonctionnelles.

Figure 1 : Flowchart du protocole utilisé pour obtenir un CM électriquement et optiquement rythmé. Les cœurs sont excisés à partir de lapins de 9 à 10 semaines, et le tissu cardiaque est digéré tout en étant perfusé à l’aide d’une configuration Langendorff. Les cellules sont libérées par l’agitation mécanique. Le rendement CM est compté au microscope. CM sont cultivés, transduits avec l’adénovirus de type 5 et les expériences fonctionnelles sont effectuées 48-72 heures après la transduction. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Protocole
Toutes les expériences sur les lapins ont été menées conformément aux lignes directrices énoncées dans la directive 2010/63/UE du Parlement européen sur la protection des animaux utilisés à des fins scientifiques et approuvées par les autorités locales du Bade-Wurtemberg (Regierungsprâsidium Freiburg, X-16/10R, Allemagne).
1. Solutions pour l’isolement cellulaire
- Préparer les solutions pour l’isolement cellulaire avec de l’eau des exigences suivantes (tableau 1) et selon les compositions ioniques énumérées dans le tableau 2.
REMARQUE : CaCl2 et MgCl2 sont ajoutés à partir de solutions de stock de 1 M.
| Exigences en matière d’eau | |
| Conductivité [-S/cm] à 25 oC | 0.055 |
| Pyrogen [UE/mL] | lt; 0,001 |
| Particules (taille 'gt; 0.22 'm) [1/mL] | 1 |
| Carbone organique total [ppb] | lt; 5 |
| Micro-organismes [CFU/mL] | 1 |
| RNase [ng/mL] | lt; 0,01 |
| DNase [ng/mL] | lt; 4 |
Tableau 1 : Exigences en matière d’eau.
| Solution saline physiologique (1) | Faible teneur en calcium, solution de potassium élevé (2) | Solution enzymatique (3) | Solution de blocage | |
| NaCl [mM] | 137 | 137 | 137 | 137 |
| KCl [mM] | 4 | 14 | 14 | 14 |
| HEPES [MM] | 10 | 10 | 10 | 10 |
| Créatine [mM] | 10 | 10 | 10 | 10 |
| Taurine [mM] | 20 | 20 | 20 | 20 |
| Glucose [mM] | 10 | 10 | 10 | 10 |
| MgCl2 [mM] | 1 | 1 | 1 | 1 |
| Adénosine [mM] | 5 | 5 | 5 | 5 |
| L-Carnitine [mM] | 2 | 2 | 2 | 2 |
| CaCl2 [mM] | 1 | - | 0.1 | 0.1 |
| Na-Heparin [UI/L] | 5000 | - | - | - |
| EGTA [mM] | - | 0.096 | ||
| Collagenase type 2, 315 U/mg [g/L] | - | - | 0.6 | - |
| Protéase XIV [g/L] | - | - | 0.03 | - |
| Album de sérum bovin [%] | - | - | - | 0.5 |
| Osmolarité [mOsmol/L] | 325 à 5 | 345 à 5 | 345 à 5 | 345 à 5 |
Tableau 2 : Solutions pour l’isolement CM.
- Ajuster toutes les solutions à pH 7,4 à 37 oC et vérifier l’osmolarité.
REMARQUE : Dissoudre les enzymes (Collagenase type 2 et Protease XIV) directement avant l’excision cardiaque. Oxygénez toutes les solutions avant utilisation.
2. Préparation de la configuration Langendorff-perfusion
REMARQUE : La configuration utilisée est faite sur mesure. Comme le montre la figure 2,la configuration se compose de trois réservoirs en veste d’eau (1-3), d’un échangeur de chaleur en contre-courant en spirale (4) et d’un récipient de perfusion veste à l’eau (5).

Figure 2 : Installation Langendorff-perfusion optimisée pour l’isolement des cellules de lapin. (1-3) Réservoirs vestes d’eau avec (1) solution saline physiologique, (2) faible calcium, solution de potassium élevée et (3) solution cardioplégique contenant des enzymes. (4) Échangeur de chaleur à contre-courant en spirale et (5) réservoir de collecte de vestes d’eau. L’afflux du système de veste d’eau est l’échangeur de chaleur en spirale (température des solutions laissant la canule perfusion à la fin de l’échangeur de chaleur devrait être constante à 37 oC), suivie par le vaisseau de perfusion et les trois réservoirs. Toutes les solutions sont oxygénées (ligne pointillée). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
- Allumez la pompe du bain d’eau pour faire circuler l’eau à 38 oC dans le système d’échange de chaleur et préchauffer toutes les solutions à 37 oC.
REMARQUE : La température à l’écoulement de (4) doit être contrôlée et constante à 37 oC. - Remplissez les trois réservoirs avec la solution respective et lavez chaque ligne (noir) avec la solution correspondante. Remplissez la ligne principale (bleue) à la fin sans bulles d’air à l’aide de la solution (1).
REMARQUE : Oxygénez les solutions avant (10 min) et pendant l’utilisation. Remplissez la ligne du réservoir (3) au robinet avec une solution de potassium faible en calcium et élevée. - Préparer une suture pour attacher le cœur autour de l’aorte à la canule.
3. Isolement cellulaire
- Préparer les seringues suivantes.
- Pour la sédation/anesthésie : Mélanger 0,5 ml/kg d’hydrochlorure d’es kétamine de poids corporel (25 mg/mL) et 0,2 mL/kg de poids corporel xylazine hydrochlorure (2 %).
- Remplissez deux seringues de 12 ml de solution NaCl (0,9 %).
- Préparer 6 ml de 12,5 mg/mL Na-thiopental, dissous dans une solution NaCl de 0,9 %.
- Remplir 0,2 ml d’hydrochlorure d’esé kétamine (25 mg/ml) dans une seringue.
- Diluer 0,2 mL de Na-heparine (5 000 UI/mL) dans 1 mL de solution NaCl de 0,9 % (concentration finale 1 000 UI/mL).
- Lapins sédatifs/anesthésiés (9-10 semaines, lapin blanc néo-zélandais, femelle ou mâle, 2 kg) par injection intramusculaire d’hydrochlorure d’esketamine et d’hydrochlorure de xylazine (étape 3.1.1).
REMARQUE : Les lapins ont besoin d’au moins 10 minutes pour être entièrement anesthésiés; la durée exacte dépend de leur poids corporel. Confirmer l’anesthésie avec la perte du réflexe de redressement. - Rasez la poitrine et les oreilles où se trouvent les veines.
- Insérez une canule flexible dans la veine de l’oreille, fixez-la avec du ruban adhésif et rincer avec une solution NaCl de 0,9 %.
- Injectez 1 ml de solution Na-heparin par voie intraveineuse et rincer avec une solution NaCl de 0,9 %.
- Injecter 0,2 ml d’hydrochlorure d’esécaminamine, rincer à nouveau avec une solution NaCl de 0,9 % et injecter Na-thiopental jusqu’à l’apnée.
REMARQUE : Le lapin ne doit pas répondre au réflexe de retrait de la pédale. - Ouvrez la poitrine sur le côté gauche et retirez le péricarde.
- Commencez la minuterie lorsque le cœur est excisé et lavez le cœur deux fois en solution saline physiologique.
REMARQUE : Utilisez des ciseaux avec des pointes rondes pour prévenir les dommages accidentels au tissu cardiaque. - Cannulate l’aorte dans un bain avec solution saline physiologique et garder tous les tissus en solution. Allumez le système Langendorff-perfusion (solution saline physiologique (1), vitesse 24 mL/min).
- Transférer le cœur à la configuration Langendorff-perfusion, relier l’aorte à la buse perfusée, et attacher étroitement le cœur avec la suture autour de l’aorte à la canule (lt; 1 min).
REMARQUE : Pré-remplir la canule avec une solution saline physiologique, assurez-vous qu’aucune bulle d’air n’entre dans la canule pendant le transport du site de cannulation à la configuration langendorff, connectez sans bulle. - Perfusez le cœur jusqu’à ce que tout le sang soit lavé (2-3 min).
- Passez à une solution de potassium faible en calcium (2). Perfuse pendant 2 minutes de plus après que le cœur a cessé de battre et passer à la solution enzymatique.
- Commencez à recirculer la solution enzymatique, après 2 minutes à partir du début de la digestion, de nouveau dans le réservoir. Réduisez la vitesse à 16 ml/min après 5 min de digestion.
- Lorsque le tissu apparaît mou (40-50 min de digestion), couper le cœur de la canule et séparer le ventricule gauche.
- Relâchez les cellules par dissociation mécanique (en tirant doucement le tissu avec une pipette et un forceps fin pour tenir le tissu) dans la solution de blocage.
- Filtrer la suspension cellulaire à l’égard d’un maillage (taille de pore de 1 mm2)et d’une centrifugeuse pendant 2 min à 22 x g (accélération gravitationnelle).
- Retirez le supernatant contenant des non-myocytes et re-suspendez CM dans la solution de blocage.
4. Culturing de CM
REMARQUE : Effectuez les étapes suivantes dans des conditions stériles.
- Dilute Laminin (de la membrane de sous-sol de sarcome murine Engelbreth-Holm-Swarm, 1 mg/mL) 1:10 en saline tamponnée de phosphate stérile (sans Ca2'/Mg2 ')à une concentration finale de 100 g/mL.
- Préparer le milieu de la culture en M199-Medium avec les suppléments comme indiqué dans le tableau 3.
| Milieu de culture cellulaire en M199-Medium | |
| Créatine [mM] | 5 |
| Hydrochlorure L-Carnitine [mM] | 2 |
| Taurine [mM] | 5 |
| Na-Pyruvat [mM] | 1 |
| Insuline (pancréas bovin) [U/L] | 0.25 |
| Cytosine-D-arabinofuranoside [mM] | 0.01 |
| Gentamycine [mg/mL] | 0.05 |
Tableau 3 : Milieu de culture cellulaire.
- Solution de filtre stérile (0,22 m) et ajouter 5 % de sérum bovin fœtal.
- Pour les expériences de pinces automatiques autoclave couvrelips 16 mm, épaisseur no 0, les enrober de 100 g/mL laminine directement avant la culture.
- Pour les expériences en fibre de carbone, enrober la surface du plat Petri de poly(2-hydroxyethyl méthacrylate) (poly-HEMA, 0,12 g/mL en 95:5 EtOH:H20) et laisser se solidifier.
REMARQUE : Les cellules ne collent pas aux plats Petri enrobés de poly-HEMA ; ceci est crucial pour leur contraction sans friction dans les études de mécanique cellulaire. - Après la suspension de CM (10-15 min), retirez le supernatant, puis suspendez CM dans le milieu de culture.
- Comptez CM avec une chambre Neubauer et une graine à une densité cible de 17 500 cellules/mL soit sur des housses enduites de stratifiés, soit dans des plats Petri recouverts de poly-HEMA.
- Incuber les cellules à 37 oC, 5% de CO2 pendant 3-4 heures. Échanger le milieu (37 oC) des cellules ensemencées coverlip.
- Ajoutez le codage de l’adénovirus (type 5) pour GtACR1-eGFP à une multiplicité d’infection (MOI) de 75 et commencez des expériences fonctionnelles après 48 heures.
REMARQUE : Après la transduction, gardez les cellules dans l’obscurité. Utilisez l’éclairage rouge lorsque vous travaillez avec des protéines bleues ou vertes activées par la lumière. Un système de livraison adénovirrielle disponible dans le commerce (voir Tableau des matériaux) est utilisé pour cloner les gènes codant GtACR1-eGFP dans le vecteur adénoviral. L’insertion d’intérêt, ici GtACR1-eGFP, est amplifiée PCR puis combinée avec un vecteur adénoviroral comprenant un promoteur CMV dans une réaction de clonage IN-Fusion. Le promoteur CMV (cytomégalovirus humain) est couramment utilisé pour conduire la surexpression des transgènes dans les cellules des mammifères. eGFP est une protéine fluorescente verte améliorée dérivée d’Aequorea victoria avec un maximum d’excitation de 488 nm et un maximum d’émission à 507 nm. L’adénovirus (type 5) a été produit à l’extérieur à Charité-Universitàtsmedizin Berlin, Institut f’r Pharmakologie, Berlin, Prof. Dr. Michael Schupp.
CAUTION : La transduction adénovirorale est classée comme un travail de niveau de sécurité BSL-2, et des mesures de sécurité appropriées sont légalement requises.
5. Expériences fonctionnelles
REMARQUE : Les enregistrements sont effectués à l’aide d’un microscope à fluorescence inversé. Filtrer la lumière de transmission par un filtre à pas de bande rouge (630/20 nm) dans le condenseur pour éviter la co-activation de GtACR1.
-
Configuration patch-clamp
- Utilisez un amplificateur en combinaison avec un convertisseur analogique-numérique. Utilisez un logiciel d’acquisition de données pour enregistrer les données actuelles et de tension (voir Tableau des matériaux).
REMARQUE : Les données enregistrées sont numérisées à 10 kHz et filtrées à 5 kHz.
- Utilisez un amplificateur en combinaison avec un convertisseur analogique-numérique. Utilisez un logiciel d’acquisition de données pour enregistrer les données actuelles et de tension (voir Tableau des matériaux).
-
Configuration de fibre de carbone
- Utilisez une caméra pour détecter la position de la fibre de carbone et la longueur du sarcome en suivant les changements de contraste optique (les fibres de carbone apparaissent comme des structures plus sombres, superposées sur le modèle de cellules striées). Une représentation schématique de la configuration est indiquée dans la figure 3.
REMARQUE : La longueur du sarcomère est calculée en temps réel à l’aide d’une transformation fourier rapide (FFT) du spectre de puissance du modèle de striation.
- Utilisez une caméra pour détecter la position de la fibre de carbone et la longueur du sarcome en suivant les changements de contraste optique (les fibres de carbone apparaissent comme des structures plus sombres, superposées sur le modèle de cellules striées). Une représentation schématique de la configuration est indiquée dans la figure 3.

Figure 3 : Schéma illustrant la configuration expérimentale pour les mesures de la fibre de carbone. (Le dessin n’est pas à l’échelle). Deux fibres de carbone sont fixées sur une cellule et leur position est contrôlée par un positioneur de piezo. Le pacer est utilisé pour la stimulation électrique du champ. Les LED multicolores sont couplées au port d’épifluorescence du microscope inversé pour l’éclairage des cellules dans le plan de l’objet. La puissance LED est contrôlée via une boîte de contrôle dédiée, qui reçoit des impulsions numériques via la sortie numérique du convertisseur numérique-analogique (DAC). Le CAD communique par sortie analogique avec l’interface du système de fluorescence. Un appareil photo en noir et blanc (774 pixels par 245 lignes) pour l’imagerie cellulaire est connecté à l’ordinateur pour suivre la longueur du sarcome et la flexion de la fibre de carbone. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
- Illumination chronométrée
- Fournir de la lumière pour la microscopie de fluorescence et l’activation des canaux ion ion à la lumière via une boîte de commande LED sur mesure externe, comprenant trois LED de couleur différente (460 nm, 525 nm, 640 nm, voir Tableau des matériaux).
- Modifier le code microcontrôleur et utilisateur graphique (GUI) pour la boîte de contrôle pour permettre le contrôle de la LED via des impulsions externes Time to Live (TTL), générées dans les protocoles logiciels d’acquisition de données (voir Tableau des matériaux). Transmettez les impulsions TTL à la boîte de commande LED par l’intermédiaire du convertisseur numérique-analogique.
- Conduisez la LED et choisissez le nombre d’impulsions via l’interface graphique. Lors de la réception de la commande de l’INTERFACE, le microcontrôleur commence un processus sur un nouveau noyau. Dans ce processus, l’entrée TTL ainsi qu’un jeu de commutateur de commande de l’interface graphique seront vérifiés en permanence.
- Lorsque l’entrée TTL est positive, le microcontrôleur allume la LED, puis reprend la vérification de l’entrée TTL. Une fois que le signal TTL revient à zéro, le microcontrôleur éteint la LED et réduit le nombre d’impulsions laissées par un. Si, à un moment donné, le commutateur de commande est faux ou si le nombre d’impulsions est nul, le microcontrôleur arrête ce processus jusqu’à ce qu’une nouvelle commande soit reçue de l’interface graphique.
- Couplez directement les LED dans le support arrière du microscope.
- Détermination de l’intensité lumineuse dans le plan objet
- Mesurer la zone illuminée à l’image d’un micromètre de scène (grossissement objectif 40x, A à 0,8 mm2).
- Utilisez un compteur de puissance optique (voir Tableau des matériaux).
- Définir les paramètres des expériences : longueur d’onde d’excitation (525 nm), grossissement objectif (40x), filtre d’excitation (530/20 nm) ou miroir, et lire la puissance lumineuse [W] à diverses tensions LED-entrée.
- Calculez l’intensité lumineuse [W/mm2] en divisant la puissance lumineuse [W] par la zone illuminée [mm2] (ici : 0,8 mm2).
REMARQUE : Mesurez la puissance réelle de la lumière avec les protocoles respectifs à l’étape 5.6 pour vérifier si les durées courtes d’impulsion lumineuse de 10 ms atteignent et les longues durées détiennent la valeur définie(figure supplémentaire 1).
- Préparation pour les expériences patch-clamp
- Préparer les solutions externes et internes suivantes(tableau 4; pour les besoins en eau voir le tableau 1).
- Ajuster l’osmolarité avec du glucose à 300 à 5 mOsmol/L. Aliquot la solution interne et conserver à -20 oC.
REMARQUE : Gardez la solution interne sur la glace pour le jour de l’enregistrement. Gardez la solution externe à température ambiante. Les solutions de correction décrites ici ont été basées sur des solutions précédemment utilisées et le Cl- concentration a été changée pour abaisser, plus physiologique niveaux7. Pour la caractérisation de la sélectivité des ions de l’actionneur optogénétique respectif, nous suggérons de varier les concentrations d’ions majeurs (par exemple, Cl-,Na, K,H-) dans les solutions extra- et intracellulaires19. - Enlevez l’électrode d’enregistrement du support de pipette et retirez la couche de chlorure d’argent du fil d’argent avec du papier de verre très fin.
REMARQUE : Faites cette étape au début de chaque journée de mesure. - Connectez le fil au poteau positif d’une batterie de 1,5 V et immerger dans la solution KCl de 3 M pour le revêtement de chlorure d’argent pendant 10 min.
REMARQUE : Le poteau négatif est relié à un fil d’argent de référence immergé dans la solution KCl de 3 M. - Préparer la chambre de mesure : mettre de la graisse de silicium sur le cadre de la chambre de mesure et placer un coverlip (diamètre : 50 mm, épaisseur no 0) sur le dessus du cadre que la chambre est scellée.
- Mettez une électrode de granule argent/argent-chlorure de référence dans le bain et connectez-la à l’étape de tête.
- Tirer 1,7 à 2,5 M ' pipettes patch de capillaires en verre de lime de soude (diamètre extérieur: 1,55 mm, diamètre intérieur: 1,15 mm) avec un puller micropipette (voir Tableau des matériaux).
- Démarrer le logiciel d’acquisition de données et ajuster le test de membrane (impulsion 10 mV pour 15 ms, base 0 mV).
| Solution de bain externe | Solution de pipette interne | |
| NaCl [mM] | 140 | - |
| KCl [mM] | 5.4 | 11 |
| CaCl2 [mM] | 1 | - |
| MgCl2 [mM] | 2 | 2 |
| Glucose [mM] | 10 | - |
| HEPES [MM] | 10 | 10 |
| K-Aspartate [mM] | - | 119 |
| Mg-ATP [mM] | - | 3 |
| EGTA [mM] | - | 10 |
| Ph | 7.4 (NaOH) | 7.2 (KOH) |
| Osmolarité (ajuster avec glucose) [mOsmol/L] | 300 à 5 | 300 à 5 |
Tableau 4 : Solutions Patch-clamp.
- Protocoles pour les mesures de correction-clamp
- Enregistrez le protocole de photoactivation en mode V-clamp à un potentiel de retenue de -74 mV. Utilisez des impulsions légères de 300 ms.
REMARQUE : Nous suggérons d’effectuer des enregistrements de V-clamp près du potentiel de membrane de repos de CM cultivé (établi dans I-clamp; dans nos mains entre -79 mV et -77 mV à la fois pour transduire et non-transduire CM19). Les cellules fraîchement isolées présentent un potentiel moyen de membrane de repos de -79 mV(figure supplémentaire 2, toutes valeurs après correction pour le potentiel de jonction liquide). - Enregistrer AP en mode I-clamp à 0 pA.
- Pour le rythme électrique, injecter des impulsions actuelles de 10 ms (rampe de 0 pA à la valeur définie dans 10 ms), 0,25 Hz et trouver le seuil pour obtenir AP. Enregistrement AP par injections actuelles de 50% de plus que le seuil.
- Pour le rythme optique utiliser des impulsions légères de 10 ms, 0,25 Hz à l’intensité minimale de la lumière pour obtenir AP fiable.
- Enregistrer la photoinhibition en mode I-clamp à 0 pA. Obtenir AP comme décrit dans l’étape 5.6.2.1 et appliquer la lumière soutenue pour 64 s à 4 mW/mm2 après 15 AP déclenché électriquement.
REMARQUE : La figure 6F montre un protocole de photoinhibition où, pendant la lumière soutenue, des injections actuelles plus élevées sont appliquées. À partir de 1,5 fois le seuil (ici: 0,7 nA) le courant injecté a été augmenté en étapes de 0,1 nA (niveau final: 2,2 nA). À toutes les amplitudes actuelles testées, l’application de lumière soutenue inhibait la génération d’AP.- Comme une expérience de contrôle, pause stimulation électrique pour 64 s sans application de lumière.
- Enregistrez le protocole de photoactivation en mode V-clamp à un potentiel de retenue de -74 mV. Utilisez des impulsions légères de 300 ms.
- Expériences patch-clamp
REMARQUE : Effectuez les expériences suivantes dans l’obscurité (la lumière rouge peut être utilisée pour les outils électriques/verts).- Placer le coverlip avec des cellules dans la chambre de mesure avec la solution externe et sélectionnez CM fluorescent.
REMARQUE : les cellules eGFP-positives peuvent être détectées à l’aide d’une LED bleue (460 nm) en combinaison avec un filtre d’excitation de passage de bande (450 nm - 490 nm), un miroir dichroïque de 510 nm et un filtre d’émission de 515 nm de long-pass. Si d’autres balises fluorescentes sont utilisées, utilisez des ensembles de filtres LED et fluorescence correspondants. Si une efficacité de transduction élevée est atteinte (entre nos mains -99% avec l’adénovirus GtACR1), il n’est pas nécessaire de vérifier la fluorescence eGFP avant les expériences fonctionnelles; cela évite la pré-activation gtACR1 potentielle. - Remplissez la pipette de patch avec la solution interne. Assurez-vous qu’il n’y a pas de bulles d’air dans la pointe.
- Attachez la pipette au support de la pipette, en insérant le fil argenté-chlorure enduit d’argent dans la solution interne.
- Après avoir atteint la configuration fixée par les cellules, passez en mode cellule entière dans le logiciel d’acquisition de données avec un potentiel de détention de -74 mV. Rupture de la membrane en appliquant doucement une pression négative pour accéder à la configuration de toute la cellule. Ceci est indiqué par une augmentation immédiate de la capacitance mesurée.
- Exécuter les protocoles décrits à l’article 5.6.
- Placer le coverlip avec des cellules dans la chambre de mesure avec la solution externe et sélectionnez CM fluorescent.
- Technique de fibre de carbone
- Produire des fibres de carbone.
- Utilisez des capillaires en verre avec les paramètres suivants : diamètre extérieur : 2,0 mm, diamètre intérieur : 1,16 mm, longueur : 100 mm (voir tableau des matériaux). À l’aide d’un pulleur de micropipette, tirez le capillaire en verre dans deux pipettes de la même longueur (longueur totale de 11 mm, figure 5) à un diamètre intérieur final de 30 m.
REMARQUE : Les paramètres utilisés pour la première et la deuxième traction sont de 85,2 % (proportion à la production maximale du pulleur) et de 49,0 %, respectivement (dépendront de l’attraction, du type et de l’âge du filament). - Pliez les pipettes jusqu’à 45 degrés avec une micro forge autodidragée à l’aide de réglages de 12 V, 24 A (voir la figure 4 pour plus de détails sur la configuration de flexion de la pipette).
- Alignez le capillaire (2) sur la ligne rouge dans le cercle d’orientation (5), maintenez le positionnement de la constante capillaire de sorte que la longueur de la partie de courbure soit toujours la même après le centre du cercle d’orientation (rayon de 4,5 mm).
- Plier le capillaire jusqu’à 45 degrés (ligne verte) en poussant vers le bas la pointe du capillaire avec le bender (3) et forger en chauffant le filament (4) jusqu’à ce que le capillaire capture l’angle de 45 degrés, même après que le bender est enlevé.
- Mettre les fibres de carbone (fournies par le professeur Jean-Yves Le Guennec) dans la pointe fine du capillaire de verre sous un microscope stéréo. Utilisez de fines forceps avec des tubes mous à la fin pour augmenter l’adhérence et diminuer le risque d’endommager les fibres.
REMARQUE : Ces fibres sont caractérisées par des microstructures, qui augmentent la surface de contact entre les fibres et les cellules, améliorant ainsi l’adhérence20. - Couper les fibres de carbone à une longueur de 2 mm et utiliser de la colle super (cyanoacrylate) pour fixer la fibre à la partie avant du capillaire.
REMARQUE : Plus les fibres sont longues, plus elles se plient à l’application de la même force.
- Utilisez des capillaires en verre avec les paramètres suivants : diamètre extérieur : 2,0 mm, diamètre intérieur : 1,16 mm, longueur : 100 mm (voir tableau des matériaux). À l’aide d’un pulleur de micropipette, tirez le capillaire en verre dans deux pipettes de la même longueur (longueur totale de 11 mm, figure 5) à un diamètre intérieur final de 30 m.
- Calibrer les fibres de carbone.
- Calibrer les fibres de carbone à l’aide d’un transducteur de force avec une sensibilité de 0,05 mN/V et une plage de force de 0 à 0,5 mN (voir Tableau des matériaux).
REMARQUE : Cette configuration est faite sur mesure afin de mesurer la compression au lieu de « tirer ». - Attachez le capillaire avec la fibre de carbone à un support qui est contrôlé par un micromanipulateur et un moteur de piezo.
- Placez la pointe de la fibre en contact avec le capteur de force, mais sans produire de force et déplacez le moteur piezo sur des marches de 10 m (mouvement total de 60 m) vers le capteur et lisez la tension mesurée (E) dans Volt.
REMARQUE : Assurez-vous que le transducteur de force est contacté par la pointe même de l’extrémité libre de la fibre de carbone. - Répétez ces mesures trois fois.
- Utilisez la Formule 1 pour calculer la force pour chaque position de piezo
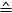 (différence de tension mesurée entre les marches du moteur piezo) :
(différence de tension mesurée entre les marches du moteur piezo) :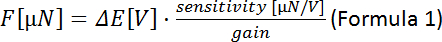
REMARQUE : La sensibilité du transducteur de force dépend du modèle du transducteur (ici : 0,05 mN/V , 50 N/V). Le gain peut être fixé au contrôleur. - Tracez la force [N] contre la position piezo. La pente correspond à la rigidité des fibres [N/m].
- Calibrer les fibres de carbone à l’aide d’un transducteur de force avec une sensibilité de 0,05 mN/V et une plage de force de 0 à 0,5 mN (voir Tableau des matériaux).
- Force record de contractage CM.
REMARQUE : Effectuez les expériences suivantes dans l’obscurité (la lumière rouge peut être utilisée pour les outils bleus/verts activés par la lumière).- Enrober la surface de la chambre de mesure de poly-HEMA. Remplissez la chambre de mesure avec la solution extérieure de bain et mettez quelques gouttes de la suspension de cellule cultivée dans la chambre (étape 4.9).
- Attachez les capillaires avec des fibres de carbone au micromanipulateur de scène. Sélectionnez GtACR1-exprimant CM en vérifiant la capacité d’induire des contractions par l’application de courtes impulsions de feu vert. Alignez les fibres de carbone près horizontalement à la surface de la chambre de mesure.
- Abaissez la première fibre sur la surface cellulaire. Attachez la deuxième fibre parallèle à la première fibre à l’autre extrémité du CM. L’alignement idéal est quasi-perpendiculaire à l’axe cellulaire.
REMARQUE : Attachez la fibre en poussant doucement la cellule à la surface inférieure. Relâchez la pression avant d’attacher la deuxième fibre. Ne pas étirer la cellule en attachant la deuxième fibre. - Après que les deux fibres sont attachées sur la cellule, soulevez les fibres, de sorte que la cellule n’a plus de contact avec la surface de la chambre et est capable de se contracter sans aucune friction.
- Concentrez les sarcombres dans le logiciel d’acquisition de données (voir Tableau des matériaux) et définissez la fenêtre de suivi de la longueur du sarcomère(figure 7A I (3)) entre les fibres.
REMARQUE : Le spectre d’alimentation FFT résultant(figure 7A I (2)) montre idéalement un pic pointu, représentant la longueur moyenne du sarcome. - Suivre la flexion des fibres à l’aide du module de détection des bords. Réglez les zones de détection avec la fenêtre rouge et verte et définissez un seuil (ligne horizontale rouge et verte) au premier dérivé de la trace d’intensité lumineuse(figure 7A III).
- Commencez à rythmer optiquement la cellule à 0,25 Hz (si possible, essayez des rythmes plus rapides) et suivez la longueur du sarcome et la flexion des fibres.
REMARQUE : La position du support de fibre, la gâchette LED et les impulsions de stimulation électrique sont contrôlées par l’intermédiaire du logiciel d’acquisition de données (voir Tableau des matériaux). - Après avoir enregistré au moins 15 contractions optiquement obtenues, stimuler le champ électriquement (voir Tableau des matériaux). Trouvez le seuil pour obtenir des contractions et enregistrer en appliquant 1,5 fois de la tension seuil.
- Pour le protocole d’inhibition, appliquer des stimuli électriques pour provoquer des contractions, puis exposer à une lumière soutenue de 64 s (à diverses intensités lumineuses).
- Produire des fibres de carbone.

Figure 4 : Configuration de flexion de Pipette. (1) Le micromanipulateur sur le côté gauche est utilisé pour contrôler la position du capillaire, et un deuxième micromanipulateur à droite est utilisé pour le plier. (2) Capillaire. (3) Bender. (4) Microforge. (5) Cercle d’orientation. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 5 : Pipette à la fibre de carbone. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
6. Analyse des données
-
Enregistrements patch-clamp
REMARQUE : Corriger toutes les tensions enregistrées et de commande pour le potentiel de jonction liquide après l’expérience. Déterminer le potentiel de jonction liquide dans le logiciel d’acquisition de données en utilisant la calculatrice potentielle de jonction d’outils (pour les solutions de pinces à patch déclarées dans le tableau 4: 14,4 mV à 21 oC). Soustrayez le potentiel de jonction liquide de la tension enregistrée/commande.- Pour les enregistrements AP I-clamp, vérifiez le rythme électrique par rapport au rythme optique. Calculer la durée AP (APD) à 20 et 90% de repolarisation avec un script écrit sur mesure (Matériel supplémentaire). Déterminer le potentiel de membrane au repos et l’amplitude AP.
REMARQUE : Déterminer l’APD tel que décrit dans Wang K. et coll.21 Le script pour charger les fichiers .abf est généralement accessible via le lien suivant : https://de.mathworks.com/matlabcentral/fileexchange/22114-fcollman-abfload. Valeurs moyennes de DPA pour au moins 6 AP. - Pour la photoactivation de V-clamp, vérifiez si la ligne de base est à 0 pA. Si ce n’est pas ajuster la ligne de base à zéro. Analyser le courant enregistré déclenché par des impulsions de lumière de 300 ms à -74 mV. Transférez les données au logiciel d’analyse de données et déterminez le courant stationnaire de pointe et moyen.
- Pour les enregistrements AP I-clamp, vérifiez le rythme électrique par rapport au rythme optique. Calculer la durée AP (APD) à 20 et 90% de repolarisation avec un script écrit sur mesure (Matériel supplémentaire). Déterminer le potentiel de membrane au repos et l’amplitude AP.
-
Expériences sur la fibre de carbone
- Enregistrements de contraction pendant le rythme optique : Chargez les données enregistrées dans le logiciel d’acquisition de données et lisez la ligne de base et les maxima de la flexion de la fibre de carbone et des changements de longueur de sarcomere.
REMARQUE : Valeurs moyennes pour 10 contractions d’un enregistrement stable. - Mesurer la largeur de la cellule et calculer la zone transversale de la cellule en supposant une section elliptique(figure 7B II).
REMARQUE: La formule pour la zone d’une ellipse est A -a’b (Formule 2) où a est la distance du centre au sommet et b est la distance entre le centre et le co-vertex. Dans notre cas, cela signifie un '(largeur de la cellule)/2 et b '(épaisseur de la cellule)/2. Selon Nishimura et coll.22, l’épaisseur de CM peut être estimée à un tiers de la largeur cellulaire de sorte que A (1/2) (1/2) d’épaisseur (1/4) (1/3) (1/12) largeur2. - Calculer la force systolique (F) :
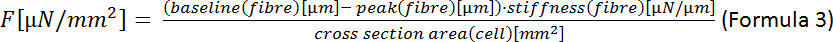
- Calculer la déformation des cellules systoliques (DSE) :
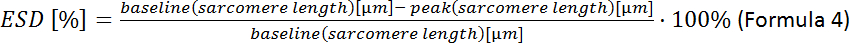
REMARQUE : D’autres paramètres contractuels peuvent être analysés : longueur du sarcome au repos, temps de pointe, décalage à 90%, raccourcissement fractionnaire du sarcome, vitesse maximale de contraction et relaxation (voir manuel d’acquisition de logiciels).
- Enregistrements de contraction pendant le rythme optique : Chargez les données enregistrées dans le logiciel d’acquisition de données et lisez la ligne de base et les maxima de la flexion de la fibre de carbone et des changements de longueur de sarcomere.
Résultats
GtACR1-eGFP a été exprimé dans le lapin cultivé CM(insert de la figure 6) et les photocurrents ont été mesurés avec la technique de correction-pince. La photoactivation de GtACR1 montre de grands courants dirigés vers l’intérieur à -74 mV. Dans la figure 6Un courant de pointe (IP) à 4 mW/mm2 est de 245 pA. AP ont été déclenchés électriquement(figure 6B) ou optiquement (figure 6C) avec des injections actuelles 1,5 fois le seuil, ou de courtes impulsions lumineuses dépolarisantes de 10 ms, respectivement. En analysant les valeurs apD, le CM au rythme électrique montre un AD 20 de 0,24 à 0,08 s et un APA 90 de 0,75 à 0,17 s, considérant que le CM au rythme optique montre un AD 20 de 0,31 à 0,08 s et un AD 90 de 0,81 à 0,19 s (SE, n - 5, N et 2, dans l’exemple présenté ici APD 20électrique - 0,17 s; APD 20optique 0,27 s et APD 90électrique - 0,61 s; APD 90optique 0,68 s; Figure 6D). Le CM au rythme optique montre un début AP plus lent (figure 6D). L’activation de CM a été inhibée sur l’éclairage soutenu (pour 64 s, 4 mW/mm2) en polarisant le potentiel de membrane vers le potentiel d’inversion du chlorure, ici -58 mV(figure 6E). Des injections actuelles plus élevées que 1,5 fois le seuil n’obtiennent pas la génération AP(figure 6F). Les forces de pointe générées ont été déterminées à partir de la flexion de la fibre de carbone(figure 7B,C,E). Le CM a généré 232 N/mm2 sur le rythme électrique(figure 7B) et 261 N/mm2 suivant le rythme optique(figure 7C). Les impulsions de lumière verte prolongée inhibent les contractions(figure 7E). Après l’inhibition optique de 64 s, les contractions récurrentes génèrent une force contractile plus faible, et les valeurs de force se rétablissent vers la ligne de base après 10 contractions (rythme à 0,25 Hz, figure 7D) en accord avec la perte de calcium diastolique du lapin CM.
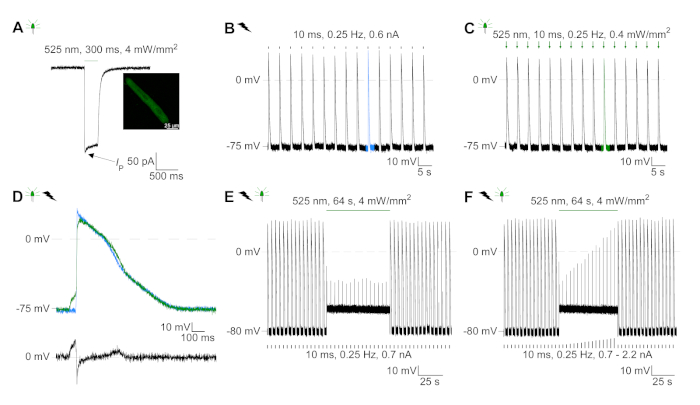
Figure 6 : Enregistrements représentatifs de pinces à patchs de CM au rythme électrique et optique. (A) Représentant photocurrent à -74 mV en utilisant une impulsion légère de 300 ms, 4 mW/mm2. IP indique le courant de pointe. L’insert montre une cellule positive GtACR1-eGFP. (B) Représentant AP enregistrement à 0 pA en utilisant une rampe actuelle de 10 ms, 0,6 nA pour rythme électriquer le CM. (C) Représentant AP enregistrement à 0 pA en utilisant des impulsions légères de 10 ms, 0,4 mW /mm2. (D) Graphique supérieur montre la superposition de la 10e AP de CM électriquement (bleu) et optique (vert) activé. AP ont été alignés par le changement maximal du potentiel de membrane (dV/dt max). Graphique en bas montre la différence de potentiel de membrane entre optiquement et électriquement déclenché AP (Eoptique-Eélectrique). (E) AP déclenché électriquement ont été inhibés sous une lumière soutenue de 64 s, 4 mW/mm2. (F) AP sont inhibés par des injections actuelles plus élevées que 1,5 fois le seuil (de 0,7 nA dans les étapes de 0,1 nA à 2,2 nA) sous une lumière soutenue. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
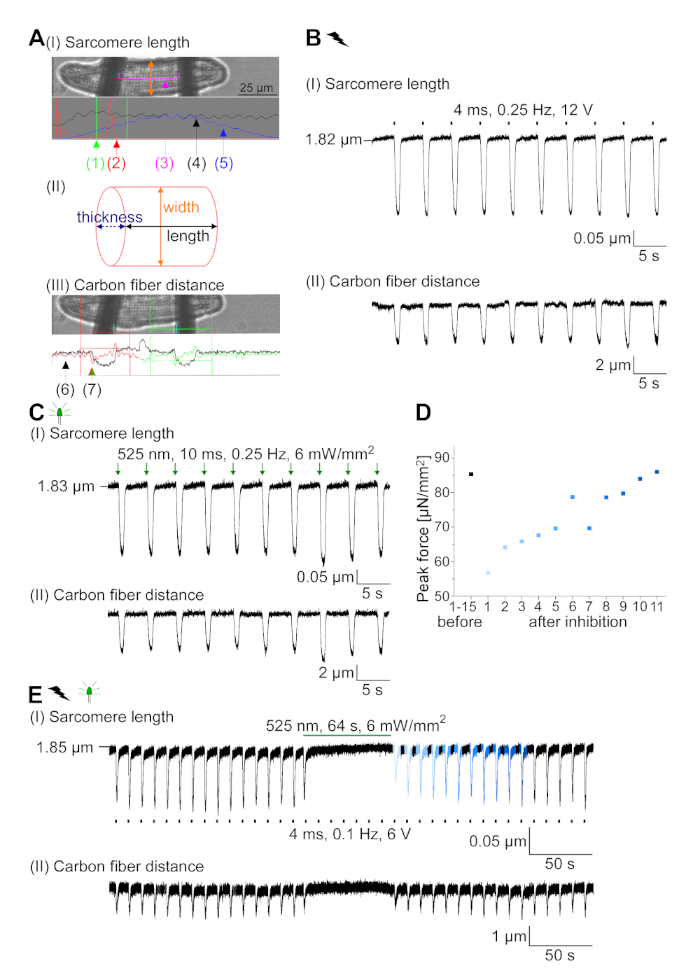
Figure 7 : Données représentatives des enregistrements en fibre de carbone de CM optiquement et électriquement rythmées/inhibées. (A) Afficher dans le logiciel d’acquisition de données. Image (I) montre le CM mesuré avec la fenêtre pour calculer la longueur du sarcome. La largeur cellulaire est étiquetée en orange. (1) Gamme de fréquences pertinentes. (2) Le spectre d’alimentation FFT montre la fréquence de l’espacement du sarcome sur la cellule. La longueur moyenne du sarcome est calculée à partir de la fréquence de pointe. (3) Fenêtre de suivi de longueur sarcomere. (4) Trace d’intensité. (5) La trace d’intensité multipliée par une fenêtre Hamming est la trace d’intensité vitrée. Schéma (II) montre la section elliptique de la cellule. Largeur en orange et épaisseur en bleu pointillé. Image (III) montre la position des fibres de carbone avec les boîtes de détection respectives, laissées en rouge et à droite en vert. (6) Trace d’intensité. (7) Premier dérivé de la trace d’intensité (voir manuel de logiciel d’acquisition de données). (B) Trace représentative des contractions obtenues électriquement. Le panneau (I) montre le raccourcissement de longueur de sarcomere, panneau (II) la distance entre les deux fibres de carbone. (C) Trace représentative des contractions optiquement obtenues (525 nm, 0,25 Hz, 10 ms, 6 mW/mm2). Le panneau (I) montre le raccourcissement de longueur de sarcomere, panneau (II) la distance entre les deux fibres de carbone. (D) A généré la force de pointe de la contraction 1 à 11 après une pause causée par l’inhibition de la génération AP. (E) Trace représentative de l’inhibition optique des contractions sous éclairage soutenu (525 nm, 64 s, 6 mW/mm2). Le panneau (I) montre le raccourcissement de longueur de sarcomere, panneau (II) la longueur entre les deux fibres de carbone. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
| Un | Zone |
| ACR (ACR) | canal d’anion |
| Ap | potentiel d’action |
| APD | durée potentielle d’action |
| Ufc | unité de formation de colonies |
| Chr | canalrhodopsine |
| Cm | cardiomyocyte |
| EGFP (en) | protéines fluorescentes vertes améliorées |
| Esd | déformation de cellules systoliques fin |
| Ue | unités d’endotoxine |
| F | Force |
| Fft | rapide Fourier transformer |
| GtACR (En anglais) | Guillardia theta anion channelrhodopsin |
| Gui | interface utilisateur graphique |
| I-clamp | actuelle-serra |
| Ui | unités internationales |
| MOI (en) | multiplicité d’infection |
| poly-HEMA | poly(2-hydroxéthyle méthacrylate) |
| V-clamp | tension-clamp |
Tableau 5 : Liste des abréviations.

Figure supplémentaire 1 : Mesures de l’intensité lumineuse avec compteur de puissance optique. (A) Mesure de 10 légumineuses légères à 4 mW/mm2. (B) Mesure de l’éclairage soutenu de 64 s à 4 mW/mm2. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
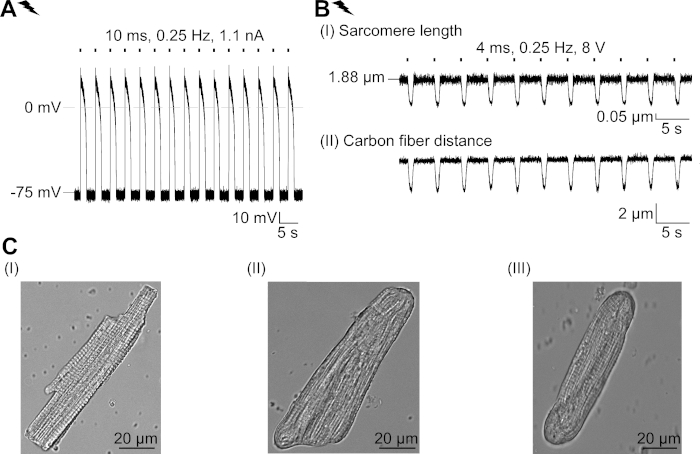
Figure supplémentaire 2 : Propriétés de CM fraîchement isolées et leur adaptation structurelle en culture. (A) AP enregistrement d’un CM fraîchement isolé (APD 20 de 1,11 à 0,34 s, APD 90 de 1,96 à 0,32 s, n - 7, N et 2). Potentiel moyen de membrane de repos de -79,3 à 0,8 mV (n ' 7, N ' 2). (B) Enregistrement en fibre de carbone d’un CM fraîchement isolé au rythme électrique. Moyenne force maximale de 205 à 78 N/mm2 (n - 7, N et 2). (C) Images confocales d’un CM fraîchement isolé (I); CM non traduit (II) et transducteur (III) après 48 heures de culture. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Matériel supplémentaire : script MatLab pour déterminer le potentiel de la DPA et de la membrane au repos. S’il vous plaît cliquez ici pour télécharger ce fichier.
Discussion
Alors que les outils optogénétiques permettent la modulation de l’électrophysiologie cellulaire excitable d’une manière non invasive, ils ont besoin d’une caractérisation approfondie dans différents types de cellules (par exemple, CM) pour permettre de choisir le meilleur outil disponible pour une conception expérimentale spécifique. La technique de la pince de correction est une méthode standard pour évaluer l’électrophysiologie cellulaire. Dans la configuration de toute la cellule, il permet d’enregistrer des courants photo-activés à travers la membrane plasmatique ou des changements temporels dans la tension de membrane suivant la stimulation/inhibition de la lumière. La manipulation optogène de l’excitation électrique affecte également les contractions de CM. Nous utilisons le suivi du sarcomère et les mesures de force assistées en fibre de carbone pour quantifier les effets de l’interrogatoire optique sur l’activité mécanique des myocytes.
Nous décrivons un protocole pour caractériser les effets de base d’un canal de chlorure à la lumière, GtACR1, en CM. En tant que système modèle, nous avons choisi le lapin CM, comme leurs caractéristiques électrophysiologiques (p. ex., forme AP et période réfractaire) ressemblent à celles observées chez le CM humain plus étroitement que le CM de rongeur. En outre, le lapin CM peut être cultivé pendant plusieurs jours, assez longtemps pour la livraison adénovirrielle et l’expression de GtACR1-eGFP. Notamment, CM isolé changer leurs propriétés structurelles dans la culture au fil du temps, y compris l’arrondissement des terminaisons cellulaires et la perte progressive de la lutte croisée, T-tubular système et caveolae23,24. Dans cette lignée, des altérations fonctionnelles ont été signalées dans CM cultivé : dépolarisation du potentiel de membrane de repos, prolongation de l’AP et changements dans la manipulation cellulaire ca2MD. Pour examen des adaptations cellulaires dans la culture, s’il vous plaît voir Louch et coll.25. La figure 2 supplémentaire montre des mesures exemplaires de l’AP et de la contraction de CM fraîchement isolées pour la comparaison avec celles observées dans le CM cultivé(figure 6, figure 7) en utilisant le protocole présenté ici.
Les enregistrements de pinces à cellules entières permettent des mesures directes des propriétés photocurrentes (p. ex., amplitudes et cinétique) et des changements induits par la lumière dans le potentiel membranaire ou les caractéristiques d’AP à haute résolution temporelle. Cependant, ces enregistrements ont plusieurs limites: Tout d’abord, le cytosol est remplacé par la solution pipette dans les enregistrements à cellules entières, ce qui est avantageux pour contrôler les gradients électrochimiques ioniques, mais a le désavantage intrinsèque de lavage des organites cellulaires, protéines et autres composés, affectant ainsi potentiellement les réponses électriques cellulaires. Deuxièmement, les effets secondaires comme l’activation de canaux ion supplémentaires résultant d’une dépolarisation non physiologiquement longue (p. ex., des constantes de temps lent des canaux ion ion élégés) sont difficiles à évaluer car notre méthode ne permet qu’à détecter les changements dans la DPA, mais pas à effectuer des mesures directes des concentrations ioniques dans les compartiments cellulaires électrophysioologiquement pertinents. Cela pourrait se faire avec des indicateurs fluorescents (p. ex. capteurs Ca2MD) ou des électrodes ion-sélectives. D’autres caractérisations peuvent inclure des titrations d’intensité lumineuse, la détermination de la dépendance au pH, la cinétique photocurrente à différents potentiels de membrane, et la cinétique de récupération pendant la stimulation répétitive de lumière.
Contrairement aux enregistrements de pinces à correction, les mesures de force à cellule unique permettent l’analyse des contractions cellulaires des myocytes intacts sans affecter leur milieu intracellulaire. Les effets secondaires sur les concentrations d’ions (p. ex., Ca2MD)peuvent être évalués indirectement en déterminant l’amplitude et la dynamique générées de force (p. ex., vitesse maximale de contraction et de relaxation; ici non analysées). Les mesures de force avec la technique de fibre de carbone ont un avantage sur les cellules de passation de marchés librement car elles fournissent des informations directes sur les forces passives et actives dans les cellules préchargées (c.-à-d. dans des conditions qui sont plus semblables aux milieux in situ ou in vivo). Le préchargement mécanique est particulièrement important lors de l’analyse de la contractilité cellulaire, car l’étirement affecte la production de force et la relaxation26,27.
Les approches optogénétiques permettent une manipulation spatiotemporally précise du potentiel de membrane cellulaire, à la fois dans le CM unique et le tissu cardiaque intact. Classiquement, ChR2, un canal non sélectif de cation à la lumière, a été employé pour la dépolarisation du potentiel de membrane, tandis que les pompes de proton et/ou de chlorure à propulsion légère ont été employées pour l’hyperpolarisation de membrane. Les deux groupes d’actionneurs optogénétiques exigent des niveaux d’expression élevés, car ChR2 est caractérisé par une conductance à canal unique intrinsèquement faible28 et des pompes à éclairage transportent au maximum un ion par photon absorbé. En outre, l’activation prolongée de ChR2 dans CM peut conduire àla surcharge na et/ou Ca2MD, et les pompes à éclairage peuvent changer leH trans-sarcolemmal ou cl- gradients29,30. À la recherche d’outils alternatifs pour le contrôle optogénétique de l’activité CM, nous avons récemment testé le canal d’anion naturel GtACR1, caractérisé par une conductance supérieure d’un seul canal et une sensibilité de lumière plus élevée par rapport à la cation ChR comme ChR2. Nous avons constaté que l’activation de GtACR1 dépolarise CM et peut être utilisée pour le rythme optique et l’inhibition, selon le calendrier et la durée de l’impulsion lumineuse. Un avantage supplémentaire de l’utilisation de l’ACR au lieu de cation ChR pourrait être le potentiel d’inversion plus négatif de Cl- par rapport à Na-, réduisant artificiellement introduit les courants d’ions. Comme nous l’avons déjà montré, le rythme optique avec GtACR1 peut conduire à la prolongation AP en raison de la composante lente de la fermeture du canal GtACR1, qui pourrait être surmontée en utilisant plus rapide GtACR1 mutants19. Cependant, la prolongation d’AP est beaucoup moins prononcée lors de l’utilisation d’une C cl intracellulaire plus faible et plus physiologique- concentration (voir la figure 6). En outre, l’inhibition à médiation GtACR1 par une illumination prolongée entraîne une dépolarisation profonde de la membrane, qui pourrait encore une fois activer l’afflux secondairede Na et Ca2, modifiant ainsi l’activité des canaux tension-fermés. Dans nos mesures, nous constatons que l’AP et les paramètres de contraction se rétablissent à la ligne de base dans les 40 s après une inhibition induite par la lumière pendant 1 min (voir Kopton et al. 2018, figure 6, figure 7). Les canaux Ket K légèrement fermés offrent une alternative puissante pour faire taire le CM sans affecter le potentiel de la membrane de reposCM 31.
À l’avenir, nous aimerions comparer quantitativement différents outils optogénétiques pour leur potentiel d’inhiber l’activité cardiaque. À cette fin, nous testons une variété de canaux d’ions ion à la lumière, y compris les variantes ACR, ChR2 et ChR32,ainsi que des actionneurs hyperpolarisants tels que l’halorhodopsine ou la lumière fermée cyclase d’adénylylique bPAC en combinaison avec le canal de potassium SthK (PAC-K)31.
Le protocole présenté ici peut être utilisé pour la caractérisation en profondeur des propriétés électromécaniques de CM. Il s’applique principalement aussi à LA CM d’autres espèces, et à CM isolé du myocarde malade. La stimulation optique permet de rythmer CM à différentes fréquences, et différentes précharges peuvent être testées lors d’expériences de contraction de la fibre de carbone. Une expérience intéressante serait d’utiliser l’éclairage de basse intensité pour la dépolarisation de subthreshold, pour imiter l’augmentation graduelle du potentiel de membrane de repos, comme on peut l’observer pendant le développement du tissu cardiaque remodelant pendant la progression de la maladie. Enfin, des mesures fonctionnelles pourraient être combinées à l’imagerie Ca2MD pour mieux comprendre le couplage de la contraction de l’excitation, ou avec des interventions pharmacologiques pour évaluer les effets de différents médicaments sur l’activité cm.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Stefanie Perez-Feliz pour son excellente assistance technique, Dr. Jonas Wietek (Humboldt-University, Berlin, Allemagne) pour la fourniture du pUC57-GtACR1 plasmide, Prof. Dr. Michael Schupp (Charité-Universit-tsmedizin Berlin, Institut f’r Pharmakologie, Berlin) pour la production d’adénovirus et le Dr Anastasia Khokhlova (Université fédérale de l’Oural) pour le partage de son expertise pour améliorer le protocole d’isolement cellulaire et de re-conception de la configuration de la pipette. Le projet a été financé par la Fondation allemande de la recherche (SPP1926: SCHN 1486/1-1; Bourse Emmy-Noether : SCHN1486/2-1) et l’ERC Advanced Grant CardioNECT.
matériels
| Name | Company | Catalog Number | Comments |
| Equipment - Cell isolation/Culturing/Transduction | |||
| Adeno-X Adenoviral System 3 CMV | TaKaRa, Clontech Laboratories, Inc., Mountain View, California, USA | ||
| Aortic cannula | Radnoti | 4.8 OD x 3.6 ID x 8-9 L mm | |
| Coverslips ø 16 mm, Thickness No. 0 | VWR International GmbH, Leuven, Belgium | 631-0151 | Borosilicate Glass |
| Griffin Silk, Black, 2 m Length, Size 3, 0.5 mm | Samuel Findings, London, UK | TSGBL3 | |
| Incubator | New Brunswick, Eppendorf, Schönenbuch, Switzerland | Galaxy 170S | |
| Langendorff-perfusion set-up | Zitt-Thoma Laborbedarf Glasbläserei, Freiburg, Germany | Custom-made | |
| Langendorff-pump | Ismatec, Labortechnik-Analytik, Glattbrugg-Zürich, Switzerland | ISM444 | |
| Mesh: Nylon Monodur filter cloth | Cadisch Precision Meshes Ltd | 800 µm holes, 1 m wide | |
| Neubauer chamber | VWR International GmbH, Leuven, Belgium | 717806 | |
| Rabbit, New Zealand White | Charles River | Strain Code: 052 | |
| Scissors | Aesculap AG, Tuttlingen, Germany | BC774R | Bauchdeckenschere ger. 18cm |
| Sterile filter, 0.22 µm | Merck, Darmstadt, Germany | SLGP033RB | |
| Equipment - Patch-clamp | |||
| Amplfier | AxonInstruments, Union City, CA, United States | Axopatch 200B | |
| Coverslip ø 50 mm, Thickness No. 1 | VWR International GmbH, Leuven, Belgium | 631-0178 | Borosilicate Glass |
| Digitizer Axon Digidata | Molecular Devices, San José, CA, United States | 1550A | |
| Filter (530/20) | Leica Microsystems, Wetzlar, Germany | 11513878 | BZ:00 |
| Filter (630/20) | Chroma Technology, Bellows Falls, Vermont, United States | 227155 | |
| Headstage | AxonInstruments, Union City, CA, United States | CV203BU | |
| Interface | Scientifica, Uckfield, UK | 1U Rack, 352036 | |
| LED 525 nm | Luminus Devices, Sunnyvale, CA, United States | PT-120-G | |
| LED control software | Essel Research and Development, Toronto, Canada | ||
| LED control system | custom-made | ||
| Micropipette Puller | Narishige Co., Tokyo, Japan | PP-830 | |
| Microscope inverted | Leica Microsystems, Wetzlar, Germany | DMI4000B | |
| Motorised Micromanipulator | Scientifica, Uckfield, UK | PatchStar | |
| Optical power meter | Thorlabs, Newton, NJ, United States | PM100D | |
| Silicone Grease | RS Components, Corby, UK | 494-124 | |
| Silver wire | A-M Systems, Sequim, WA, United States | 787500 | Silver, Bare 0.015'', Coated 0.0190'', Length 25 Feet |
| Soda lime glass capillaries | Vitrex Medical A/S, Vasekaer, Denmark | 160213 BRIS, ISO12772 | 1.55 OD x 1.15 ID x 75 L mm |
| Software Axon pClamp | Molecular Devices, San José, CA, United States | Version 10.5 | |
| Software MatLab2017 | The MathWorks, Inc. | ||
| Stage micrometer | Graticules Optics LTD, Tonbridge, UK | 1 mm | |
| Equipment - Carbon fiber | |||
| Carbon fibers | provided from Prof. Jean-Yves Le Guennec | BZ:00 | |
| Digitizer Axon Digidata | Molecular Devices, Sunnyvale, CA, United States | 1550B | |
| Filter (530/20) | Leica Microsystems, Wetzlar, Germany | 11513878 | |
| Filter (630/20) | Chroma Technology, Bellows Falls, Vermont, United States | 227155 | |
| Fluorescence System Interface | IonOptix, Milton, MA United States | FSI-800 | 2.0 OD x 1.16 ID x 100 L mm |
| Force Transducer System | Aurora Scientific Inc., Ontario, Canada | 406A | |
| Glass capillaries for force measurements | Harvard Apparatus, Holliston, Massachusetts, United States | GC200F-10 | |
| Interface National Instruments | National Instruments, Budapest, Hungary | BNC-2110 | |
| LED 525 nm | Luminus Devices, Sunnyvale, CA, United States | PT-120-G | |
| LED control box | Essel Research and Development, Toronto, Canada | ||
| LED control system | custom-made | ||
| Microcontroller | Parallax Inc., Rocklin, California, United States | Propeller | |
| Micropipette Puller | Narishige Co., Tokyo, Japan | PC-10 | |
| Microscope inverted | Leica Microsystems, Wetzlar, Germany | DMI4000B | |
| MyoCam-S camera | IonOptix, Dublin, Ireland | ||
| MyoCam-S camera Power | IonOptix, Milton, MA, United States | MCS-100 | |
| MyoPacer Field Stimulator | IonOptix Cooperation, Milton, MA, United States | MYP100 | |
| Piezo Motor | Physik Instrumente (PI) GmbH & Co. KG, Karlsruhe, Germany | E-501.00 | |
| Silicone Grease | RS Components, Corby, UK | 494-124 | |
| Software Axon pClamp | Molecular Devices, San José, CA, United States | Version 10.5 | |
| Software IonWizard | IonOptix, Dublin, Ireland | Version 6.6.10.125 | |
| Software MatLab2017 | The MathWorks, Inc. | ||
| Stage micrometer | Graticules Optics LTD, Tonbridge, UK | 1 mm | |
| Chemicals | |||
| Adenosine | Sigma-Aldrich, St. Louis, Missouri, United States | A9251-100G | |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, Missouri, United States | A7030-50G | |
| CaCl2 | Honeywell Fluka, Muskegon, MI, USA | 21114-1L | |
| L-Carnitine hydrochloride | Sigma-Aldrich, St. Louis, Missouri, United States | C9500-25G | |
| Collagenase type 2, 315 U/mg | Worthington, Lakewood, NJ, USA | LS004177 | |
| Creatine | Sigma-Aldrich, St. Louis, Missouri, United States | C0780-50G | |
| Cytosine-β-D-arabinofuranoside | Sigma-Aldrich, St. Louis, Missouri, United States | C1768-100MG | |
| EGTA | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 3054.3 | |
| Esketamine hydrochloride, Ketanest S 25 mg/mL | Pfizer Pharma PFE GmbH, Berlin, Germany | PZN-07829486 | |
| Fetal Bovine Serum | Sigma-Aldrich, St. Louis, Missouri, United States | F9665 | |
| Gentamycin 50 mg/mL | Gibco, Life Technologies, Waltham, MA, USA | 15750-037 | |
| Glucose | Sigma-Aldrich, St. Louis, Missouri, United States | G7021-1KG | |
| Heparin-Sodium, 5,000 IU/mL | Braun Melsungen AG, Melsungen, Germany | PZN-03029843 | |
| HEPES | Sigma-Aldrich, St. Louis, Missouri, United States | H3375-1KG | |
| Insulin (bovine pancreas) | Sigma-Aldrich, St. Louis, Missouri, United States | I6634-50MG | |
| K-aspartate | Sigma-Aldrich, St. Louis, Missouri, United States | A6558-25G | |
| KCl | VWR International GmbH, Leuven, Belgium | 26764.260 | 1 mg/mL |
| KOH | Honeywell Fluka, Muskegon, MI, USA | 35113-1L | |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma-Aldrich, St. Louis, Missouri, United States | L2020-1MG | |
| M199-Medium | Sigma-Aldirch, St. Louis, Missouri, United States | M4530 | |
| Mg-ATP | Sigma-Aldrich, St. Louis, Missouri, United States | A9187-1G | |
| MgCl2 | Sigma-Aldrich, St. Louis, Missouri, United States | 63069-500ML | |
| NaCl | Fisher Scientific, Loughborough, Leics., UK | 10428420 | |
| NaCl-Solution 0.9%, Isotone Kochsalz-Lösung 0.9% | Braun Melsungen AG, Melsungen, Germany | 3200950 | |
| NaOH | AppliChem GmbH, Darmstadt, Germany | A6579 | without Ca2+/Mg2+ |
| Na-pyruvat | Sigma-Aldrich, St. Louis, Missouri, United States | P2256-100MG | |
| Phosphate Buffered Saline | Sigma-Aldrich, St. Louis, Missouri, United States | D1408-500ML | |
| Poly(2-hydroxyethyl methacrylate) | Sigma, Poole, UK | 192066 | |
| Protease XIV from Streptomyces griseus | Sigma-Aldrich, St. Louis, Missouri, United States | P5147-1G | |
| Taurine | Sigma-Aldrich, St. Louis, Missouri, United States | T0625-500G | |
| Thiopental Inresa 0.5 g | Inresa Arzneimittel GmbH, Freiburg, Germany | PZN-11852249 | |
| Xylazine hydrochloride, Rompun 2% | Bayer Vital GmbH, Leverkusen, Germany | PZN-01320422 |
Références
- Harz, H., Hegemann, P. Rhodopsin-regulated calcium currents in Chlamydomonas. Nature. 351, 489-491 (1991).
- Litvin, F. F., Sineshchekov, O. A., Sineshchekov, V. A. Photoreceptor electric potential in the phototaxis of the alga Haematococcus pluvialis. Nature. 271, 476-478 (1978).
- Nagel, G., et al. Channelrhodopsin-1: A Light-Gated Proton Channel in Green Algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
- Lozier, R. H., Bogomolni, R. A., Stoeckenius, W. Bacteriorhodopsin: a light-driven proton pump in Halobacterium Halobium. Biophysical journal. 15 (9), 955-962 (1975).
- Schobert, B., Lanyi, J. K. Halorhodopsin is a light-driven chloride pump. Journal of Biological Chemistry. 257 (17), 10306-10313 (1982).
- Inoue, K., et al. A light-driven sodium ion pump in marine bacteria. Nature Communications. 4, 1678 (2013).
- Han, X., et al. A High-Light Sensitivity Optical Neural Silencer: Development and Application to Optogenetic Control of Non-Human Primate Cortex. Frontiers in Systems Neuroscience. 5, 18 (2011).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Grimm, C., Silapetere, A., Vogt, A., Bernal Sierra, Y. A., Hegemann, P. Electrical properties, substrate specificity and optogenetic potential of the engineered light-driven sodium pump eKR2. Scientific Reports. 8, 9316 (2018).
- Wietek, J., et al. Conversion of channelrhodopsin into a light-gated chloride channel. Science. 344 (6182), 409-412 (2014).
- Berndt, A. Structure-Guided Transformation. Science. 344 (6182), 420-424 (2014).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Mohamed, G. A., et al. Optical inhibition of larval zebrafish behaviour with anion channelrhodopsins. BMC Biology. 15 (1), 103 (2017).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic Neuronal Silencing in Drosophila during Visual Processing. Scientific Reports. 7, 13823 (2017).
- Govorunova, E. G., Cunha, S. R., Sineshchekov, O. A., Spudich, J. L. Anion channelrhodopsins for inhibitory cardiac optogenetics. Scientific Reports. 6, 33530 (2016).
- Kopton, R. A., et al. Cardiac Electrophysiological Effects of Light-Activated Chloride Channels. Frontiers in Physiology. 9, 1806 (2018).
- Peyronnet, R., et al. Load-dependent effects of apelin on murine cardiomyocytes. Progress in Biophysics and Molecular Biology. 130, 333-343 (2017).
- Wang, K., et al. Cardiac tissue slices: preparation, handling, and successful optical mapping. American Journal of Physiology-Heart and Circulatory Physiology. 308 (9), 1112-1125 (2015).
- Nishimura, S., et al. Single cell mechanics of rat cardiomyocytes under isometric, unloaded, and physiologically loaded conditions. American Journal of Physiology-Heart and Circulatory Physiology. 287 (1), 196-202 (2004).
- Mitcheson, J. S., Hancox, J. C., Levi, A. J. Action potentials, ion channel currents and transverse tubule density in adult rabbit ventricular myocytes maintained for 6 days in cell culture. Pflugers Archiv European Journal of Physiology. 43 (6), 814-827 (1996).
- Burton, R. A. B., et al. Caveolae in Rabbit Ventricular Myocytes: Distribution and Dynamic Diminution after Cell Isolation. Biophysical Journal. 113 (5), 1047-1059 (2017).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in cardiomyocyte isolation, culture, and gene transfer. Journal of Molecular and Cellular Cardiology. 51 (3), 288-298 (2011).
- Janssen, P. M., Hunter, W. C. Force, not sarcomere length, correlates with prolongation of isosarcometric contraction. The American Journal of Physiology. 269 (2), 676-685 (1995).
- Monasky, M. M., Varian, K. D., Davis, J. P., Janssen, P. M. L. Dissociation of force decline from calcium decline by preload in isolated rabbit myocardium. Pflugers Archiv European Journal of Physiology. 456 (2), 267-276 (2008).
- Kleinlogel, S., et al. Ultra light-sensitive and fast neuronal activation with the Ca 2+-permeable channelrhodopsin CatCh. Nature Neuroscience. 14 (4), 513-518 (2011).
- Schneider-Warme, F., Ravens, U. Using light to fight atrial fibrillation. Cardiovascular Research. 114 (5), 635-637 (2018).
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature. 463 (7277), 98-102 (2010).
- Bernal Sierra, Y. A., et al. Potassium channel-based optogenetic silencing. Nature Communications. 9 (1), 4611 (2018).
- Oda, K., et al. Crystal structure of the red light-activated channelrhodopsin Chrimson. Nature Communications. 9 (1), 3949 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon