Method Article
Evaluación electromecánica de la actividad de cardiomiocitos moduladas optogenéticamente
En este artículo
Resumen
Presentamos un protocolo para evaluar los efectos electromecánicos de la activación de GtACR1 en cardiomiocitos de conejo. Proporcionamos información detallada sobre el aislamiento celular, el cultivo y la transducción adenoviral, y sobre experimentos funcionales con las técnicas de abrazadera de parche y fibra de carbono.
Resumen
En las últimas dos décadas, las herramientas optogenéticas se han establecido como medios potentes para modular la actividad específica del tipo celular en los tejidos excitables, incluido el corazón. Mientras que Channelrhodopsin-2 (ChR2) es una herramienta común para despolarizar el potencial de membrana en cardiomiocitos (CM), potencialmente provocando potenciales de acción (AP), una herramienta eficaz para el silenciamiento confiable de la actividad de CM ha faltado. Se ha sugerido utilizar aniones canalrhodopsins (ACR) para la inhibición optogenética. Aquí, describimos un protocolo para evaluar los efectos de la activación del ACR GtACR1 natural de Guillardia theta en conejo cultivado CM. Las lecturas primarias son grabaciones electrofisiológicas de abrazaderas de parche y seguimiento óptico de las contracciones de CM, ambas realizadas mientras se aplican diferentes patrones de estimulación de la luz. El protocolo incluye aislamiento CM del corazón del conejo, sembración y cultivo de las células durante un máximo de 4 días, transducción a través de la codificación de adenovirus para el canal de cloruro cerrado a la luz, preparación de configuraciones de abrazaderas de parche y fibra de carbono, recopilación y análisis de datos. El uso de la técnica de abrazadera de parche en la configuración de células enteras permite grabar corrientes activadas por la luz (en modo de abrazadera de voltaje, abrazadera en V) y AP (modo de abrazadera de corriente, I-clamp) en tiempo real. Además de los experimentos con abrazaderas de parches, realizamos mediciones de contractilidad para la evaluación funcional de la actividad de CM sin alterar el entorno intracelular. Para ello, las células se precargan mecánicamente utilizando fibras de carbono y las contracciones se registran mediante el seguimiento de los cambios en la longitud del sarcomere y la distancia de la fibra de carbono. El análisis de datos incluye la evaluación de la duración de AP a partir de grabaciones de abrazaderas I, corrientes máximas de grabaciones de abrazadera en V y cálculo de fuerza a partir de mediciones de fibra de carbono. El protocolo descrito se puede aplicar a las pruebas de efectos biofísicos de diferentes actuadores optogenéticos en la actividad de CM, un requisito previo para el desarrollo de una comprensión mecanicista de experimentos optogenéticos en tejido sorcardíaco y corazones enteros.
Introducción
Las fotocorrientes mediadas por ChR se registraron por primera vez en la mancha ocular de las algas verdes unicelulares1,2. Poco después de la clonación genética y la expresión heteróloga de Chlamydomonas reinhardtii ChR1 y ChR2, se utilizaron ChR como herramientas para alterar el potencial de membrana en los ovocitos de Xenopus y las células de mamíferos por la luz3,4. Cación chR no selectivo despolarizar la membrana de las células con un potencial de membrana en reposo que es negativo al potencial de inversión de ChR. Por lo tanto, se pueden utilizar para obtener AP en células excitables, incluyendo neuronas y CM, permitiendo el ritmo óptico5,6.
Complementarios a la cación ChR, protones accionados por la luz, bombas de cloruro y sodio7,8,9 se han utilizado para inhibir la actividad neuronal10,11,12. Sin embargo, estos últimos tienen limitaciones, que requieren altas intensidades de luz e iluminación sostenida, ya que un ion se transporta por fotón absorbido. En 2014, dos estudios independientes de Wietek et al. y Berndt et al. describieron la conversión de ChR conductor catiónico en ACR a través de mutaciones en el poro del canal13,14. Un año más tarde, el ACR natural fue descubierto en el criptofito Guillardia theta (GtACR)15. Como el ACR de ingeniería mostró conductividad catiónica residual, fueron reemplazados por ACR natural, caracterizado por una gran conductancia de un solo canal y alta sensibilidad a la luz15. GtACR se utilizaron para silenciar la actividad neuronal polarizando el potencial de membrana hacia el potencial de reversión del cloruro16,17. Govorunova et al. aplicaron GtACR1 a la rata cultivada ventricular CM y mostraron fotoinhibición eficiente a niveles de intensidad de luz bajos que no eran suficientes para activar las herramientas de inhibición previamente disponibles, como la bomba de protones Arch18. Nuestro grupo informó recientemente que la fotoinhibición mediada por GtACR1 de CM se basa en la despolarización y que GtACR1 también se puede utilizar, por lo tanto, para el ritmo óptico de CM19.
Aquí, presentamos un protocolo para estudiar los efectos electrofisiológicos y mecánicos de la fotoactivación GtACR1 en el cm ventricular del conejo cultivado. Primero describimos el aislamiento celular, el cultivo y la transducción. Los efectos electrofisiológicos se miden utilizando grabaciones de abrazaderas de parche de células enteras. Las corrientes mediadas por luz a una tensión de membrana determinada se evalúan en modo de abrazadera en V. La dinámica del potencial de membrana se mide mientras se pisa eléctrica u ópticamente CM (modo I-clamp). La inhibición óptica de AP activado eléctricamente se prueba utilizando una aplicación de luz sostenida. Los efectos mecánicos se miden utilizando fibras de carbono en combinación con el seguimiento basado en imágenes de la longitud del sarcomere. Para ello, las células ópticamente pacebles se precargan mecánicamente mediante la fijación de dos fibras de carbono a la membrana plasmática cerca de los extremos de las células opuestas. Los cambios en la longitud de Sarcomere se registran durante el ritmo óptico o eléctrico. Finalmente, la fotoinhibición se mide durante la estimulación eléctrica del campo de las células, y se analizan las fuerzas generadas.
El protocolo incluye los siguientes pasos que se muestran en el diagrama de flujo en la Figura 1:anestesia profunda de conejo, inyección de sobredosis tiopental, escisión cardíaca, digestión de langendorff y tejido, disociación mecánica del tejido para liberar células, análisis microscópico del rendimiento de CM, cultivo de CM, transducción con adenovirus tipo 5, seguido de incubación y experimentos funcionales.

Figura 1: Diagrama de flujo del protocolo utilizado para obtener CM eléctrica y ópticamente paceble. Los corazones se extirpan de conejos de 9-10 semanas de edad, y el tejido cardíaco se digiere mientras se perfunde usando una configuración de Langendorff. Las células se liberan por agitación mecánica. El rendimiento CM se cuenta bajo un microscopio. CM son cultivados, transducidos con adenovirus tipo 5 y los experimentos funcionales se realizan 48-72 horas después de la transducción. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Todos los experimentos con conejos se llevaron a cabo de acuerdo con las directrices establecidas en la Directiva 2010/63/UE del Parlamento Europeo sobre la protección de los animales utilizados con fines científicos y aprobados por las autoridades locales de Baden-Wurtemberg (Regierungspr-sidium Freiburg, X-16/10R, Alemania).
1. Soluciones para el aislamiento celular
- Preparar las soluciones para el aislamiento celular con agua de los siguientes requisitos (Tabla 1) y de acuerdo con las composiciones iónicas enumeradas en la Tabla 2.
NOTA: CaCl2 y MgCl2 se añaden a partir de soluciones de stock de 1 M.
| Requisitos de agua | |
| Conductividad [S/cm] a 25oC | 0.055 |
| Pirógeno [EU/mL] | < 0.001 |
| Partícula (tamaño > 0,22 m) [1/mL] | N.o 1 |
| Carbono orgánico total [ppb] | < 5 |
| Microorganismos [CFU/mL] | N.o 1 |
| RNase [ng/mL] | < 0.01 |
| DNase [ng/mL] | < 4 |
Tabla 1: Requisitos de agua.
| Solución salina fisiológica (1) | Baja solución de calcio y potasio alta (2) | Solución enzimática (3) | Solución de bloqueo | |
| NaCl [mM] | 137 | 137 | 137 | 137 |
| KCl [mM] | 4 | 14 | 14 | 14 |
| HEPES [mM] | 10 | 10 | 10 | 10 |
| Creatina [mM] | 10 | 10 | 10 | 10 |
| Taurina [mM] | 20 | 20 | 20 | 20 |
| Glucosa [mM] | 10 | 10 | 10 | 10 |
| MgCl2 [mM] | 1 | 1 | 1 | 1 |
| Adenosina [mM] | 5 | 5 | 5 | 5 |
| L-carnitina [mM] | 2 | 2 | 2 | 2 |
| CaCl2 [mM] | 1 | - | 0.1 | 0.1 |
| Na-Heparina [IU/L] | 5000 | - | - | - |
| EGTA [mM] | - | 0.096 | ||
| Colagenasa tipo 2, 315 U/mg [g/L] | - | - | 0.6 | - |
| Proteasa XIV [g/L] | - | - | 0.03 | - |
| Albúmina sérica bovina [%] | - | - | - | 0.5 |
| Osmolaridad [mOsmol/L] | 325 x 5 | 345 x 5 | 345 x 5 | 345 x 5 |
Tabla 2: Soluciones para el aislamiento de CM.
- Ajustar todas las soluciones a pH 7,4 a 37 oC y comprobar la osmolaridad.
NOTA: Disolver las enzimas (Colagenasa tipo 2 y Proteasa XIV) directamente antes de la escisión cardíaca. Oxigenar todas las soluciones antes de su uso.
2. Preparación de la configuración de perfusión de Langendorff
NOTA: La configuración utilizada está hecha a medida. Como se muestra en la Figura 2,la configuración consta de tres depósitos con camisa de agua (1-3), un intercambiador de calor de contraflujo espiral (4) y un recipiente de perfusión con camisa de agua (5).

Figura 2: Configuración de perfusión de Langendorff optimizada para el aislamiento de células de conejo. (1-3) Reservorios con revestimiento de agua con (1) solución salina fisiológica, (2) solución cardiopléjica baja en calcio, alta solución de potasio y (3) solución cardiopléjica que contiene enzimas. (4) Intercambiador de calor de contraflujo espiral y (5) tanque de recogida con camisa de agua. La entrada del sistema con camisa de agua es el intercambiador de calor en espiral (la temperatura de las soluciones que salen de la cánula de perfusión al final del intercambiador de calor debe ser constante a 37 oC), seguido del recipiente de perfusión y los tres depósitos. Todas las soluciones están oxigenadas (línea discontinua). Haga clic aquí para ver una versión más grande de esta figura.
- Encienda la bomba del baño de agua para hacer circular el agua a 38 oC en el sistema de intercambio de calor y precaliente todas las soluciones a 37 oC.
NOTA: La temperatura a la salida de (4) debe ser controlada y constante a 37 oC. - Llenar los tres depósitos con la solución respectiva y lavar cada línea (negro) con la solución correspondiente. Llene la línea principal (azul) al final sin burbujas de aire utilizando la solución (1).
NOTA: Oxigene las soluciones antes (10 min) y durante el uso. Llene la línea desde el depósito (3) hasta el grifo con baja solución de calcio y potasio alto. - Prepara una sutura para atar el corazón alrededor de la aorta en la cánula.
3. Aislamiento celular
- Prepare las siguientes jeringas.
- Para sedación/anestesia: Mezclar 0,5 ml/kg de clorhidrato de esketamina de peso corporal (25 mg/ml) y 0,2 ml/kg de clorhidrato de xilazina de peso corporal (2%).
- Llene dos jeringas con 12 ml de solución de NaCl (0,9%).
- Preparar 6 ml de 12,5 mg/ml de Na-tiopental, disuelto en 0,9% de solución de NaCl.
- Llene 0,2 ml de clorhidrato de esketamina (25 mg/ml) en una jeringa.
- Diluir 0,2 ml de Na-heparina (5.000 UI/ml) en 1 ml de 0,9% de solución de NaCl (concentración final 1.000 UI/ml).
- Seda/anestesia conejos (9-10 semanas, Conejo blanco de Nueva Zelanda, hembra o macho, 2 kg) mediante inyección intramuscular de clorhidrato de esketamina e hidrocloruro de xilazina (paso 3.1.1).
NOTA: Los conejos necesitan al menos 10 minutos para ser completamente anestesiados; la duración exacta depende de su peso corporal. Confirme la anestesia con la pérdida del reflejo de retorce. - Afeitar el pecho y las orejas donde se encuentran las venas.
- Inserte una cánula flexible en la vena del oído, arréjela con cinta adhesiva y lávela con una solución NaCl al 0,9%.
- Inyectar 1 ml de solución de Na-heparina por vía intravenosa y enjuague con 0,9% de solución de NaCl.
- Inyectar 0,2 ml de clorhidrato de esketamina, lavar de nuevo con 0,9% de solución de NaCl e inyectar Na-thiopental hasta la apnea.
NOTA: El conejo no debe responder al reflejo de retirada del pedal. - Abra el pecho en el lado izquierdo y retire el pericardio.
- Inicie el temporizador cuando el corazón esté extirpado y lave el corazón dos veces en solución salina fisiológica.
NOTA: Use tijeras con puntas redondas para evitar daños accidentales en el tejido cardíaco. - Cannute la aorta en un baño con solución salina fisiológica y mantenga todo el tejido en solución. Encienda el sistema de perfusión de Langendorff (solución salina fisiológica (1), velocidad 24 ml/min).
- Transfiera el corazón a la configuración de perfusión de Langendorff, conecte la aorta a la boquilla perfundida y ate firmemente el corazón con la sutura alrededor de la aorta a la cánula (< 1 min).
NOTA: Prellene la cánula con solución salina fisiológica, asegúrese de que no entren burbujas de aire en la cánula durante el transporte desde el sitio de la cánula a la configuración de Langendorff, conecte sin burbujas. - Perfumar el corazón hasta que toda la sangre se lave (2-3 min).
- Cambie a una solución de alto nivel de calcio y potasio (2). Perpeto durante 2 minutos más después de que el corazón haya dejado de latir y cambie a solución enzimática.
- Empezar a recircular la solución enzimática, después de 2 minutos desde el inicio de la digestión, de nuevo en el depósito. Disminuir la velocidad a 16 ml/min después de 5 min de digestión.
- Cuando el tejido parezca blando (40-50 min de digestión), corte el corazón de la cánula y separe el ventrículo izquierdo.
- Liberar las células por disociación mecánica (desmontar suavemente el tejido con una pipeta y un fórceps fino para sujetar el tejido) en la solución de bloqueo.
- Filtrar la suspensión celular a través de una malla (tamaño de los poros de 1 mm2) y centrífuga durante 2 min a 22 x g (aceleración gravitacional).
- Retire el sobrenadante que contenga no miocitos y vuelva a suspender el CM en la solución de bloqueo.
4. Cultivo de CM
NOTA: Realice los siguientes pasos en condiciones estériles.
- Diluir Laminin (de membrana de sótano de sarcoma murino Engelbreth-Holm-Swarm, 1 mg/ml) 1:10 en salina tamponada de fosfato estéril (sin Ca2+/ Mg2+) a una concentración final de 100 g/ml.
- Preparar el medio de cultivo en M199-Medium con los suplementos indicados en la Tabla 3.
| Medio de cultivo celular en M199-Medio | |
| Creatina [mM] | 5 |
| Clorhidrato de L-carnitina [mM] | 2 |
| Taurina [mM] | 5 |
| Na-Pyruvat [mM] | 1 |
| Insulina (páncreas bovino) [U/L] | 0.25 |
| Citosina-D-arabinofuranoside [mM] | 0.01 |
| Gentamicina [mg/mL] | 0.05 |
Tabla 3: Medio de cultivo celular.
- Solución de filtro estéril (0,22 m) y añadir un 5% de suero bovino fetal.
- Para los experimentos de abrazadera de parche autoclave cubrelips de 16 mm, espesor No. 0, recubrirlos con 100 g/ml de laminin directamente antes del cultivo.
- Para experimentos de fibra de carbono, cubra la superficie de la placa Petri con poli(2-hidroxietilo metacrilato) (poli-HEMA, 0,12 g/ml en 95:5 EtOH:H20) y déjela solidificar.
NOTA: Las células no se 'pegan' a los platos Petri recubiertos de poli-HEMA; esto es crucial para su contracción sin fricción en los estudios de mecánica celular. - Después de volver a suspender CM se han asentado (10-15 min), quitar el sobrenadante, y luego volver a suspender CM en el medio de cultivo.
- Cuente CM con una cámara Neubauer y semillas a una densidad objetivo de 17.500 células/ml, ya sea en cubiertas recubiertas de laminina o en platos Petri recubiertos con poli-HEMA.
- Incubar células a 37oC, 5%CO2 durante 3-4 horas. Intercambie el medio (37 oC) de las células sembradas de encubrimiento.
- Añadir adenovirus (tipo 5) codificación para GtACR1-eGFP en una multiplicidad de infección (MOI) de 75 e iniciar experimentos funcionales después de 48 horas.
NOTA: Después de la transducción, mantenga las células en la oscuridad. Utilice iluminación roja cuando trabaje con proteínas activadas por luz azul o verde. Un sistema de administración adenoviral disponible comercialmente (ver Tabla de Materiales)se utiliza para clonar los genes que codifican GtACR1-eGFP en el vector adenoviral. El inserto de interés, aquí GtACR1-eGFP, se amplifica PCR y luego se combina con un vector adenoviral que incluye un promotor de CMV en una reacción de clonación IN-Fusion. El promotor del CMV (citomegalovirus humano) se utiliza comúnmente para impulsar la sobreexpresión de transgenes en células de mamíferos. eGFP es una proteína fluorescente verde mejorada derivada de Aequorea victoria con un máximo de excitación de 488 nm y un máximo de emisión de 507 nm. El adenovirus (tipo 5) fue producido externamente en Charité-Universitétsmedizin Berlin, Institut f'r Pharmakologie, Berlín, Prof. Dr. Michael Schupp.
ADVERTENCIA: La transducción adenoviral se clasifica como trabajo a nivel de seguridad BSL-2, y se requieren legalmente medidas de seguridad adecuadas.
5. Experimentos funcionales
NOTA: Las grabaciones se realizan utilizando un microscopio de fluorescencia invertido. Filtrar la luz de transmisión por un filtro de paso de banda rojo (630/20 nm) en el condensador para evitar la coactivación de GtACR1.
-
Configuración de abrazadera de parche
- Utilice un amplificador en combinación con un convertidor analógico a digital. Utilice un software de adquisición de datos para registrar datos de corriente y voltaje (consulte Tabla de materiales).
NOTA: Los datos grabados se digitalizan a 10 kHz y se filtran a 5 kHz.
- Utilice un amplificador en combinación con un convertidor analógico a digital. Utilice un software de adquisición de datos para registrar datos de corriente y voltaje (consulte Tabla de materiales).
-
Configuración de fibra de carbono
- Utilice una cámara para detectar la posición de la fibra de carbono y la longitud del sarcomere mediante el seguimiento de los cambios en el contraste óptico (las fibras de carbono aparecen como estructuras más oscuras, superpuestas en el patrón de células estriadas). En la Figura 3se muestra una representación esquemática de la configuración.
NOTA: La longitud de Sarcomere se calcula en tiempo real utilizando una rápida transformación de Fourier (FFT) del espectro de potencia del patrón de estriación.
- Utilice una cámara para detectar la posición de la fibra de carbono y la longitud del sarcomere mediante el seguimiento de los cambios en el contraste óptico (las fibras de carbono aparecen como estructuras más oscuras, superpuestas en el patrón de células estriadas). En la Figura 3se muestra una representación esquemática de la configuración.

Figura 3: Esquema que representa la configuración experimental para mediciones de fibra de carbono. (El dibujo no está a escala). Dos fibras de carbono están unidas en una célula y su posición es controlada por un posicionador piezoeléctrico. El marcapasos se utiliza para la estimulación eléctrica del campo. Los LED multicolor se acoplan en el puerto de epifluorescencia del microscopio invertido para la iluminación de las células en el plano del objeto. La potencia LED se controla a través de una caja de control dedicada, que recibe pulsos digitales a través de la salida digital del convertidor analógico digital (DAC). El DAC se comunica a través de una salida analógica con la interfaz del sistema de fluorescencia. Una cámara en blanco y negro (774 píxeles por 245 líneas) para imágenes celulares está conectada a la computadora para rastrear la longitud del sarcomere y la flexión de fibra de carbono. Haga clic aquí para ver una versión más grande de esta figura.
- Iluminación cronometrada
- Proporcionar luz para la microscopía de fluorescencia y la activación de canales ióniones de luz a través de una caja de control LED a medida externa, que comprende tres LED de diferente color (460 nm, 525 nm, 640 nm, ver Tabla de materiales).
- Modifique el código del microcontrolador y de la interfaz gráfica de usuario (GUI) para el cuadro de control para permitir el control del LED a través de pulsos externos de Tiempo de Vida (TTL), generados en protocolos de software de adquisición de datos (consulte Tabla de materiales). Transmita pulsos TTL a la caja de control LED a través del convertidor analógico digital.
- Conduzca el LED y elija el número de pulsos vía la GUI. Al recibir el comando del GUI el microcontrolador comienza un proceso en un nuevo núcleo. En este proceso la entrada TTL así como un conjunto del switch de control del GUI serán verificadas continuamente.
- Cuando la entrada TTL es positiva, el microcontrolador enciende el LED y, a continuación, reanuda la comprobación de la entrada TTL. Una vez que la señal TTL vuelve a cero, el microcontrolador apaga el LED y reduce el número de pulsos dejados por uno. Si en cualquier momento el Switch de control es falso o el número de pulsos es cero, el microcontrolador detiene este proceso hasta que se reciba un nuevo comando del GUI.
- Acople directamente los LED en el puerto trasero del microscopio.
- Determinación de la intensidad de la luz en el plano del objeto
- Mida el área iluminada con un micrómetro de etapa (ampliación objetiva 40x, A a 0,8 mm2).
- Utilice un medidor de potencia óptico (consulte Tabla de materiales).
- Defina los ajustes para los experimentos: longitud de onda de excitación (525 nm), aumento objetivo (40x), filtro de excitación (530/20 nm) o espejo, y lea la potencia de la luz [W] en varios voltajes de entrada LED.
- Calcular la intensidad de la luz [W/mm2] dividiendo la potencia de la luz [W] por el área iluminada [mm2] (aquí: 0,8 mm2).
NOTA: Mida la potencia de la luz real con los protocolos respectivos en el paso 5.6 para comprobar si las duraciones de pulso de luz cortas de 10 ms alcanzan y las duraciones largas mantienen el valor establecido(Figura Suplementaria 1).
- Preparación para experimentos con abrazaderas de parches
- Preparar las siguientes soluciones externas e internas(Tabla 4; para los requisitos hídricos, véase el Cuadro 1).
- Ajustar la osmolaridad con glucosa a 300 o 5 mOsmol/L. Aliquot la solución interna y almacenar a -20 oC.
NOTA: Mantenga la solución interna en hielo para el día de la grabación. Mantenga la solución externa a temperatura ambiente. Las soluciones de abrazadera de parche aquí descritas se basaron en soluciones utilizadas anteriormente y la concentración de Cl- se cambió a niveles más bajos, más fisiológicos7. Para la caracterización de la selectividad iónial del actuador optogenético respectivo, sugerimos variar las concentraciones de iones principales (por ejemplo, Cl-, Na+, K+, H+) en las soluciones extra e intracelulares19. - Retire el electrodo de grabación del soporte de la pipeta y retire la capa de cloruro de plata del alambre de plata con papel de lija muy fino.
NOTA: Realice este paso al principio de cada día de medición. - Conecte el cable al polo positivo de una batería de 1,5 V y sumerja en una solución de 3 M KCl para recubrimiento de cloruro de plata durante 10 minutos.
NOTA: El poste negativo está conectado a un cable de plata de referencia sumergido en la solución KCl de 3 M. - Preparar la cámara de medición: coloque la grasa de silicio en el marco de la cámara de medición y coloque un cubreobjetos (diámetro: 50 mm, espesor No. 0) en la parte superior del marco que la cámara está sellada.
- Ponga un electrodo de pellet de plata/cloruro de plata de referencia en el baño y conéctelo con la etapa de la cabeza.
- Tire de pipetas de parche de 1,7 - 2,5 M de capilares de vidrio cal sosa (diámetro exterior: 1,55 mm, diámetro interior: 1,15 mm) con un tirador de micropipetas (ver Tabla de materiales).
- Inicie el software de adquisición de datos y ajuste la prueba de membrana (pulso 10 mV para 15 ms, línea de base 0 mV).
| Solución de baño externo | Solución de pipeta interna | |
| NaCl [mM] | 140 | - |
| KCl [mM] | 5.4 | 11 |
| CaCl2 [mM] | 1 | - |
| MgCl2 [mM] | 2 | 2 |
| Glucosa [mM] | 10 | - |
| HEPES [mM] | 10 | 10 |
| K-Aspartato [mM] | - | 119 |
| Mg-ATP [mM] | - | 3 |
| EGTA [mM] | - | 10 |
| Ph | 7.4 (NaOH) | 7.2 (KOH) |
| Osmolaridad (ajustar con glucosa) [mOsmol/L] | 300 x 5 | 300 x 5 |
Tabla 4: Soluciones de abrazadera de parche.
- Protocolos para mediciones de abrazaderas de parches
- Registre el protocolo de fotoactivación en el modo de abrazadera en V con un potencial de sujeción de -74 mV. Utilice pulsos de luz de 300 ms.
NOTA: Sugerimos realizar grabaciones de abrazadera en V cerca del potencial de membrana de reposo de CM cultivado (establecido en I-clamp; en nuestras manos entre -79 mV y -77 mV tanto para CM19transducido y no transducido). Las células recién aisladas muestran un potencial medio de membrana en reposo de -79 mV(Figura Suplementaria 2,todos los valores después de la corrección para el potencial de unión líquida). - Grabe EL AP en el modo de la abrazadera I en 0 pA.
- Para el ritmo eléctrico, inyectar pulsos de corriente de 10 ms (rampa de 0 pA al valor establecido dentro de 10 ms), 0.25 Hz y encontrar el umbral para obtener AP. Registre AP por inyecciones de corriente de 50% más que el umbral.
- Para el ritmo óptico utilice pulsos de luz de 10 ms, 0.25 Hz a la intensidad mínima de la luz para obtener AP confiable.
- Registre la fotoinhibición en modo I-clamp a 0 pA. Elicit AP como se describe en el paso 5.6.2.1 y aplique la luz sostenida para 64 s a 4 mW/mm2 después de 15 AP activado eléctricamente.
NOTA: La Figura 6F muestra un protocolo de fotoinhibición en el que durante la luz sostenida se aplican inyecciones de corriente más alta. A partir de 1,5 veces el umbral (aquí: 0,7 nA) la corriente inyectada se incrementó en pasos de 0,1 nA (nivel final: 2,2 nA). En todas las amplitudes de corriente probadas, la aplicación de luz sostenida inhibió la generación de AP.- Como experimento de control, pausa la estimulación eléctrica durante 64 s sin aplicación ligera.
- Registre el protocolo de fotoactivación en el modo de abrazadera en V con un potencial de sujeción de -74 mV. Utilice pulsos de luz de 300 ms.
- Experimentos con abrazaderas de parches
NOTA: Realice los siguientes experimentos en la oscuridad (la luz roja se puede utilizar para herramientas activadas por luz azul/verde).- Coloque el cubreobjetos con las células en la cámara de medición con solución externa y seleccione CM fluorescente.
NOTA: las células eGFP positivas se pueden detectar utilizando un LED azul (460 nm) en combinación con un filtro de excitación de paso de banda (450 nm - 490 nm), un espejo dicroico de 510 nm y un filtro de emisión de paso largo de 515 nm. Si se utilizan otras etiquetas fluorescentes, utilice los conjuntos de filtros LED y fluorescencia correspondientes. Si se logra una alta eficiencia de transducción (en nuestras manos >99% con el adenovirus GtACR1), no hay necesidad de comprobar la fluorescencia eGFP antes de los experimentos funcionales; esto evita la posible preactivación de GtACR1. - Llene la pipeta de parche con solución interna. Asegúrese de que no haya burbujas de aire en la punta.
- Fije la pipeta al soporte de la pipeta, insertando el cable de plata recubierto de cloruro de plata de grabación en la solución interna.
- Después de alcanzar la configuración de la célula conectada, cambie al modo de célula entera en el software de adquisición de datos con un potencial de retención de -74 mV. Romper la membrana aplicando suavemente la presión negativa para acceder a la configuración de células enteras. Esto se indica mediante un aumento inmediato de la capacitancia medida.
- Ejecute los protocolos descritos en la sección 5.6.
- Coloque el cubreobjetos con las células en la cámara de medición con solución externa y seleccione CM fluorescente.
- Técnica de fibra de carbono
- Producir fibras de carbono.
- Utilizar capilares de vidrio con los siguientes parámetros: diámetro exterior: 2,0 mm, diámetro interior: 1,16 mm, longitud: 100 mm (ver Tabla de materiales). Usando un tirador de micropipeta, tire del capilar de vidrio en dos pipetas de la misma longitud (longitud total del cónico 11 mm, Figura 5) a un diámetro interior final de 30 m.
NOTA: Los ajustes utilizados para la primera y la segunda extracción son del 85,2% (proporcional a la salida máxima del tirador) y del 49,0%, respectivamente (dependerán del tirador, el tipo y la edad del filamento). - Doble las pipetas hasta 45o con una microforja autofabricada utilizando ajustes de 12 V, 24 A (consulte la figura 4 para obtener más información sobre la configuración de flexión de la pipeta).
- Alinee el capilar (2) en la línea roja en el círculo de orientación (5), mantenga la posición de la constante capilar para que la longitud de la parte de pliegue sea siempre la misma después del centro del círculo de orientación (radio de 4,5 mm).
- Doblar el capilar hasta 45o (línea verde) empujando hacia abajo la punta del capilar con el doblador (3) y forjar calentando el filamento (4) hasta que el capilar capture el ángulo de 45o incluso después de que se retire el doblador.
- Coloque las fibras de carbono (proporcionadas por el profesor Jean-Yves Le Guennec) en la punta fina del capilar de vidrio bajo un microscopio estéreo. Utilice fórceps finos con tubos blandos al final para aumentar el agarre y disminuir el riesgo de dañar las fibras.
NOTA: Estas fibras se caracterizan por microestructuras, que aumentan la superficie de contacto entre fibras y células, mejorando así la adhesión20. - Cortar las fibras de carbono a una longitud de 2 mm y utilizar super pegamento (cianoacrilato) para fijar la fibra a la sección frontal del capilar.
NOTA: Cuanto más largas son las fibras, más se doblan tras la aplicación de la misma fuerza.
- Utilizar capilares de vidrio con los siguientes parámetros: diámetro exterior: 2,0 mm, diámetro interior: 1,16 mm, longitud: 100 mm (ver Tabla de materiales). Usando un tirador de micropipeta, tire del capilar de vidrio en dos pipetas de la misma longitud (longitud total del cónico 11 mm, Figura 5) a un diámetro interior final de 30 m.
- Calibrar las fibras de carbono.
- Calibrar las fibras de carbono utilizando un transductor de fuerza con una sensibilidad de 0,05 mN/V y un rango de fuerza de 0 a 0,5 mN (ver Tabla de Materiales).
NOTA: Esta configuración está hecha a medida para medir la compresión en lugar de "tirar". - Fije el capilar con la fibra de carbono a un soporte controlado por un micromanipulador y un motor piezoeléctrico.
- Coloque la punta de la fibra en contacto con el sensor de fuerza, pero sin producir ninguna fuerza y mueva el motor piezoeléctrico en pasos de 10 m (movimiento total de 60 m) hacia el sensor y lea la tensión medida (E) en Volt.
NOTA: Asegúrese de que el transductor de fuerza esté contactado por la punta del extremo libre de la fibra de carbono. - Repita estas medidas tres veces.
- Utilice la Fórmula 1 para calcular la fuerza para cada posición piezoeléctrica ()
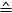 diferencia de voltaje medido entre los pasos del motor piezoeléctrico:
diferencia de voltaje medido entre los pasos del motor piezoeléctrico: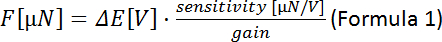
NOTA: La sensibilidad del transductor de fuerza depende del modelo del transductor (aquí: 0,05 mN/V a 50 o50 n/v). La ganancia se puede ajustar en el controlador. - Trazar la fuerza [-N] contra la posición piezoeléctrica. La pendiente corresponde a la rigidez de la fibra [-N/m].
- Calibrar las fibras de carbono utilizando un transductor de fuerza con una sensibilidad de 0,05 mN/V y un rango de fuerza de 0 a 0,5 mN (ver Tabla de Materiales).
- Fuerza récord de contratación CM.
NOTA: Realice los siguientes experimentos en la oscuridad (la luz roja se puede utilizar para herramientas activadas por luz azul/verde).- Recubrir la superficie de la cámara de medición con poli-HEMA. Llene la cámara de medición con solución de baño externa y coloque unas gotas de la suspensión celular cultivada en la cámara (paso 4.9).
- Conecte los capilares con fibras de carbono al micromanipulador del escenario. Seleccione GTACR1-expressing CM comprobando la capacidad de inducir contracciones mediante la aplicación de pulsos cortos de luz verde. Alinee las fibras de carbono casi horizontalmente a la superficie de la cámara de medición.
- Baje la primera fibra sobre la superficie celular. Fije la segunda fibra paralela a la primera fibra en el otro extremo del CM. La alineación ideal es casi perpendicular al eje de la celda.
NOTA: Fije la fibra empujando suavemente la celda a la superficie inferior. Suelte la presión antes de conectar la segunda fibra. No estire la célula uniendo la segunda fibra. - Después de que ambas fibras estén unidas en la célula, levante las fibras, para que la célula ya no tenga contacto con la superficie de la cámara y sea capaz de contraerse sin ninguna fricción.
- Enfoque a los sarcomeres en el software de adquisición de datos (consulte Tabla de materiales)y establezca la ventana de seguimiento de longitud de sarcomere(Figura 7A I(3)) entre las fibras.
NOTA: El espectro de potencia FFT resultante(Figura 7A I (2)) muestra idealmente un pico agudo, que representa la longitud media del sarcomere. - Realice un seguimiento de la flexión de la fibra utilizando el módulo de detección de bordes. Establezca las áreas de detección con la ventana roja y verde y defina un umbral (línea horizontal roja y verde) en la primera derivada de la traza de intensidad de luz(Figura 7A III).
- Comience a ritmo óptico de la celda a 0,25 Hz (si es posible, intente velocidades de ritmo más rápidas) y realice un seguimiento de la longitud del sarcomere y la flexión de la fibra.
NOTA: La posición del soporte de fibra, el gatillo LED y los pulsos de estimulación eléctrica se controlan a través del software de adquisición de datos (consulte Tabla de materiales). - Después de registrar al menos 15 contracciones ópticamente provocados, estimule la célula eléctricamente (ver Tabla de Materiales). Encuentre el umbral para obtener contracciones y registrar mediante la aplicación de 1,5 veces de la tensión de umbral.
- Para el protocolo de inhibición, aplique estímulos eléctricos para obtener contracciones y luego exponera a una luz sostenida de 64 s (a varias intensidades de luz).
- Producir fibras de carbono.

Figura 4: Configuración de plegado de pipetas. (1) El micromanipulador en el lado izquierdo se utiliza para controlar la posición del capilar, y un segundo micromanipulador a la derecha se utiliza para doblarlo. (2) Capilar. (3) Bender. (4) Microforja. (5) Círculo de orientación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Pipeta con fibra de carbono. Haga clic aquí para ver una versión más grande de esta figura.
6. Análisis de datos
-
Grabaciones de abrazaderas de parches
NOTA: Corrija todos los voltajes grabados y de comando para el potencial de unión líquida después del experimento. Determinar el potencial de unión líquida en el software de adquisición de datos utilizando la calculadora de potencial de unión de la herramienta (para las soluciones de abrazadera de parche indicadas en la Tabla 4:14,4 mV a 21 oC). Restar el potencial de unión líquida de la tensión de mando/registrada.- Para grabaciones AP de abrazadera i, compruebe el ritmo eléctrico frente al ritmo óptico. Calcule la duración AP (APD) en 20 y 90% de repolarización con un script escrito a medida(material suplementario). Determinar el potencial de la membrana en reposo y la amplitud AP.
NOTA: Determine el APD como se describe en Wang K. et al.21 El script para cargar archivos .abf es generalmente accesible a través del siguiente enlace: https://de.mathworks.com/matlabcentral/fileexchange/22114-fcollman-abfload. Valores promedio de APD para al menos 6 AP. - Para la fotoactivación de la abrazadera en V, compruebe si la línea de base está en 0 pA. Si no ajusta la línea base a cero. Analizar la corriente registrada activada por pulsos de luz de 300 ms a -74 mV. Transfiera los datos al software de análisis de datos y determine el pico y el promedio de corriente estacionaria.
- Para grabaciones AP de abrazadera i, compruebe el ritmo eléctrico frente al ritmo óptico. Calcule la duración AP (APD) en 20 y 90% de repolarización con un script escrito a medida(material suplementario). Determinar el potencial de la membrana en reposo y la amplitud AP.
-
Experimentos de fibra de carbono
- Grabaciones de contracción durante el ritmo óptico: Cargue los datos registrados en el software de adquisición de datos y lea la línea de base y el máximo de la flexión de la fibra de carbono y los cambios en la longitud del sarcomere.
NOTA: Valores medios para 10 contracciones de una grabación estable. - Mida el ancho de celda y calcule el área de sección transversal de la celda asumiendo una sección elíptica(Figura 7B II).
NOTA: La fórmula para el área de una elipse es A á a a -a-b (Fórmula 2) donde a es la distancia desde el centro hasta el vértice y b es la distancia desde el centro hasta el co-vértice. En nuestro caso, esto significa un á (ancho de la celda)/2 y b (espesor de la celda)/2. Según Nishimura et al.22 el grosor de CM se puede estimar en un tercio del ancho de la célula de modo que A (1/2)-ancho- (1/2)-espesor - (1/4)-ancho-ancho-ancho-ancho (1/3)-ancho- (1/12)-ancho2. - Calcular la fuerza sistólica final (F):
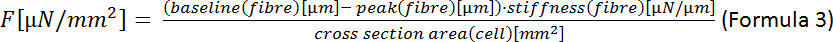
- Calcular la deformación de la célula sistólica final (ESD):
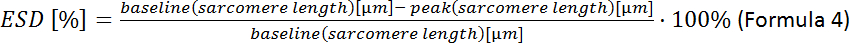
NOTA: Se pueden analizar otros parámetros contractivos: duración del sarcomere en reposo, tiempo hasta el pico, tiempo de relajación del 90%, acortamiento fraccionario del sarcomere, velocidad máxima de contracción y relajación (ver manual de adquisición de software).
- Grabaciones de contracción durante el ritmo óptico: Cargue los datos registrados en el software de adquisición de datos y lea la línea de base y el máximo de la flexión de la fibra de carbono y los cambios en la longitud del sarcomere.
Resultados
GtACR1-eGFP se expresó en conejo cultivado CM(figura 6 inserto) y las fotocorrientes se midieron con la técnica de abrazadera de parche. La fotoactivación de GtACR1 muestra grandes corrientes dirigidas hacia adentro a -74 mV. En la Figura 6Una corriente pico(IP) a 4 mW/mm2 es 245 pA. AP se activó eléctricamente(Figura 6B)o ópticamente(Figura 6C) con inyecciones de corriente 1,5 veces el umbral, o pulsos de luz despolarizantes cortos de 10 ms, respectivamente. Analizando los valores de APD, el CM de ritmo eléctrico muestra un APD 20 de 0,24 a 0,08 s y un APD 90 de 0,75 a 0,17 s, mientras que los CM de ritmo óptico muestran un APD 20 de 0,31 a 0,08 s y un APD 90 de 0,81 a 0,19 s (SE, n a 5, N a 2, en el ejemplo aquí presentado APD 20eléctrico a 0,17 s; APD 20óptico s 0,27 s y APD 90eléctrico a 0,61 s; APD 90óptico a 0,68 s; Figura 6D). El CM de ritmo óptico muestra un inicio AP más lento(figura 6D). La activación de CM se inhibió al iluminarse sostenidamente (para 64 s, 4 mW/mm2) mediante la polarización del potencial de membrana hacia el potencial de inversión del cloruro, aquí -58 mV(Figura 6E). Las inyecciones de corriente más altas que 1,5 veces el umbral no profunden la generación AP(Figura 6F). Las fuerzas máximas generadas se determinaron a partir de la flexión de la fibra de carbono(Figura 7B,C,E). El CM generó 232 n/mm2 al ritmo eléctrico(Figura 7B)y 261 n/mm2 después del ritmo óptico(Figura 7C). Los pulsos prolongados de luz verde inhiben las contracciones(Figura 7E). Después de la inhibición óptica durante 64 s, las contracciones recurrentes generan una menor fuerza contráctil, y los valores de fuerza se recuperan hacia la línea de base después de 10 contracciones de 10 euros (ritmo a 0,25 Hz, Figura 7D)en consonancia con la pérdida de calcio diastólica de la CM de conejo.
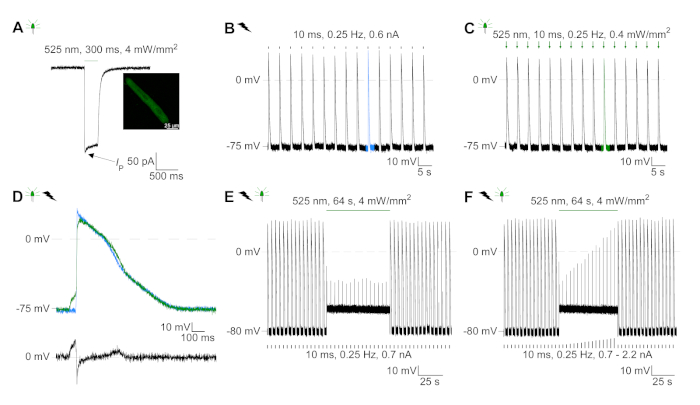
Figura 6: Grabaciones representativas de abrazaderas de parche de CM eléctricos y ópticamente ritmo/inhibido. (A) Fotocorriente representativa a -74 mV utilizando un pulso de luz de 300 ms, 4 mW/mm2. IP indica la corriente máxima. La plaquita muestra una celda positiva GtACR1-eGFP. (B) Registro REPRESENTATIVO AP a 0 pA utilizando una rampa de corriente de 10 ms, 0,6 nA para acelerar eléctricamente el CM. (C) Registro REPRESENTATIVO AP a 0 pA utilizando pulsos de luz de 10 ms, 0,4 mW/mm2. (D) El gráfico superior muestra la superposición del10o AP de CM activado eléctricamente (azul) y óptico (verde) se alinearon por el cambio máximo en el potencial de membrana (dV/dt max). El gráfico inferior muestra la diferencia del potencial de membrana entre AP activado óptica y eléctricamente(Eóptica-Eeléctrica). (E) Los AP activados eléctricamente se inhibiron bajo una luz sostenida de 64 s, 4 mW/mm2. (F) AP se inhiben por inyecciones de corriente más altas que 1,5 veces el umbral (de 0,7 nA en pasos de 0,1 nA a 2,2 nA) bajo luz sostenida. Haga clic aquí para ver una versión más grande de esta figura.
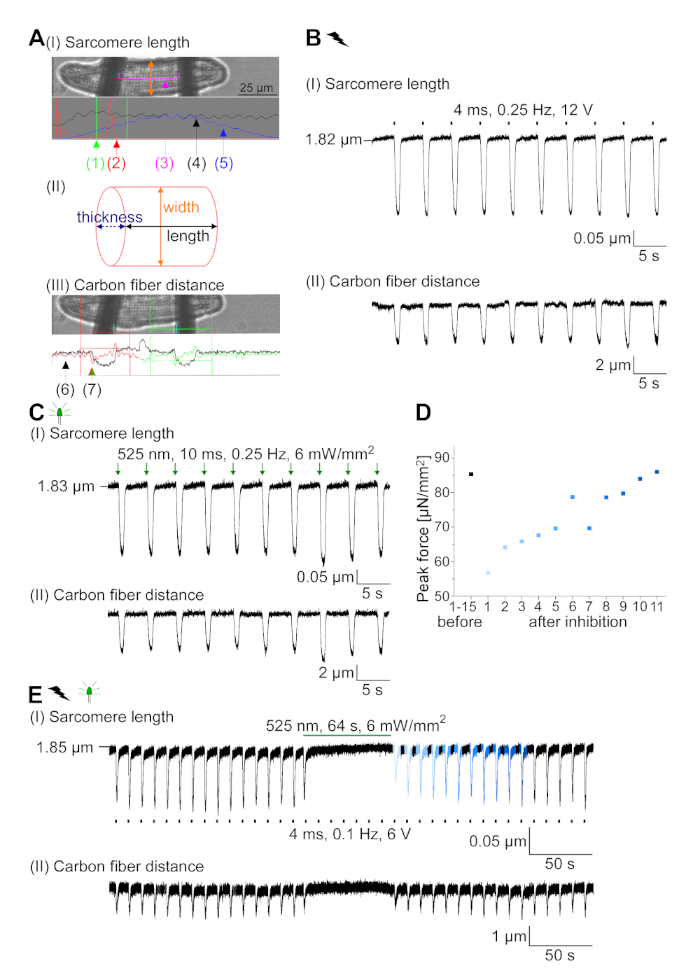
Figura 7: Datos representativos de las grabaciones de fibra de carbono de CM óptica y eléctricamente acelerado/inhibido. (A) Visualizar en el software de adquisición de datos. La imagen (I) muestra el CM medido con la ventana para calcular la longitud del sarcomere. El ancho de celda está etiquetado en naranja. (1) Rango de frecuencias relevantes. (2) El espectro de potencia FFT muestra la frecuencia del espaciado del sarcomere en la célula. La longitud media del sarcomere se calcula a partir de la frecuencia máxima. (3) Ventana de seguimiento de la longitud de Sarcomere. (4) Traza de intensidad. (5) El rastro de intensidad multiplicado por una ventana Hamming es el rastro de intensidad de ventana. Esquema (II) muestra la sección elíptica de la célula. Ancho en naranja y espesor en azul discontinuo. La imagen (III) muestra la posición de las fibras de carbono con las respectivas cajas de detección, dejadas en rojo y derecha en verde. (6) Traza de intensidad. (7) Primera derivada de la traza de intensidad (véase el manual del software de adquisición de datos). (B) Rastro representativo de contracciones provocada eléctricamente. El Panel (I) muestra el acortamiento de la longitud del sarcomere, panel (II) la distancia entre las dos fibras de carbono. (C) Rastro representativo de contracciones provocadas ópticamente (525 nm, 0,25 Hz, 10 ms, 6 mW/mm2). El Panel (I) muestra el acortamiento de la longitud del sarcomere, panel (II) la distancia entre las dos fibras de carbono. (D) Fuerza pico generada de la contracción 1 a 11 después de una pausa causada por la inhibición de la generación AP. (E) Rastro representativo de la inhibición óptica de las contracciones bajo iluminación sostenida (525 nm, 64 s, 6 mW/mm2). El Panel (I) muestra el acortamiento de la longitud del sarcomere, panel (II) la longitud entre las dos fibras de carbono. Haga clic aquí para ver una versión más grande de esta figura.
| Un | Área |
| Acr | anión channelrhodopsin |
| Ap | potencial de acción |
| Apd | duración potencial de la acción |
| Ufc | unidad formadoras de colonias |
| Chr | channelrhodopsin |
| Cm | cardiomiocito |
| eGFP | proteína fluorescente verde mejorada |
| Esd | fin de la deformación de la célula sistólica |
| Ue | unidades de endotoxina |
| F | Fuerza |
| Fft | rápida transformación de Fourier |
| GtACR | Guillardia theta anion channelrhodopsin |
| Gui | interfaz gráfica de usuario |
| I-clamp | actual-clamp |
| Iu | unidades internacionales |
| Moi | multiplicidad de infección |
| poli-HEMA | poli(2-hidroxietilo metacrilato) |
| Abrazadera en V | tensión-pinza |
Tabla 5: Lista de abreviaturas.

Figura suplementaria 1: Mediciones de intensidad de la luz con medidor de potencia óptica. (A) Medición de pulsos de luz de 10 ms a 4 mW/mm2. (B) Medición de la iluminación sostenida de 64 s a 4 mW/mm2. Haga clic aquí para ver una versión más grande de esta figura.
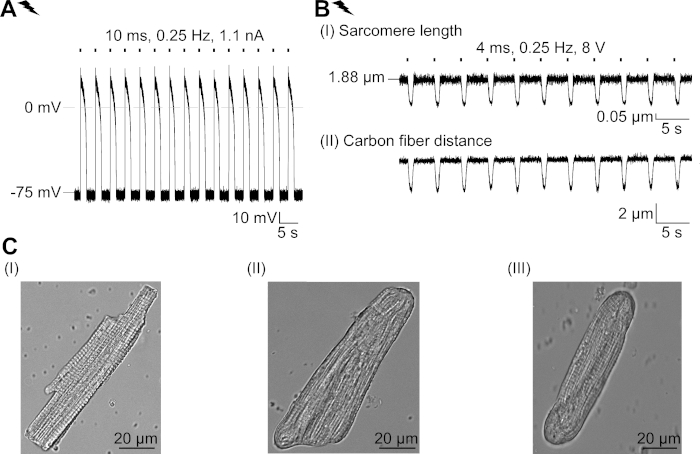
Figura suplementaria 2: Propiedades del CM recién aislado y su adaptación estructural en el cultivo. (A) Registro AP de un CM recién aislado (APD 20 de 1,11 a 0,34 s, APD 90 de 1,96 a 0,32 s, n a 7, N a 2). Potencial medio de la membrana en reposo de -79,3 a 0,8 mV (n a 7, n a 2). (B) Registro de fibra de carbono de un CM recién aislado de ritmo eléctrico. (C) Imágenes confocales de un CM (I) recién aislado; no transducido (II) y transducido (III) CM después de 48 horas en cultivo. Haga clic aquí para ver una versión más grande de esta figura.
Material Suplementario: Secuencia de comandos MatLab para determinar el TPA y el potencial de membrana en reposo. Haga clic aquí para descargar este archivo.
Discusión
Mientras que las herramientas optogenéticas permiten la modulación de la electrofisiología celular excitable de una manera no invasiva, necesitan una caracterización exhaustiva en diferentes tipos de células (por ejemplo, CM) para permitir que uno elija la mejor herramienta disponible para un diseño experimental específico. La técnica de abrazadera de parche es un método estándar para evaluar la electrofisiología celular. En la configuración de células enteras, permite grabar corrientes fotoactivadas a través de la membrana plasmática o cambios temporales en el voltaje de la membrana después de la estimulación/inhibición de la luz. La manipulación optogenética de la excitación eléctrica también afecta a las contracciones de CM. Utilizamos el seguimiento de sarcomere y las mediciones de fuerza asistida por fibra de carbono para cuantificar los efectos del interrogatorio óptico en la actividad mecánica de los miocitos.
Describimos un protocolo para caracterizar los efectos básicos de un canal de cloruro ligero, GtACR1, en CM. Como sistema modelo, elegimos el conejo CM, ya que sus características electrofisiológicas (por ejemplo, forma AP y período refractario) se asemejan más a las observadas en CM humano más cercano que a los roedores CM. Además, el conejo CM se puede cultivar durante varios días, el tiempo suficiente para la administración adenoviral y la expresión de GtACR1-eGFP. En particular, el CM aislado cambia sus propiedades estructurales en el cultivo a lo largo del tiempo, incluyendo el redondeo de terminaciones celulares y la pérdida gradual de estrías cruzadas, sistema T-tubular y caveolas23,24. En línea con esto, se han reportado alteraciones funcionales en CM cultivado: despolarización del potencial de membrana en reposo, prolongación de la AP y cambios en el manejo celular De2+. Para una revisión de las adaptaciones celulares en la cultura, consulte Louch et al.25. La Figura Suplementaria 2 muestra las mediciones ejemplares DE AP y de contracción de CM recién aislado para la comparación con las observadas en CM cultivado(Figura 6, Figura 7)utilizando el protocolo aquí presentado.
Las grabaciones de abrazaderas de parche de células enteras permiten mediciones directas de las propiedades fotocorrientes (por ejemplo, amplitudes y cinética) y cambios inducidos por la luz en el potencial de membrana o las características de AP a alta resolución temporal. Sin embargo, tales grabaciones tienen varias limitaciones: En primer lugar, el citosol es reemplazado por la solución de pipeta en grabaciones de células enteras, lo que es ventajoso para controlar gradientes electroquímicos iónicos, pero tiene la desventaja intrínseca de lavar orgánulos celulares, proteínas y otros compuestos, lo que potencialmente afecta a las respuestas eléctricas celulares. En segundo lugar, los efectos secundarios como la activación de canales iónicos adicionales resultantes de la despolarización no fisiológicamente larga (por ejemplo, constantes de tiempo lento de los canales iónicos bloqueados por la luz) son difíciles de evaluar, ya que nuestro método sólo permite detectar cambios en el TPA, pero no realizar mediciones directas de las concentraciones iónicas en compartimentos celulares electrofisiológicamente relevantes. Esto podría hacerse con indicadores fluorescentes (por ejemplo, sensores Ca2+) o electrodos selectivos de iones. La caracterización adicional puede incluir valoraciones de intensidad de la luz, determinación de la dependencia del pH, cinética fotocorriente en diferentes potenciales de membrana y cinética de recuperación durante la estimulación de la luz repetitiva.
A diferencia de las grabaciones de abrazaderas de parche, las mediciones de fuerza de una sola célula permiten el análisis de las contracciones celulares de los miocitos intactos sin afectar su entorno intracelular. Los efectos secundarios sobre las concentraciones iónicas (por ejemplo, Ca2+) pueden evaluarse indirectamente determinando la amplitud y la dinámica de fuerza generadas (por ejemplo, la velocidad máxima de contracción y relajación; aquí no analizada). Las mediciones de fuerza con la técnica de fibra de carbono tienen una ventaja sobre las células que se contraen libremente, ya que proporcionan información directa sobre las fuerzas pasivas y activas en las células precargadas (es decir, en condiciones más similares a las configuraciones in situ o in vivo). La precarga mecánica es especialmente importante a la hora de analizar la contractilidad celular, ya que el estiramiento afecta a la producción de fuerza y la relajación26,27.
Los enfoques optogenéticos permiten una manipulación naturalmente precisa del potencial de la membrana celular, tanto en un solo CM como en el tejido cardíaco intacto. Clásicamente, ChR2, un canal no selectivo de cationes ligeros, se ha utilizado para la despolarización del potencial de membrana, mientras que las bombas de protones y/o cloruro impulsadas por la luz se utilizaron para la hiperpolarización de membranas. Ambos grupos de actuadores optogenéticos requieren altos niveles de expresión, ya que ChR2 se caracteriza por una conductividad de un solo canal intrínsecamente baja28 y bombas accionadas por luz transportan al máximo un ion por fotón absorbido. Además, la activación prolongada de ChR2 en CM puede dar lugar a sobrecarga Na+ y/o Ca2+, y las bombas accionadas por luz pueden cambiar trans-sarcolem H+ o Cl- gradientes29,30. En busca de herramientas alternativas para el control optogenético de la actividad de CM, recientemente probamos el anión natural channelrhodopsin GtACR1, caracterizado por una conductancia de un solo canal superior y una mayor sensibilidad a la luz en comparación con el Catión ChR como ChR2. Encontramos que la activación GtACR1 despolariza CM y se puede utilizar para el ritmo óptico y la inhibición, dependiendo de la sincronización del pulso de luz y la duración. Una ventaja adicional de usar ACR en lugar de cation ChR podría ser el potencial de inversión más negativo de Cl- en comparación con Na+, reduciendo las corrientes iónicas introducidas artificialmente. Como hemos demostrado anteriormente, el ritmo óptico con GtACR1 puede conducir a la prolongación de AP como resultado del componente lento del cierre del canal GtACR1, que podría ser superado mediante el uso de mutantes GtACR1 más rápidos19. Sin embargo, la prolongación de AP es mucho menos pronunciada cuando se utiliza unaconcentración de Cl intracelular más baja y fisiológica (ver Figura 6). Por otra parte, la inhibición mediada por GtACR1 por iluminación prolongada da como resultado una profunda despolarización de la membrana, que de nuevo podría activar la afluencia secundaria Na+ y Ca2+, alterando así la actividad de los canales cerrados por voltaje. En nuestras mediciones, encontramos que los parámetros AP y de contracción se recuperan a la línea de base dentro de 40 s después de una inhibición inducida por la luz durante 1 min (véase Kopton et al. 2018, Figura 6, Figura 7). Los canales K+ con cierre ligero ofrecen una potente alternativa para silenciar CM sin afectar al potencial de membrana de reposo DE CM31.
En el futuro nos gustaría comparar cuantitativamente diferentes herramientas optogenéticas por su potencial para inhibir la actividad cardíaca. Con este fin, probamos una variedad de canales de iones con luz, incluyendo ACR, ChR2 y variantes ChR de cambio rojo32,así como actuadores hiperpolarizantes como halorhodopsin o el bPAC adenil cyclase cerrado con luz en combinación con el canal de potasio SthK (PAC-K)31.
El protocolo aquí presentado se puede utilizar para la caracterización en profundidad de las propiedades electromecánicas de CM. Es principalmente aplicable también a CM de otras especies, y a CM aislado de miocardio enfermo. La estimulación óptica permite que uno tome el ritmo CM a diferentes frecuencias, y se pueden probar diferentes precargas durante los experimentos de contracción de fibra de carbono. Un experimento interesante sería utilizar la iluminación de baja intensidad para la despolarización de los subumbrales, para imitar el aumento gradual en el potencial de la membrana en reposo, como se puede observar durante el desarrollo de la remodelación del tejido cardíaco durante la progresión de la enfermedad. Por último, las mediciones funcionales podrían combinarse con imágenes Ca2+ para obtener más información sobre el acoplamiento excitación-contracción, o con intervenciones farmacológicas para evaluar los efectos de diferentes fármacos en la actividad de CM.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Stefanie Perez-Feliz por su excelente asistencia técnica, Dr. Jonas Wietek (Universidad DeHumboldt, Berlín, Alemania) por proporcionar el plásmido pUC57-GtACR1, el Prof. Dr. Michael Schupp (Charité- Universidad de Berlín, Instituto de Farmacia, Berlín) para la producción de adenovirus y la Dra. Anastasia Khokhlova (Universidad Federal de los Urales) por compartir su experiencia para mejorar el protocolo de aislamiento celular y rediseñar la El proyecto fue financiado por la Fundación Alemana de Investigación (SPP1926: SCHN 1486/1-1; Beca Emmy-Noether: SCHN1486/2-1) y el ERC Advanced Grant CardioNECT.
Materiales
| Name | Company | Catalog Number | Comments |
| Equipment - Cell isolation/Culturing/Transduction | |||
| Adeno-X Adenoviral System 3 CMV | TaKaRa, Clontech Laboratories, Inc., Mountain View, California, USA | ||
| Aortic cannula | Radnoti | 4.8 OD x 3.6 ID x 8-9 L mm | |
| Coverslips ø 16 mm, Thickness No. 0 | VWR International GmbH, Leuven, Belgium | 631-0151 | Borosilicate Glass |
| Griffin Silk, Black, 2 m Length, Size 3, 0.5 mm | Samuel Findings, London, UK | TSGBL3 | |
| Incubator | New Brunswick, Eppendorf, Schönenbuch, Switzerland | Galaxy 170S | |
| Langendorff-perfusion set-up | Zitt-Thoma Laborbedarf Glasbläserei, Freiburg, Germany | Custom-made | |
| Langendorff-pump | Ismatec, Labortechnik-Analytik, Glattbrugg-Zürich, Switzerland | ISM444 | |
| Mesh: Nylon Monodur filter cloth | Cadisch Precision Meshes Ltd | 800 µm holes, 1 m wide | |
| Neubauer chamber | VWR International GmbH, Leuven, Belgium | 717806 | |
| Rabbit, New Zealand White | Charles River | Strain Code: 052 | |
| Scissors | Aesculap AG, Tuttlingen, Germany | BC774R | Bauchdeckenschere ger. 18cm |
| Sterile filter, 0.22 µm | Merck, Darmstadt, Germany | SLGP033RB | |
| Equipment - Patch-clamp | |||
| Amplfier | AxonInstruments, Union City, CA, United States | Axopatch 200B | |
| Coverslip ø 50 mm, Thickness No. 1 | VWR International GmbH, Leuven, Belgium | 631-0178 | Borosilicate Glass |
| Digitizer Axon Digidata | Molecular Devices, San José, CA, United States | 1550A | |
| Filter (530/20) | Leica Microsystems, Wetzlar, Germany | 11513878 | BZ:00 |
| Filter (630/20) | Chroma Technology, Bellows Falls, Vermont, United States | 227155 | |
| Headstage | AxonInstruments, Union City, CA, United States | CV203BU | |
| Interface | Scientifica, Uckfield, UK | 1U Rack, 352036 | |
| LED 525 nm | Luminus Devices, Sunnyvale, CA, United States | PT-120-G | |
| LED control software | Essel Research and Development, Toronto, Canada | ||
| LED control system | custom-made | ||
| Micropipette Puller | Narishige Co., Tokyo, Japan | PP-830 | |
| Microscope inverted | Leica Microsystems, Wetzlar, Germany | DMI4000B | |
| Motorised Micromanipulator | Scientifica, Uckfield, UK | PatchStar | |
| Optical power meter | Thorlabs, Newton, NJ, United States | PM100D | |
| Silicone Grease | RS Components, Corby, UK | 494-124 | |
| Silver wire | A-M Systems, Sequim, WA, United States | 787500 | Silver, Bare 0.015'', Coated 0.0190'', Length 25 Feet |
| Soda lime glass capillaries | Vitrex Medical A/S, Vasekaer, Denmark | 160213 BRIS, ISO12772 | 1.55 OD x 1.15 ID x 75 L mm |
| Software Axon pClamp | Molecular Devices, San José, CA, United States | Version 10.5 | |
| Software MatLab2017 | The MathWorks, Inc. | ||
| Stage micrometer | Graticules Optics LTD, Tonbridge, UK | 1 mm | |
| Equipment - Carbon fiber | |||
| Carbon fibers | provided from Prof. Jean-Yves Le Guennec | BZ:00 | |
| Digitizer Axon Digidata | Molecular Devices, Sunnyvale, CA, United States | 1550B | |
| Filter (530/20) | Leica Microsystems, Wetzlar, Germany | 11513878 | |
| Filter (630/20) | Chroma Technology, Bellows Falls, Vermont, United States | 227155 | |
| Fluorescence System Interface | IonOptix, Milton, MA United States | FSI-800 | 2.0 OD x 1.16 ID x 100 L mm |
| Force Transducer System | Aurora Scientific Inc., Ontario, Canada | 406A | |
| Glass capillaries for force measurements | Harvard Apparatus, Holliston, Massachusetts, United States | GC200F-10 | |
| Interface National Instruments | National Instruments, Budapest, Hungary | BNC-2110 | |
| LED 525 nm | Luminus Devices, Sunnyvale, CA, United States | PT-120-G | |
| LED control box | Essel Research and Development, Toronto, Canada | ||
| LED control system | custom-made | ||
| Microcontroller | Parallax Inc., Rocklin, California, United States | Propeller | |
| Micropipette Puller | Narishige Co., Tokyo, Japan | PC-10 | |
| Microscope inverted | Leica Microsystems, Wetzlar, Germany | DMI4000B | |
| MyoCam-S camera | IonOptix, Dublin, Ireland | ||
| MyoCam-S camera Power | IonOptix, Milton, MA, United States | MCS-100 | |
| MyoPacer Field Stimulator | IonOptix Cooperation, Milton, MA, United States | MYP100 | |
| Piezo Motor | Physik Instrumente (PI) GmbH & Co. KG, Karlsruhe, Germany | E-501.00 | |
| Silicone Grease | RS Components, Corby, UK | 494-124 | |
| Software Axon pClamp | Molecular Devices, San José, CA, United States | Version 10.5 | |
| Software IonWizard | IonOptix, Dublin, Ireland | Version 6.6.10.125 | |
| Software MatLab2017 | The MathWorks, Inc. | ||
| Stage micrometer | Graticules Optics LTD, Tonbridge, UK | 1 mm | |
| Chemicals | |||
| Adenosine | Sigma-Aldrich, St. Louis, Missouri, United States | A9251-100G | |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, Missouri, United States | A7030-50G | |
| CaCl2 | Honeywell Fluka, Muskegon, MI, USA | 21114-1L | |
| L-Carnitine hydrochloride | Sigma-Aldrich, St. Louis, Missouri, United States | C9500-25G | |
| Collagenase type 2, 315 U/mg | Worthington, Lakewood, NJ, USA | LS004177 | |
| Creatine | Sigma-Aldrich, St. Louis, Missouri, United States | C0780-50G | |
| Cytosine-β-D-arabinofuranoside | Sigma-Aldrich, St. Louis, Missouri, United States | C1768-100MG | |
| EGTA | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 3054.3 | |
| Esketamine hydrochloride, Ketanest S 25 mg/mL | Pfizer Pharma PFE GmbH, Berlin, Germany | PZN-07829486 | |
| Fetal Bovine Serum | Sigma-Aldrich, St. Louis, Missouri, United States | F9665 | |
| Gentamycin 50 mg/mL | Gibco, Life Technologies, Waltham, MA, USA | 15750-037 | |
| Glucose | Sigma-Aldrich, St. Louis, Missouri, United States | G7021-1KG | |
| Heparin-Sodium, 5,000 IU/mL | Braun Melsungen AG, Melsungen, Germany | PZN-03029843 | |
| HEPES | Sigma-Aldrich, St. Louis, Missouri, United States | H3375-1KG | |
| Insulin (bovine pancreas) | Sigma-Aldrich, St. Louis, Missouri, United States | I6634-50MG | |
| K-aspartate | Sigma-Aldrich, St. Louis, Missouri, United States | A6558-25G | |
| KCl | VWR International GmbH, Leuven, Belgium | 26764.260 | 1 mg/mL |
| KOH | Honeywell Fluka, Muskegon, MI, USA | 35113-1L | |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma-Aldrich, St. Louis, Missouri, United States | L2020-1MG | |
| M199-Medium | Sigma-Aldirch, St. Louis, Missouri, United States | M4530 | |
| Mg-ATP | Sigma-Aldrich, St. Louis, Missouri, United States | A9187-1G | |
| MgCl2 | Sigma-Aldrich, St. Louis, Missouri, United States | 63069-500ML | |
| NaCl | Fisher Scientific, Loughborough, Leics., UK | 10428420 | |
| NaCl-Solution 0.9%, Isotone Kochsalz-Lösung 0.9% | Braun Melsungen AG, Melsungen, Germany | 3200950 | |
| NaOH | AppliChem GmbH, Darmstadt, Germany | A6579 | without Ca2+/Mg2+ |
| Na-pyruvat | Sigma-Aldrich, St. Louis, Missouri, United States | P2256-100MG | |
| Phosphate Buffered Saline | Sigma-Aldrich, St. Louis, Missouri, United States | D1408-500ML | |
| Poly(2-hydroxyethyl methacrylate) | Sigma, Poole, UK | 192066 | |
| Protease XIV from Streptomyces griseus | Sigma-Aldrich, St. Louis, Missouri, United States | P5147-1G | |
| Taurine | Sigma-Aldrich, St. Louis, Missouri, United States | T0625-500G | |
| Thiopental Inresa 0.5 g | Inresa Arzneimittel GmbH, Freiburg, Germany | PZN-11852249 | |
| Xylazine hydrochloride, Rompun 2% | Bayer Vital GmbH, Leverkusen, Germany | PZN-01320422 |
Referencias
- Harz, H., Hegemann, P. Rhodopsin-regulated calcium currents in Chlamydomonas. Nature. 351, 489-491 (1991).
- Litvin, F. F., Sineshchekov, O. A., Sineshchekov, V. A. Photoreceptor electric potential in the phototaxis of the alga Haematococcus pluvialis. Nature. 271, 476-478 (1978).
- Nagel, G., et al. Channelrhodopsin-1: A Light-Gated Proton Channel in Green Algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
- Lozier, R. H., Bogomolni, R. A., Stoeckenius, W. Bacteriorhodopsin: a light-driven proton pump in Halobacterium Halobium. Biophysical journal. 15 (9), 955-962 (1975).
- Schobert, B., Lanyi, J. K. Halorhodopsin is a light-driven chloride pump. Journal of Biological Chemistry. 257 (17), 10306-10313 (1982).
- Inoue, K., et al. A light-driven sodium ion pump in marine bacteria. Nature Communications. 4, 1678 (2013).
- Han, X., et al. A High-Light Sensitivity Optical Neural Silencer: Development and Application to Optogenetic Control of Non-Human Primate Cortex. Frontiers in Systems Neuroscience. 5, 18 (2011).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Grimm, C., Silapetere, A., Vogt, A., Bernal Sierra, Y. A., Hegemann, P. Electrical properties, substrate specificity and optogenetic potential of the engineered light-driven sodium pump eKR2. Scientific Reports. 8, 9316 (2018).
- Wietek, J., et al. Conversion of channelrhodopsin into a light-gated chloride channel. Science. 344 (6182), 409-412 (2014).
- Berndt, A. Structure-Guided Transformation. Science. 344 (6182), 420-424 (2014).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Mohamed, G. A., et al. Optical inhibition of larval zebrafish behaviour with anion channelrhodopsins. BMC Biology. 15 (1), 103 (2017).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic Neuronal Silencing in Drosophila during Visual Processing. Scientific Reports. 7, 13823 (2017).
- Govorunova, E. G., Cunha, S. R., Sineshchekov, O. A., Spudich, J. L. Anion channelrhodopsins for inhibitory cardiac optogenetics. Scientific Reports. 6, 33530 (2016).
- Kopton, R. A., et al. Cardiac Electrophysiological Effects of Light-Activated Chloride Channels. Frontiers in Physiology. 9, 1806 (2018).
- Peyronnet, R., et al. Load-dependent effects of apelin on murine cardiomyocytes. Progress in Biophysics and Molecular Biology. 130, 333-343 (2017).
- Wang, K., et al. Cardiac tissue slices: preparation, handling, and successful optical mapping. American Journal of Physiology-Heart and Circulatory Physiology. 308 (9), 1112-1125 (2015).
- Nishimura, S., et al. Single cell mechanics of rat cardiomyocytes under isometric, unloaded, and physiologically loaded conditions. American Journal of Physiology-Heart and Circulatory Physiology. 287 (1), 196-202 (2004).
- Mitcheson, J. S., Hancox, J. C., Levi, A. J. Action potentials, ion channel currents and transverse tubule density in adult rabbit ventricular myocytes maintained for 6 days in cell culture. Pflugers Archiv European Journal of Physiology. 43 (6), 814-827 (1996).
- Burton, R. A. B., et al. Caveolae in Rabbit Ventricular Myocytes: Distribution and Dynamic Diminution after Cell Isolation. Biophysical Journal. 113 (5), 1047-1059 (2017).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in cardiomyocyte isolation, culture, and gene transfer. Journal of Molecular and Cellular Cardiology. 51 (3), 288-298 (2011).
- Janssen, P. M., Hunter, W. C. Force, not sarcomere length, correlates with prolongation of isosarcometric contraction. The American Journal of Physiology. 269 (2), 676-685 (1995).
- Monasky, M. M., Varian, K. D., Davis, J. P., Janssen, P. M. L. Dissociation of force decline from calcium decline by preload in isolated rabbit myocardium. Pflugers Archiv European Journal of Physiology. 456 (2), 267-276 (2008).
- Kleinlogel, S., et al. Ultra light-sensitive and fast neuronal activation with the Ca 2+-permeable channelrhodopsin CatCh. Nature Neuroscience. 14 (4), 513-518 (2011).
- Schneider-Warme, F., Ravens, U. Using light to fight atrial fibrillation. Cardiovascular Research. 114 (5), 635-637 (2018).
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature. 463 (7277), 98-102 (2010).
- Bernal Sierra, Y. A., et al. Potassium channel-based optogenetic silencing. Nature Communications. 9 (1), 4611 (2018).
- Oda, K., et al. Crystal structure of the red light-activated channelrhodopsin Chrimson. Nature Communications. 9 (1), 3949 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados