Method Article
Электромеханическая оценка оптогенетически модулированной кардиомиоцитной активности
В этой статье
Резюме
Мы представляем протокол для оценки электромеханических эффектов активации GtACR1 в кроличьи кардиомиоцитах. Мы предоставляем подробную информацию об изоляции клеток, культивировании и аденовирусной трансдукции, а также о функциональных экспериментах с методами патч-зажима и углеродного волокна.
Аннотация
За последние два десятилетия, оптогенетические инструменты были созданы в качестве мощного средства для модулировать клеточного типа конкретной деятельности в возбудимых тканей, в том числе сердца. В то время как Channelrhodopsin-2 (ChR2) является общим инструментом для деполяризации мембранного потенциала в кардиомиоцитах (CM), потенциально вызывая потенциалы действий (AP), эффективный инструмент для надежного замалчивания активности СМ отсутствует. Было предложено использовать анион каналаrhodopsins (ACR) для оптогенетического ингибирования. Здесь мы описываем протокол для оценки последствий активации естественного ACR GtACR1 от Guillardia theta в культивированных кролика CM. Первичные считывания электрофизиологических патч-зажим записей и оптического отслеживания сокращений CM, как осуществляется при применении различных моделей световой стимуляции. Протокол включает в себя изоляцию CM от сердца кролика, посев и культивирование клеток на срок до 4 дней, трансдукцию через аденовирусно-кодирование для светозащитного хлорида канала, подготовка патч-зажима и углеродного волокна установки, сбор данных и анализ. Использование метода патч-зажима в конфигурации цельноя ячейки позволяет записывать светоактивные токи (в режиме напряжения-зажима, V-зажим) и AP (режим тока-зажима, I-clamp) в режиме реального времени. В дополнение к патч-зажим экспериментов, мы проводим измерения контрактности для функциональной оценки активности CM, не нарушая внутриклеточной среды. Для этого клетки механически предварительно загружаются с использованием углеродных волокон, а сокращения регистрируются путем отслеживания изменений длины саркомера и расстояния углеродного волокна. Анализ данных включает оценку продолжительности AP с записей I-зажима, пиковых токов из V-зажимных записей и расчета силы из измерений углеродного волокна. Описанный протокол может быть применен к тестированию биофизического воздействия различных оптогенетических приводов на активность СМ, что является необходимым условием для развития механистического понимания оптогенетических экспериментов в сердечной ткани и целых сердцах.
Введение
ChR-опосредовано фототоки были впервые зарегистрированы в eyepot of одноклеточных зеленых водорослей1,2. Вскоре после генетического клонирования и гетерологические выражения Chlamydomonas reinhardtii ChR1 и ChR2, ChR были использованы в качестве инструментов для изменения мембранного потенциала в ооцитов Xenopus и млекопитающих клетоксветом 3,4. Кация неселективных ChR деполяризовать мембрану клеток с потенциалом покоя мембраны, что отрицательно к реверсивного потенциала ChR. Таким образом, они могут быть использованы для вызвать AP в возбудимых клетках, включая нейроны и CM, что позволяет оптический темп5,6.
В дополнение к катионch ChR, светоуправляемый протон, хлорид и натриевые насосы7,8,9 были использованы для ингибирования нейронной активности10,11,12. Однако последние имеют ограничения, требующие высокой интенсивности света и устойчивого освещения, так как один ион транспортируется на поглощенный фотон. В 2014 году в двух независимых исследованиях Wietek et al. и Berndt et al. описано преобразование катионопроводящей ChR в ACR через мутации в поре канала13,14. Год спустя, природные ACR были обнаружены в криптофит Гийярдия тета (GtACR)15. Как инженерии ACR показали остаточный катид проводимости, они были заменены природными ACR, характеризуется большой одноканальной проводимости и высокой светочувствительности15. GtACR были использованы, чтобы заставить замолчать нейронной активности путем поляризации мембранного потенциала к разворотному потенциалу хлорида16,17. Говорунова и др. применили GtACR1 к культивируемому крысиному желудочку CM и показали эффективный фотоингибион при низких уровнях интенсивности света, которые не были достаточными для активации ранее доступных инструментов ингибирования, таких как протонный насос Arch18. Наша группа недавно сообщила, что GtACR1-опосредованных фотоингионсcm CM основан на деполяризации и что GtACR1 также может быть использован, следовательно, для оптического темпа CM19.
Здесь мы представляем протокол для изучения электрофизиологических и механических эффектов фотоактивации GtACR1 на культивируемый желудочковый желудочек кролика CM. Сначала мы описываем изоляцию клеток, культивирование и трансдукцию. Электрофизиологические эффекты измеряются с помощью цельноклеточных записей патч-зажима. Свето-опосредованные токи при данном мембранном напряжении оцениваются в режиме V-зажима. Потенциальная динамика Мембраны измеряется во время электрического или оптического темпа CM (режим I-зажима). Оптическое ингибирование электрически срабатывающей АП тестируется с помощью устойчивого применения света. Механические эффекты измеряются с использованием углеродных волокон в сочетании с слежением на основе изображений длины саркомера. Для этого оптически темпируемые клетки механически предварительно загружаются путем присоединения двух углеродных волокон к плазменной мембране вблизи противоположных концов клеток. Изменения длины саркомера регистрируются во время оптического или электрического темпа. Наконец, фотоингибибион измеряется во время стимуляции электрического поля клеток, и анализируются генерируемые силы.
Протокол включает в себя следующие шаги, показанные в flowchart на рисунке 1: кролик анестезия глубокой анестезии, тиопентальной передозировки инъекции, иссечение сердца, Langendorff-перфузии и пищеварения тканей, механическая диссоциация ткани, чтобы освободить клетки, микроскопический анализ урожайности СМ, культивирование CM, трансдукция с аденовирусным типом 5, а затем инкубации и функциональных экспериментов.

Рисунок 1: Flowchart протокола, используемого для получения электрически химаидируемого CM. Сердца вырезаны из кроликов 9-10 недель, и сердечная ткань переваривается во время проникнуты с помощью установки Langendorff. Клетки высвобождаются механическим возбуждением. Доходность CM подсчитывается под микроскопом. CM культивируются, трансумцируются аденовирусом типа 5 и функциональные эксперименты проводятся 48-72 часа после трансдукции. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
протокол
Все эксперименты с кроликами проводились в соответствии с руководящими принципами, изложенными в Директиве 2010/63/ЕС Европейского парламента по защите животных, используемых в научных целях, и одобрены местными властями в Баден-Вюртемберге (Regierungspr'sidium Freiburg, X-16/10R, Германия).
1. Решения для клеточной изоляции
- Подготовьте решения для изоляции клеток с водой следующих требований (Таблица 1) и в соответствии с ионными композициями, перечисленными в таблице 2.
ПРИМЕЧАНИЕ: CaCl2 и MgCl2 добавляются из 1 M фондовых решений.
| Потребности в воде | |
| Проводимость (S/cm) при 25 градусах Цельсия | 0.055 |
| Пироген (ЕС/мл) | Злт; 0,001 |
| Частица (размерю 0,22 мкм) | No 1 No 1 |
| Всего органического углерода (ppb) | Злт; 5 |
| Микроорганизмы (CFU/mL) | No 1 No 1 |
| RNase (нг/мл) | Злт; 0,01 |
| DNase (нг/мл) | Злт; 4 |
Таблица 1: Потребности в воде.
| Физиологический соевый раствор (1) | Низкий уровень кальция, раствор с высоким содержанием калия (2) | Ферментный раствор (3) | Блокирующее решение | |
| НаКл (ММ) | 137 | 137 | 137 | 137 |
| KCl (ММ) | 4 | 14 | 14 | 14 |
| HEPES (мМ) | 10 | 10 | 10 | 10 |
| Креатин (мМ) | 10 | 10 | 10 | 10 |
| Таурин (мМ) | 20 | 20 | 20 | 20 |
| Глюкоза (мМ) | 10 | 10 | 10 | 10 |
| MgCl2 (мМ) | 1 | 1 | 1 | 1 |
| Аденозин (мМ) | 5 | 5 | 5 | 5 |
| L-карнитин (мМ) | 2 | 2 | 2 | 2 |
| CaCl2 (мМ) | 1 | - | 0.1 | 0.1 |
| На-Хепарин (IU/L) | 5000 | - | - | - |
| EGTA (MM) | - | 0.096 | ||
| Коллагенеза типа 2, 315 U/mg (г/л) | - | - | 0.6 | - |
| Протеаза XIV (г/л) | - | - | 0.03 | - |
| Бойвин сывороточный альбомин (%) | - | - | - | 0.5 |
| Осмолярити (моосмол/Л) | 325 х 5 | 345 х 5 | 345 х 5 | 345 х 5 |
Таблица 2: Решения для изоляции CM.
- Отрегулируйте все решения на рН 7.4 при 37 градусах Цельсия и проверьте осмоляритность.
ПРИМЕЧАНИЕ: Растворите ферменты (Collagenase типа 2 и Protease XIV) непосредственно перед иссечением сердца. Кислородировать все растворы до использования.
2. Подготовка установки Лангендорф-перфузии
ПРИМЕЧАНИЕ: Использованная установка изготовлена на заказ. Как показано на рисунке 2, установка состоит из трех водяных водохранилищ (1-3), один спиральный счетчик потока теплообменник (4) и водяной куртке перфузии судна (5).

Рисунок 2: Лангендорф-перфузионная установка, оптимизированная для изоляции клеток кролика. (1-3) Водяные резервуары с (1) физиологическим сольственный раствор, (2) низкий уровень кальция, раствор высокого калия и (3) ферментосодержащий кардиоплегический раствор. (4) Спиральный встречный поток теплообменщика и (5) воды куртки сбора бака. Приток воды курткой системы спиральный теплообменник (температура растворов, оставляющих перфузионную канюли в конце теплообменника должна быть постоянной при температуре 37 градусов по Цельсию), а затем перфузии судна и трех резервуаров. Все растворы насыщены кислородом (линия с разбитой). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
- Включите насос водяной ванны, чтобы циркулировать воду при температуре 38 градусов по Цельсию в системе теплообмена и разогреть все растворы до 37 градусов по Цельсию.
ПРИМЕЧАНИЕ: Температура при оттоке (4) должна контролироваться и быть постоянной при температуре 37 градусов по Цельсию. - Заполните три резервуара соответствующим раствором и промойте каждую линию (черную) соответствующим раствором. Заполните основную (синюю) линию в конце без пузырьков воздуха с помощью раствора (1).
ПРИМЕЧАНИЕ: Oxygenate решения до (10 мин) и во время использования. Заполните линию от резервуара (3) до крана с низким содержанием кальция, высоким раствором калия. - Подготовьте шов, чтобы связать сердце вокруг аорты у канюли.
3. Изоляция клеток
- Подготовьте следующие шприцы.
- Для седации/анестезии: Смешайте 0,5 мл/кг массы тела экетамина гидрохлорида (25 мг/мл) и 0,2 мл/кг массы тела ксилазина гидрохлорид (2%).
- Заполните два шприца раствором NaCl 12 мл (0,9%).
- Приготовьте 6 мл 12,5 мг/мл Na-thiopental, растворенный в 0,9% раствора NaCl.
- Заполните 0,2 мл гидрохлорида эскетамина (25 мг/мл) в шприце.
- Разбавить 0,2 мл На-гепарина (5000 МЕ/мл) в 1 мл 0,9% NaCl раствор (конечная концентрация 1000 МЕ/мл).
- Седат/анестезируйте кроликов (9-10 недель, новозеландский белый кролик, самка или мужчина, 2 кг) с помощью внутримышечной инъекции гидрохлорида экетамина и гидрохлорида ксилазина (шаг 3.1.1).
ПРИМЕЧАНИЕ: Кролики нужно по крайней мере 10 минут, чтобы быть полностью анестезируется; точная продолжительность зависит от их массы тела. Подтверждайте анестезию с потерей выправителя. - Бритье груди и ушей, где расположены вены.
- Вставьте гибкую канюлю в ухо ввену, зафиксируй ее лентой и промойте ее раствором NaCl 0,9%.
- Вводят 1 мл раствора Na-heparin внутривенно и промывают раствором NaCl 0,9%.
- Вводят 0,2 мл гидрохлорида экетамина, снова промойте раствором NaCl 0,9% и впрысните На-тиопентал до апноэ.
ПРИМЕЧАНИЕ: Кролик не должен реагировать на рефлектор отмены педали. - Откройте грудь с левой стороны и удалите перикард.
- Запустите таймер, когда сердце вырезано и мыть сердце в два раза в физиологических сольняного раствора.
ПРИМЕЧАНИЕ: Используйте ножницы с круглыми наконечниками, чтобы предотвратить случайное повреждение сердечной ткани. - Каннуляция аорты в ванне с физиологическим сольным раствором и держать все ткани в растворе. Включите систему Лангендорф-перфузионная (физиологический солевый раствор (1), скорость 24 мл/мин).
- Перенесите сердце в установку Лангендорф-перфузии, соедините аорту с перфузатным соплом и плотно свяжите сердце швом вокруг аорты к канюле (злт; 1 мин).
ПРИМЕЧАНИЕ: Предварительно заполнить канюли с физиологическим сольственный раствор, убедитесь, что никакие пузырьки воздуха войти в канюль во время транспортировки из канистика сайта в установку Langendorff, подключить пузырь бесплатно. - Пронизывают сердце до тех пор, пока вся кровь не вымывается (2-3 мин).
- Перейти на низкокальциевый, раствор с высоким содержанием калия (2). Perfuse в течение 2 минут после того, как сердце перестало биться и перейти на ферментный раствор.
- Начните рециркуляции фермента раствор, после 2 мин от начала пищеварения, обратно в резервуар. Снижение скорости до 16 мл/мин после 5 мин пищеварения.
- Когда ткань появится мягкой (40-50 мин пищеварения), отрежьте сердце от канюли и отделите левый желудочек.
- Высвобождение клеток путем механической диссоциации (мягко потянув друг от друга ткани с пипеткой и тонкими щипками для удержания ткани) в блокирующем растворе.
- Фильтр ячейки подвески через сетку (размер омичи 1 мм2) и центрифуги в течение 2 мин при 22 х г (гравитационное ускорение).
- Удалите супернатант, содержащий немиоциты и повторно приостановить CM в блокирующем растворе.
4. Культивирование СМ
ПРИМЕЧАНИЕ: Выполните следующие шаги в стерильных условиях.
- Разбавленный ламинин (от Engelbreth-Holm-Swarm murine sarcoma подвалм мембраны, 1 мг/мл) 1:10 в стерильных фосфатных буферных солей (без Ca2 "/Mg2")до окончательной концентрации 100 мкг/мл.
- Подготовка среды культуры в M199-Medium с добавками, как указано в таблице 3.
| Среда культуры клетки в M199-Medium | |
| Креатин (мМ) | 5 |
| L-карнитин гидрохлорид (мМ) | 2 |
| Таурин (мМ) | 5 |
| На-Пируват (ММ) | 1 |
| Инсулин (бычья поджелудочная железа) | 0.25 |
| Цитозин-я-D-арабиноураганид (mM) | 0.01 |
| Гентамицин (мг/мл) | 0.05 |
Таблица 3: Среда культуры клеток.
- Стерильный фильтр раствор (0,22 мкм) и добавить 5% фетальной сыворотки крупного рогатого скота.
- Для патч-зажим экспериментов autoclave охватывает губы 16 мм, толщина No 0, покрасуй их 100 мкг/мл ламинина непосредственно перед культивированием.
- Для экспериментов с углеродным волокном, пальто Петри блюдо поверхности с поли (2-гидроксиэтил метакрилат) (поли-HEMA, 0,12 г/мл в 95:5 EtOH:H2 0)и дайте ему затвердеть.
ПРИМЕЧАНИЕ: Клетки не 'прилипают' к поли-HEMA покрытием Петри блюда; это имеет решающее значение для их трения менее сокращения в исследованиях клеточной механики. - После повторного приостановлено CM поселились (10-15 мин), удалить супернатант, а затем повторно приостановить CM в культуре среды.
- Подсчитайте CM с камерой Neubauer и семенем на плотности цели 17.500 клеток/mL или на ламинина покрынные крышки или в поли-HEMA покрынных тарелках Петри.
- Инкубировать клетки при 37 градусах Цельсия, 5% CO2 в течение 3-4 часов. Обмен среды (37 градусов по Цельсию) покрывало посевных клеток.
- Добавьте аденовирус (тип 5) кодирования для GtACR1-eGFP с множественностью инфекции (МВД) 75 и начните функциональные эксперименты через 48 часов.
ПРИМЕЧАНИЕ: После трансдукции держать клетки в темноте. Используйте красное освещение при работе с синими или зелеными светоактивированными белками. Для клонирования генов, кодирующих GtACR1-eGFP в аденовирусный вектор, используется коммерчески доступная система аденовирусной доставки (см. Таблица материалов). Вставка интереса, здесь GtACR1-eGFP, усиливается ПЦР, а затем в сочетании с аденовирусным вектором, включая промоутер ЦМВ в реакции IN-Fusion Cloning. Промоторик ЦМВ (цитомегаловирус человека) обычно используется для привода переэкспрессии трансгенов в клетках млекопитающих. eGFP представляет собой улучшенный зеленый флуоресцентный белок, полученный из Aequorea victoria с максимумом возбуждения 488 нм и максимумом выбросов на уровне 507 нм. Аденовирус (тип 5) был произведен за вневцертом в Шарите-Университете Берлина, Институт фармакологии, Берлин, профессор д-р Михаэль Шупп.
ВНИМАНИЕ: Аденовирвиртрансация классифицируется как BSL-2 безопасности работы, и соответствующие меры безопасности являются юридически обязательными.
5. Функциональные эксперименты
ПРИМЕЧАНИЕ: Записи выполняются с помощью перевернутого флуоресцентного микроскопа. Фильтр передачи света красным фильтром полосы прохода (630/20 нм) в конденсаторе, чтобы избежать совместной активации GtACR1.
-
Установка патч-зажима
- Используйте усилитель в сочетании с аналогом цифрового преобразователя. Используйте программное обеспечение для сбора данных для записи текущих данных и данных о напряжении (см. таблицу материалов).
ПРИМЕЧАНИЕ: Записанные данные оцифровываются при 10 кГц и фильтруются при 5 кГц.
- Используйте усилитель в сочетании с аналогом цифрового преобразователя. Используйте программное обеспечение для сбора данных для записи текущих данных и данных о напряжении (см. таблицу материалов).
-
Установка углеродного волокна
- Используйте камеру для обнаружения положения углеродного волокна и длины саркомера путем отслеживания изменений в оптическом контрасте (углеродные волокна появляются как более темные структуры, наложенные на полосатый рисунок ячейки). Схематическое представление установки показано на рисунке 3.
ПРИМЕЧАНИЕ: Длина Саркомера рассчитывается в режиме реального времени с помощью быстрого преобразования Фурье (FFT) спектра мощности шаблона полос.
- Используйте камеру для обнаружения положения углеродного волокна и длины саркомера путем отслеживания изменений в оптическом контрасте (углеродные волокна появляются как более темные структуры, наложенные на полосатый рисунок ячейки). Схематическое представление установки показано на рисунке 3.

Рисунок 3: Схема, изображающая экспериментальную установку для измерений углеродного волокна. (Рисование не в масштабе). Два углеродных волокна крепятся на клетке, и их положение контролируется позиционером пьезо. Темсер используется для стимуляции электрического поля. Многоцветные светодиоды соединяются в портом эпифлюоресценции перевернутого микроскопа для освещения клеток в плоскости объекта. Светодиодная мощность управляется с помощью специального пульта управления, который получает цифровые импульсы через цифровую выходную часть цифрового аналога-преобразователя (DAC). DAC общается через аналоговый выход с интерфейсом системы флуоресценции. Черно-белая камера (774 пикселя на 245 строк) для клеточной визуализации подключена к компьютеру для отслеживания длины саркомера и изгиба углеродного волокна. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
- Приуроченное освещение
- Обеспечить свет для флуоресценции микроскопии и активации световых ионных каналов через внешний специально построенный светодиодный контрольный ящик, состоящий из трех светодиодов разного цвета (460 нм, 525 нм, 640 нм, см. Таблица материалов).
- Измените микроконтроллер и графический пользовательский интерфейс (GUI) код для коробки управления, чтобы позволить контролировать светодиод через внешние импульсы Time to Live (TTL), генерируемые в протоколах программного обеспечения для сбора данных (см. Таблица Материалов). Передаем импульсы TTL в светодиодную коробку управления с помощью цифрового аналога-преобразователя.
- Привод светодиодии и выбрать количество импульсов через GUI. Получив команду от GUI, микроконтроллер запускает процесс на новом ядре. В этом процессе ввод TTL, а также набор переключателей управления от GUI будут постоянно проверяться.
- Когда ввод TTL положительный, микроконтроллер включает светодиод, а затем возобновляет проверку ввода TTL. Как только сигнал TTL возвращается к нулю, микроконтроллер выключает светодиод и уменьшает количество импульсов, оставленных одним. Если в какой-либо момент переключатель управления является ложным или количество импульсов равно нулю, микроконтроллер останавливает этот процесс до получения новой команды от графического интерфейса.
- Непосредственно пара светодиодов в backport микроскопа.
- Определение интенсивности света в плоскости объекта
- Измерьте освещенную область сценическим микрометром (объективное увеличение 40x, А 0,8 мм2).
- Используйте оптический счетчик мощности (см. Таблица материалов).
- Определите настройки для экспериментов: волнообразная длина возбуждения (525 нм), объективное увеличение (40x), возбуждающий фильтр (530/20 нм) или зеркало, и зачитывайте световую мощность при различных светодиодных входиных напряжениях.
- Рассчитайте интенсивность света «W/mm2»,разделив световую мощь по освещенной области (мм2)(здесь: 0,8 мм2).
ПРИМЕЧАНИЕ: Измерьте фактическую силу света с соответствующими протоколами в шаге 5.6 для того чтобы проверить если короткие продолжительности ИМПа пульса света 10 MS достигают и длинние продолжительности держат установленное значение (Дополнительная рисунок 1).
- Подготовка к экспериментам патч-зажима
- Подготовьте следующие внешние и внутренние решения(Таблица 4; для потребностей в воде см. Таблица 1).
- Отрегулируйте осмоляритность с глюкозой до 300 и 5 mOsmol/L. Aliquot внутреннего раствора и хранить при -20 градусах Цельсия.
ПРИМЕЧАНИЕ: Держите внутреннее решение на льду в течение дня записи. Держите внешний раствор при комнатной температуре. Здесь описано патч-зажим решения были основаны на ранее используемых решений и Cl- концентрация была изменена на более низкие, более физиологические уровни7. Для характеристики ионной селективности соответствующего оптогенетического актуатора мы предлагаем изменять концентрации основных ионов (например, Cl-, Naq, Kq, H)в вне- и внутриклеточных растворах19. - Снимите электрод записи с держателя пипетки и удалите слой хлорида серебра из серебряной проволоки с очень тонкой наждачной бумагой.
ПРИМЕЧАНИЕ: Сделайте этот шаг в начале каждого дня измерения. - Подключите провод к положительному полюсу батареи 1.5 V и погрузите в раствор 3 M KCl для покрытия хлорида серебра в течение 10 мин.
ПРИМЕЧАНИЕ: Отрицательный полюс подключен к эталонной серебряной проволоке, погруженной в решение 3 M KCl. - Подготовьте измерительную камеру: положите кремниевую смазку на раму измерительной камеры и поместите крышку (диаметр: 50 мм, толщина No 0) на верхней части рамы, чтобы камера была запечатана.
- Положите эталонный электрод из серебра/серебряного хлорида в ванну и соедините его с головной стадией.
- Вытяните 1,7 - 2,5 МЗ патч пипетки из соды известковых стеклянных капилляров (внешний диаметр: 1,55 мм, внутренний диаметр: 1,15 мм) с микропипетом шкив (см. Таблица материалов).
- Начало программного обеспечения для сбора данных и отрегулируйте мембранный тест (пульс 10 мВ на 15 мс, базовый 0 мВ).
| Внешний раствор для ванны | Внутреннее решение пипетки | |
| НаКл (ММ) | 140 | - |
| KCl (ММ) | 5.4 | 11 |
| CaCl2 (мМ) | 1 | - |
| MgCl2 (мМ) | 2 | 2 |
| Глюкоза (мМ) | 10 | - |
| HEPES (мМ) | 10 | 10 |
| К-Аспартат (мМ) | - | 119 |
| Мг-АТП (мМ) | - | 3 |
| EGTA (MM) | - | 10 |
| Ph | 7.4 (NaOH) | 7.2 (KOH) |
| Осмоляритность (отрегулировать с глюкозой) | 300 х 5 | 300 х 5 |
Таблица 4: Патч-зажим решений.
- Протоколы для измерений патч-зажима
- Запись протокола фотоактивации в режиме V-зажима при удержании потенциала -74 мВ. Используйте световые импульсы 300 мс.
ПРИМЕЧАНИЕ: Мы предлагаем выполнять V-зажим записей близко к покоя мембраны потенциал культивированных CM (установлено в I-зажим; в наших руках между -79 мВ и -77 мВ как для транс-индуцированных и не-трансиндуцированных CM19). Свежеизолированные клетки показывают средний потенциал мембраны отдыха -79 мВ(Дополнительная диаграмма 2, все значения после коррекции для потенциала жидкого соединения). - Запись AP в режиме I-зажима на 0 pA.
- Для электрического темпа, вводить ток импульсов 10 мс (рампа от 0 pA до установленного значения в пределах 10 мс), 0,25 Гц и найти порог, чтобы вызвать AP. Запись AP токовых инъекций на 50% больше порога.
- Для оптического темпа используют световые импульсы 10 мс, 0,25 Гц при минимальной интенсивности света, чтобы вызвать надежный AP.
- Запись фотоингионирования в режиме I-зажима на 0 pA. Elicit AP, как описано в шаге 5.6.2.1 и применять устойчивый свет для 64 с на 4 мВт / мм2 после 15 электрически срабатывает AP.
ПРИМЕЧАНИЕ: На рисунке 6F показан протокол фотоингибиции, где при устойчивом освещении применяются более высокие инъекции тока. Начиная с 1,5 раза порога (здесь: 0,7 н.а.) впрыскиваемый ток был увеличен шагами 0,1 н.А. (окончательный уровень: 2,2 н.А.). При всех испытанных текущих амплитуд, устойчивое применение света ингибирует генерацию AP.- В качестве контрольного эксперимента, пауза электрической стимуляции на 64 с без применения света.
- Запись протокола фотоактивации в режиме V-зажима при удержании потенциала -74 мВ. Используйте световые импульсы 300 мс.
- Эксперименты с патч-зажимом
ПРИМЕЧАНИЕ: Выполните следующие эксперименты в темноте (красный свет может быть использован для синих / зеленых светоактивных инструментов).- Поместите крышку с клетками в измерительной камере с внешним раствором и выберите флуоресцентный СМ.
ПРИМЕЧАНИЕ: eGFP-положительные клетки могут быть обнаружены с помощью синего светодиода (460 нм) в сочетании с фильтром возбуждения диапазона (450 нм - 490 нм), дихроическим зеркалом 510 нм и фильтром дальнего прохода 515 нм. Если используются другие флуоресцентные метки, используйте соответствующие светодиодные и флуоресцентные фильтры. Если достигается высокая эффективность трансдукции (в наших руках 99% с аденовирусом GtACR1), нет необходимости проверять флуоресценцию eGFP перед функциональными экспериментами; это позволяет избежать потенциальной предварительной активации GtACR1. - Заполните патч пипетку внутренним решением. Убедитесь, что в кончике нет пузырьков воздуха.
- Прикрепите пипетку к держателю пипетки, вставив в внутреннее решение записи серебряно-хлоридной серебряной проволоки.
- После достижения конфигурации, прикрепленной к ячейке, переключитесь на режим для всех ячеек в программном обеспечении для сбора данных с потенциалом удержания -74 мВ. Разрежайте мембрану, мягко применяя отрицательное давление для доступа к конфигурации цельноклеточных клеток. Об этом свидетельствует немедленное увеличение измеренной емки.
- Выполнить протоколы, описанные в разделе 5.6.
- Поместите крышку с клетками в измерительной камере с внешним раствором и выберите флуоресцентный СМ.
- Техника углеродного волокна
- Производство углеродных волокон.
- Используйте стеклянные капилляры со следующими параметрами: внешний диаметр: 2,0 мм, внутренний диаметр: 1,16 мм, длина: 100 мм (см. Таблица материалов). Используя выдвижной микропипетет, потяните стеклянный капилляр на две пипетки одинаковой длины (общая длина конуса 11 мм, рисунок 5) до окончательного внутреннего диаметра в 30 мкм.
ПРИМЕЧАНИЕ: Параметры, используемые для первого и второго тяги, составляют 85,2% (пропорционально максимальному выходу шкива) и 49,0%, соответственно (будет зависеть от шкива, типа и возраста нити). - Согните пипетки до 45 "с самодельной микро кузницы с использованием настроек 12 V, 24 A (см. Рисунок 4 для деталей установки изгиба пипетки).
- Выровнять капилляр (2) на красной линии в круге ориентации (5), сохранить позиционирование капилляра постоянной, так что длина изгиба части всегда то же самое после центра круга ориентации (радиус 4,5 мм).
- Согните капилляр до 45 "(зеленая линия), нажав вниз кончик капилляра с бендером (3) и ковать путем нагрева нити (4) до капилляра захватывает 45 "угол даже после бендер удаляется.
- Приспособите углеродные волокна (при условии, от профессора Jean-Yves Le Guennec) в тонкий кончик стеклянного капилляра под стерео микроскопом. Используйте тонкие щипцы с мягкими трубками в конце, чтобы увеличить сцепление и уменьшить риск повреждения волокон.
ПРИМЕЧАНИЕ: Эти волокна характеризуются микроструктурами, которые увеличивают контактную поверхность между волокнами и клетками, тем самым улучшая адгезию20. - Вырезать углеродные волокна на длину 2 мм и использовать супер клей (цианоакрилат) для фиксации волокна в передней части капилляра.
ПРИМЕЧАНИЕ: Чем длиннее волокна, тем больше они согнуть при применении той же силы.
- Используйте стеклянные капилляры со следующими параметрами: внешний диаметр: 2,0 мм, внутренний диаметр: 1,16 мм, длина: 100 мм (см. Таблица материалов). Используя выдвижной микропипетет, потяните стеклянный капилляр на две пипетки одинаковой длины (общая длина конуса 11 мм, рисунок 5) до окончательного внутреннего диаметра в 30 мкм.
- Калибровка углеродных волокон.
- Калибровать углеродные волокна с помощью силового преобразователя с чувствительностью 0,05 мН/В и диапазоном сил 0 - 0,5 мн (см. Таблица материалов).
ПРИМЕЧАНИЕ: Эта установка изготовлена на заказ для того, чтобы измерить сжатие, а не "тянуть". - Прикрепите капилляр с углеродным волокном к держателю, который управляется микроманипулятором и двигателем пьезо.
- Поместите кончик волокна в контакт с датчиком силы, но без производства какой-либо силы и переместить пьезо двигателя в шагах 10 мкм (общее движение 60 мкм) к датчику и зачитывать измеренное напряжение (E) в Вольт.
ПРИМЕЧАНИЕ: Убедитесь, что сила преобразователя связаться на самом кончике свободного конца углеродного волокна. - Повторите эти измерения три раза.
- Используйте Формулу 1, чтобы рассчитать силу для каждой позиции пьезо
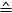 (разница измеренного напряжения между ступенями пьезо двигателя):
(разница измеренного напряжения между ступенями пьезо двигателя):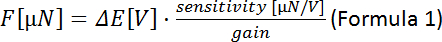
ПРИМЕЧАНИЕ: Чувствительность преобразователя силы зависит от модели преобразователя (здесь: 0,05 мН/В и 50 кН/В). Прибыль может быть установлена на контроллере. - Участок силы (N) против положения пьезо. Склон соответствует жесткости волокна (N/мкм).
- Калибровать углеродные волокна с помощью силового преобразователя с чувствительностью 0,05 мН/В и диапазоном сил 0 - 0,5 мн (см. Таблица материалов).
- Рекордная сила заключения контракта cm.
ПРИМЕЧАНИЕ: Выполните следующие эксперименты в темноте (красный свет может быть использован для синих / зеленых светоактивных инструментов).- Покрась поверхность измерительной камеры поли-ХЕМА. Заполните измерительную камеру внешним раствором ванны и положите несколько капель культивированных клеточных суспензий в камеру (шаг 4.9).
- Прикрепите капилляры с углеродными волокнами к микроманипулятору сцены. Выберите GTACR1-выражение CM, проверяя способность вызывать сокращения путем применения коротких импульсов зеленого света. Выровнять углеродные волокна почти горизонтально к поверхности измерительной камеры.
- Опустите первое волокно на поверхность клетки. Прикрепите второе волокно параллельно первому волокну на другом конце CM. Идеальное выравнивание почти перпендикулярно оси клетки.
ПРИМЕЧАНИЕ: Прикрепите волокно, осторожно нажав ячейку на нижнюю поверхность. Отпустите давление перед крепежем второго волокна. Не растягивайте клетку, прикрепив второе волокно. - После того, как оба волокна крепятся на ячейке, поднимите волокна, так что клетка не имеет контакта с поверхностью камеры больше и может сокращаться без каких-либо трений.
- Сосредоточьте саркомета в программном обеспечении для сбора данных (см. Таблица материалов)и установите окно отслеживания длины саркомера(рисунок 7А I (3)между волокнами.
ПРИМЕЧАНИЕ: В результате FFT спектр мощности (Рисунок 7A I (2)) показывает, идеально один резкий пик, представляющий среднюю длину саркомера. - Отслеживайте изгиб волокна с помощью модуля обнаружения края. Установите области обнаружения красным и зеленым окном и определите порог (красная и зеленая горизонтальная линия) на первом производной следа интенсивности света(рисунок 7A III).
- Начните оптически темп ячейки на 0,25 Гц (если это возможно, попробуйте быстрее темпа) и отслеживать саркомета длины и волокна изгиба.
ПРИМЕЧАНИЕ: Положение держателя волокна, Спусковой крючок и ульс электрической стимуляции проконтролированы через програмное обеспечение присваивания данных (см. Таблица материалов). - После записи по крайней мере 15 оптически вызвали сокращения, поле стимулируют клетку электрически (см. Таблица материалов). Найдите порог, чтобы вызвать сокращения и записать, применяя 1,5 раза порогового напряжения.
- Для протокола ингибирования, применять электрические стимулы, чтобы вызвать сокращения, а затем подвергать устойчивый свет 64 s (при различных интенсивности света).
- Производство углеродных волокон.

Рисунок 4: Установка изгиба Pipette. (1) микроманипулятор на левой стороне используется для управления положением капилляра, и второй микроманипулятор справа используется, чтобы согнуть его. (2) Капилляр. (3) Бендер. (4) Микрофорж. (5) Круг ориентации. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Пипетка с углеродным волокном. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
6. Анализ данных
-
Записи патч-зажима
ПРИМЕЧАНИЕ: Исправьте все записанные и командные напряжения для потенциала жидкого соединения после эксперимента. Определите потенциал жидкого соединения в программном обеспечении для сбора данных с помощью потенциального калькулятора соединения инструмента (для заявленных решений патч-зажима в таблице 4: 14,4 мВ при 21 КС). Вычесть потенциал жидкого соединения из зарегистрированного/командного напряжения.- Для I-зажим AP записей, проверить электрические темппо сравнению с оптическим темпом. Рассчитайте продолжительность AP (APD) на 20 и 90% repolarization с заказным скриптом (Дополнительный материал). Определите потенциал мембраны и амплитуду AP.
ПРИМЕЧАНИЕ: Определите APD как описано в Wang K. et al.21 Скрипт для загрузки файлов .abf, как правило, доступен по следующей ссылке: https://de.mathworks.com/matlabcentral/fileexchange/22114-fcollman-abfload. Средние значения APD, по крайней мере 6 AP. - Для фотоактивации V-зажима проверьте, находится ли базовый унасищение 0 pA. Если не настроить базовый уровень до нуля. Проанализируйте записанный ток, срабатывающий 300 мс световых импульсов при -74 мВ. Передача данных в программное обеспечение для анализа данных и определение пикового и среднего стационарного тока.
- Для I-зажим AP записей, проверить электрические темппо сравнению с оптическим темпом. Рассчитайте продолжительность AP (APD) на 20 и 90% repolarization с заказным скриптом (Дополнительный материал). Определите потенциал мембраны и амплитуду AP.
-
Эксперименты с углеродным волокном
- Записи сокращения во время оптического темпа: Загрузите записанные данные в программное обеспечение для сбора данных и зачитывайте базовые и максимальные изгибы углеродного волокна и изменения длины саркомера.
ПРИМЕЧАНИЕ: Средние значения для 10 сокращений стабильной записи. - Измерьте ширину ячейки и вычислите поперечную область клетки, предполагая эллиптический поперечный сечение(рисунок 7B II).
ПРИМЕЧАНИЕ: Формула для области эллипса является А АЗа",b (Формула 2), где расстояние от центра до вершины и b является расстояние от центра до со-вершины. В нашем случае это означает , что (ширина ячейки)/2 и b (толщина ячейки)/2. По данным Nishimura et al.22 толщина CM может быть оценена в одну треть ширины ячейки, так что А ширина ширины толщина ширина ширины ширина ширины (1/12) ширина2. - Рассчитайте конечную систолическую силу (F):
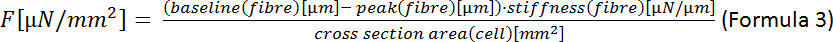
- Рассчитайте деформацию конечных систолических клеток (ESD):
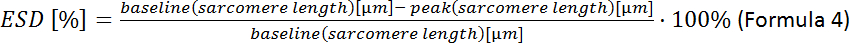
ПРИМЕЧАНИЕ: Дальнейшие контрактные параметры могут быть проанализированы: продолжительность саркомера длина, время до пика, время до 90% релаксации, дробное сокращение саркомера, максимальная скорость сжатия и релаксации (см. руководство по приобретению программного обеспечения).
- Записи сокращения во время оптического темпа: Загрузите записанные данные в программное обеспечение для сбора данных и зачитывайте базовые и максимальные изгибы углеродного волокна и изменения длины саркомера.
Результаты
GtACR1-eGFP был выражен в культивированных кролика CM(Рисунок 6 вставки) и фототоки были измерены с патчем техники. Фотоактивация GtACR1 показывает большие внутренние токи на уровне -74 мВ. На рисунке 6Пиковый ток(IP) при 4 мВт/мм2 составляет 245 pA. AP были вызваны либо электрически(Рисунок 6B) или оптически(Рисунок 6C) с текущими инъекциями 1,5 раза порог, или короткие деполяризационные световые импульсы 10 мс, соответственно. Анализируя значения APD, электрически темп ОМС показывает APD 20 из 0,24 и 0,08 с и APD 90 0,75 и 0,17 с, в то время как оптически темп CM показать APD 20 0,31 и 0,08 с и APD 90 0,81 и 0,19 с (SE, n 5, N 2, в здесь представленпример APD 20электрических 0,17 с; APD 20оптические 0,27 с и APD 90электрических 0,61 с; APD 90оптический 0,68 с; Рисунок 6D). Оптически темп CM показать медленнее AP начала(Рисунок 6D). Активация СМ была ингибирована при устойчивом освещении (для 64 с, 4 мВт/мм2)путем поляризации мембранного потенциала в сторону разворотного потенциала хлорида, здесь -58 мВ(рис. 6E). Более высокие текущие инъекции, чем в 1,5 раза порог не вызывают AP поколения(рисунок 6F). Сгенерированные пиковые силы были определены из изгиба углеродного волокна(рисунок 7B,C,E). CM генерируется 232 кН /мм2 на электрической ходьбы(рисунок 7B) и 261 кН /мм2 после оптического темпа(рисунок 7C). Длительные импульсы зеленого света подавляют сокращения(рисунок 7E). После оптического ингибирования для 64 s, повторяющиеся сокращения генерировать более низкую контрактуля силу, и силы значения восстановить к исходной линии после 10 сокращений (темп на 0,25 Гц, Рисунок 7D) в соответствии с диастолической потери кальция от кролика CM.
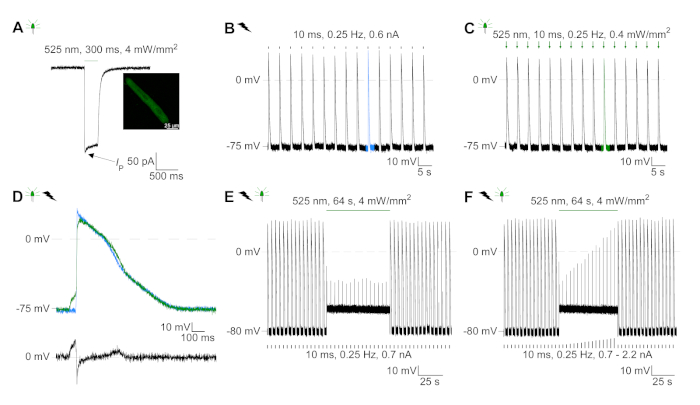
Рисунок 6: Представитель патч-зажим записи электрически и оптически темп / ингибируется CM. (A) Представитель фототок при -74 мВ с использованием легкого импульса 300 мс, 4 мВт/мм2. IP указывает пиковое течение. В вставке показана положительная ячейка GtACR1-eGFP. (B) Представитель AP записи на 0 pA с использованием текущего пандуса 10 мс, 0,6 nA для электрическиго темпа CM. (C) Представитель AP записи на 0 pA с использованием световых импульсов 10 мс, 0,4 мВт / мм2. (D) Топ-график показывает наложение10-й АП электрически (синий) и оптически (зеленый) активированный CM. AP были выровнены максимальное изменение мембранного потенциала (dV/dt max). Нижний график показывает разницу мембранного потенциала между оптически и электрически срабатывает AP(Eоптический-Eэлектрический). (E) Электрическисотилиap AP были ингибированы при устойчивом свете 64 с, 4 мВт / мм2. (F) AP ингибируются более высокими текущими инъекциями, чем 1,5 раза порог (от 0,7 nA в шагах от 0,1 nA до 2,2 nA) при устойчивом свете. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
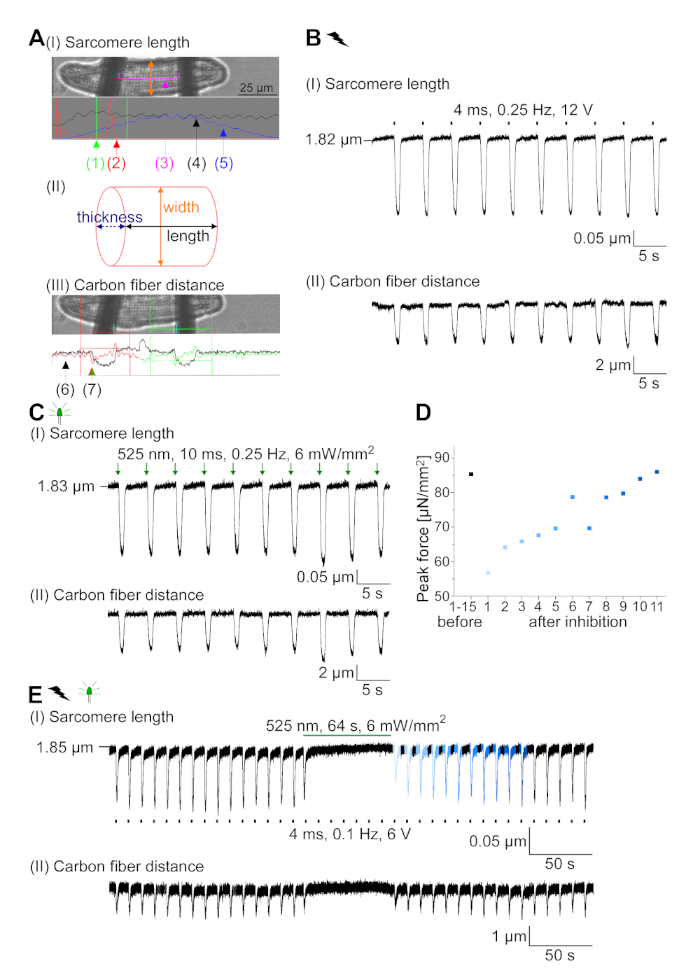
Рисунок 7: Репрезентативные данные из углеродного волокна записи оптически и электрически темп / ингибируется CM. (A) Дисплей в программном обеспечении для сбора данных. Изображение (I) показывает измеренный CM с окном для расчета длины саркомера. Ширина ячейки обозначена оранжевым цветом. (1) Диапазон соответствующих частот. (2) спектр мощности FFT показывает частоту интервала саркомера на клетке. Средняя длина саркомера рассчитывается по пиковой частоте. (3) Окно отслеживания длины Саркомера. (4) След интенсивности. (5) След интенсивности, помноженный на окно Хамминга, является следом интенсивности окон. Схема (II) показывает эллиптической сечение ячейки. Ширина в оранжевом и толщина в пунктирной синей. Изображение (III) показывает положение углеродных волокон с соответствующими ящиками обнаружения, оставленными красным цветом и правым зеленым цветом. (6) След интенсивности. (7) Первая производная следа интенсивности (см. руководство по разработке программного обеспечения для сбора данных). (B) Представитель след электрически вызвали сокращения. Панель (I) показывает сокращение длины саркомера, панель (II) расстояние между двумя углеродными волокнами. (C) Представитель след оптически вызвал сокращения (525 нм, 0,25 Гц, 10 мс, 6 мВт / мм2). Панель (I) показывает сокращение длины саркомера, панель (II) расстояние между двумя углеродными волокнами. (D) Генерируется пиковая сила от сокращения 1 до 11 после паузы, вызванной ингибированием генерации AP. (E) Представительслед оптического ингибирования сокращений при устойчивом освещении (525 нм, 64 с, 6 мВт/мм2). Панель (I) показывает сокращение длины саркомера, панель (II) длина между двумя углеродными волокнами. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| A | Области |
| Acr | анион каналродопсин |
| Ap | потенциал действия |
| Apd | потенциальной продолжительности действия |
| Cfu | колония формирования единицы |
| Chr | каналродопсин |
| См | кардиомиоцит |
| eGFP | улучшенный зеленый флуоресцентный белок |
| Esd | конец систолической деформации клеток |
| Ес | эндотоксинные единицы |
| F | Силы |
| Fft | быстрый фурьер преобразования |
| GtACR | Гийярдия тета анион каналродопсин |
| Gui | графический пользовательский интерфейс |
| I-зажим | ток-зажим |
| Ме | международные подразделения |
| Moi | множественность инфекции |
| поли-HEMA | поли (2-гидроксиэтил метакрилат) |
| V-зажим | напряжение-зажим |
Таблица 5: Список сокращений.

Дополнительная диаграмма 1: Измерения интенсивности света с оптическим счетчиком мощности. (A) Измерение 10 мс световых импульсов на 4 мВт /мм2. (B) Измерение устойчивого освещения 64 с на 4 мВт/мм2. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
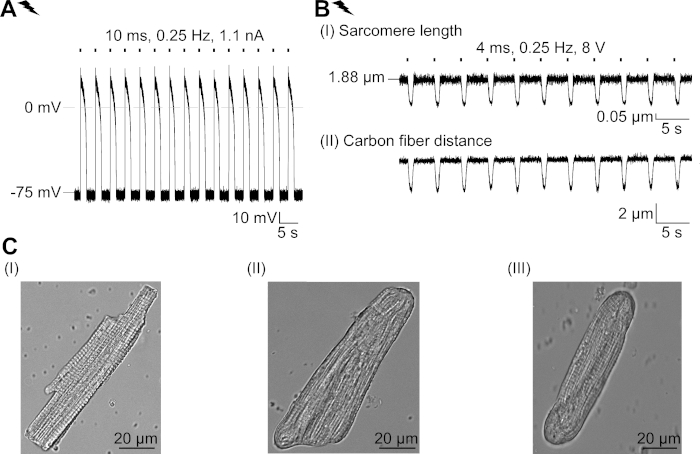
Дополнительная рисунок 2: Свойства свежеисзоледового СМ и их структурная адаптация в культуре. (A) AP запись свежеисзоледов CM (APD 20 из 1,11 и 0,34 с, APD 90 из 1,96 и 0,32 с, n No 7, N no 2). Средний потенциал мембраны покоя -79,3 и 0,8 мВ (n No 7, N 2). (B) Углеродное волокно записи электрически темпсвежей изолированных CM. Средняя пиковая сила 205 - 78 кН /мм2 (п No 7, N No 2). (C) Конфокальные изображения свежеисзоледов CM (I); нетрансутированный (II) и трансиндуцированный (III) CM после 48 часов в культуре. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Дополнительный материал: MatLab скрипт для определения APD и отдыха мембраны потенциал. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В то время как оптогенетические инструменты позволяют модуляции возбудимой электрофизиологии клеток в неинвазивной основе, они нуждаются в тщательной характеристике в различных типах клеток (например, CM), чтобы позволить выбрать наилучший доступный инструмент для конкретного экспериментального дизайна. Метод патч-зажима является стандартным методом оценки клеточной электрофизиологии. В конфигурации из цельноклеток он позволяет записывать фото-активированные токи через плазменную мембрану или временные изменения в мембранном напряжении после стимуляции света/ингибирования. Оптогенетическая манипуляция электрическим возбуждением также влияет на сокращения СМ. Мы используем саркомер отслеживания и углеродного волокна при содействии силовых измерений для количественной оценки влияния оптического допроса на механическую активность миоцитов.
Мы описываем протокол, описывающий основные эффекты свето-закрытого хлорида канала, GtACR1, в CM. В качестве модельной системы мы выбрали кролика CM, так как их электрофизиологические характеристики (например, форма AP и огнеупорный период) напоминают те, которые наблюдаются в сМ человека более близко, чем у грызунов CM. Кроме того, кролик амс может быть культивируется в течение нескольких дней, достаточно долго для аденовирусной доставки и выражения GtACR1-eGFP. Примечательно, что изолированные CM изменить свои структурные свойства в культуре с течением времени, в том числе округление клеточных окончаний и постепенное снижение кросс-стили, Т-трубной системы и caveolae23,24. В соответствии с этим, функциональные изменения были зарегистрированы в культурных CM: деполяризация потенциала покоя мембраны, продление AP и изменения в клеточной Ca2 "обработки. Для обзора клеточной адаптации в культуре, пожалуйста, см. Дополнительная диаграмма 2 показывает образцовые AP и измерения сокращения свежеисзоледов CM для сравнения с теми, которые наблюдаются в культивированных CM(Рисунок 6, Рисунок 7)с использованием здесь представленпротокола.
Цельно-клеточные записи патч-зажима позволяют проводить прямые измерения фототоковых свойств (например, амплитуд и кинетики) и световых изменений в мембранном потенциале или характеристиках AP при высоком височном разрешении. Тем не менее, такие записи имеют несколько ограничений: во-первых, цитозол заменяется раствором пипетки в цельноклеточных записях, что выгодно для управления ионными электрохимическими градиентами, но имеет внутренний недостаток мытья клеточных органелл, белков и других соединений, тем самым потенциально влияющих на клеточные электрические реакции. Во-вторых, побочные эффекты, такие как активация дополнительных ионных каналов в результате нефизиологически длительной деполяризации (например, медленные временные константы световых ионных каналов) трудно оценить, так как наш метод позволяет только обнаружить изменения в APD, но не проводить прямые измерения ионных концентраций в электрофизиологически значимых клеточных отсеках. Это может быть сделано с помощью флуоресцентных индикаторов (например, датчиков Ca2) или ионно-селективных электродов. Дальнейшая характеристика может включать в себя интенсивности света, определение рН-зависимости, фототокки кинетики в различных мембранных потенциалах и восстановление кинетики во время повторяющейся стимуляции света.
В отличие от записей патч-зажима, одноклеточные измерения силы позволяют анализировать клеточные сокращения нетронутых миоцитов, не влияя на их внутриклеточную среду. Вторичное воздействие на концентрации ионов (например, Ca2)можно косвенно оценить путем определения генерируемой амплитуды и динамики силы (например, максимальной скорости сжатия и релаксации; здесь не анализируются). Измерения силы с методом волокна углерода имеют преимущество над свободно зажатыми клетками по мере того как они обеспечивают сразу информацию на пассивных и активных усилиях в pre-loaded клетках (т.е., в условиях которые больше подобны к in situ или in vivo установкам). Механическая предзагрузка особенно важна при анализе клеточной контрактности, так как растяжка влияет на выработку силы и расслабление26,27.
Оптогенетические подходы позволяют пространственно точное манипулирование клеточной мембранной потенциал, как в одном СМ и нетронутой сердечной ткани. Классически, ChR2, свет-gated катион non-селективный канал, был использован для depolarization потенциала мембраны, тогда как свет-управляемые протон и/или насосы хлорида были использованы для гиперполяризации мембраны. Обе группы оптогенетических приводов требуют высокого уровня экспрессии, так как ChR2 характеризуется внутренне низкой одноканальной проводимостью28 и светоуправляемыми насосами, максимально транспортированными по одному иону на поглощенный фотон. Кроме того, длительная активация ChR2 в CM может привести к перегрузке Na и/или Ca2, а светоуправляемые насосы могут изменить транс-сарколеммальныйH или Cl- градиенты29,30. В поисках альтернативных инструментов для оптогенетического контроля активности CM, мы недавно протестировали естественный анион каналrhodopsin GtACR1, характеризуется превосходной одноканальной проводимости и более высокой светочувствительности по сравнению с катуляцией ChR, таких как ChR2. Мы обнаружили, что активация GtACR1 деполяризует CM и может быть использована для оптического темпа и ингибирования, в зависимости от времени и продолжительности легкого импульса. Дополнительным преимуществом использования ACR вместо катуляции ChR может быть более негативный потенциал разворота Cl- по сравнению с Naq, сокращение искусственно введенных ионных токов. Как мы уже показали ранее, оптический темп с GtACR1 может привести к продлению AP в результате медленного компонента закрытия канала GtACR1, который может быть преодолен с помощью более быстрого мутантов GtACR119. Тем не менее, ap пролонгации гораздо менее выраженприв при использовании нижней, более физиологической внутриклеточной Cl- концентрации (см. рисунок 6). Кроме того, опосредованное ингибирование gtACR1 длительным освещением приводит к глубокой деполяризации мембраны, которая снова может активировать вторичный приток Naи Ca2, тем самым изменяя активность каналов, прикрепляемых к напряжению. В наших измерениях, мы находим, что AP и сокращения параметров восстановить до базового в течение 40 с после свето-индуцированного ингибирования в течение 1 мин (см. Коптон и др. 2018, Рисунок 6, Рисунок 7). Свето-gated Kканалы предлагают мощную альтернативу для замалчивания CM, не влияя на CM отдыха мембраны потенциал31.
В будущем мы хотели бы количественно сравнить различные оптогенетические инструменты для их потенциала для ингибирования сердечной деятельности. С этой целью мы тестируем различные свето-закрытые ионные каналы, включая ACR, ChR2 и красно-сдвинутые варианты ChR32,а также гиперполяризаторы, такие как галоходопсин или легкий закрытый аденилайл циклазный bPAC в сочетании с калийным каналом SthK (PAC-K)31.
Представленный здесь протокол может быть использован для углубленной характеристики электромеханических свойств СМ. Это в основном применимо также к CM от других видов, и к CM изолированы от больной миокарда. Оптическая стимуляция позволяет темп CM на разных частотах, и различные презаты могут быть проверены во время экспериментов сокращения углеродного волокна. Интересным экспериментом было бы использовать низкоинтенсивное освещение для подпороговой деполяризации, чтобы имитировать постепенное увеличение потенциала покоя мембраны, как это можно наблюдать при развитии ремоделирования сердечной ткани во время прогрессирования заболевания. Наконец, функциональные измерения могут быть объединены с визуализацией Ca2 "для дальнейшего понимания связей возбуждения-сокращения или с фармакологическими вмешательствами для оценки влияния различных препаратов на активность СМ.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим Стефани Перес-Фелиз за отличную техническую помощь, д-р Джонас Витек (Гумбольдт-Университет, Берлин, Германия) за предоставление pUC57-GtACR1 плазмида, профессор михаэль Шупп (Шарите-Университет-Университет, Институт фармаколаги, Берлин) для производства аденовирусов и д-р Анастасия Хохлова (Уральский федеральный университет) для обмена своим опытом по улучшению клеточной изоляции и повторной разработке Проект финансировался Немецким исследовательским фондом (SPP1926: SCHN 1486/1-1; Эмми-Ноэтер стипендий: SCHN1486/2-1) и ERC Расширенный Грант CardioNECT.
Материалы
| Name | Company | Catalog Number | Comments |
| Equipment - Cell isolation/Culturing/Transduction | |||
| Adeno-X Adenoviral System 3 CMV | TaKaRa, Clontech Laboratories, Inc., Mountain View, California, USA | ||
| Aortic cannula | Radnoti | 4.8 OD x 3.6 ID x 8-9 L mm | |
| Coverslips ø 16 mm, Thickness No. 0 | VWR International GmbH, Leuven, Belgium | 631-0151 | Borosilicate Glass |
| Griffin Silk, Black, 2 m Length, Size 3, 0.5 mm | Samuel Findings, London, UK | TSGBL3 | |
| Incubator | New Brunswick, Eppendorf, Schönenbuch, Switzerland | Galaxy 170S | |
| Langendorff-perfusion set-up | Zitt-Thoma Laborbedarf Glasbläserei, Freiburg, Germany | Custom-made | |
| Langendorff-pump | Ismatec, Labortechnik-Analytik, Glattbrugg-Zürich, Switzerland | ISM444 | |
| Mesh: Nylon Monodur filter cloth | Cadisch Precision Meshes Ltd | 800 µm holes, 1 m wide | |
| Neubauer chamber | VWR International GmbH, Leuven, Belgium | 717806 | |
| Rabbit, New Zealand White | Charles River | Strain Code: 052 | |
| Scissors | Aesculap AG, Tuttlingen, Germany | BC774R | Bauchdeckenschere ger. 18cm |
| Sterile filter, 0.22 µm | Merck, Darmstadt, Germany | SLGP033RB | |
| Equipment - Patch-clamp | |||
| Amplfier | AxonInstruments, Union City, CA, United States | Axopatch 200B | |
| Coverslip ø 50 mm, Thickness No. 1 | VWR International GmbH, Leuven, Belgium | 631-0178 | Borosilicate Glass |
| Digitizer Axon Digidata | Molecular Devices, San José, CA, United States | 1550A | |
| Filter (530/20) | Leica Microsystems, Wetzlar, Germany | 11513878 | BZ:00 |
| Filter (630/20) | Chroma Technology, Bellows Falls, Vermont, United States | 227155 | |
| Headstage | AxonInstruments, Union City, CA, United States | CV203BU | |
| Interface | Scientifica, Uckfield, UK | 1U Rack, 352036 | |
| LED 525 nm | Luminus Devices, Sunnyvale, CA, United States | PT-120-G | |
| LED control software | Essel Research and Development, Toronto, Canada | ||
| LED control system | custom-made | ||
| Micropipette Puller | Narishige Co., Tokyo, Japan | PP-830 | |
| Microscope inverted | Leica Microsystems, Wetzlar, Germany | DMI4000B | |
| Motorised Micromanipulator | Scientifica, Uckfield, UK | PatchStar | |
| Optical power meter | Thorlabs, Newton, NJ, United States | PM100D | |
| Silicone Grease | RS Components, Corby, UK | 494-124 | |
| Silver wire | A-M Systems, Sequim, WA, United States | 787500 | Silver, Bare 0.015'', Coated 0.0190'', Length 25 Feet |
| Soda lime glass capillaries | Vitrex Medical A/S, Vasekaer, Denmark | 160213 BRIS, ISO12772 | 1.55 OD x 1.15 ID x 75 L mm |
| Software Axon pClamp | Molecular Devices, San José, CA, United States | Version 10.5 | |
| Software MatLab2017 | The MathWorks, Inc. | ||
| Stage micrometer | Graticules Optics LTD, Tonbridge, UK | 1 mm | |
| Equipment - Carbon fiber | |||
| Carbon fibers | provided from Prof. Jean-Yves Le Guennec | BZ:00 | |
| Digitizer Axon Digidata | Molecular Devices, Sunnyvale, CA, United States | 1550B | |
| Filter (530/20) | Leica Microsystems, Wetzlar, Germany | 11513878 | |
| Filter (630/20) | Chroma Technology, Bellows Falls, Vermont, United States | 227155 | |
| Fluorescence System Interface | IonOptix, Milton, MA United States | FSI-800 | 2.0 OD x 1.16 ID x 100 L mm |
| Force Transducer System | Aurora Scientific Inc., Ontario, Canada | 406A | |
| Glass capillaries for force measurements | Harvard Apparatus, Holliston, Massachusetts, United States | GC200F-10 | |
| Interface National Instruments | National Instruments, Budapest, Hungary | BNC-2110 | |
| LED 525 nm | Luminus Devices, Sunnyvale, CA, United States | PT-120-G | |
| LED control box | Essel Research and Development, Toronto, Canada | ||
| LED control system | custom-made | ||
| Microcontroller | Parallax Inc., Rocklin, California, United States | Propeller | |
| Micropipette Puller | Narishige Co., Tokyo, Japan | PC-10 | |
| Microscope inverted | Leica Microsystems, Wetzlar, Germany | DMI4000B | |
| MyoCam-S camera | IonOptix, Dublin, Ireland | ||
| MyoCam-S camera Power | IonOptix, Milton, MA, United States | MCS-100 | |
| MyoPacer Field Stimulator | IonOptix Cooperation, Milton, MA, United States | MYP100 | |
| Piezo Motor | Physik Instrumente (PI) GmbH & Co. KG, Karlsruhe, Germany | E-501.00 | |
| Silicone Grease | RS Components, Corby, UK | 494-124 | |
| Software Axon pClamp | Molecular Devices, San José, CA, United States | Version 10.5 | |
| Software IonWizard | IonOptix, Dublin, Ireland | Version 6.6.10.125 | |
| Software MatLab2017 | The MathWorks, Inc. | ||
| Stage micrometer | Graticules Optics LTD, Tonbridge, UK | 1 mm | |
| Chemicals | |||
| Adenosine | Sigma-Aldrich, St. Louis, Missouri, United States | A9251-100G | |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, Missouri, United States | A7030-50G | |
| CaCl2 | Honeywell Fluka, Muskegon, MI, USA | 21114-1L | |
| L-Carnitine hydrochloride | Sigma-Aldrich, St. Louis, Missouri, United States | C9500-25G | |
| Collagenase type 2, 315 U/mg | Worthington, Lakewood, NJ, USA | LS004177 | |
| Creatine | Sigma-Aldrich, St. Louis, Missouri, United States | C0780-50G | |
| Cytosine-β-D-arabinofuranoside | Sigma-Aldrich, St. Louis, Missouri, United States | C1768-100MG | |
| EGTA | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 3054.3 | |
| Esketamine hydrochloride, Ketanest S 25 mg/mL | Pfizer Pharma PFE GmbH, Berlin, Germany | PZN-07829486 | |
| Fetal Bovine Serum | Sigma-Aldrich, St. Louis, Missouri, United States | F9665 | |
| Gentamycin 50 mg/mL | Gibco, Life Technologies, Waltham, MA, USA | 15750-037 | |
| Glucose | Sigma-Aldrich, St. Louis, Missouri, United States | G7021-1KG | |
| Heparin-Sodium, 5,000 IU/mL | Braun Melsungen AG, Melsungen, Germany | PZN-03029843 | |
| HEPES | Sigma-Aldrich, St. Louis, Missouri, United States | H3375-1KG | |
| Insulin (bovine pancreas) | Sigma-Aldrich, St. Louis, Missouri, United States | I6634-50MG | |
| K-aspartate | Sigma-Aldrich, St. Louis, Missouri, United States | A6558-25G | |
| KCl | VWR International GmbH, Leuven, Belgium | 26764.260 | 1 mg/mL |
| KOH | Honeywell Fluka, Muskegon, MI, USA | 35113-1L | |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma-Aldrich, St. Louis, Missouri, United States | L2020-1MG | |
| M199-Medium | Sigma-Aldirch, St. Louis, Missouri, United States | M4530 | |
| Mg-ATP | Sigma-Aldrich, St. Louis, Missouri, United States | A9187-1G | |
| MgCl2 | Sigma-Aldrich, St. Louis, Missouri, United States | 63069-500ML | |
| NaCl | Fisher Scientific, Loughborough, Leics., UK | 10428420 | |
| NaCl-Solution 0.9%, Isotone Kochsalz-Lösung 0.9% | Braun Melsungen AG, Melsungen, Germany | 3200950 | |
| NaOH | AppliChem GmbH, Darmstadt, Germany | A6579 | without Ca2+/Mg2+ |
| Na-pyruvat | Sigma-Aldrich, St. Louis, Missouri, United States | P2256-100MG | |
| Phosphate Buffered Saline | Sigma-Aldrich, St. Louis, Missouri, United States | D1408-500ML | |
| Poly(2-hydroxyethyl methacrylate) | Sigma, Poole, UK | 192066 | |
| Protease XIV from Streptomyces griseus | Sigma-Aldrich, St. Louis, Missouri, United States | P5147-1G | |
| Taurine | Sigma-Aldrich, St. Louis, Missouri, United States | T0625-500G | |
| Thiopental Inresa 0.5 g | Inresa Arzneimittel GmbH, Freiburg, Germany | PZN-11852249 | |
| Xylazine hydrochloride, Rompun 2% | Bayer Vital GmbH, Leverkusen, Germany | PZN-01320422 |
Ссылки
- Harz, H., Hegemann, P. Rhodopsin-regulated calcium currents in Chlamydomonas. Nature. 351, 489-491 (1991).
- Litvin, F. F., Sineshchekov, O. A., Sineshchekov, V. A. Photoreceptor electric potential in the phototaxis of the alga Haematococcus pluvialis. Nature. 271, 476-478 (1978).
- Nagel, G., et al. Channelrhodopsin-1: A Light-Gated Proton Channel in Green Algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
- Lozier, R. H., Bogomolni, R. A., Stoeckenius, W. Bacteriorhodopsin: a light-driven proton pump in Halobacterium Halobium. Biophysical journal. 15 (9), 955-962 (1975).
- Schobert, B., Lanyi, J. K. Halorhodopsin is a light-driven chloride pump. Journal of Biological Chemistry. 257 (17), 10306-10313 (1982).
- Inoue, K., et al. A light-driven sodium ion pump in marine bacteria. Nature Communications. 4, 1678 (2013).
- Han, X., et al. A High-Light Sensitivity Optical Neural Silencer: Development and Application to Optogenetic Control of Non-Human Primate Cortex. Frontiers in Systems Neuroscience. 5, 18 (2011).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Grimm, C., Silapetere, A., Vogt, A., Bernal Sierra, Y. A., Hegemann, P. Electrical properties, substrate specificity and optogenetic potential of the engineered light-driven sodium pump eKR2. Scientific Reports. 8, 9316 (2018).
- Wietek, J., et al. Conversion of channelrhodopsin into a light-gated chloride channel. Science. 344 (6182), 409-412 (2014).
- Berndt, A. Structure-Guided Transformation. Science. 344 (6182), 420-424 (2014).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Mohamed, G. A., et al. Optical inhibition of larval zebrafish behaviour with anion channelrhodopsins. BMC Biology. 15 (1), 103 (2017).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic Neuronal Silencing in Drosophila during Visual Processing. Scientific Reports. 7, 13823 (2017).
- Govorunova, E. G., Cunha, S. R., Sineshchekov, O. A., Spudich, J. L. Anion channelrhodopsins for inhibitory cardiac optogenetics. Scientific Reports. 6, 33530 (2016).
- Kopton, R. A., et al. Cardiac Electrophysiological Effects of Light-Activated Chloride Channels. Frontiers in Physiology. 9, 1806 (2018).
- Peyronnet, R., et al. Load-dependent effects of apelin on murine cardiomyocytes. Progress in Biophysics and Molecular Biology. 130, 333-343 (2017).
- Wang, K., et al. Cardiac tissue slices: preparation, handling, and successful optical mapping. American Journal of Physiology-Heart and Circulatory Physiology. 308 (9), 1112-1125 (2015).
- Nishimura, S., et al. Single cell mechanics of rat cardiomyocytes under isometric, unloaded, and physiologically loaded conditions. American Journal of Physiology-Heart and Circulatory Physiology. 287 (1), 196-202 (2004).
- Mitcheson, J. S., Hancox, J. C., Levi, A. J. Action potentials, ion channel currents and transverse tubule density in adult rabbit ventricular myocytes maintained for 6 days in cell culture. Pflugers Archiv European Journal of Physiology. 43 (6), 814-827 (1996).
- Burton, R. A. B., et al. Caveolae in Rabbit Ventricular Myocytes: Distribution and Dynamic Diminution after Cell Isolation. Biophysical Journal. 113 (5), 1047-1059 (2017).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in cardiomyocyte isolation, culture, and gene transfer. Journal of Molecular and Cellular Cardiology. 51 (3), 288-298 (2011).
- Janssen, P. M., Hunter, W. C. Force, not sarcomere length, correlates with prolongation of isosarcometric contraction. The American Journal of Physiology. 269 (2), 676-685 (1995).
- Monasky, M. M., Varian, K. D., Davis, J. P., Janssen, P. M. L. Dissociation of force decline from calcium decline by preload in isolated rabbit myocardium. Pflugers Archiv European Journal of Physiology. 456 (2), 267-276 (2008).
- Kleinlogel, S., et al. Ultra light-sensitive and fast neuronal activation with the Ca 2+-permeable channelrhodopsin CatCh. Nature Neuroscience. 14 (4), 513-518 (2011).
- Schneider-Warme, F., Ravens, U. Using light to fight atrial fibrillation. Cardiovascular Research. 114 (5), 635-637 (2018).
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature. 463 (7277), 98-102 (2010).
- Bernal Sierra, Y. A., et al. Potassium channel-based optogenetic silencing. Nature Communications. 9 (1), 4611 (2018).
- Oda, K., et al. Crystal structure of the red light-activated channelrhodopsin Chrimson. Nature Communications. 9 (1), 3949 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены