A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تسرب الكريات البيض من العضلات الكريماستر في الفئران التي تم تقييمها من قبل المجهر Intravital
In This Article
Summary
هنا، نعرض كيفية إجراء المجهر intravital على الأفير ما بعد الشعرية من العضلات كريسماستر الماوس. تطبق عادة على نماذج مختلفة من الالتهاب والإنتان، وخاصة تلك الناجمة عن chemokines والسيتوكينيات، ونحن تسليط الضوء على أهميتها في دراسة الموسكولوباثالتي التي تنطوي على تسرب الكريات البيض العضلي مبالغ فيها.
Abstract
يستخدم المجهر اللاحيفي (IVM) على نطاق واسع لمراقبة العمليات الفسيولوجية والفسيولوجية المرضية داخل سلسلة توظيف الكريات البيض في الجسم الحي. يمثل البروتوكول الحالي طريقة عملية وقابلة للاستنساخ لتصور تفاعل البطانة البيض الكريات البيض مما يؤدي إلى تجنيد الكريات البيض في الأنسجة المشتقة من العضلات الهيكلية داخل الكائن السليم للفأرة. النموذج ينطبق على جميع مجالات البحوث التي تركز على تنشيط الحبيبية ودورها في المرض.
نحن نقدم بروتوكول خطوة بخطوة لتوجيه من خلال الأسلوب وتسليط الضوء على المزالق المحتملة والصعوبات التقنية. يغطي البروتوكول الجوانب التالية: الإعدادات التجريبية والمواد المطلوبة ، وتخدير الماوس ، وتشريح عضلة cremaster وكذلك القصبة الهوائية والإزالة السباتية ، وتسجيلات IVM والتحليل غير المتصل بالإنترنت. يتم شرح تنسيقات البيانات مثل الكريات البيض الملتصقة ، وتدفق المتداول (RF) وكسر التدفق المتداول (RFF) بالتفصيل ويتم مناقشة التطبيقات المناسبة. يتم توفير النتائج التمثيلية من الفئران mdx mdx dystrophin ناقص في قسم النتائج.
IVM هو أداة قوية لتقييم تجنيد الكريات البيض في وضع في الجسم الحي; ومع ذلك، قد يتطلب تحديد على سبيل المثال وظيفة الانبوثيوليال والكريات البيض مزيجًا مع الإعدادات القابلة للقافية مثل تجارب غرفة التدفق. وعلاوة على ذلك، فإن الخلفية الوراثية للحيوانات ذات الأهمية قد تؤثر تأثيرا كبيرا على التوظيف الأساسي، مما يتطلب ضبطا دقيقا فرديا للبروتوكول المقدم. على الرغم من قيوده، قد تكون IVM بمثابة منصة لترجمة النتائج المختبرية بسهولة إلى كائن حي الفقاريات.
Introduction
المجهر الفيتفيلي (IVM) هو أداة تطبق عادة في مجال علم الأحياء الكريات البيض. تجنيد الكريات البيض يلي سلسلة من الأحداث المحددة جيدا التي بدأتها التقاط الكريات البيض، المتداول والالتصاق إلى الجدار الانبهي، وأخيرا نقل الهجرة وextravasation من الكريات البيض إلى الموقع الفعلي للالتهاب1. يتم التوسط في كل خطوة والتحكم فيها من قبل مختلف chemokines (على سبيل المثال، IL-8/CXCL8)، ومستقبلات (على سبيل المثال، LFA-1، ماك-1) والجزيئات الالتصاق الخلايا الانفحلية المقابلة (على سبيل المثال، ICAM-1، VCAM-1 و E-Selectin)2،,3. التفاعل بين المواقع التنظيمية المختلفة، والعوامل المسيطرة والوسطاء من الكريات البيضاء تجنيد سلسلة مثل مستقبلات المنتجات النهائية الجليسيشن المتقدمة (الغضب)، جزيء الالتصاق بين الخلايا 1 (ICAM-1)، C-X-C عزر ligand (CXCL)1/2 وتم الكشف عن مستقبلاتهم CXCR2 باستخدام IVM44،5،,6،,7،,8،99.
وقد وصفت طريقة IVM لكثير من الأجهزة والأنسجة المختلفة مثل الأمعاء10، الجلد11، الغدد الليمفاوية12، كيس صفار الجنينية13 وغيرها. ومع ذلك، فإن الطريقة الأكثر دراسة على نطاق واسع من IVM هو نموذج cremaster، وصفت لأول مرة في الفئران14. في حين لا تزال تستخدم في الفئران15، يتم تطبيق هذه الطريقة في الوقت الحاضر بشكل رئيسي في الفئران بسبب وفرة عالية من خطوط المعدلة وراثيا مختلفة. وقد أبرزت مجموعتنا مؤخرا الدور المحتمل للcremaster IVM في مجال الموسكولاثات الالتهابية مثل دوشين ضمور العضلات (DMD) دراسة dystrophin ناقص mdx الفئران16. نظرًا لتكوين الألياف الرقيق المتشابك ة والسهل الوصول إليه ، تمثل عضلة الكريماستر العضلات المرشحة المثالية التي يجب دراستها كجبل كامل باستخدام المجهر الخفيف أو الفلوري. تجنيد الكريات البيض وextravasation أساسا تجري في الأفيين ما بعد الشعرية، والتي يمكن بسهولة أن تحدد على طبقة العضلات المستمرفي العضلات الكريماستر.
ميزة في التصوير الحي مقارنة مع غيرها من المقالات في المختبر هو سياقها البيولوجي في كائن حي. في الوقت نفسه، قد يتطلب تحديد المساهمات الخاصة بالخلايا في توظيف الكريات البيض المعدلة نماذج إضافية في المختبر مثل غرف التدفق أو المقالات البطانية. إن الجمع بين أساليب متعددة سوف ينتج بيانات أكثر إقناعاً. يجب أن يكون العلماء على بينة من القيود المفروضة على نموذج cremaster كما أي تلاعب الجراحية سيؤدي إلى زيادة الاتجار الكريات البيض والتجنيد. ومن ثم، يصعب تقدير التوظيف الأساسي بهذه الطريقة. على الرغم من تطبيقه على نطاق واسع ، يمكن أن يكون IVM من cremaster تحديًا وقد يستغرق الإعداد الجديد وقتًا وموارد لإنشاء. نحن نقدم الآن بروتوكول سهل من شأنه أن يساعد على تجنب بعض الأخطاء الشائعة في IVM. كما سيتم مناقشة القيود وسيتم تسليط الضوء على الطرق المجانية عند الاقتضاء.
IVM من الكريماستر يمثل نهجا مثاليا ليتم تنفيذه في مجال الدراسات الالتهابية والمعدية. وبشكل أكثر تحديدا، قد يكون نموذج cremaster ذات أهمية عالية للعلماء الذين يدرسون بيولوجيا العضلات الهيكل العظمي في سياق الأمراض الالتهابية.
Protocol
تم إيواء الحيوانات تحت ظروف خاضعة للرقابة وخالية من مسببات الأمراض في IBF (Interfakultäre Biomedizinische Forschungseinrichtung)، هايدلبرغ. تمت الموافقة على جميع الإجراءات المذكورة هنا من قبل IRB المحلية وRegierungspraesidium كارلسروه، بادن فورتمبرغ، ألمانيا.
1. إدارة التخدير
- تُشَعَيّر الفأرة عن طريق حقن البولوس (i.p.) بـ 125 ملغم/كغ من الكيتامين و12.5 ملغم/كغ xylazine.
- ضع الماوس وأصلحه في وضع دوري على وسادة تدفئة للحفاظ على درجة حرارة الجسم للفأرة (36.5-38 درجة مئوية). استخدام خياطة معقمة غير قابلة للامتصاص (6/0) لالرياح حلقة بسيطة حول الأسنان الأمامية والشريط نهايات الانضمام من خياطة إلى وسادة التدفئة. يهدف هذا التثبيت إلى إبقاء الفم مفتوحًا من أجل تجنب الاضطراب في التنفس.
- تحقق من الماوس للحصول على عمق مناسب من التخدير عن طريق قرصة إصبع القدم بين الرقمية (لا ينبغي أن ينظر إلى الانسحاب).
- مرة واحدة يتم الوصول إلى التخدير كافية المضي قدما في إعداد الجراحية. تأكيد التخدير مرارا وتكرارا على طول التجربة الجارية كل 30 دقيقة. إعادة إعطاء الأدوية على النحو المبين أعلاه إذا لزم الأمر.
- محلول الملح الفسيولوجي Equilibrate (PSS، التركيب: 132 ملليمول/لتر ناكل، 4.7 ملليمول/لتر KCl، 1.2 مليمول/لتر MgS04،2.0 مليمول/لتر CaCl2، 18 ملليمول/لتر ناهكو3)مع 5% CO2/95% N2 لمدة 15 دقيقة. فقاعة PSS باستمرار مع 5٪ CO2/95٪ N2 طوال التجربة والحفاظ على 37 درجة مئوية.
2. الإعداد الجراحي للالقصبة الهوائية والشريان السباتي (اختياري)
- تشريح الجلد من منطقة الرقبة عن طريق سحب الجلد بلطف مع ملاقط في خط الوسط. استخدام مقص لتطبيق قطع دائريمن 1-2 سم في القطر لإعطاء مساحة كافية لإعداد الجراحية.
- تشريح بعناية العضلات المحيطة بها، والدهون والأنسجة الضامة باستخدام ملاقط.
- جعل قطع عرضية (~ 1.3 ملم) في القصبة الهوائية باستخدام مقص الجراحية الصغيرة وإدخال أنبوب البولي ايثيلين (I.D x O.D. 0.034 "x 0.050") داخل نهاية caudal من القصبة الهوائية لتأمين الشعب الهوائية العليا.
- إصلاح أنبوب يقع في القصبة الهوائية من قبل خياطة عقدة دائرية واحدة (6/0 USP).
- حدد موقع الشريان السباتي على طول الجانب الأيمن من القصبة الهوائية وتشريح الأنسجة المحيطة من جدار الشريان السباتي. بدلا من ذلك، يمكن استخدام الوداجي أو أيضا الوريد الذيل للوصول i.v. في محاولة لتجنب إصابة العصب المبهم، كما هو موجود عن كثب.
- تمرير قطعتين من خياطة (6/0) تحت الشريان السباتي. ضع أول خياطة قحفية قريبة، بالقرب من تشعب الشرايين السباتية وربطها بشكل دائم. سيتم تحديد موقع الغرزة الثانية حوالي 5-8 مم من أول واحد ، وبعد ذلك سيتم استخدامها لتأمين الأنبوب في الشريان السباتي. لا تربطه بعد.
- إعداد أنبوب البولي إيثيلين (I.D x O.D. 0.011" × 0.024") بطول 30 سم عن طريق ثني جزء النهاية إلى إبرة حقنة 1 مل مليئة بالمالحة (0.9٪ NaCl). التنظيف الدقيق مهم لمنع انسداد الهواء أثناء التحضير.
- استخدام مقطع وعاء 7 ملم لقط الشريان السباتي بشكل منتفخ من خياطة الثاني.
- قم بإجراء قطع عرضي صغير (~ 0.5 مم) في الشريان السباتي وإدخال أنبوب البولي إيثيلين المعقم. تأمين الأنبوب في الشريان باستخدام خياطة الثاني أعدت من قبل.
- إزالة مقطع السفينة وبلطف تطبيق القليل من التوتر على حقنة متصلة أنبوب البولي ايثيلين. يمكن الآن استخدام هذه القسطرة السباتية لإدارة الأدوية أو أخذ عينات الدم إذا لزم الأمر ، حتى مراقبة ضغط الدم أو معدل النبض ممكن مع الأجهزة المعنية.
3. إعداد جراحي للعضلة الكريماستر
- نقل الماوس على لوحة التدفئة (جنبا إلى جنب مع لوحة التدفئة) إلى الإطار البلاستيك حسب الطلب عقد المرحلة للميكروسكوبية في وقت لاحق. توجيه الماوس مع كيس الصفن التي تواجه مرحلة المجهر.
- إعادة تقييم عمق التخدير قبل المتابعة؛ إعادة إعطاء ربع إلى نصف جرعة من التخدير إذا لزم الأمر.
- توطين كيس الصفن، والاحتفاظ به في الجزء الأكثر distal باستخدام ملاقط، وسحبه بلطف وقطع مقطع دائري من الجلد الصفن مع حوالي 5 ملم في القطر. تأكد من عدم إيذاء الهياكل الأساسية مثل العضلات الكريماستر. تأكد من الحفاظ على الأنسجة المفتوحة رطبة جيدا مع محلول المالحة.
- تشريح النسيج الضام فضفاضة باستخدام اثنين من ملاقط وتوطين كل الخصيتين.
- عقد واحد testis distly وتبدأ بلطف سحبه بها، وإزالة الأنسجة الضامة المحيطة خطوة بخطوة.
- بمجرد أن يتم الخارجي الخصية، دبوس نهايته اقاصية إلى حلقة مطاطية المحيطة المرحلة. عند التغريب، هيدرات الأنسجة مع محلول ملحي خلال العملية برمتها.
- الخطوة الحرجة: إزالة النسيج الضام بعناية دون الإضرار العضلات الأساسية. قد تعيق الأنسجة الضامة الزائدة الرؤية في المجهر في وقت لاحق وقد تنتج صورًا ضبابية.
- دبوس الجزء القاصي من الخصية إلى أسفل وفتح العضلات كريمر من قبل قطع عرضية صغيرة (حوالي 1 ملم)، تليها شق طولي من الغاية جدا إلى نهاية قريبة. ونتيجة لذلك ينبغي أن العضلات cremaster فتح spherically. لا ينبغي قطع السفينة مرئية بمنظار، لأن هذا قد يؤثر على الديناميكا الدموية.
- نشر العضلات بعناية على خشبة المسرح الزجاجي وتثبيته على حلقة مطاطية. تأكد من عدم لمس أو إيذاء المنطقة الوسطى، كما سيتم إجراء المجهر هنا.
تحذير: قد يؤدي التمدد الزائد إلى إعاقة تدفق الدم. - قم بتثبيت الخصية المتبقية جانباً لإعطاء الوصول إلى المنطقة ذات الاهتمام. تأكد من ترطيب مع PSS مرارا وتكرارا لمنع التجفيف. العضلات المركبة جاهزة الآن للتنظير المجهري.
4. الفحص المجهري داخل الفيتال
- ضع العضلات المثبتة في المجهر المنتصب وقم بإجراء المجهر باستخدام هدف 40x.
- الحصول على البيانات والتصدير باستخدام الطيف التصويري عالي الإنتاجية.
- أداء التسجيلات تحت superfusion المستمر مع محمّى مسبقا (35-37 درجة مئوية) PSS17. تطبيق superfusion بواسطة أنابيب صغيرة التي تم تسجيلها على الهدف تستقيم من المجهر للسماح نازف مستمر من PSS جنبا إلى جنب مع الهدف وصولا الى الأنسجة العضلية.
- تحديد الأفيان ما بعد الشعرية (التقاء سفينتين أصغر) وقياس دوران الأوعية الدقيقة على الأفيون التي يبلغ قطرها 20-40 ميكرومتر.
- تسجيل صور عالية الدقة من دوران الأوعية الدقيقة من العضلات cremaster في نطاق زمني من 30 s. كما قد يكون هناك تقلص طفيف والاسترخاء من الأنسجة العضلية أثناء التسجيل، تأكد من ضبط التركيز باستمرار. عموما، الماوس يميل إلى عرض دوران مستقر لمدة 2 ساعة تقريبا. من الممكن الحصول على عدة تسجيلات لسفن مختلفة من مناطق مختلفة. يمكن استخدام اختبار واحد أو كليهما لاحقًا.
ملاحظة: لأن هذا هو نموذج من الالتهاب، وطرق شائعة من التعريفي هي: تطبيق الجهازية أو حقن الصفن المحلي من الوسطاء التهابات الموالية، فضلا عن superfusion مع على سبيل المثال ن-Formylmethionyl-leucyl-phenylalanine (fMLP). يستخدم التحفيز المحلي TNF-α عادة ً لتحفيز تجنيد الكريات البيض. LPS الناجمعن endotoxemia هو نموذج من التهاب الجهازية الحادة SIRS.
5. التصور الكريات البيض
ملاحظة: يمكن بسهولة رؤية الكريات البيض الملتصقة والمتداولة دون مزيد من التصور. لتحديد سرعة خط الوسط من الكريات البيض تتحرك بحرية، أداء تلطيخ التفاضلية.
- إذا تم استخدام الفئران المسماة eGFP، قم بتحليلها مباشرة عن طريق المجهر الفلوري.
- لسلالات الماوس غير eGFP المسمى، استخدم تلطيخ الروداامين.
- إدارة rhodamine 6G في 0.2 ملغ / كجم وزن الجسم. قد تكون هناك حاجة إلى جرعات متكررة لتحقيق كثافات تلطيخ كافية. تأكد من الاحتفاظ بكميات صغيرة، حيث قد تؤثر وحدات التخزين الأكبر على المعلمات الهيموديناميكية.
- للتلطيخ الفوري للكريات البيض، وإدارة وصمة عار عن طريق الشريان السباتي. إذا لم يتم إجراء تشريح الشريان السباتي ، يمكن تحقيق تلطيخ كاف ٍ عن طريق تطبيق i.p. باستخدام نفس الجرعة18. كبديل للقسطرة الشريان السباتي، يمكن إجراء أي قسطرة الوريدية أخرى.
ملاحظة: نضع في اعتبارنا أن تلطيخ الرودامين، على عكس تسمية eGFP، يظهر اضمحلال الوقت من شدة الفلورسان، فضلا عن الحد الأقصى للتلطيخ الشامل من حوالي 80٪ من الكريات البيض في تركيزات أعلى. - تصور تتحرك بحرية روداامين الكريات البيض الملطخة عن طريق المجهر الفلوري.
6- نهاية التجربة
ملاحظة: يجب أن يكون الوقت المقدر الإجمالي لتنفيذ هذا البروتوكول 90 - 150 دقيقة.
- إنهاء تجربة القتل الرحيم عن طريق خلع عنق الرحم.
- لمزيد من التحليلات، مثل الهجرة، إصلاح العضلات cremaster في PFA في حين لا تزال امتدت على خشبة المسرح وملطخة لعلم الأنسجة على النحو المطلوب.
7. التحليل دون اتصال
- تحليل المعلمات التالية كعدد بسيط أثناء تشغيل الفيديو.
- حساب تدفق المتداول [عدد / دقيقة]: عدد الخلايا المتداول تمرير خط وهمي / دقيقة
- حساب التصاق [عدد / مم2]: عدد الخلايا لاصقة إلى جدار السفينة داخل مجال الرؤية ≥ 30 s / سطح الأوعية الدموية [مم2].
- قياس المعلمات التالية هياميكاناالحيوية والأوعية الدموية الدقيقة يتم قياسباستخدام ImageJ.
- حساب قطر السفينة [μm] وقطر الجدار الداخلي.
- حساب طول السفينة [μm] كطول خط الوسط للوعاء.
- حساب سرعة خط
 الوسط التي تم الحصول عليها من تحليل الفيديو من الإطار إلى الإطار من الكريات البيض تتحرك بحرية في خط الوسط.
الوسط التي تم الحصول عليها من تحليل الفيديو من الإطار إلى الإطار من الكريات البيض تتحرك بحرية في خط الوسط.
- استخدم المعادلات التالية كتقدير.
- حساب سطح الأوعية الدموية في [مم2]: طول السفينة [μm] × قطر السفينة [μm] × × 10-6.
- حساب معدل
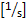 القص الجدار: 4.9 x (8
القص الجدار: 4.9 x (8  × سرعة خط الوسط × 0.625/قطر السفينة [μm]).
× سرعة خط الوسط × 0.625/قطر السفينة [μm]). - حساب متوسط سرعة
 تدفق الدم:
تدفق الدم:  سرعة خط الوسط × 0.625.
سرعة خط الوسط × 0.625. 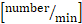 حساب مجموع تدفق الكريات البيض: عدد
حساب مجموع تدفق الكريات البيض: عدد 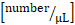 الكريات البيض الجهازية
الكريات البيض الجهازية  x (متوسط سرعة تدفق الدم
x (متوسط سرعة تدفق الدم 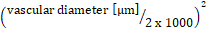 × 60/1000) x x .
× 60/1000) x x .- حساب تدفق المتداول جزء [%]: تدفق المتداول / مجموع تدفق الكريات البيض x 100.
النتائج
سوف IVM وفقا للبروتوكول المقدمة تسفر عن رؤى فريدة من نوعها في سلسلة من تجنيد الكريات البيض في العضلات الهيكل العظمي. وسيركز قسم النتائج على النتائج النموذجية التي حصل عليها مركز الإدارة المكانية للنتائج ويسلط الضوء على المشاكل المحتملة التي قد تواجهها.
ويرد الإعداد التجريب?...
Discussion
وقد استخدمت على نطاق واسع IVM كوسيلة لدراسة أنواع مختلفة من الخلايا في أجهزة مختلفة، وقد وصفت على نطاق واسع ونوقشت19. والهدف الرئيسي من هذه الدراسة هو توفير نهج فعال لإعداد وتنفيذ IVM في العضلات cremaster. ممارسة هذه الطريقة سوف تسفر عن نتائج موثوقة وقابلة للاستنساخ. وبالتالي، فإن الت...
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد دعمت هذه الدراسة وزارة التعليم والبحوث الاتحادية الألمانية (BMBF) 01GL1746E كجزء من اتحاد بريمال. يعترف المؤلفان ببريتا هيكمان وسيلفيا بزر للحصول على مساعدة تقنية ماهرة.
Materials
| Name | Company | Catalog Number | Comments |
| Material | |||
| Ketanest S | Pfizer Pharma GmbH | PZN: 08509909 | anesthesia. Generic / IUPAC Name: ketamine |
| Xylazine | CP-Pharma GmbH | Article-nr.: 1205 | anesthesia. Generic / IUPAC Name: xylazine (as hidrochloride) |
| Saline Solution | B. Braun Melsungen | PZN 02737756 | surgical preparation. Generic / IUPAC Name: sodium chloride |
| Syringe needle Omnican F | B. Braun Melsungen | REF 9161502 | surgical preparation |
| Suture 6/0 USP | Resorba | REF 4217 | surgical preparation |
| Polyethylene tube #10 | BD GmbH | Supplier No. 427401 | surgical preparation |
| Polyethylene tube #90 | BD GmbH | Supplier No. 427421 | surgical preparation |
| Rhodamine 6G | Sigma-Aldrich Chemie GmbH | CAS Number 989-38-8 | leukocyte staining. Generic / IUPAC Name: ethyl 2-[3-(ethylamino)-6-ethylimino-2,7-dimethylxanthen-9-yl]benzoate |
| Setup Equipment | |||
| Upright microscope | Olympus | BX51W1 | microscopy |
| 40-fold objective | Zeiss | Achroplan 40 × /0.80 W | microscopy |
| ImSpector software | Lavision Biotec GmbH | ver. 4.0.469 | software |
| ImageJ | National Institute of Health, USA | ver. 1.51j8 | software |
References
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nature Reviews. Immunology. 7 (9), 678-689 (2007).
- Zanardo, R. C. O., et al. A down-regulatable E-selectin ligand is functionally important for PSGL-1-independent leukocyte-endothelial cell interactions. Blood. 104 (12), 3766-3773 (2004).
- Woodfin, A., et al. ICAM-1-expressing neutrophils exhibit enhanced effector functions in murine models of endotoxemia. Blood. 127 (7), 898-907 (2016).
- Frommhold, D., et al. RAGE and ICAM-1 cooperate in mediating leukocyte recruitment during acute inflammation in vivo. Blood. 116 (5), 841-849 (2010).
- Braach, N., et al. RAGE controls activation and anti-inflammatory signalling of protein C. PloS One. 9 (2), 89422 (2014).
- Frommhold, D., et al. RAGE and ICAM-1 differentially control leukocyte recruitment during acute inflammation in a stimulus-dependent manner. BMC Immunology. 12 (1), 56 (2011).
- Braach, N., et al. Anti-inflammatory functions of protein C require RAGE and ICAM-1 in a stimulus-dependent manner. Mediators of Inflammation. 2014, 743678 (2014).
- Girbl, T., et al. Distinct Compartmentalization of the Chemokines CXCL1 and CXCL2 and the Atypical Receptor ACKR1 Determine Discrete Stages of Neutrophil Diapedesis. Immunity. 49 (6), 1062-1076 (2018).
- Smith, M. L., Olson, T. S., Ley, K. CXCR2- and E-selectin-induced neutrophil arrest during inflammation in vivo. The Journal of Experimental Medicine. 200 (7), 935-939 (2004).
- Emre, Y., Jemelin, S., Imhof, B. A. Imaging Neutrophils and Monocytes in Mesenteric Veins by Intravital Microscopy on Anaesthetized Mice in Real Time. Journal of Visualized Experiments. (105), (2015).
- Eriksson, E., Boykin, J. V., Pittman, R. N. Method for in vivo microscopy of the cutaneous microcirculation of the hairless mouse ear. Microvascular Research. 19 (3), 374-379 (1980).
- von Andrian, U. H. Intravital microscopy of the peripheral lymph node microcirculation in mice. Microcirculation. 3 (3), 287-300 (1996).
- Hudalla, H., et al. LPS-induced maternal inflammation promotes fetal leukocyte recruitment and prenatal organ infiltration in mice. Pediatric Research. 84 (5), 757-764 (2018).
- Grant, R. T. Direct observation ok skeletal muscle blood vessels (rat cremaster). The Journal of Physiology. 172 (1), 123-137 (1964).
- Thiele, J. R., Goerendt, K., Stark, G. B., Eisenhardt, S. U. Real-time digital imaging of leukocyte-endothelial interaction in ischemia-reperfusion injury (IRI) of the rat cremaster muscle. Journal of Visualized Experiments. (66), e3973 (2012).
- Kranig, S. A., et al. Dystrophin deficiency promotes leukocyte recruitment in mdx mice. Pediatric Research. 11, 4457 (2019).
- Bagher, P., Segal, S. S. The mouse cremaster muscle preparation for intravital imaging of the microcirculation. Journal of Visualized Experiments. (52), e2874 (2011).
- Reichenbach, Z. W., Li, H., Gaughan, J. P., Elliott, M., Tuma, R. IV and IP administration of rhodamine in visualization of WBC-BBB interactions in cerebral vessels. Microscopy Research and Technique. 78 (10), 894-899 (2015).
- Secklehner, J., Lo Celso, C., Carlin, L. M. Intravital microscopy in historic and contemporary immunology. Immunology and Cell Biology. 95 (6), 506-513 (2017).
- Nussbaum, C., et al. Neutrophil and endothelial adhesive function during human fetal ontogeny. Journal of Leukocyte Biology. 93 (2), 175-184 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved