Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İntravital Mikroskopi Ile Değerlendirilen Farelerde Cremaster Kasın Lökosit İnfiltrasyonu
Bu Makalede
Özet
Burada, fare cremaster kasının post-kılcal venüzlerinde intravital mikroskopinin nasıl yapılacağını gösteriyoruz. Yaygın olarak farklı inflamasyon ve sepsis modellerine, özellikle kemokinler ve sitokinler tarafından indüklenenlere uygulanan, abartılı kas lökosit infiltrasyonu içeren muscolopatilerin çalışmasında önemini vurguluyoruz.
Özet
İntravital mikroskopi (IVM) yaygın olarak lökosit işe kaskad in vivo içinde fizyolojik ve patofizyolojik süreçleri izlemek için kullanılır. Mevcut protokol, farenin bozulmamış organizması içinde elde edilen iskelet kası dokuda lökosit alımına yol açan lökosit endotel etkileşimini görselleştirmek için pratik ve tekrarlanabilir bir yöntemi temsil eder. Bu model, granülosit aktivasyonuna ve hastalıktaki rollerine odaklanan tüm araştırma alanlarına uygulanabilir.
Yöntemde rehberlik etmek ve olası tuzakları ve teknik zorlukları vurgulamak için adım adım protokol sağlıyoruz. Protokol aşağıdaki hususları kapsamaktadır: deneysel ayarlar ve gerekli malzeme, farenin anestezisi, cremaster kasının diseksiyonu, trakeal ve karotis kanülasyonu, IVM kayıtları ve çevrimdışı analiz. Yapışık lökositler, yuvarlanma akısı (RF) ve yuvarlanma akı fraksiyonu (RFF) gibi veri biçimleri ayrıntılı olarak açıklanmış ve uygun uygulamalar tartışılmıştır. Sonuç bölümünde distrofin eksikliği mdx farelerin indeks sonuçları verilmektedir.
IVM bir in vivo ortamda lökosit işe değerlendirmek için güçlü bir araçtır; ancak, örneğin endotel ve lökosit fonksiyonu için delineating akış odası deneyleri gibi ex vivo kurulumları ile bir kombinasyon gerektirebilir. Ayrıca, ilgi hayvanların genetik arka plan büyük ölçüde sağlanan protokol bireysel ince ayar gerektiren, temel işe etkileyebilir. Sınırlamalarına rağmen, IVM in vitro bulguları yaşayan bir omurgalı organizmaya kolayca çevirmek için bir platform olarak hizmet verebilir.
Giriş
İntravital mikroskopi (IVM) lökosit biyolojisi alanında yaygın olarak uygulanan bir araçtır. Lökosit işe lökosit yakalama tarafından başlatılan iyi tanımlanmış olayların bir çağlayan izler, haddeleme ve endotel duvarına yapışma, ve son olarak transmigration ve inflamasyon gerçek siteye lökosit ekstravazasyon1. Her adım çeşitli kemokinler (örneğin, IL-8/CXCL8), reseptörler (örneğin, LFA-1, Mac-1) ve ilgili endotel hücre adezyon molekülleri (örneğin, ICAM-1, VCAM-1 ve E-Selectin)2,3tarafından aracılık ve kontrol edilir. Farklı düzenleyici sitelerin etkileşimi, kontrol faktörleri ve lökosit işe mediatörleri ileri glisasyon sonu ürünleri (RAGE), hücreler arası adezyon molekülü 1 (ICAM-1), C-X-C motif ligand (CXCL)1/2 ve reseptör CXCR2 ivm4,kullanılarak ortaya çıkarıldı,5,6,7,8,9.
IVM yöntemi bağırsak10gibi birçok farklı organ ve dokular için tarif edilmiştir 10 , deri11, lenf düğümleri12, embriyonik sarısı çuval13 ve diğerleri. Ancak, IVM en yaygın olarak çalışılan yöntem cremaster modeli, ilk sıçanlaraçıklanan 14. Hala sıçanlarda kullanılırken15, yöntem günümüzde ağırlıklı olarak farklı transgenik çizgilerin yüksek bolluğu nedeniyle farelerde uygulanmaktadır. Grubumuz son zamanlarda duchenne Musküler Distrofi (DMD) distrofin eksikliği mdx fareler16çalışma gibi inflamatuar muskolopatiler alanında cremaster IVM potansiyel rolü vurgulamıştır. İnce iç içe geçmiş ve kolayca erişilebilen lif bileşimi sayesinde, cremaster kas ışık veya floresan mikroskopi kullanılarak bir bütün montaj olarak çalışılması için ideal aday kas temsil eder. Lökosit işe alma ve ekstravazasyon esas olarak post-kılcal venüller yer alır, hangi kolayca cremaster kas sürekli bir kas tabakası üzerinde tespit edilebilir.
In vivo görüntülemenin diğer in vitro tahlillere göre avantajı, canlı bir organizmadaki biyolojik bağlamıdır. Aynı zamanda, değiştirilmiş lökosit işe hücre özel katkıları delineating akış odaları veya endotel tahlilleri gibi ek in vitro modeller gerektirebilir. Birden çok yöntemin birleşimi en ikna edici veri verecektir. Herhangi bir cerrahi manipülasyon artmış lökosit ticareti ve işe yol açacaktır gibi bilim adamları cremaster modelinin sınırlamaları farkında olmalıdır. Bu nedenle, temel işe bu yöntem ile tahmin etmek zordur. Geniş uygulamasına rağmen, cremaster IVM zor olabilir ve yeni bir kurulum kurmak için zaman ve kaynak alabilir. Şimdi IVM bazı yaygın hataları önlemek için yardımcı olacak kolay bir protokol sağlar. Ayrıca, sınırlamalar tartışılacak ve uygun olduğu durumlarda ücretsiz yöntemler vurgulanacaktır.
Kremaster IVM inflamatuar ve enfeksiyöz çalışmalar alanında uygulanacak ideal bir yaklaşım temsil eder. Daha spesifik olarak, cremaster modeli inflamatuar hastalık bağlamında iskelet kas biyolojisi okuyan bilim adamları için yüksek ilgi olabilir.
Protokol
Hayvanlar IBF (Interfakultäre Biomedizinische Forschungseinrichtung), Heidelberg'de kontrollü ve spesifik patojensiz koşullar altında barındırıldı. Burada açıklanan tüm prosedürler yerel IRB ve Regierungspraesidium Karlsruhe, Baden-Wuerttemberg, Almanya tarafından onaylanmıştır.
1. Anestezi uygulaması
- 125 mg/kg ketamin ve 12.5 mg/kg ksilazin intraperitoneal (i.p.) bolus enjeksiyonu ile fareyi anestezi edin.
- Farenin vücut Sıcaklığını korumak için fareyi ısıtma yastığına dorsal recumbent pozisyonunda yerleştirin ve düzeltin (36.5-38 °C). Ön dişlerin etrafında basit bir döngü yüzevetmek ve sütürün birleştirme uçlarını ısıtma yastığına bantlamak için emilmeyen bir steril dikiş (6/0) kullanın. Bu fiksasyon, solunumda rahatsızlık lanmaması için ağzı açık tutmayı amaçlar.
- Interdigital parmak ucutu ile uygun anestezi derinliği için fareyi kontrol edin (çekilme görülmemelidir).
- Yeterli anesteziye ulaşıldıktan sonra cerrahi hazırlık için devam edin. Devam eden deney boyunca anesteziyi tekrar tekrar onaylayın her 30 dk. Gerekirse yukarıda açıklandığı gibi ilaçları yeniden uygulayın.
- Fizyolojik tuz çözeltisini (PSS, bileşim: 132 mmol/L NaCl, 4,7 mmol/L KCl, 1,2 mmol/L MgS04, 2,0 mmol/L CaCl2, 18 mmol/L NaHCO3)%5 CO2/95% N2 ile 15 dakika boyunca dengeleyin. Deney boyunca PSS'yi %5 CO2/95 N2 ile sürekli kabarcıklayın ve 37 °C'de tutun.
2. Trakea ve karotis arterin cerrahi hazırlanması (isteğe bağlı)
- Orta hattacıcılarla deriyi hafifçe çekerek boyun bölgesinden deriyi inceleyin. Cerrahi hazırlık için yeterli alan vermek için çapı 1-2 cm dairesel bir kesim uygulamak için makas kullanın.
- Dikkatle cımbız kullanarak çevreleyen kas, yağ ve bağ dokuları incelemek.
- Küçük cerrahi makas kullanarak trakeaiçine enine bir kesim (~ 1,3 mm) yapın ve üst hava yollarını güvenli hale getirmek için trakeanın kaudal ucunda ki polietilen tüpü (I.D x O.D. 0.034 x 0.050") takın.
- Trakeada bulunan tüpü tek bir dairesel düğüm sütürle (6/0 USP) sabitler.
- Trakeanın sağ tarafı boyunca karotis arteri bulun ve karotis arter duvarından çevredeki dokuyu inceleyin. Alternatif olarak, juguler veya aynı zamanda kuyruk damarı i.v. erişim için kullanılabilir. Yakından bulunduğu gibi vagal sinir yaralanmasını önlemek için deneyin.
- Karotis arterin altında iki parça sütür (6/0) geçirin. İlk kraniyal sütür proksimal yerleştirin, karotis arterlerin bifurkasyon yakın ve kalıcı olarak kravat. İkinci dikiş ilkinden yaklaşık 5-8 mm distal bulunacak ve daha sonra karotis arter tüp güvenli kullanılacaktır. Henüz bağlama.
- Uç kısmı tuzlu (%0,9 NaCl) dolu 1 mL şırınga iğnesine bükerek 30 cm uzunluğunda polietilen bir tüp (I.D x O.D. 0.011" x 0.024") hazırlayın. Titiz yıkama hazırlık sırasında hava embolizasyonu önlemek için önemlidir.
- İkinci sütürşah arter distal kelepçe için 7 mm damar klipsi kullanın.
- Karotis arterde küçük bir enine kesim (~0,5 mm) yapın ve steril polietilen tüpü tanıtılın. Daha önce hazırlanan ikinci sütür kullanarak arter tüp güvenli.
- Damar klibini çıkarın ve polietilen tüpe bağlı şırıngaya hafifçe biraz gerginlik uygulayın. Bu karotis kateter artık ilaç vermek veya gerekirse kan örneği almak için kullanılabilir, hatta ilgili cihazlar ile kan basıncı veya nabız oranının izlenmesi mümkündür.
3. Cremaster kas cerrahi hazırlık
- Isıtma yastığıüzerindeki fareyi (ısıtma yastığı ile birlikte) daha sonra mikroskopi için sahneyi tutan özel yapım plastik çerçeveye aktarın. Mikroskop aşamasına bakan testis torbası ile fareyi yönlendirin.
- Devam etmeden önce anesteziderinliğini yeniden değerlendirin; gerekirse dörtte bir ila yarım doz anestezi uygulayın.
- Skrotum lokalize, cımbız kullanarak en distal kısmında tutarak, yavaşça çekin ve çapı yaklaşık 5 mm ile skrotal deri dairesel bir bölümünü kesti. Cremaster kas gibi altta yatan yapılara zarar vermemeye özen Açık dokuyu tuzlu çözelti ile iyice sulu tuttuğundan emin olun.
- İki cımbız kullanarak gevşek bağ dokusunu inceleyin ve her iki testisi de yerelleştirin.
- Bir testis distally tutun ve yavaşça dışarı çekerek başlamak, adım adım çevreleyen bağ dokusu kaldırarak.
- Testis dışa doğru çıktıktan sonra distal ucunu sahneyi çevreleyen kauçuk halkaya sabitle. Dışlaştırma üzerine, tüm süreç boyunca tuzlu çözelti ile doku nemlendirin.
- Kritik adım: Dikkatle altta yatan cremaster kas zarar vermeden bağ dokusu kaldırın. Aşırı bağ dokusu daha sonra mikroskopi de görme engelleyebilir ve bulanık görüntüler üretebilir.
- Testisin distal kısmını aşağı sabitle ve cremaster kasını küçük bir enine kesim (yaklaşık 1 mm) ile açın, ardından çok distalden proksimal uca kadar uzunlamasına kesi. Sonuç olarak cremaster kas sherically açılmalıdır. Makroskopik olarak görülebilen damar kesilmemelidir, çünkü bu hemodinamik etkileyebilir.
- Dikkatle cam sahne üzerinde kas yayıldı ve kauçuk halka ya pin. Mikroskopi burada yapılacağı için merkezi bölgeye dokunmamaya veya zarar vermemeye özen göstermektedir.
Dikkat: Aşırı esneme kan akışını engelleyebilir. - İlgi çekici bölgeye erişim sağlamak için kalan testis'i bir kenara sabitle. Kurutmayı önlemek için PSS ile tekrar tekrar nemlendirin. Monte edilen kas şimdi mikroskopi için hazırdır.
4. İntravital mikroskopi
- Dik mikroskop monte cremaster kas yerleştirin ve 40x amacı kullanarak mikroskopi gerçekleştirin.
- Yüksek iş çıkışlı görüntüleme spektrografisi kullanarak veri edinin ve dışa aktarın.
- Önceden ısıtılmış (35-37 °C) PSS17ile sürekli süperfüzyon altında kayıt gerçekleştirin. PsS'nin kas dokusuna sürekli damlama sını sağlamak için mikroskobun dik hedefine bantlanmış küçük bir tüple süperfüzyon uygulayın.
- Post-kılcal venülleri (iki küçük damarın birleşmesi) belirleyin ve 20-40 μm çapında venüller üzerindeki mikro sirkülasyonu ölçün.
- 30 s bir zaman aralığında cremaster kas mikrosirkülasyon yüksek çözünürlüklü görüntüleri kaydedin. Kayıt sırasında kas dokusunda hafif bir kasılma ve gevşeme olabileceğinden, odağı sürekli olarak ayarladıklarından emin olun. Genellikle, fare yaklaşık 2 saat boyunca kararlı sirkülasyon sergileme eğilimindedir. Farklı bölgelerden farklı gemilerin çeşitli kayıtlarını elde etmek mümkündür. Bir veya her iki testis daha sonra kullanılabilir.
NOT: Bu inflamasyon bir model olduğu gibi, indüksiyon ortak yolları şunlardır: sistemik uygulama veya pro inflamatuar mediatörler inskrotal enjeksiyon yanı sıra örneğin N-Formylmethionyl-lucyl-fenillalanine (fMLP) ile superfüzyon. Lokal TNF-α stimülasyon genellikle lökosit işe tetiklemek için kullanılır; LPS'ye bağlı endotoksemi SIRS şiddetli sistemik inflamasyon modelidir.
5. Lökosit görselleştirme
NOT: Yapışık ve haddeleme lökositleri daha fazla görselleştirme olmadan kolayca görülebilir. Serbestçe hareket eden lökositlerin merkez hat hızını belirlemek için diferansiyel boyama yapın.
- EGFP etiketli fareler kullanılıyorsa, bunları doğrudan floresan mikroskobu ile analiz edin.
- EGFP etiketli olmayan fare suşları için rodamin boyama kullanın.
- Rhodamine 6G'yi 0.2 mg/kg vücut ağırlığında uygulayın. Yeterli boyama yoğunlukları elde etmek için tekrarlanan dozlarda gerekebilir. Daha büyük hacimler hemodinamik parametreleri etkileyebileceğinden, küçük hacimleri sakladığından emin olun.
- Lökositlerin anında boyanışı için, karotis arter üzerinden leke uygulayın. Karotis arter diseksiyonu yapılmamışsa, aynı doz18kullanılarak i.p. uygulaması ile yeterli boyama sağlanabilir. Karotis arter kateterizasyonuna alternatif olarak başka bir venöz kateterizasyon yapılabilir.
NOT: Rhodamine boyamanın, eGFP etiketlemenin aksine, floresan şiddetinde zaman çürümesinin yanı sıra yüksek konsantrasyonlarda lökositlerin maksimum %80'inin genel olarak boyandığını gösterdiğini unutmayın. - Floresan mikroskopi ile serbestçe hareket eden rhodamine lekeli lökositleri görselleştirin.
6. Deney sonu
NOT: Bu protokolü gerçekleştirmek için genel tahmini süre 90 -150 dakika olmalıdır.
- Servikal çıkış la ötenazi ile deneyi sonlandırın.
- Transmigration gibi daha fazla analiz için, pfa'daki kremaster kaslarını düzeltin ve sahnede uzatılırken ve gerektiğinde histoloji için lekeliyken.
7. Çevrimdışı analiz
- Video oynatma sırasında aşağıdaki parametreleri basit sayımlar olarak analiz edin.
- Yuvarlanma akını hesaplama [sayı/dk]: hayali bir çizgi/dk geçen yuvarlanan hücre sayısı
- Yapışmayı hesaplayın [sayı/mm2]: görüş alanı içindeki damar duvarına yapıştırılan hücre sayısı ≥ 30 s/vasküler yüzey [mm2].
- Aşağıdaki hemodinamik ve mikrovasküler parametreleri ölçmek ImageJ kullanılarak ölçülür.
- İç duvar çapı olarak damar çapı [μm] hesaplayın.
- Geminin orta çizgi uzunluğu olarak gemi uzunluğunu [μm] hesaplayın.
- Merkez satırda
 serbestçe hareket eden lökositlerin kare kare video analizinden elde edilen merkez çizgi hızını hesaplayın.
serbestçe hareket eden lökositlerin kare kare video analizinden elde edilen merkez çizgi hızını hesaplayın.
- Aşağıdaki denklemleri bir tahmin olarak kullanın.
- Vasküler yüzeyi [mm2]'de hesaplayın: damar uzunluğu [μm] x damar çapı [μm] x π x 10-6.
- Duvar kesme hızını
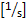 hesaplayın : 4,9 x
hesaplayın : 4,9 x  (8 x merkez hattı hızı x 0,625/damar çapı [μm]).
(8 x merkez hattı hızı x 0,625/damar çapı [μm]). - Ortalama kan akış
 hızını hesaplayın : merkez çizgi hızı
hızını hesaplayın : merkez çizgi hızı  x 0,625.
x 0,625. - Toplam lökosit akı
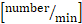 hesaplamak : sistemik
hesaplamak : sistemik 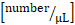 lökosit
lökosit  sayısı x (ortalama kan akımı hızı
sayısı x (ortalama kan akımı hızı 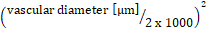 x 60/1000) x π x .
x 60/1000) x π x . - Yuvarlanma akı fraksiyonu [%]: yuvarlanma akısı/toplam lökosit akısı x 100.
Sonuçlar
IVM sağlanan protokol uyarınca iskelet kası lökosit işe çağlayan içine benzersiz anlayışlar verecektir. Sonuçlar bölümünde IVM tarafından elde edilen tipik sonuçlar üzerinde durulacak ve karşılaşılabilecek olası sorunları vurgulayacaktır.
İntravital mikroskopi için deneysel kurulum Şekil 1'deözetlenmiştir. Cremaster kas hazırlanması ve bağ dokusunun çıkarılması tek tip bir yüzey ile odaklanmış mikroskobik görüntüler elde e...
Tartışmalar
IvM bir yöntem olarak yaygın olarak farklı organlarda farklı hücre tipleri çalışma için kullanılan ve yaygın olarak tarif edilmiş ve tartışıldı19. Bu çalışmanın temel amacı, cremaster kas ivm kurmak ve gerçekleştirmek için etkili bir yaklaşım sağlamaktır. Yöntemin pratik güvenilir ve tekrarlanabilir sonuçlar üretecektir. Bu nedenle, planlama ve standardizasyon tekniği ana için önemli faktörlerdir. Her şeyden önce, teknik çok yakından izlenmesi ve kontrol edi...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma, Almanya Federal Eğitim ve Araştırma Bakanlığı (BMBF) 01GL1746E tarafından PRIMAL Konsorsiyumu'nun bir parçası olarak desteklenmiştir. Yazarlar britta Heckmann ve Silvia Pezer usta teknik yardım için kabul.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Material | |||
| Ketanest S | Pfizer Pharma GmbH | PZN: 08509909 | anesthesia. Generic / IUPAC Name: ketamine |
| Xylazine | CP-Pharma GmbH | Article-nr.: 1205 | anesthesia. Generic / IUPAC Name: xylazine (as hidrochloride) |
| Saline Solution | B. Braun Melsungen | PZN 02737756 | surgical preparation. Generic / IUPAC Name: sodium chloride |
| Syringe needle Omnican F | B. Braun Melsungen | REF 9161502 | surgical preparation |
| Suture 6/0 USP | Resorba | REF 4217 | surgical preparation |
| Polyethylene tube #10 | BD GmbH | Supplier No. 427401 | surgical preparation |
| Polyethylene tube #90 | BD GmbH | Supplier No. 427421 | surgical preparation |
| Rhodamine 6G | Sigma-Aldrich Chemie GmbH | CAS Number 989-38-8 | leukocyte staining. Generic / IUPAC Name: ethyl 2-[3-(ethylamino)-6-ethylimino-2,7-dimethylxanthen-9-yl]benzoate |
| Setup Equipment | |||
| Upright microscope | Olympus | BX51W1 | microscopy |
| 40-fold objective | Zeiss | Achroplan 40 × /0.80 W | microscopy |
| ImSpector software | Lavision Biotec GmbH | ver. 4.0.469 | software |
| ImageJ | National Institute of Health, USA | ver. 1.51j8 | software |
Referanslar
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nature Reviews. Immunology. 7 (9), 678-689 (2007).
- Zanardo, R. C. O., et al. A down-regulatable E-selectin ligand is functionally important for PSGL-1-independent leukocyte-endothelial cell interactions. Blood. 104 (12), 3766-3773 (2004).
- Woodfin, A., et al. ICAM-1-expressing neutrophils exhibit enhanced effector functions in murine models of endotoxemia. Blood. 127 (7), 898-907 (2016).
- Frommhold, D., et al. RAGE and ICAM-1 cooperate in mediating leukocyte recruitment during acute inflammation in vivo. Blood. 116 (5), 841-849 (2010).
- Braach, N., et al. RAGE controls activation and anti-inflammatory signalling of protein C. PloS One. 9 (2), 89422 (2014).
- Frommhold, D., et al. RAGE and ICAM-1 differentially control leukocyte recruitment during acute inflammation in a stimulus-dependent manner. BMC Immunology. 12 (1), 56 (2011).
- Braach, N., et al. Anti-inflammatory functions of protein C require RAGE and ICAM-1 in a stimulus-dependent manner. Mediators of Inflammation. 2014, 743678 (2014).
- Girbl, T., et al. Distinct Compartmentalization of the Chemokines CXCL1 and CXCL2 and the Atypical Receptor ACKR1 Determine Discrete Stages of Neutrophil Diapedesis. Immunity. 49 (6), 1062-1076 (2018).
- Smith, M. L., Olson, T. S., Ley, K. CXCR2- and E-selectin-induced neutrophil arrest during inflammation in vivo. The Journal of Experimental Medicine. 200 (7), 935-939 (2004).
- Emre, Y., Jemelin, S., Imhof, B. A. Imaging Neutrophils and Monocytes in Mesenteric Veins by Intravital Microscopy on Anaesthetized Mice in Real Time. Journal of Visualized Experiments. (105), (2015).
- Eriksson, E., Boykin, J. V., Pittman, R. N. Method for in vivo microscopy of the cutaneous microcirculation of the hairless mouse ear. Microvascular Research. 19 (3), 374-379 (1980).
- von Andrian, U. H. Intravital microscopy of the peripheral lymph node microcirculation in mice. Microcirculation. 3 (3), 287-300 (1996).
- Hudalla, H., et al. LPS-induced maternal inflammation promotes fetal leukocyte recruitment and prenatal organ infiltration in mice. Pediatric Research. 84 (5), 757-764 (2018).
- Grant, R. T. Direct observation ok skeletal muscle blood vessels (rat cremaster). The Journal of Physiology. 172 (1), 123-137 (1964).
- Thiele, J. R., Goerendt, K., Stark, G. B., Eisenhardt, S. U. Real-time digital imaging of leukocyte-endothelial interaction in ischemia-reperfusion injury (IRI) of the rat cremaster muscle. Journal of Visualized Experiments. (66), e3973 (2012).
- Kranig, S. A., et al. Dystrophin deficiency promotes leukocyte recruitment in mdx mice. Pediatric Research. 11, 4457 (2019).
- Bagher, P., Segal, S. S. The mouse cremaster muscle preparation for intravital imaging of the microcirculation. Journal of Visualized Experiments. (52), e2874 (2011).
- Reichenbach, Z. W., Li, H., Gaughan, J. P., Elliott, M., Tuma, R. IV and IP administration of rhodamine in visualization of WBC-BBB interactions in cerebral vessels. Microscopy Research and Technique. 78 (10), 894-899 (2015).
- Secklehner, J., Lo Celso, C., Carlin, L. M. Intravital microscopy in historic and contemporary immunology. Immunology and Cell Biology. 95 (6), 506-513 (2017).
- Nussbaum, C., et al. Neutrophil and endothelial adhesive function during human fetal ontogeny. Journal of Leukocyte Biology. 93 (2), 175-184 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır